A7其它过渡元素(19页63题)
大学无机化学第20章 过渡金属元素习题答案 20120319

第20章d区过渡金属元素习题解答1.为什么过渡元素中,同族元素从上到下高氧化态物质的稳定性升高,而过渡后的p区元素同族自上而下低氧化态的物质趋于稳定?2.自ⅣB族到ⅦB族元素的最高氧化态在溶液中为什么不存在简单的离子M4+、M5+、M6+?3.为什么d区金属的密度、硬度、熔点、沸点一般较高?4.过渡元素的氧化态分布有何特点?5.由MnO2制备锰酸盐应在酸性介质还是碱性介质中进行?欲把Mn2+ 离子氧化为MnO4–离子应选用何种氧化剂?6.Cr3+与Al3+在生成化合物方面有何异同?7.根据下列实验现象,写出相应的化学反应方程式:(1)在酸性K2Cr2O7溶液中加入Na2SO3溶液,颜色由橙红变蓝绿色,此时加入乙醚,并用HNO3酸化,溶液变为深蓝色。
(2)黄色的BaCrO4溶在浓盐酸中,得到的是绿色溶液,写出化学方程式,说明颜色变化。
(3)Fe2(SO4)3溶液与Na2CO3溶液作用,得不到Fe2(CO3)3。
(4)在水溶液中用Fe3+与KI作用,不能制得FeI3。
(5)向Fe3+溶液中加入KSCN后出现红色,若再向溶液中加入Fe粉或NH4F晶体,红色又消失;(6)向CoCl2溶液中加入NaOH溶液,先析出粉红色沉淀,沉淀很快又转为灰绿色至褐色。
8.写出下列反应的化学方程式:(1)TiO2(s) + BaCO3(s) → ;(2)V2O5(s) + HCl(aq) → ;(3)Cr2O72–(aq) + Ag+(aq) + H2O(l) → ;(4)[Cr(OH)4]–(aq) + H2O2(l) + OH–(aq) → ;(5)MnO4–(aq) + Fe2+(aq) + H+(aq) → ;(6)MnO2(s) + HCl(aq,浓) → ;(7)Cr3+(aq) + MnO4–(aq) + H2O(l) → ;(8)Co2O3(s)+ HCl (aq,浓) → ;(9)K3[Fe(CN)6] (aq) + Fe2+(aq) → ;(10)PO43–(aq) + (NH4)2MoO4(aq) + H+(aq) → ;(11)PdCl2(aq) + CO(g) + H2O(l) → ;(12)Pt(s) + HNO3(aq) + HCl(aq) → 。
陶瓷装饰工题库考点(三)

陶瓷装饰工题库考点(三)1、单选青花瓷是以含的()矿物质为着色剂,在瓷器坯体上进行装饰,再覆盖一层玻璃釉,经高温一次烧成的瓷器。
A.铅元素B.锰元素C.钴元素D.铁元素正确答案:C2、单选((江南博哥))是用一定的轮廓外形,划分出装饰面,使它成为主要的部位。
A.分割法B.对比法C.双关法D.开光法正确答案:D3、单选中国山水画简称为下面哪一项()。
A、水墨B、大山C、山河D、山水正确答案:D4、单选中国画强调下面哪一项的存在()。
A、硬B、势C、柔D、软正确答案:B5、单选下列新彩颜料中不能混合调配的是()。
A.海碧+艳黑B.海碧+玛瑙红C.西赤+薄黄D.西赤+艳黑正确答案:C6、单选新彩油料的乳香油不宜(),否则在烤花时颜色会流动,影响画面效果。
A.过稀B.过稠C.过少D.过多正确答案:D7、单选“书画家在他的作品上题款时仅仅只写下他的名字”指的是下面哪一项()。
A、穷款B、长款C、短款D、微款正确答案:A8、单选()是在瓷胎上先施白或黑釉,然后按花纹的要求剔刻去花纹以外的空间,露出瓷胎,形成胎与釉的色泽对比。
A.画花B.刻花C.划花D.雕釉正确答案:D9、问答题为什么过渡元素和稀土元素大多能够呈色?正确答案:过渡金属元素如铁、铜、铬、钒等,由于存在4s1~23dx型的电子结构,它们最外层的s层、次外层的d层、甚至自外数第三层的f层上均未充满电子(除Ⅷ,副族),这些未成对的电子不稳定,容易在次亚层之间发生跃迁,跃迁所需的能量刚好是可见光区域内光子所具有的能量,故能选择性地吸收各种可见光10、单选下面关于康乾六号青花料表达正确的一项是()。
A.色彩和原青花的颜色完全不同B.色彩张扬C.色彩沉着D.没有色彩正确答案:C11、单选下面哪种粉彩颜料为透明色()。
A.茄色B.广翠C.淡翡翠D.墨绿正确答案:D12、单选“成教化助人伦”是下面哪一位的观点()。
A、李白B、白居易C、杜牧D、张彦远正确答案:D13、单选()是在白色瓷器上绘制蓝色花纹的一种瓷器。
元素周期表人教版必修公开课一等奖优质课大赛微课获奖课件

1.下列相关元素周期表说法中不正确是 () A.长周期中,第ⅡA族右侧为第ⅢB族,第 ⅢA族左侧为第ⅡB族 B.元素周期表从左到右共有18列,其中第三 列含有元素种类最多 C.副族和第Ⅷ族中所有元素都是金属元素 D.某元素原子最外层上只有2个电子,该元素 一定位于第ⅡA族
第28页
解析: 依据元素周期表结构,可知选项A正确。 元素周期表第三列因含有镧系、锕系元素,故元 素种类最多,选项B正确。副族和第Ⅷ族统称为 过渡元素,所有为金属元素,选项C正确。某元 素原子最外层上只有2个电子,该元素也许位于 第ⅡA族,也也许为稀有气体元素He(0族)。 答案: D
第35页
热点试验 探究短周期元素—H、He排布 元素周期表中每一纵行元素化学性质含有相同 性。探究H、He在周期表中排布主要依据两原子 原子结构特点和两元素化学性质进行分析,该类 题目的发散思维性较强,主要考察学生对元素周 期表编排原则以及元素化学性质掌握程度、灵活 应用能力。
第36页
[探究举例]某研究性学习小组以元素周期律为 课题研究“短周期元素在周期表中分布”,他 们提出元素在周期表中排布四种方案:
第46页
2.下列关于元素周期表判断中正确是 () A.三个短周期都含有8种元素 B.四个长周期都含有18种元素 C.第ⅠA族,即包括7种碱金属元素 D.0族含有6种元素
第47页
解析: 元素周期表中,每一周期含有元素分别 为2、8、8、18、18、32、26,因此A和B错误; 第ⅠA包括六种碱金属元素和氢元素,C错误;0 族元素包括He、Ne、Ar、Kr、Xe、Rn六种元素, D正确。 答案: D
第15页
2.下列关于元素周期表说法中,正确是 () A.元素周期表是按照元素原子最外层电子数 多少排布而成 B.元素周期表共有7个周期16个族 C.过渡元素都是金属元素,第ⅠA族元素都是 金属元素 D.最外层电子数相同元素在同一族
部编人教版九年级化学上册第3单元 物质构成的奥秘 3.3.2 元素符号 元素周期表【习题课件】

(3)R2+结构示意图为
,R元素位于元素周期表中第
____四____周期,它的化学性质与第三周期中的___镁____
元素相似。
探究培优·拓展练
18.【中考•南京】核电荷数为1~18的元素的原子结构示 意图等信息如下,回答下列问题:
探究培优·拓展练
(1)图中不同元素的本质区别是__核__内__质__子__数__不__同__,原子 序数为9的元素位于第___二_____周期。
(4)写出核外电子排布与氖原子相同的阳离子和阴离子符 号各一个:阳离子__N__a_+_(_或__M__g_2+__或__A_l_3+__) ___,阴离子 _O__2-__(或__F_-__或__N_3_-_)_。
探究培优·拓展练
【点拨】本题运用归纳比较法解答。分析元素周期表, 比较和挖掘同一周期、同一族元素之间存在的内在规律。 如同一周期的元素,原子的电子层数相同,从左到右最 外层电子数依次递增;同一族的元素,原子的最外层电 子数一般相同,从上到下,电子层数依次递增。
夯实基础·逐点练
【点拨】元素周期表是按照原子序数由小到大,根据原 子结构和元素性质周期性变化的规律排列而成的。由图 可知:Y、Z在同一周期,X、Z在同一族,原子序数X< Y<Z,故A、B、D均错误。 【答案】C
夯实基础·逐点练
9.(1)下面是一次练习中,王老师收集的一些错误符号, 请你将其改正过来: 钙 CA 镁 mg 汞 Ag 铝 Cl 氖 Ni _钙__C_a___镁__M__g___汞__H__g___铝__A_l___氖__N_e______________。
夯实基础·逐点练
7.【2018•内江改编】如图为元素周期表的一部分,根 据三种元素的相关信息,下列说法不正确的是( D )
第三节 元素周期表
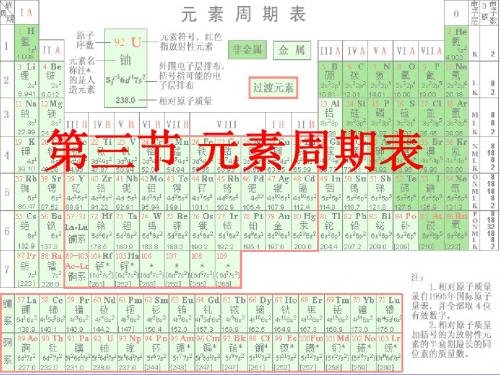
(1)主族:由短周期元素和长周期元素共 同构成的族。 表示方法:在族序数后面标一“A” 字。ⅠA、ⅡA、ⅢA、…ⅦA (2)副族:完全由长周期元素构成的族。 表示方法:在族序数后标“B”字。 如ⅠB、ⅡB、ⅢB、…ⅦB (3)第VⅢ族: (“8、9、10” 三个纵行) (4) 0族:稀有气体元素
米奇利还分析了其它的一些规律, 最终,一种全新的致冷剂CCl2F2终 于应运而生了。 80年代,科学家们发现氟里昂会破 坏大气的臭氧层,危害人类的健康 的气候,逐步将被淘汰。人们又将 在元素周期表的指导下去寻找新一 代的致冷剂。
氟里昂的发现与元素周期表
在第三周期中,单质的易燃性是 Na>Mg>Al,在第二周期中,CH4比 NH3易燃,NH3双比H2O易燃,再比较 氢化物的毒性:AsH3>PH3>NH3 H2S>H2O,根据这样的变化趋势,元 素周期表中右上角的氟元素的化合物 可能是理想的元素,不易燃的致冷剂。
氟里昂的发现与元素周期表
> HCl > HBr > HI NH3 < HF NH3 > PH3
HF 2.碱性强弱: KOH
>
NaOH HNO3
3.酸性强弱: HClO4
> > >
Mg(OH)2 HBrO4 H3PO4
三、元素化合价与元素在周期表中 位置的关系
价电子——元素原子的最外层电子或
某些元素的原子的次外层或倒数第三层的 部分电子。 (1)最高正价= 主族序数 = 最外层电子数
2
10
K
2
4
12 20 38 III B 21 39 IV B 22 40 V B 23 41 VI B 24
镧系元素

原子半径/pm
187.7 182.4 182.8 182.1 181.0 180.2 204.2 180.2 178.2 177.3 176.6 175.7 174.6 194.0 173.4
Ln3+半径 /pm E q /V
106.1 -2.38
103.4 -2.34
101.3 -2.35
99.5 -2.32
97.9
-2.29
96.4
-2.30
95.0
-1.99
93.8 -2.28
92.3
-2.31
90.8
-2.29
89.4
-2.33
88.1
-2.32
86.9
-2.32
85.8
-2.22
84.8
-2.30
7Hale Waihona Puke 从上图中可以看出,镧系元素的原子半径和
离子半径在总的趋势上都随着原子序数的增加而
缩小的幅度很小,这叫做
2
3 Li
锂
4 Be
铍
5 B 6 C 7 N 8 O 9 F 10 Ne
硼 碳 氮氧 氟 氖
3
11 Na
钠
12 Mg
镁
IIIB
IVB
VB
VIB VIIB
VIII
13 Al 14 Si 15 P 16 S 17 Cl 18 Ar
IB IIB 铝 硅 磷 硫 氯 氩
4 19 K 20 Ca 21 Sc 22 Ti 23 V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni 29 Cu 30 Zn 31 Ga 32 Ge 33 As 34 Se 35 Br 36 Kr
整个电子壳层依次收缩的积累造成总的镧系收缩
第16章 过渡元素2题解

=0.771 0.851 0.080V E θ I /I- =0.56V
2
EθCu2+/CuI =0.86V
E θ I /I- =0.56V
2
所以在含F-离子的溶液中,KI可以被Cu2+ 氧化,但不 能被Fe3+离子氧化生。
6.写出下列反应方程式:
1. Zn+2NaOH( 过量) +2H 2O Na 2Zn(OH) 4+H 2
2. Zn+4NH3(过量)+2H 2O [Zn(NH 3) 4](OH) 2+H 2
高温 3. Zn+CO2 ZnO+CO
4. 3Hg+8HNO3( 浓) 3Hg(NO 3) 2+2NO 2 +4H 2O
研磨 5. HgCl2 +Hg Hg2Cl2
6. Hg(NO3 )2 +2KI(适量) HgI2 (橘红) +2KNO3
时,橘红色沉淀消失; 4.若在A中加入数滴汞并振荡,汞逐渐消失。此时 再加氨水得灰黑色沉淀。问此时无色溶液A中含 有哪种化合物?写出有关的反应方程式。
此无色溶液A中含:Hg(NO3)2 。反应方程式为:
1.在A中加入氨水时有白色沉淀生成;
1. 2Hg 2+ +NO3- +4NH3 +H2O HgO NH2 HgNO3 +3NH4+ 白色
用碱处理I,生成浅蓝色沉淀J。
9. Cu(NO3 )2 +2OH- Cu(OH)2 +2NO3I 浅蓝J
将J滤出后强热,又变成A。
强热 10. Cu(OH) 2 CuO+H 2O
高等无机过渡元素化学习题
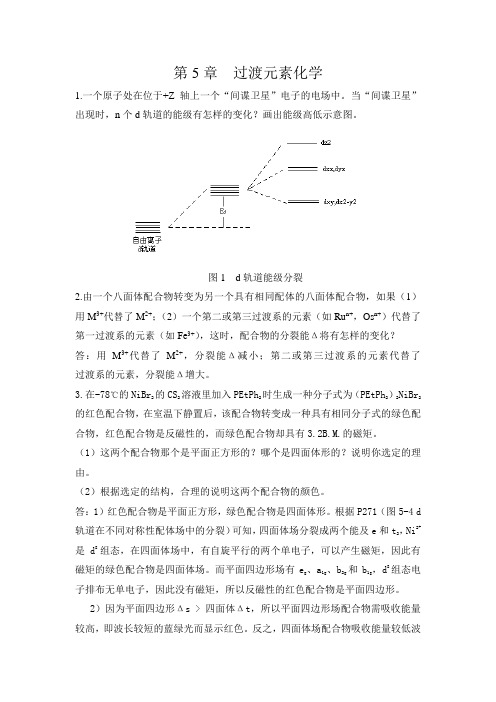
因为μ= n(n 2),分裂能Δ值 I4- < Cl4-,与 Cl 相比,I 是弱场,高自旋,
单电子数多,所以磁矩大。
14.根据下列化合物的有效磁矩,描述它们的电子结构和几何构型: (1)K2[NiF6],0.0B.M.; (2)[Mn(NCS)6]4-,6.06B.M.; (3)[PtCl4]2-,0.0B.M.; (4)CoCl42-,4.3~4.7B.M. (Et-乙基,Ph-苯基)
答:1)[Fe(H2O)6]3+:Δ < P,高自旋;[PtCl6]2-:Δ > P,低自旋。 2)Nb、Ta 的半径比 Ti 的大,外层电子多,所以能够容纳较多的配体。 3)Mo、W 的含氧酸是高酸,能结合质子,水的配位数增加,且 M-OH 键较弱,
易失水聚合,所以 Mo 和 W 比 Cr 易形成聚合度高的多酸。 4)Re 原子的电子组态为[Xe]5d56s2,在 Re2Cl82-中 Re 的氧化态为+3,价电子
答:不同。Fe(Ⅵ)的磁矩:μ= n(n 2)=2.83B.M.
Pr(Ⅲ)的磁矩:μ=g
J(J
1),根据表
5-17
得
Pr(Ⅲ)的基态光谱支项为H34,可知 S=1,L=5,J=4;g=1+ J(J 1) S(S 1) L(L 1) = 4 ;所以μ=3.58B.M.
2J (J 1)
5
18.解释下列问题: (1)[Fe(H2O)6]3+为高自旋,而[PtCl6]2-为低自旋; (2)Ti 形成 TiF62-离子,而 Nb,Ta 则形成 MF82-或 MF83-离子(其中 M=Nb,Ta) (3)Mo 和 W 比 Cr 易形成聚合度高的多酸; (4)Re 可形成含有四重 Re-Re 键的 Re2Cl82-离子,而 Mn 未见报道。
过渡元素(课后基础习题)

过渡元素1、钛的主要矿物是什么?简述从钛铁矿制取钛白得反应原理。
2、完成并配平下列反应方程式。
(1)Ti + HF →(2)TiO2 + H2SO4→(3)TiCl4 + H2O →(4)FeTiO3 + H2SO4→(5)TiO2 + BaCO3→(6)TiO2 + C + Cl2→3、完成下列反应(1)TiI4在真空中强热;(2)FeTiO3和碳得混合物在氯气中加热;得水溶液加入过量得氨;(3)向含有TiCl-26(4)向VCl3的水溶液加入过量的氨;(5)将VCl2的固体加到HgCl2水溶液中。
4、根据下列实验写出有关的反应方程式:将一瓶TiCl4打开瓶塞时立即冒白烟。
向瓶中加入浓HCl溶液和金属锌时生成紫色溶液,缓慢地加入NaOH溶液直至溶液呈碱性,于是出现紫色沉淀。
沉淀过滤后,先用HNO3处理,然后用稀碱溶液处理,生成白色沉淀。
5、完成并配平下列反应方程式−(1)V2O5 + NaOH−→−(2)V2O5 + HCl−→−(3)VO43- + H+(过量) −→−(4)VO2+ + Fe2+ + H+−→−(5)VO2+ + H2C2O4 + H+−→6、新生成的氢氧化物沉淀为什么会发生下列变化(1)Mn(OH)2几乎是白色的,在空气中变为暗褐色?(2)白色的Hg(OH)2立即变为黄色?(3)蓝色的Cu(OH)2,加热时为什么变黑?7、根据下述各实验现象,写出相应的化学反应方程式(1)往Cr2(SO4)3溶液中滴加NaOH溶液,先析出葱绿色絮状沉淀,后又溶解,此时加入溴水,溶液就由绿色变为黄色。
用H2O2代替溴水,也得到同样结果。
(2)当黄色BaCrO4沉淀溶解在浓HCl溶液中时得到一种绿色溶液。
(3)在酸性介质中,用锌还原Cr2O-2时,溶液颜色由橙色经绿色而变成蓝色。
放置时又变回绿色。
7(4)把H2S通入已用H2SO4酸化的K2Cr2O7溶液中时,溶液颜色由橙变绿,同时析出乳白色沉淀。
过渡金属元素

2. 羰基簇合物 (分子中含有M—M键的化合物)
过渡元素能和CO形成许多羰基簇合物。 羰基簇合物中金属原子多为低氧化态并具有适宜的d轨道。 双核和多核羰基簇合物中羰基与金属原子的结合方式:
(1) 端基(1个CO和1个成簇原子相连);(2) 边桥基(1个CO
与2个成簇原子相连);(3) 面桥基(1个CO与3个成簇原子相 连)。
第7章 过渡金属元素
表7-1 过渡金属元素(d 区元素除第七周期外, 共23种)
周期\族
四
IIIB
Sc
IVB
Ti
VB
Ⅴ
VIB
Cr
VIIB
Mn Fe
VIII
Co Ni
五
六
Y
La
Zr
Hf
104Rf
Nb
Ta
105Db
Mo
W
106Sg
Tc
Re
107Bh
Ru
Os
108Hs
Rh
Ir
109Mt
Pd
Pt
110Uun
近时, 两个Re3+的dz2轨道以
“ 头碰头 ”重叠形成σ键; 两 个Re3+ 的dxz轨道、dyz轨道以
“ 肩并肩 ”重叠形成两个 d—d
π键; 而两个Re3+ 的dxy轨道以 “面对面”重叠形成δ键,说明 Re与Re之间形成四重键。
26
Re 5d56s2
-3e
Re3+ 5d4
dsp2杂化
5d4 (dsp2)0( dsp2)0( dsp2)0( dsp2)0 σ σ σ σ (3px)2 (3px)2 (3px)2 (3px)2 Cl Cl Cl Cl
高中化学专题2原子结构与元素的性质第一单元第2课时原子核外电子的排布

量状态。如右图所示。
12/10/2021
第四页,共四十二页。
相关视频
答案(dá
12/10/2021
第五页,共四十二页。
2.泡利不相容原理
每个原子轨道上最多只能容纳(róngn两à) 个(liǎnɡ ɡè)自旋状态不的同电子。
3.洪特规则
对于较复杂的电子排布式,应先按能量最低原理从低到高排列,然后将同一层的 电子移到一起。
如:26Fe:先按能量从低到高排列为1s22s22p63s23p64s23d6,然后将同一层的排 列一起,即该原子的电子排布式为1s22s22p63s23p63d64s2。
12/10/2021
第二十三页,共四十二页。
C.Cl-:1s22s22p63s23p5
D.Mn:1s22s22p63s23p63d54s2
解析 本题考查的是构造(gòuzào)原理及各轨道最多容纳的电子数。s轨道最多容纳2
个电子,p轨道最多可容纳6个电子;电子总是从能量低的电子层、原子轨道开
始排列,Cl-应是Cl原子得一个电子形成的稳定结构,所以Cl-的电子排布式
应为1s22s22p63s23p6。
12/10/2021
第二十七页,共四十二页。
解析(jiě
解题(jiě tí)反 思
绝大多数原子或离子的电子排布均遵循轨道能量顺序,过渡元素(yuán sù)电子排布 式书写顺序与电子填充顺序不一致。
12/10/2021
第二十八页,共四十二页。
变式训练2 按要求填空: (1)基态B原子的电子排布式为___1_s_22_s_2_2。p1 解析 B的核外有5个电子,核外电子排布式为1s22s22p1。 (2)基态N原子的外围(wàiwéi)电子排布式为_2_s_22_p_3_。 解析 N原子最外层有5个电子,最高电子层为2,外围电子排布式为2s22p3。
过渡金属元素

2. 羰基簇合物 (分子中含有M—M键的化合物) 过渡元素能和CO形成许多羰基簇合物。 羰基簇合物中金属原子多为低氧化态并具有适宜的d轨道。
双核和多核羰基簇合物中羰基与金属原子的结合方式: (1) 端基(1个CO和1个成簇原子相连);(2) 边桥基(1个CO 与2个成簇原子相连);(3) 面桥基(1个CO与3个成簇原子相 连)。
镧系收缩的影响:
(1)第五周期,IIIB族元素钇(Y)成为“稀土”一员 :
四 Sc 63Eu 4s76s2 39Y 4d15s2 64Gd 4f75d16s2
五Y
198.3ห้องสมุดไป่ตู้
180.3
180.1 pm
六 La-Lu 67Ho3+
39Y3+
68Er3+
89.4
89.3
88.1 pm
习惯上,把Y列入“重稀土”。
见教材p.221-222, 表8-2 –表8-4.
2. 同一副族原子半径:第四周期元素 < 五 ~ 六
15
四、第一电离能I1的变化(理解)
影响因素
Z*, I1 r , I1
1. 同一周期
左 r↘,Z*↗,I1和(I1 + I2)↗,(总趋势)
右
2. 同一副族
原子半径 r 有效核电荷 Z* 第一电离能 I1
三、原子半径
影响原子半径的因素
1. 同一周期
Z* ↗, r ↘ 同亚层:电子数↑,r↑ 主量子数n = 电子层数↑,r↑
原子序数增加,有效核电荷增加,原子半径减小。
例外: VIII 3d84s2 Ni 125 pm
IB 3d104s1 Cu 128 pm
IIB 3d104s2 Zn 133 pm
1第17章 碱金属和碱土金属习题

碱金属和碱土金属习题目录一判断题;二选择题;三填空题;四完成反应方程式;五计算和解释一判断题(返回目录)1 重水是由H和18O组成的水。
()2 氢在自然界中主要以单质形式存在。
()3 由于H2是双原子分子,所以H2比He的扩散速率小。
()4 氢气是最轻的单质,所以它的熔点和沸点在所有单质中最低。
()5 因为氢分子的极化率大于氦分子的极化率,所以氢的熔点比氦高。
()6 常温下H2的化学性质不很活泼,其原因之一是H-H键键能较大。
()7 在HMn(CO)5中,H原子与Mn原子以Mn-H键相结合。
()8 在H[Cr(CO)5]2分子中存在着Cr-H-Cr氢桥键。
()。
9 如果某氢化物的水溶液为碱性,则此氢化物必为离子型氢化物。
()10 碱金属氢化物都具有NaCl型晶体结构。
()11 H-在水溶液中不能存在。
()12 通常,s区元素只有一种稳定的氧化态。
()13 由于s区、p区元素性质活泼,它们都不能以单质的形式存在于自然界。
()14 s区元素在自然界不以单质形式存在。
()15 金属钙保存在煤油中。
()16 由于s区元素单质的密度很小,它们都可以浸在煤油中保存。
()17 碱金属熔点的高低次序为Li>Na>K>Rb>Cs。
()18 碱土金属的E(M2+/M)从Be到Ba依次变大。
()19 N2只能与碱土金属直接作用形成氮化物。
()20 在周期表中,处于对角线位置的元素性质相似,这称为对角线规则。
()21 所有碱金属和碱土金属都能形成稳定的过氧化物。
()22 s区元素形成的化合物大多是离子型化合物。
()23 由于E(Li+/Li)最小,所以锂是金属性最强的元素。
()24 碱土金属氢化物的熔点比同周期碱金属的氢化物熔点高。
()25 碱金属的所有盐类都是无色的。
()26 钠的所有盐全部可溶于水。
()27 所有碱金属的碳酸盐都是易溶于水的。
()28 碱金属的盐类都是可溶性的。
()29 碱金属的氢氧化物皆具有强碱性。
复旦化学第9章-过渡元素(一)

ⅥB 铬 Cr 3d54s1 钼 Mo 4d55s1 钨 W 5d46s2
辉钼矿MoS2
(Fe、Mn)WO4黑钨矿
CaWO4白钨矿
9.3.2 铬的氧化态与形态变化
Cr(Ⅱ):Cr2+ Cr(Ⅲ):Cr 3+(酸性介质)
CrO2- 、[Cr(OH)4-] (碱性介质) Cr(Ⅵ):Cr2O72- (酸性介质)
电解: 阳极: 2MnO42- -2e→2MnO4- 阴极: 2H2O+2e→H2↑+2OH-
总反应:2K2MnO4+2H2O == 2KMnO4+2KOH+H2↑
Cl2或NaClO氧化:
2K2MnO4+ Cl2 == 2KMnO4 + 2KCl
9.5 铁系元素
9.5.1 概述
Ⅷ
Fe
Co
Ni
3d64s2
3d74s2
3d84s2
价态:+2 +3 (+6) +2 +3 (+5) +2 +3 (+4)
铁、钴、镍在+2、+3氧化态时,半径较小,又有未充满的d轨道,使它们 有形成配合物的强烈倾向,尤其是Co(Ⅲ)形成配合物数量特别多。
许多铁、钴、镍合金是很好的磁性材料。
9.5.2 氢氧化物
Fe(OH)3 Co(OH)3 Ni(OH)3 氧化能力逐渐增加 Fe(OH)2 Co(OH)2 Ni(OH)2 还原能力逐渐减弱
8.3.3 铬的难溶盐
Ag+ Cr2O72- + Ba2+ →
Pb2+
Ag2CrO4↓砖红 BaCrO4↓黄 PbCrO4↓黄
2022特种设备焊工理论考试真题模拟及答案(2)

2022特种设备焊工理论考试真题模拟及答案(2)共412道题1、埋弧自动焊时,采用较大的焊缝成形系数可以防止产生()(单选题)A. 冷裂纹B. 咬边C. 热裂纹D. 未焊透试题答案:C2、锅炉按结构可分为两大类,它们是()。
(单选题)A. 立式锅炉和卧式快装锅炉B. 水管锅炉和锅壳式锅炉C. 工业锅炉和电站锅炉D. 水管锅炉和卧式快装试题答案:B3、金属材料在一定温度和介质条件下,抵抗氧化的能力称为()。
(单选题)A. 耐腐蚀性B. 抗氧化性C. 组织稳定性D. 焊接性试题答案:B4、《焊工考核细则》中规定焊工基本知识考试满分为100分,不低于()分为合格。
(单选题)A. 50B. 60C. 70D. 80试题答案:B5、焊条型号和焊条牌号不仅符号不同,而且表示的内容也有差别,焊条牌号增加了特殊性能的符号,但没有()。
(单选题)A. 焊接电流种类的代号B. 药皮类型的代号C. 熔敷金属抗拉强度的代号D. 区别焊接位置的编号试题答案:D6、焊条电弧焊时,开始结晶的主要晶核形成条件是()(单选题)A. 合金元素或杂质的悬浮质点B. 没有熔化的母材表面晶粒C. 表面张力差引起的强烈对流运动D. 合金元素的不均匀分布试题答案:B7、不易淬火钢的热影响区中,不完全重结晶区的加热温度范围是()(单选题)A. Ac1~Ac3B. 912℃以上C. Acm以上D. 600~650℃试题答案:A8、CO2气体保护半自动焊过程中,手工操作用于完成()。
(单选题)A. 焊接热源的移动B. 焊丝的送入C. CO2气体的送入D. 熔滴过渡的控制试题答案:A9、氩弧焊时,钨棒作为电极,不但有导电、引燃电弧和维持电弧正常燃烧作用,还具有()的作用。
(单选题)A. 发射电子B. 保护喷嘴C. 氧化还原D. 防止合金元素烧损试题答案:A10、电焊工不允许穿有铁钉的鞋是为了防止()(单选题)A. 烫伤B. 滑倒C. 触电D. 扎脚试题答案:C11、CO2气体保护焊时,焊丝的含碳量必须限制在0.10%以下,其主要目的是()。
喇遇市喊景学校高考化学一轮复习 第五章 第二讲 元素周期表元素周期律试题

解析:第三周期第ⅣA 族元素的原子有 3 个电子层,最外层电子数为 4,其核外电子排布为 2、8、4,
即 14 号元素 Si;与 Na 元素(原子序数为 11)相邻的同族元素的原子序数是 11-8=3 或 11+8=19;在短
周期元素中,族序数等于周期序数的元素有第一周期第ⅠA 族的 H 元素,第二周期第ⅡA 族的 Be 元素,第
(7)位于同一主族的甲、乙两种元素,甲的原子序数为 x,则乙的原子序数可能为 x+4。( )
(8)位于同一周期的甲、乙两种元素,甲位于ⅠA 族,原子序数为 x,乙位于ⅢA 族,则乙原子序数可
能为 x+19。( )
答案:(1)× (2)× (3)× (4)× (5)√ (6)× (7)× (8)×
题组二 元素周期表的应用
素,W 为 S 元素,Q 为 Cl 元素。O 和 S 元素同处第ⅥA 族,类比 Na 和 O 元素形成化合物 Na2O2,推测 Na 和 S 元素可形成化合物 Na2S2,A 项正确。Si 和 O 元素形成的 SiO2 为原子晶体,在熔融状态下不导电,B 项错。 Cl 元素的非金属性比 S 元素的强,则 Cl 原子得电子能力比 S 原子强,C 项错。C 元素可形成石、石墨、C60 等多种同素异形体,O 元素可形成 O2、O3 等同素异形体,D 项错。
1.(2013·高考浙江卷)短周期元素 X、Y、Z、W、Q 在元素周期表中的位置如下表所示,
其中 X 元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是( )
X Z
A.钠与 W 可能形成 Na2W2 化合物 B.由 Z 与 Y 组成的物质在熔融时能导电
Y
W
Q
C.W 得电子能力比 Q 强
斜线,即为金属元素和非金属元素的分界线(氢元素除外)。 2.金属元素:位于分界线的左面区域,包括所有的过渡元素和部分主族元素。
镧系和锕系元素ppt(共19张PPT)

Er3+(88.1pm)附近,Sc3+的半径接近Lu3+,在自然界中Y,Sc常同镧系元素共生,成为 稀土元素成员。
第8页,共19页。
镧系元素的原子半径、离子半径
左表示出镧系元素的原子半径、离
原子 元素 金属原子 离子半径/ pm
25.2.1 镧系元素的价电子层结构
第5页,共19页。
镧系元素气态原子的4f轨
道的充填呈现两种构型,即4fn-
15d16s2和4fn6s2,这两种电 子
Ln2O3在水中发生水合作用而形成水合氧化物
构型的相对能量如图1所示: 另一方面,激发的结果增加了一个成键电子,成键时可以多释放出一份成键能。
3 镧系元素的发光材料
99.5
次填充的(n-2)f电子其屏蔽常数可能略
61 Pm 181.0
97.9
小于1.00(有文献报告为0.98),对核电荷
62 Sm 180.2 111 96.4
的屏蔽不够完全,使有效核电荷Z*递增,
63 Eu 204.2 109 95.0
核对电子的引力增大使其更靠近核;而
64 Gd 180.2
93.8
84.8
过渡系的Zr和Hf、Nb与Ta、Mo与W三 对元素的半径相近,化学性质相似,分 离困难。
第9页,共19页。
原子半径
将镧系元素的原子半径随原子序数的变化作图
58 Ce 3
182. 90.
较低,而其余元素皆为4fn6s2
。 f 区过渡元素是指正在充填七条(n-2)f轨道的14个电子的镧系和锕系元素。
一方面, 镧系元素原子半径从La的187.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
其它过渡元素A组1.植物叶绿素与动物血红蛋白中所含的微量金属元素分别是A 镁和铜B 镁和铁C 锌和铜D 锌和铁2.下列物质中,不属于合金的是A 硬铝B 黄铜C 钢铁D 水银3.下列金属中属于有色金属的是A 铁B 锰C 钠D 金4.利用新技术能将不锈钢加工成为柔软的金属丝,它和棉纤维一起编织成为防辐射的劳防服装,这是利用了金属的A 耐腐蚀性B 还原性C 热传导性D 延展性5.下列有关金属元素特征的叙述,正确的是A 金属元素的原子只有还原性而离子只有氧化性B 金属元素的单质在常温下均为固体C 金属元素原子的价电子(参与形成化学键的电子)数都不超过4D 在周期表中,过渡元素都是金属元素6.下列关于金属元素特征的叙述正确的是A 金属元素的原子只有还原性,离子只有氧化性B 金属元素在化合物中一般都显正价C 金属元素在不同化合物中的化合价均不同D 金属单质在常温下均为固体7.钛和钛的合金被认为是21世纪的重要材料,它们具有很多优良的性能。
如熔点高、密度小、可塑性好、易于加工,钛合金与人体有很好的“相容性”。
下列用途不切合实际的是A用来做保险丝 B 用于制造航天飞机C 用来制造人造骨D 用于制造汽车、船舶8.所谓合金,就是不同种金属(也包括一些非金属)在熔化状态下形成的一种熔合A Fe、AgB Au、AgC Au、CuD Zn、W9.镧(La)是一种活泼性比锌更强的稀土元素,它的氧化物分子式La2O3,La(OH)3是不溶于水的碱;而LaCl3、La(NO3)3都溶于水。
现有下列几种组合①La2O3+HCl ②La+HCl ③La(OH)3+HCl④NaCl+La(OH)3⑤La+Cl2⑥La2O3+KCl能直接制得LaCl3的反应是A ①②③④B ①②③⑤C ②③⑤⑥D ①②③④⑤10.镧系元素的含水氯化物LaCl3·nH2O,加热脱水时,易发生水解。
为了制得无水LaCl3,常常加入的脱水剂为A HCl(气流)B NH4Cl(固体)C P2O5(固体)D 浓H2SO411.我国拥有世界上最大的稀土矿,品位甚高。
若以RE表示稀土元素,则向RE的硫酸盐溶液中加入粉状的Na2SO4,可以使稀土元素转为沉淀,反应方程式为RE2(SO4)3+Na2SO4+xH2O→RE2(SO4)3·Na2SO4·xH2O↓(x=1,2)。
下列有关叙述正确的是A 该反应为复分解反应B 该反应一定在强碱溶液中进行C 产生的沉淀物为复盐D 产生的沉淀物一定是难溶物质12.钛(Ti)被称为铁、铝之后的第二金属,以TiO2制取Ti的主要反应①TiO2+2C+2Cl 2TiCl4+2CO ②TiCl4+2Mg2MgCl2+TiA 反应①是置换反应B 反应②是复分解反应C 反应①中TiO2是氧化剂D 反应②中金属镁是还原剂13.高温金属陶瓷广泛应用于火箭和导弹技术中。
将铝粉、石墨和二氧化钛按一定比例混合均匀,涂在金属表面,在高温下煅烧:4Al+3TiO2+3C=2Al2O3+3TiC,留在金属表面的涂层是一种高温金属陶瓷。
下列有关该反应说法正确的是A TiO2是氧化剂,C、Al是还原剂B TiC中钛元素为-4价C TiC是分子晶体,Al2O3是离子晶体D 每生成1mol TiC转移电子4mol14.最近研究证明,钒对糖尿病的治疗有特殊的疗效,患者饮用含少量偏钒酸钠和食盐的混合溶液,4天后血液中的糖量即可恢复正常。
但钒的化合物有毒,人吸收多了会得肺水肿。
下列叙述正确的是A 钒是过渡元素,在元素周期表中处于第四周期B 人体血液中含的糖是蔗糖,医院注射所用的糖也是蔗糖C 检测糖尿病患者尿液的实质就是检测含不含蔗糖D V2O5常用作制硫酸和有机合成的催化剂15.2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。
工业上冶炼钼的化学原理为:①2MoS2+7O 22MoO3+4SO2,②MoO3+2NH3·H2O=(NH4)2MoO4+H2O,③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4Cl,④H2MoO4=MoO3+H2O,⑤用还原剂将MoO3还原成金属钼。
则下列说法中正确的是A MoS2煅烧产生的尾气不可直接排到空气中B MoO3是金属氧化物,也是碱性氧化物C H2MoO4是一种强酸D 利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3︰3︰216.过渡元素的化合物是高温超导物质研究的热点。
某过渡元素A与氧形成的化合物叫金红石,其晶体的最小结构单元如右图。
则下面有关金红石的说法正确的是A 一定是共价化合物B 可能是离子化合物C 它的化学式为AO2D 它的化学式为A3O2A17.背景材料:①去年12月,我省北江因某企业超标排放含镉的污水,水体受到严重污染;②镉(元素符号Cd)和锌是同主族元素,在自然界中镉与锌、铅共生;③镉化合物中的硫化镉属低毒类;④专家表示“不能治一个污染有造成另一个污染”,在用药选择上,放弃了投放硫化钠的方案,使用了对人没有危害的无机高分子絮凝剂聚合硫酸铁,根据以上材料,下列说法中正确的是A 镉是ⅡA族元素B 污染物镉离子的符号是Cd3+C 硫化镉和氢氧化镉都几乎不溶于水D 治疗的两种方案都是使污染物与药剂发生氧化还原反应而除去18.2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。
工业上冶炼钼的化学原理为①2MoS2+7O22MoO3+4SO2;②MoO3+2NH3·H2O=(NH4)2MoO4+H2O;③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4Cl;④H2MoO4MoO3+H2O;⑤用还原剂将MoO3还原成金属钼。
则下列说法正确的是A MoS2煅烧产生的尾气可直接排空B MoO3是金属氧化物,也是碱性氧化物C H2MoO4是一种强酸D 利用H2、CO和铝分别还原等量的MoO3,所消耗还原剂的物质的量之比为3︰3︰219.单质钛的机械强度高,抗蚀能力强,有“未来金属”之称,工业上常用硫酸分解钛铁矿(FeTiO3)的方法制取TiO2,再由TiO2制金属钛,主要反应有①FeTiO3+3H2SO4=Ti(SO4)2+FeSO4+3H2O②Ti(SO4)2+3H2O=H2TiO3↓+2H2SO4③H2TiO3TiO2+H2O④TiO2+2C+Cl2TiCl4+2CO⑤TiCl4+2Mg=2MgCl2+Ti下列叙述错误的是A 反应①是非氧化还原反应B 反应②是水解反应C 反应④中TiO2是氧化剂D 反应⑤是置换反应20.将5mL 0.1mol/L氯化铈(CeCl x)溶液分别注入7支各盛有不同体积的0.25mol/L硝酸银溶液的试管中。
右图表示生成氯化银沉淀的质量与所用硝酸银溶液体积的关系。
则化学式中x的值是A 1B 2C 3D 421.V2O3和V2O5按不同摩尔比混合可按计量发生完全反应。
试问:为制取V6O13、V3O7及V8O17,反应物摩尔比各是多少?22.三氧化铀是一种两性氧化物,它在溶液中可以以UO22-和U2O72-形式存在,按要求写出UO3与强酸、强碱反应的离子方程式:(1)UO3表现酸性:(2)UO3表现碱性:23.随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。
已知钒的原子序数为23,回答下列问题:(1)钒被认为是一种稀土元素,广泛分散于各种矿物中,钾钒铀矿中的钒原子最外层已达8电子稳定结构,其化学式为K2H6U2V2O15,若用氧化物的形式表示,该化合物的化学式为。
(2)测定钒含量的方法是先把钒转化成V2O5,V2O5在酸性溶液里转变成VO2+,再用盐酸、硫酸亚铁、草酸等测定钒。
请配平下列反应式并表示电子转移方向和数目:VO2++H2C2O4→VO++CO2+H2O其中还原剂是;若消耗0.9g草酸,所对应钒元素质量是g。
24.金属钛的强度大,密度小,外观像钢,被誉为“太空金属”和“未来钢铁”。
其单质和化合物的许多性质和金属铝很相似。
请根据以上叙述回答下列问题:(1)常温下,钛在空气中具有很好的抗腐蚀性,是因为。
(2)常温下TiCl4是一种无色液体,能发生强烈水解故可以作烟雾弹,请用化学方程式来表示其原理。
(3)TiO2的水化物不溶于水,但在一定条件下既能溶于强酸,又能溶于强碱。
请用电离方程式解释TiO2的水化物既能溶于强酸又能溶于强碱的原因。
(4)常温下,钛不与水、稀盐酸、稀H2SO4或稀HNO3作用,但易溶于氢氟酸,推测其原因是A 氢氟酸的酸性比其他酸强B 氢氟酸的氧化性比其他酸强C 氢氟酸的还原性比其他酸强D 钛离子易与氟离子形成可溶性难电离物质将该金属投入冷水中无变化,投入稀盐酸中,可产生大量的无色气体。
根据上述信息回答:(1)试推断该金属可能的一种用途,该金属的活动性比铜(填“强”或“弱”)(2)请自选试剂,设计实验探究该金属与铁的活动性强弱,并完成下表:26.TiO2(二氧化钛)是高级的白色颜料,它可用下列反应制得:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O ①TiOSO4+2H2O=TiO2·H2O+H2SO4 ②制取TiO2的关键是②步反应。
根据平衡移动的原理,为使反应②能够顺利进行,应采用,,等措施。
27.二氧化钛在现代社会里有广泛的用途,它的产量是一个国家国民经济发展程度的标志,我国至今产量不足尚需进口二氧化钛。
“硫酸法”生产二氧化钛的原料是钛铁矿(主要成分是FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质),主要生产流程是:(1)将钛铁矿与浓H2SO4煮解:FeTiO3+2H2SO4(浓)=TiOSO4(硫酸钛酰)+FeSO4+2H2O(2)加水分解硫酸氧钛:TiOSO4+(n+1)H2O=TiO2·nH2O+H2SO4(3)煅烧TiO2·nH2O TiO2+nH2O“硫酸法”生产TiO2排放出的废液对水体有哪些污染,请指出主要的三点。
根据废液主要成分,提出一种处理上述废水的方法。
28.四氯化钛是工业上制备金属钛的重要原料。
在常温下,它是一种极易水解的无色液体,沸点为136.4℃。
工业制备TiCl4的反应原理为:TiO2+2C+2Cl2TiCl4+2CO下图是实验室模拟工业生产制备氯化钛的反应装置,其主要操作步骤有:①连接好整套装置,在通Cl2前先通入干燥的CO2气体并持续一段时间;②当锥形瓶中的TiCl4的量不再增加时,停止加热,改通CO2气体直至电炉中的瓷管冷却为止;③将TiO2、炭粉混合均匀后,装入管式电炉中;④将电炉升温至800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
