无机化学第21章 P区金属(2013)
21 第21章 p区金属

GeO2 (白色) SnO2(白,难溶于酸或碱) PbO2 (棕黑,两性偏酸)
Ge(OH)2(白色) Ge(OH)4(棕色)
Sn(OH)2(白色) Sn(OH)4(白色) Pb(OH)2(白色) Pb(OH)4(棕色)
稳定性: Sn(II)还原性 <
Sn(IV)
Pb(II)
>
Pb(IV)氧化性
高价体现氧化性, 低价体现还原性
3)单质的化学性质:
M2O3
O
2
S
M2S3
MX3
X2
H2SO4(热浓) Sb2(SO4)3
Sb
Bi2(SO4)3
Bi
HNO3
Sb2O5 ·xH2O
Bi(NO3)3
21-4-2 锑和铋的化合物
1、氧化物和氢氧化物
锑、铋氧化物及其氢氧化物的酸碱性
锑
Sb4O6
+III
Sb(OH)3
两性偏碱性
Sb2O5
+V
4. 铝的卤化物
AlF3
AlCl3 AlBr3
AlI3
离子晶体
共价键(分子晶体) 熔点低,易挥发,易溶于有机溶剂
气态时形成二聚体Al2Cl6。 Cl
Cl Al
Cl Al
Cl
Cl
Cl
3p1
3s2
sp3 杂化
AlCl3的激烈水解:
A3 l C 32 lH O水 ( 或潮 ) A 湿 l(3空 O 3H H 气 C ) l
3. Al2O3和Al(OH)3
723K Al(OH)3 -Al2O3 活性氧化铝(可作为催化剂载体)
1273K
a-Al2O3
刚玉
红宝石(Cr3+) 蓝宝石(Ti4+, Fe2+) 黄玉 (Fe3+)
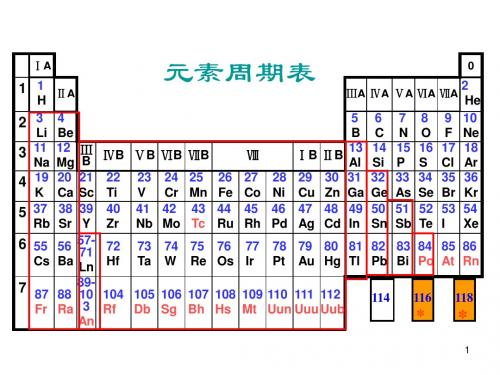
元素化学:p区金属

好,更符合滴定操作要求。
例2:碱式氯化铝BAC的分子式为[Al2(OH)xCl6-x]y,其中1<x<6, y<10。BAC溶于水后净水效果好于硫酸铝,可通过煤矸石(主要 成分为硅、铝、铁的氧化物)与浓度均为16%的硫酸与盐酸的混 合酸在沸腾下制备。
三、硫化物
硫化物 状态 溶解
GeS2 白色
Na2S
SnS2 黄色
Na2S
GeS 红色
SnS 棕色
(NH4)2Sx (NH4)2Sx
PbS 黑色
浓盐酸 HNO3
第三节 锑和铋
ns2 np3
3-1 锑、铋的单质 1、存在:我国锑的含量占世界第一位,湖南冷水江的锡矿山 是世界最大的锑矿。辉锑矿(Sb2S3)、辉铋矿(Bi2S3)。 2、提取: 2Sb2S3+3O2+6Fe=Sb4O6+6FeS; Sb4O6+6C=4Sb+6CO;Bi2S3+3Fe=2Bi+3FeS 3、性质 1)与氧气、卤素、硫 2)与浓硝酸、浓硫酸、王水: 2M+6H2SO4=M2(SO4)3+3SO2+6H2O 4、用途:伍德合金用作保险丝、灭火和蒸气锅炉中安全装置
KI溶液1~2 mL充分溶解,使溶液呈透明橙红色。加0.5 mL
2%淀粉溶液,用0.0100 mol/L Na2S2O3标准溶液滴定使溶液由 蓝色刚好褪去为止,记下所用去的Na2S2O3标准溶液的体积为 V(S2O32-)。再加入二甲酚橙3~4滴,用0.0100 mol/L EDTA标 准液滴定溶液由紫红色变为亮黄色时,即为终点。记下所消耗
Sb2S3
Bi2S3
Chapter 21 p区金属

College of Chemistry & Materials Science
Al2O3 γ-Al2O3 -Al2O3 活性氧化铝
硬度不大 可作催化剂载体 可溶于酸、碱 《无机化学》-p区金属
Sichuan Normal University
College of Chemistry & Materials Science
College of Chemistry & Materials Science
从铝矾土矿(Al2O3)冶炼金属铝的步骤:
College of Chemistry & Materials Science
Sichuan Normal University
碱溶铝矾土矿 过滤 通CO2于滤 液析出Al(OH)3 灼烧 纯氧化铝 Al2O3 石墨阳极 铁槽 (阴极) 熔融金属铝
熔点低,易挥发, 共价键 分子晶体 易溶于有机溶剂 《无机化学》-p区金属
Sichuan Normal University
结构
College of Chemistry & Materials Science
Al原子是缺
电子原子,因此 AlCl3是典型的
3p
3s
Al原子基态
Lewis酸。
3s
3p
Sichuan Normal University
College of Chemistry & Materials Science
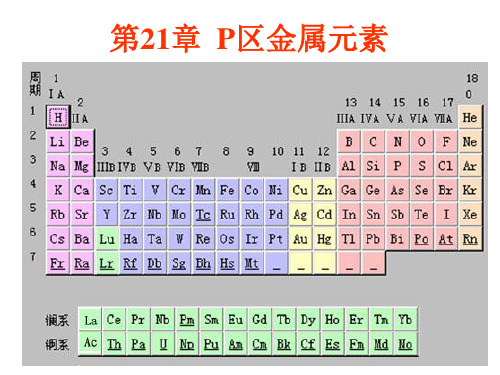
21-1 p区金属概述
1.p区金属在价层电子结构上与s区金属的区别 p区金属包括:Al、Ga、In、Tl、Ge、Sn、
Pb、Sb、Bi和Po共10种金属。
(1) p区金属元素的价电子构型为ns2np1~4 ,与s 区金属相比,有了np电子,即价电子数增多。
第四版无机化学21章课后答案

第四版无机化学21章课后答案第21章 p区金属思考题21-1如何制备无水AlCl3?能否用加热脱水的方法从AlCl3·6H2O 中制取无水AlCl3?解:制备无水AlCl3,可采用干法,即用Al和Cl2在加热的条件下反应制得。
2Al + 3Cl2 === 2AlCl3也可在HCl气氛下,由AlCl3·6H2O加热脱水得到。
但不能直接由AlCl3·6H2O 加热脱水得到无水AlCl3,因为铝离子的强烈水解性,在加热过程中,发生水解,不能得到无水AlCl3。
21-2矾的特点是什么?哪些金属离子容易成矾?解:矾在组成上可分为两类:M I2SO4·M II SO4·6H2O(M I=K+、Rb+、Cs+和NH4+等,M II=Mg2+、Fe2+等);M I M III(SO4)2·12H2O(M I=Na+、K+、Rb+、Cs+和NH4+等,M II=Al3+、Fe3+、Cr3+、Co3+、Ga3+、V3+等),都为硫酸的复盐,形成复盐后,稳定性增强,在水中的溶解性减小。
21-3 若在SnCl2溶液中含有少量的Sn4+,如何除去它?若在SnCl4溶液中含有少量Sn2+,又如何除去?解:(1) SnCl2中含有少量的Sn4+,可加入锡粒将其除去。
发生的化学反应是:SnCl4+Sn === 2SnCl2(2) 在SnCl4中含有少量的Sn2+,可利用Sn2+的还原性,用H2O2将其氧化为Sn4+。
21-4比较Sb、Bi的硫化物和氧化物的性质,并联系第16章内容,总结归纳砷分族元素的氧化物及其水合物、硫化物的酸碱性、氧化还原性的递变规律。
解:砷分族元素的氧化物及其水合物的酸碱性和氧化还原性的递变规律与其对应的硫化物相似。
即:从上到下,酸性减弱,碱性增强;+V氧化值的氧化性从上到下增强,+III 氧化值的还原性从上到下减弱;同一元素+V氧化值的酸性比+III氧化值的强。
2018年安徽化学竞赛 无机 21第21章p区金属

氧sO3
Sb(OH)3
仅存在于溶液中 白色难溶
Al(OH)3+3C14H5O2(OH)2(茜素) → Al(C14H7O4)3(红色)+3 H2O
A3l + +
OOH OH
浓NH 3· H2O
SO 3Na O
A/l3
OO OH (红色 SO 3Na
O
Al3+ 的鉴定(方法2)
取 Al3+ 溶 液 , 加 入 NH4Ac 溶 液 使 溶 液 接 近 中性。然后加1~2滴铝试剂,搅匀微热, 有红色沉淀生成即示有Al3+。
§21-2 铝 镓分族
• 铝及镓分族元素的一些化合物有缺电子性。 • 常见氧化态为+I,+III。
Tl的+I化合物稳定。 • +III化合物有很强的共价性
一、铝及其化合物
1. 单质铝的冶炼及性质 铝的冶炼:
Al2O3(s)+2NaOH+2H2O=2Na[Al(OH)4] 2Na[Al(OH)4]+CO2=Al(OH)3↓+NaCO3+H2O
第5主族元素的基本性质
p区金属元素通性
• 它们的价电子构型为ns2np1-4,内层饱和; • 常有两种氧化态,且相差为2; • p区同族元素从上到下低氧化态的化合物
稳定性逐渐增强,高氧化态的化合物稳 定性逐渐减弱。 • 低氧化态化合物中部分离子性强。 • 高氧化态化合物中多数为共价化合物。 • 大多数的盐在水中极易水解。
锡的性质
• 比锗活泼 能与稀酸缓慢作用, 生成Sn(II)的化合物
Sn+2HCl=SnCl2+H2↑ 4Sn+10HNO3=4Sn(NO3)2+NH4NO3+3H2O 与热的HCl, H2SO4, HNO3反应,
Chapter21 P区金属

②第四周期元素表现出异样性(d区插入) 第四周期元素表现出异样性( 区插入) 周期元素表现出异样性 例如:溴酸、高溴酸氧化性分别比其他卤酸 例如:溴酸、高溴酸氧化性分别比其他卤酸(HClO3 , HIO3)、高卤酸 、高卤酸(HClO4,H5IO6)强。 强 ϕθClO3-/Cl2 =1.47 v ϕθ BrO3-/Br2= 1.48v ϕθ IO3-/I2= 1.195v ϕθ ClO4-/ClO3- = 1.19v ϕθ BrO4-/BrO3-= 1.763v ϕθ H5IO6/IO3- = 1.70v
三.铝盐和铝酸盐 1.铝盐和铝酸盐的形成及水解性 [Al,Al2O3或Al(OH)3]+HCl AlCl3 (铝盐) 铝盐) , [Al,Al2O3或Al(OH)3]+NaOH NaAl(OH)4 (铝酸盐) 铝酸盐) , ①铝盐溶液由于水解均呈酸性: 铝盐溶液由于水解均呈酸性: Al(H2O)63+ + H2O Al(H2O)5(OH)2+ + H3+O { [Al(H2O)5(OH)]2+还将逐级水解 } 向铝盐中加入碳酸钠不能得到碳酸铝,水解反应如下: ②向铝盐中加入碳酸钠不能得到碳酸铝,水解反应如下: 2Al3+ + 3CO32-+ xH2O Al2O3·xH2O↓ +3CO2↑ 铝酸盐水解使水溶液呈弱碱性: ③铝酸盐水解使水溶液呈弱碱性: Al(OH)4Al(OH)3 + OH冰晶石Na 的制取: ④冰晶石 3AlF6的制取: 2Al(OH)3+12HF +3Na2CO3 2Na3AlF6 + 3CO2↑+ 9H2O 电解法制铝所需要的助熔剂) (2Na3AlF6电解法制铝所需要的助熔剂)
第21章p区金属

2
Ge 由于可作半导体材料,制备工艺较复杂。 GeS
O2
GeO2
HCl
GeCl4
2O H
GeO2 · xH2O
H2
Ge
区域熔融 Ge(超纯)
过程中经历 Al(OH)Cl2 、Al(OH) 2Cl、Al(OH)3 , 其分解历程与 PCl3 水解历程相似。 b、硫酸铝和明矾 制备:见书 675 页的反应,分别得到纯净和含杂质的有 18 个结晶水的硫酸 盐。 硫酸铝是最常见的铝盐,它的最重要的性质就是形成明矾。矾的通式之一:
2
M 2SO4· M 2(SO4)3·24H2O(或: M M (SO4) 2·12H2O) ,当 M 是 Al3+、 M
三、硫化物
四、铅的一些含氧酸盐
(自学)
6
Ⅰ Ⅲ Ⅰ Ⅲ Ⅲ
Ⅰ
是 K+时,称为铝钾矾,俗称明矾。 21-2-2、周期表中的对角线关系(自学) 21-3 锗分族 由于锗、锡、铅的离子是 18 或 18+2 电子构性的离子,锗、锡、铅的化合物 中,极化作用显著,难溶、有颜色。铅受惰性电子对效应影响显著。 21-3-1、锗、锡、铅的冶炼、性质和用途 锗、锡、铅在自然界的存在形式主要为氧化物和硫化物。 制备:Sn、Pb 由氧化物还原得到:
θ
利用该反应的高反应热, Al 可以在高温下从其它金属氧化物中夺取氧并置换出 金属单质,因高热使金属熔化而达到分离。如: Fe2O3 + 2Al = Al2 O3 + 2Fe 这种制备金属单质的方法称为铝热还原法。 Al 显两性。由此导致其单质、氧化物、氢氧化物都可溶于酸、碱。 Ga 作为非本征半导体具有一定的应用。 二、氧化铝和氢氧化铝 1、氧化铝 Al2 O3 为白色固体,约有八种变体:α (六方) 、 γ (立方) 、ρ (无定形) 、 χ (立方) 、η (立方尖晶石) 、 δ (正交) 、κ (正交) 、θ (单斜) 。最常见的 是α - Al2O3、 γ - Al2O3。 制备: 工业:水铝矿( Al(OH)3 ) 、铝土矿( AlO(OH) ) 、水铝石( AlO(OH) )等在 一定条件下受热脱水即得α - Al2O3 或γ - Al2O 3。 实验室: 铝盐转变成氢氧化铝, 后者受热分解得γ - Al2O3 。 γ - Al2O3 在 1120K 时受热转变成α - Al2O 3。 结构:α - Al2O3 是致密的,属六方紧密堆积构型,对化学反应呈高度惰性,
二十一章p区金属

•溶解性:
少数可溶:Pb(NO3)2, Pb(Ac)2(弱电解质, 有甜味,俗称铅糖),铅的可溶性化合物都 有毒。
多数难溶:PbCl2,PbI2,PbSO4,PbCO3,
PbCrO4等。
PbCl2溶于热水,也溶于盐酸:
PbCl2 2HCl H2[PbCl4] PbSO4溶于浓硫酸,生成Pb(HSO 4 )2。
它们的化学性质可以括如下:
1.与氧的反应:在通常条件下, 空气中的氧只对铅有作用,空气中 的氧对锗和锡都无影响。这三种元 素在高温下能与氧反应而生成氧化 物。
2.与其它非金属的反应:这些金 属能同卤素和硫生成卤比物和硫化 物。
3.与水的反应
锗不与水反应,锡既不被空气氧化, 又不与水反应,常被用来镀在某些金 属(主要是低碳钢制件)表面以防锈蚀。 铅的情况比较复杂,它在有空气存在 的条件下,能与水缓慢反应而生成 Pb(OH)2。
I-
HNO3
Pb(HSO4)2 PbI42- Pb2++Cr2O72-
21-4 锑和铋
21-4-1 单质
砷、锑、铋在地壳中的含量不大,它 们有时以游离态存在于自然界中,但 主要以硫化物矿存在。 砷锑铋都有金 属的外形,是电和热的良导体,具有 脆性,熔点低,并且容易挥发,熔点 从As到Bi依次降低
21-4-2 砷、锑、铋的 化合物
常温为 对应水合物
As4O6
As(OH)3 H3AsO3 两性偏酸
Sb4O6
Sb(OH)3 两性偏碱
Bi(OH)3 碱性
(微两性)
两性
M2O3 6H 2M3 3H2O M2O3 6OH- 2MO33- 3H2O
M = As、Sb
第21章 P区金属

21-2 铝 镓分族 Al, Ga, In, Tl
二、铝的氧化物及其水合物 氧化铝: α- Al2O3 :刚玉,硬度大,不溶于水、酸、碱。 γ- Al2O3 :活性氧化铝,可溶于酸、碱,可作为催 化剂载体。
红宝石(Cr3+)
蓝宝石(Fe3+,Fe2+,Ti4+) 黄玉/黄晶(Fe3+)
2. 氢氧化铝
(Al(OH)3)
Al3+ + 3H2O [Al(OH)4]+H2O
还原:GeO2 + 2H2 === Ge + 2H2O
Sn:以锡石(SnO2)形式存在。 锡。
以焦炭还原SnO2 得粗锡,再电解精炼得纯
SnO2 + C === Sn + 2CO↑ Pb: 以方铅矿(PbS) 形式存在。焙烧使之变成氧 化物,再用还原剂还原得粗铅,最后电解精 炼得纯铅。 2PbS + 3O2 === 2PbO + 2SO2 PbO + C === Pb + CO↑ PbO + CO === Pb + CO2
二卤化物
Sn 白色晶体 - - 白色固体 熔点 519K 淡黄色固 体、熔点 Pb 无色晶体 1128K 熔化 白色晶体 熔点 774K 白色晶体 熔点
F
236K升华 无色液体 沸点 357K 灰白色晶体 熔点
Cl
Br
无机化学第21章 P区金属(2013)

1、铝的卤化物 在三卤化铝中,除AlF3为离子型化合物外,其 余均为共价型化合物。 在气相或非极化溶剂,AlCl3,AlBr3,AlI3均是二 聚体。 。 在二聚分子中卤素原子对铝呈四面体配置,是 一种桥式结构。即在每个AlX3分子中,铝原子 有空轨道,X原子有孤电子对,因而在两个AlX3 分子间发生x→Al提供电子对而配位,形成卤桥 的配位化合物
21-3 锗分族
一、通性 电子层构型为ns2np2,常见氧化态为:+4,+2 在锗、锡、铅中随着原子序数的增大,低氧化 态稳定性逐渐增强。这种递变规律在其它几个 主族中也同样存在,这是由于ns2电子对逐渐稳 定的结果。
二、
锗、锡、铅的存在和冶炼
锗为稀有元素,无独立的矿物,常以硫化物形式伴生在其 它金属的硫化物矿中。 锡在自然界中以氧化物如锡石SnO2的状态存在。 铅以各种形态的化合物存在,其中最重要的是方铅矿(PbS)。 锗的冶炼:焙烧 锡的冶炼:锡石 铅的冶炼:方铅矿 提纯 氢气还原 锗 焦碳还原 粗锡 电解精炼 焙烧 还原 粗铅 电解精炼
三氯化铝的结构与性质: 三氯化铝溶于有机溶剂或处于熔融状态时都以共价的 二聚分子Al2Cl6形式存在。在这种分子中有氯桥键 (三中心四电子键),与B2H6的桥式结构形式上相似, 但本质不同。
因为AlCl3为缺电子分子,Al倾向于接受电子对形 成sp3杂化轨道。两个AlCl3分子间发生Cl→Al的电 子对授予而配位,形成Al2Cl6分子。
3、价键特征:
这些元素与其它元素化合时以离子键
为主,但由于形成M+3离子所需的电离能
很大,因此它们的+3氧化态化合物有很强 的共价性。例如在卤化物中,除氟化物为
离子型的以外,其它都是共价型的,熔、
无机化学第21章

第21章 P 区金属
本章所讲述的内容涉及Al, Ga, In, Tl, Ge, Sn, Pb, Sb, Bi 和Po 十种元素, 其中Al, Sn, Pb 为常见元素,本章的重点是这三种元素.
1.铝 是活泼金属元素,有两性,有+3价氧化态化合物Al 2O 3; 形成的共价化合物有缺电子特征,为路易斯酸。
卤化铝(Cl 、Br 、I )能形成二聚体Al 2X 6以卤桥键相结合。
2.锡、铅 有+2、+4氧化态化合物。
Sn 2+是中等强度酸,是强还原剂。
Sn 4+ 在水溶液中以配离子存在,Pb 2+的酸性不如Sn 2+。
Pb (Ⅳ)是强氧化剂以PbO 2存在。
3.惰性电子对效应: p 区ⅢA—ⅤA 都具有两种氧化态, 低氧化态从上至下稳定,即第六周期的Tl (Ⅰ)、Pb (Ⅱ)、Bi (Ⅲ)稳定。
Ga In Tl Ge Sn Pb As Sb Bi 因此TlCl 、PbCl 2、BiCl 3都很稳定,而Tl 2(SO 4)3, PbO 2、NaBiO 3是强氧化剂。
In (Ⅰ)、Sn (Ⅱ)、Sb (Ⅲ)是还原剂。
这些事实说明6s 2电子对有较大的惰性,不易失去,称为惰性电子对效应.
4. 在周期表中,在第二周期和第三周期元素中,处于对角线位置上的三对元素:Li—Mg 、Be—Al 、B—Si ,它们的性质具有相似性。
这种相似性称为“对角线规则”。
第二十一章 p区金属概论
a-Al2O3
刚玉,硬度
低温、快速下加热
γ -Al2O3
活性氧化铝,可溶于 酸、碱,可作为催化 剂载体.
大,不溶于
水、酸、碱
22
Al2O3 有离子传导能力允许Na+通过以铝矾
土为电解质制成钠-硫蓄电池.由于这种蓄电池
单位重量的蓄电量大能进行大电流放电因而具
有广阔的应用前景这种蓄电池使用温度范围可
25
3)、铝盐和铝酸盐
金属铝 +酸 +碱 铝盐 铝酸盐
氧化铝
氢氧化铝
铝酸盐水解使溶液显碱性
[Al(OH)4]Al(OH)3+OH-
溶液中通入CO2,将促进水解的进行而得到真正的氢 氧化铝沉淀。
26
4)、硫酸铝和明矾
无水硫酸铝Al2(SO4)3为白色粉末。 从水溶液中得到的为Al2(SO4)3· 2O。 18H 纯Al(OH)3+热的浓H2SO4 或用H2SO4直接处理铝土矿或粘土 硫酸铝钾KAl(SO4)2· 2O叫做铝钾矾,俗称明矾, 12H 它是无色晶体。 Al2(SO4)3
准金属:既有金属性又有非金属性。
包括B、Si、As、Se、Te等。
两性金属都是金属,甚至是典型的金属,两性之意仅
指金属或其氧化物或氢氧化物既溶于酸又溶于碱。 包括Be、Zn、Cr、Al、Ga、Sn、Pb等
9
21-1 铝族 21-2 锗分族
10
21-1 铝族
Al、Ga、In、Tl均为银白色,质软、轻而富有延 展性的金属。它们相当活泼,一般用电解法制取。 铝族元素的固态化合物,只有少数为离子型的, 大部分属共价型的。 从铝到铊,其化合物的共价性逐渐减弱,离子性逐 渐增强。铝和镓化合物的共价性比较显著,而铟和铊化 合物的离子性则比较显著。
【最新】安徽化学竞赛 无机 21第21章p区金属-(共51页PPT)

铅的性质 • 比锡活泼 与空气中氧反应
2Pb+O2+2H2O=2Pb(OH)2 铅可被所有的酸侵蚀而形成难溶盐 与热浓HCl, 浓H2SO4, 生成Pb(II)盐 Pb+4HCl(热,浓)=H2[PbCl4]+H2↑ Pb+3H2SO4 (热,浓)=Pb(HSO4)2+SO2 ↑+2H2O 2Pb+O2=2PbO; PbO+2HAc=Pb(Ac)2+H2O 3Pb+8HNO3(稀)=3Pb(NO3)2+2NO ↑+4H2O
三、锗、锡、铅的化合物
1. 氧化物和氢氧化物
氧化物:
SnO2(黑色)
强酸
性
增
酸性增强
SnO(白色)
强碱 性 增
两性偏酸 PbO2(棕黑色) 碱性增强 PbO(黄红色 )两性偏碱
锡的氧化物: 重要的是SnO2
SnO2+2NaOH=Na2SnO3+H2O 铅的氧化物: PbO, PbO2, Pb3O4 • PbO与HAc和HNO3反应生成相应盐 • PbO2的氧化性和酸性 PbO2+2NaOH(热)=Na2PbO3+H2O PbO2+4HCl=PbCl2+Cl2↑+2H2O 2PbO2+2H2SO4=PbSO4↓+O2↑+2H2O 5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O Pb3O4+4HNO3=PbO2 ↓+2Pb(NO3)2+2H2O
氢氧化铝
• 两性: Al(OH)3+3H+=Al3++3H2O Al(OH)3+OH-=[Al(OH)4]- +2H2O
第21章 P区铝族元素
第21章 P区元素
P区十种金属元素
Al Ga In Tl
Ge Sn Pb
Sb Bi
Po
电子层结构 ns2np1~4 内层为饱和结构,它们在化 合物中常有两种氧化态,氧化值相差为2。 大部分P区金属元素在化合物中,电荷较高,半径较 小,其盐类在水中极易水解
§21-1
一 、铝的发展简史
所以,弱酸的铝盐不能用湿法制得。
(4)铝的鉴定
Al3+ 的鉴定:在氨碱性条件下,加入茜素,生成红色沉淀。
§21-2 镓(Ga)
1871年,元素周期系的发现者门捷列夫曾预言“类铝”(镓) 元素的存在。 1875 年 , 法 国 化 学 家 布 瓦 博 德 朗 ( Boisbaudran L.de. , 1839—1912)在用光谱法分析从比利牛斯的闪锌矿得到的提取 物时,发现两条从未见过的新谱线,其波长在 417nm的地方。 进一步后确定为一新元素。他用电解的方法得到了金属镓。 布瓦博得朗为了纪念自己的祖国法兰西,把新发现的元素 命名为“Gallium”(镓),就是法国的古名“家里亚”,它源自 于法国的拉丁名称:Gallia。中文根据音译成“镓”,元素符 号为Ga。 镓在地壳中的含量为5×10-4% ,以很低的含量分布于铝 矾土矿和某些硫化物矿中,含量最富的锗石中也只含0.1% 镓。 镓还容易和锗共存于煤中,所以燃烧后剩下的煤道灰中就含有 微量的镓和锗。
镓与砷、锑、磷等生成的砷化镓、锑化镓、磷化镓等都是优良 的半导体材料。磷化镓还是一种半导体发光材料,能够发射出红光 或绿光。 低温时镓有良好的超导性,在接近绝对零度即0K时,电阻几乎 为零。钒三镓(一个镓原子和三个钒原子形成的合金)是超导材料。
应当注意的是,镓及其化合物都有毒。其毒性远远超过汞和砷!镓 可以伤肾,破坏骨髓,沉积在软组织中,造成神经、肌肉中毒。它 可以与引起肿瘤、抑制正常生长有关。
北京师范大学、华中师范大学、南京师范大学无机化学教研室《无机化学》(第4版)(下册)-第21章 p区

第21章 p区金属21.1 复习笔记一、概述1.p区金属p区金属包括Al、Ga、In、Tl、Ge、Sn、Pb、Sb、Bi、Po,分属于周期表中的第ⅢA族、ⅣA族和VA族。
2.p区金属元素性质(1)p区同族金属元素从上到下原子半径逐渐增大,失电子趋势逐渐增大,元素的金属性逐渐增强;(2)它们在化合物中常有两种氧化态,且其氧化值相差为2;(3)它们的高氧化态化合物多数为共价化合物;低氧化态的化合物中部分离子性较强;(4)大部分p区金属元素在化合物中,电荷较高,半径较小,其盐类在水中极易水解。
二、铝镓分族1.铝及镓分族元素铝及镓分族元素Ga、In、Tl为第ⅢA族的金属元素。
2.铝镓分族价电子构型及特征(1)价电子构型为;(2)价电子数少于价轨道数,为缺电子原子。
3.铝镓分族氧化态特点(1)除Tl 外,铝及镓分族元素在化合物中的主要氧化态为+Ⅲ;(2)铊的+I氧化态比+Ⅲ氧化态的化合物稳定;(3)它们的+Ⅲ氧化态化合物有很强的共价性。
4.铝及其化合物(1)铝的冶炼①的纯制a.用碱溶液处理铝土矿:b.通入,促使铝酸盐水解,得沉淀:c .将过滤分离,干燥后煅烧,得到较纯的符合电解要求的氧化铝:②的熔融电解将溶解于熔融的冰晶石中进行电解,在阴极得到铝:(2)铝的物理性质①银白色的金属,质轻;②耐腐蚀性较好;③延展性和导电性能很好,能与多种金属形成高强度的合金。
(3)铝的化学性质①铝的亲氧性及用途a .原理第一,铝一接触空气,表面立即氧化,生成一层致密的氧化膜,阻止铝进一步被氧化,此膜不溶于水和酸,铝在空气中相当稳定;第二,铝能夺取化合物中的氧:b .用途第一,是冶金上常用的还原剂;第二,用来作为炼钢的脱氧剂;第三,用于制取高温金属陶瓷。
②铝的两性及用途a .铝既能溶于稀盐酸和稀硫酸,也易溶于强碱;铝还能溶于热的浓硫酸中;高纯度的铝(99.95%)只溶于王水。
b .铝在冷的浓硫酸及稀、浓硝酸中被钝化,常用铝桶装运浓、浓等化学试剂。
第21章P区金属

第21章P区金属第21章P区金属21-1 P区金属概述1.P区金属在价层电子结构上与S区金属有何不同?P区金属的价层电子结构使P区金属在金属性和形成化合物时的化学键上与S区金属有何不同?2.P区金属在在氧化态表现和变化规律上有何特征?21-2 铝镓分族1.铝族元素价层电子结构有何特征?铝族元素在形成化合物时在价键结构上与硼有何不同?2.单质铝如何制取?铝单质有何主要性质?铝是较活泼的金属,为什么日常生活中可使用许多的铝制品?3.铝的氧化物、氢氧化物有何特性?4.何谓铝盐和铝酸盐?它们有哪些主要性质?5. Al2Cl6与B2H6的结构有何相似与不同?为什么?为什么AlF3不二聚?6.何谓对角线规则?铝和铍有哪些相似性?21-3 锗分族1.锗分族元素在氧化态表现上有何特征?在形成化合物时与C、Si有何不同?锗分族+Ⅱ和+Ⅳ氧化态化合物的氧化还原性变化有何规律?2.单质锡有几种变体?为什么锡制品在低温下会自行毁灭?Ge、Sn、Pb 的单质有哪些主要性质?3.为什么不活泼的Pb可与非氧化性的弱酸HAc作用?这一性质有何用途?4. SnO2有何用途?铅有几种常见氧化物?请设计一实验证明铅丹的组成为Pb3O4(即含1个Pb(Ⅳ),2个Pb(Ⅱ))?锗分族氢氧化物的酸碱性变化有何规律?5.如何配制SnCl2溶液?如何鉴定Sn2+ ?6.了解锗分族的硫化物并与砷分族对比。
了解铅的重要含氧酸盐。
21-4 锑和铋1.锑和铋在自然界主要以何种物质存在?与氮、磷比为什么不同?2.砷分族+Ⅲ氧化态卤化物的水解性有何变化规律?写出其相应的水解反应方程式。
3.砷分族元素的氧化物及其水合物的酸碱性有何变化规律?其+Ⅲ和+Ⅴ氧化态的氧化还原性有何变化规律?4.砷分族的硫化物有何特性?其硫化物的酸碱性和氧化还原性有何变化规律?21-5 P区金属6S2电子的稳定性1.P区金属6S2电子为什么特别稳定性?4S2电子有特别的稳定性吗?其它区呢?2.P区金属6S2电子的特别稳定性对P区金属的性质带来哪些主要影响?作业P695:21-3,21-6,21-8,21-9 21-2,21-7,21-12,21-13,21-14。
第21章 p区金属3

氧化铝的电解 2Al2O3=4Al+3O2
2Al(OH)3+12HF+3Na2CO3=2Na3AlF6+3CO2+9H2O
2.铝的性质
银白色金属,质轻(密度为2.7g/cm3), 具有一定程度的耐腐蚀性;延展性和 导电性好;能与多种金属形成高强度 合金,有些合金强度可与钢相当. 应用:电讯器材,建筑设备,汽车, 航空,航天飞行器的制造.
21-2-2 周期表中的对角线关系 对角线关系(对角线规则): 周期表中除了同族元素的性质相似外, 还有一些处于对角线上的元素的性质 表现出相似性. Li Be B C Na Mg Al Si 原因:对角线上的元素原子具有相近 的静电场力.Z / r 比较相似.
锂与镁的相似性
① 单质与氧作用生成正常氧化物 氢氧化物均为中强碱, ② 氢氧化物均为中强碱,且水中溶解度不大 加热分解为正常氧化物 氟化物,碳酸盐, ③ 氟化物,碳酸盐,磷酸盐均难溶于水 氯化物共价性较强, ④ 氯化物共价性较强,均能溶于有机溶剂中 碳酸盐受热分解, ⑤ 碳酸盐受热分解,产物为相应氧化物 ⑥ Li+和Mg2+的水合能力较强
溶于稀盐酸和稀硫酸,也能溶于强碱. 2Al+6HCl=2AlCl3+3H2↑ 2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ 浓酸呢? 2Al+6H2SO4(浓,热)=Al2(SO4)3+3SO2↑+6H2O 冷的浓硫酸和硝酸中:钝化作用. 高纯度的铝(99.95%)不与一般的酸反应.
红宝石(Cr3+) 蓝宝石(Fe3+,Cr3+) 黄玉/黄晶(Fe3+)
氢氧化铝:氧化铝的水合物 无定型:通过沉淀法制得,具有两性 解离平衡: Al3++3OH-Al(OH)3 H++[Al(OH)4] 与酸碱反应: Al(OH)3+3HNO3=Al(NO3)3+3H2O Al(OH)3+KOH=K[Al(OH)4]+2H2O 结晶型:难溶于酸,加热到373K也不脱水.
北京师范大学、华中师范大学、南京师范大学无机化学教研室《无机化学》笔记和课后习题详解(下册)p区金属

和 Ag(Ⅰ)的电子构型(18e)相类似,因此在 T1(Ⅰ)形成共价键为主的化合物中,与
Ag(Ⅰ)相似。如 TlCl 像 AgCl 一样,为白色絮状沉淀,且暴露于日光下易分解变色;TlCl、
TlBr、TlI 同 AgCl、AgBr、AgI 一样,溶解度均很小;也能生成难溶的
三、判断题
1.
难溶于 HAc(aq)。( )
【答案】×
2.
可溶于浓硫酸。( )
【答案】√
3.制备α-锡酸应在高温下进行。( ) 【答案】×
四、简答题
1.铊(Ⅰ)的化合物和银(Ⅰ)的某些相应化合物有何相似之处?说明原因。
答:元素在化合物中所表现的性质与它的电荷-半径比及电子层结构密切相关。特别是
在共价化合物中,其电子层结构与极化能力和变形性相联系。Tl(Ⅰ)的电子构型(18+2e)
【答案】Sn(Ⅱ);差
5 / 31
圣才电子书 十万种考研考证电子书、题库视频学习平台
4.填写下列反应的主要产物,并指出产物的颜色
(1)
______
______ ______。
(2)
______
______ ______。
(3)
______
______。
【答案】(1)
【答案】D
8.在 和 化合物中,Tl 的氧化数分别为( )。 A.+3、+3 B.+1、+1 C.+3、+1 D.+1、+3 【答案】C
9.下列物质不溶于 NaOH 溶液的是( )。
【答案】D
2 / 31
圣才电子书 十万种考研考证电子书、题库视频学习平台
10.下列反应方程式正确的是( )。
B.除 是共价化合物外,其余都是离子化合物
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3、它们是P型半导体的掺杂剂,也可以制成III A—VA族元素的半导体化合物,如砷化镓 GaAs。 4、镓和铟易与许多金属形成合金,常用于制 易熔合金,含铟25%的镓合金在289K时熔化, 用于自动喷水灭火装置中。 5、含铟量较高的焊接剂,具有特殊性,用它可 把金属焊接到金属薄膜上,还可把金属焊接 到非金属部件上。 6、In-Pb、In-Sn合金抗碱腐蚀,用于化工 器械的焊接。
这种二聚分子遇到电子对给予分子时会离 解成单分子,然后这个AlCl3单分子再同这个 电子对给予体形成配位化合物. 例如: AlCl3· NH3。当Al2Cl6溶于水,它立即解离为 Al(H2O)63-和Cl-,并强烈水解。 AlBr3和AlI3的结构和性质与AlCl3相似。
制备:
1) Al(熔融) Cl 2 AlCl3 (无水)
铍与铝的相似性
① 两者都是活泼金属,在空气中易形成 致密的氧化膜保护层 ② 两性元素,氢氧化物也属两性 ③ 氧化物的熔点和硬度都很高 ④ 卤化物均有共价型 ⑤ 盐都易水解 ⑥ 碳化物与水反应生成甲烷 Be2C + 4 H2O Al4C3 + 12 H2O 2 Be(OH)2 + CH4 ↑ 4 Al(OH)3 + 3 CH4 ↑
1、铝的卤化物 在三卤化铝中,除AlF3为离子型化合物外,其 余均为共价型化合物。 在气相或非极化溶剂,AlCl3,AlBr3,AlI3均是二 聚体。 。 在二聚分子中卤素原子对铝呈四面体配置,是 一种桥式结构。即在每个AlX3分子中,铝原子 有空轨道,X原子有孤电子对,因而在两个AlX3 分子间发生x→Al提供电子对而配位,形成卤桥 的配位化合物
四、锗、锡、铅的化学性质
1、它们属于中等活泼的金属,活泼性锗﹤锡﹤铅。 表21-5 列出了锗、锡、铅的主要化学性质。
2、与氧反应:在通常条件下,空气中铅能被氧化, 在铅表面生成一层氧化铅或碱式碳酸铅,且形成 保护膜。空气中的氧对锗和锡都无影响。三种金 属在高温下能与氧反应生成氧化物。
3、与酸反应: ①与HCl反应:
2.铝的性质 Al为银白色,质软、轻而富有延展性的金属。铝的密度小, 延展性、导电性、导热性好,有一定的强度,又能大规模 地生产,所以铝及其合金被广泛地用于电讯器材、建筑设 备、电器设备的制造以及机械、化工和食品工业中。
(1)铝的亲氧性 铝与氧反应的自发性程度很大,铝一接触空气,表面 立即氧化,生成一层致密的氧化膜而耐腐蚀。铝能夺取化 合物中的氧且放出大量的热,致使反应时不必向体系供热。 如Fe2O3粉与铝粉的反应,用引燃剂点燃后,反应即猛烈 进行,放出的热可使铁熔化。故铝是冶金上常用的还原剂, 在冶金学上称为铝热法。 (2)铝的两性 铝既能溶于稀盐酸和稀硫酸中,也易溶于强碱中:
锗:不反应。 锡 :与稀酸反应慢,与浓酸反应
Sn 2HCl(浓) SnCl2 H 2
铅:反应生成微溶物覆盖在Pb表面,反应中止。
3、价键特征:
这些元素与其它元素化合时以离子键
为主,但由于形成M+3离子所需的电离能
很大,因此它们的+3氧化态化合物有很强 的共价性。例如在卤化物中,除氟化物为
离子型的以外,其它都是共价型的,熔、
沸点低;易水解。
4、缺电子特征:
缺电子化合物有很强的继续接受电子的能力, 这种能力表现在分子本身聚合以及同电子对给 予体形成稳定的配合物等。
二、铝及其化合物
(一)、单质铝的冶炼及性质 1.铝的冶炼
Al 2 O3 ( s ) NaOH H 2O Na[ Al(OH ) 4 ] Al(OH ) 3 Al2O3 H 2O Al2O 3 电解 Al O2
Na[ Al(OH ) 4 ] CO2 Al(OH ) 3 Na2CO3 H 2O
3、p区金属元素的价电子构型为ns2np1-4 ,内 层为饱和结构。由于ns、np电子可同时成键, 也可仅由np电子参与成键,因此它们在化合 物中常有两种氧化态,且其氧化值相差为2。 4、p区金属元素的高价氧化态化合物多数为 共价化合物,低氧化态的化合物中部分离 子性较强。另外,大部分p区金属元素在化 合物中,电荷较高,半径较小,其盐类在 水中极易水解。
(二)、铝的氧化物及水合物——氧化铝 (Al2O3) 和氢氧化铝 [Al(OH)3]
a-Al2O3
低温、快速加热 强热到1273K
g -Al2O3
刚玉,硬度大, 不溶于水、酸、 碱
活性氧化铝,可溶于酸、碱,可 作为催化剂载体, 有些氧化铝晶 体透明,因含有杂质而虽现鲜明 颜色.
红宝石(Cr3+) 蓝宝石(Fe3+,Cr3+) 黄玉/黄晶(Fe3+)
(三)铝盐和铝酸盐
铝盐在水中强烈水解,铝盐溶液因水解均呈酸性:
[ Al(H2O)6 ] H 2O [ Al(H 2O)5 (OH)] H3 O
弱酸的铝盐在水中几乎完全水解,所以制备Al2S3, Al2(CO)3不能用湿法制得。 铝酸盐水解使水溶液呈弱碱性:
3
2
[ Al(OH)4 ] Al(OH)3 OH
Al(OH)3或 氧化铝的水合物
结晶的氢氧化铝与无定型水合氧化铝不同,它 难溶于酸,加热到373K也不脱水。 Al(OH)3两性,加酸生成铝盐,加碱生成铝酸 盐。其碱性略强于酸性。
Al(OH )3 3HNO3 Al( NO3 )3 3H 2O Al(OH )3 KOH K[ Al(OH ) 4 ] 2H 2O
在聚合和配位过 程中,中心原子的杂 化轨道将由sp2杂化 转化为sp3杂化,分 子的几何形状则由平 面的转化为立体的。
5、氧化物\氢氧化物的酸碱性: Ga(OH)3的酸性比 Al(OH)3, In(OH)3都强; Tl2O,TlOH——碱性,易溶于水,其它都是 难溶于水的两性物质; TlOH不稳定,易分解为Tl2O(黑色)。
三、周期表中的对角线关系
周期表相邻两族位于从左上到右下的对角线上 的元素有许多相似之处(原因在于离子极化力相似)。
阳离子电荷 Z 阳离子半径 r
锂与镁的相似性
① 单质与氧作用生成正常氧化物
② 氢氧化物均为中强碱,且水中溶解度不大 加热分解为正常氧化物
③ 氟化物、碳酸盐、磷酸盐均难溶于水 ④ 氯化物共价性较强,均能溶于有机溶剂中 ⑤ 碳酸盐受热分解,产物为相应氧化物 ⑥ Li+和Mg2+的水合能力较强
21-2、铝
一、概述
镓分族
1、存在状态: Al,Ga,In,Tl 均为银白色,质轻而富有延展 性的金属,它们相当活泼,以化合物形式存在于自然 界。铝在地壳中的含量仅次于氧和硅,居第三位,镓, 铟,铊没有单独的矿藏,都分散作为与其它矿共生的 组分存在。
2、价电子结构: ns2np1它们的一般氧化态为+3,同其 它主族元素一样,随着原子序数的递增, 生成低氧化态(+1)的倾向随之增强,因 此,镓,铟,铊在一定条件下能显示出+1 氧化态,特别是Tl的+1氧化态是常见的, 并且一价Tl化合物具有较强的离子键特征。
三、锗、锡、铅单质的物理性质及用途
a、锗为银白色的硬金属。晶态锗具有类似金刚石的结构。为重要的半
导体材料。 铅为重而软的金属,密度很大。新切开的铅表面有金属光泽,但很快变 成暗灰色(铅与空气中的水、氧和CO2作用生成了致密的碱式碳酸铅保护 层)。由于铅的稳定性及质软,用它制作铅片,铅管,铅蓄电池。 锡有三种同素异性体:
2)通Cl2于Al2O3和碳的混合物中:
Al2 O3 3C 3Cl 2 2 AlCl3 3CO
3)2Al+6HCl====2AlCl3+H2 湿法只能制得AlCl3· 6H2O,在干燥的HCl气氛中也 可制得。
(2)碱式氯化铝
以铝灰和盐酸(适量)为主要原料,在控制的条件下制 得一种碱式氯化铝。它是由介于AlCl3和Al(OH)3之间 一系列中间水解产物聚合而成的高分子化合物,且有 桥式结构,它有强的吸附能力,用作高效净水剂。
21-3 锗分族
一、通性 电子层构型为ns2np2,常见氧化态为:+4,+2 在锗、锡、铅中随着原子序数的增大,低氧化 态稳定性逐渐增强。这种递变规律在其它几个 主族中也同样存在,这是由于ns2电子对逐渐稳 定的结果。
二、
锗、锡、铅的存在和冶炼
锗为稀有元素,无独立的矿物,常以硫化物形式伴生在其 它金属的硫化物矿中。 锡在自然界中以氧化物如锡石SnO2的状态存在。 铅以各种形态的化合物存在,其中最重要的是方铅矿(PbS)。 锗的冶炼:焙烧 锡的冶炼:锡石 铅的冶炼:方铅矿 提纯 氢气还原 锗 焦碳还原 粗锡 电解精炼 焙烧 还原 粗铅 电解精炼
286K 434K 灰锡(a型) 白锡( 型) 脆锡(g型)
立方晶系
四方晶系
正交晶系
b、三种元素的常见氧化态为+IV和+II。 +4氧化态化合物的稳定性是:Ge>Sn>Pb +2氧化态化合物的稳定性是:Ge<Sn<<Pb Ge和Sn的化合物为共价化合物,从Ge到Pb,低价 化合物趋于稳定。Pb(II)有离子化合物。
三氯化铝的结构与性质: 三氯化铝溶于有机溶剂或处于熔融状态时都以共价的 二聚分子Al2Cl6形式存在。在这种分子中有氯桥键 (三中心四电子键),与B2H6的桥式结构形式上相似, 但本质不同。
因为AlCl3为缺电子分子,Al倾向于接受电子对形 成sp3杂化轨道。两个AlCl3分子间发生Cl→Al的电 子对授予而配位,形成Al2Cl6分子。
Al+HCl+H2O→[Al2(OH)nCl6-n]m
