第二十一章 p区金属概论
PPTp区金属概述

2Al(s)+6H+(aq)==2Al3+(aq)+3H2(s) 2Al(s)+2OH-(aq)+6H2O(l)==2Al(OH)-(aq)+3H2(g)
铝及其化合物
二、铝的氧化物及其水合物
(1)、三氧化二铝
Al2O3有多种变体,其中最为人们所熟悉的是- Al2O3和-Al2O3它们是白色晶形粉末。 自然界存在的刚玉为-Al2O3。它也可以由金属铝 在O2中燃烧或者灼烧Al(OH)3和某些铝盐[Al(NO3)3、 AlCl3]而得到。
铝及其化合物
(3)、硫酸铝和明矾 无水硫酸铝Al2(SO4)3为白色粉末。从水溶液 中得到的为Al2(SO4)3· 18H2O。将纯Al(OH)3溶 于热的浓H2SO4或者用H2SO4直接处理铝土矿 或粘土都可以制得Al2(SO4)3。 硫酸铝易与K+、Rb+、Cs+、NH4+和Ag+等的 硫酸盐结合形成矾,其通式为 MAl(SO4)2· 12H2O(M表示一价金属离子)。 硫酸铝钾KAl(SO4)2· 12H2O叫做铝钾矾,俗 称明矾,它是无色晶体。
589.1 1970 2875
762.2
708.4
715.4 1449.9 3081
KJ/ mol
1816.1 1979 2744.8 2963
1537. 4
3301. 9
1411. 3
2942
电负性
标准 电极 电势 M3++3e-M
1.61
-1.076
1.81
1.78
2.04
+0.72
2.01
1.96
2.33
-0.56 -0.338
无机化学-21 第21章 p区金属(1)-057
铁制餐具安全性好,但谨防与铝铲、铝勺搭配使用 ,否则会使人体含铝量增加,对人体带来危害。
超过80%的胃药都含有铝的成分, 如Al(OH)3、Al2Mg6(OH)16CO3·4H2O!
2. 铝的化学性质
3)单质的化学性质:
M2O3
O
2
S
Sb
M2S3
Bi
MX3
X2
(热浓) H2SO4 Sb2(SO4)3 Bi2(SO4)3
HNO3
Sb2O5 ·xH2O
Bi(NO3)3
21-4-2 锑和铋的化合物
1、氧化物和氢氧化物
锑
+III
Sb4O6 Sb(OH)3 两性偏碱性
Sb2O5 +V H[Sb(OH)6] 两性偏酸性,
A12(SO4)3易形成矾,通式MAl(SO4)2•12H2O ,
M = 碱金属(除锂)、NH4+和Ag+
白色粉末
如明矾 KAl(SO4)2•12H2O
A12(SO4)3和明矾 易溶于水,水解成Al(OH)3胶状沉淀, 吸附、絮凝——用作净水剂!
碱式氯化铝 [Al2(OH)nCl6-n]m, 1 < n <5,m < 10
锑酸,微溶于水。
铋
Bi2O3 Bi(OH)3 弱碱性
Sb4O6又称锑白,优良的白色颜料,其遮盖力略次于钛白,与锌 钡白(ZnS·BaSO4)相近。用于搪瓷、颜料、油漆、防火织物等。
2.三卤化物在溶液中强烈水解
按As、Sb、Bi顺序,水解程度减弱, 碱性增强。 SbCl3 + 2H2O = SbOCl (氯化氧锑) + H2O + 2HCl BiCl3 + 2H2O = BiOCl (氯化氧铋) + H2O + 2HCl
第二十一章 p区金属

32
50
82
51
83
4s24p2 5s25p2 6s26p2 5s25p3 6s26p3
+2, +4
+2, +2, +4 (+4)
+3, +5 143 832
+3, (+5) 152 703
共价半 118 126 144 148 122 141 154 径/pm
第一电 578 579 558 589 762 709 716 离能 电负性 1.5 1.6 1.7 1.8 1.8 1.8 1.9
解:这与金属镓的结构有关.因金属镓中除 正常的金属键外,还存在Ga2团,Ga-Ga之间 为共价键,因Ga2团的存在,导致镓的熔点很 低(在手中即可熔化).而成为蒸气时需破坏 Ga-Ga共价键,消耗更多的能量,因此沸点很 高.正由于金属镓原子间距离不同,固态的 密度(5.91)比液态的密度(6.09)反而小, 是凝固时体积膨胀的少数几种金属之一.
2。铝的性质
性质 密度小,质轻 良好的导电性 良好的延展性 铝是亲氧元素 铝与氧反应放出大量热 铝是两性金属,但遇冷,浓的 氧化性酸发生钝化 用途 与其它金属形成的各种轻质坚硬合金 广泛用于航空航天业 用于代替部分铜制造电线,高压电缆, 发电机等电器设备 铝箔大量用于电容器制造和商品包装. 因表面致密氧化膜的保护,广泛用作 炊具,日用器具;在炼钢中作为除氧 剂 在冶金工业中做还原剂制备其它金属 如Mn,Cr,V等 常用铝罐装运浓硫酸,浓硝酸等
因反应吸热(△rHθ>0)并熵减 (△rSθ<0),则无论在何种温度下,该 反应都是非自发向右进行的,即使高温 下用金属钠(或钾)做还原剂也不能从 Al2O3中臵换出单质Al的.
第二十一章 P区金属

鉴定Pb2+和CrO42-
第二十一章
P区金属
§21.3 锗分族
3 锡的化合物 (1)Sn(OH)2 —— 两性 Sn(OH)2 + 2OH - = [Sn(OH)4]2亚锡酸根
(2)亚锡酸钠 NaSnO2 Na2[Sn(OH)4]
水解
[Sn(OH)4
]2-
Sn(OH)2(s)+2OH-
第二十一章
P区金属
§21.3 锗分族
2-
Sn2++2HgCl2+4Cl- = [SnCl6] +Hg2Cl2(s) Sn2++Hg
2Cl2+4Cl
=
2SnCl6+2Hg
用于鉴定Sn2+、Hg2+ 2Sn2+ +O2+ 4H+ = 2H2O+2Sn4+ Sn4++Sn = 2Sn2+ 性质二:水解性 SnCl2+H2O Sn(OH)Cl(s)+HCl
第二十一章
P区金属
§21.1 P区金属概述
21.1 p区金属概述 Al、Ga、Ge、Sn、Pb的单质、氧化物及其 水合物均表现出两性。
21.2 铝 镓分族
Al(OH)3不溶于氨水中,它与NH3不生成配合物。
第二十一章
P区金属
§21.3 锗分族
21.2 锗分族
1. 氧化物和氢氧化物 弱酸
氧 化 性 增 强 酸性增强 Ge(OH)4(棕色) Ge(OH)2(白色) 酸 性 增 强 碱 Sn(OH)4(白色) Sn(OH)2(白色) 性 增 Pb(OH)4(棕色) Pb(OH)2(白色) 碱性增强 强 还 原 性 增 强
第二十一章 p区金属
§21.1 p区金属概述 §21.2 铝、镓分族 §21.3 锗分族(Sn,Pb) §21.4 锑和铋
第二十一章p区金属

镓、铟多用于电子工业, 如作半导体材料
二、氧化铝和氢氧化铝
一)、三氧化二铝
α-Al2O3──不溶于水,也不溶于酸和碱,熔点高,硬度 大,由铝和氧气燃烧或高温灼烧Al(OH)3得到。自然界存 在的刚玉是指这种氧化铝。 γ-Al2O3──不溶于水,溶于酸,具有很强的吸附能力 和催化活性,所以又称活性氧化铝,用于作吸附剂和催 化剂。由氢氧化铝或铝铵矾加热分解得到。把它强热至 1273K时,转变为α-Al2O3。
氧化物、铝盐、铝酸盐的性质。 3.Ge、Sn、Pb 的冶炼、单质的性质、氧
化物、氢氧化物、卤化物的性质。 4.锑和铋的氧化物、氢氧化物、卤化物、
硫化物的性质。
21-1 p区金属概论
p区金属共有十种: Al、Ga、In、Tl、Ge、Sn、Pb、Sb、 Bi和Po;其中Po为放射性元素。
p区金属的特性:
原子序数 13 31 49 81 32
50
价电子构 型
主要氧化 态
共价半径 /pm
3s23p1 +III
118
4s24p1 5s25p1 6s26p1 4s24p2 +I, III (+I),III +I,(III) +IV, +II
126 144 148 122
5s25p2
+IV, +II
141
I1/kJ·mol-1 577.6 578.8 558.3 589.3 762
加入冰晶石做助熔剂。
从铝矾土矿(Al2O3) 冶炼金属铝的步骤:
碱溶铝矾土矿
石墨阳极 铁槽阴极
过滤
熔融金属铝
通CO2于滤 液析出Al(OH)3
电解金属铝示意图 Al2O3+2NaOH+3H2O=2NaAl(OH)4
Chapter21 P区金属

②第四周期元素表现出异样性(d区插入) 第四周期元素表现出异样性( 区插入) 周期元素表现出异样性 例如:溴酸、高溴酸氧化性分别比其他卤酸 例如:溴酸、高溴酸氧化性分别比其他卤酸(HClO3 , HIO3)、高卤酸 、高卤酸(HClO4,H5IO6)强。 强 ϕθClO3-/Cl2 =1.47 v ϕθ BrO3-/Br2= 1.48v ϕθ IO3-/I2= 1.195v ϕθ ClO4-/ClO3- = 1.19v ϕθ BrO4-/BrO3-= 1.763v ϕθ H5IO6/IO3- = 1.70v
三.铝盐和铝酸盐 1.铝盐和铝酸盐的形成及水解性 [Al,Al2O3或Al(OH)3]+HCl AlCl3 (铝盐) 铝盐) , [Al,Al2O3或Al(OH)3]+NaOH NaAl(OH)4 (铝酸盐) 铝酸盐) , ①铝盐溶液由于水解均呈酸性: 铝盐溶液由于水解均呈酸性: Al(H2O)63+ + H2O Al(H2O)5(OH)2+ + H3+O { [Al(H2O)5(OH)]2+还将逐级水解 } 向铝盐中加入碳酸钠不能得到碳酸铝,水解反应如下: ②向铝盐中加入碳酸钠不能得到碳酸铝,水解反应如下: 2Al3+ + 3CO32-+ xH2O Al2O3·xH2O↓ +3CO2↑ 铝酸盐水解使水溶液呈弱碱性: ③铝酸盐水解使水溶液呈弱碱性: Al(OH)4Al(OH)3 + OH冰晶石Na 的制取: ④冰晶石 3AlF6的制取: 2Al(OH)3+12HF +3Na2CO3 2Na3AlF6 + 3CO2↑+ 9H2O 电解法制铝所需要的助熔剂) (2Na3AlF6电解法制铝所需要的助熔剂)
第21章p区金属-2004

1.7
1.8
第4主族元素的基本性质
性 质 原子序数
价电子层结构 主要氧化态 第一电离能 (kJ/mol) 电负性
Ge 32
4s24p2
Sn 50
5s25p2
Pb 82
6s26p2
+IV,+II +IV,+II +II, (+IV) 760 709 716
1.8
1.8
1.9
第5主族元素的基本性质
性 质 原子序数
-
[Al(H2O)5(OH)]2++H3+O Al2O3· 2O↓+3CO32xH [Al(OH)3+OH-
(2)几种重要的盐 • 卤化物——AlCl3 结构(Al2Cl6):
Cl 118o Al Cl Al 3s 3p Cl 3s 3p Cl Al Cl
Cl
Cl
Sp3杂化 sp3 Sp3杂化 sp3
锗的性质 • 性质不活泼 与浓硫酸和浓硝酸反应生成Ge(IV)化合物 Ge+4H2SO4(浓)=Ge(SO4)2+2SO2↑+4H2O Ge+4HNO3(浓)=GeO2· 2O↓+4NO2↑+H2O H 与硅相似, 与强碱反应 Ge+2OH-+H2O=GeO32-+2H2↑
锡的性质
• 比锗活泼 能与稀酸缓慢作用, 生成Sn(II)的化合物 Sn+2HCl=SnCl2+H2↑ 4Sn+10HNO3=4Sn(NO3)2+NH4NO3+3H2O 与热的HCl, H2SO4, HNO3反应, Sn+2HCl(浓)=SnCl2+H2↑
第21章p区金属

2
Ge 由于可作半导体材料,制备工艺较复杂。 GeS
O2
GeO2
HCl
GeCl4
2O H
GeO2 · xH2O
H2
Ge
区域熔融 Ge(超纯)
过程中经历 Al(OH)Cl2 、Al(OH) 2Cl、Al(OH)3 , 其分解历程与 PCl3 水解历程相似。 b、硫酸铝和明矾 制备:见书 675 页的反应,分别得到纯净和含杂质的有 18 个结晶水的硫酸 盐。 硫酸铝是最常见的铝盐,它的最重要的性质就是形成明矾。矾的通式之一:
2
M 2SO4· M 2(SO4)3·24H2O(或: M M (SO4) 2·12H2O) ,当 M 是 Al3+、 M
三、硫化物
四、铅的一些含氧酸盐
(自学)
6
Ⅰ Ⅲ Ⅰ Ⅲ Ⅲ
Ⅰ
是 K+时,称为铝钾矾,俗称明矾。 21-2-2、周期表中的对角线关系(自学) 21-3 锗分族 由于锗、锡、铅的离子是 18 或 18+2 电子构性的离子,锗、锡、铅的化合物 中,极化作用显著,难溶、有颜色。铅受惰性电子对效应影响显著。 21-3-1、锗、锡、铅的冶炼、性质和用途 锗、锡、铅在自然界的存在形式主要为氧化物和硫化物。 制备:Sn、Pb 由氧化物还原得到:
θ
利用该反应的高反应热, Al 可以在高温下从其它金属氧化物中夺取氧并置换出 金属单质,因高热使金属熔化而达到分离。如: Fe2O3 + 2Al = Al2 O3 + 2Fe 这种制备金属单质的方法称为铝热还原法。 Al 显两性。由此导致其单质、氧化物、氢氧化物都可溶于酸、碱。 Ga 作为非本征半导体具有一定的应用。 二、氧化铝和氢氧化铝 1、氧化铝 Al2 O3 为白色固体,约有八种变体:α (六方) 、 γ (立方) 、ρ (无定形) 、 χ (立方) 、η (立方尖晶石) 、 δ (正交) 、κ (正交) 、θ (单斜) 。最常见的 是α - Al2O3、 γ - Al2O3。 制备: 工业:水铝矿( Al(OH)3 ) 、铝土矿( AlO(OH) ) 、水铝石( AlO(OH) )等在 一定条件下受热脱水即得α - Al2O3 或γ - Al2O 3。 实验室: 铝盐转变成氢氧化铝, 后者受热分解得γ - Al2O3 。 γ - Al2O3 在 1120K 时受热转变成α - Al2O 3。 结构:α - Al2O3 是致密的,属六方紧密堆积构型,对化学反应呈高度惰性,
二十一章p区金属

•溶解性:
少数可溶:Pb(NO3)2, Pb(Ac)2(弱电解质, 有甜味,俗称铅糖),铅的可溶性化合物都 有毒。
多数难溶:PbCl2,PbI2,PbSO4,PbCO3,
PbCrO4等。
PbCl2溶于热水,也溶于盐酸:
PbCl2 2HCl H2[PbCl4] PbSO4溶于浓硫酸,生成Pb(HSO 4 )2。
它们的化学性质可以括如下:
1.与氧的反应:在通常条件下, 空气中的氧只对铅有作用,空气中 的氧对锗和锡都无影响。这三种元 素在高温下能与氧反应而生成氧化 物。
2.与其它非金属的反应:这些金 属能同卤素和硫生成卤比物和硫化 物。
3.与水的反应
锗不与水反应,锡既不被空气氧化, 又不与水反应,常被用来镀在某些金 属(主要是低碳钢制件)表面以防锈蚀。 铅的情况比较复杂,它在有空气存在 的条件下,能与水缓慢反应而生成 Pb(OH)2。
I-
HNO3
Pb(HSO4)2 PbI42- Pb2++Cr2O72-
21-4 锑和铋
21-4-1 单质
砷、锑、铋在地壳中的含量不大,它 们有时以游离态存在于自然界中,但 主要以硫化物矿存在。 砷锑铋都有金 属的外形,是电和热的良导体,具有 脆性,熔点低,并且容易挥发,熔点 从As到Bi依次降低
21-4-2 砷、锑、铋的 化合物
常温为 对应水合物
As4O6
As(OH)3 H3AsO3 两性偏酸
Sb4O6
Sb(OH)3 两性偏碱
Bi(OH)3 碱性
(微两性)
两性
M2O3 6H 2M3 3H2O M2O3 6OH- 2MO33- 3H2O
M = As、Sb
p区金属
2、化学性质 、
• (浓HCl) (-) SnCl2 H2 [PbCl4] • (稀H2SO4) (-) (-) PbSO4↓+H2↑ • (浓H2SO4) Ge(SO4)2 SnSO4 Sn(SO4)2 Pb (H SO4)2 • (稀HNO3) (-) Sn(NO3)2 Pb(NO3)2 • (浓HNO3)xGeO2•yH2O↓xSnO2•yH2O↓Pb(NO3)2
对角线规则
• 一、 单质 • 1、锡的同素异形体 • α-Sn→(>286K)β-Sn→(>434K)γ-Sn • 灰锡(立方) 白锡(四方) 脆锡(正交) • 原子晶体,键能小,易粉碎 金属晶体(常见) • 锡制品若长期处在低温(<286K)会自行毁坏,由 于一旦开始毁坏,迅速蔓延,称为“锡疫”。
∆ Al2O3 + 3C + 3Cl2 → 2AlCl3 + 3CO
2Al + 6HCl (g) ∆ 2AlCl3 + 3H2 (g) →
潮湿空气中的 AlCl3
路易斯酸性: ● 路易斯酸性:以氧为给予原子时 BCl3 >AlCl3 >GaCl3 以硫为给予原子时GaX3 >AlX3 >BX3 为给予原子时 (X=Cl, Br)
• 锡:银白色金属,质软,延性不佳但展性好(锡箔),作包 装材料(在空气中不易被氧化,能长期保存其光泽;价格便 宜,又无毒) • 铅:很软的重金属,易形成一层碱式碳酸铅,保护其内层金 属不被氧化,主要用作X射线、原子能工业用的防护材料 (能挡住X射线);用于制合金特别是低溶点合金。 • 焊锡:67%Sn 33%Pb—450K/bp 铅字合金:82%Pb 15%Sb 3%Sn 青铜:78%Cu 22%Sn用于制日用器材、工具。
第21章 P区金属

21-2 铝 镓分族 Al, Ga, In, Tl
二、铝的氧化物及其水合物 氧化铝: α- Al2O3 :刚玉,硬度大,不溶于水、酸、碱。 γ- Al2O3 :活性氧化铝,可溶于酸、碱,可作为催 化剂载体。
红宝石(Cr3+)
蓝宝石(Fe3+,Fe2+,Ti4+) 黄玉/黄晶(Fe3+)
2. 氢氧化铝
(Al(OH)3)
Al3+ + 3H2O [Al(OH)4]+H2O
还原:GeO2 + 2H2 === Ge + 2H2O
Sn:以锡石(SnO2)形式存在。 锡。
以焦炭还原SnO2 得粗锡,再电解精炼得纯
SnO2 + C === Sn + 2CO↑ Pb: 以方铅矿(PbS) 形式存在。焙烧使之变成氧 化物,再用还原剂还原得粗铅,最后电解精 炼得纯铅。 2PbS + 3O2 === 2PbO + 2SO2 PbO + C === Pb + CO↑ PbO + CO === Pb + CO2
二卤化物
Sn 白色晶体 - - 白色固体 熔点 519K 淡黄色固 体、熔点 Pb 无色晶体 1128K 熔化 白色晶体 熔点 774K 白色晶体 熔点
F
236K升华 无色液体 沸点 357K 灰白色晶体 熔点
Cl
Br
第21章 P区金属

PbCO3 ↓(白)
PbO2(棕黑) 强氧化剂
能氧化HCl,H2SO4,Mn2+ Pb3O4 红色
铅丹(2PbO· PbO2)
Pb3O4 + HNO3 == Pb(NO3)2 + PbO2 + H2O
K2CrO4
沉淀分离出来: PbO2+HCl(浓) PbO2 + Mn2+ + H+
PbCrO4↓
△ △
PbCl2 + Cl2↑ MnO42- + Pb2+ + H2O
(砷、)锑、铋
存在及成键特征
自然界以硫化物形式存在
(雄黄 As4S4) (雌黄 As2S3) 辉锑矿 Sb2S3 +5氧化态化合物是强氧化剂。 ( 砷、)锑、铋能与碱金属和碱土金属组成氧化态为- 3 的化合物(有的类似合金)。 ( 砷、)锑、铋可以生成一系列簇状离子,如Bi53+、Bi42
• 2Al3++3CO32-+XH2O
• 2Al(OH)3 +12HF +3Na2CO3
Al2O3xH2O + 3CO2
2Na3AlF6 +3CO2 +9H2O
几种重要的铝盐
• 卤化物 • 只有AlF3有明显的离子性,其它均有不同程 度的共价性。 • AlCl3、 AlBr3、 AlI3的蒸汽状态均为双聚分 子; • 有缺电子性、桥键、存在3中心4电子(3C4e)键。
H+
SnS2
Na2S
Na2SnS3
SnS2 +H2S↑
HCl
[SnCl6]2-+H2S↑
SnS32-
S22-
21章 P区金属

2Al3++3CO32-+3H2O ==2Al(OH)3↓ + 3CO2↑ 2Al3+ + 3S2- + 6H2O ==2Al(OH)3↓ + 3H2S↑ CO32- + 2H+ == H2O +CO2↑ - S2- + 2H+ == H2 S
2, 铝酸盐 铝酸盐中含Al(OH)4 等配离子 拉曼光谱已证实行 等配离子,拉曼光谱已证实行 铝酸盐中含 A1(OH)4 离子存在 离子存在. 铝酸盐水解使溶液显碱性水解反应式如下: 铝酸盐水解使溶液显碱性水解反应式如下 A1(OH)4 == A1(OH)3 + OH
2. 氢氧化铝 (Al(OH)3)
Al 2O3难溶于水,它的氢氧化物只能通过其它方法 难溶于水, 制得, 制得,加氨水或碱于铝盐溶液中得种白色无定形凝 胶沉淀,它的含水量不定组成也不均匀统称为水合氧 胶沉淀 它的含水量不定组成也不均匀统称为水合氧 化铝。 化铝。A12O3 的水合物般都通称为氢氧化铝 。
金属铝或氧化铝或氢氧化铝与碱反应而得到铝酸盐 Al Al 2O3 Al(OH) 3 + NaOH Na[Al(OH)4]
1, 铝盐 铝盐都含有A1 离子,在水溶液中 在水溶液中A1 铝盐都含有 3+离子 在水溶液中 3+离子实际上以 八面体的水和配离子[A1(H 2O) 6]3+而存在 它在水中解 而存在,它在水中解 八面体的水和配离子 离而使溶液显酸性 这也就是铝盐的水解作用. 溶液显酸性,这也就是铝盐的水解作用 离而使溶液显酸性 这也就是铝盐的水解作用 [Al(H2O) 6]3+ + H 2O [Al(H 2O)5OH]2+ + H3+O
北京师范大学、华中师范大学、南京师范大学无机化学教研室《无机化学》(第4版)(下册)-第21章 p区

第21章 p区金属21.1 复习笔记一、概述1.p区金属p区金属包括Al、Ga、In、Tl、Ge、Sn、Pb、Sb、Bi、Po,分属于周期表中的第ⅢA族、ⅣA族和VA族。
2.p区金属元素性质(1)p区同族金属元素从上到下原子半径逐渐增大,失电子趋势逐渐增大,元素的金属性逐渐增强;(2)它们在化合物中常有两种氧化态,且其氧化值相差为2;(3)它们的高氧化态化合物多数为共价化合物;低氧化态的化合物中部分离子性较强;(4)大部分p区金属元素在化合物中,电荷较高,半径较小,其盐类在水中极易水解。
二、铝镓分族1.铝及镓分族元素铝及镓分族元素Ga、In、Tl为第ⅢA族的金属元素。
2.铝镓分族价电子构型及特征(1)价电子构型为;(2)价电子数少于价轨道数,为缺电子原子。
3.铝镓分族氧化态特点(1)除Tl 外,铝及镓分族元素在化合物中的主要氧化态为+Ⅲ;(2)铊的+I氧化态比+Ⅲ氧化态的化合物稳定;(3)它们的+Ⅲ氧化态化合物有很强的共价性。
4.铝及其化合物(1)铝的冶炼①的纯制a.用碱溶液处理铝土矿:b.通入,促使铝酸盐水解,得沉淀:c .将过滤分离,干燥后煅烧,得到较纯的符合电解要求的氧化铝:②的熔融电解将溶解于熔融的冰晶石中进行电解,在阴极得到铝:(2)铝的物理性质①银白色的金属,质轻;②耐腐蚀性较好;③延展性和导电性能很好,能与多种金属形成高强度的合金。
(3)铝的化学性质①铝的亲氧性及用途a .原理第一,铝一接触空气,表面立即氧化,生成一层致密的氧化膜,阻止铝进一步被氧化,此膜不溶于水和酸,铝在空气中相当稳定;第二,铝能夺取化合物中的氧:b .用途第一,是冶金上常用的还原剂;第二,用来作为炼钢的脱氧剂;第三,用于制取高温金属陶瓷。
②铝的两性及用途a .铝既能溶于稀盐酸和稀硫酸,也易溶于强碱;铝还能溶于热的浓硫酸中;高纯度的铝(99.95%)只溶于王水。
b .铝在冷的浓硫酸及稀、浓硝酸中被钝化,常用铝桶装运浓、浓等化学试剂。
第21章P区金属

第21章P区金属第21章P区金属21-1 P区金属概述1.P区金属在价层电子结构上与S区金属有何不同?P区金属的价层电子结构使P区金属在金属性和形成化合物时的化学键上与S区金属有何不同?2.P区金属在在氧化态表现和变化规律上有何特征?21-2 铝镓分族1.铝族元素价层电子结构有何特征?铝族元素在形成化合物时在价键结构上与硼有何不同?2.单质铝如何制取?铝单质有何主要性质?铝是较活泼的金属,为什么日常生活中可使用许多的铝制品?3.铝的氧化物、氢氧化物有何特性?4.何谓铝盐和铝酸盐?它们有哪些主要性质?5. Al2Cl6与B2H6的结构有何相似与不同?为什么?为什么AlF3不二聚?6.何谓对角线规则?铝和铍有哪些相似性?21-3 锗分族1.锗分族元素在氧化态表现上有何特征?在形成化合物时与C、Si有何不同?锗分族+Ⅱ和+Ⅳ氧化态化合物的氧化还原性变化有何规律?2.单质锡有几种变体?为什么锡制品在低温下会自行毁灭?Ge、Sn、Pb 的单质有哪些主要性质?3.为什么不活泼的Pb可与非氧化性的弱酸HAc作用?这一性质有何用途?4. SnO2有何用途?铅有几种常见氧化物?请设计一实验证明铅丹的组成为Pb3O4(即含1个Pb(Ⅳ),2个Pb(Ⅱ))?锗分族氢氧化物的酸碱性变化有何规律?5.如何配制SnCl2溶液?如何鉴定Sn2+ ?6.了解锗分族的硫化物并与砷分族对比。
了解铅的重要含氧酸盐。
21-4 锑和铋1.锑和铋在自然界主要以何种物质存在?与氮、磷比为什么不同?2.砷分族+Ⅲ氧化态卤化物的水解性有何变化规律?写出其相应的水解反应方程式。
3.砷分族元素的氧化物及其水合物的酸碱性有何变化规律?其+Ⅲ和+Ⅴ氧化态的氧化还原性有何变化规律?4.砷分族的硫化物有何特性?其硫化物的酸碱性和氧化还原性有何变化规律?21-5 P区金属6S2电子的稳定性1.P区金属6S2电子为什么特别稳定性?4S2电子有特别的稳定性吗?其它区呢?2.P区金属6S2电子的特别稳定性对P区金属的性质带来哪些主要影响?作业P695:21-3,21-6,21-8,21-9 21-2,21-7,21-12,21-13,21-14。
第21章 P区铝族元素
镓与砷、锑、磷等生成的砷化镓、锑化镓、磷化镓等都是优良 的半导体材料。磷化镓还是一种半导体发光材料,能够发射出红光 或绿光。 低温时镓有良好的超导性,在接近绝对零度即0K时,电阻几乎 为零。钒三镓(一个镓原子和三个钒原子形成的合金)是超导材料。
应当注意的是,镓及其化合物都有毒。其毒性远远超过汞和砷!镓 可以伤肾,破坏骨髓,沉积在软组织中,造成神经、肌肉中毒。它 可以与引起肿瘤、抑制正常生长有关。
3、与酸或碱均反应 →H2↑ 2Al + 6H+ = 2Al3+ + 3H2↑ 2Al + 2OH- + 6H2O = 2Al(OH)4 - + 3H2 ∴Al是“两性元素” (Zn也是) 但Al在冷、浓HNO3、H2SO4中“钝化”。 铝合金:比重小而坚韧→飞机、建筑材料。 4、铝化合物的缺电子性 AlF3气态为单分子; AlCl3 、AlBr3 、AlI3气态时有二聚体分子; Al2H6中有3c-2e键
1、Al的亲氧性
已知B、Si为亲氧元素,铝也是亲氧元素。
fHm (B2O3) = -1264 kJ· mol-1 fHm (SiO2) = -859.4 kJ· mol-1 fHm (Al2O3) = -1669.7 kJ· mol-1 2、 Al3+的水解性 Al(H2O)63++ H2O→[Al(H2O)5(OH)]2+ + H3O+ 加热、 OH- 促进水解,可直到完全。 Al2S3、 Al2 (CO3)3 、Al4C3 、AlN都可完全水解
另外, Al 原子有空的 3d 轨道,与电子对给予体能形成 配位数为6或4的稳定配合物。例如Na3[AlF6]、Na[AlCl4]等。
1 铝的冶炼
第二十一章 p 区金属
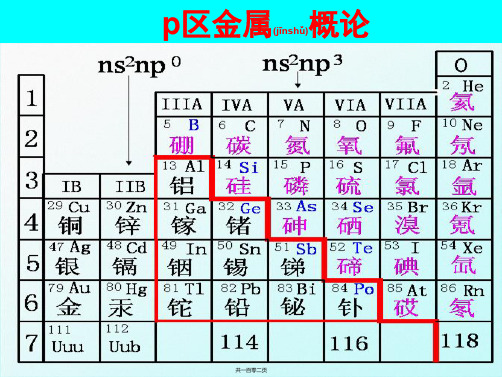
p区金属元素的价电子构型为 ns2np1~4 ,内层为饱和(bǎohé)结构。
由于ns、np电子可同时成键,也可仅由
电子参与成键,因此它们在化合物中常有两 种氧化态,且其氧化值相差为2。
p区金属元素的高价氧化态化合物多数 为共价化合物,低氧化态的化合物中部分 离子性较强。另外,大部分p区金属元素在 化合物中,电荷较高,半径较小,其盐类 在水中极易水解。
In(OH)3都强;
TlOH不稳定,易分解为Tl2O(黑
色)。
共一百零二页
当Al2Cl6溶于水中时,它立即解离为 Al(H2O)63+和Cl-离子(lízǐ)并强烈地水解。AlCl3还容 易与电子对给予体形成配离子(如AlCl4-)和加合物 (如AlCl3·NH3)。这一性质使它成为有机合成中常 用的催化剂。
In In 0.34 3 T.l03T 3 61 l.2T 53 l
到Tl3+离子时成为正值,说明(shuōmíng)Tl3+ 离子不稳定,它是个强氧化剂,而Tl3+在
溶液及化合物中都很稳定。 共一百零二页
3、价键特征 : (tèzhēng)
这些元素与其它元素化合时以离子键 为主,但处于高价态的离子,因其离子势 很大,易形成共价化合物,例如在卤化物 中,除氟化物为离子型的以外(yǐwài),其它都 是共价型的,熔、沸点低,易水解。
征。
共一百零二页
这从它们的氧化过程也可以看到:氧化时, 当失去(shīqù)所有价电子成为M3+离子,要成为这 样的离子,其电离能很大(I1,I2,I3),但这 时离子的水合热也很大,半径小的离子,水合 热更大。因此,它们在水溶液中容易离子化, 而且标准电极电势从Al到Tl逐渐增大。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
a-Al2O3
刚玉,硬度
低温、快速下加热
γ -Al2O3
活性氧化铝,可溶于 酸、碱,可作为催化 剂载体.
大,不溶于
水、酸、碱
22
Al2O3 有离子传导能力允许Na+通过以铝矾
土为电解质制成钠-硫蓄电池.由于这种蓄电池
单位重量的蓄电量大能进行大电流放电因而具
有广阔的应用前景这种蓄电池使用温度范围可
25
3)、铝盐和铝酸盐
金属铝 +酸 +碱 铝盐 铝酸盐
氧化铝
氢氧化铝
铝酸盐水解使溶液显碱性
[Al(OH)4]Al(OH)3+OH-
溶液中通入CO2,将促进水解的进行而得到真正的氢 氧化铝沉淀。
26
4)、硫酸铝和明矾
无水硫酸铝Al2(SO4)3为白色粉末。 从水溶液中得到的为Al2(SO4)3· 2O。 18H 纯Al(OH)3+热的浓H2SO4 或用H2SO4直接处理铝土矿或粘土 硫酸铝钾KAl(SO4)2· 2O叫做铝钾矾,俗称明矾, 12H 它是无色晶体。 Al2(SO4)3
准金属:既有金属性又有非金属性。
包括B、Si、As、Se、Te等。
两性金属都是金属,甚至是典型的金属,两性之意仅
指金属或其氧化物或氢氧化物既溶于酸又溶于碱。 包括Be、Zn、Cr、Al、Ga、Sn、Pb等
9
21-1 铝族 21-2 锗分族
10
21-1 铝族
Al、Ga、In、Tl均为银白色,质软、轻而富有延 展性的金属。它们相当活泼,一般用电解法制取。 铝族元素的固态化合物,只有少数为离子型的, 大部分属共价型的。 从铝到铊,其化合物的共价性逐渐减弱,离子性逐 渐增强。铝和镓化合物的共价性比较显著,而铟和铊化 合物的离子性则比较显著。
达620-680K 其蓄电量为铅蓄电池蓄电量的
3-5 倍
Al2O3 陶瓷做电解食盐水的隔膜生产烧碱有
产品纯度高公害小的特点
23
2)、氢氧化铝
Al2O3的水合物一般都称为氢氧化铝。
铝盐溶液 +氨水或碱
白色无定形凝胶沉淀。
它的含水量不定,组成也不均匀,统称为水合氧化铝。
铝酸盐溶液+CO2
氢氧化铝白色沉淀
铝一接触空气或氧气,其表面就立即被一层致密 的氧化膜所覆盖,这层膜可阻止内层的铝被氧化,它 也不溶于水,所以铝在空气和水中都很稳定。
Al2O3的生成热负值很大。其氧化物稳定,耐高温,
是冶金上常用的还原剂(铝热剂)、炼钢中的脱Al(H2O)6
3++
H2O
[Al(H2O)5(OH)]2+ + H3O+
氧化态 +3
+1,+3
[Ne]3s23p1
[Ar]4s24p1
In
Tl
[Kr]5s25p1
[Xe]6s26p1
+1,+3
+1,+3
Ge
Sn Pb
[Ar]4s24p2
[Kr]5s25p2 [Xe]6s26p2
+2,+4
+2,+4 +2,+4
3
Sb Bi Po
[Kr]5s25p3 [Xe]6s26p3 [Xe]6s26p4
从Ge到Pb,低价化合物趋于稳定。
Ge和Sn的化合物为共价化合物,Pb(II)为离子
化合物,Pb为亲硫元素。它们属于中等活泼的金
属,但由于种种原因却表现出一定的化学情性。
29
21-2-2 单质的化学性质 1、与空气反应:
常温下; 2Pb+O2=2PbO
2Pb+O2 + CO2+H2O =Pb(OH)2 · PbCO3 高温下: Ge+O2= GeO2 2、与其它非金属的反应 Pb+X2==PbX2 Sn+X2==SnX4(适量SnX2) Pb+S==PbS Ge+X2==GeX4 Sn+O2= SnO2
离子性也略强,但还不是典型的离子化合物。
所有这些氧化物都是不溶于水的固体。
36
MO2 GeO2
颜色与状态 白色固体
MO GeO
两性
颜色与状态 黑色固体
↑ SnO2 酸 两性偏酸性 性 增 强
弱酸性
白色固体
SnO
两性略偏碱性
黑色固体
两性略偏酸性 棕黑色固体
PbO2
PbO
两性偏碱性
黄或黄红色固体
32
(4)Pb与酸反应得Pb(II)化合物 Pb+2HCl (稀)===PbCl2↓+H2↑ Pb+H2SO4(稀) ===PbSO4 ↓+H2 (反应不易发生)
Pb+4HCl(浓)=== H2[PbCl4]+H2↑ (反应不易继续)
Pb+3H2SO4(浓)===Pb(HSO4)2+SO2↑+2H2O 3Pb+8HNO3(稀)===3Pb(NO3)2+2NO↑+4H2O 因Pb(NO3)2不溶于浓硝酸,所以Pb不与浓硝酸发生反应。
+3,+5 +3,+5 +2,+6
4
21章 铝族 锗分族
5
本章要求
1.了解锗分族单质及其重要化合物的性质。
2.掌握铝的性质及冶炼原理,掌握氧化铝、
氢氧化铝、铝盐的性质。
3.铝和铍的相似性。
6
简介
铝是地壳中含量最多的金属元素,仅次于硅和氧。
其它元素含量很少。
铝族的Al、Ga,锗分族的Ge 、 Sn 、Pb,砷分族 的As都有不同程度的两性。 Al的两性表现最为突出。
27
21-2 锗分族
21-2-1 单质和氧化态 锗为银白色的硬金属。 铅为暗灰色,重而软的金属。 锡有三种同素异性体,常见的为白锡,它有较好的 延展性。
> 434K
脆锡
< 434K
白锡
>286K
粉末状的灰锡
28
常见氧化态为+IV和+II
+4氧化态化合物的稳定性是: Ge>Sn>Pb
+2氧化态化合物的稳定性是: Ge<Sn<<Pb
称为正氢氧化铝。
与无定形水合氧化铝不同,它难溶于酸,而且加热
到373K也不脱水;在573K下,加热两小时,才能变
为AlO(OH)。
24
氢氧化铝是典型的两性化合物。
新鲜制备的氢氧化铝易溶于酸也易溶于碱
Al(OH)3+3HNO3==Al(NO3)3+3H2O Al(OH)3+KOH== K[Al(OH)4]
1) Ge → Sn → Pb 金属性?
2)Ge 、 Sn 、Pb 都有两性 3) Ge → Sn → Pb
+Ⅱ稳定性? + Ⅳ 稳定性?
35
21-2-3 锗 锡 铅的化合物
一、氧化物和氢氧化物
(一)、氧化物
锗锡铅有MO2 和MO 两类氧化物。
MO2 都是共价型两性偏酸性的化合物。
MO也是两性的,但碱性略强。MO 化合物的
-Al2O3
-Al2O3的晶体属于六方紧密堆积构型,晶体中 Al3+离子与O2-离子之间的吸引力强,晶格能大,所以 -Al2O3的熔点(228815K)和硬度(8.8)都很高。
20
刚玉-Al2O3晶体透明,因含有杂质而呈现鲜明颜色。
它不溶于水,也不溶于酸或碱,耐腐蚀且电绝缘性。
21
无定型Al2O3则具有两性。
Ge+S==GeS2
Sn+S==SnS2(适量SnS)
30
3、与水反应: 铅在有空气时与水反应: 2Pb+O2 + 2H2O =2Pb(OH)2 4、与酸反应(HCl、H2SO4 、HNO3) (1)Ge不与非氧化性酸作用; (2)Sn与非氧化性酸反应生成Sn(II)化合物; Sn+2HCl(浓)==SnCl2+H2↑
加热、 OH- 促进水解,可直到完全。
Al2S3、 Al2 (CO3)3 、Al4C3 都可完全水解
3、Al的两性
Al、 Al2O3、Al(OH)3都有两性。
但高纯铝只溶解于王水;
不纯的Al易溶于稀盐酸、稀硫酸和浓热硫酸;而在
冷浓硫酸和硝酸中钝化;
14
铝溶于所有的强碱生成[Al(OH)4]4、铝化合物的缺电子性 AlF3气态为单分子;AlCl3 、AlBr3 、AlI3气态时有
二聚体分子;为什么?
答:AlF3 离子键
AlCl3
AlBr3
AlI3 共价键
共价分子:熔点低,易挥发,易溶于有机溶剂.
15
因为AlCl3为缺电子分子,Al倾向于接受电子对形成 sp3杂化轨道。两个AlCl3分子间发生Cl→Al的电子对授
予而配位,形成Al2Cl6分子。
Cl Cl Al Cl Cl Al Cl Cl
Tl-Hg合金(含8.7%铊)的凝固点比汞的凝固点低20K, 故可用在温度计上以替代汞。
在灯泡用钨丝中加人很少量的铊,可延长灯丝的寿命。
Tl及其化合物都有毒,可制杀鼠药和灭虫药,但它们
对人体也有毒害,误食少量钠盐可使毛发脱落,工业废
水中不容许含铊。
19
1)、三氧化二铝﹡ Al2O3有多种变体,其中最为人们所熟悉的是 -Al2O3和-Al2O3它们是白色晶形粉末。 自然界存在的刚玉为-Al2O3。 或铝在O2中燃烧; 灼烧Al(OH)3、某些铝盐[Al(NO3)3、AlCl3]
于镓较昂贵,毒性又很大,故其应用受到了限制。约有
80%的镓和铟用于电子工业
