切中要害:EGFR突变NSCLC的治疗进展
RCC1、EGFR与K-ras在NSCLC治疗中的进展

[4 1】夏绘 晶 , 玫 , 德哉 , . 万 戴 等 芦生坦 对大 鼠心肌 内皮素受 体结合的影响及一次给药对肺动脉 高压 的治疗作用[ . J 中 ]
【J F咖 d 3 e A( n M n ∞ E 1 \£。( a , Ne tp da v i 曲昭
[ 啦 பைடு நூலகம்
c lim .h mn l lc eso uvv ln pi ay p l n r acu c a a o k r ns ria r r umo ay b i m
承
德
医
学
院
学
报
VO . 8 No. 0 1 12 42 l
中医药注重整体和辨证论治, 在治疗肺动脉高压方面有 独特的疗效。 近年来 , 中药复方治疗肺动脉高压 围绕着肺脾 肾虚损、 气虚气滞血瘀的发病机理展开 , 但复方的研究中大
[l 1】Naa a S i z S thTe a .rl ea rs s du g y hmi N, u a , 1O a b rpo t o im o t
i inO f rp o t iapo tc ci n lg ei ain s nf o e rsi l r say l a ao u , p t t us t n , n n e
【 参考文献】
【j P s EDLig LC r n a de rigt rp o pi r l as , ln M . ur t n S s e meg n h a yfr r y e ma
w t p l nr t i hpr ni [ .m R siC iC r i umoaya e a y e es nJA J epr r ae h rrl t o ] t
晚期NSCLC一线靶向治疗进展

晚期NSCLC一线靶向治疗进展[导读] 自从2004年发现EGFR基因活化突变与TKI治疗非小细胞肺癌的疗效相关以来,通过服用EGFR-TKI,越来越多的患者从中获益,推动了肺癌治疗越来越精准。
非小细胞肺癌是第一个进入精准治疗而且走得最好的实体肿瘤,EGFR-TKI是精准治疗的典范。
非小细胞肺癌中EGFR基因的突变率非常高,特别是亚裔患者EGFR突变率约50%,不吸烟者高达59.6%,吸烟者也有35.3%。
在我国,大约30%~40%的肺腺癌患者都存在EGFR敏感突变。
自从2004年发现EGFR基因活化突变与TKI治疗非小细胞肺癌的疗效相关以来,通过服用EGFR-TKI,越来越多的患者从中获益,推动了肺癌治疗越来越精准。
非小细胞肺癌是第一个进入精准治疗而且走得最好的实体肿瘤,EGFR-TKI是精准治疗的典范。
目前已经拥有针对EGFR敏感突变的靶向药有5种。
第一代有吉非替尼、厄洛替尼、埃克替尼;第二代阿法替尼、达克替尼;第三代奥希替尼。
推动肺癌治疗越来越精准的同时,更多的TKI也为临床提供了更多的选择。
而且一些临床研究也似乎为NSCLC一线治疗提供了新的可选择模式。
近10年来,肺癌EGFR一线靶向药物主要有吉非替尼、厄洛替尼、埃克替尼。
当患者接受EGFRTKI治疗后,随着时间的延长,几乎都会出现获得性耐药,最终会出现疾病进展,目前考虑EGFR-TKI获得性耐药主要相关因素为T790M二次突变及c-MET基因扩增,二者所占比例分别为50%及20%左右。
研究显示,约3.6%未经治疗的非小细胞癌患者,肿瘤组织标本中T790M突变阳性,而吉非替尼和厄洛替尼耐药的非小细胞癌患者其阳性率表答为50%。
二代TKI与一代TKI相比,其疗效的提高主要是与其血药浓度高和覆盖多个EGFR家族成员有关,但目前其耐药机制尚不明确。
奥希替尼是第三代口服不可逆的EGFR抑制剂,可抑制EGFR-TKI敏感和T790M耐药突变的药物,用于EGFRT790M突变阳性的局部晚期或转移性非小细胞肺癌的肿瘤药物。
伏美替尼治疗EGFR基因突变非小细胞肺癌的研究进展

全性等方面的研究进展,以期为伏美替尼的临床合理使用及其开展后续研究提供参考。
1 伏美替尼的作用机制EGFR基因突变是中国NSCLC患者的常见突变类型,约半数的患者显示出EGFR活性增强,增强的EGFR 信号通过激活与细胞增殖、侵袭、血管生成、转移和死亡抑制等密切相关的信号通路,来促进细胞增殖和肿瘤生长[7]。
EGFR-TKI可以抑制EGFR的自身磷酸化,阻止肿瘤的进展,而伏美替尼正是针对EGFR基因突变开发的第三代EGFR-TKI。
如图1所示,伏美替尼的结构式与目前指南首选推荐的第三代EGFR-TKI奥希替尼的结构式非常相似,但伏美替尼基于奥希替尼的结构进行了修饰,引入了强疏水性三氟乙氧基吡啶结构,这一结构可与ATP结合区域中由L792和M793等残基组成的疏水口袋结合,不仅增强了伏美替尼与EGFR的结合活性和激酶选择性,而且还改善了伏美替尼的代谢特性,抑制了非选择性代谢物的形成。
伏美替尼在人体中的主要活性代谢产物为AST5902,其由侧链的N-去甲基化代谢产生,表现出与伏美替尼原型相似的抑瘤活性和选择性,两者均可通过不饱和丙烯酰胺键不可逆地与EGFR 结合,具有双重活性和强抑瘤性;此外,两者均具有高选择性,对野生型EGFR编码产物的亲和力较低,可将野生型EGFR编码产物的抑制作用降至最低,减少相关副作用发生,提高安全性[8]。
2 伏美替尼的药代动力学伏美替尼及其活性代谢产物AST5902的药代动力学数据来自多项临床试验。
NSCLC患者在20~240 mg/d 剂量范围内,伏美替尼的药峰浓度(peak concentration,c max)和曲线下面积(area under the curve,AUC)增加比例略小于给药剂量的增加比例,而AST5902的c max和AUC 增加比例则近似于给药剂量的增加比例[8]。
当给药剂量为80 mg/d,每天给药1次时,伏美替尼和AST5902分别于7 d和14 d后基本达到稳态血药浓度,均值分别为1030、762 ng·h/mL[8]。
佐利替尼一线治疗EGFR突变NSCLC伴中枢神经系统转移2例报告

佐利替尼一线治疗EGFR 突变NSCLC 伴中枢神经系统转移2例报告徐丹,刘夏,钟殿胜△摘要:目的 探讨佐利替尼一线治疗具有原发表皮生长因子受体(EGFR )突变的非小细胞肺癌(NSCLC )伴中枢神经系统转移患者的疗效。
方法 2例患者均为一线使用佐利替尼,通过实体瘤的疗效评价标准RECIST v1.1和神经系统肿瘤脑转移RANO-BM 标准评估肿瘤治疗反应。
结果 病例1基线伴多发脑转移,EGFR exon 19del 突变,佐利替尼治疗51.4个月后仍维持肺部病灶部分缓解(PR )、颅内病灶完全缓解(CR )。
病例2基线单个脑转移病灶,EGFR exon 19del 突变,佐利替尼治疗期间达到肺部病灶PR 、颅内病灶CR ,13.7个月后肺部疾病进展(PD ),新发单个脑转移病灶,综合评效PD 。
病例1出现3级不良反应,为皮肤干燥,其余主要为皮疹、肝功能异常、腹泻,不良反应总体可控。
结论 佐利替尼对EGFR 突变NSCLC 伴中枢神经系统转移患者有较好的颅内及颅外病灶的控制效果,与EVEREST 研究一致,可作为一线初始治疗的选择。
关键词:ErbB 受体;癌,非小细胞肺;无进展生存期;中枢神经系统转移;佐利替尼中图分类号:R734.2 文献标志码:A DOI :10.11958/20231793Frst-line treatment of Zorifertinib in EGFR-mutant NSCLC with CNS metastases:a report of two casesXU Dan, LIU Xia, ZHONG Diansheng △Department of Medical Oncology, Tianjin Medical University General Hospital, Tianjin 300052, China△Corresponding Author E-mail:********************Abstract: Objective To investigate the efficacy of Zorifertinib in first-line treatment of patients with untreated epidermal growth factor receptor (EGFR) mutation in non –small-cell lung cancer (NSCLC) with central nervous system (CNS) metastases. Methods Two patients received Zorifertinib as first-line treatment. The response of tumor treatment was evaluated by response evaluation criteria in solid tumors version 1.1 (RECEST v1.1) and RANO criteria for brain metastases (RANO-BM). Results Case 1 had EGFR exon 19del mutation and multiple brain metastases at baseline. After 51.4 months of treatment with Zorifertinib, case 1 still maintained partial response (PR) in lung lesions and complete response (CR) in intracranial lesions. Case 2 had EGFR exon 19del mutation and a single brain metastasis at baseline. Case 2 achieved PR in lung lesions and CR in intracranial lesions during the treatment with Zorifertinib. After 13.7 months, lung disease progression (PD) and new single brain metastases occurred. The comprehensive evaluation was PD. Case 1 had three-grade treatment-related adverse events (TRAEs), including dry skin, and other TRAEs were rash, abnormal liver function and diarrhea. The TRAEs were generally controllable. Conclusion Zorifertinib has a good effect on controlling intracranial and extracranial lesions in patients with EGFR-mutated NSCLC with CNS metastases. The efficacy of Zorifertinib is consistent with the EVEREST study. Zorifertinib can be one of the first-line initial treatment options.Key words: ErbB receptors; carcinoma, non-small-cell lung; progression-free survival; central nervous system metastases; Zorifertinib 作者单位:天津医科大学总医院肿瘤内科(邮编300052) 作者简介:徐丹(1997),女,博士在读,主要从事肺部肿瘤基础临床转化方面研究。
晚期NSCLC患者外周血中EGFR突变检测预测靶向治疗的疗效观察

( 45 1 P: .3 ;243 4, 00 8 。K pa — ir x= .6 , 00 3 X= .1 P= . ) a ln Mee 生存 曲线表 明 , 3 A组 生存 率 高 于 B组 ( 274 6, 00 6 。 X= .0 P= .0 )
结论 晚期 N C C患 者 可通 过外 周血 检测 出 E F SL G R突变 , 对一 线靶 向治 疗具 有 一定 的指 导意 义 。 【 关键 词 】 小细胞 肺 癌 ; 皮生 长 因子 受体 ; 非 表 外周血 ; 子靶 向 ; 分 治疗
aayi. h ieec so uv a aeb t engopA a dgo pB = 。0 , 00 6 w r t i ia ys nf a t n ls T edf rn e f ri l t ew e ru n u 74 6 P= . ) ees t t l i icn. s f s v r r 0 a sc l g i
冰 箱 中保存 。 解冻 后 , 高通 量血 液 D A提 取试 剂 盒操 作说 按 N
明提取 D A, 于 5 L灭菌水 中 。经 微量 紫外 可 见分 光光 N 溶 0
度 计测 定 D A 纯 度及 含 量 ,提取 的 D A放 置一 0 冰 箱储 N N 2℃
存 。 计上 下游 引 物 。 C 设 P R反 应条 件 为 9 ℃ 2m n 9 ℃ 5s 6 i ,6 ,
wto tE F tt n ( op B eet ae yc e c rg. eut h aeo G R m tt n n p r hrl i u G R muai s g u )w r r td b h mi du s R sl T ert fE F uai si ei ea h o r e l a s o p
EGFRTKI治疗NSCLC脑转移研究进展

EGFRTKI治疗NSCLC脑转移研究进展神经上皮生长因子受体(EGFR)是一种跨膜蛋白质,在多种细胞类型中都有表达。
EGFR是一种重要的受体酪氨酸激酶,在肿瘤细胞的存活、增殖和转移中起关键作用。
EGFR在多种癌症中过度表达或突变,例如非小细胞肺癌(NSCLC),这就为EGFR作为抗肿瘤治疗的靶点提供了可能性。
NSCLC是影响人们健康生活的重要疾病,其脑转移是常见且严重的并发症。
NSCLC患者的脑转移通常是肺癌进展的表现,这会导致患者生存率的显著减少。
传统的治疗方法对于NSCLC脑转移疗效有限,而EGFR靶向治疗的出现为NSCLC脑转移的治疗带来了新的希望。
EGFR靶向抑制剂是一类针对EGFR进行靶向干预的药物,通过抑制EGFR信号通路的活化,达到阻断肿瘤细胞生长和扩散的效果。
EGFR靶向抑制剂主要包括单克隆抗体和小分子酪氨酸激酶抑制剂两类。
其中,埃克替尼(Erlotinib)和吉非替尼(Gefitinib)是最常用的EGFR小分子酪氨酸激酶抑制剂,可有效治疗EGFR突变阳性的NSCLC患者。
一些研究表明,EGFR靶向治疗对NSCLC脑转移的疗效也具有一定的作用。
近年来的一些临床研究指出,EGFR靶向治疗对NSCLC脑转移患者的生存期和生存质量有显著改善。
例如,有研究发现,EGFR靶向治疗可显著降低NSCLC脑转移患者的脑转移进展率和死亡率。
此外,EGFR靶向治疗还可以减缓NSCLC脑转移患者的症状进展,提高患者的生活质量。
然而,目前EGFR靶向治疗对于NSCLC脑转移的疗效仍存在一些限制。
一些研究表明,部分NSCLC脑转移患者对EGFR靶向治疗有抗药性,这可能与肿瘤细胞内EGFR基因突变、信号通路激活等因素有关。
此外,EGFR靶向治疗的不良反应也是制约其在NSCLC脑转移治疗中广泛应用的因素之一针对EGFR靶向治疗在NSCLC脑转移治疗中的研究进展,未来研究方向可以考虑以下几个方面。
首先,进一步明确EGFR突变对于NSCLC脑转移的影响机制,研究EGFR突变与抗药性之间的关系,有助于提高靶向治疗的疗效。
一线治疗EGFR突变NSCLC

吉非替尼
9.2
mPFS(月)
多泽润®
14.7
mPFS(月)
随机分组后时间(月)
5.5个月
PFS显著延长
疾病进展 风险降低
41%
HR 0.59 (95% CI 0.47–0.74)
P<0.0001
风险患者数 达可替尼 吉非替尼
吉非替尼
11.0
mPFS(月)
多泽润®
16.6
mPFS(月)
随机分组后时间(月)
达可替尼
1
吉非替尼
11
0
2
4
6
8
10
12
发生脑转移的人数
7 1. Sun H, Wu YL. Future Oncol. 2019 Aug;15(23):2769-2777. 2. Mok TS, et al. J Clin Oncol. 2018 Aug 1;36(22):2244-2250
PP-DAC-CHN-0143 Expiration Date: 2022-3-6
5.6个月
PFS显著延长
疾病进展 风险降低
38%
HR 0.62 (95% CI 0.50-0.78)
P<0.0001
PFS(%) PFS(%)
4 Wu YL, et al. Lancet Oncol. 2017 Nov;18(11):1454-1466
PP-DAC-CHN-0143 Expiration Date: 2022-3-6
<0.0001 0.0027 0.3021
0.0068 0.001 0.0203
8
1. Supplement to: Wu YL, et al. Lancet Oncol 2017;18(11):1454-1466.
NSCLC患者胸腔积液ROS1、EGFR基因突变与临床病理及靶向治疗的关系研究

作者简介:伍秉翔,男,副主任医师,主要从事肺癌临床方面的研究㊂ ә 通信作者,E -m a i l :b i n g x i a n g_w u @163.c o m ㊂㊃论著㊃D O I :10.3969/j.i s s n .1672-9455.2023.15.025N S C L C 患者胸腔积液R O S 1㊁E G F R 基因突变与临床病理及靶向治疗的关系研究伍秉翔1,杨雪荣2,刘 龙2ә上海天佑医院:1.肿瘤科;2.中医科,上海200061摘 要:目的 探究非小细胞肺癌(N S C L C )患者胸腔积液肉瘤致癌因子-受体酪氨酸激酶(R O S 1)㊁表皮生长因子受体(E G F R )基因突变与临床病理及靶向治疗的关系㊂方法 选取2018年10月至2021年2月上海天佑医院收治的285例N S C L C 患者作为研究对象,均抽取胸腔积液,其中197例患者采用靶向治疗(靶向治疗组),88例患者采用传统化疗(化疗组),通过突变扩增系统-聚合酶链反应(A R M S -P C R )检测患者胸腔积液R O S 1㊁E G F R 基因突变情况㊂分析胸腔积液R O S 1㊁E G F R 基因突变与N S C L C 患者临床特征及治疗效果的关系㊂结果 N S C L C 患者胸腔积液R O S 1基因突变率为3.51%(10/285),E G F R 基因突变率为41.05%(117/285)㊂女性N S C L C 患者R O S 1㊁E G F R 基因突变率高于男性N S C L C 患者(P <0.05);腺癌N S C L C 患者R O S 1㊁E G F R 基因突变率高于非腺癌N S C L C 患者(P <0.05);无吸烟史的N S C L C 患者R O S 1㊁E G F R 基因突变率高于有吸烟史的N S C L C 患者(P <0.05)㊂R O S 1基因突变阳性N S C L C 患者中,靶向治疗组客观缓解率(O R R )㊁疾病控制率(D C R )与化疗组比较,差异无统计学意义(P >0.05)㊂E G F R 基因突变阳性N S C L C 患者中,靶向治疗组O R R ㊁D C R 分别为61.25%㊁80.00%,均高于化疗组的32.43%㊁51.35%,差异均有统计学意义(P <0.05)㊂R O S 1基因突变阳性的N S C L C 患者靶向治疗组不良反应发生率与化疗组比较,差异无统计学意义(P >0.05),E G F R 基因突变阳性的N S C L C 患者靶向治疗组恶心/呕吐㊁肝损害㊁骨髓抑制不良反应发生率均低于化疗组(P <0.05)㊂结论 N S C L C 患者胸腔积液检测可见R O S 1㊁E G F R 基因突变,其与患者临床特征(性别㊁病理分型和吸烟史)㊁疗效及不良反应有关㊂关键词:非小细胞肺癌; 胸腔积液; 肉瘤致癌因子-受体酪氨酸激酶; 表皮生长因子受体; 基因突变;临床特征中图法分类号:R 734.2文献标志码:A文章编号:1672-9455(2023)15-2250-06R e l a t i o n s h i p b e t w e e n R O S 1,E G F R g e n e m u t a t i o n i n p l e u r a l e f f u s i o n a n d c l i n i c o p a t h o l o g y a n d t a r g e t e d t h e r a p y of N S C L C p a t i e n t s WU B i ng x i a n g 1,Y A N G X u e r o n g 2,L I U L o n g2ә1.D e p a r t m e n t o f O n c o l o g y ;2.D e p a r t m e n t o f Tr a d i t i o n a l C h i n e s e M e d i c i n e ,T i a n y o u H o s p i t a l ,S h a n gh a i 200061,C h i n a A b s t r a c t :O b j e c t i v e T o e x p l o r e t h e r e l a t i o n s h i p b e t w e e n R O S p r o t o -o n c o g e n e 1-r e c e p t o r t y r o s i n e k i n a s e (R O S 1)a n d e p i d e r m a l g r o w t h f a c t o r r e c e p t o r (E G F R )g e n e m u t a t i o n s a n d c l i n i c o p a t h o l o g i c a n d t a r g e t e d t h e r a p y i n p a t i e n t s w i t h n o n -s m a l l c e l l l u n g ca n c e r (N S C L C )i n p l e u r a l e f f u s i o n .M e t h o d s A t o t a l o f 285p a -t i e n t s w i t h N S C L C i n T i a n y o u H o s p i t a l f r o m O c t ob e r 2018t o F e b r u a r y 2021w e r e s e l e c t e d a s t h e r e s e a r c h s u b j e c t s ,a l l o f w h o m u n d e r w e n t p l e u r a l f l u i d e x t r a c t i o n ,i n c l u d i n g 197p a t i e n t s t r e a t e d w i t h t a r g e t e d t h e r a p y(t a r g e t e d t h e r a p y g r o u p )a n d 88p a t i e n t s t r e a t e d w i t h t r a d i t i o n a l c h e m o t h e r a p y (c h e m o t h e r a p y g r o u p ),a n d t h e p a t i e n t s 'p l e u r a l f l u i d R O S 1a n d E G F R g e n e m u t a t i o n s w e r e d e t e c t e d b y m u t a t i o n a m p l i f i c a t i o n s y s t e m -p o l y m e r a s e c h a i n r e a c t i o n (A R M S -P C R ).T h e r e l a t i o n s h i p be t w e e n t h e R O S 1a n d E G F R g e n e m u t a t i o n s i n p l e u r a l ef f u s i o n a n d t h e c l i n i c a l c h a r a c t e r i s t i c s a n d t r e a t m e n t e f f e c t o f N S C L C p a t i e n t s w a s a n a l yz e d .R e s u l t s T h e m u t a t i o n r a t e o f R O S 1g e n e i n N S C L C p a t i e n t s w i t h p l e u r a l e f f u s i o n w a s 3.51%(10/285),a n dt h e m u t a t i o n r a t e o f E G F R g e n e w a s 41.05%(117/285).T h e m u t a t i o n r a t e s o f R O S 1a n d E G F R g e n e s i n f e -m a l e N S C L C p a t i e n t s w e r e h i gh e r t h a n t h o s e i n m a l e N S C L C p a t i e n t s (P <0.05);t h e m u t a t i o n r a t e s o f R O S 1a n d E G F R g e n e s i n a d e n o c a r c i n o m a N S C L C p a t i e n t s w e r e h i gh e r t h a n t h o s e i n n o n -a d e n o c a r c i n o m a N S C L C p a t i e n t s (P <0.05);t h e m u t a t i o n r a t e s o f R O S 1a n d E G F R g e n e s i n N S C L C p a t i e n t s w i t h o u t s m o k i n g h i s t o r yw e r e h i g h e r t h a n t h o s e i n N S C L C p a t i e n t s w i t h s m o k i n g h i s t o r y (P <0.05).I n R O S 1m u t a t i o n -po s i t i v e N S C L C p a t i e n t s ,t h e r e w e r e n o s i g n i f i c a n t d i f f e r e n c e s i n o b je c t i v e r e m i s s i o n r a t e (O R R )a n d d i s e a s e c o n t r o l ㊃0522㊃检验医学与临床2023年8月第20卷第15期 L a b M e d C l i n ,A u gu s t 2023,V o l .20,N o .15Copyright ©博看网. All Rights Reserved.r a t e(D C R)b e t w e e n t h e t a r g e t e d t h e r a p y g r o u p a n d t h e c h e m o t h e r a p y g r o u p(P>0.05).I n E G F R m u t a t i o n-p o s i t i v e N S C L C p a t i e n t s,O R R a n d D C R i n t a r g e t e d t h e r a p y g r o u p w e r e61.25%a n d80.00%,r e s p e c t i v e l y, h i g h e r t h a n32.43%a n d51.35%i n c h e m o t h e r a p y g r o u p(P<0.05).T h e r e w a s n o s t a t i s t i c a l s i g n i f i c a n c e i n t h e i n c i d e n c e o f a d v e r s e r e a c t i o n s i n p a t i e n t s w i t h N S C L C c o m p l i c a t e d w i t h R O S1g e n e m u t a t i o n s b e t w e e n t h e t a r g e t e d t h e r a p y g r o u p a n d t h e c h e m o t h e r a p y g r o u p(P>0.05).T h e i n c i d e n c e r a t e s o f a d v e r s e r e a c t i o n s s u c h a s n a u s e a/v o m i t i n g,l i v e r d a m a g e a n d b o n e m a r r o w s u p p r e s s i o n o f p a t i e n t s w i t h N S C L C a n d E G F R g e n e m u-t a t i o n s i n t h e t a r g e t e d t h e r a p y g r o u p w e r e l o w e r t h a n t h o s e i n t h e c h e m o t h e r a p y g r o u p(P<0.05).C o n c l u s i o n R O S1a n d E G F R g e n e m u t a t i o n s c a n b e d e t e c t e d i n t h e p l e u r a l e f f u s i o n o f p a t i e n t s w i t h N S C L C, w h i c h a r e r e l a t e d t o t h e c l i n i c a l c h a r a c t e r i s t i c s(g e n d e r,p a t h o l o g i c a l t y p e a n d s m o k i n g h i s t o r y),e f f i c a c y a n d a d v e r s e r e a c t i o n s o f p a t i e n t s.K e y w o r d s:n o n-s m a l l c e l l l u n g c a n c e r;p l e u r a l e f f u s i o n; R O S p r o t o-o n c o g e n e1-r e c e p t o r t y r o s i n e k i-n a s e;e p i d e r m a l g r o w t h f a c t o r r e c e p t o r;g e n e m u t a t i o n s;c l i n i c a l c h a r a c t e r i s t i c s国际癌症研究机构2018年公布的数据显示,在全球恶性肿瘤中,肺癌发病率为11.6%,病死率为18.4%,均排在首位[1]㊂我国国家癌症报告中也指出,肺癌发病率与病死率在恶性肿瘤中占比最高[2]㊂根据病理分型,肺癌可分为小细胞肺癌(S C L C)㊁非小细胞肺癌(N S C L C),后者在肺癌中占比约为80.0%,主要为腺癌㊁鳞癌等[3]㊂尽管临床诊治恶性肿瘤均获得了一定进展,但多数肺癌患者在确诊时已发展至中晚期,此时难以进行手术治疗㊂近年来,分子生物学技术的快速发展使特异性分子靶向治疗在临床恶性肿瘤治疗中应用增多㊂分子靶向治疗具有高度特异性,能够更好地作用于肿瘤特定位点,选择性杀死肿瘤细胞,有利于改善肺癌患者预后[4]㊂在分子靶向治疗中,以肉瘤致癌因子-受体酪氨酸激酶(R O S1)㊁表皮生长因子受体(E G F R)等为靶点的靶向药物酪氨酸激酶抑制剂(T K I)应用较多,但并非所有患者均可从T K I治疗中获得满意效果,R O S1㊁E G F R基因突变是T K I药物靶向治疗的前提条件[5]㊂有研究指出,E G-F R基因突变与患者性别㊁病理分型等有关[6]㊂因此了解N S C L C患者R O S1㊁E G F R基因突变情况,并对患者特征进行分析总结,对指导临床治疗具有重要意义㊂因N S C L C患者确诊时多处于中晚期,大多不符合手术要求,而穿刺标本取样少,加之肿瘤组织本身具有异质性,故需寻找其他方法来完成检测㊂胸腔积液的获取安全性相对较高,实时性强,可作为R O S1㊁E G F R基因突变检测的生物学材料㊂本研究检测了N S C L C患者胸腔积液中R O S1㊁E G F R基因突变情况,并分析了胸腔积液R O S1㊁E G F R基因突变与患者临床特征及治疗效果的关系,现报道如下㊂1资料与方法1.1一般资料选取2018年10月至2021年2月上海天佑医院收治的285例N S C L C患者,其中有197例患者采用靶向治疗(靶向治疗组),88例患者采用传统化疗(化疗组)㊂纳入标准:(1)符合‘肿瘤综合诊疗新进展“[7]中N S C L C相关的诊断标准,且经病理学检查确诊;(2)在进行胸腔积液R O S1㊁E G F R基因突变检测前未行放化疗;(2)临床资料完整㊂排除标准: (1)合并其他恶性肿瘤;(2)心㊁肝㊁肾功能不全;(3)合并免疫系统疾病㊂1.2方法1.2.1治疗方法(1)靶向治疗:口服厄洛替尼片(上海罗氏制药有限公司)150m g/d,连续治疗2个月㊂(2)化疗:顺铂(江苏豪森药业集团有限公司)70 m g/m2,第1天静脉滴注;吉西他滨(南京正大天晴制药有限公司)1000m g/m2,第1㊁8天静脉滴注;每21天为1个周期,连续治疗2个周期㊂1.2.2检测方法(1)胸腔积液R O S1㊁E G F R提取㊂取经细胞学检查确定有癌细胞的胸腔积液50m L,4ħ保存并于24 h内进行D N A提取及基因检测㊂于4ħ环境中3000r/m i n离心10m i n;吸取上清液,再在4ħ环境中3000r/m i n离心10m i n;吸取上清液加入B u f f e r S P L和蛋白酶K溶液,于63ħ水浴消化㊂加入D N A 示踪剂㊁异丙醇,1000r/m i n离心5m i n㊂清洗2次, 1000r/m i n离心5m i n,收集D N A㊂采用厦门艾德生物医药科技有限公司生产的人类R O S1融合基因检测试剂盒与E G F R基因突变检测试剂盒进行检测,检测仪器为A B I7500仪器,检测方法为突变扩增系统-聚合酶链反应(A R M S-P C R)㊂离心机为美国B e c k m a n C o u l t e r公司A l l e g r a64R台式高速冷冻离心机㊂(2)R O S1基因检测㊂于-20ħ冰箱中取出R O S1混合酶和N(R O S1样本数)条8联P C R反应管条,均离心15s㊂移取1.5μL R O S1混合酶至待测样本c D N A㊁阳性及阴性对照中,振荡混匀后快速离心10s㊂进行P C R扩增,扩增条件:第1阶段95ħ5 m i n;第2阶段95ħ25s,64ħ20s,72ħ20s,15个循环;第3阶段93ħ25s,60ħ35s,72ħ20s,35个循环㊂(3)E G F R基因检测㊂于-20ħ冰箱中取出E G-F R混合酶和N(EG F R样本数)+2条8联P C R反应管条,均离心15s㊂稀释D N A,加入2.7μL E G F R混㊃1522㊃检验医学与临床2023年8月第20卷第15期 L a b M e d C l i n,A u g u s t2023,V o l.20,N o.15Copyright©博看网. All Rights Reserved.合酶,振荡后离心㊂行P C R 扩增,扩增条件:第1阶段95ħ5m i n ;第2阶段95ħ25s ,64ħ20s ,72ħ20s ,15个循环;第3阶段93ħ25s ,60ħ35s ,72ħ20s ,35个循环㊂1.2.3 基因检测结果判读 R O S 1基因检测位点包含S L C 34A 2-R O S 1㊁C D 74-R O S 1㊁S D C 4-R O S 1㊁E Z R -R O S 1㊁T P M 3-R O S 1㊁L R I G 3-R O S 1㊁G O P C -R O S 1,若未检测到上述突变则认为R O S 1融合阴性㊂E G F R 基因检测位点包含19-D e l ㊁L 858R ㊁T 790M ㊁20-I n s㊁G 719X ㊁S 768I ㊁L 861Q ㊂因E G F R 基因除18~21外显子外的突变极少见且目前与用药不相关,故如果未检测到上述突变则判断为E G F R 野生型㊂1.3 疗效评价 采用实体瘤临床疗效评价标准(R E -C I S T )评价治疗效果,分为完全缓解(C R )㊁部分缓解(P R )㊁疾病稳定(S D )和疾病进展(P D )㊂客观缓解率(O R R )=(C R 例数+P R 例数)/总例数ˑ100.00%,疾病控制率(D C R )=(C R 例数+P R 例数+S D 例数)/总例数ˑ100.00%㊂1.4 统计学处理 采用S P S S 20.0统计软件进行数据分析㊂计数资料以例数或百分率表示,组间比较采用χ2检验或连续性校正χ2检验㊂以P <0.05为差异有统计学意义㊂2 结 果2.1 N S C L C 患者胸腔积液R O S 1㊁E G F R 基因突变情况 N S C L C 患者胸腔积液R O S 1基因突变率为3.51%(10/285),E G F R 基因突变率为41.05%(117/285)㊂在R O S 1基因突变中,S L C 34A 2-R O S 1占比最高,其次为C D 74-R O S 1;在E G F R 基因突变中,19-D e l 占比最高,其次为L 858R ㊂见表1㊂2.2 N S C L C 患者R O S 1㊁E G F R 基因突变与临床特征的关系 女性N S C L C 患者R O S 1㊁E G F R 基因突变率高于男性N S C L C 患者(P <0.05);腺癌N S C L C 患者R O S 1㊁E G F R 基因突变率高于非腺癌N S C L C患者(P <0.05);无吸烟史N S C L C 患者R O S 1㊁E G -F R 基因突变率高于有吸烟史N S C L C 患者(P <0.05);但不同年龄㊁肿瘤最大径㊁解剖学部位㊁初诊T NM 分期患者R O S 1㊁E G F R 基因突变率比较,差异均无统计学意义(P >0.05)㊂见表2㊂2.3 伴R O S 1基因突变的N S C L C 患者靶向治疗与化疗效果比较 伴R O S 1基因突变的N S C L C 患者中,靶向治疗组O R R ㊁D C R 与化疗组比较,差异均无统计学意义(P >0.05)㊂见表3㊂2.4 伴E G F R 基因突变的N S C L C 患者靶向治疗与化疗效果比较 伴E G F R 基因突变的N S C L C 患者中,靶向治疗组O R R ㊁D C R 均高于化疗组(P <0.05)㊂见表4㊂2.5 伴R O S 1基因突变的N S C L C 患者靶向治疗与化疗后的不良反应比较 伴R O S 1基因突变的N S C L C 患者靶向治疗组不良反应发生率与化疗组比较,差异均无统计学意义(P >0.05)㊂见表5㊂2.6 伴E G F R 基因突变的N S C L C 患者靶向治疗与化疗后的不良反应比较 伴E G F R 基因突变的N S C L C 患者靶向治疗组恶心/呕吐㊁肝损害㊁骨髓抑制的发生率均低于化疗组(P <0.05)㊂见表6㊂表1 N S C L C 患者胸腔积液R O S 1㊁E G F R 基因突变类型[n (%)]基因突变类型构成R O S 1S L C 34A 2-R O S 13(30.00) C D 74-R O S 12(20.00) S D C 4-R 0S 11(10.00) E Z R -R O S 11(10.00) T P M 3-R 0S 11(10.00) L R I G 3-R 0S 11(10.00) G 0P C -R 0S 11(10.00)E G F R (单位点) 19-D e l 57(48.72) L 858R 45(38.46) G 719X 2(1.71) T 790M2(1.71) 20-I n s 2(1.71) S 768I2(1.71) L 861Q1(0.85)E G F R (双位点) 19-D e l /T 790M 2(1.71) 19-D e l /L 858R 2(1.71) G 719X /S 768I1(0.85) T 790M /20-I n s1(0.85)表2 N S C L C 患者R O S 1㊁E G F R 基因突变与临床特征的关系[n (%)]临床特征nR O S 1基因突变构成χ2PE GF R 基因突变构成χ2P性别5.4130.0208.1680.004男1722(1.16)59(34.30) 女1138(7.08)58(51.33)年龄0.4120.5210.2560.613㊃2522㊃检验医学与临床2023年8月第20卷第15期 L a b M e d C l i n ,A u gu s t 2023,V o l .20,N o .15Copyright ©博看网. All Rights Reserved.续表2 N S C L C 患者R O S 1㊁E G F R 基因突变与临床特征的关系[n (%)]临床特征nR O S 1基因突变构成χ2PE GF R 基因突变构成χ2P<60岁1283(2.34)46(35.94) ȡ60岁1577(4.46)61(38.85)吸烟史5.7740.0167.2490.007有1491(0.07)50(33.56) 无1369(6.62)67(49.26)病理类型6.9090.0269.7550.006腺癌17110(5.85)81(47.37) 鳞癌880(0.00)35(39.78) 其他260(0.00)4(15.38)肿瘤最大径0.0370.8470.5280.468<3c m1345(3.73)52(38.81) ȡ3c m1515(3.31)65(43.05)解剖学部位0.020.8870.070.792中央型1224(3.28)49(40.16) 周围型1636(3.68)68(41.72)初诊T NM 分期0.2910.9620.1470.986Ⅰ期271(3.70)11(40.74) Ⅱ期673(4.48)27(40.30) Ⅲ期1023(2.94)41(40.20) Ⅳ期893(3.37)38(42.70)表3 伴R O S 1基因突变的N S C L C 患者靶向治疗与化疗效果比较[n (%)]组别nC RP RS DP DO R RD C R 靶向治疗组70(0.00)3(42.86)2(28.57)2(28.57)3(42.86)5(71.43)化疗组30(0.00)0(0.00)1(33.33)2(66.67)0(0.00)1(33.33)χ20.3630.179P0.5470.673表4 伴有E G F R 基因突变的N S C L C 患者靶向治疗与化疗效果比较[n (%)]组别nC RP RS DP DO R RD C R 靶向治疗组800(00.00)49(61.25)15(18.75)16(20.00)49(61.25)64(80.00)化疗组370(00.00)12(32.43)7(18.92)18(48.65)12(32.43)19(51.35)χ28.41910.072P0.0040.002表5 伴R O S 1基因突变的N S C L C 患者靶向治疗与化疗后的不良反应比较[n (%)]组别n恶心/呕吐腹泻肝损害骨髓抑制皮疹靶向治疗组72(28.57)2(28.57)1(14.29)1(14.29)2(28.57)化疗组32(66.67)2(66.67)1(33.33)1(33.33)1(33.33)χ20.1790.1790.0300.0300.363P0.6730.6730.8630.8630.547㊃3522㊃检验医学与临床2023年8月第20卷第15期 L a b M e d C l i n ,A u gu s t 2023,V o l .20,N o .15Copyright ©博看网. All Rights Reserved.表6伴E G F R基因突变的N S C L C患者靶向治疗与化疗后的不良反应比较[n(%)]组别n恶心/呕吐腹泻肝损害骨髓抑制皮疹靶向治疗组8032(40.00)21(26.25)17(21.25)15(18.75)15(18.75)化疗组3723(62.16)16(43.24)15(40.54)14(37.84)13(35.14)χ24.9883.3794.7384.9443.731 P0.0260.0660.0300.0260.0533讨论外科手术㊁放化疗㊁免疫治疗是N S C L C治疗的常用手段,但由于多数患者确诊时已经处于癌症中晚期,故化疗使用更多㊂然而化疗不具有特异性,其在杀死肿瘤细胞的同时也会对正常细胞造成损害,引起明显不良反应㊂随着分子生物技术的不断发展,分子靶向治疗N S C L C逐渐兴起,与放化疗相比较,其可减少不良反应,更好地延长患者生存期㊂与N S C L C相关的基因较多,其中R O S1㊁E G F R基因为目前临床研究较多的驱动基因,本次研究选取上述2种基因,分析其在N S C L C患者胸腔积液中的突变率,并探讨了伴R O S1㊁E G F R基因突变的N S C L C患者临床特征和治疗效果㊂R O S1为单体型受体酪氨酸激酶,人R O S1基因定位于6q21染色体中,其发生重排时会丢失细胞外区域,重排位点主要见于32~36外显子[8]㊂有研究显示,N S C L C中R O S1基因主要和C D74㊁S L C34A 融合,可促使下游J A K/S T A T㊁P I3K/A K T等信号通路呈持续激活状态,继而促进肿瘤发生[9-10]㊂有研究显示,R O S1染色体重排在N S C L C中较少见,仅为1%~2%[11-12]㊂刘光峨等[13]对黔北地区N S C L C患者R O S1基因突变进行检测,显示R O S1基因突变率为1.2%㊂吴丹等[14]研究显示,N S C L C患者R O S1基因突变率为2.7%㊂本研究结果显示,285例N S C L C患者胸腔积液R O S1基因突变率为3.51% (10/285),略高于以往研究,可能与患者居住地㊁生活习惯有关㊂E G F R基因位于第7号常染色体7p12-14区,是人表皮生长因子受体家族成员之一,其发生突变或异常高表达均能够引发肿瘤[15]㊂E G F R基因突变主要区域为T K区域18~21外显子[16],本研究中, E G F R基因突变率为41.05%(117/285),19-D e l占比最高(48.72%),其次为L858R(38.46%)㊂鲁涛等[17]研究显示,N S C L C患者胸腔积液E G F R基因突变率为54.5%,且突变类型以19-D e l㊁L858R为主,可见尽管不同研究中N S C L C患者E G F R基因突变率存在差异,但总体而言E G F R基因突变率较高,且主要类型为19-D e l㊁L858R㊂有研究显示,R O S1㊁E G F R基因突变与性别㊁组织类型㊁地域等有关,多数R O S1㊁E G F R基因突变阳性者为女性㊁腺癌㊁东亚人群[18-19]㊂本研究结果中,女性㊁腺癌㊁无吸烟史的N S C L C患者R O S1㊁E G F R基因突变率高于男性㊁非腺癌㊁有吸烟史的N S C L C患者(P<0.05),但不同年龄㊁肿瘤最大径㊁解剖学部位㊁初诊T NM分期R O S1㊁E G F R基因突变率比较,差异均无统计学意义(P>0.05),提示性别㊁病理分型和吸烟史与R O S1㊁E G F R基因突变有关㊂R O S1㊁E G F R基因突变是造成患者预后不良的影响因素之一,采用分子靶向药物治疗存在R O S1㊁E G F R基因突变位点的患者,可以减少不良反应,有效提升患者治疗耐受性和生存质量,延长其无进展生存期㊂本研究对采用靶向治疗或化疗的伴有R O S1㊁E G F R基因突变的N S C L C患者治疗效果进行观察分析,发现R O S1基因突变阳性患者中,靶向治疗组O R R㊁D C R分别为42.86%㊁71.43%,高于化疗组的0.00%㊁33.33%,但差异无统计学意义(P>0.05),这可能与例数太少有关,提示通过靶向治疗有提高伴R O S1基因突变N S C L C患者的疗效的可能㊂E G F R基因突变阳性患者中,靶向治疗组O R R㊁D C R分别为61.25%㊁80.00%,高于化疗组的32.43%㊁51.35%,差异均有统计学意义(P<0.05),表明E G F R基因突变阳性患者采用靶向治疗可获得更好的效果㊂笔者还对治疗不良反应进行分析,显示伴R O S1基因突变的N S C L C患者靶向治疗组与化疗组不良反应发生率比较,差异无统计学意义(P>0.05),伴E G F R基因突变的N S C L C患者靶向治疗组恶心/呕吐㊁肝损害㊁骨髓抑制不良反应发生率均低于化疗组(P<0.05),提示伴有E G F R基因突变阳性的N S C L C患者行靶向治疗可以降低不良反应发生率㊂虽然本次研究中胸腔积液E G F R基因突变检测结果没有对应的肿瘤组织检测结果予以对比验证,但是该检测结果指导下的靶向治疗效果与过去在肿瘤组织检测结果指导下的靶向治疗效果相符[20],间接说明了在病理质控把关前提下的胸腔积液E G F R突变检测结果准确可靠,有确切的临床价值㊂综上所述,N S C L C患者胸腔积液检测可见R O S1㊁E G F R基因突变,其突变率分别为3.51%㊁41.05%,R O S1㊁E G F R基因突变与患者性别㊁病理分型和吸烟史等临床特征有关,且E G F R基因突变和疗效㊁不良反应存在关系㊂检测N S C L C患者胸腔积液能够有效指导N S C L C患者靶向治疗㊂本次研究也存在不足之处,纳入样本量相对较少,使R O S1基因突变阳性病例少,对研究结果会产生一定影响,还有待㊃4522㊃检验医学与临床2023年8月第20卷第15期 L a b M e d C l i n,A u g u s t2023,V o l.20,N o.15Copyright©博看网. All Rights Reserved.后续扩大样本量研究㊂参考文献[1]B R A Y F,F E R L A Y J,S O E R J OMA T A R AM I,e t a l.G l o b a l c a n c e r s t a t i s t i c s2018:G L O B O C A N e s t i m a t e s o fi n c i d e n c e a n d m o r t a l i t y w o r l d w i d e f o r36c a n c e r s i n185c o u n t r i e s:g l o b a l c a n c e r s t a t i s t i c s2018[J].C A C a n c e r JC l i n,2018,68(S u p p l8):394-424.[2]赫捷,李霓,陈万青,等.中国肺癌筛查与早诊早治指南(2021,北京)[J].中华肿瘤杂志,2021,43(3):243-268.[3]中国抗癌协会肺癌专业委员会,中华医学会肿瘤学分会肺癌学组.Ⅲ期非小细胞肺癌多学科诊疗专家共识(2019版)[J].中华肿瘤杂志,2019,41(12):881-890. [4]胡鹏程,耿僡临,魏慎海,等.晚期非小细胞肺癌靶向治疗的研究进展[J].山东医药,2020,60(16):102-106. [5]吴伟,曹紫阳,侯立坤,等.非小细胞肺癌液基细胞学标本用于分子检测前的评估体系及表皮生长因子受体突变状态检测[J].中华病理学杂志,2018,47(12):955. [6]袁世洋,贺荣芝,谢军平,等.非小细胞肺癌患者E G F R基因突变[J].中国老年学杂志,2019,39(18):4434-4437.[7]罗荣城,韩焕兴.肿瘤综合诊疗新进展[M].3版.北京:人民军医出版社,2003:75-88.[8]陶洁,薛淑萍,马晓梅.Ⅳ期肺腺癌患者R O S1基因状态与使用培美曲塞联合铂类方案化疗效果的关系[J].中国医药导报,2022,19(11):111-142.[9]江薇,王懿娜.R O S1融合基因突变在非小细胞肺癌诊断与治疗中的研究进展[J].中国肿瘤临床,2019,46(5): 257-262.[10]张晴,张杰.非小细胞肺癌中R O S1融合基因及其检测技术的应用进展[J].中华病理学杂志,2017,46(10):741-744.[11]白冬雨,张海萍,索文昊,等.非小细胞肺癌患者中E G F R突变㊁A L K和R O S1融合基因表达变化及其临床病理学意义[J].中国组织化学与细胞化学杂志,2019,28(1):32-36.[12]王文娴,许春伟,宋勇.非小细胞肺癌R O S1融合基因少见融合伙伴的故事[J].循证医学,2019,19(2):10-11.[13]刘光峨,杨玲,李佩洁,等.贵州黔北地区922例非小细胞肺癌E G F R㊁A L K㊁R O S-1基因突变状态及其临床病理特征分析[J].中华肿瘤防治杂志,2020,27(21):1691-1697.[14]吴丹,李静,姚梅宏,等.非小细胞肺癌表皮生长因子受体,间变性淋巴瘤激酶,R O S1基因突变及突变共存的临床病理学意义[J].中华病理学杂志,2021,50(3):251-253.[15]李文生,郑幼伟,孙君军,等.结肠癌组织表皮生长因子受体的表达及其临床意义[J].中华实验外科杂志,2019,36(7):1299-1301.[16]周建平,徐德,王代文,等.非小细胞肺癌患者癌组织表皮生长因子受体基因18~21号外显子的碱基序列突变情况观察[J].山东医药,2018,58(31):1-4.[17]鲁涛,李强,李岚,等.132例晚期非小细胞肺癌胸腔积液E GF R基因突变检测结果及其临床意义:一项来自单中心的回顾性研究[J].中国肺癌杂志,2020,23(12):1059-1065.[18]贺荣芝,刘川,蔡婧,等.非小细胞肺癌E G F R,A L K,R O S1基因突变和临床病理特征分析[J].临床与实验病理学杂志,2019,35(7):843-845.[19]黄清洁,陈天东,陈海瑞,等.基于二代测序的300例非小细胞肺癌中驱动基因突变与临床病理特征的关系[J].临床与实验病理学杂志,2019,35(3):286-290. [20]S H I Y K,WA N G L,HA N B H,e t a l.F i r s t-l i n e i c o t i n i bv e r s u s c i s p l a t i n/p e m e t r e x e d p l u s p e m e t r e x e d m a i n t e-n a n c e t h e r a p y f o r p a t i e n t s w i t h a d v a n c e d E G F R m u t a-t i o n-p o s i t i v e l u n g a d e n o c a r c i n o m a(C O N V I N C E):a p h a s e3,o p e n-l a b e l,r a n d o m i z e d s t u d y[J].A n n O n c o l, 2017,28(10):2443-2450.(收稿日期:2022-12-18修回日期:2023-05-15)(上接第2249页)民卫生出版社,2015:109-111.[6]郑筱萸.中药新药临床指导原则[M].北京:中国医药科技出版社,2002:473-475.[7]赵辨.湿疹面积及严重度指数评分法[J].中华皮肤科杂志,2004,37(1):3-4.[8]刘怡均,林向英,张燕.中文版世界卫生组织生存质量测定量表简表用于终末期肾病的信效度验证[J].首都医科大学学报,2021,42(4):635-641.[9]费晓影,王思农,王亚红,等.藏药二十五味儿茶凝胶对慢性湿疹模型大鼠血清中C C L17及C C L18表达的影响[J].中医药信息,2021,38(12):31-35.[10]L I Y,L I M,Z HO U B,e t a l.E f f i c a c y a n d s a f e t y o f q i n g-p e n g o i n t m e n t f o r s u b a c u t e a n d c h r o n i c e c z e m a:a s y s t e m-a t i c r e v i e w a n d m e t a-a n a l y s i s[J].B i o m e d R e s I n t,2021, 95(11):1-14.[11]尚佩生,詹明峰,沈晓峰.皮炎洗剂联合地奈德乳膏治疗亚急性湿疹的疗效观察[J].中国中医急症,2018,27(2): 329-331.[12]张丽红,闫志华,方明,等.中医祛风除湿法治疗慢性湿疹疗效及对血嗜酸性粒细胞和免疫功能的影响[J].现代中西医结合杂志,2021,30(6):662-665.[13]林红燕,王煊,何聪,等.中药植物紫草天然产物的生物合成及其功能研究进展[J].遗传,2021,43(5):459-472.[14]金阳,葛金环,刘思琦,等.当归多糖的化学结构㊁药理作用及构效关系研究进展[J].中医药信息,2022,39(2):69-77.[15]张梦鸽,徐菁,陈彦蓉,等.基于远期疗效优势的温阳健脾益肺固本方治疗慢性湿疹疗效观察[J].现代中西医结合杂志,2022,31(10):1342-1346.(收稿日期:2023-02-10修回日期:2023-06-11)㊃5522㊃检验医学与临床2023年8月第20卷第15期 L a b M e d C l i n,A u g u s t2023,V o l.20,N o.15Copyright©博看网. All Rights Reserved.。
EGFR突变阳性的晚期NSCLC治疗全程化管理教学课件ppt

随着医疗技术的不断进步,新的药物和治疗手段 的研发将为NSCLC的治疗带来巨大的机遇。
对临床医生和患者的建议
临床医生需要不断了解最新的治疗进展和指南推荐,以 便为患者提供最佳的治疗方案。
患者需要积极配合医生的治疗建议,同时要关注自身的 生活质量,加强自我管理和预防措施。
针对EGFR突变阳性晚期NSCLC患者,建议采用多学科联 合治疗模式,以提高治疗效果和生活质量。
免疫治疗
PD-1/PD-L1抑制剂,如帕博西尼、 纳武单抗、卡瑞珠单抗等。
化疗
选择以铂类为基础的联合化疗方案 ,如培美曲塞+卡铂等。
其他治疗
放疗、介入治疗等。
联能增加不良反应的风险。
耐药性问题
靶向治疗一段时间后可能产生 耐药性,需更换其他治疗方案
探讨治疗过程中可能遇到的问题及处理方法
阐述治疗原则、策略、药物选择及疗效评估 分享临床典型案例,加深学员理解
NSCLC的简介
1
NSCLC是肺癌的一种病理组织类型,约占所有 肺癌的80%-85%
2
晚期NSCLC指已经出现远处转移或局部晚期无 法手术的患者
3
晚期NSCLC的5年生存率仅为5%-10%
EGFR突变的定义和重要性
THANKS
感谢观看
01
EGFR是肺癌中常见的致癌基因之一,突变后可导致细胞异常 增殖和转移
02
EGFR突变阳性是指肺癌组织中存在EGFR基因的突变,通常为
T790M、L858R等位点
EGFR突变在NSCLC中发生率约为10%-20%,与患者预后及
03
治疗反应密切相关
02
EGFR突变阳性晚期NSCLC治疗现状
传统治疗手段及效果
肺癌 egfr突变 细胞系

肺癌 egfr突变细胞系(实用版)目录1.介绍肺癌和 EGFR 突变的基本概念2.阐述 EGFR 突变在肺癌诊断和治疗中的重要性3.介绍肺癌细胞系及其在 EGFR 突变研究中的应用4.总结肺癌 EGFR 突变的研究进展和挑战正文肺癌是全球癌症死亡率最高的疾病之一,其中非小细胞肺癌(NSCLC)占所有肺癌的 80-85%。
表皮生长因子受体(EGFR)突变是 NSCLC 的一个重要分子生物学特征,对于诊断、治疗和预后具有重要的临床意义。
EGFR 是一种跨膜受体,激活后可引发细胞内信号通路,促进细胞生长、增殖和分化。
在 NSCLC 患者中,EGFR 突变会导致信号通路过度激活,从而促进肿瘤发生、发展和转移。
因此,检测 EGFR 突变对于 NSCLC 的诊断、治疗和预后具有重要价值。
肺癌细胞系是研究肺癌发生机制和药物筛选的重要模型。
在这些细胞系中,EGFR 突变的表达和活性可以通过基因工程技术进行调控,为研究EGFR 突变在肺癌发病机制中的作用提供了有力的工具。
同时,肺癌细胞系也可以用于筛选和评估针对 EGFR 突变的药物,为肺癌治疗提供新的靶点和策略。
近年来,随着分子生物学和基因组学技术的发展,肺癌 EGFR 突变的研究取得了显著进展。
研究人员已经识别出多种 EGFR 突变亚型,如 19 外显子缺失、21 外显子 L858R 点突变和 20 外显子插入突变等。
这些突变亚型的发现为肺癌的精确诊断和治疗提供了新的生物标志物和靶点。
然而,肺癌 EGFR 突变的研究仍然面临诸多挑战。
例如,EGFR 突变的异质性强,不同亚型之间的生物学特性和药物敏感性差异较大。
此外,针对 EGFR 突变的药物治疗也存在耐药性和毒副作用等问题。
因此,进一步研究肺癌 EGFR 突变的分子机制、药物筛选和个体化治疗策略仍然是当前肺癌研究的重要方向。
总之,EGFR 突变在肺癌诊断和治疗中具有重要作用。
晚期非小细胞肺癌靶向治疗进展

晚期非小细胞肺癌靶向治疗进展化疗对晚期NSCLC的疗效已达到平台期,患者很难再从化疗中进一步获益。
随着肿瘤分子生物学研究的深入,靶向治疗的研究和临床应用已成为当前肺癌领域的热点,对接受EGFR-TKI治疗的EGFR突变的NSCLC患者,无论是有效率还是生存期以及生活质量都远远超过当前单纯化疗的水平,又一新的靶点EML4-ALK阳性的靶向药物Crizotinib治疗晚期NSCLC患者的有效率高达80%以上,肺癌的新的驱动基因EGFR-1、ROS1、mTOR、DDR2、PIK3CA、MEK 等的发现,相应的靶向治疗药物不断开发成功,肺癌的治疗才是真正的走向基因指导下的个体化治疗新时代。
现对当前晚期NSCLC靶向治疗的现状总结如下。
标签:晚期非小细胞肺癌;靶向治疗;基因;进展在世界范围内,无论是发病率还是死亡率,肺癌均居恶性肿瘤首位,一旦发现,约80%肺癌为晚期,失去了手术机会,并且非小细胞肺癌(NSCLC)约占肺癌的80%。
第三代新药联合铂类二药化疗方案是治疗晚期NSCLC的标准方案,但疗效达到一个平台期,其总体有效率(RR)为25%~35%,至疾病进展时间(TTP)4~6个月,中位总生存期(OS)8~10个月,患者似乎很难再从化疗中进一步获益。
随着肿瘤分子生物学研究的深入,靶向治疗的研究和临床应用已成为当前肺癌领域的热点,包括表皮生长因子受体-酪氨酸激酶抑制剂(EGFR-TKI)、抑制肿瘤血管生成药物、抗EGFR单克隆抗体以及棘皮动物微管相关蛋白样4-间变淋巴瘤激酶(EML4-ALK)抑制剂等等。
2009年Jackman 等[1]分析了5项临床试验,旨在研究EGFR和K-RAS突变对晚期NSCLC患者的影响,结果表明:无论是有效率还是生存期,TKI都远远超过当前单纯化疗的水平,EGFR突变的NSCLC患者接受TKI治疗的RR达67%,OS约为24个月。
这使我们相信,靶向治疗正在引领肺癌走向真正个体化治疗的时代。
EGFR敏感突变晚期NSCLC的一线治疗,各大指南共识是如何推荐的?
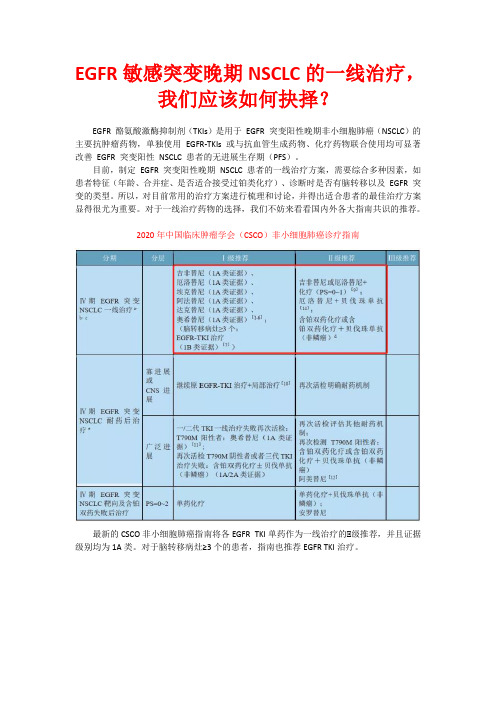
EGFR敏感突变晚期NSCLC的一线治疗,我们应该如何抉择?EGFR 酪氨酸激酶抑制剂(TKIs)是用于EGFR 突变阳性晚期非小细胞肺癌(NSCLC)的主要抗肿瘤药物,单独使用EGFR-TKIs 或与抗血管生成药物、化疗药物联合使用均可显著改善EGFR 突变阳性NSCLC 患者的无进展生存期(PFS)。
目前,制定EGFR 突变阳性晚期NSCLC 患者的一线治疗方案,需要综合多种因素,如患者特征(年龄、合并症、是否适合接受过铂类化疗)、诊断时是否有脑转移以及EGFR 突变的类型。
所以,对目前常用的治疗方案进行梳理和讨论,并得出适合患者的最佳治疗方案显得很尤为重要。
对于一线治疗药物的选择,我们不妨来看看国内外各大指南共识的推荐。
2020年中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南最新的CSCO非小细胞肺癌指南将各EGFR TKI单药作为一线治疗的Ⅰ级推荐,并且证据级别均为1A类。
对于脑转移病灶≥3个的患者,指南也推荐EGFR TKI治疗。
中华医学会肺癌临床诊疗指南(2019版)对于EGFR敏感驱动基因阳性患者的一线治疗,中华医学会肺癌临床诊疗指南(2019版)推荐使用EGFR TKI,包括吉非替尼、厄洛替尼、埃克替尼、阿法替尼、奥希替尼(1类推荐证据),脑转移患者优先推荐奥希替尼(2A类推荐证据),无脑转移者也可使用达可替尼2A 类推荐证据);对于G719X、L861Q、S768I等少见突变的患者,首先推荐阿法替尼。
一线已经开始化疗的过程中发现EGFR驱动基因阳性的患者,推荐完成常规化疗(包括维持治疗)后换用EGFR TKI,或者中断化疗后开始靶向治疗(2A类推荐证据)。
第17届中国肺癌高峰论坛专家共识近期公布的第17届中国肺癌高峰论坛专家共识,对EGFR敏感突变晚期NSCLC患者进行了进一步的细化。
共识指出,需要细分EGFR敏感突变的两个亚型(Exon 19Del和Exon 21 L858R)和是否伴有脑转移,分别给予不同的治疗:对于Exon 19Del,优先推荐奥希替尼或阿法替尼;对于Exon 21 L858R突变,优先推荐达可替尼、厄洛替尼+贝伐珠单抗或埃克替尼;对于脑转移患者,优先推荐奥希替尼、埃克替尼。
EGFR突变NSCLC治疗之中国专家共识

EGFR突变NSCLC治疗之中国专家共识来自于:医学论坛网2011-10-11分享编辑:陈蒙9月3-4日,第3届中德肺癌论坛在上海举行。
在为期两天的论坛中,数十位国内外知名肺癌专家对2011年全球肺癌领域的学术热点、难点进行年度盘点,并和与会人士展开全面的交流和讨论。
广东省人民医院的吴一龙教授报告了表皮生长因子受体(EGFR)突变非小细胞肺癌(NSCLC)治疗的中国专家共识。
众所周知,EGFR突变型肺癌是非小细胞肺癌中的一个特殊类型,这种肺癌的癌细胞依靠“EGFR通路”维持生长、增殖和转移等生物学行为。
国内外关于这种肺癌治疗的研究很多,在越来越多的临床研究的基础上,中国的肺癌专家对其治疗已经形成共识。
EGFR突变的NSCLC可以从EGFR-酪氨酸激酶抑制剂(TKI)治疗中获益,且将其作为一线药物治疗EGFR突变的患者,相比传统的化疗可以取得更长的无进展生存期(PFS)且副作用相对较小,患者容易耐受,但总体生存期(OS)并未延长。
EGFR-TKI目前主要用于NSCLC一线、二线和维持治疗。
据调查,我国大部分医生将其用于二线(69.4%)治疗,但亦有41.7%的医生将其用于一线治疗,另外,27.8%的医生将其作为维持治疗药物。
目前支持其用于一线治疗的临床研究有亚洲的IPASS研究、日本的WJTOG3405和NEG002研究以及中国的OPTIMAL研究等。
IPASS研究因入选的患者为亚裔、女性和非吸烟(或轻度吸烟)的患者,其EGFR的突变率相对较高,可以达到60%。
结果发现,在EGFR突变阳性的患者中,一线使用吉非替尼比传统化疗的患者PFS显著延长(P<0.0001),而在EGFR突变阴性的患者中,使用吉非替尼比传统化疗的患者PFS显著缩短(P<0.0001)。
随后,韩国的First-Signal研究入选了和IPASS研究相似的人群,证实了IPASS研究结果的可重复性。
WJTOG3405研究是一项前瞻性随机对照研究,入选了被证实是EGFR突变的患者,一组一线接受吉非替尼治疗,另外一组接受传统化疗,结果显示,吉非替尼组和化疗组PFS分别为9.2个月和6.3个月(P<0.001),但是二者的OS 无差异(吉非替尼组30.9月对化疗组未达到,P=0.211)。
EGFR基因突变与酪氨酸激酶抑制剂治疗晚期非小细胞肺癌的疗效和预后的关系的开题报告

EGFR基因突变与酪氨酸激酶抑制剂治疗晚期非小细胞肺癌的疗效和预后的关系的开题报告一、研究背景肺癌是全球最常见的恶性肿瘤之一,其中非小细胞肺癌(Non-Small Cell Lung Cancer, NSCLC)占有绝大多数,而晚期NSCLC治疗仍然是一个难题。
EGFR基因突变是NSCLC的一个重要分子标志物,约有15%的NSCLC患者存在EGFR基因突变,这一变异会影响到酪氨酸激酶抑制剂(Tyrosine Kinase Inhibitor, TKI)的疗效和预后结果,但是EGFR突变的变异类型和其对治疗的影响目前还存在许多争议。
二、研究目的本研究的目的是探究EGFR基因突变类型与酪氨酸激酶抑制剂治疗晚期NSCLC的疗效和预后的关系,为NSCLC的个体化治疗提供科学依据。
三、研究内容和方法1. 研究对象:收集2010年至2020年间在XXX医院诊断为晚期NSCLC并进行EGFR基因检测、接受过TKI治疗的患者共计150例。
2. 数据收集:通过患者病历、影像学数据和实验室检查结果等进行收集,包括基本属性(性别、年龄、病理类型、分期等)、EGFR突变类型、治疗方案、药物剂量、治疗时长等信息。
3. 研究方法:使用SPSS 22.0数据分析软件对收集到的数据进行分析。
通过对不同EGFR突变类型和治疗方案的比较,分析EGFR突变类型与TKI治疗晚期NSCLC效果的相关性。
同时,通过生成生存曲线、Cox回归分析等方法,分析EGFR突变类型与患者预后的关系。
四、预期结果和意义本研究可以深入探究EGFR基因突变类型与TKI治疗的晚期NSCLC的预后,为晚期NSCLC患者治疗提供个体化的治疗选择和对病情的预测,有助于进一步提高晚期NSCLC患者的生存质量和治疗效果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
切中要害:EGFR突变NSCLC的治疗进展编译:月下荷花来源:肿瘤资讯肺癌是癌症死亡的主要原因,占所有癌症死亡的18.4%。
非小细胞肺癌(NSCLC)占所有肺癌85%,肺腺癌占所有肺癌40%,多由突变所驱动,并据此划分为不同分子亚群,最常改变的基因为EGFR (10%-35%)、KRAS(25%-30%)、FGR(20%)、ALK(3%-7%)、MET(2%-4%)、BRAF(1%-3%)、ROS1(1%-3%)和RET(1%-3%),部分分子亚群已有批准的靶向治疗,部分分子亚群的治疗正在研究中,如EGFR 20外显子插入突变、18外显子改变和HER2扩增NSCLC。
本文将着重介绍相对常见的肺癌驱动突变的靶向治疗及其发展方向。
EGFR突变EGFR信号通路突变在NSCLC的发生发展中非常重要,其激酶活化突变或EGFR表达增加导致EGFR途径功能上调,使得突变肿瘤细胞不受控制的增殖。
EGFR突变多见于腺癌、不吸烟者、女性、亚裔。
EGFR突变主要发生在酪氨酸激酶域18-21外显子区,19外显子缺失和21外显子L848R突变代表了多数EGFR突变。
识别特定EGFR突变很重要,包括敏感突变、原发耐药突变、新发和获得性耐药突变。
EGFR突变检测是NSCLC诊断评估标准,EGFR突变存在与否极大的影响了治疗选择。
研究表明,12%-34%EGFR突变NSCLC患者携带非典型或罕见EGFR突变。
罕见EGFR突变表现多样,包括各种点突变和18-21外显子插入突变,其中最常见的是20外显子插入突变(9%)和18外显子点突变G719S/A/C(统称为G719×,占11.5%)、20外显子S768I (5.5%),21外显子L861Q(5.85%)。
部分罕见突变NSCLC采用酪氨酸激酶抑制剂(TKIs)治疗有获益,如G719×、A768I和L861Q 点突变,但也有罕见EGFR突变对TKIs治疗不敏感,如EGFR20外显子插入突变(约占EGFR突变9%)通常对标准EGFR TKIs耐药,阿法替尼客观缓解率(ORR)11%,吉非替尼/厄洛替尼0%,平均无进展生存(PFS)不足2个月。
类似于其他常见突变(ALK、KRAS、常见EGFR突变)驱动的NSCLC,罕见EGFR突变NSCLC采用免疫检查点抑制剂治疗疗效较差,常见突变驱动的NSCLC患者免疫治疗的中位PFS为2.8个月,EGFR 20外显子插入突变患者的中位PFS为2.7个月。
因此非常有必要识别治疗相关致癌驱动突变,明确哪些靶向治疗敏感,确定原发耐药机制,发现新的和获得性耐药突变。
推荐生物标志物检测,确定EGFR特异性突变以指导靶向治疗。
NCCN指南推荐,转移性NSCLC明确组织学亚型后,应对合格患者进行生物标志物检测。
非鳞状NSCLC应检测EGFR、ALK、ROS1、KRAS、BRAF、RET、MET 14外显子跳跃、NTRK 1/2/3和PD-L1。
ASCO还推荐对任何非鳞状NSCLC、任何有腺癌成分的组织、临床/人口统计学特征提示有可能存在生物标志物驱动的恶性肿瘤(如年龄≤50岁,从不吸烟或轻度吸烟)均应进行突变检测。
通常更推荐使用大的生物标志物组合初筛,以发现罕见EGFR突变。
EGFR突变检测可以使用组织或血液进行,两种方法各有优缺点。
组织检测敏感度高,新诊断患者的组织容易获取。
理想情况下应采用二代测序组合,因其可检测出罕见的和既往缺少特征性的改变,单基因检测只能确定常见EGFR突变。
缺点是组织标本有时可能不充足或缺少肿瘤细胞,且多不能反映肿瘤的异质性,而且需要2-4周才能完成DNA测序。
血液突变检测快速无创,其主要优点是容易检测到常见和罕见突变。
主要缺点是不及组织检测敏感,因其依赖于脱落到外周循环的DNA,且花费不菲,保险多不能全面覆盖。
组织活检标本不足或无法获得时,液体活检是一种可替代的选择,对新出现的耐药机制可快速评估。
IASLC小组制定的根据液体检测结果确定初治晚期NSCLC靶向治疗的指南建议:优先检测手术(活检)标本,根据是否存在致癌驱动突变进行相应的标准治疗;如果组织标本不足以进行分子检测,则可进行液体活检的分子分析;优选二代测序组合,如果不具备二代测序检测,其他检测至少应包括EGFR、ALK、ROS1和BRAF,根据结果选择标准治疗;鉴于液体活检假阴性率较高,阴性结果时应重新进行组织活检和分子分析;所有NSCLC组织标本均采用免疫组化方法检测PD-L1。
少见EGFR突变的靶向治疗进展对NSCLC罕见EGFR突变生物学的了解有助于特定类型突变靶向治疗的发展。
靶向EGFR点突变(G719×、S768I和L861Q)的三代TKIs和用于20外显子插入突变的治疗手段都已可用或正在研发中。
靶向18外显子和HER2突变的治疗也在研发中。
以下介绍了新的EGFR 靶向治疗的临床数据。
1. EGFR点突变(1)阿法替尼阿法替尼是二代不可逆ErbB阻滞剂,最初获FDA批准治疗铂类化疗后进展的EGFR 19外显子缺失或21外显子替代突变的NSCLC。
2018年1月适应证扩大到治疗3种不典型EGFR点突变(S768I L861Q和/或G719×)转移NSCLC,该适应证获批主要基于汇总分析结果。
32例NSCLC患者的突变包括G719×(S、A、C、D替代)、S768I和L861Q,可以与其他点突变合并存在,阿法替尼40mg或50mg/d治疗,证实的ORR为66%(95% CI,47-81),21例缓解患者中,52%的缓解持续时间≥12个月,33%患者的缓解持续时间≥18个月。
Ⅱ期LUX-Lung 2研究、随机Ⅲ期LUX-Lung 3和LUX-Lung 6 研究的post hoc分析显示,阿法替尼治疗的EGFR突变晚期(Ⅲb-Ⅳ期)肺癌中,12%(75/600例)携带罕见EGFR突变。
1组(n=38)罕见EGFR突变包括18-21外显子单独点突变或重复突变(L861Q、G719S、G719A、G719C、S768I)或联合改变,2组(n=14)罕见EGFR突变包括20外显子单独新发T790M突变或联合其他突变,3组(n=23)为20外显子插入突变。
1组患者阿法替尼治疗反应最显著,ORR为71.1%(23/38例),中位PFS为10.7个月,中位总生存(OS)为19.4个月。
随后的一项汇总分析评估了多种类型研究中共计693例罕见EGFR 突变NSCLC患者采用阿法替尼治疗的临床疗效,结果发现,阿法替尼对主要罕见突变(G719×、L861Q、S768I)和复合EGFR突变的TKI初治患者具有强烈的治疗活性。
主要罕见突变患者的ORR为60%(n=110),复合突变患者的ORR为77%(n=35),治疗失败时间分别为10.8个月和14.7个月。
(2)奥希替尼奥希替尼是三代不可逆EGFR TKI,FDA批准多种NSCLC治疗适应证,包括EGFR突变转移性NSCLC EGFR抑制剂治疗后发生T790M 突变,一线转移性肿瘤治疗,EGFR19外显子缺失或21外显子L858R 突变NSCLC切除术后的辅助治疗。
ASCO和安大略健康指南推荐奥希替尼一线治疗19外显子缺失、21外显子 L858R和20外显子T790M 突变患者。
I期AURA研究采用免疫组化分析评估关键通路和肿瘤标志物,如磷酸化EGFR、磷酸化S6、磷酸化AKT、PD-L1和CD8。
AURA研究表明,奥希替尼调节EGFR关键信号通路,增加免疫细胞浸润。
Ⅲ期AURA3研究纳入419例 EGFR TKI一线治疗后肿瘤发生EGFR T790M 突变的转移性NSCLC患者,比较奥希替尼与铂-培美曲塞化疗,奥希替尼显著改善中位PFS,从化疗的4.4个月到奥希替尼的10.1个月(风险比[HR],0.30,P<0.001),ORR也是奥希替尼组更好(71%和31%,P<0.001)。
重要的是,奥希替尼可显著改善中枢神经系统转移患者的中位PFS,且3级不良事件发生率较低。
Ⅲ期随机双盲FLAURA研究纳入556例初治EGFR突变(19外显子缺失或L858R)晚期NSCLC患者,给予奥希替尼80mg/d口服或标准TKI(吉非替尼250mg/d或厄洛替尼150mg/d口服)治疗,结果奥希替尼组的中位PFS显著延长(18.9个月和10.2个月,疾病进展或死亡的HR为0.46,95%CI,0.37-0.57,P<0.001)。
奥希替尼和标准TKI组的ORR相似(80%和76%),中位缓解持续时间分别为17.2和8.5个月,中位治疗暴露持续时间为20.7和11.5个月。
数据截止时,分别有22%和5%的患者继续接受分配的治疗。
次要终点中位OS奥希替尼组38.6个月(95% CI,34.5-41.8),标准TKI组31.8个月(95% CI,26.6-36.0)(死亡HR 0.80,95%CI 0.64-1.00,P=0.046)。
12、24和36个月时的OS率和继续接受一线研究治疗的患者数量以奥希替尼组更高。
≥3级不良事件奥希替尼组较低(42%和47%)。
基于对多种EGFR突变患者的疗效,目前正在评估奥希替尼治疗罕见EGFR点突变的疗效。
一项Ⅱ期研究纳入36例罕见EGFR突变复发转移NSCLC患者,包括G719×(n=19)、L861Q(n=9)和S768I (n=8),奥希替尼治疗后ORR分别为53%、78%和38%,PFS分别为8.2、15.2和12.3个月。
2. 20外显子插入突变EGFR 20外显子插入突变是第二常见的EGFR突变,占所有EGFR 突变的10%-12%,一代、二代和三代EGFR TKIs耐药,主要源于20外显子插入突变诱导药物结合袋的空间位阻。
但研究表明,具有伸展性的小喹唑啉衍生物(如阿法替尼)可能能够抑制20外显子插入突变,因为他们能适应位阻绑定口袋,而不具有伸展性的大药物基团(如厄洛替尼)不能到达C797残基,不能抑制20外显子插入突变。
与其他EGFR突变NSCLC相比,20外显子插入突变NSCLC预后更差,其现有TKI靶向治疗疗效远不如经典EGFR突变。
一项Ⅱ期研究评估了三代EGFR TKI奥希替尼160mg/d治疗21例20外显子插入突变NSCLC患者的疗效,结果显示奥希替尼具有一定活性,ORR为25%,中位PFS为9.7个月(95% CI,4.07-NA)。
与19和21外显子的经典EGFR突变相比,20外显子突变患者可从免疫检查点抑制剂治疗中获益更多,但仍很有限(中位PFS约2个月),且治疗相关不良事件风险很高。
尽管评估了多种20外显子插入突变的治疗方法,目前标准治疗仍是含铂化疗。
对突变生物学理解的提高促进了20外显子插入突变靶向治疗的发展,首个20外显子插入突变靶向药物amivantamab已获批二线治疗。
