八年级科学下册2_3原子结构的模型第2课时练习新版浙教版
(部编版)2020八年级科学下册2.3原子结构的模型第2课时练习新版浙教版61

第3节原子结构的模型姓名学号一、我学会了1、钠在氯气中燃烧的现象:燃烧,发出火焰,生成固体。
氯气是色气体。
钠是具有的固体。
2、离子是原子或。
带的离子称为。
带的离子称为。
离子所带的电荷数取决于的数目。
离子与原子之间的转换可以通过来实现。
3、构成物质的微粒有:、、。
大多数物质是由构成的;是化学变化中的最小微粒;硫酸铜是由和构成的。
4、把具有相同(即质子数)的同一类原子总称为。
目前人类已知的元素有多种。
5、原子中核内质子数、中子数的同类原子互为同位素原子。
氢元素也有3种同位素原子,分别称、、。
同位素原子在、、、等方面有着广泛的应用。
二、我理解了6.物质是由原子、分子、离子等粒子构成的,有一粒子,其原子核内有16个质子、 16个中子,原子核外有18个电子,该粒子是---------------------------------()A. 原子B. 阳离子C. 阴离子D. 分子7.下列有关微粒的说法错误的是------------------------------------------------------()A. 离子带电,但由离子构成的物质不带电B. 钠原子失去1个电子形成钠离子C. 硫酸铜晶体就是由铜原子和硫酸根离子构成的D. 离子能通过得失电子转化为原子8.科学家成功合成了第117号新元素,填补了第116号和118号元素之间的空缺。
推测该元素为117号元素的依据是---------------------()A. 中子数B. 质子数C. 电子数D. 中子数和质子数9.日本大地震引发了核泄漏事故。
事故发生时,放射性原子氮16可能短暂存在。
氮16原子的质子数为7,中子数为9。
下列有关氮16原子的说法正确的是-------------------------------------------------------------------------------------() A.核外电子数为9 B.核电荷数为9C.和普通氮原子是相同的原子 D.和普通氮原子属于同种元素10.科学上常用元素符号左下角的数字表示原子的质子数,左上角的数字表示原子的中子数与质子数之和,如 613C表示核内有6个质子和7个中子的碳原子。
浙教版八年级下册科学 2.3 原子结构的模型练习(包含答案)
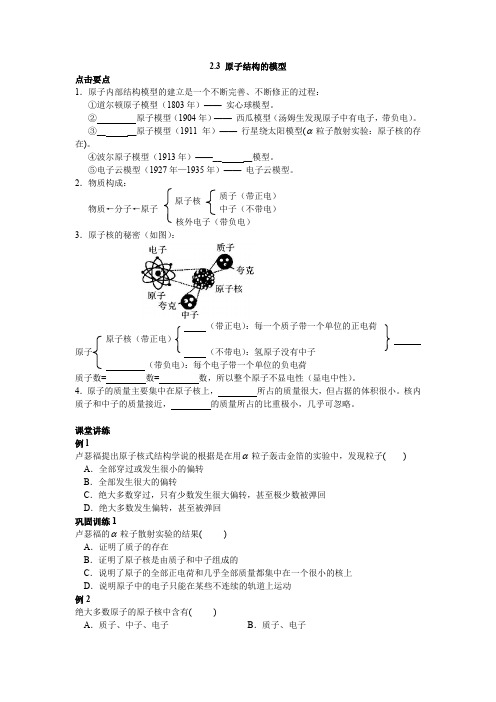
2.3 原子结构的模型点击要点1.原子内部结构模型的建立是一个不断完善、不断修正的过程:①道尔顿原子模型(1803年)—— 实心球模型。
②原子模型(1904年)—— 西瓜模型(汤姆生发现原子中有电子,带负电)。
③__ __原子模型(1911年)—— 行星绕太阳模型(α粒子散射实验:原子核的存在)。
④波尔原子模型(1913年)——__ __模型。
⑤电子云模型(1927年—1935年)—— 电子云模型。
2.物质构成:质子(带正电)物质←分子←原子中子(不带电)核外电子(带负电)3.原子核的秘密(如图):(带正电):每一个质子带一个单位的正电荷原子核(带正电)原子(不带电):氢原子没有中子(带负电):每个电子带一个单位的负电荷质子数= 数= 数,所以整个原子不显电性(显电中性)。
4.原子的质量主要集中在原子核上,所占的质量很大,但占据的体积很小。
核内质子和中子的质量接近,的质量所占的比重极小,几乎可忽略。
课堂讲练例l卢瑟福提出原子核式结构学说的根据是在用α粒子轰击金箔的实验中,发现粒子( ) A.全部穿过或发生很小的偏转B.全部发生很大的偏转C.绝大多数穿过,只有少数发生很大偏转,甚至极少数被弹回D.绝大多数发生偏转,甚至被弹回巩固训练1卢瑟福的α粒子散射实验的结果( )A.证明了质子的存在B.证明了原子核是由质子和中子组成的C.说明了原子的全部正电荷和几乎全部质量都集中在一个很小的核上D.说明原子中的电子只能在某些不连续的轨道上运动例2绝大多数原子的原子核中含有( )A.质子、中子、电子B.质子、电子原子核C.中子、电子D.质子、中子巩固训练2下列关于原子的叙述正确的是( )A.原子是不能再分的微粒B.一切物质都是由原子直接构成的C.一切原子的原子核由质子和中子构成D.对原子而言,核内质子数必等于核外电子数跟踪演练一、选择题1.原子模型帮助科学家成功解释了物质具有的各种性质,随着科学研究的深入,原子模型也不断改变,下列模型中建立最早的是( )A.卢瑟福模型B.道尔顿模型C.波尔模型D.汤姆生模型2.依据卢瑟福的原子行星模型理论,在原子中绕核高速旋转的是( )A.核子B.电子C.质子D.中子3.原子的质量主要集中在( )A.质子B.原子核C.中子D.电子4.假如把原子放大到一个大型运动场的话,那么原子核就像运动场内的( )A.一粒芝麻B.一只乒乓球C.一只篮球D.一头水牛5.下列氢原子的各种模型图中,正确的是( )6.下列关于原子的叙述正确的是( )A.原子是不能再分的微粒B.原子的质量等于原子核的质量C.一切原子的原子核由质子和中子构成D.对原子而言,核内质子数必等于核外电子数7.已知某原子的原子核所带正电荷数为A,该原子核内有B个质子和C个中子,核外有D 个电子,则( )A.A=B=C B.B=C=DC.A=C=D D.A=B=D8.下列叙述正确的是( )A.汤姆生建立的“汤姆生模型”认为原子核像太阳,电子像行星绕原子核运行B.卢瑟福建立的“卢瑟福模型”认为电子像云雾一样出现在原子核周围C.波尔建立的“分层模型”认为电子在原子核周围分层运动D.现代科学家认为电子像西瓜籽似地嵌在原子中9.下列粒子:夸克、原子、质子、原子核,按空间尺度由小到大进行正确排列的是( ) A.夸克、质子、原子核、原子B.原子、原子核、质子、夸克C.原子、质子、原子核、夸克D.质子、夸克、原子、原子核10.钛和钛合金被认为是21世纪的重要金属材料,它们具有熔点高、密度小、抗腐蚀性能好等优良性能,因此被广泛用于火箭、航天飞机、船舶和化工等。
初中浙教版科学八年级下册第2章 第3节 原子结构的模型 练习

原子构造的模型第1课时原子的构造知识点❶原子构造模型及其开展过程1.汤姆生最早发现了原子中存在一种带负电荷的粒子,证明了原子是可以再分的。
汤姆生发现的这一粒子是()A.原子核B.质子C.电子D.中子2.卢瑟福的α粒子轰击金箔实验推翻了汤姆生在1903年提出的原子构造模型,为建立现代原子构造理论打下了根底。
如图B2-3-1所示线条中,可能是α粒子(带正电)在该实验中的运动轨迹的是()图B2-3-1A.abcd B.abc C.bcd D.ad子(带正电荷)散射实验中,断定原子中的绝大局部空间是空的,他的依据是()A.α粒子受到金原子的作用,改变了原来的运动方向B.α粒子受到金原子内的电子吸引,改变了原来的运动方向C.α粒子中的绝大多数通过金箔并按原来方向运动D.α粒子会激发金原子释放出原子内的电子4.原子构造模型的建立,经过了几代科学家艰辛努力,直到现在仍在探索中。
其中,行星模型的提出标志着原子构造的现代模型的问世,如图B2-3-2是锂原子构造的行星模型,图中原子核内有3个质子、4个中子。
不能根据原子构造的行星模型得出的结论是()图B2-3-2A.原子始终在做无规那么的运动B.原子核体积只占整个原子体积的很小一局部C.构成原子核的粒子之间存在一种互相吸引的力D.原子呈电中性知识点❷原子核的秘密5.以下三种粒子:①质子、②中子、③电子,在原子中一定存在的是()A.①③B.②③C.①②D.①②③6.据科学家预测,月球的土壤中吸附着数百万吨的氦(He——3的相对原子质量为3),每百吨氦核聚变所释放出的能量相当于目前人类一年消耗的能量,可用于解决地球能源危机。
氦(He——3)原子核内质子数为2,那么其原子核内中子数为()A.2 B.1 C.3 D.57.关于原子的表达正确的选项是()A.一切原子的原子核内都有质子和中子B.原子中没有带电荷的粒子,所以原子不显电性C.原子是不能再分的粒子D.原子是化学变化中的最小粒子8.通过分析下表,你能得出哪些结论?结论1:________________________________________________________________________;结论2:________________________________________________________________________;结论3:________________________________________________________________________;结论4:________________________________________________________________________。
初中浙教版科学八年级下册第2章第3节《原子结构的模型》习题1

《第3节原子结构的模型》习题一、选择题1.为了探索原子内部的构造,科学家们进行了无数次实验:他们使用原子模型来表示原子并用实验来校正模型。
其中提出“分层模型”的科学家是()A.汤姆森B.卢瑟福C.玻尔D.道尔顿2.能直接构成物质的粒子有()A.分子和原子B.质子和中子C.质子和电子D.电子和中子3.原子和分子的根本区别在于()A.大小不同B.质量不同C.在化学反应中是否可再分D.是不是构成物质的粒子4.关于原子的叙述正确的是 ( )A.一切原子的原子核都有质子和中子B.原子中没有带电荷的粒子,所以原子不显电性C.原子是不能再分的粒子D.原子是化学变化中的最小粒子5.原子核是由 ( )A.质子和电子构成 B.质子和中子构成C.电子和中子构成 D.质子、中子和电子构成6.已知A原子核内有6个质子,6个中子;B原子核内有6个质子,7个中子。
则它们不相等的是 ( )A.核外电子数 B.核电荷数C.质量数 D.原子的电性7.1999年诺贝尔奖获得者艾哈迈德·泽维尔,开创了“飞秒化学”的新领域,他发明的激光光谱技术,使观测化学反应时分子中原子的运动成为可能。
你认为该技术不能观察到的是 ( )A.化学变化中反应物分子的分解 B.反应中原子的运动C.化学变化中反应物分子的形成 D.原子核的内部结构8.一种元素的原子变成离子,则该原子 ( )A.一定失去电子 B.一定得到电子C.可能失去电子,也可能得到电子D.既不得到电子,也不失去电子9.具有相同质子数的粒子是()A.同一种原子B.同一种分子C.同一种元素D.无法确定10.1994年,科学家发现了一种新元素,它的中子数与质子数之和为272,其原子核内有161个中子,该元素的核电荷数为()A.433B.161C.272D.11111.下列粒子能决定元素种类的是 ( )A.质子数B.中子数C.电子数D.中子数与质子数之和12.某原子M,中子数与质子数之和为a,核内中子数为b,其核外电子数是()A.a-bB.a+bC.b-aD.b+a13.某微粒核外有18个电子,核内有16个质子和16个中子,该微粒是()A.原子B.分子C.阳离子D.阴离子14.目前普遍认为,质子和中子都是由被称为u夸克和d夸克的两类夸克组成。
浙教版科学八年级下册 原子结构的模型基础训练

2.3 原子结构的模型1.有三种原子,甲原子核内有8个质子和8个中子,乙原子核内有8个质子和9个中子,丙原子核内有6个质子和6个中子,则下列说法正确的是()A.甲和乙是同种原子B.甲和乙是同种元素C.乙和丙核电荷数相等D.乙和丙核外电子数相等2.科学研究中,人们通过一定的科学方法,建立一个适当的模型来代替和反映客观对象,并通过研究这个模型来揭示客观对象的形态、特征和本质。
下列分析正确的是()A.①揭示单侧光对生长素分布的影响,向光侧生长素多,生长快B.①用磁感线描述条形磁体周围的磁场分布,越密表示磁场越弱C.①是原子结构模型,中央是原子核,核外是绕核高速运动的电子D.①描述地球绕日公转,地轴始终呈倾斜状态,箭头表示公转方向3.俄国科学家门捷列夫对元素周期表的编制做出了巨大贡献,人们将101号元素命名为“钔”来纪念他。
钔原子的核电荷数为101,相对原子质量为258,则钔原子的核外电子数为()A.101B.157C.258D.3594.金属是由原子构成的,1kg下列金属中所含原子个数最多的是()A.铁B.铜C.铝D.锌5.同位素的应用非常广泛,比如用于考古。
三星堆遗址出土的文物经C-14同位素检测,已有5000年左右的历史,这表明我国上下五千年的历史是真实存在的。
碳有多种同位素,互为同位素的两种碳原子不可能具有相同的()A.化学性质B.质子数C.电子数D.中子数6.卢瑟福的α粒子轰击金箔实验为建立现代原子理论打下了基础。
如图线条中,可能是α粒子(带正电)在该实验中的运动轨迹的是()A .adB .abcC .bcdD .abcd7.1909年起,英国科学家卢瑟福和他的助手用一束带正电荷的高速α粒子流轰击一片很薄的金箔,并根据如图所示的实验现象和已有知识,在1911年提出了原子的有核模型。
要解释本实验现象产生的原因,下列知识中不需要用到的是( )A .同种电荷相互排斥B .电荷的定向移动形成电流C .力是改变物体运动状态的原因D .一个α粒子的质量比一个电子的质量大得多8.铪是一种金属,耐高温抗腐蚀,是原子能工业重要材料。
【课时练习】浙教版科学八年级下册-第2章-第3节-原子结构的模型(原卷版)

2020-2021学年浙教版科学八年级下册第2章第3节原子结构的模型课时练习一、单选题(共20题;共40分)1.如图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是()A. 决定该原子种类的粒子是bB. 原子的质量集中在a和c上C. 原子中b与c的数目一定相同D. 原子中a与c的数目一定相同2.原子论开辟了从微观世界认识物质及其变化的新纪元。
下列哪位科学家最早提出了原子的概念()A. 牛顿B. 爱因斯坦C. 道尔顿D. 阿基米德3.曾经充满活力的碧波,滋养着740平方公里土地的母亲河“温瑞塘河”,而现今由于生活污水的肆意排放造成了重度污染,水质监测结果表明,氮、磷含量严重超标,这里提到的“氮”、“磷”指的是()A. 分子B. 原子C. 离子D. 元素4.知识梳理有助于我们对已学知识的巩固,如图是某同学学习物质结构层次后以氧气为例进行的梳理,下列选项中与a、b、c相对应的是( )A. 原子、原子核、核外电子B. 原子核、原子、核外电子C. 原子、核外电子、原子核D. 核外电子、原子核、原子5.我国著名科学家张青莲教授主持测定了铕等9种原子质量新值,已知铕原子的相对原子质量为152,核电荷数为63,则铕原子的核外电子为()A. 63B. 89C. 152D. 2156.决定元素种类的是()A. 电子数B. 中子数C. 最外层电子数D. 质子数7.下列关于原子核构成的说法正确的是()A. 一般由质子和电子构成B. 一般由质子和中子构成C. 一般由电子和中子构成D. 一般由质子、中子和电子构成8.俄罗斯科学家利用第72号元素铪和第74号元素钨精确测出月球至少比地球早700万年形成。
铪、钨两种元素原子本质的不同是()A. 核内质子数目B. 核内中子数目C. 核外电子数目D. 相对原子质量9.下列关于元素的理解,正确的是()A. 元素的种类取决于该元素原子的核外电子数B. 中子数相等的原子的统称叫元素C. 元素既论种数,也可计个数D. 自然界中所有的物质都是由元素组成的10.科学家用质子数为20的钙离子,轰击核电荷数为98的锎元素靶,使两种元素的原子核合并在一起,合成核电荷数为118的新元素。
八年级科学下册 2.3 原子结构的模型习题2 (新版)浙教版

《第3节原子结构的模型》习题1、一种元素与另一种元素的最本质的区别是其原子的()A. 质子数不同B. 中子数不同C. 核外电子数不同D. 原子质量不同2、同种元素的原子和离子,一定相同的是()A. 质子数B. 电子数C. 质量D. 核外电子数*3、在卢瑟福用α粒子轰击金属箔时,发现小部分α粒子发生偏转,极少的α粒子甚至像碰到硬盒似的反弹回来,大部分α粒子却能通过原子,已知α粒子带正电,这一实验不能说明的是()A. 原子核极其微小B. 原子核质量比电子大得多C. 原子并不是一个实心球体,大部分空间是空的D. α粒子发生偏转是因为同种电荷互相排斥4、下列说法不正确的是()A. 原子的质量主要集中在原子核上,核外电子质量往往忽略不计B. 因为构成原子核的质子和中子数量相等,电性相反,所以整个原子不显电性C. 原子中核电荷数和核外电子数总是相等的D. 质子、中子是由更小的夸克构成的5、原子中一定相等的是()A. 质子数和中子数B. 中子数和电子数C. 质子数和核外电子数D. 质子数、中子数和电子数6、两种不同的原子,一种核内有15个质子、15个中子,另一种核内有15个质子、16个中子,则有关它们的说法正确的是()A. 它们属于不同的元素B. 它们属于同一种元素C. 它们的质量是相等的D. 它们虽然属同位素,但核电荷数是不同的7、同类原子中具有相同的()①中子数②核外电子数③核电荷数④质子数⑤原子核组成A. ①②③B. ①③④C. ②③④D. ②④⑤8、有三种不同的原子,A原子核内有6个质子6个中子,B原子核内有6个质子8个中子,C原子核内有7个质子7个中子,则下列说法正确的是()A. A和B是不同种元素B. A和B的核电荷数不同C. B和C核外电子数相等D. A和B互为同位素原子9、下列氢原子的各种模型图中,正确的是()*10、1999年诺贝尔化学奖获得者艾哈迈德·泽维尔开创了“飞秒(10-10~10-15S)化学”的新领域,使运用激光技术观测化学反应时分子中原子的运动成为可能。
第二单元:2.3原子结构的模型同步训练 —2020-2021学年浙教版八年级科学下册

2.3原子结构的模型一.选择题1.下列对原子结构的认识正确的是()A.原子能构成分子,也能构成物质B.原子核都是由质子和中子构成的C.卢瑟福发现了原子核,并提出了分层模型D.原子的质量主要集中在质子和电子上2.下列对于Fe、Fe2+、Fe3+的说法不正确的是()A.核电荷数相同B.相对原子质量相同C.属于同一种微粒D.属于同一种元素3.原子结构模型的建立,经过了几代科学家的艰辛努力,直到现在仍在探索中。
其中,行星模型的提出标志着原子结构的现代模型的问世,如图是锂原子结构的行星模型,图中原子核内有3个质子、4个中子。
不能根据原子结构的行星模型得出的结论是()A.原子始终在做无规则的运动B.原子核的体积只占整个原子体积的很小一部分C.构成原子核的粒子之间存在一种互相吸引的力D.电子绕原子核沿一定轨道运动4.在近代原子学说的发展过程中,有下列观点:①物质都是由原子构成的;②原子是实心球体;③正电荷均匀分布在整个原子内。
1911 年卢瑟福用带正电的α粒子轰击原子,发现多数α粒子穿过后仍保持原来的运动方向,但有极少数α粒子发生了较大角度的偏转,如图所示。
分析实验结果,可以否定上述观点中的()A.①②B.①③C.②③D.①②③5.如图为原子变化的示意图,其中①②③表示三种原子,“●”、“〇”、“。
”表示原子中的不同微粒,①②③中属于同种元素的原子是()A.①②③B.①②C.②③D.①③6.生物体死亡后,体内含有的碳﹣14会逐渐减少(称为衰变)。
因此科学家可通过测量生物体遗骸中碳﹣14的含量,来计算它存活的年代,这种方法称之为放射性碳测年法。
碳﹣14原子核中含6个质子与8个中子,在衰变时,一个中子变成质子,形成新的原子核。
下列关于新原子核的说法正确的是()A.碳原子核,含7个质子,8个中子B.氮原子核,含7个质子,7个中子C.碳原子核,含6个质子,7个中子D.氧原子核,含7个质子,8个中子7.某元素原子A的质子数为a,已知B3+和A2﹣具有相同的核外电子数,则B元素的质子数为()A.a﹣2+3B.a﹣2﹣3C.a+2+3D.a+2﹣38.O表示该氧元素的原子有8个质子,(16﹣8)个中子,O是O的一种同位素,含有8个质子,10个中子。
[配套K12]八年级科学下册 第二章 第3节 原子结构的模型(第2课时)教学设计 (新版)浙教版
![[配套K12]八年级科学下册 第二章 第3节 原子结构的模型(第2课时)教学设计 (新版)浙教版](https://img.taocdn.com/s3/m/bd3787634b35eefdc9d33329.png)
原子结构的模型(2)
课程标准:本课属于“物质科学”领域内、主题2 “物质的结构”下的“构成物质的微粒”中内容。
中考考试内容有:知道物质由分子、原子或离子构成;知道分子、原子、离子微粒大小的数量级;知道原子由原子核和电子构成;知道原子核由质子和中子构成;知道质子和中子由夸克构成。
考试要求都为a级。
学习目标:
1.知识与技能
了解原子的构成,了解原子核内各种微粒的电性,了解原子核内各种微粒之间的数量关系,知道物质也可以由离子构成,认识离子微粒大小的数量级。
2.过程与方法
用敲碎桃核的比喻让学生了解研究原子核秘密的方法,通过对一杯水的微观层次分析,将物质结构的系统性和层次性直观地表达出来。
3.情感、态度与价值观:
结合教学内容,进行科学思维方法的教育,培养学生的创造意识。
教学重点:了解原子核的结构,知道物质也可以由离子构成
教学难点:了解原子核内各种微粒之间的数量关系,认识离子
研究原子核的方法
原子是由什么粒子
一个大
像运动场里的一粒米。
?
→原子核→质子和中子→夸克
⑷质子和中子又是由更小的微粒夸克构成。
演示实验:金属钠在氯气中燃烧(注意氯气有毒,注意、观察钠和氯气的状态和颜色
粒子的知识解释金属钠在氯气中燃烧而是由两种离子构成的物质。
电的电子构成的列有关氯化钠的叙述正确的是
)
布置作业:
教学反思:。
2020新浙教版八年级科学下册同步测试:2.3原子结构的模型

第3节原子结构的模型第1课时原子的结构[学生用书B14]1.[2019·杭州上城区期末]原子结构的模型是在实验和探索中不断地修正和完善的,如图甲、乙、丙、丁,有关“当时”模型的建立有误的是(B)图2-3-1A.甲是汤姆生模型:正电荷均匀分布在整个球体内,电子镶嵌在其中B.乙是卢瑟福模型:电子在中心原子核里,正电荷在核外绕核运动C.丙是波尔模型:电子在原子内的一些特定的稳定轨道上运动D.丁是现代原子结构模型:电子绕核运动形成一个带负电荷的云团2.将夸克、原子、质子、原子核按空间尺寸由小到大进行排列正确的是(A) A.夸克、质子、原子核、原子B.原子、原子核、质子、夸克C.原子、质子、原子核、夸克D.质子、夸克、原子、原子核3.图甲是卢瑟福用α粒子轰击金属箔而产生散射的实验,在分析实验结果的基础上,他提出了图乙所示的原子核式结构,卢瑟福的这一研究过程是一个(A)图2-3-2A.建立模型的过程B.得出结论的过程C.提出问题的过程D.验证证据的过程4.如图为某原子的结构示意图,该原子的原子核中有(A)图2-3-3A.6个质子和8个中子B.8个质子和6个中子C.6个质子和8个电子D.8个质子和6个电子5.下列说法中正确的是(A)A.原子核内的质子数与其核电荷数相等B.原子核内的质子数与中子数一定相等C.原子核一定由质子和中子构成D.原子和中子由夸克构成,夸克不可再分6.学习完“原子结构模型的建立”之后,萍萍同学形成了以下认识,其中错误的是(C)A.原子由居于中心的原子核和核外电子构成B.核外电子在离核远近不同的区域中运动C.原子核的质量和电子的质量相差不大D.原子核的体积与整个原子的体积相比要小很多7.在科学发展史上,道尔顿提出了近代原子学说,对科学的发展起着十分重要的作用,因而拥有“原子之父”的美誉。
关于原子的下述三个说法:①原子是不能再分的实心球体;②质子数相同的原子的各种性质和质量都相同;③原子是微小的实心球体。
浙教版科学八年级下册同步练习题2.3原子的结构模型

2.3 原子的结构模型一、单选题1.著名科学家居里夫人首先发现某些原子具有放射性,即原子能自动放射出一些粒子。
若一种元素的原子经过放射变成了另一种元素的原子,则此原子放射出的粒子中一定有( )A.电子B.中子C.质子D.原子核2.2019年联合国把今年定为“元素周期表年”。
俄国科学家门捷列夫对元素周期表的编制做出巨大贡献,人们将101号元素命名为“钔”来纪念他。
钔原子的核电荷数为101,相对原子质量为258,则钔原子的质子数为( )A.101B.157C.258D.3593.图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法不正确的是()A.决定该原子种类的粒子是cB.原子中b与c的数目一定相同C.原子中a与c的数目一定相同D.原子的质量集中在b和c上4.有3种不同的原子,甲原子核内有6个质子和6个中子,乙原子核内有6个质子和8个中子,丙原子核内有7个质子和7个中子.下列说法正确的是( )A.甲和乙是同一种元素B.甲和乙的核电荷数不同C.乙和丙核外电子数相等D.乙和丙互为同位素原子5.下列关于原子模型叙述正确的是( )A.卢瑟福建立的“卢瑟福模型”认为电子像云雾一样出现在原子核周围B.玻尔建立的“分层模型”认为电子在原子核周围分层运动C.现代科学家认为电子像西瓜籽似地嵌在原子中D.汤姆生建立的“汤姆生模型”认为电子像行星绕太阳运行6.原子结构的模型在实验和探索中不断地修正和完善。
如图为某原子的结构示意图,该原子的原子核中有( )A.6 个质子和8 个中子B.8 个质子和6 个中子C.6 个质子和8 个电子D.8 个质子和6 个电子7.极光是一种绚丽多彩的发光现象,其发生是由于太阳带电粒子流进入地球磁场。
在地球南北两极附近地区的高空,夜间出现的灿烂美丽的光辉,在南极被称为南极光,在北极被称为北极光。
下列这些微粒中,不会引起极光的是( )A.a粒子(氦的原子核)B.电子C.质子D.中子8.碳一12是指含6个中子的碳原子,下列对氧一16和氧一18两种氧原子的说法正确的是( )A.质子数相同B.质量相同C.电子数不相同D.16和18表示原子个数9.“朝核问题”引发国际关注,核问题的关键是核能的如何利用。
浙教版2020八年级科学下册练习题2.3 原子结构的模型

【文库独家】2.3原子结构的模型1.下列对分子、原子、离子的认识正确的是(B)A. 都是带电的粒子B. 都是构成物质的基本粒子C. 都是化学变化中的最小粒子D. 都是保持物质化学性质的最小粒子2.物质是由原子、分子、离子等粒子构成的,有一粒子,其原子核内有16个质子、16个中子,原子核外有18个电子,该粒子是(C)A. 原子B. 阳离子C. 阴离子D. 分子3.下列物质中由离子构成的是(C)A. 铜B. 干冰C. 氯化钠D. 金刚石4.下表所列微粒中,是阳离子的是B,是阴离子的是D。
组别质子数中子数电子数A 14 14 14B 26 30 24C 26 30 26D 8 8 105.请填表并比较氯原子与氯离子、镁原子与镁离子、镁离子与氯离子,把它们的异同点写在下面的横线上。
粒子名称核内质子数核外电子数粒子所带电荷镁原子12 12 0镁离子12 10 两个单位正电荷氯原子17 17 0氯离子17 18 一个单位负电荷氯原子与氯离子:质子数相同,电子数不同。
镁原子与镁离子:质子数相同,电子数不同。
镁离子与氯离子:都带电,但电荷数和电性不同。
6.在分子、原子、质子、中子、电子、原子核、阳离子、阴离子这些微粒中:(1)显电中性的微粒有中子、分子、原子。
(2)带正电的微粒有质子、原子核、阳离子。
(3)带负电的微粒有电子、阴离子。
(4)质量最小的微粒是电子。
(5)化学变化中,一定发生变化的微粒有分子。
(6)在同一原子里数目相等的是质子、电子。
7.如图表示某物质的微观形成过程。
请仔细观察并回答下列问题:(第7题)(1)该过程说明原子通过得失电子形成离子。
(2)甲原子形成的离子是阳离子。
(3)最终形成的化合物不显(填“显”或“不显”)电性,原因是两种离子所带电荷数相同,电性相反。
【解析】通过对图的观察可知,电子由甲原子向乙原子转移,形成带正电的甲离子和带负电的乙离子,因为电子只在甲、乙间移动,所以两种离子所带的电量相同,电性相反。
浙教版八年级科学下册 2.3 原子结构的模型 原子结构 同步练习 含答案

第2章微粒的模型与符号第3节原子结构的模型原子结构同步练习1.汤姆生最早发现了原子中存在一种带负电荷的粒子,证明了原子是可以再分的。
汤姆生发现的这一粒子是( )A.原子核 B.质子 C.电子 D.中子2.卢瑟福的α粒子轰击金箔实验推翻了汤姆生在1903年提出的原子结构模型,为建立现代原子理论打下了基础。
如图线条中,可能是α粒子(带正电)在该实验中的运动轨迹的是( )A.abcd B.abc C.bcd D.ad3. 道尔顿、汤姆生和卢瑟福等科学家对原子结构进行了不断探索。
下列叙述正确的是( )①原子由原子核和核外电子构成②原子的质量主要集中在原子核上③原子核在原子中所占的体积极小A.①② B.①③ C.②③ D.①②③4. 原子是构成物质的基本粒子。
下列有关原子的叙述错误的是( ) A.原子是最小的微粒 B.原子核中一定含有质子C.原子的质子数等于核电荷数 D.原子在化学变化中的表现主要由电子决定5. 原子的构成示意图如图所示,下列叙述正确的是( )A.原子是实心球体 B.质子、中子、电子均匀分布在原子中C.质子与电子质量相等 D.整个原子的质量主要集中在原子核上6.下列粒子:夸克、原子、质子、原子核,按空间尺度由小到大进行排列正确的是( )A.夸克、质子、原子核、原子 B.原子、原子核、质子、夸克C.原子、质子、原子核、夸克 D.质子、夸克、原子、原子核7.如图所示,氢原子结构的各种模型图,其中正确的是( )8. 如图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是( )A.决定该原子种类的粒子是b B.原子中b与c的数目一定相同C.原子中a与c的数目一定相同 D.原子的质量集中在a和c上9. 下列说法中正确的是( )A.原子核内的质子数与其核电荷数相等 B.原子核中的质子数与中子数一定相等C.原子核一定由质子和中子构成 D.原子核不显电性10. 汤姆生和卢瑟福都对现代原子结构理论作出了巨大贡献。
【结构】八年级科学下册第2章第3节原子结构的模型教案2新版浙教版

【关键字】结构第3节原子结构的模型1.原子结构模型的建立与修正“原子核式结构发现”的课堂教学中,尝试用“特殊—一般”的归纳式教学法进行课堂教学。
充分利用“角色效应”,让每一位学生都扮演小科学家,在假想让时光倒退100年的前提下,一起作原子世界的科学探索,努力使学生体验成功的喜悦,收到了良好的教学效果。
[教学目标](l)了解a粒子散射实验和卢瑟福的原子核式结构。
(2)结合教学内容,进行科学思维方法的教育,培养学生的创造意识。
[教学重点]a粒子散射实验原理及原子核式结构的建立。
[教学方法]探究式教学,师生共同讨论[教具准备]高亮度液晶投影仪、实物展示台、多媒体、鸡蛋1只、盛水烧杯1只[教学过程]一、新课引入出示一只鸡蛋并设问:假如你以前从来没有吃过鸡蛋,甚至没有见过鸡蛋,你想知道蛋壳里面是什么,有什么办法吗?学生们异口同声地回答:把它打碎!又问:如果你不想打破它但又想知道这里面是什么,有什么办法呢?学生议论,提出实验方案:透视、摇晃、称量……等等演示实验:将鸡蛋放入清水中。
实验现象:这只鸡蛋漂浮在水面上学生讨论:提出各种各样的猜想、假设演示实验:得出鸡蛋里面是空的归纳得出:科学家进行科学探索时常用的思维方法:即观察物理现象——建立理想模型——理论实验验证。
(注1:用1只鸡蛋作为课题的引入,一是寓意原子的核式结构;二是激活学生的思维。
学生们对第一个问题会不介意,对第二个问题觉得有点棘手。
但为了能展现他们的聪明才智,个个开动脑筋争先恐后地发言。
当他们看到鸡蛋漂浮在水面上时,他们感到惊讶,又开始了新一轮的猜测,此时教学气氛十分活跃。
创设具有感染力的物理情境,能激活课堂教学气氛,有效地调动学生的学习热情;第三是让学生体会科学探索的方法。
)2、新课教学(l)电子的发现简单介绍汤姆生发现电子的过程。
提问:①不同物质都能发射电子,这说明了什么?②电子的发现有何意义?让学生讨论并回答。
(2)汤姆生原子模型根据原子是电中性的、电子是带负电的事实,让学生讨论、猜测原子的结构投影展示学生提出的原子结构方案,并介绍汤姆生原子模型。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第3节原子结构的模型
姓名学号
一、我学会了
1、钠在氯气中燃烧的现象:燃烧,发出火焰,生成固体。
氯气是色气体。
钠是具有的固体。
2、离子是原子或。
带的离子称为。
带的离子称为。
离子所带的电荷数取决于的数目。
离子与原子之间的转换可以通过来实现。
3、构成物质的微粒有:、、。
大多数物质是由构成的;是化学变化中的最小微粒;硫酸铜是由和构成的。
4、把具有相同(即质子数)的同一类原子总称为。
目前人类已知的元素有多种。
5、原子中核内质子数、中子数的同类原子互为同位素原子。
氢元素也有3种同位素原子,分别称、、。
同位素原子在、、、等方面有着广泛的应用。
二、我理解了
6.物质是由原子、分子、离子等粒子构成的,有一粒子,其原子核内有16个质子、 16个中子,原子核外有18个电子,该粒子是---------------------------------()
A. 原子
B. 阳离子
C. 阴离子
D. 分子
7.下列有关微粒的说法错误的是------------------------------------------------------()
A. 离子带电,但由离子构成的物质不带电
B. 钠原子失去1个电子形成钠离子
C. 硫酸铜晶体就是由铜原子和硫酸根离子构成的
D. 离子能通过得失电子转化为原子
8.科学家成功合成了第117号新元素,填补了第116号和118
号元素之间的空缺。
推测该元素为117号元素的依据是---------------------()
A. 中子数
B. 质子数
C. 电子数
D. 中子数和质子数
9.日本大地震引发了核泄漏事故。
事故发生时,放射性原子氮16可能短暂存在。
氮16原子的质子数为7,中子数为9。
下列有关氮16原子的说法正确的是
-------------------------------------------------------------------------------------()
A.核外电子数为9 B.核电荷数为9
C.和普通氮原子是相同的原子 D.和普通氮原子属于同种元素
10.科学上常用元素符号左下角的数字表示原子的质子数,左上角的数字表示原子的中子数与质子数之和,如 613C表示核内有6个质子和7个中子的碳原子。
下列关于 53131I和 53127I的说法中错误的是----------------------------------------()
A. 各取一个原子相比较,中子数相同
B. 属于同种元素
C. 各取一个原子相比较,核外电子数相同
D. 各取一个原子相比较,质子数相同
11.美国夏威夷联合天文中心的科学家发现了一种新型氢粒子,它由三个氕原子核和两个电子构成。
这对解释宇宙演化提供了新的参考。
对于这种粒子,下列说法中错误的是-------------------------------------------------------------------------------() A.它一定含有3个中子 B.它比一个普通氢分子多一个氢原子核
C.它的组成可以用H3+表示 D.它的化学性质与H2不同
12.法国里昂的科学家发现了一种由四个中子构成的微粒,这种微粒被称为“四中子”,也有人称之为“零号元素”,它与天体中的中子星构成类似。
下列有关“四中子”微粒的说法正确的是--------------------------------------------------------------()
A. 该微粒是一种原子
B. 该微粒不显电性
C. 该微粒与普通中子互为同位素
D. 该微粒的质量为4克
13.科学研究证实,物质是由微粒构成的。
例如,铁是由铁原子构成的。
请你填写构成下列物质的具体微粒名称。
(1)家中铝合金窗户中的铝是由构成的。
(2)用于人工降雨的干冰(固态二氧化碳)是由构成的。
(3)用于配制生理盐水的氯化钠晶体是由和构成的。
14.请填表并比较氯原子与氯离子、镁原子与镁离子、镁离子与氯离子,把它们的
氯原子与氯离子:。
镁原子与镁离子:。
镁离子与氯离子:。
15.如图表示某物质的微观形成过程。
请仔细观察并回答下列问题:
(1) 该过程说明原子通过电子形成离子。
(2) 甲原子形成的离子是离子。
(3) 最终形成的化合物(填“显”或“不显”)
电性,原因是。
