第7章 多环芳烃
07多环芳烃和稠环芳烃

+
X2
CCl4 低温
(B) 氧 化 反 应
O O
工业 :在 V2O5下加 热 300-500制 备 O
O O 9,10-蒽 醌 O
+
AlCl3 F-C反应 COOH O SO3H
H2SO4 - H2O
O
发烟硫 酸 加 热
O
7.2.3 菲
菲是白色片状晶体,熔点100 ℃,沸点340 ℃,易溶于苯和乙醚,溶液呈蓝色荧光。菲的结 构比蒽稳定,反应主要发生在9,10位。
联苯为无色晶体,熔 点70 ℃ ,沸点254 ℃。 不溶于水,而易溶于有 机溶剂。 它的性质与苯相似, 两个苯环上均可发生磺 化、硝化等反应(主要 为对位产物,邻位较 少)。
I + Cu
+
CuI
HNO3 H2SO4 O2N
HNO3 H2SO4 O2N NO2
NO2
Zn NaOH
N N H H
HCl
H2N
振)。
返回
6 5 0.139 0.142 4 0.137
3
0.140
(2) 萘的性质
A、取代反应(主要在α 位Cl )
Cl2 Fe Cl
+ Br
CCl4 (72%-75%) NO2 NH2 Zn + HCl (79%) SO3H
+
Br2
+ HNO3
H2SO4
100% H2SO4 (80)
(96%)
H2SO4(165) 95% H2SO4 (165) NaOH (300) H+ OH SO3H (85%) 容 易 得到
3
92% H2SO4
3
SO3H
10第七章多环芳烃

2' 1' 1
2
3 4
CH2
(CH 2 ) n
6 5
n 2
二苯甲烷
3' 4' 6' 5' 6 2' 1' 1 2
三苯甲烷
3 4 5 4" 5" 6" 3" 2" 1" 4' 3' 2' 1' 1 4 5' 6' 6 5 2 3
2. 联苯
二联苯
三联苯
3. 稠环芳烃
3 8 7 6 5 4 1 2 3 7 6 5 10 4 8 9 4 1 2 3 6 5 1 10 8 9 2
2 Cu 2 X X = I, Br, C l
NO 2 Cu I
NO 2
O 2N
2. 联苯的构象
45o
C O 2H NO2 NO2 C O 2H
NO2
C O 2H
C O 2H
NO2
邻位H之间有位阻 旋转受阻
邻位四取代联苯有手性
3. 亲电取代反应
H N O 3 / A c2O H N O 3 / H 2 SO 4
[14]轮烯
H H H H
π电 子 =18,
H H
n =4
轮内氢原子间的斥力微弱,环接近于平面, 故有芳香性
[18]轮烯
本次课小结:
多环芳烃(类型,制备,性质,Haworth萘合成法) 萘的结构及其性质 萘环上的亲电取代反应(重点:反应取向) 萘环上的氧化还原 蒽和菲的性质(芳香性和烯烃性质)
2、 环庚三烯正离子
+ ф 3C X
H H H
有机化学第七章 芳烃

H
H
H
H
H
H
可以解释:为什么苯分子特别稳定? 为什么苯分子中碳碳键长完全等同? 为什么邻位二取代物只有一种?
(b)分子轨道理论 分子轨道理论认为:苯分子形成σ键后,苯的
六个碳原子上的六个P 轨道经线性组合可以形成六 个分子轨道,其中ψ1 、ψ2 和ψ3 是成键轨道,ψ4、 ψ5和 ψ6是反键轨道。当苯分子处于基态时六个电 子填满三个成键轨道,反键轨道则是空的。
-络合物
(b)硝化反应
2 H2SO4 HNO3
NO2
HNO3 H2SO4,45℃
CH3
HNO3 H2SO4,30℃
NO2
CH3 NO2
CH3
NO2
HNO3 H2SO4,95℃
NO2
NO2
NO2
H3O 2 HSO4
反应比苯容易 反应比苯困难
硝化反应机理
硝化反应中进攻试剂是NO2+,浓硫酸的作 用促进NO2+的生成:
苯环的特殊稳定性可以从它具有较低的氢化热 得到证明:
环己三烯氢化热=360kj/mol(假想值) 苯环氢化热=208kj/mol 相差152kj/mol
氢化热简图:
环己三烯+3H2
环己二烯+2H2
苯+3H2
环己烯+H2
231kj/mol
120kj/mol
208kj/mol
360kj/mol
环己烷
苯分子的近代概念
ቤተ መጻሕፍቲ ባይዱ
(1)煤的干馏
煤隔绝空气加热至1000~1300℃时分解所得到的 液态产物——煤焦油,其中含有大量芳烃化合物。 再经分馏得到各类芳烃。
馏分名称 轻油 酚油 萘油 洗油 蒽油
7 第七章 芳烃
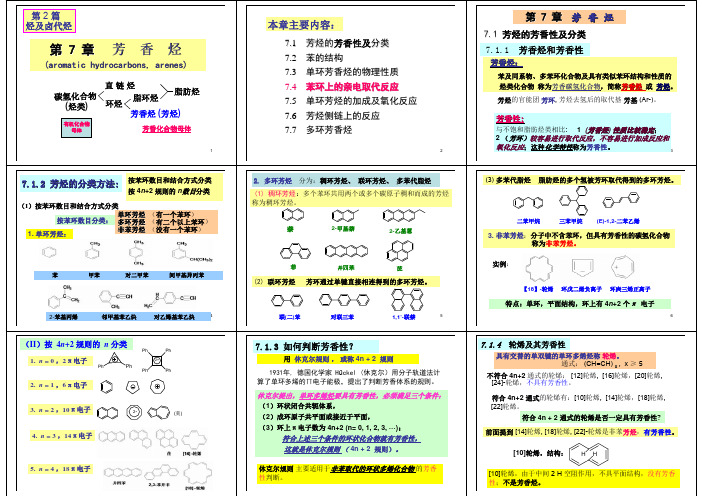
本章主要内容:
第 7 章 芳 香 烃
7.1 芳烃的芳香性及分类 7.1.1 芳香烃和 和芳香性
芳香烃:
苯及同系物、多苯环化合物及具有类似苯环结构和性质的 烃类化合物 称为芳 芳香碳氢化合物,简称芳香烃 芳香烃 或 芳烃。 碳氢化合物 芳烃 芳烃的官能团 芳环, 芳烃去氢后的取代基 芳基 (Ar-)。
二苯甲烷
三苯甲烷
(E)-1,2-二苯乙烯
萘
2-甲基萘
2-乙基蒽
3. 非苯芳烃:分子中不含苯环,但具有芳香性的碳氢化合物 称为非苯芳烃。 实例:
菲
并四苯
芘
苯
甲苯
对二甲苯
间甲基异丙苯
(2) 联环芳烃
芳环通过单键直接相连得到的多环芳烃。
【18】-轮烯 环戊二烯负离子 环庚三烯正离子
特点:单环,平面结构,环上有 4n+2 个π 电子
思考:二甲苯三种异构体中, 邻二甲苯的沸点最高,对二甲苯对熔点最高?
17
7.3.2
沸点 熔点
苯的同系物中每增加一个 -CH2-单位,沸点平均 增高约 20-30 ℃。
16
沸 点
如: 苯、甲苯、乙苯、正丙苯和正丁苯的沸点分别 为 80.1 ℃, 110.6 ℃,136 ℃,159.2 ℃和 183 ℃。
+ Cl2
FeCl3
Cl
Cl
+
Cl
24
在卤化反应中,铁粉也能起到催化剂的作用。
X
苯与卤素的反应的活性顺序:
氟>氯>溴>碘
苯与氟的反应过于激烈,很难控制,一般不用; 苯与碘的反应太慢, 需要在氧化剂(HNO3)存在下进行, 一般也不用。 氯的反应活性大于溴的反应活性,但溴化产物的选择性 比氯化产物高。取代苯的溴化产物,以对位产物为主。
高教第二版(徐寿昌)有机化学课后习题答案第7章

第七章 多环芳烃和非苯芳烃一、 写出下列化合物的构造式。
1、α-萘磺酸2、 β-萘胺3、β-蒽醌磺酸SO 3HNH 2C C OO SO 3H4、9-溴菲5、三苯甲烷6、联苯胺BrCHNH 2二、 命名下列化合物。
1.2.C COO 3.SO 3HNO 24.CH 25.6.CH 3CH 3OHNO 2二苯甲烷 对联三苯 1,7-二甲基萘三、 推测下列各化合物发生一元硝化的主要产物。
SO 3HSO 3H1.HNO 3H 2SO 4O 2NSO 3HNO 2+2.CH 3H 2SO 4HNO CH 3NO 23.OCH HNO 3H 2SO 4NO 2OCH4.CNCNNO 2HNO 3H 2SO 4NO 2CN四、 回答下列问题:1,环丁烯只在较低温度下才能生成,高于350K 即(如分子间发生双烯合成)转变为二聚体什么?写出二苯环丁烯三种异构体的构造式。
解:环丁二烯π-电子为四个,具有反芳香性,很不稳定,电子云不离域。
三种二苯基环丁二烯结构如下:2,1,3,5,7-环辛四烯能使高锰酸钾水溶液迅速褪色,和溴的四氯,已知它的衍生物二苯基环丁二烯,有三种异构体。
上述现象3 3化碳溶液作用得到C 8H8Br8。
(a),它具有什么样结构?这两个共振结构式表示?解:不可以,因为1,3,5,7-辛环四烯不具有离域键,不能用共振结构式表示。
(c),用金属钾和环辛四烯作用即得到一个稳定的化合物2K+C8H8(环辛四烯二负离子),这种盐的形成说明了什么?预期环辛四烯二负离子将具有怎样的结构?解:环辛四烯二负离子具有芳香性,热力学稳定,其结构为:五、写出萘与下列化合物反应所生成的主要产物的构造式和名称。
1,CrO3, CH3COOH 2,O2,V2O5 3, Na,C2H5OHOO C O CO O解:具有右式结构,不是平面的(b),π-电子云是离域的。
1,4-萘醌邻苯二甲酸酐 1,2-二氢萘4,浓硫酸,800C 5,HNO3,H2SO4 6,Br2α-萘磺酸α-硝基萘 1-溴萘7,H2,Pd-C加热,加压 8,浓硫酸,1650C四氢萘β-萘磺酸六、用苯、甲苯、萘以及其它必要试剂合成下列化合物:1.CH 2CH 3Cl ,hvCH 2ClAlCl 3CH 2ClCl 2FeCH 2Cl2.(C 6H 5)3CHCH 3Cl ,hvCHCl2AlCl 3(C 6H 5)3CH3.NO 2Br23H 2SO 424.NO 2SO 3HSO 3H NO 2SO 3HH 2SO 4165C3H 2SO 45.C C OOCO O COAlCl 3O 2,V 2O 5450CC COOHO 97%H 2SO 4C C OO七、 写出下列化合物中那些具有芳香性? 解:1.2.3..4.+5.6.7.8.9.10.H HH HHH11.CH 2=CHCH=CHCH=CH 2代表有芳香性代表无芳香性。
第7章 多环芳烃

Naphthalene
萘
3
81
8
91
34
2
28 79 1
73
2
2
45 2
1
35
35 4 6 5
6 5
130 4
10 4
1
10 89
10
Anthracene
8 P9henanthrene
蒽
菲
7.3.1、萘及其衍生物
1)物性:白色闪光晶体,m.p 80.6℃,b.p 218℃, 易升华,不溶于水。 2) 结构: C10H8,平面型分子,闭合共轭体系,有芳 性。分子中键长不等:
3
7.2 联苯
1,联苯的结构:两个或多个苯环以单键相连的化合物
2 制备
(1)联苯的工业制备
H+ H
700~800 ℃
(2)联苯的实验室制备
2
I + 2Cu
+ H2
+ 2CuI
联苯为无色晶体,熔点70℃,沸点254℃,不溶于水 而溶于有机溶剂.
3,联苯的命名:
32
2' 3'
32
2' 3'
2" 3"
Cl
卤化
Fe,C6H6
Cl2
硝化
HNO3
H2SO4
30~60℃
NO2
16
磺化:萘磺化反应的位置与温度有关,低温下多为α-萘磺酸, 较高温度时则主要是β-萘磺酸。
SO3H
40-80oC
+ H2SO4
160oC
96%
160oC H2SO4
SO3H
85%
由于磺化反应是可逆的,磺酸基体积又较大,导致在低温下主 要生成α-萘磺酸(动力学控制的反应);在高温下,主要生成β萘磺酸(热力学控制的反应)。
《有机化学》第7章 芳香烃

所以如果希望获得所需的产物,使用正确的反应步骤是重要的。
2023/6/13
18
第三节 稠环芳烃
一、 萘
萘,分子式C10H8,光亮的片状结构,熔点80.2 ℃,沸点218 ℃,有特殊气味,易 升华,不溶于水,易溶于乙醇、乙醚、苯等有机溶剂。其化学性质与苯相似。
2023/6/13
11
⑷ 傅-克(Friedel-Crafts)反应 ① 烷基化反应 凡在有机化合物分子中引入烷基的反应,称为烷基化反应。反
应中提供烷基的试剂叫烷基化剂,它可以是卤代烷、烯烃和醇。
当烷基化剂含有三个或三个以上直链碳原子时,产物发生碳链异构。
② 酰基化反应 凡在有机化合物分子中引入酰基(
①若原有两个取代基不是同一类的,则第三个取代基进入的位置一般受邻、对 位定位基的支配,因为邻、对位基反应的速率大于间位基。
②若原有两个取代基是同一类的,则第三个取代基进入的位置主要受强的定位基 的支配。
2023/6/13
17
⑵ 选择适当的合成路线
例如:由甲苯制备对硝基苯甲酸。
比较这两个结构,反应步骤必须是先硝化,后侧链氧化。
1.取代反应
在萘环上,p电子的离域并不像苯环那样完全平均化,而是在α-碳原子上的电子 云密度较高,β-碳原子上次之,中间共用的两个碳原子上更小,因此亲电取代反应 一般发生在α位。
⑴ 卤化反应
在Fe或FeCl3存在下,将Cl2 通入萘的苯溶液中,主要得到α-氯萘。α-氯萘为无 色液体,沸点259 ℃,可做高沸点溶剂和增塑剂。
2023/6/13
6
苯分子去掉一个氢原子后的基团(C6H5―)叫做苯基,也可以用Ph―代 表。芳烃分子的芳环上去掉一个氢原子后的基团叫做芳基,可用Ar―代表。甲 苯分子中苯环上去掉一个氢原子后所得的基团CH3C6H5―称甲苯基;如果甲苯 的甲基上去掉一个氢原子,C6H5CH2―称苯甲基,又称苄基。
第七章 多环芳烃

第七章 多环芳烃1、 联苯及其衍生物2、 稠环芳烃:萘、蒽、菲及其衍生物的结构和化学性质1、 芳香体系与休克尔规则基本要求:1.熟练掌握稠环芳烃萘蒽等衍生物的命名。
2.熟练掌握萘的化学性质及萘环上亲电取代产物的定位规律。
3.掌握H ückel 规则,理解芳香性的概念,能应用H ückel 规则判断环状化合物的芳香性。
分子中含有多个苯环的烃称作多环芳烃。
多环芳烃可分如下三种:联苯和联多苯类:这类多环芳烃分子中有两个或两个以上的苯环直接以单键相联结。
稠环芳烃:这类多环芳烃分子中有两个或两个以上的苯环以共用两个碳原子的方式相互稠合。
多苯代脂肪类:这类多环芳烃可看作是脂肪烃中两个或两个以上的氢原子被苯基取代。
7.1联苯及其衍生物联苯是两个苯环通过单键直接连接起来的二环芳烃。
其结构为:联苯为无色晶体,熔点70℃,沸点254℃。
不溶于水而溶于有机溶剂。
因其沸点高和具有很好的热稳定性,所以工业上常用它作热传导介质(热载体)。
联苯的化学性质与苯相似,在两个苯环上均可发生磺化、硝化等取代反应。
联苯环上碳原子的位置采用下列所示的编号来表示:联苯可看作是苯的一个氢原子被苯基取代,而苯基是邻对位定位基,所以,当联苯发生取代反应时,取代基进入苯的对邻位和对位。
但由于邻位上的空间位阻较大,主要生成对位产物。
7.2稠环芳烃有多个苯环共用两个或多个碳原子稠合而成的芳烃称为稠环芳烃。
简单的稠环芳烃如萘、蒽、菲等。
稠环芳烃最重要的是萘。
7.2.1萘(naphthalene)萘的结构:平面结构,所有的碳原子都是sp 2杂化的,是大π键体系。
分子中十个碳原子不是等同的,为了区别,对其编号如下: 萘的一元取代物只有两种,二元取代物两取代基相同时有10种,不同时有14种。
萘的物理性质:萘是白色晶体,熔点80.5℃,沸点218℃,有特殊气味,易升华,不溶于水,易溶于热的气醇及乙醚,常用作防柱剂。
萘在染料合成中应用很广,大部分用于制造邻苯二甲酸酐。
第7章、多环芳烃和非苯芳烃
Br2 FeBr3
高温
SO3H
H2SO4
有机化学 芳烃 19
蒽的化学性质
② 加氢 氢化时多在 9 、 10 位,这样氢化后形 成两个苯环,稳定性高。若在其它位置,则产物中 留下一个萘环,相比之下,萘环不如苯环稳定,所 以氢化亦多在9、10位加成。
Zn HCl
9,10-二氢蒽
③ 氧化 蒽比苯易氧化,发生在 位,生成 9,10-蒽醌,是重要的化工原料,其衍生物是许多 醌式染料的中间体。 O
有机化学
芳烃
常见的非苯芳香体系
碳原子数 电子数 离域键 (4n+2)n值
0
3 2
2 3
1
5 6
6 5
1
6 6
6 6
1
7 6
6 7
8 10 2
10 8
以上这些结构不具有苯的六员环结构,但却有与 苯相似的芳香性。
芳烃 26
有机化学
例:
该化合物由一个五员环和一个七员环 稠合而成。其外围有 10 个电子,经测 定,该化合物有偶极距(烃类,应无 偶极距或偶极距很小),但其=1.0D, 这说明分子中发生了电子偏移。 原因是,七员环中的一个电子转移到 五员环中,则两个环都有6个电子,符 合4n+2规则,则两部分都有芳香性, 使体系能量降低,分子稳定。该化合 物是一个芳香化合物,具有芳香性。
如:6,6’-二硝基-2,2’-联苯二甲酸的异构体
镜面
有机化学 芳烃 6
(6) 重要联苯衍生物——联苯胺(4,4’-二氨基联苯):
无色晶体; 熔点127℃ ; 是合成多种染料的中间体; 该化合物毒性大,且有致癌可能,近来很少用。
徐寿昌《有机化学》(第2版)配套题库【名校考研真题】(上册) 第7章~第10章【圣才出品】

第7章多环芳烃和非苯芳烃一、选择题1.下列化合物有芳香性的是()。
[华中科技大学2000研]【答案】(B),(C)【解析】(B)项分子中有6个π电子,符合休克尔规则;(C)项中的七元环带一个单位正电荷,五元环带一个单位负电荷,这样七元环和五元环的π电子数都为6个,且在同一平面内,都符合休克尔规则。
2.下列化合物中有芳香性的是()。
[中国科学院-中国科学技术大学2001研]【答案】(A)【解析】(A)中有10个π电子数,符合休克尔规则。
3.薁的亲核取代反应容易发生在哪些位置上?()[上海大学2004研]A.1、2和3位B.1和3位C.5和7位D.4、6和8位【答案】D【解析】薁的七元环带一单位正电荷,五元环带一单位负电荷,是典型的非苯芳烃,有芳香性。
七元环显正电性,易受亲核试剂的进攻,同时亲核反应发生在4、6和8位时,活性中间体中五元环带一单位负电荷,较稳定。
4.如果薁进行亲电取代反应,那么容易发生在哪些位置上呢?()[上海大学2004研]A.1、2和3位B.1和3位C.5和7位D.4、6和8位【答案】B【解析】薁的五元环带负电荷,易受亲电试剂进攻,故亲电反应发生在五元环,同时亲电反应发生在1和3位时,活性中间体碳正离子较稳定。
二、填空题1.命名:。
[武汉理工大学2004研]【答案】β-5-硝基萘乙酸(或5-硝基-2-羧甲基萘)【解析】以羧酸作为主体命名或以萘作为主体命名都可。
2.用系统命名法命名:。
[华中科技大学2002研]【答案】5-硝基-1-溴萘【解析】以萘作为主体进行命名,取代基的列出顺序按顺序规则,将小基团优先列出。
3.写出化合物9,10-二溴菲的结构式。
[华东理工大学2004研]【答案】【解析】要熟悉菲的取代基编号顺序:三、简答题1.杯烯具有较大的偶极矩(5.8D),为何?[上海大学2004研]答:杯烯中电子离域,五元环带一个单位负电荷,三元环带一个单位正电荷,这样五元环电子数为6,三元环电子数为2,都符合休克尔规则,为稳定的芳香结构。
第7章芳烃及非苯芳烃详解

— 3H2
7.3.2 石油的芳构化 2.烷烃脱氢环化和再脱氢
C H3 C H2 C H2 C H2 C H3 C H2
—H2
—3H2
3.环烷烃异构化和脱氢
C H3
异构化
—3H2
4.石油裂解生成的副产品也有一定量的芳烃。
7.4 单环芳烃的物理性质 单环芳烃不溶于水,而溶于汽油,乙醚和四氯化 碳等有机溶剂。 一般单环芳烃都比水轻。 沸点随相对分子量增高而升高。 对位异构体的熔点一般比邻位和间位异构体的高 (可能是由于对位异构体分子对称,晶格能较大之故)。 芳环骨架的伸缩振动表现在: 1625~1576 cm-1和 1525~1475 cm-1 处有两个吸收峰。 芳环的C-H伸缩振动在3100~3010 cm-1。 苯的取代物及其异构体在 900~650 cm-1处具有特 殊的C-H面外弯曲振动。
OH
OH
C O 2H
S O 3H
C H 2C H 3
S O 3H
对乙基苯酚
间羟基苯磺酸
邻磺基苯甲酸
芳基、苯基、苄基 芳基:芳烃分子的芳环上减去一个H后的基团, 用“Ar”表示。 苯基:苯分子上减去一个H后的基团,用“Ph” 表示。
苄基:甲苯的甲基上减去一个H。 7.3 单环芳烃的来源和制备 1845年-1940年期间 7.3.1 煤的干馏
C H3
C H3
邻二甲苯 (1,2-二甲苯)
间二甲苯 (1,3-二甲苯)
对二甲苯 (1,4-二甲苯)
三元取代物:用数字代表取代基的位置或用“连, 偏,均”字表示它们的位置。
C H3 C H3
C H3 C H3
C H3
C H3
H3C
C H3
1,2,3-三甲苯 (连三甲苯)
有机化学第7章,ppt

苯分子环状结构及π电子云分布图
共振论认为苯的结构是两个或多个经典结构 的共振杂化体:
共振能=极限结构的能量-杂化体的能量
苯的氢化热比假想的 1,3,5-环己三烯的低 150 kJ· -1,称作共振能或离域能,体现了苯的稳定性。 mol
7.2.3 分子轨道理论对苯结构的处理
苯的分子轨道模型
反键轨道
sp 2 杂 化
H E +E
+
sp 3 杂 化
E
π络合物
+
+
+ -H
E
+H
取代苯
+
亲电试剂
σ络合物
讨论:1.当过渡态
+H
E
+
比
H E+
+
稳定时,中间体 σ
H E+
络合物较难形成,一旦形成后很快转化成产物。
+H
2.当过渡态 + 比 + 能量相近时, σ 络合物能逆转回反应物,即反应可逆。
K
2K, T HF
K
=
=
2K+
0.1462nm
成环 C 不在同一平面 π 电子 = 8 不能形成环状共轭体系
无 芳 性
成环 C 在同一平面 π 电子 = 10 n = 2 环状闭合共轭体系
有芳 性
薁
7 6 5 4 3 8 1 2
天蓝色片状固体,熔点90° 含10个π 电子,成环C都在同一平面 是闭环共轭体系,有芳性
的毒性,吸入过量苯蒸气,急性中毒引起神经性 头昏,并可发生再生障碍性贫血,急性白血病; 慢性中毒造成肝损伤。
沸点
b.p:与偶极矩有关: o- > m- , p蒸馏法分离出邻位异构体
有机化学-第七章

7.2 苯环上的亲电取代反应
苯与亲电试剂E+作用时,亲电试剂先与离域的π电子结合, 生成π络合物。 亲电试剂从苯环的π体系中得到两个π电子,与苯环上一 个碳原子形成σ键。这个碳原子由sp2杂化变成sp3杂化状 态,苯环中的闭合共轭体系被破坏,变成四个π电子离域 在五个碳原子上。 σ络合物的能量比苯高,不稳定。它很容易从sp3杂化碳 原子上失去一个质子,使该碳原子恢复成sp2杂化状态, 再形成六个π电子离域的闭合共轭体系——苯环。
练习
1. 排列下列化合物的亲电取代活性顺序
(1)
7.2 苯环上的亲电取代反应
(2)
7.2 苯环上的亲电取代反应
2. 利用什么二取代苯, 经亲电取代反应制备下列化 合物:
7.3
单环芳烃的加成及氧化反应
7.3 单环芳烃的加成及氧化反应
一、加成反应
1.加氢反应
苯在液相中用碱金属和乙醇还原,通常生成 1,4-环己二烯,这个反应称为伯奇(Birth) 反应:
7.1 芳香烃的分类及结构
练习
利用休克规则判断下列化合物是否有芳香性?
无
有
有
无
无
7.2
苯环上的亲电取代反应
本章重点
7.2 苯环上的亲电取代反应
一、苯环上亲电取代反应机理
苯环上没有典型的 C=C 双键性质,但环上电子 云密度高,而易被亲电试剂进攻,引起 C—H 键 的氢被取代,这种由亲电试剂的进攻而引起的取 代反应,称为亲电取代反应。 从苯的结构可知,苯环碳原子所在平面上下电子 密度高,有利于亲电试剂的进攻。
苯分子环状结构
7.1 芳香烃的分类及结构
价键理论对苯结构的处理
有机化学第七章芳香烃

2-苯基-2-丁烯
3-苯基丙烯
苯乙烯
Organic Chem
§2、苯的结构
一、苯的Kè kulè 结构
1834年 经元素分析、分子量测定 C6H6
C6H6 +
FeCl3 Br2 → C6H5Br
+ HBr
H
只得到一种取代苯——苯中的六个H原子完全等价 1865年 Kèkulè 提出苯的结构式应为:
Organic Chem
§1.芳香化合物的分类和命名
一、分类:
CH3 CH CH2
单环芳烃—只含有一个苯环:
联苯类:ቤተ መጻሕፍቲ ባይዱ
多环芳烃:
多苯代脂烃: 稠环芳烃:
C H
CH CH
Organic Chem
二、命名:
CH3 Cl NO2
1.一取代苯 甲苯 氯苯 硝基苯
有些一取代苯另有专门名称---取代基与母体一起作为新的母体
CH3 + Cl2
FeCl3
+ Cl
CH3 CCl3
h
CH2 Cl
控制苯过量,不要太激烈, 避免二卤代
H
H H
H H H
H H H
同期还有许多结构提出:
H
H H H
H H H
H
Organic Chem
Kè kulè 式被广泛被接受,但仍面临下列难题:
Br Br Br
1.只有一种邻二溴代苯
(按Kèkulè式应该有两种):
Br
却不发生加成 2.高度不饱和的分子:而发生取代 不与氧化剂反应; 3.特殊的稳定性: 在化学反应或降解中保持不变; 氢化热和燃烧热低
OH NH2 SO3H COOH
第七章多环芳烃
H
2
165度
SO
4
H2SO4 165度
SO3H
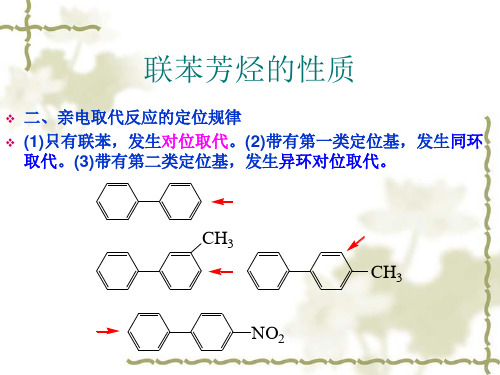
萘的磺化
出现上述现象是由于在-萘磺酸中 由于磺酸基体积较大,与邻环8位上 H
的氢原子距离较近,存在着范德华
SO3H
H SO3H
张力。而在-萘磺酸中,这种空间
H
斥力较小,因此-萘磺酸比-萘磺酸稳定。所以在高温下-
萘磺酸是主要产物。但 由于-位电子云密度较高,反应活化
HH
H
H
K2Cr2O7 + H2SO4
OO 9,10-菲醌
9,10-菲醌是一种农药,可防治小麦莠病和红薯黑斑病等。
7.4 非苯芳烃
在有机化合物中,除苯系芳烃外,还有一些环状烯烃及离子和一 些轮烯等,它们虽然不含有苯环,但却具有闭合的离域大键, 它们的性质也和苯相似,不易加成和氧化,易发生亲电取代反 应,即具有芳香性。常把这类不含苯环的,具有芳香性的环状 多烯化合物叫非苯芳烃。
7.3 蒽和菲
除了萘,蒽和菲是较重要的稠环芳烃,它们和萘一起存
在于煤焦油中,蒽和菲是同分异构体,命名时有固定
的编号。 8 9 1
7
2
6
3
5 10 4
9 8
10 1
7
2
6 5 43
一、蒽和菲的结构
一、蒽和菲的结构
蒽和菲都是平面型分子,C为SP2杂化,都存在一个闭
π 合的离域大键(
14 14
)。但它们与苯和萘相比,
COCH3
+ CH3COCl
AlCl 3 CH2Cl2 0度
-萘乙酸是一个重要的植物生长调节剂。
2. 萘的还原反应
萘比苯更易进行加成和还原,但比烯烃难。如:
芳烃及非苯芳烃

1
2
3
联苯及其衍生物 (简讲)
工业: 2
3'
700~800℃ 4' 通过铁管 5'
2' 2 1' 1 6' 6
3 4
5 + H2
实验室: 2
I + 2 Cu
+ 2CuI
苯取代苯 :苯基为最弱的 O,P 基. 取代时,主要进入对位,也有少量邻位产物. 两苯环可饶 C-C 键自由旋转,当有取代基时旋转有 限制,形成异构体.
二 :萘的化学性质
无色片状,特殊臭味,常用卫生球为粗萘,
易取代,与苯相比易加成。
(一):取代反应 (比苯容易,芳香性比苯弱)
1: 卤代
Br
+ Br2 100℃
+ HBr
α -溴代萘
不用催化剂,比苯活泼.
2: 硝化
HNO3,H2SO4 室温
NO2
+
NO2
(苯硝化须加热)
95%
Zn/HCl 还原
5% NH2
α -萘胺
3: 磺化
60℃
SO3H α -萘磺酸
+ H2SO4
165℃
165℃
SO3H β -萘磺酸
α 位空间阻力大,不稳定,但生成速度快,低温以α 位 为主; 高温时,β 位也易生成,稳定,以β 位为主.
4: 付氏烷基化产率低,无价值.
(三) 氧化反应 (比苯容易)
O
+ O2 V2O5 400℃
§7-1 芳香性
芳香性:
化合物具有的环稳定,易亲电取代, 难加成,难氧化的性质,称为芳香性。
芳香性判椐---休克尔规则 (1)环状共平面,即原子SP2杂化; (2) ∏电子数符合(4n+2). 注:n=0,1,2……整数;二条件同时具备.
徐寿昌《有机化学》(第2版)名校考研真题(多环芳烃和非苯芳烃)【圣才出品】

第7章多环芳烃和非苯芳烃一、选择题1.下列化合物有芳香性的是()。
[华中科技大学2000研]【答案】(B),(C)【解析】(B)项分子中有6个π电子,符合休克尔规则;(C)项中的七元环带一个单位正电荷,五元环带一个单位负电荷,这样七元环和五元环的π电子数都为6个,且在同一平面内,都符合休克尔规则。
2.下列化合物中有芳香性的是()。
[中国科学院-中国科学技术大学2001研]【答案】(A)【解析】(A)中有10个π电子数,符合休克尔规则。
3.薁的亲核取代反应容易发生在哪些位置上?()[上海大学2004研]A.1、2和3位B.1和3位C.5和7位D.4、6和8位【答案】D【解析】薁的七元环带一单位正电荷,五元环带一单位负电荷,是典型的非苯芳烃,有芳香性。
七元环显正电性,易受亲核试剂的进攻,同时亲核反应发生在4、6和8位时,活性中间体中五元环带一单位负电荷,较稳定。
4.如果薁进行亲电取代反应,那么容易发生在哪些位置上呢?()[上海大学2004研]A.1、2和3位B.1和3位C.5和7位D.4、6和8位【答案】B【解析】薁的五元环带负电荷,易受亲电试剂进攻,故亲电反应发生在五元环,同时亲电反应发生在1和3位时,活性中间体碳正离子较稳定。
二、填空题1.命名:。
[武汉理工大学2004研]【答案】β-5-硝基萘乙酸(或5-硝基-2-羧甲基萘)【解析】以羧酸作为主体命名或以萘作为主体命名都可。
2.用系统命名法命名:。
[华中科技大学2002研]【答案】5-硝基-1-溴萘【解析】以萘作为主体进行命名,取代基的列出顺序按顺序规则,将小基团优先列出。
3.写出化合物9,10-二溴菲的结构式。
[华东理工大学2004研]【答案】【解析】要熟悉菲的取代基编号顺序:三、简答题1.杯烯具有较大的偶极矩(5.8D),为何?[上海大学2004研]答:杯烯中电子离域,五元环带一个单位负电荷,三元环带一个单位正电荷,这样五元环电子数为6,三元环电子数为2,都符合休克尔规则,为稳定的芳香结构。
第7章 重金属及其它有机污染物

第7章重金属及其它有机污染物在食品安全领域中,重金属的概念和范围并不十分严格,一般是指对生物有显著毒性的一类元素,而其它有机污染物主要包括N-亚硝基化合物、多环芳烃化合物、杂环胺类化合物和二恶英等化合物。
7.1重金属从毒性角度出发,重金属既包括有毒元素如铅、镉、汞、铬、锡、镍、铜、锌、钡、锑、铊等金属,也包括铍、铝等轻金属和砷、硒等类金属,非金属元素氟通常也包括在内。
自从20世纪50年代日本出现水俣病和痛痛病,最终查明是由于食品遭到汞污染和镉污染所引起的,自此以后,重金属所造成的食源性危害问题开始引起人们极大的关注。
7.1.1重金属污染食品的途径重金属污染食品的途径除高本底的自然环境以外,主要是人类活动造成的环境污染。
其中造成食品污染的主要渠道是工业生产中三废的不合理排放,农业上施用含重金属的农药和化肥等;其次是原料、添加剂、加工机械、容器、包装、贮存和运输等环节可能对食品造成重金属污染。
7.1.2重金属的毒性作用特点人体摄入的重金属,不仅其本身表现出毒性,而且可在人体微生物作用下转化为毒性更大的金属化合物,如汞的甲基化作用。
另外其他生物还可以从环境中摄取重金属,经过食物链的生物放大作用,在体内千万倍地富集,并随食物进入人体而造成慢性中毒。
一般认为,重金属的中毒机理是:重金属离子与蛋白质分子中的巯基、羧基、氨基、咪唑基等形成重金属配合物,可产生使酶阻断或使膜变性等生理毒害作用。
重金属形成的化合物在体内不易分解,半衰期较长,有蓄积性,可引起急性或慢性中毒反应,还有可能产生致畸、致癌和致突变作用。
重金属在体内的毒性作用受许多因素影响,如与侵入途径、浓度、溶解性、存在状态、膳食成分、代谢特点及人体的健康状况等因素密切相关。
在众多有毒元素中,以铅、镉、汞、砷等元素对食品安全的影响最为严重,下面主要介绍它们的污染来源以及常用的国家标准检测方法。
7.1.3铅对食品的污染铅(lead,Pb)为灰白色金属。
铅的氧化态有0、+2和+4。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
O Zn-Hg O HCl
O
Pt, - H2 Phenanthrene
PPA:多聚磷酸
② 氧化反应
萘比苯易氧化,室温下萘可被CrO3/HOAc氧化得1, 4—萘醌,若在高温下,V2O5催化下被空气氧化,则 得重要的有机化工原料邻苯二甲酸酐,简称苯酐。
O
V2O5,O2
C O C O O
邻苯二甲酸酐
CrO3,CH3COOH
Cl
Fe,C6H6
卤化
Cl2
NO2
HNO3
硝化
H2SO4
30~60℃
16
磺化:萘磺化反应的位置与温度有关,低温下多为α -萘磺酸, 较高温度时则主要是β -萘磺酸。
SO 3H
40-80 C 160oC H2SO4 + H2SO4 160 C
o
o
96%
SO 3H
85%
由于磺化反应是可逆的,磺酸基体积又较大,导致在低温下主 要生成α-萘磺酸(动力学控制的反应);在高温下,主要生成β萘磺酸(热力学控制的反应)。 17
芘 电子数=16 (周边14)
(3)轮烯:环多烯CnHn,n≥10,称为轮烯。
[10]轮烯虽有10个π电子,因环内氢的相互作用, 使C不能同处在同一平面内,不能共轭,无芳性。 [14]、[18]轮烯都有芳性。
H
H
[10]轮烯 [18]轮烯
48
[18]轮烯是平面形分子,电子数为18,具有芳香性。
☺ 联苯胺是合成多种染料的中间体. ☺ 联苯胺制备:
① 4,4′-二硝基苯还原得到. ②工业上由硝基苯为原料,经联苯胺重排反应而来.
氢化偶氮苯 (重排) 联苯胺
7.3 稠环芳烃:
稠环芳烃:两个或多个苯环共用两个邻位碳原子的化合物。
几种重要的稠环芳烃:萘、蒽、菲、致癌芳烃。
Naphthalene 萘
O
二甲苯
O O
O
O O
36
H2 Pd/C
Br
Br 9,10-二氢化蒽
Br2/CCl 4
- HBr
Br O
9- bromoanthracene
Na2Cr2O7 H2SO4 D- A
CO O CO
Anthraquinone
O
CO O CO
9,10-蒽醌
•蒽的加成反应发生在位的原因是由于加成后能生成稳定产物: 在位加成产物的结构中还留有两个苯环 (共振能约为301 kJ/mol); 位或位的加成产物则留有一个萘环(共振能255kJ/mol). 前者比后者稳定.
磺酸基的空间位阻
-萘磺酸位阻大
-萘磺酸位阻小,产物更稳定
α 位活泼 反应速度快 低温产物 动力学控制
β 位稳定 反应速度慢 高温产物 热力学控制
*共振论的解释
E H +
+ H Cl
+ E H
E H +
-位取代两个共振 式都有完整的苯环。
-位取代只有一个共 振式有完整的苯环。
-位电子云密度高,所以-位的亲电取代是 动力学控制(速度控制)的反应。 -位的空阻比-位大,所以-位的亲电取代 是热力学控制(平衡控制)的反应。
41
三元环
O
O
+
无芳香性
Cl
无芳香性
有芳香性
SbF5, SO2 -75oC
+ +
有芳香性
环丁二烯:分子轨道中非键轨道为半充满,是 极不稳定的体系,离域电子数符合4n规则,称 为反芳性物质,很不稳定。
43
四元环
无芳香性
CH3 CH3
CH3 Cl Cl CH3
SbF5, SO2
CH3 ++ CH3
8 7 6 5
1 2 3 4
1,4,5,8称为位, 2,3,6,7称为位, 电荷密度位> 位。 萘的一取代异构体有两种:α —和β —取代物;
二取代异构体如是相同的原子或基团有10种异构体, 不同基团有14种异构体。
1,5—二硝基萘
α—萘磺酸
CH3
对甲基萘磺酸
SO3H
4) 化学性质
与苯相似,但比苯活泼,易发生亲电取代、加成、氧 化等反应,且反应时α —H比β —H活泼。 ① 亲电取代 (反应条件较温和,取代主要发生在α位)
8 1 28 7 9 6 5 8 9 1 2 3
1 2 3 10 4
4
3 4
5
4
2 1 10
2 1
7
4
3
35 8
35
6
5
Anthracene
蒽
10
8
Phenanthrene 9
菲
10
9
7.3.1、萘及其衍生物
1) 物性:白色闪光晶体, m.p 80.6℃, b.p 218℃, 易升华,不溶于水。
2) 结构 : C10H8,平面型分子,闭合共轭体系,有芳 性。分子中键长不等:
菲
382 127.3
• 环闭共轭体系(大键); • 电子云分布不均匀;
• 离域能:苯>萘>菲>蒽;
•苯、萘、菲、蒽的芳香性依次减弱; • 9,10位化学活性较大,大部分反应发生在中 位。如氧化、还原、取代、加成等。 35
由于蒽的芳香性比较差,并且在9,10位比 较活泼,因此蒽可以作为二烯体发生Diels-Alder 反应。
第七章 多环芳烃和非苯芳烃
7.1 芳烃的分类
7.2 联苯
7.3 稠环芳烃
7.4 非苯芳烃的判断
(休克尔规则)
1
7.1 芳烃的分类
芳烃通常可分为三大类:
CH 3 NO2
① 单环芳烃:
CH 3
② 多环芳烃:
CH
③ 非苯芳烃:
2
多环芳烃:
联苯类: H2N 多苯代脂烃类:
NH2
CH2
稠环芳烃:
非苯芳烃:
5) 一取代萘的定位规律
a.原取代基为活化基团:
亲电试剂进同环α-位,
CN
且为邻位或对位。
b.原取代基为钝化基团:
–CH3
亲电试剂进异环α-位。
c.磺化及烷基化、酰基化通
常发生在β-位。
(A) 当第一个取代基是邻、对位定位基时: 由于邻、对位定位基能使与其连接的环活化 ,第 二个取代基就进入该环,即发生“同环取代”. 若原来取代基是在位,则第二取代基主要进入同 环的另一位. 例:
主要产物:对羟基萘磺酸
若原来取代基是在位,则第二取代基主要进入 同环相邻的位.
(主要产物) 10 : 1 (次要产物)
特例(不符合规律):
(B) 当第一个取代基是间位定位基时 间位定位基使与其连接的环钝化 , 第二个取代基便 进入另一环上,发生“异环取代”;不论原有取代基是在 位还是在位,第二取代基一般进入另一环上的位. 例1:
例2:
萘的反应总结
O C O C O
四氢化萘
SO 3H
邻苯二甲酸酐
O
V2O5(空气) 400~500℃ CrO3,CH3COOH 10~15℃
Ni/H2
100 %H 2SO 4
-萘磺酸
H 2SO 4 SO 3H
65℃ 165℃
95 %H 2SO 4
O
1,4-萘醌
Pt/H2
Na/EtOH
165℃
-萘磺酸
10 1 2 4 3
蒽分子中1,4,5,8四个位置相同,称为α位;2,3, 6,7四个位置相同,称为β位;9,10两个位置相同称 为γ位。
菲分子中1与8,2与7,3与6,4与5,9与10有五个位 置相同。 34
苯
共振能(kJ· mol-1) 每环共振能 152 152
萘
255 127.5
蒽
351 117
4)环上的π电子能够发生离域,且π电子数为4n+2 。
休克尔规则:环状闭合共轭体系,如果π 电子 数= 4n+2(n=0,1,2,3,4,5),具有芳香性。
39
(1)环多烯(通式为: CnHn)
芳香性: 平面 环状 4n+2 共轭 反芳香性: 平面 环状 4n 共轭
40
环丙烯正离子:闭合共轭,平面型分子, SP2杂化,4n+2=2,n=0,具有芳性。
酰基化
COCH3 AlCl3 CS2 -15oC
O + CH 3CCl
AlCl3 C6H5NO2 250oC
75%
COCH3
90%
① 傅—克烷基化反应应用很少,因为萘比苯活泼, 易形成多烷基化产物。
② 傅—克酰基化常用于合成环系化合物。
O
+
COCH 2CH2COOH AlCl 3 O C6H5NO2 PPA
[18]轮烯
(4)神奇的全碳分子——富勒烯
C60
C70
60个C组成球星32面体,包括12个五边形和20个六边形, 每个C原子都处于两个六环和一个五环的节点上。具有钢强度 的100倍,用于无菌无氧包装、耐压火箭燃料、超导体、人造 器官等。全碳分子包括富勒烯、纳米碳管、布基洋葱。
50
十氢化萘
四氢化萘(萘满)--沸点270.2℃; 十氢化萘(萘烷),沸点191.7℃. 所以都是良好的高沸点溶剂.
四氢化萘
※十氢化萘的两种构象异构体
反式十氢化萘 沸点185℃
顺式十氢化萘 沸点194℃
可将一个环看成另一个环上的两个取代基: 反式的两个取代基均为: e键 顺式的两个取代基为: 一个为e键和一个a键 ∵ 取代基在e键多的稳定, ∴ 反式构象比顺式稳定..
1,4-萘醌
O
23
当萘环上有取代基时,活化基团常使氧化 发生在同环,钝化基团使氧化发生在异环。
NH2
