无机物的分类及性质
高中化学无机物的分类

高中化学无机物的分类全文共四篇示例,供读者参考第一篇示例:高中化学中,无机物是指除了碳氢氧氮这几种元素外的其他元素及其化合物。
在无机物中,我们会发现有很多种不同的化合物,它们具有不同的性质和用途。
为了更好地理解和研究这些无机物,我们可以将它们按不同的性质进行分类。
一、金属物质金属是化学中非常重要的一类无机物,它们具有许多共同的性质,比如导电、导热、延展性等。
金属物质可以进一步分为原子金属和金属化合物两类。
1. 原子金属:原子金属是由单质金属元素组成的物质,通常是由金属原子组成的晶格结构。
常见的原子金属有铁、铜、铝、锌等,它们在化工、建筑、电子等领域都有广泛的应用。
2. 金属化合物:金属元素与非金属元素或其他金属元素形成的化合物称为金属化合物。
金属化合物有着多种不同的结构和性质,比如金属氧化物、金属盐等。
例如氧化铁、氯化钠等都属于金属化合物。
二、非金属物质除了金属物质外,还有许多无机物是由非金属元素构成的。
非金属物质通常具有良好的电绝缘性和化学稳定性,广泛应用在化工、电子、医药等领域。
1. 硅、硼、氟等元素的化合物:非金属元素之间或与金属元素形成的化合物属于这一类别。
例如二氧化硅、氟化氢等都是常见的非金属物质。
2. 非金属氧化物:氧和非金属元素结合形成的化合物称为非金属氧化物。
这类氧化物通常具有酸性,可以在酸碱中起到重要作用。
例如二氧化硫、三氧化硫等。
三、离子类物质离子类物质是指化合物中所含的阳离子和阴离子分别来自金属元素和非金属元素。
这类物质通常具有离子键结构,具有良好的溶解度和导电性。
1. 金属盐:金属原子失去电子形成阳离子,非金属原子获得电子形成阴离子结合而成的化合物称为金属盐。
金属盐在实验室制备、药物生产等方面有广泛应用。
2. 酸、碱:酸和碱是离子类物质中的重要代表,它们可以通过离子间的交换反应产生盐和水。
酸碱反应在化学实验和工业生产中都有着重要作用。
四、氢化合物氢化合物是一类含有氢元素的无机物,通常与金属元素或非金属元素形成共价键结构。
无机化合物的分类

原子间通过共用电子对所形成的化合物,如氯化氢、水等。 这类化合物通常熔点、沸点较低,硬度较小,且不导电。
按物理性质分类
固体无机化合物
如金属氧化物、盐类等,具有固定的形状和体积,不易被压缩。
液体无机化合物
如水、液氨等,无固定形状,有一定的体积,易被压缩。
气体无机化合物
如氧气、氮气等,无固定形状和体积,易被压缩和扩散。此外,还有一些无机化合物在特定条件下可以呈现 出不同的物理状态,如金属氢化物在常温下为固态,但加热后可变为气态。
基本性质
氢氧化物是指金属元素与氢氧根离子 结合形成的化合物,通常呈碱性。
分类
应用
氢氧化物在化工、医药、环保等领域 有广泛应用,如用作中和剂、沉淀剂、 净水剂等。
根据金属元素的性质,氢氧化物可分 为强碱、中强碱和弱碱等。
盐类
1 2
基本性质
金属盐类是指金属元素与酸根离子结合形成的化 合物,具有不同的溶解度和稳定性。
热稳定性
无机化合物的热稳定性因种类而异,如碳 酸盐在高温下易分解生成氧化物和二氧化 碳。
常见反应类型及机理
酸碱反应
无机酸与碱反应生成盐和水,如盐酸与 氢氧化钠反应生成氯化钠和水。
配位反应
金属离子与配体发生配位反应生成配 位化合物,如银离子与氨分子反应生
成银氨配合物。
氧化还原反应
无机化合物中的氧化剂与还原剂发生 电子转移反应,如铁与氯气反应生成 氯化铁。
卤化物
氟化物
氟与其他元素形成的二 元化合物,如CaF2、 NaF等。
氯化物
氯与其他元素形成的二 元化合物,如NaCl、 KCl等。
溴化物和碘化物
溴和碘与其他元素形成 的二元化合物,如NaBr、 KI等。
化学物质的性质分类

化学物质的性质分类化学物质是组成世界万物的基本元素,它们具有不同的性质,可以根据这些性质将化学物质进行分类。
在本文中,我们将探讨化学物质的性质分类及其特点。
一、按物质组成分类1. 无机物无机物是指由无机元素组成的化学物质。
无机元素主要包括金属元素和非金属元素。
无机物的特点是在常温下大多为固体或液体,其化学性质相对稳定,不易变化。
2. 有机物有机物是指由碳元素与氢元素以及其他元素通过共价键组成的化学物质。
有机物的特点是在常温下一般为气体、液体或固体,其化学性质多样,容易发生化学反应。
二、按物质的组织结构分类1. 元素元素是由相同类型的原子组成的纯净物质。
元素的特点是化学性质相对稳定,难以分解成其他物质。
2. 化合物化合物是由不同类型的原子通过化学键结合而成的物质。
化合物的特点是具有新的物理和化学性质,可以通过化学反应分解成其他物质。
三、按物质的物理性质分类1. 固体固体是一种具有定形和定体积的物质,其分子或离子之间通过相互作用力结合在一起。
固体的特点是具有一定的硬度和强度,不易流动。
2. 液体液体是一种具有定体积但没有定形的物质,其分子或离子之间通过相互作用力保持在一定的距离上。
液体的特点是具有一定的流动性和可变形性。
3. 气体气体是一种无定形无定体积的物质,其分子或离子之间通过高速运动相互碰撞。
气体的特点是具有高度的可压缩性和可扩散性。
四、按物质的化学性质分类1. 酸酸是一类能够释放出氢离子(H+)的物质。
酸的特点是酸性物质与碱性物质发生中和反应释放出盐和水。
2. 碱碱是一类能够释放出氢氧根离子(OH-)的物质。
碱的特点是具有苦味、腥味和腻味,与酸发生中和反应释放出盐和水。
3. 盐盐是一类由阳离子和阴离子通过离子键结合而成的物质。
盐的特点是在水中可以电离产生阳离子和阴离子。
4. 氧化物氧化物是一类由氧元素与其他元素结合而成的化合物。
氧化物的特点是与氧气反应可以产生氧化和还原反应。
五、按物质的重要用途分类1. 基础化学物质基础化学物质是指广泛用于制造其他化学品的原始原料。
无机物的分类及性质
钠盐、钾盐、铵盐
根据电离出的阴离子不同
硫酸盐、硝酸盐、碳酸盐
课堂巩固练习
想一想 下列化合物的名称各是什么?分别属于无机物中的哪一类 (金属单质、非金属单质、酸、碱、盐、氧化物)?
Cl2
Al2O3
Ca(OH)2 Mg
Na2CO3 NH3•H2O
HNO3 NaHCO3
第二部分 无机物的性质
一元酸、二元酸…
根据组成元素
有机酸、无机酸
2.2.3 碱的分类及其写法
根据是否完全电离
强碱: NaOH 、Ca(OH)2、KOH 弱碱: NH3•H2O、Cu(OH)2、Fe(OH)2
写法:金属元素先写,氢氧根后写
2.2.4 盐的分类及其写法
根据酸跟碱反应的程度不同
正盐: NaCl、Mg(NO3)2 酸式盐: NaHCO3 碱式盐: Cu(OH)2CO3
(4) 酸+碱→盐+H2O H2SO4+NaOH =Na2SO4 +2H2O
(5) 酸+盐→新酸+新盐 2HCl+Na2CO3 =2NaCl +H2O+CO2↑
3、碱的通性
(1) 碱能使酸碱指示剂变色
紫色石蕊试液遇碱后 变蓝 色 无色酚酞试液遇碱后 变红 色
(2) 碱+非金属化合物→盐+H2O NaOH+CO的分类
1、分类的依据
是否由 同种元素 构成
2、种类
无机物
单质( O2、H2 、Fe、Cu )
化合物(CO2、H2O、HCl、NaOH、NaCl)
2.1 单质
单质
金属单质(Fe、Cu) 非金属单质(O2、H2)
常见无机物有机物性质归纳
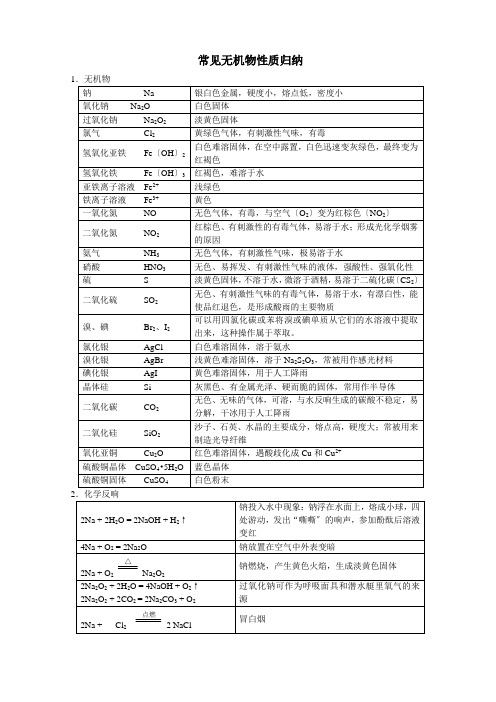
常见无机物性质归纳12Fe + 3Cl 2点燃2FeCl 3 产生棕黄色的烟 Cu + Cl 2点燃CuCl 2 产生棕色的烟 H 2 + Cl 2点燃2HCl产生苍白色火焰Cl 2 + H 2O = HCl + HClOHClO 不稳定,有强氧化性,可做漂白剂,Cl 2可用作漂白剂〔Cl 2不能使枯燥的红纸条退色〕 Cl 2 + 2NaOH = NaCl + NaClO + H 2O制漂白精Cl 2 + 2CaOH = CaCl 2 + Ca 〔ClO 〕2+ H 2O 工业制漂白粉,漂白粉的成分CaCl 2 和 Ca 〔ClO 〕2,有效成分为Ca 〔ClO 〕2 4Fe(OH)2 + O 2 + 2H 2O = 4Fe(OH)3 白色沉淀迅速变成灰绿色,最后变成红褐色 Fe 3+ + 3SCN -= Fe(SCN)3 红色溶液,可用KSCN 、NH 4SCN 溶液检验Fe 3+ Fe + 2H + = Fe 2+ + H 2↑ Fe 具有复原性 2Fe 3+ + Fe = 3Fe 2+Fe 3+具有氧化性Fe 2+ + Zn = Fe + Zn 2+2Fe 2+ + Cl 2 = 2Fe 3+ + 2Cl -Fe2+既有氧化性又有复原性 Na 2CO 3 + 2HCl = 2NaCl + H 2O + CO 2↑ NaHCO 3 + HCl = NaCl + H 2O + CO 2↑ NaHCO 3 + NaOH = Na 2CO 3 + H 2O 2NaHCO 3 △Na 2CO 3 + H 2O + CO 2↑N 2 + O 22NON 2 + 3H 2催化剂 高温高压2NH 3使空气中游离态的氮转化为含氮化合物叫做氮的固定〔固氮〕2NO + O 2 = 2NO 2 3NO 2 + H 2O = 2HNO 3 + NO NH 3 +H 2O = NH 3·H 2ONH 3·H 2O NH 4+ + OH -NH 3·H 2O 呈弱碱性,氨水能使酚酞溶液变红 NH 3 + HCl = NH 4Cl 产生白烟4NH 3 + 5O 2 催化剂△4NO + 6H 2O NH 4HCO 3△ NH 3↑ + H 2O + CO 2↑ NH 4Cl△NH 3↑ + HCl ↑NH 4+ + OH -△NH 3↑+ H 2O 〔用于检验铵根离子〕2NH 4Cl+Ca(OH)2 △CaCl 2 +2NH 3↑+ 2H 2O实验室制氨气,用湿润的红色石蕊试纸检验氨气是否收集满4HNO 34NO 2↑ + O 2↑ + 2H 2O为了防止硝酸见光分解,一般将它保存在棕色试剂瓶里,不能用胶塞 Cu + 4HNO 3(浓) = Cu(NO 3)2 + 2NO 2↑ + 2H 2O 常温下,浓硝酸可使铁、铝钝化3Cu + 8HNO 3(稀)= 3Cu(NO 3)2 + 2NO ↑+ 4H 2O C + 4HNO 3(浓)△CO 2↑+ 2NO 2↑+ 2H 2O 浓、稀硝酸有强氧化性Fe + S △ FeS S + O 2 点燃SO 2 SO 2 + O 2催化剂 加热2SO 3 2H 2S + SO 2 = 3S + 2H 2OCu + 2H 2SO 4(浓) △CuSO 4 + SO 2↑+ 2H 2O 在常温下,浓硫酸使铁、铝钝化 C + 2H 2SO 4(浓) △CO 2↑+ 2SO 2↑+ 2H 2O浓硫酸表现强氧化性 2Mg + CO 2点燃2MgO + C受热或见光放电有机物苯与液溴在铁粉〔FeBr 3〕作催化剂时反响生成溴苯和HBr乙醇 构造:CH 3CH 2OH 〔—OH 称为羟基〕 乙醇俗称酒精,是优良的有机溶剂乙酸构造:CH 3 〔—COOH 称为羧基〕 乙酸俗称醋酸,有酸性,能使紫色的石蕊溶液变红油脂 油脂可用来制取高级脂肪酸和甘油糖类由C 、H 、O 三种元素组成糖类分为单糖〔不水解,如葡萄糖、果糖〕、二糖〔如蔗糖、麦芽糖〕、多糖〔如淀粉、纤维素〕,淀粉水解最终生成葡萄糖 蛋白质属于有机高分子化合物,水解生成氨基酸浓的盐溶液会使蛋白质从溶液中析出,不影响蛋白质的生理活性;紫外线照射、加热或参加有机化合物、酸、碱、重金属盐〔如铜盐、铅盐、汞盐等〕会使蛋白质聚沉,蛋白质失去生理活性。
无机物和有机物的分类

无机物和有机物的分类无机化学是研究无机物质的组成、性质、结构和反应的科学。
它是化学中最古老的分支学科。
无机物质包括所有化学元素和它们的化合物~不过大部分的碳化合物除外。
,除二氧化碳、一氧化碳、二硫化碳、碳酸盐等简单的碳化合物仍属无机物质外~其余均属于有机物质。
,无机物主要包括:单质和无机化合物。
单质又包括金属单质,如:铁、铜、锌等,和非金属单质,如:氢气、氧气、氮气、碳、硅等,无机化合物主要包括:氧化物,如:一氧化碳、二氧化碳、一氧化硫、氧化铁、三氧化铁,、无机酸,如:硫酸、盐酸、硝酸,、碱,如:氢氧化钠、氢氧化钙,、无机盐,如:氯化钠、碳酸钙、硫酸钠,等。
有机化合物的现代定义为:碳氢化合物及其衍生物。
主要包括烃类及其衍生物。
烃类包括:主要包括烷烃,如:甲烷、乙烷、己烷,、烯烃,如:乙烯,、炔烃,如:乙炔,、芳香烃,如:苯、甲苯、蒽、萘, 烃的衍生物包括:醇,如:甲醇、乙醇,、醚,如:乙醚,、醛,如:甲醛,、酮,如:丙酮,、羧酸,如:乙酸,、酯,如:乙酸乙酯,、胺,如:甲胺、苯胺,、酰胺,如:尿素,、杂环类,如:呋喃、糠醛,、核酸和核糖核酸。
玛纳斯:金信化工:硫酸、硫磺、二硫化碳,澳洋科技:液氯、硫酸、氢氧化钠、二硫化碳, 澳洁:硫氢化钠舜泉化纤:液氯、硫酸、氢氧化钠、二硫化碳, 呼图壁县:鸿新石化:凝析油、BTX,苯、甲苯、二甲苯,, 鑫联煤:高温煤焦油、萘、燃料油昌吉市:金茂化工:溶剂油、甲苯,海龙化工:甲醇,锐源通化工:甲醇、甲醛,丰达磷:硫酸,中粮屯河:酒精,焰山乙炔:电石、丙酮、乙炔,屯河聚酯: 1、4—丁二醇~四氢呋喃,低闪点易燃液体,~对苯二甲酸~阜康市:中泰矿业:电石、氧化钙,阜康冶炼厂:液氯、硫酸,吉木萨尔县:派犨型材:电石、氧化钙,庆华:粗苯。
高中化学无机物

高中化学无机物高中化学教学中,无机物是一个重要的知识点,它包括无机酸、碱、盐和氧化物等多种物质。
无机物是指由金属元素、非金属元素或金属元素与非金属元素组成的化合物,其结构稳定,不易发生化学变化。
本文将重点探讨高中化学无机物的性质、分类及应用。
一、性质1. 无机酸:无机酸是一类含有H+离子的化合物,具有酸性,能与碱发生中和反应。
常见的无机酸有硫酸、盐酸、硝酸等。
无机酸的酸性大小与其离子解离的程度有关,离子解离度越高,酸性越强。
2. 碱:碱是一类含有OH-离子的化合物,具有碱性,能与酸发生中和反应。
常见的碱有氢氧化钠、氢氧化钾等。
碱的碱性大小与其提供的氢氧离子的数量有关,提供的氢氧离子越多,碱性越强。
3. 盐:盐是由金属离子与非金属离子或者两种非金属离子组成的化合物,具有各种不同的性质。
常见的盐有氯化钠、硫酸钠、硫酸铜等。
盐的性质取决于其组成离子的种类和数量。
4. 氧化物:氧化物是一类含有氧元素的化合物,与其他物质发生氧化还原反应。
常见的氧化物有氧化铁、氧化铝、氧化钙等。
氧化物的性质与其中金属元素的氧化态有关,氧化态越高,氧化性越强。
二、分类无机物可以根据其成分和性质进行分类,主要分为无机盐、弱酸、强酸、弱碱、强碱等几种类型。
其中,无机盐是最常见和广泛应用的一类无机物,广泛应用于生活和工业生产中。
1. 无机盐:无机盐是由金属离子和非金属离子或者两种非金属离子组成的化合物,其具有各种不同的性质。
常见的无机盐有氯化钠、硫酸钠、硫酸铜等。
无机盐在农业、医药、化工等领域有着重要的应用价值。
2. 弱酸:弱酸是指离子解离程度较低,酸性较弱的无机酸。
常见的弱酸有碳酸、硼酸等。
弱酸通常在实验室中用于制备其他化合物或作为试剂使用。
3. 强酸:强酸是指离子解离程度较高,酸性较强的无机酸。
常见的强酸有硫酸、盐酸、硝酸等。
强酸在工业生产中有着广泛的应用,如用于废水处理、金属清洗等。
4. 弱碱:弱碱是指提供氢氧离子较少,碱性较弱的化合物。
常见无机物有机物性质归纳
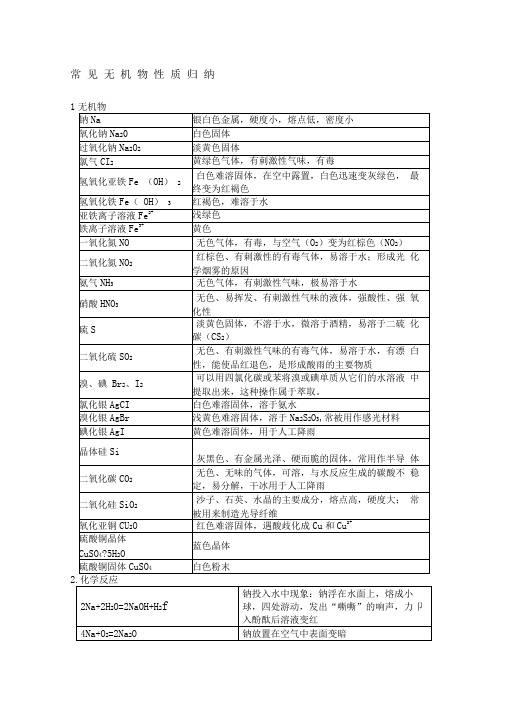
晶体硅Si
灰黑色、有金属光泽、硬而脆的固体,常用作半导 体
二氧化碳CO2
无色、无味的气体,可溶,与水反应生成的碳酸不 稳定,易分解,干冰用于人工降雨
二氧化硅SiO2
沙子、石英、水晶的主要成分,熔点高,硬度大; 常被用来制造光导纤维
氧化亚铜CU2O
红色难溶固体,遇酸歧化成Cu和Cu2+
高温
SiO2+CaOCaSiO3
SiO2属于酸性氧化物
SiO2+4HF=SiF4T+2H2O
此反应常被用来刻蚀玻璃
高温
SiO2+CaCO3CaSiO3+CO2T
高温
SiO2+Na2CO3Na2SiO3+CO2T
生产玻璃发生的主要的化学反应
点燃
4AI+3O22AI2O3
铝在氧气里燃烧,发出耀眼的白光
高温
白色沉淀迅速变成灰绿色,最后变成红褐 色
Fe3++3SCN_=Fe(SCN)3
红色溶液,可用KSCN、NH4SCN溶液检 验Fe3+
Fe+2H+=Fe2++H2T
Fe具有还原性
2Fe3++Fe=3Fe?+
Fe3+具有氧化性
Fe2++Z n=Fe+Z n2+
2Fe2++Cl2=2Fe3++2Cl
Fe2+既有氧化性又有还原性
△
C+2H2SO4(浓)——CO2T+2SO2T+2H2O
浓硫酸表现强氧化性
点燃
2Mg+CO22MgO+C
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2、酸的通性
(1) 酸能使酸碱指示剂变色
紫色石蕊试液遇酸后 变红 色 无色酚酞试液遇酸后 不变 色
(2) 酸+活泼金属→盐+H2↑ H2SO4 +Zn=ZnSO4 +H2 ↑
(3) 酸+金属氧化物→盐+H2O H2SO4+CuO =CuSO4 +H2O
铁(Fe)、铜(Cu)、锌(Zn)、银(Ag) 汞(Hg)、碘(I)
第一部分 无机物的分类
1、分类的依据
是否由 同种元素 构成
2、种类
无机物
单质( O2、H2 、Fe、Cu )
化合物(CO2、H2O、HCl、NaOH、NaCl)
2.1 单质
单质
金属单质(Fe、Cu) 非金属单质(O2、H2)
气体单质一般都是双原子分子,稀有气体除外 固体单质常为单原子分子
(3) 盐+碱→新盐+新碱 CuSO4+NaOH=Na2SO4+Cu(OH)2↓
(4) 盐1+盐2→盐3+盐4 NaCl+AgNO3=AgCl↓+NaNO3
本节小结
1、无机物的分类 2、酸、碱、盐、氧化物的组成、分类和命名 3、无机物的性质
课堂巩固练习
1、二氧化碳、三氧化硫是什么氧化物? 2、氧化钙、氧化镁是什么氧化物? 3、氨水属于什么碱? 4、硫酸、碳酸、磷酸分别属于什么酸? 5、碳酸氢钠是什么盐? 6、请写出铝和稀盐酸的反应式; 7、请写出BaCl2和Na2SO4的反应式;
根据电离出的阳离子不同
钠盐、钾盐、铵盐
根据电离出的阴离子不同
硫酸盐、硝酸盐、碳酸盐
课堂巩固练习
想一想 下列化合物的名称各是什么?分别属于无机物中的哪一类 (金属单质、非金属单质、酸、碱、盐、氧化物)?
Cl2
Al2O3
Ca(OH)2 Mg
Na2CO3 NH3•H2O
HNO3 NaHCO3
第二部分 无机物的性质
无机物的分类及性质
本节内容
复习常用化学元素 无机物的分类 无机物的性质 小结
常用化学元素
氢(H)、氦(He)、锂(Li)、铍(Be) 硼(B)、碳(C)、氮(N)、氧(O) 氟(F)、氖(Ne)、钠(Na)、镁(Mg) 铝(Al)、硅(Si)、磷(P)、硫(S) 氯(Cl)、氩(Ar)、钾(K)、钙(Ca)
一元酸、二元酸…
根据组成元素
有机酸、无机酸
2.2.3 碱的分类及其写法
根据是否完全电离
强碱: NaOH 、Ca(OH)2、KOH 弱碱: NH3•H2O、Cu(OH)2、Fe(OH)2
写法:金属元素先写,氢氧根后写
2.2.4 盐的分类及其写法
根据酸跟碱反应的程度不同
正盐: NaCl、Mg(NO3)2 酸式盐: NaHCO3 碱式盐: Cu(OH)2CO3
命名方法
氧化某: MgO、CuO 几氧化几某: P2O5、Fe3O4 几氧化某: CO2、SO2
2.2.2 酸的分类方法及书写
根据是否完全电离
强酸: HCl、H2SO4、HNO3 弱酸: H2CO3、HClO、H2S
根据是否含有氧元素
含氧酸、无氧酸
根据能电离出的氢离子个数
(4) 酸+碱→盐+H2O 2H2O
(5) 酸+盐→新酸+新盐 2HCl+Na2CO3 =2NaCl +H2O+CO2↑
3、碱的通性
(1) 碱能使酸碱指示剂变色
紫色石蕊试液遇碱后 变蓝 色 无色酚酞试液遇碱后 变红 色
(2) 碱+非金属化合物→盐+H2O NaOH+CO2=Na2CO3+H2O
2.2 化合物
化合物
氧化物( CuO、Fe3O4、CO2 ) 酸( HCl、H2SO4、HNO3 ) 碱( NaOH 、Ca(OH)2、KOH、NH3•H2O ) 盐( NaCl 、NaHCO3、Cu(OH)2CO3 )
2.2.1 氧化物的分类及命名方法
分类
酸性氧化物: CO2、SO2 碱性氧化物:CaO 两性氧化物:Al2O3 不成盐氧化物:H2O、NO、CO 其他复杂氧化物:Na2O2、KO2
1、金属的性质
(1) 金属的活泼性 K﹥Ca ﹥ Na ﹥ Mg ﹥ Al ﹥ Zn ﹥ Fe ﹥ Sn ﹥ Pb(H) ﹥ Cu ﹥ Hg ﹥ Ag ﹥ Pt ﹥ Au
(2) 金属活泼性的意义
金属位置越靠前,其在水溶液中就越容易失去电子而变成离 子,活泼性越强
(3) 金属活泼性顺序的应用
排在氢前的金属能够置换出酸中的氢(元素) Zn+HCl=ZnCl2+H2↑
(3) 碱+酸→盐+H2O NaOH+HCl =NaCl +H2O
(4) 碱+盐→新盐+新碱 Ba(OH)2+ Na2SO4=BaSO4↓+NaOH
4、盐的性质
(1) 盐+金属→新盐+新金属 Fe+CuSO4=FeSO4+Cu
(2) 盐+酸→新盐+新酸 CaCO3+HCl=CaCl2++H2O+CO2↑
