第三章 酶与酶促反应
第三章酶与酶促反应练习题200407153409

第三章酶与酶促反应练习题一、单项选择题1. 大多数酶的化学本质是()A. 蛋白质B. 维生素C. 多糖D. 磷脂E. 胆固醇2. 以下哪项不是酶的特点?()A. 大多数酶是细胞制造的蛋白质B. 易受pH值、温度等外界因素的影响C. 能加速反应,能改变反应平衡点D. 催化效率极高E. 有高度特异性3. 酶促反应中决定反应特异性的是()A. 酶蛋白B. 辅基C. 辅酶D. 金属离子 E .变构剂4. 酶促反应速度(V)达最大反应速度(Vm)的60%时,底物浓度[S]为()A. 1 K mB. 2 K mC. 1.5 K mD. 2.5 K mE. 3 K m5. 酶蛋白变性后其活性丧失,是因为()A. 酶蛋白完全被降解为氨基酸B. 酶蛋白的一级结构受破坏C. 酶蛋白的空间结构受破坏D. 酶蛋白不再溶于水E. 失去了激活剂6. 酶分子中将底物转变为产物的基团是()A. 结合基团B. 催化基团C. 碱性基团D. 酸性基团E. 疏水基团7. 温度对酶活性的影响是()A. 低温可以使酶失活B. 催化的反应速度随温度的升高而增加C. 最适温度是酶的特征性常数D. 最适温度随反应的时间而有所变化E. 以上全对8. pH值对酶促反应速度的影响,下列哪项是对的()A. pH值对酶促反应速度影响不大B. 不同酶有其不同的最适pH值C. 酶的活性随pH值的增高而增大D. 酶的最适pH值都在中性即pH=7左右E. pH值对酶促反应速度影响主要在于影响酶的等电点9. 一种酶作用于多种底物,其天然底物的K m是()A. 与其他底物相同B. 最大C. 最小D. 居中E. 与Ks相同10. 酶能加速化学反应的进行是由于哪一种效应()A. 向反应体系提供能量B. 降低反应的自由能变化C. 降低反应的活化能D. 降低底物的能量水平E. 提高产物的能量水平11. 竞争性抑制剂作用特点是()A. 与酶的底物竞争激活剂B. 与酶的底物竞争酶的活性中心C. 与酶的底物竞争酶的辅基D. 与酶的底物竞争酶的必需基团E. 与酶的底物竞争酶的变构剂12. 哪一种情况可用增加[S]的方法减轻抑制程度()A. 不可逆抑制作用B. 竞争性可逆抑制作用C. 非竞争性可逆抑制作用D. 反竞争性可逆抑制作用E.无法确定13. 下列关于同工酶概念的叙述哪一项是正确的()A. 是结构相同而存在部位不同的一组酶B. 是催化相同化学反应而酶的一级结构和理化性质不同的一组酶C. 是催化的反应及性质都相似而分布不同的一组酶D. 是催化相同反应的所有酶E. 以上都不是14. K m值是指()A. 反应速度为最大速度一半时的底物浓度B. 反应速度为最大速度一半时的酶浓度C. 反应速度为最大速度一半时的温度D. 反应速度为最大速度一半时的抑制剂浓度E. 以上都不是15. K m值与底物亲和力大小的关系是()A. K m值越小,亲和力越大B. K m值越大,亲和力越大C. K m值越小,亲和力越小D. K m值大小与亲和力无关E. 以上都是错误的16. 对可逆性抑制剂的描述,哪项是正确的()A. 使酶变性失活的抑制剂B. 抑制剂与酶是共价键结合C. 抑制剂与酶是非共价键结合D. 可逆性抑制剂即指竞争性抑制剂E. 抑制剂与酶结合后用透析等物理方法不能解除抑制17. 丙二酸对琥珀酸脱氢酶的抑制效应是()A. V max降低,K m不变B. V max不变,K m增加C. V max降低,K m降低D. V max不变,K m降低E. V max降低,K m增加18. 酶原的激活是由于()A. 激活剂将结合在酶原分子上的抑制物除去B. 激活剂使酶原的空间构象发生变化C. 激活剂携带底物进入酶原的活性中心D. 激活剂活化酶原分子上的催化基团E. 激活剂使酶原的活性中心暴露或形成19. 最常见的酶的化学修饰的方式是()A. 腺苷化与去腺苷化B. 磷酸化与去磷酸化C. 甲基化与去甲基化D. 乙酰化与去乙酰化E. -SH与-S-S-相互转变20.在酶浓度不变的条件下,以反应速度V对底物浓度[S]作图,其图形为()A.直线B.S形曲线C.矩形双曲线D.抛物线E.钟形曲线21. 酶原是酶的哪种前体()A. 有活性B. 无活性C. 提高活性D. 降低活性E. 低活性22. 下列关于酶活性的叙述哪个是错误的?()A. 催化效率高B. 专一性强C. 作用条件温和D. 都有辅因子参与催化反应E. 可调节23. 酶原激活生理意义上()A. 避免自身细胞损伤B. 加速代谢C. 降低酶活性D. 使酶失活E. 使酶变性24. 下列通过共价修饰调节酶活性的描述中,不正确的描述是()A. 是一种快速调节机制B. 主要是磷酸化和去磷酸化修饰C. 酶蛋白质分子中被修饰的常为丝氨酸或苏氨酸残基D. 只有磷酸化形式是有活性的酶E. 有多种修饰方式25. 全酶是指()A. 酶的辅助因子以外的部分B. 酶的无活性前体C. 一种酶一抑制剂复合物D. 一种需要辅助因子的酶,具备了酶蛋白、辅助因子各种成分E. 所有酶都有全酶形式二、多项选择题1. 磺胺药的抑菌作用机理()A. 结构与二氢叶酸相似B. 是二氢叶酸合成酶的竞争性抑制剂C. 对人体核酸代谢有干扰D. 抑制作用的强弱取决于药物和酶的底物浓度的相对比例E. 对人体核酸代谢无干扰2. 酶的辅助因子可以是()A. 金属离子B. 小分子有机化合物C. 酶活性中心的组分D. 连接底物和酶分子的桥梁E. RNA3. 下列关于酶的竞争性抑制作用的叙述哪些是正确的()A. 抑制剂的结构与底物的结构相似B. 对V max无影响C. 增加底物浓度可减弱抑制剂的作用D. 使K m值变小E. 使K m值变大4. 关于酶的叙述,哪些是正确的()A.所有的酶都是蛋白质B. 所有的酶都是特异生物催化剂C. 酶都能降低反应的活化能D. 都能加速反应速度,不改变反应平衡点E. 酶的反应条件温和5. 酶原的激活在于()A. 形成酶的活性中心B. 除去酶的非蛋白质部分C. 暴露活性中心D. 酶原分子相互聚合E. 酶与辅酶结合6. 有关同工酶的叙述正确的是()A.催化相同的化学反应B. 对不同的底物或辅酶有不同的Km值C. 具有相同的电泳迁移率D. 有不同的底物专一性E. 具有相同的化学结构7. 影响酶反应速度的因素是()A. 缓冲液的种类B. 离子浓度C. 抑制剂D. 激活剂E. 温度8. 温度对酶促反应的影响包括()A.温度对酶促反应有双重影响B.温度越高,酶促反应速度越快C.最适温度是酶的特征性常数,与反应时间无关D.不同酶的最适温度不同E.不同酶的最适温度相同三、名词解释1. 酶的活性中心2. 同工酶3. 酶原及酶原激活4. 变构调节5. 共价修饰四、问答题1. 举例说明酶的竞争性抑制作用在医学上的运用。
生物化学 第三章 酶(共65张PPT)

含多条肽链则为寡聚酶,如RNA聚合酶,由4种亚基构成五聚体。
(cofactor)
别构酶(allosteric enzyme):能发生别构效应的酶
9 D-葡萄糖6-磷酸酮醇异构酶 磷酸葡萄糖异构酶
esterase)活性中心丝氨酸残基上的羟基结合,使酶失活。
酶蛋白
酶的磷酸化与脱磷酸化
五、酶原激活
概念
酶原(zymogen):细胞合成酶蛋白时或者初分 泌时,不具有酶活性的形式
酶原 切除片段 酶
(–)
(+)
酶原激活
本质:一级结构的改变导致构象改变,激活。
胰蛋白酶原的激活过程
六、同工酶
同工酶(isoenzyme)是指催化相同的化学反应, 而酶蛋白的分子结构、理化性质乃至免疫学性质 不同的一组酶。
正协同效应(positive cooperativity) 后续亚基的构象改变增加其对别构效应剂
的亲和力,使效应剂与酶的结合越来越容易。
负协同效应(negative cooperativity) 后续亚基的构象改变降低酶对别构效应剂
的亲和力,使效应剂与酶的结合越来越难。
协同效应
正协同效应的底物浓度-反应速率曲线为S形曲线
/ 即: Vmax = k3 [Et]
Km 和 Vmax 的测定
双倒数作图法 Lineweaver-Burk作图
将米氏方程式两侧取倒数
1/v = Km/Vmax[S] + 1/Vmax = Km/Vmax •1/ [S] + 1/Vmax 以 1/v 对 1/[S] 作图, 得直线图
斜率为 Km/Vmax
酶与酶促反应课件
C、脂肪酶
D、麦芽糖酶
A
B C D 1 A
A C
A
E
F
2
3
反应前后本身 不变
专一性
BCD同时存ห้องสมุดไป่ตู้时,只催化C物质的反应。 葡萄糖 麦芽糖酶
葡萄糖
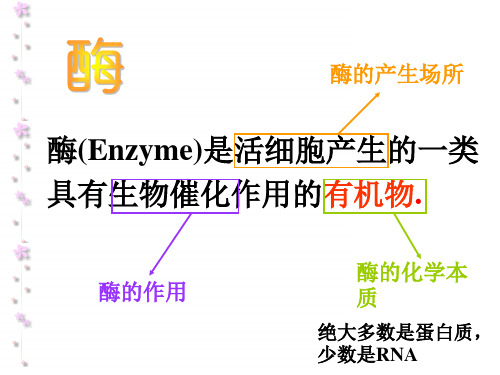
酶的产生场所
酶(Enzyme)是活细胞产生的一类 具有生物催化作用的有机物.
酶的作用 酶的化学本 质
绝大多数是蛋白质, 少数是RNA
强氧化性,不稳定,易分解。
H2O2 H2O + O2
新鲜酵母菌液含有过氧化氢酶。
实验1 酶的催化性
H2O2溶液 3mL
新鲜酵母菌液
蒸馏水
1号试管
2号试管
无机催化剂
H2O2
FeCl3
H2O + O2
生物催化剂
H2O2
过氧化氢酶
H2O + O2
认识酶
H2O2
酶的特性之一:高效性
过氧化氢酶
Fe3+
H2O+O2
酶的催化效率一般是无机催化剂的107-1013倍
保 证 细 胞 中 化 学 反 应 快 速 进 行
酶 的 高 效 性 的 意 义 :
实验二(P65):
实验结果 及 原因? 实验结论?
最适PH=8
酶促反应:由酶催化的化学反应称为酶促反应。
酶活性:酶的催化效率。
影响酶促反应速率的其它因素:
酶的浓度:反应速率随
酶浓度的升高而加快。
酶 促 反 应 速 率
酶的浓度
底物浓度:在一定浓度
范围内,反应速率随浓 度的升高而加快,但达 到一定浓度,反应速率 不再变化
酶 促 反 应 速 率
第三章 酶

(三)Km的求测方法
1. 双曲线法
2. 双倒数作图法
斜率=Km/Vmax
1.0
1 = v
Km . Vmax
1 1 + [S] Vmax
0.8
0.6
1/v
0.4
-1/Km
0.2
1/Vmax
0.0 -4 -2 0 2 4
-1
6
8
10
1/[S](1/mmol.L )
3.Hanes作图法
二、酶浓度对反应速度的影响
酶的活性中心:在酶分子上,必需基团在空 间结构上彼此靠近,形成具有特定空间结构 的区域,能与底物特异结合并将底物转化为 产物,此区域称为酶的活性中心。
活性中心内的必需基团
结合基团 与底物相结合 催化基团 催化底物转变成产物
活性中心外的必需基团 位于活性中心以外,维持酶活性中 心应有的空间构象所必需。
白结合紧密,用透析或超滤的方法不能将其除
去的称为辅基。
金属离子的作用
1.稳定酶分子构象。 2.参与催化反应或传递电子。 3.在酶与底物间起桥梁作用。
4.中和阴离子降低反应中的静电斥力。
根据金属离子与酶结合的形式不同,可将
酶分为金属酶和金属活化酶。
小分子有机物的作用
其结构中常含有维生素或维生素类物 质,以辅酶或辅基的形式参与酶的催化过
活性中心以外 的必需基团
底物
催化基团
结合基团
活性中心
第二节 酶促反应的特性与催化机制
酶与一般催化剂的共同点
只能催化热力学上允许进行的化学反应。 能缩短反应达到平衡所需的时间,而不能 改变平衡点。 对可逆反应的正反两个方向都具有的催化
作用。
酶和酶促反应

思考:低温和高温使酶活性下降的原理相同吗? 低温:暂时抑制酶活性,但酶的分子结构没有 被破坏,酶的活性在适宜温度下可以恢复 高温:导致酶的结构彻底破坏,使酶活性完全 丧失,不可再恢复
(2)PH
序号 项目 1号 1 注入新鲜的淀粉酶溶液 1mL 2 调节酶溶液的PH 1m蒸馏水 5 注入可溶性淀粉 2mL 6 水浴保温处理 60℃5min 7 注入斐林试剂 2mL 8 水浴加热 1min 9 现象记录 ? 2号 1mL 1mL NaOH 2mL 60℃5min 2mL 1min ? 3号 1mL 1mL盐酸 2mL 60℃5min 2mL 1min ?
• 3.特性
• (1)催化性 • (2)高效性 • 思考:酶具有催化高效性的原因是什么? • 酶能降低化学反应所需要的活化能 • (3)专一性(特异性) • 思考:酶具有专一性的原因是什么? • 酶的活性中心与底物分子在空间结构上就有特 殊的匹配关系
强氧化性,不稳定,易分解。
2H2O2 2H2O + O2
新鲜酵母菌液(或新鲜猪肝研磨液) 含有过氧化氢酶。
实验1 酶的催化性
H2O2溶液 3mL
1.哪只试管产生的气泡多? 2.这个实验说明了什么?
新鲜酵母菌液 蒸馏水
1号试管
2号试管
无机催化剂
2H2O2
FeCl3
2H2O + O2
生物催化剂
2H2O2
过氧化氢酶
2H2O + O2
无机催化剂和生物催化剂,究竟 哪种催化效率更高呢?
授课人:孙艳娟
酶与生 活密切 相关
1.概念
酶通常是指由活细胞产生的具有催化活性的有机物
2.本质
绝大多数酶是蛋白质,少数是RNA
第三章酶与酶的促反应

第三章酶与酶的促反应名词解释全酶对于大多数化学本质为蛋白质的酶来说,按照化学组成可分为单纯酶和结合酶两大类。
全酶(又称结合酶)除了蛋白质组分外,还含有对热稳定的小分子物质。
前者称为酶蛋白,后者称为辅因子。
酶蛋白和辅因子单独存在时,均无催化活力。
只有二者结合成完整的分子时,才具有活力。
此完整的酶分子称为全酶。
全酶=酶蛋白+辅因子酶的辅助因子:主要包括金属离子和小分子有机化合物,在酶促反应中主要决定反应的种类和性质,在反应中起到传递电子、原子或某些化学基团的作用。
辅酶和辅基:辅酶是指以非共价键和酶蛋白结合的小分子有机物质,通过透析或超滤等物理方法可以除去。
辅基是指以共价键和酶蛋白结合的小分子有机物质,不能通过透析或超滤的方法除去酶的活性中心是指酶分子能与底物特异性结合并将底物转化为产物,具有特定空间结构的区域。
使酶分子执行其催化功能的部位同工酶催化相同的化学反应,而酶蛋白的分子结构,理化性质及免疫学性质不同的一组酶(5种乳酸脱氢酶同工酶)变构调节变构调节(也叫别构调节)是指一些代谢物与某些酶分子活性中心以外的某一部位可逆的结合(非共价结合),引起酶构象变化、从而改变酶的催化活性,此种调节方式叫做变构调节。
共价修饰调节在其他酶的催化作用下,某些酶蛋白肽链上的一些基因可与某种化学基因发生可逆的共价结合,从而改变酶的活性,此过程成为共价修饰。
抑制剂凡能是酶的催化活性下降而不引起酶蛋白变性的物质称为酶的抑制剂。
Km米氏常数(Km)的含义是酶促反应达最大速度(Vm)一半时的底物(S)的浓度。
竞争性抑制抑制剂的结构与底物结构相似,能与底物竞争结合在酶的活性中心,从而降低或抑制酶活性这种抑制作用称竞争性抑制剂,这种抑制作用称竞争性抑制作用。
底物浓度增大,抑制下降。
Km增大,亲和力下降,Vm不变非竞争性抑制有些抑制剂可与酶活性中心以外的必需基团结合,不影响酶与底物的结合,抑制剂和底物可同时结合在酶分子上,形成酶-底物-抑制剂复合物,不能释放出产物,使酶活性丧失,这种抑制剂称为非竞争性抑制剂,这种抑制作用称为非竞争性作用。
酶和酶促反应

中,在各自温度下保持一定的时间 第五步:取出123三支试管,加入碘液,混合均匀后,观察试管 溶液颜色深浅
实验结果: 2号试管溶液颜色最浅
能否先将底物和酶混合后再进行不同温度的处理? 能否将碘液换成本尼迪特试剂,热水浴后观察比较各组的红黄色 沉淀的量?
四、影响酶促反应的因素
1.pH 2.温度 3.底物浓度 4.酶浓度
7
现象记录 有砖红色 无砖红色沉 无砖红色 沉淀生成 沉淀生成 淀生成或偏低都会影响酶活性。 步骤2和3不能颠倒,若颠倒,容易使底物在酶 的作用下水解,无法证实环境过酸过碱对酶活性 的影响
温度对酶促反应的影响
步骤 1 2 3 4 5
1号试管2号试管 3号试管 注入3%淀粉溶液 2mL 2mL 2mL 温度(保温5min) 60℃ 100℃ 0℃ 注入新鲜淀粉酶并摇匀 1 mL 1 mL 1 mL 滴入碘液,并摇匀 1滴 1滴 1滴 不变蓝 变蓝 变蓝 现象记录
参与反应,不提供能量 75 无催化剂催化
用胶态铂催化
过氧化氢酶
54
29
产物
反应进程
二、酶在细胞代谢中的作用
正是由于酶的催化作用,细胞代谢才 能在温和的条件下快速进行
酶促反应 (1)概念:由___ 酶 催化的化学反应。 催化效率 。。 (2)酶活性:酶对化学反应的_________
三、酶的特性
1、高效性 2、专一性 3、作用条件温和
谢谢大家!
酶
产 物
酶与底物 结合
酶-底物 复合体
酶恢复原状 其数量和性 质未发生改 变
注入3%溶液 2 注入新鲜淀粉酶溶 2mL 2mL 液,并振荡 60℃温水保温 3 5min 5min 注入斐林试剂,并 4 2mL 2mL 振荡 加热煮沸 1min 1min 5 现象记录 6 生成砖红色沉淀 无砖红色沉淀 实验结论:酶的催化作用具有专一性 检测底物是否被分解宜选用斐林试剂。不能用碘液进行 检测,碘液无法检测蔗糖是否被水解,淀粉用尽时1和2 均显示碘液颜色
第03章酶催化作用机制

V
Vmax
[S]
随着底物浓度的增高 反应速度不再成正比例加速。
V
Vmax
[S]
当底物浓度高达一定程度 反应速度不再增加,达最大速度,说明酶已 经被底物所饱和。
1. 米氏方程
第 三 章 酶 催 化 作 用 机 制
1913年,米彻利斯(Michaelis)和曼吞 (Menton)在前人研究的基础上,推导出 著名的米氏方程: v——反应速度; S——底物浓度; v m —— 最大反应速度; K m —— 米氏常数,为 酶催化反应速度等于最大反应速度一半时 的底物浓度。
(一)酶的刚性与“琐和钥匙”学说
第 三 章 酶 催 化 作 用 机 制
1890年,德 国化学家费舍 尔(Fisher) 提出了著名的 “琐和钥匙” 此学说认为:酶与底物都是刚性的,二者 学说。 结构间天然存在互补的关系,就像锁和钥
匙一样。此学说较好的解释了酶对底物选 择的专一性,但不能解释酶能够高效催化 反应的原因。
中间产物学说
中间产物
第 三 章 酶 催 化 作 用 机 制
酶促反应速度与底物浓度的关系,可以用 中间产物学说加以解释。 酶促反应模式——中间产物学说
E+S
k1 k2
ES
k3
E+P
推导过程
米-曼氏方程式推导基于两个假设:
第 三 章 酶 催 化 作 用 机 制
E与S形成ES复合物的反应是快速平衡反应,
Dixon plot
Cornish-Bowden plot
酶的转换数
定义 — 当酶被底物充分饱和时,单位时间内 (每秒钟)每个酶分子催化底物转变 为产物的分子数(微摩尔数)。 意义 — 可用来比较每单位酶的催化能力。
第三章 酶促反应动力学(简)-1

例题3-1
6
二、单底物酶促反应动力学
单底物酶促反应动力学系指由一种 反应底物参与的不可逆反应。属于 此类反应的有酶的水解反应、异构 反应以及多数裂解反应。
7
中间络合物学说
100
ห้องสมุดไป่ตู้
在低底物浓度时, 反应速度与 底物浓度成正比,表现为一级 反应特征。 当底物浓度达到一定值,反应 速度达到最大值(Vmax ),此 时再增加底物浓度,反应速度 不再增加,表现为零级反应。 (酶浓度不变时)
ln( [ S ]0 [ S ]) [ S ]0 − [ S ]
VmaX Km
1 − KM
1 Vmax
t [ S ]0 − [ S ]
例3-2,3-3,3-4
24
根据米氏方程,结合t=0,[S]=[S]0的初值积 分得到 [ S ]0 Vmax t = ([ S ]0 − [ S ]) + K m ln [S ] [ S ]0 Km 1 引入转化率 χ s ⎯⎯ ⎯ ⎯ → t = ⎯ χs ln( )+ Vmax 1 − χ s Vmax
14
k +1 k +2 ⎯⎯→ ES ⎯⎯→ P + E E + S← ⎯⎯ k −1
米氏方程:
Vmax [ S ] v= K m + [S ]
米氏常数:
k −1 + k + 2 k+2 Km = = Ks + k +1 k +1
15
酶反应速度与底物浓度的 关系曲线
当[S] <<Km时
V=
V max [ S ] V max [ S ] = = K’S ] [ Km + [ S ] Km
酶与酶促反应

活化能: 活化能:
分子从常态变为容易发生化学反应的 活跃状态所需要的能量。 活跃状态所需要的能量。
酶催化作用实质: 酶催化作用实质: 降低化学反应的活化能 降低化学反应的活化能
2.作用机理: 2.作用机理: 作用机理
加入催化剂相当于给汽车找到了一条穿山隧道 活化能 活跃状态 分子初态
酶的催化机理是降低活化能 酶的催化机理是降低活化能
二、酶与酶促反应
细胞内成千上万个化学反应 为什么能在常温、 为什么能在常温、常压下高 效有序地进行呢? 效有序地进行呢?
1. 酶的概念 酶的概念:
酶是活细胞产生的一类具有催化作用 酶是活细胞产生的一类具有催化作用 活细胞产生的一类具有
来源 功能
的有机物,其中绝大多数酶是蛋白质。 有机物,其中绝大多数酶是蛋白质。 蛋白质
本质
绝大多数酶是蛋白质, 绝大多数酶是蛋白质 少数的酶是RNA 少数的酶是
P57记忆 记忆
酶促反应: 酶促反应: 由酶催化的化学反应 酶活性: 酶活性: 酶对化学反应的催化效率
提高化学反应速率的途径:(P57课本) 提高化学反应速率的途径:(P57课本) :(P57课本 用加热或光照给反应体系提供能量。 (1) 用加热或光照给反应体系提供能量。 使用催化剂,降低活化能。 (2) 使用催化剂,降低活化能。
70℃ 时间
三图依次表示酶浓度一定时, 例2:下列 、B、C三图依次表示酶浓度一定时,反应速度和反应 :下列A、 、 三图依次表示酶浓度一定时 物浓度、温度、 值的关系 请据图回答下列问题: 值的关系。 物浓度、温度、pH值的关系。请据图回答下列问题: (1)图A中,反应物达到某一浓度时,反应速度不再上升,其原因 ) 中 反应物达到某一浓度时,反应速度不再上升, 是 受反应液中的酶浓度的限制 。 (2)图B中,a点所对应的温度称 酶反应的最适温度 ) 中 点所对应的温度称 。 点到b点曲线急剧下降 (3)图B中,a点到 点曲线急剧下降,其原因是 ) 中 点到 点曲线急剧下降, 温度升高使酶活性下降 。 (4)将装有酶与反应物的甲、乙两试管分别放入 ℃和75℃水浴 )将装有酶与反应物的甲、乙两试管分别放入12℃ ℃ 锅中, 分钟后取出转入 分钟后取出转入37℃的水浴锅中保温, 锅中,20分钟后取出转入 ℃的水浴锅中保温,两试管内反应分别 应为甲 速度加快 ,乙 无催化反应 。 C 催化反应的速率变化曲线。 (5)图C表示了 ) 表示了 催化反应的速率变化曲线。 A、唾液淀粉酶 B、胃蛋白酶 C、胰蛋白酶 D、植物淀粉酶 、 、 、 、
酶(part2)
经整理得:[ES ]=[Et ][S ] K m +[S ]
(1)
由于酶促反应速度由[ES]决定,即 决定, 由于酶促反应速度由 决定
v = k2 [ES ]
,所以
[ES ] =
将(2)代入(1)得: )代入( ) 当[Et]=[ES]时, 时
[Et ][S ] v = k2 K m + [S ]
所以
Vmax 2
Vmax[S] = Km + [S] Km=[S]
∴Km值等于酶促反应速度为最大反应速度一半时 的底物浓度,单位是mol/L。 的底物浓度,单位是 。
小结: 小结:Km的物理意义 的物理意义
Km值
① Km等于酶促反应速度为最大反应速度一半时的底物浓 度。 ② 意义: 意义:
a) Km是酶的特征性常数之一; 是酶的特征性常数之一; b) Km可近似表示酶对底物的亲和力; 可近似表示酶对底物的亲和力; c) 同一酶对于不同底物有不同的 同一酶对于不同底物有不同的Km值。 值
2.酶活力单位和比活力表示方式 (1)酶活力单位
惯用单位 :酶促反应在单位时间内生成一定量的产物或消 耗一定数量的底物所需的酶量 。 国际单位(IU):在特定条件下,每分钟催化1μ mol底物 国际单位(IU):在特定条件下,每分钟催化1μ mol底物 ):在特定条件下 转化为产物所需的酶量为一个国际单位。(1976) 转化为产物所需的酶量为一个国际单位。 1催量(1 kat)是指在特定条件下,每秒钟使 催量( 催量 )是指在特定条件下,每秒钟使1mol底物转化 底物转化 产物所需的酶量。 产物所需的酶量。(1979) Kat与IU的换算:1IU=16.67×10-9Kat, 与 的换算 的换算: = × , 1Kat=6×107IU = ×
第三章 酶催化反应动力学

测定反应初速度的方法来测定相关制剂中酶的含量(活性)。
1.2 酶活力的测定原理
酶蛋白的含量很低,很难直接测定其蛋白质的 含量,且常与其他各种蛋白质混合存在,将其 提纯耗时费力。故不能直接用重量或体积等指 标来衡量。
分光光度法 荧光法 同位素法 电化学方法 其他方法:如旋光 法、量气法、量热 法和层析法等
E
+
S
ES
ESI
E
+
P
图3-7 反竞争性抑制曲线
特点: ⑴ Vm值和Km值都随[I]的增加而降低; ⑵ 双倒数作图所得为一组平行线; ⑶必须有底物存在,抑制剂才能对酶产生抑制作用;抑制程 度随底物浓度的增加而增加。
举例:
这种抑制作用在单底物反应中比较少见,而常
见于多底物反应中。
目前已经证明,肼类化合物对胃蛋白酶的抑制
举例:磺胺类药物的抑菌机制
•与对氨基苯甲酸竞争性抑制二氢叶酸合成酶
Glu + H2N COOH PAB A + 二氢蝶呤
FH2合成酶
FH 2
FH2还原酶
FH 4
氨甲蝶呤 H2N 磺胺药 SO2NHR
②非竞争性抑制(noncompetitive inhibition) : 非竞争性抑制剂(I)和底物(S)可以同时与酶(E) 结合,两者之间不存在竞争关系。 但是在酶与抑制剂结合后,还可以进一步与底 物结合形成酶-底物-抑制剂复合物ESI;酶与 底物结合后,也可以进一步与抑制剂结合形成 酶-底物-抑制剂复合物ESI。
4.2 不可逆的抑制作用
根据不可逆抑制剂选择性的差异,通常把不可
逆抑制剂分为两种类型,即非专一性不可逆抑
制剂和专一性不可逆抑制剂。
第三章酶与酶促反应-练习题-及答案

第一次视频作业:1・下列关于酶的叙述,正确的是(B)A.酶不能在胞外发挥作用B•酌的化学本质是蛋白质C.所有蛋白质都有酶活性D.所有的酶都有同工酶E.酶能改变反应的平衡点3.全酶是指(D)A.酶一抑制剂复合物B.酶-底物复合物C.防的无活性前体D.酶蛋白-辅助因子复合物E.酶•别构剂复合物4.酶促反应中决定酶特异性的是(C)A•辅基B•辅酶C.酶蛋白D.酶原E.酶活性中心外的必需基团5.辅助因子是(D)A.小分子肽B•核酸C.决定酶特异性的必需成分D.I:属Z广与小分子的有机化合物E.氨基酸6.辅酶与辅基的区别是(E)A.含不同的金属离子B.生物学性质不同C.化学本质不同D.理化性质不同E.与酶蛋白结合紧密程度不同7.下列关于辅酶或辅基的叙述,错误的是(D)A.结合酶的酶分子组成中才含有辅酶或辅基8.维生素Bj参与辅酶或辅展的组成C.辅酶或辅基直接参加酶促反应D.一种辅酶或辅基只能与一种酶蛋白结合成一种全酶E.辅酎与辅基都是酸的辅助因子11・下列关于同工酶概念的叙述,正确的是(B)A,是结构相同,而存在部位不同的一组酎B・是催化相同的化学反应,而酶的分子结构不同、理化性质可各并的一组酶C,是催化的反应和酶的性质都相似,而分布不同的一组酶D.是催化相同反应的所有酶E,以上都不正确12.肝中含量最多的1DH同工酶是(E)A.1DH1B.1DH2C.1DH3D.1DH4E.1DH5第二次视频作业:14.醐活性中心的某些基团可以参与质子的转移,这种作用称为(D)A. 亲核催化作用B.共价催化作用C. 多元催化作用D.酸-碱催化作用E.定向作用13.下列关于诱导契合学说的叙述,正确的是(E)A.底物与酶如同锁和钥匙的关系B・底物构象改变,酶构象不变C.醐构象改变,底物构象不变D.使酶的结构与产物相互适应E.底物和酶的结构相互诱导、变形,构象匹配第三次视频作业:16.下列关于酶的K值的叙述,正确的是(D)A.是反应速度达到最大速度时的底物浓度B.不能反映酶对底物的亲和力C.对有多个底物的酶其Kn1值相同D.对同一底物不同的酉有有不同的Km值E.是反应速度达到最大反应速度一半时所需酶的浓度17.酶K m值的大小所代表的含义是(A)A.酶对底物的亲和力B.最适的酶浓度C.酶促反应速度D.酶抑制剂的类型E.底物的最适浓度18.KnI值是指(D)A.酸与底物的亲和力常数B.酶一底物复合物的解离常数C.酶促反应的底物常数D.酶促反应的速到最大反应速度一半时所需的底物浓度E.酶促反应达到最大反应速度时所需底物浓度的一半19.已知某种酶的K值为25mmo1∕1,欲使酶促反应达到最大反应速度的50%,该底物浓度应为(B)A.125mmo1∕1B∙25mmo1∕1C,37.5mmo1∕1D.50mmo1/1∙E∙75mmo1∕122.已知某酶Kn I值为0.05mmo"1,欲使其所催化的反应速率达最大反应速率的80%时,底物浓度应是(D)A.0.04mmo1∕1B.0.05mmo1∕1C.0.Immo1Z1D.0.2mmo1∕1E.0.8mmo1∕123.反应速度与酶浓度成正比的条件是(E)A.反应速度达到最大B.酎浓度远大于底物浓度C.底物被酶饱和D.反应刚开始E.底物浓度远大于酶浓度24.酶的最适温度(E)A.全部在37°C左右B.全部在25℃左右C.都低于65℃D.比酶的变性温度低5。
第3章 第3节酶促反应动力学
李新梅 湖南大学生物学院
李新梅 湖南大学生物学院
V-T曲线为钟形曲线
在达到最适温度之前,温度 升高,活化分子数增加,反 应速度加快 – 温度系数(Q10) • 温度每提高10℃其反应 速度与原来的反应速度 之比 • 对于许多酶来说,Q10 多为1-2之间。 超过最适温度时, 温度升高, 酶的最适温度不是一 酶逐步变性,V降低 最适温度还与反应时间有关, 个固定不变的常数。 反应时间短,最适温度高, 李新梅 反应时间长,最适温度低湖南大学生物学院
A、随酶浓度的增加而增加 B、随酶浓度的增加而减小 C、随底物浓度的增加而增大 D、是酶的特征常数 A、饱和底物浓度时的速度 B、在一定酶浓度下,最大速度的一半 C、饱和底物浓度的一半 D、速度达最大速度一半时的底物浓度
李新梅 湖南大学生物学院
斜率=Km/Vmax
lineweaker-Burk方程
k2
发生在 很短的 时间内
S: substance P: product E: enzyme
李新梅 湖南大学生物学院
由米氏方程可以看出: (1)[S]很小时,[S]《Km,则V=(Vmax/Km)[S] 一级反应; (2)[S]很大时,[S] 》Km,则V=Vmax,零级反应; (3)[S]处于Km附近时,混和级反应。
湖南大学生物学院
猎豹最多只能跑3分钟
肌糖原分解产生乳酸除了生成ATP,还有大量热 量阐述,时间太长会因身体过热而死
奔跑后的猎豹体能状况孱弱,需要数十分钟 复原
乳酸经肝脏重新生成糖原
化学反应中的酶与酶促反应

化学反应中的酶与酶促反应在化学反应中,酶是一种重要的催化剂。
它们能够加速酶促反应的进行,降低活化能,从而使反应更加高效。
本文将从酶的结构与功能、酶促反应的机制等方面进行讨论。
一、酶的结构与功能酶是一种特殊的蛋白质,由氨基酸组成,具有复杂的三维结构。
它们可以在生物体内特异性地催化化学反应,而不改变自身的化学性质。
酶能够与底物结合形成酶底物复合物,通过改变反应介质中底物的构象,使反应速率增加。
酶的功能主要体现在以下几个方面:1. 催化反应:酶通过提供活化能的途径,降低化学反应的活化能,从而加速反应进行。
这种催化作用可以使反应速率提高几千倍甚至百万倍。
2. 特异性:酶对特定底物有高度的选择性,只与特定的底物结合并催化特定的化学反应。
这种特异性是由酶的结构决定的。
3. 调节反应:酶可以通过调节其自身的活性,根据细胞内外的环境变化,来对化学反应进行调节。
这种调节使生物体能够适应不同的生理和环境需求。
二、酶促反应的机制酶促反应是指在酶存在的条件下,底物发生化学反应,最终生成产物。
酶促反应的机制可以分为以下几个步骤:1. 酶与底物的结合:酶与底物之间通过非共价相互作用力,如氢键、离子键、范德华力等,结合形成酶底物复合物。
2. 底物转化:酶通过改变底物的构象,使其在酶的作用下发生化学变化。
这种构象改变通常涉及底物的键长、键角等参数的变化。
3. 产物释放:酶通过进一步改变底物的构象,使之转化为产物。
产物在酶的作用下与酶解离,释放出来。
通过上述步骤,酶能够在细胞内部发挥催化作用,加速复杂的生物化学反应,从而维持细胞内的代谢平衡。
三、酶与生物反应的应用由于酶对生物反应的催化作用具有高效、特异性和选择性等优点,因此在生物技术领域得到广泛应用。
1. 生物催化:酶在工业生产中被广泛利用,例如酶制剂可以用于制备食品、药物和化妆品等。
利用酶催化反应,可以减少废物产生,提高反应效率。
2. 生物传感器:酶可以被用作生物传感器的生物元件。
酶促反应动力学

底物相类似的结构,而且抑制剂本身也是酶的底物, 这类不可逆抑制剂的特点是专一性极高,因此也被称 为自杀性底物(suicide substrate)。
3.3.1.2 可逆的抑制作用
• 由于抑制剂与酶以非共价键的形式结合而引起酶
活力降低或丧失,但是能用透析、超滤等物理方
法除去抑制剂而使酶复活,这种抑制作用是可逆
3.3.1抑制作用的类型
• 根据抑制剂与酶的作用方式的区别以及抑制作用
是否可逆,我们可以将抑制作用分为两大类,即: – 不可逆的抑制作用
– 可逆的抑制作用。
3.3.1.1 不可逆的抑制作用
• 由于抑制剂与酶的必需基团以共价键的形式结合而引起酶
活力降低或丧失,因此不能用透析、超滤等物理方法去除 抑制剂而使酶复活,这种抑制作用是不可逆的,我们称之 为不可逆抑制。此时被抑制的酶分子受到抑制剂对其不同 程度的化学修饰,因此不可逆抑制从本质上来说就是酶的
法等
3.2 底物浓度对酶促反应速度的影响
• 中间络合物学说
– 中间络合物学说也称酶底物中间络合物学说,最早是由 Henri和Wurtz两位科学家提出的。在1903年,Henri在用 蔗糖酶水解蔗糖实验研究化学反应中底物浓度与反应速
度的关系时发现,当酶浓度不变时,可以测出一系列不
同底物浓度下的化学反应速度,以该反应速度对底物浓 度作图,可得到如图3-2所示的曲线。
• 当底物浓度达到相当高的程度时,溶液中的酶已经全部被
底物所饱和,此时溶液中再也没有多余的酶,虽增加底物 浓度也不会有更多的中间复合物ES生成,因此酶促反应速 度 变 得 与底 物 浓 度无 关 , 而且 反 应达到 最 大反应 速 度 (Vmax)。当我们以底物浓度[S]对反应速度v作图时,就 形成一条双曲线。在此需要特别指出的是,只有酶促催化 反应才会有这种饱和现象,而与此相反,非催化反应则不 会出现这种饱和现象。
生物化学与分子生物学-第三章 酶与酶促反应

一、底物浓度对酶促反应速率的影响呈矩形双曲线
底物浓度对酶促反应速率的影响
(一)米-曼方程揭示单底物反应的动力学特性
E+S
k1
k3
ES
k2
E + P (1)
k1( [Et]-[ES] )[S]=k2[ES]+k3[ES] (2)
([Et]-[ES]) [S] k2 + k3
[ES]
=
k1
令
K m=
非竞争性抑制作用双倒数作图
3.反竞争性抑制剂的结合位点由底物诱导产生
反竞争性抑制剂双倒数方程
反竞争性抑制剂抑制特点:表观Km减小,Vmax下降
反竞争性抑制作用双倒数作图
六、激活剂可提高酶促反应速率
使酶由无活性变为有活性或使酶活性增加的物质称为酶的激活剂 1. 必需激活剂:为酶的活性所必需 2.非必需激活剂:不是酶的活性所必需
(三)酶原需要通过激活过程才能转变为有活性的酶
酶原:无活性的酶的前体 酶原激活:酶原转变为有活性的酶 激活的本质:使酶活性中心形成或暴露 酶原存在的意义:保护机体
胰蛋白酶原的激活
二、酶含量的调节是对酶促反应速率的缓慢调节
细胞也可通过改变酶蛋白合成与分解的速率来调节酶的含量, 进而影响酶促反应速率。
(一)酶对底物具有极高的催化效率
底物 苯酰胺
尿素 H2O2
某些酶与一般催化剂催化效率的比较
催化剂 H+ OH-
反应温度(℃) 52 53
α-胰凝乳蛋白酶
25
H+
62
脲酶
21
Fe2+
56
速率常速 2.4×10-6 8.5×10-6
14.9 7.4×10-7 5.0×106
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
辅助因子多为小分子的有机化合物或金属离子。
作为辅助因子的有机化合物多为B族维生素的衍生物或卟啉化合物 它们在酶促反应中主要参与传递电子、质子(或基团)或起运载体
作用
部分辅酶/辅基在催化中的作用
转移的基团
(ribozyme)的概念。 1995年,Jack W.Szostak研究室首先报道了具有DNA连接酶活性DNA
片段,称为脱氧核酶(deoxyribozyme)。
第一节
酶的分子结构与功能
Structure and Function of Enzymes
酶的不同形式:
单体酶(monomeric enzyme):单一亚基构成的酶 。如牛胰核糖核酸酶,溶菌酶 等。
人体各组织器官LDH同工酶谱(活性%)
红细胞 白细胞 血清 骨骼肌 心肌 肺 肾 肝 脾
43
12 27
0
73 14 43 2 10
44
49 34.7 0
24 34 44 4 25
与底物相结合
催化基团 (catalytic group) 催化底物转变成产物
活性中心外的必需基团
位于活性中心以外,维持酶活性中心应有的空间构象和 (或)作为调节剂的结合部位所必需。
活性中心以外 的必需基团
结合基团
底物 催化基团 活性中心
溶菌酶的活性中心
溶菌酶的活性中心是一裂隙, 可以容纳肽多糖的6个单糖 基(A,B,C,D,E,F), 并与之形成氢键和van derwaals力。
催化基团是35位Glu,52位 Asp;
101位Asp和108位Trp是结 合基团。
三、同工酶催化相同的化学反应
定义:同工酶 (isoenzyme)是指催化相同的化学反应,但酶蛋白的分子结构、理化 性质乃至免疫学性质不同的一组酶。
乳酸脱氢酶同工酶的亚基构成
举例 1
LDH同工酶
LDH1 LDH2 LDH3 LDH4 LDH5
酶学研究简史
公元前两千多年,我国已有酿酒记载。 一百余年前,Pasteur认为发酵是酵母细胞生命活动的结果。 1878年,Kühne首次提出Enzyme一词。 1897年,Eduard Buchner用不含细胞的酵母提取液,实现了发酵。 1926年,Sumner首次从刀豆中提纯出脲酶结晶 (deoxyribozyme)。 1982 年 , Cech 首 次 发 现 RNA 也 具 有 酶 的 催 化 活 性 , 提 出 核 酶
多酶体系:丙酮酸脱氢酶复合体
多功能酶:哺乳类动物脂肪酸合酶
7种酶活性都在一条多 肽链上,属多功能酶 ,由一个基因编码; 有活性的酶为两相同 亚基首尾相连组成的 二聚体。
一、酶的分子组成中常含有辅助因子
1. 单纯酶(simple enzyme):仅含有肽链的酶称为单纯酶。脲酶,蛋 白酶,淀粉酶,核糖核酸酶。
第一节 酶分子的结构与功能 第二节 酶的工作原理 第三节 酶促反应动力学 第四节 酶的调节 第五节 酶的分类与命名 第六节 酶在医学中的应用
重点难点
掌握
酶的分子组成、酶的活性中心、同工酶、酶促反应 特点、米氏方程、别构调节、化学修饰调节、酶原 及其激活
熟悉
熟悉影响酶促反应速率的因素及其机制
了解
酶的分类与命名、酶在医学中的应用
维生素B2(核黄素) 维生素B2(核黄素) 维生素B1(硫胺素) 泛酸 硫辛酸
烷基 二氧化碳
钴胺素辅酶类 生物素
维生素B12 生物素
氨基Leabharlann 磷酸吡哆醛甲基、甲烯基、甲炔基、 四氢叶酸 甲酰基等一碳单位
吡哆醛(维生素B6之一) 叶酸
金属离子是最多见的辅助因子
金属酶(metalloenzyme) 金属离子与酶结合紧密,提取过程中不易丢失。 金属激活酶(metal-activated enzyme) 金属离子为 的酶作的用活:性所必需,但与酶的结合不甚紧密。 参与催化反应,传递电子; 在酶与底物间起桥梁作用; 稳定酶的构象;
小分子有机化合物(辅酶或辅基)
名称
所含的维生素
氢原子(质子)
醛基 酰基
NAD+(烟酰胺腺嘌呤二核苷 酸,辅酶I NADP+(烟酰胺腺嘌呤二核苷 酸磷酸,辅酶II FMN(黄素单核苷酸) FAD(黄素腺嘌呤二核苷酸) TPP(焦磷酸硫胺素) 辅酶A(CoA) 硫辛酸
烟酰胺(维生素PP)之一
烟酰胺(维生素PP)之一
金属酶 过氧化氢酶 过氧化物酶 己糖激酶
固氮酶 核糖核苷酸还原
羧基肽酶 碳酸酐酶
某些金属酶和金属激活酶
金属离子 Fe2+ Fe2+ Mg2+ Mo2+ Mn2+ Zn2+ Zn2+
金属激活酶 丙酮酸激酶 丙酮酸羧化酶 蛋白激酶 精氨酸酶 磷脂酶C 细胞色素氧化酶 脲酶
金属离子 K+、Mg2+ Mn2+、Zn2+ Mg2+、Mn2+ Mn2+ Ca2+ Cu2+ Ni2+
二、酶的活性中心是酶分子中执行其催化功能的部位
酶的活性中心或活性部位(active site) 是酶分子中能与底物特异地结合并催化 底物转变为产物的具有特定三维结构的 区域。
酶的活性中心示意图
二、酶的活性中心是酶分子执行其催化功能的部位
活性中心内的必需基团
结合基团 (binding group)
2.缀合酶(conjugated enzyme):由酶蛋白和辅助因子共同构成的 酶。 辅助因子(cofactor):分为辅酶和辅基
全酶分子中各部分在催化反应中的作用:
酶蛋白决定反应的特异性 辅助因子决定反应的种类与性质
辅助因子分类 (按其与酶蛋白结合的紧密程度)
辅酶 (coenzyme): 与酶蛋白结合疏松,可用透析或超滤的方法除去。
寡聚酶(oligomeric enzyme):由多个相同或不同亚基以非共价键连接组成的酶。 如蛋白激酶A,磷酸果糖激酶-1。
多酶体系(multienzyme system):由几种不同功能的酶彼此聚合形成多酶体系或 称多酶复合物。如丙酮酸脱氢酶复合物。
多功能酶(multifunctional enzyme)或串联酶(tandem enzyme):一些多酶体系在 进化过程中由于基因的融合,多种不同催化功能存在于一条多肽链中,这类酶 称为多功能酶。如脂肪酸合酶。
