BEZ235 (NVP-BEZ235)_ATP竞争性的PI3KmTOR抑制剂_915019-65-7_Apexbio
贝伐单抗联合BEZ235给药对人肾细胞癌移植瘤裸鼠瘤体的影响

贝伐单抗联合BEZ235给药对人肾细胞癌移植瘤裸鼠瘤体的影响徐晓华;吴昆哲;刘峰【期刊名称】《中国老年学杂志》【年(卷),期】2013(033)017【摘要】目的探讨贝伐单抗联合BEZ235给药对人肾细胞癌移植的裸鼠瘤体的影响.方法无胸腺的裸鼠40只,接种人肾细胞癌组织7~10 d后将合格的实验组随机分成四组:对照组(不做任何给药处理)、BEZ235组、贝伐单抗组及联合给药组(n=5).贝伐单抗5 mg·kg-1·d-1尾静脉注射,连续6 w; BEZ235系口服给药按照10 mg·kg-1·d-1的剂量给药,连续6w,联合治疗组两种药物亦按照上述给药剂量进行,给药后第6周后的1~2d内处死裸鼠,取出肿瘤组织进行称重,测量体积然后切片、染色、MVD染色,裸鼠处死前1天抽血样测定血清血管内皮生长因子(VEGF)水平.结果联合给药组体积和质量都较单药组降低,肿瘤组织染色发现明显坏死,组织MVD和血清VEGF都明显降低.结论贝伐单抗联合BEZ235可以通过强化抑制肿瘤血管形成增强抑制肿瘤.【总页数】2页(P4208-4209)【作者】徐晓华;吴昆哲;刘峰【作者单位】吉林大学中日联谊医院肾内科,吉林长春 130033;吉林大学中日联谊医院肾内科,吉林长春 130033;吉林大学中日联谊医院肾内科,吉林长春 130033【正文语种】中文【中图分类】R737.11【相关文献】1.活体观察贝伐单抗对人骨肉瘤裸鼠移植瘤模型的作用 [J], 陆萌;吴苏稼;施鑫;周光新;黎承军;赵建宁2.贝伐单抗对荷耐顺铂人肺腺癌A549/DDP裸鼠皮下移植瘤生长的影响 [J], 戴明;罗荣城;郑大勇;吕成伟;丁雪梅3.贝伐单抗对裸鼠胃癌移植瘤免疫功能及血管内皮细胞生长因子的影响 [J], 殷鹏飞;杨小翠;郭联斌;贺永锋;魏玉梅4.贝伐单抗对视网膜母细胞瘤荷瘤裸鼠的影响及机制探讨 [J], 刘法;郝静;陈志杰;刘洪涛;王明坤5.贝伐单抗联合伊立替康对接种人结肠癌SW480细胞裸鼠的肝脏损伤研究 [J], 李婷婷;刘兆喆;郑振东因版权原因,仅展示原文概要,查看原文内容请购买。
横扫六大癌种,PI3K抑制剂开启“异病同治”精准治疗时代

横扫六大癌种,PI3K抑制剂开启“异病同治”精准治疗时代肿瘤医疗的进步,发现不同癌种可存在同一靶点,类似PD1、NTRK等跨癌种的治疗模式逐渐成为主流,通过精准找出突变位点,针对性治疗。
近年PI3K成为热议,该通路激活可见于肺、肝胆、淋巴瘤、乳腺、卵巢、头颈鳞等大癌种,也是耐药的机制。
小编今天呕心汇总PI3K/AKT/mTOR通路抑制剂在各个癌种的临床数据,供大家参考。
▼详谈PI3K/AKT/mTOR通路及靶向药研发PI3K/Akt/mTOR通路是细胞内重要的信号转导途径,在细胞的生长、增殖、凋亡、血管生成、自吞噬等发挥着重要的功能,该通路的紊乱会引起一系列的疾病,包括癌症、神经病变、自身免疫性疾病和造血型疾病。
PI3K主要通过两种方式激活,一种是与具有磷酸化酪氨酸残基的生长因子受体或连接蛋白相互作用, 引起二聚体构象改变而被激活;另一种是通过Ras和p110直接结合导致PI3K的活化。
PI3K被激活后,可活化Akt,而活化的Akt通过磷酸化作用可激活mTOR(丝/苏氨酸激酶)。
在细胞中mTOR以两种复合物的形式存在:mTORC1和mTORC2。
但只有mTORC1对雷帕霉素敏感(rapamycin)。
而PTEN可减少AKT的活化而阻止所有由AKT调控的下游信号传导事件。
该信号通路非常复杂,通路紊乱是癌变的重要机制之一,可广泛见于各个癌种,并且也是耐药的机制之一。
PI3K抑制剂的临床开发根据理论依据,各药厂从通路中不同的位点切入,进行阻断,根据靶向PI3K的小分子抑制剂的选择性不同,可以分为3个类型,即靶向PI3K/mTOR、广谱型的PI3K抑制剂和选择性的PI3K抑制剂。
下图所示不同类型的抑制剂所针对的不同靶点。
▼肺癌:经典案例展示,各PI3K通路抑制剂已初现数据一71岁的日本男性患者,肾癌切除5年后肺部转移,先后使用舒尼替尼(sunitinib)及everolimus(10mg/d)治疗,因治疗相关性间质性肺炎而症状加重。
ATR分子通路及其抑制剂抗肿瘤研究进展

ATR分子通路及其抑制剂抗肿瘤研究进展冯春来;吴文凡【摘要】Ataxia telangiectasia and Rad3-related(ATR)is an important regulatory factor for the DNA damage response(DDR)mechanism.The research found that ATR molecular pathway regulates cell DNA damage repair through a variety of cytokines,which leads to the development of normal cells into tumor cells.ATR is also an ideal antitumor target without affecting normal cells.In recent years,the development of ATR inhibitors has attracted wide attention,and a consid-erable number of ATR kinase inhibitors have been developed,some of which have shown a significant anti-tumor effect,and have entered the clinical trial,and the efficacy and safety of its alone or in combination with other drugs still need further clinical validation.%共济失调毛细血管扩张突变基因Rad3相关激酶(ATR)是一种DNA损伤修复应答(DDR)机制的重要调节因子.研究发现,ATR分子通路通过多种细胞因子调控细胞DNA损伤修复,进而致使正常细胞发展为肿瘤细胞.ATR激酶也是一种能够抗肿瘤且不影响正常细胞的理想靶标,其抑制剂的开发引起广泛关注.目前,已经有相当多的ATR激酶抑制剂被开发出来,其中部分抑制剂展现出了显著的抑瘤效果,且已进入临床试验阶段,其单用或与其他药物联用的疗效和安全性有待进一步临床验证.【期刊名称】《医学综述》【年(卷),期】2017(023)022【总页数】8页(P4419-4426)【关键词】共济失调毛细血管扩张突变基因Rad3相关激酶分子通路;共济失调毛细血管扩张突变基因Rad3相关激酶抑制剂;肿瘤;靶点【作者】冯春来;吴文凡【作者单位】江苏大学药学院,江苏镇江212013;江苏大学药学院,江苏镇江212013【正文语种】中文【中图分类】R322DNA在外部环境和细胞内部的各种因素作用下可不断产生损伤,如体内代谢过程中产生的自由基、DNA在复制和重组过程中自发的错误、环境中的紫外线和离子辐射(ionizing radiation,IR)以及一些化学物质等均能引起DNA损伤,从而导致细胞死亡,有害突变影响细胞活力以及异常细胞行为[1]。
抑制自噬增加 PI3K/AKT/mTOR 信号通路抑制剂引起的胃癌细胞死亡

抑制自噬增加 PI3K/AKT/mTOR 信号通路抑制剂引起的胃癌细胞死亡斯庆图娜拉;刘磊【摘要】目的:为了研究3-MA 是否可能增强胃癌细胞对 PI3K/mTOR 抑制剂NVP-BEZ235的敏感性。
方法以胃癌 SNU16细胞系为研究对象,SNU16细胞用不同浓度的 NVP-BEZ235(10 nM、20 nM 和50 nM)处理24 h。
实验分为四组:Control 组,20 nM NVP-BEZ235组,5 mM 3-MA 组,20 nM NVP-BEZ235联合5mM 3-MA 组。
MTT 法用来检测不同组内细胞的生存率,Western blotting 用来检测 Cleaved Caspase-3和 Cytochrome C 的表达水平。
结果MTT 结果表明 NVP-BEZ235能抑制 SNU16细胞的增殖,3-MA 增强了NVP-BEZ235对 SNU16细胞的增殖抑制作用。
Western blotting 结果表明NVP-BEZ235增加了 Cleaved Caspase-3和 Cytochrome C 的表达,而 NVP-BEZ235联合3-MA 会进一步诱导 Cleaved Caspase-3和 Cytochrome C 蛋白的表达。
结论3-MA 通过抑制自噬增加了 SNU16细胞对 NVP-BEZ235的敏感性。
%Objective To study whether 3-MA can enhance the sensitivity of inhibitor NVP-BEZ235 to gastric canc-er cell.Methods SNU16 cells were treated by different coneentrations of NVP-BEZ235(10 nM,20 nM and 50 nM)for 24 h.Next,SNU16 cells were divided into four groups:Control group,20 nM NVP-BEZ235 group,5 mM 3-MA group, 20 nM NVP-BEZ235 combined with 5 mM 3-MA group.MTT assay was used to examine the proliferation inhibition of SNU16 cells.Western blotting was used to detect a change in protein level of Cleaved Caspase-3 and CytochromeC.Re-sults MTT assay showed that growth inhibition rates among thegroups with different levels of NVP-BEZ235 was sta-tistically significant.NVP-BEZ235 combined with 3-MA enhanced the inhibition ratio of cell compared with NVP-BEZ235 group.Western blotting showed that Cleaved Caspase-3 and Cytochrome C were increased in cells following treated with NVP-BEZ235,and then 3-MA enhanced the expression of these proteins induced by NVP-BEZ235.Conclu-sion 3-MA sensitized SNU16 cells to NVP-BEZ235 by inhibition of auto-phagy.【期刊名称】《中国实验诊断学》【年(卷),期】2015(000)009【总页数】4页(P1457-1460)【关键词】胃癌;自噬;NVP-BEZ235;凋亡【作者】斯庆图娜拉;刘磊【作者单位】鄂尔多斯市中心医院,内蒙古鄂尔多斯 017000;鄂尔多斯市中心医院,内蒙古鄂尔多斯 017000【正文语种】中文【中图分类】R735.2尽管最近几年胃癌的发病率有所下降,但胃癌在我国恶性肿瘤中仍高居第一位。
PI3KAKT信号通路与白血病

PI3K/AKT信号通路与白血病吴建敏贾秀红张健滨州医学院附属医院儿科256603通信作者:贾秀红,Email:【摘要】白血病(leukemia)是一种源于骨髓的造血干细胞恶性增殖性疾病。
PI3K/AKT信号通路是一种胞内传导的信号通路,与肿瘤细胞生存息息相关。
本文就PI3K/AKT信号通路与白血病的相关性进行综述。
【关键词】PI3K/AKT信号通路;白血病;抑制剂基金项目:山东省自然科学基金项目(ZR2014HL032);山东省医药卫生科技发展计划项目(2014WS0183;2017WSB30031)PI3K/AKT signaling pathway and leukemiaWu Jianmin,Jia Xiuhong,Zhang JianDepartment of Pediatrics,Binzhou Medical University Hospital,Binzhou256603,China Corresponding author:Jia Xiuhong,Email:【Abstract】Leukemia is a malignant proliferative disease of hematopoietic stem cells derived from bone marrow.The PI3K/AKT signaling pathway is an intracellular signaling pathway, which is closely related to the survival of tumor cells.This paper reviews the correlation between PI3K/AKT signaling pathway and leukemia.【Key words】PI3K/AKT signaling pathway;Leukemia;InhibitorsFund program:Natural Science Foundation of Shandong Province(ZR2014HL032);Medical and Health Technology Development Program of Shandong Province(2014WS0183; 2017WSB30031)白血病的演变及耐药是一系列复杂机制相互作用的结果,如细胞内信号通路异常激活在其发生发展过程中发挥了重要作用。
PI3K_AKT_mTOR信号通路抑制剂在卵巢癌治疗中的应用进展

PI3K/AKT/mTOR 信号通路抑制剂在卵巢癌治疗中的应用进展发布时间:2021-10-19T05:45:03.971Z 来源:《教育学文摘》2021年6月16期作者:郝德霞[导读] 卵巢癌是临床之中最为常见的妇科恶性肿瘤之一郝德霞武威职业学院,甘肃武威市733000卵巢癌是临床之中最为常见的妇科恶性肿瘤之一,其发病率较高,且病死率居于妇科恶性肿瘤的首位。
卵巢癌患者患病后往往缺乏特异性的症状,且临床之中对于该疾病的筛查手段有限,使得患者在确诊时往往处于疾病的晚期阶段。
对于该疾病的治疗,往往以手术治疗为主,辅以卡铂和紫杉醇联合的全身化疗,保障患者的生存时间得以延长。
但术中、术后往往需要较长时期的间断用药,还可能导致患者产生一定的毒性反应[1]。
当今对于卵巢癌的治疗取得较为显著的进展,卵巢癌患者预后显著改善,生存率较高且疾病复发率呈现下降趋势。
但临床之中仍旧需要寻求更为积极有效的治疗措施,进一步保障患者生命安全,通过卵巢癌基因组图谱对分子图谱的广泛基因组进行分析,能够更好地识别卵巢癌之中涉及代谢以及信号传导途径的变化。
磷脂酰肌醇-3激酶(PI3K)、蛋白激酶B(AKT)以及哺乳动物雷帕霉素靶蛋白(mTOR)信号通路在卵巢癌细胞活动之中具有较高的意义,上述指标能够在不同程度上对细胞的生长、运动、存活等一系列细胞活动情况进行调节, PI3K/AKT/mTOR 信号通路中基因的突变或扩增致使该通路在卵巢癌中处于过度激活状态,说明上述指标与卵巢癌的增殖、侵袭、转移等行为密切相关。
因而本次研究主要就PI3K/AKT/mTOR信号通路抑制剂在进行卵巢癌治疗之中的研究进展进行综述。
一、PI3K/AKT/mTOR信号通路PI3K是一种胞内磷脂酰肌醇激酶,属于脂质激酶家族,依据不同的结构与功能,能够将PI3K分为Ⅰ、Ⅱ、Ⅲ三个大类,其中研究最为广泛的为PI3KⅠ。
PI3KⅠ为异源二聚体,主要组成单位为调节亚基、催化亚基,PI3KⅠ参与细胞增殖、胰岛素信号传导、免疫功能和炎症反应。
PI3K信号通路抑制剂研究进展

Hans Journal of Medicinal Chemistry 药物化学, 2020, 8(3), 51-65Published Online August 2020 in Hans. /journal/hjmcehttps:///10.12677/hjmce.2020.83007The Research Progress of PI3K InhibitorsZijian Zhao1, Ming Zhang2, Chi Li1, Xin Wang1,2*1School of Pharmaceutical Sciences, Liaoning University, Shenyang Liaoning2Liaoning Key Laboratory of New Drug Research & Development, Shenyang LiaoningReceived: Jul. 13th, 2020; accepted: Jul. 27th, 2020; published: Aug. 3rd, 2020AbstractPI3K signaling pathway refers to the PI3K/AKT/mTOR signaling pathway. In this review, we briefly summarized the classification of PI3K inhibitors, and the interaction between PI3K inhibi-tors and PI3K active sites. We also introduced the research progress of PI3K inhibitors in detail, and then revealed the structure-activity relationship and design ideas of PI3K inhibitors in order to find drugs with high activity, good selectivity and small side effects, and bring hope for the can-cer therapy. PI3K signaling pathway plays an important role in human development and is closely related to the occurrence and development of a variety of tumors. In different treatment methods for PI3K signaling pathway, small molecule PI3K inhibitors have great potential in molecular tar-geted anti-tumor treatment. Currently, the main known PI3K inhibitors are Copanlisib, Idelalisib Dactolisib, Omipalisib, etc.KeywordsPI3K Signaling Pathway Inhibitors, Structural, Targets, Research ProgressPI3K信号通路抑制剂研究进展赵咨鉴1,张明2,李驰1,王欣1,2*1辽宁大学药学院,辽宁沈阳2辽宁省新药研发重点实验室,辽宁沈阳收稿日期:2020年7月13日;录用日期:2020年7月27日;发布日期:2020年8月3日摘要PI3K信号通路是指PI3K/AKT/mTOR信号通路。
NVP-BEZ235逆转伯基特淋巴瘤RAJI细胞阿霉素耐药的研究

NVP-BEZ235逆转伯基特淋巴瘤RAJI细胞阿霉素耐药的研究李纯团;朱雄鹏;王少雄;彭群艺;郑艳;刘生全;卢旭东;王永彬;翁丹;王丹【期刊名称】《中国实验血液学杂志》【年(卷),期】2024(32)2【摘要】目的:研究NVP-BEZ23对耐阿霉素细胞株RAJI/DOX的逆转耐药作用。
方法:利用浓度梯度法诱导耐阿霉素细胞株RAJI/DOX;Western blot测定各组细胞Pgp、p-AKT、p-mTOR蛋白水平;MTT法检测细胞抑制率,SPSS软件测定IC50。
结果:成功诱导出耐阿霉素细胞株RAJI/DOX。
耐阿霉素细胞株RAJI/DOX中Pgp、p-AKT、p-mTOR蛋白水平高于亲本细胞RAJI。
NVP-BEZ235可引起耐阿霉素细胞株RAJI/DOX中p-AKT、p-mTOR蛋白水平下降。
NVP-BEZ235能够抑制耐阿霉素细胞株RAJI/DOX增殖,与阿霉素具有协同作用。
结论:PI3K/AKT/mTOR通道在耐阿霉素伯基特淋巴瘤细胞中进一步活化;NVP-BEZ235通过抑制PI3K/AKT/mTOR信号通道活化,能够与阿霉素协同抑制伯基特淋巴瘤耐药细胞,逆转伯基特淋巴瘤耐药细胞对阿霉素的耐药性。
【总页数】7页(P476-482)【作者】李纯团;朱雄鹏;王少雄;彭群艺;郑艳;刘生全;卢旭东;王永彬;翁丹;王丹【作者单位】福建医科大学附属泉州第一医院血液内科;福建医科大学临床医学部【正文语种】中文【中图分类】R733.3【相关文献】1.细胞内GSH耗竭逆转人乳腺癌耐药细胞株MCF-7/ADM对阿霉素的耐药性2.阿霉素纳米粒对白血病耐药细胞株K562/DOX耐药逆转作用的研究3.细胞因子诱导杀伤细胞联合阿霉素逆转多药耐药的研究4.β-榄香烯乳剂逆转多药耐药细胞株MCF-7/ADM对阿霉素耐药性研究因版权原因,仅展示原文概要,查看原文内容请购买。
激酶抑制剂(inase inhibitors)列表
期临床试验;治疗淋巴瘤已经
完成1期临床研究
BI6727(Volasertib) GSK461364 ON01910 HMN-214
PLK1
该化合物已完成一期临床试 验,而对于膀胱癌的治疗已进 入二期临床试验阶段
PLK1
对于实体瘤的治疗已完成一期 临床试验
PLK CDK 等
对胰腺癌的治疗已进入三 期 临床试验阶段。
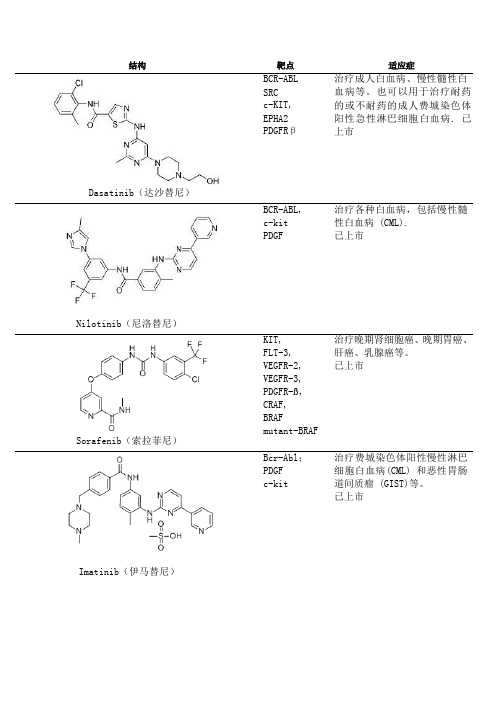
治疗费城染色体阳性慢性淋巴 细胞白血病(CML) 和恶性胃肠 道间质瘤 (GIST)等。 已上市
Gefitinib(吉非替尼) Erlotinib(埃罗替尼) Sunitinib(苏尼替尼) Lapatinib(拉帕替尼)
Vemurafenib
EGFR
用于铂类或多紫杉醇类药物化 疗失败后的局部晚期或转移性 非小细胞肺 癌患者 的 持续治 疗。已上市
CDK Aurora
JNJ-7706621是新型有效的广 谱CDK和Aurora激酶抑制剂;作 用于CDK1和2具有高度有效性。
CDK
治疗淋巴瘤已经完成二期临床
研究;治疗成人实体瘤已经完
成一期临床研究。
UCN-01 BI2536
PLK
治疗实体瘤、急性粒细胞白血
病、非小细胞肺癌、胰腺癌、
小细胞癌、前列腺癌已完成二
Everolimus(依维莫司) Cabozantinib(XL-184)
VEGFR2 RET
广谱络氨酸激酶抑制剂。用于 治疗转移性甲状腺髓样癌。 已上市
mTOR
用于治疗肾细胞癌;也用于治 疗乳腺癌、淋巴瘤、风湿性关 节炎以及多发性骨髓瘤。 已 上市
Temsirolimus(西罗莫司)
Rapamycin (Sirolimus, AY22989, NSC226080)
抗结肠癌纳米紫杉醇与PI3K-mTOR双通路抑制剂BEZ235复方制剂临床前关键技术研究

抗结肠癌纳米紫杉醇与PI3K-mTOR双通路抑制剂BEZ235复方制剂临床前关键技术研究抗结肠癌纳米紫杉醇与PI3K/mTOR双通路抑制剂BEZ235复方制剂临床前关键技术研究近年来,结肠癌作为一种常见的危害人类健康的恶性肿瘤,已经引起了广泛的关注。
在结肠癌的治疗过程中,药物治疗一直占据着重要地位。
纳米技术作为一种新型药物传递系统,被广泛应用于肿瘤治疗,进一步提高了药物的疗效和减轻了不良反应。
而PI3K/mTOR双通路抑制剂BEZ235作为一种免疫治疗药物,也被认为具有良好的治疗效果。
本文旨在研究抗结肠癌纳米紫杉醇与PI3K/mTOR双通路抑制剂BEZ235复方制剂的临床前关键技术。
首先,本研究需要对纳米紫杉醇进行关键技术研究。
紫杉醇作为一种常用的癌症治疗药物,具有良好的抗肿瘤效果。
经过纳米化处理后,纳米紫杉醇能够更好地发挥其药物效果,并且在输送过程中更易穿透癌细胞膜,提高治疗效果。
因此,本研究需要对纳米紫杉醇的制备方法进行探索和改进,以提高其稳定性和生物利用度。
其次,关键技术研究还需包括对PI3K/mTOR双通路抑制剂BEZ235的研究。
PI3K/mTOR双通路是细胞信号转导过程中的一个重要组成部分,对于癌症的形成和发展起到关键作用。
BEZ235作为PI3K/mTOR双通路的抑制剂,能够有效抑制肿瘤细胞增殖并诱导凋亡。
因此,本研究需要对BEZ235的制备方法进行探索和优化,以提高其稳定性和抗肿瘤效果。
同时,本研究还需要对纳米紫杉醇与BEZ235复方制剂的制备工艺进行研究。
在纳米技术的基础上,将纳米紫杉醇与BEZ235复方制剂相结合,能够进一步提高药物的疗效。
因此,将纳米紫杉醇和BEZ235复合制备成复方制剂,需要选择合适的载体和药物比例,并对其制备工艺进行优化。
最后,本研究还需进行体外和体内实验验证。
体外实验可以通过细胞实验来评估纳米紫杉醇和BEZ235复方制剂的抗肿瘤效果和毒副作用。
而体内实验则需要建立合适的小鼠模型,通过给予纳米紫杉醇和BEZ235复方制剂,观察其对结肠癌的治疗效果和安全性。
BEZ235对A549细胞体外增殖的影响及其作用机制的探讨的开题报告

BEZ235对A549细胞体外增殖的影响及其作用机制
的探讨的开题报告
一、研究背景
BEZ235是一种新型有效的分子靶向抗肿瘤药物,可以抑制PI3K和mTOR的激活,从而阻止癌细胞的增殖和转移,被广泛应用于肺癌、乳腺癌、结直肠癌等多种恶性肿瘤的治疗中。
然而,目前对于BEZ235在肺癌A549细胞中的抑制作用机制仍有待深入研究。
二、研究目的
本研究旨在探讨BEZ235对A549细胞体外增殖的影响以及其作用机制,为深入研究该药物的抗肿瘤机制提供理论依据,并为肺癌治疗提供新的思路。
三、研究方法
1.培养A549细胞,将其分为对照组和实验组,实验组分为多个浓度组。
2.采用MTT法检测不同浓度BEZ235对A549细胞增殖的影响。
3.采用Western blot法检测PI3K、AKT和mTOR蛋白的表达水平,探讨BEZ235对这些蛋白的影响。
4.采用细胞周期检测及凋亡检测方法,分析BEZ235对A549细胞的细胞周期和细胞凋亡的影响。
四、预期结果
经过实验,预计能够获得下列结果:
1. BEZ235能够抑制A549细胞的增殖,且存在明显的浓度依赖性。
2. BEZ235能够抑制PI3K、AKT和mTOR蛋白的表达,进而影响肺癌细胞的增殖。
3. BEZ235能够引导A549细胞进入细胞凋亡阶段,并抑制其细胞周期。
五、意义和价值
本研究可以为进一步探讨BEZ235的抗肿瘤机制提供理论依据,并为肺癌治疗提供新的思路。
同时,对于肺癌的研究也有重要启示作用。
BEZ235体内外抑制人乳腺癌细胞系增殖

BEZ235体内外抑制人乳腺癌细胞系增殖周宪春;张松男;林贞花;金铁峰【摘要】目的探讨BEZ235体内外抑制乳腺癌细胞的作用.方法选用人三阴乳腺癌细胞系MDA-MB-231及三阳乳腺癌细胞系MCF-7,用MTT检测细胞增殖;用裸鼠荷瘤实验分析乳腺癌细胞系体内增殖;用Western blot法检测PI3 K/Akt相关信号通路蛋白的表达.结果 BEZ235对乳腺癌细胞具有明显的增殖抑制作用(P<0.01),尤其是对三阴性乳腺MDA-MB-231细胞具有较强的体内外抑制作用(P<0.01).结论 BEZ235可体内外抑制乳腺癌细胞,其机制可能是通过抑制PI3K/Akt信号通路蛋白的磷酸化修饰而实现的.【期刊名称】《基础医学与临床》【年(卷),期】2016(036)003【总页数】4页(P311-314)【关键词】BEZ235;三阴乳腺癌;蛋白质磷酸化【作者】周宪春;张松男;林贞花;金铁峰【作者单位】延边大学附属医院科教处,吉林延吉133000;延边大学附属医院肿瘤科,吉林延吉133000;延边大学肿瘤研究所,吉林延吉133000;延边大学肿瘤研究所,吉林延吉133000【正文语种】中文【中图分类】R734.2;R730.5乳腺癌是一种肿瘤异质性非常明显的疾病,在众多乳腺癌分子亚型中,三阴性乳腺癌(triple negative breast cancer, TNBC; ER-/PR-/Her2-)为恶性度最高的一种。
研究表明,三阴乳腺癌集中于40岁以下绝经前年轻乳腺癌患者,且呈发病率增高趋势[1- 2]。
较其他类型乳腺癌,三阴乳腺癌更易发生远处转移,增殖迅速且对化疗及内分泌治疗不敏感,目前仍无有效的治疗方案。
小分子靶向治疗药物NVP-BEZ235(简称BEZ235)是由瑞士诺华公司新近研发的PI3K/mTOR双重靶向抑制剂,在肿瘤研究领域表现出较好的肿瘤抑制能力[3- 4]。
有研究表明BEZ235可以抑制乳腺癌细胞的增殖及迁移[5],但其具体机制仍不清楚。
PI3K抑制剂在乳腺癌治疗中的应用现状

象 [4] 。 本文将 总 结 PAM 信 号 通 路 作 用 机 制 以 及
PI3K 抑制剂在不同亚型乳腺癌治疗中的应用现状,
以期为不同亚型乳腺癌提供靶向治疗方案。
· 252·
中国肿瘤外科杂志 2021 年 6 月第 13 卷第 3 期 Chin J Surg Oncol, June 2021,Vol.13,No.3
ER + MCF⁃7 细 胞 系) 的 生 长 来 发 挥 协 同 作 用[13] 。
BEZ⁃235 与自噬抑制剂的结合,这些组合导致乳腺癌
细胞增殖抑制和凋亡增加[14] 。
族酶,ⅠA 类 PI3K 是一组由催化亚基 p110( p110α、
3 PI3K 抑制剂与乳腺癌
p85β、p85γ、p50α 和 p55α) 组成的异二聚体,其中催
2 PI3K 抑制剂
鉴于 PI3K 通路的过度激活是乳腺癌最常见的信
雌激素受体(estrogen receptor, ER) 信号传导是乳
乳腺 癌 病 例 为 激 素 受 体 阳 性 ( hormone receptor⁃
positive,HR)[即雌激素受体和 / 或孕酮受体( proges⁃
terone receptor, PR)]。 靶向雌激素作用的内分泌疗
法(endocrine therapies,ETs) 大大降低了乳腺癌的死
亡率。 然而,它们的功效受到天然和获得性内分泌抗
性的限制[15] 。 例如,使用他莫昔芬的患者中有 1 / 3
最终将在 15 年内因内分泌耐药性晚期肿瘤复发;在
common in breast cancer, which makes this pathway a new therapeutic target for breast cancer. A variety of
索拉非尼及PI3K、mTOR抑制剂对肝胆肿瘤细胞增殖及Ghrelin基因表达的影响

索拉非尼及PI3K、mTOR抑制剂对肝胆肿瘤细胞增殖及Ghrelin基因表达的影响赵相轩;温锋;孙巍;戴朝霞;卢再鸣;郭启勇【期刊名称】《临床肿瘤学杂志》【年(卷),期】2016(021)010【摘要】目的探讨索拉非尼及磷脂酰肌醇3激酶(PI3K)、哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂对肝胆肿瘤细胞增殖及Ghrelin (GHRL)基因表达的影响.方法收集体外常规培养的肝癌SMMC7721细胞和胆管癌QBC939细胞,经不同浓度(0、50、100、200 μmol/L)索拉非尼、LY294002(PI3K抑制剂)及Rapamycin(mTOR抑制剂)处理48 h后,采用MTS细胞活性检测试剂盒检测SMMC7721、QBC939细胞的增殖率,实时定量PCR(qPCR)检测SMMC7721、QBC939细胞中GHRL基因的mRNA水平.结果与对照组相比,LY294002、索拉非尼和Rapamycin处理后的SMMC7721、QBC939细胞的增殖率均降低,差异有统计学意义(P<0.05),且随着药物浓度的增加,两种细胞的增殖率均降低(P<0.05).qPCR结果显示,经LY294002和索拉非尼处理48 h后的SMMC7721细胞中GHRL mRNA水平与对照组的差异无统计学意义(P>0.05);与对照组相比,随着Ra-pamycin作用浓度的升高,实验组SMMC7721细胞的GHRL mRNA水平升高,差异有统计学意义(P<O.05);经LY294002、索拉非尼和Rapamycin处理的QBC939细胞中GHRLmRNA水平高于对照组,差异有统计学意义(P<0.05).结论三种药物均可以抑制肝癌和胆管癌细胞的增殖并促进QBC939细胞的GHRL表达,但仅Rapamycin能上调SMMC7721肝癌细胞的GHRL基因表达.GHRL基因表达与肝癌和胆管癌的发生可能有密切关系.【总页数】4页(P879-882)【作者】赵相轩;温锋;孙巍;戴朝霞;卢再鸣;郭启勇【作者单位】110004 辽宁省医学影像重点实验室;110004沈阳中国医科大学附属盛京医院放射科;110004沈阳中国医科大学附属盛京医院放射科;116044 大连医科大学肿瘤干细胞研究院;110004沈阳中国医科大学附属盛京医院放射科;110004沈阳中国医科大学附属盛京医院放射科【正文语种】中文【中图分类】R735【相关文献】1.索拉非尼对敏感人肝癌细胞株MAPK信号通路基因表达的影响 [J], 陈东;赵鹏;殷晓煜;陈伟;肖伟锴;梁力建2.索拉非尼联合5-氮杂-2′-脱氧胞苷对肝癌SMMC-7721细胞DNMT3B基因表达的影响 [J], 韩正阳;崔兵;刘纪君;贺晓珊;梅传忠3.组蛋白去乙酰化酶抑制剂联合索拉非尼对肝癌细胞增殖与凋亡的影响 [J], 郝大林; 孙成学; 肖福斌; 邓放4.益气化瘀解毒方联合索拉非尼对人肝癌索拉非尼耐药细胞移植瘤及缺氧诱导因子1α与血管拟态表达的影响 [J], 王亚琪; 曾普华; 郜文辉5.PI3K/AKT/mTOR信号通路介导索拉非尼治疗原发性肝癌耐药机制的研究进展[J], 王媛; 白玉贤因版权原因,仅展示原文概要,查看原文内容请购买。
用于肿瘤治疗的PI3K_mTOR双重抑制剂的研究进展_赵金龙

297抑制剂的研究进展专题PI3K 用于肿瘤治疗的PI3K/mTOR 双重抑制剂的研究进展赵金龙,吴成军,李鹏飞,周志旭,张亚鲁,孙铁民*(沈阳药科大学 基于靶点的药物设计与研究教育部重点实验室,沈阳 110016)摘要:磷脂酰肌醇3-激酶/蛋白激酶B/雷帕霉素靶蛋白(PI3K/Akt/mTOR )信号通路与细胞周期、血管形成、肿瘤发生和侵袭的关系密切,针对该通路的抑制剂近年也有不同程度的发展,抗肿瘤治疗前景看好。
PI3K/mTOR 双重抑制剂已成为抗肿瘤药物研发的热点之一。
本文对PI3K/mTOR 双重抑制剂的最新研究进展进行了综述,同时简要介绍了磷脂酰肌醇3-激酶,雷帕霉素靶蛋白的相关内容。
关键词:磷脂酰肌醇3-激酶;雷帕霉素靶蛋白;PI3K/mTOR 双抑制剂中图分类号:R979.1 文献标识码:A 文章编号:1672-2981(2014)04-0297-09doi:10.7539/j.issn.1672-2981.2014.04.003Research progress of PI3K/mTOR dual inhibitors for cancer treatmentZHAO Jin-long, WU Cheng-jun, LI Peng-fei, ZHOU Zhi-xu, ZHANG Ya-lu, SUN Tie-min * (Shenyang Pharma-ceutical University, Key Laboratory of Structure-Based Drug Design and Discovery, Ministry of Education, Shenyang 110016)Abstract: Objective The phosphoinositide 3-kinases/protein kinase B/mammalian target of rapamycin, PI3K /Akt /mTOR signaling pathway plays a central role in cell cycle, angiogenesis, tumorigenesis and neoplasm invasion. In re-cent years, the inhibitors, for this signaling pathway, have been researched with great prospects. The research in PI3K/mTOR dual inhibitors have become the hot spot of anticancer drug. In this paper, recent progress of PI3K/mTOR dual inhibitors is reviewed with a brief description of phosphoinositide 3-kinases and mammalian target of rapamycin.Key words: phosphoinositide 3-kinase; mammalian target of rapamycin; PI3K/mTOR dual inhibitor作者简介:赵金龙,男,硕士研究生,主要从事药物合成研究,E-mail :jinlongcxz@ *通讯作者:孙铁民,男,博士研究生导师,主要从事天然产物合成和半合成、手性药物合成以及抗病毒药物的合成研究,Tel :(024)23986398,E-mail :suntiemin@孙铁民,男,1958 年10 月出生于吉林,1982年沈阳药科大学毕业,现为沈阳药科大学药物化学专业教授(二级),博士研究生导师。
BEZ235_DataSheet_MedChemExpress

Inhibitors, Agonists, Screening Libraries Data SheetBIOLOGICAL ACTIVITY:BEZ235 is a dual pan–class I PI3K and mTOR kinase inhibitor with IC 50 of 4 nM/5 nM/7 nM/75 nM, and 6 nM for p110α/γ/δ/β and mTOR (p70S6K ), respectively.IC50 & Target: IC50: 4 nM (p110α), 5 nM (p110γ), 7 nM (p110δ), 75 nM (p110β), 6 nM (mTOR)[1]In Vitro: BEZ235 (NVP–BEZ235) potently inhibits PI3K in an ATP Competitive Manner. NVP–BEZ235 (250 nM) significantly reduced the phosphorylation levels of the mTOR activated kinase p70S6K. NVP–BEZ235 also leads to a reduction of S235/S236P–RPS6 levels with an IC 50 of 6.5 nM, suggesting that NVP–BEZ235 can directly inhibit the mTOR kinase, as the kinase domain of mTOR is highly homologous to the one of class IA PI3K. The activity of NVP–BEZ235 against mTOR is confirmed using a biochemical mTOR K–LISA assay (IC 50, 20.7 nM)[1]. The IC 50s of NVP–BEZ235 for HCT116, DLD–1, and SW480 cell lines are 14.3±6.4, 9.0±1.5, and 12.0±1.6 nM,respectively [2].In Vivo: BEZ235 (NVP–BEZ235) (45 mg/kg, p.o.) treatment induces colonic tumor regression in a GEM model for sporadic PIK3CA wild–type CRC [2]. NVP–BEZ235 (45 mg/kg) is administered to MENX rats (n=2 each group) by oral gavage and animals aresacrificed 1 or 6 hours after treatment. Immunostains for P–AKT and P–S6 show considerable reduction of the two proteins, and particularly of P–S6, 6 hours after administration of NVP–BEZ235 when compares with PEG–treated rats. At 6 hours after treatment,the pituitary adenomas of NVP–BEZ235–treated rats has a proteomic profile significantly different from the tumors ofplacebo–treated rats [3].PROTOCOL (Extracted from published papers and Only for reference)Kinase Assay:[1]PI3Kα, β, and δ proteins are composed of the iSH2 domain of p85 NH2–terminally fused to the full–length protein p110 protein, with the exception of α that also does not contain the last 20 amino acids. PI3Kγ is produced as full–length protein deleted for its first 144 amino acids. All constructs are fused to a COOH–terminal His tag for convenient purification and then cloned into the pBlue–Bac4.5 (for α, β, and δ isoforms) or pVL1393 (for γ isoform) plasmids. The different vectors are then cotransfected with BaculoGold WT genomic DNA using methods recommended by the vendor for production of the respective recombinantbaculoviruses and proteins. Compounds are tested for their activity against PI3K using a Kinase–Glo assay. The kinase reaction is done in 384–well black plate. Each well is loaded with 50 nL of test items (in 90% DMSO) and 5 μL reaction buffer [10 mM Tris–HCl (pH 7.5), 50 mM NaCl, 3 mM MgCl 2, 1 mM DTT, and 0.05% CHAPS] containing 10 μg/mL PI substrate (L–α–phosphatidylinositol;Avanti Polar Lipids; prepared in 3% octyl–glucoside) and the PI3K proteins (10, 25, 10, and 150 nM of p110α, p110β, p110δ, and p110γ, respectively) are then added. The reaction is started by the addition of 5 μL of 1 μM ATP prepared in the reaction buffer and ran for either 60 (for p110α, p110β, and p110δ) or 120 min (for p110γ) and subsequently terminated by the addition of 10 μL Kinase–Glo buffer. The plates are then read in a Synergy 2 reader for luminescence detection [1].Cell Assay: BEZ235 (NVP–BEZ235) is dissolved in DMSO (10 mM) and stored, and then diluted with appropriate media(DMSO 0.1%) before use [2].[2]HCT116 (PIK3CA mutant; kinase domain at H1047R), DLD–1 (PIK3CA mutant; helical domain atProduct Name:BEZ235Cat. No.:HY-50673CAS No.:915019-65-7Molecular Formula:C 30H 23N 5O Molecular Weight:469.54Target:PI3K; mTOR Pathway:PI3K/Akt/mTOR; PI3K/Akt/mTOR Solubility:DMSO: 8.75 mg/mLE545K), and SW480 (PIK3CA wild–type) human CRC cell lines (ATCC) and isogenic DLD–1 PIK3CA mutant and wild–type cells are maintained in DMEM with 10% FBS and 1× Penicillin/Streptomycin. Cells are plated at different initial densities (HCT116: 3,000cells/well, DLD–1: 5,500 cells/well, SW480: 4,500 cells/well, DLD–1 PIK3CA mutant: 7,000 cells/well, and DLD–1 PIK3CA wild–type:9,000 cells/well) to account for differential growth kinetics. After 16 hours, cells are incubated with increasing concentrations ofBEZ235 (10, 100, 1000 nM), and drug–containing growth medium is changed every 24 hours. Cell viability is assessed 16 hours after the initial plating and 48 hours after initiation of drug treatment using the colorimetric MTS assay CellTiter 96 AQueous One Solution Cell Proliferation Assay. Cell viability after drug treatment is normalized to that of untreated cells also grown for 48 hours.IC50 values are calculated using 4 parameter nonlinear regression in GraphPad Prism 5[2].Animal Administration: BEZ235 (NVP–BEZ235) is prepared in 10% 1–methyl–2–pyrrolidone/90% PEG 300 (Mice)[2].BEZ235 (NVP–BEZ235) is suspended in 1 volume of 1–methyl–2–pyrrolidone and 9 volumes of PEG300 (Rat)[3].[2][3]Mice[2]Tumor–bearing Apc CKO mice are randomly assigned to treatment with either control vehicle alone (n=8) or 45 mg/kg body weight BEZ235 in 10% 1–methyl–2–pyrrolidone/90% PEG 300 (n=8) by daily oral gavage for 28 days. The treatment dose is chosen based on literature indicating that 40–50 mg/kg body weight BEZ235 effectively treats murine tumor models without adverse effects. Base on pharmacokinetic studies demonstrating maximal tissue concentration one hour after NVP–BEZ235 administration, tumor–bearing mice are sacrificed one hour after final treatment dose. Colonic tumor volume is assessed using calipers (width×length×height) and tumors are harvested for both western blot analysis and immunohistochemistry.Rat[3]MENX–affected rats used. Three doses of BEZ235 are tested in MENX rats: 20, 30, and 45 mg/kg.References:[1]. Maira SM, et al. Identification and characterization of NVP–BEZ235, a new orally available dual phosphatidylinositol 3–kinase/mammalian target of rapamycin inhibitor with potent in vivo antitumor activity. Mol Cancer Ther, 2008, 7(7), 1851–1863.[2]. Roper J, et al. The dual PI3K/mTOR inhibitor NVP–BEZ235 induces tumor regression in a genetically engineered mouse model of PIK3CA wild–type colorectal cancer. PLoS One, 2011, 6(9), e25132.[3]. Lee M, et al. Targeting PI3K/mTOR Signaling Displays Potent Antitumor Efficacy against Nonfunctioning Pituitary Adenomas. Clin Cancer Res. 2015 Jul 15; 21(14):3204–15.Caution: Product has not been fully validated for medical applications. For research use only.Tel: 609-228-6898 Fax: 609-228-5909 E-mail: tech@Address: 1 Deer Park Dr, Suite Q, Monmouth Junction, NJ 08852, USA。
PI3KAKTmTOR信号通路及其与乳腺癌关系的研究进展

PI3K/AKT/mTOR信号通路及其与乳腺癌关系的研究进展吴子鑫,吴申伟蚌埠医学院临床医学院,安徽蚌埠233000摘要:I类磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(AKT)/雷帕霉素靶体蛋白(mTOR)信号通路具有调控细胞增殖、凋亡、糖原代谢的功能。
癌基因PIK3CA突变可通过激活此通路,无限促进细胞增殖,抑制细胞凋亡及自噬,最终导致乳腺癌的发生。
PI3K抑制剂能有效阻断PI3K/AKT/mTOR信号通路的激活,适用于治疗PIK3CA基因突变的乳腺癌患者。
关键词:乳腺癌;I类磷脂酰肌醇-3-激酶;蛋白激酶B;帕霉素靶体蛋白;信号通路;靶向治疗doi:10.3969/j.issn.1002-266X.2020.16.030中图分类号:R737.9文献标志码:A文章编号;1002-266X(2020)16-0107-04乳腺癌的发生与I类磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(AKT)/雷帕霉素靶体蛋白(mTOR)通路的异常激活及其相关基因突变有关,且在乳腺癌各个亚型中该通路的变化不同。
目前经该通路的靶向治疗已成为研究热点。
磷脂酰肌醇-3-激酶催化亚单位a(PIK3CA)体细胞突变常出现在激素受体(HR)阳性、人表皮生长因子受体2 (HER-2)阴性的乳腺癌患者中,约40%的乳腺癌患者会发生PIK3CA基因突变[]。
PI3K是一组蛋白多聚体,对细胞增殖、凋亡、糖原代谢等进行调控。
PI3K是PI3K/AKT/mTOR信号通路的起始,可被细胞表面受体活化男对下游蛋白的磷酸化作用产生一系列信号转导,PI3K/AKT/mTOR信号通路的过度激活对乳腺癌的发生有重要作用[2]。
早期研究表明,PI3K抑制剂对HR"HER-2-、PIK3CA基因突变的晚期乳腺癌患者具有一定的抗肿瘤作用,但由于脱靶效应造成的不良反应较强,未能实际投入使用。
目前研制出的新型PI3Ka抑制剂阿培利司(Alpelis-ib)具有选择性高、不良反应小的优点,已被纳入美国国家综合癌症网络(NCCN)乳腺癌指南,为乳腺癌患者带来希望[]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ApexBio Technology
产品描述:
BEZ235 是一种咪唑喹啉衍生物,抑制 PI3K 和 mTOR 激酶的活性,具有低纳摩尔浓度的 IC50 值。在临床前动物研究以及临床试验中,BEZ235 有很好的耐受性,具有可控制的胃肠道副 作用[1, 2]。BEZ235 与 ATP 竞争结合激酶的 ATP 结合位点,可逆的降低酶活性,导致肿瘤细 胞停滞在 G1 期[1]。除了抑制细胞生长,BEZ235 还可以阻断 VEGF 诱导的血管生成[3]。BEZ235
也可能抑制 DNA-PKcs[4]。 BEZ235 在体外和体内具有潜在的抗肿瘤活性。BEZ235 抑制不依赖于 PI3K 途径突变的多个肿 瘤细胞系的生长[5]。在异种移植小鼠模型中,BEZ235 阻断 PI3K 信号,具有抗肿瘤活性[1, 5]。 组合研究表明,BEZ235 可以增强 temozolomide 的功效[1]。 临床数据表明 BEZ235 具有抗肿瘤活性,尤其是在 PI3K 信号通路失调的癌症患者中。BEZ235 单独给药或与其他药剂组合给药被用于多个临床试验中。
2-methyl-2-[4-(3-methyl-2-oxo-8-quinolin-3-ylimidazo[4,5-c]quinolin -1-yl)phenyl]propanenitrile
CC(C)(C#N)C1=CC=C(C=C1)N2C3=C4C=C(C=CC4=NC=C3N(C2=O)C)C5 =CC6=CC=CC=C6N=C5
实验操作
细胞实验: 细胞系 溶解方法
反应时间 应用
MOLT-4 和 CEM-R 细胞
在 DMSO 中的溶解度<10 mM。为了获得更高的浓度,可以将离 心管在 37℃加热 10 分钟和/或在超声波浴中震荡一段时间。原液 可以在-20℃以下储存几个月。
在 MOLT-4 和 CEM-R 细胞系中,对 BEZ235 处理 16 小时的 PI 染色 的 T-ALL 细胞进行流式细胞分析表明 G0/G1 期细胞增加,同时 S 和 G2-M 期细胞数量减少。200 nmol/L NVP-BEZ235 处理 16 小时 的 MOLT-4 和 CEM-R 细胞中,Ser807/811 pRb 的量降低,而总的 pRb 水平保持不变。
Evaluation sample solution : ship with blue ice All other available size: ship with RT , or blue ice upon request
生物活性
靶点 :
PI3K/Akt/mTOR Signaling
信号通路:
PI3K
动物实验: 动物模型 剂量 应用
注意事项
植入 BT474-VH2 细胞的雌性无胸腺 nude-Foxn1nu 小鼠
40 mg/kg,1 次/天,21 天;口服给药
在工程表达 H1047R 热点突变或空载体(pBABE)的 HER2 扩增 BT474 乳腺癌细胞衍生的异种移植模型中评估 BEZ235 的抗肿瘤 活性,BEZ235 导致肿瘤生长抑制。与模拟对照相比,BEZ235 对 H1047R 过表达的肿瘤具有更好的效果。
产品说明书
化学性质
产品名: Cas No.: 分子量: 分子式:
BEZ235 (NVP-BEZ235) 915019-65-7 469.55 C30H23N5O
产品名: BEZ235 (NVP-BEZ235): SMILES: 溶解性: 储存条件: 一般建议:
运输条件:
请测试所有化合物在室内的溶解度,实际溶解度和理论值可能略 有不同。这是由实验系统的误差引起的,属于正常现象。
参考文献: [1] Chiarini F, Grimaldi C, Ricci F, et al. Activity of the novel dual phosphatidylinositol 3-kinase/mammalian target of rapamycin inhibitor NVP-BEZ235 against T-cell acute lymphoblastic leukemia. Cancer research, 2010, 70(20): 8097-8107. [2] Serra V, Markman B, Scaltriti M, et al. NVP-BEZ235, a dual PI3K/mTOR inhibitor, prevents PI3K signaling and inhibits the growth of cancer cells with activating PI3K mutations. Cancer research, 2008, 68(19): 8022-8030.
>7.8mg/mL in DMSO
Store at -20°C
For obtaining a higher solubility , please warm the tube at 37°C and shake it in the ultrasonic bath for a while.Stock solution can be stored below -20°C for several months.
参考文献: 1. Maira SM, Stauffer F, Brueggen J et al. Identification and characterization of NVP-BEZ235, a new orally available dual phosphatidylinositol 3-kinase/mammalian target of rapamycin inhibitor with potent in vivo antitumor activity. Mol Cancer Ther 2008; 7: 1851-1863. 2. Markman B, Tabernero J, Krop I et al. Phase I safety, pharmacokinetic, and pharmacodynamic study of the oral phosphatidylinositol-3-kinase and mTOR inhibitor BGT226 in patients with advanced solid tumors. Ann Oncol 2012; 23: 2399-2408. 3. Schnell CR, Stauffer F, Allegrini PR et al. Effects of the dual phosphatidylinositol 3-kinase/mammalian target of rapamycin inhibitor NVP-BEZ235 on the tumor vasculature: implications for clinical imaging. Cancer Res 2008; 68: 6598-6607. 4. Mukherjee B, Tomimatsu N, Amancherla K et al. The dual PI3K/mTOR inhibitor NVP-BEZ235 is a potent inhibitor of ATM- and DNA-PKCs-mediated DNA damage responses. Neoplasia 2012; 14: 34-43. 5. Serra V, Markman B, Scaltriti M et al. NVP-BEZ235, a dual PI3K/mTOR inhibitor, prevents PI3K signaling and inhibits the growth of cancer cells with activating PI3K mutations. Cancer Res 2008; 68: 8022-8030.
特别声明
产品仅用于研究,
不针对患者销售,望谅解。
每个产品具体的储存和使用信息显示在产品说明书中。ApexBio 产品在推荐的条件下是稳定 的。产品会根据不同的推荐温度进行运输。许多产品短期运输是稳定的,运输温度不同于长 期储存的温度。我们确保我们的产品是在保持试剂质量的条件下运输的。收到产品后,按照 产品说明书上的要求进行储存。
引用文献
1. Peng T, Dou QP. "Everolimus Inhibits Growth of Gemcitabine-Resistant Pancreatic Cancer Cells via Induction of Caspase-Dependent Apoptosis and G(2) /M Arrest." J Cell Biochem. 2017 Feb 6. PMID:28165150
