冻干胶塞标准
冻干车间洗胶塞、烘盘岗位安全规范

冻干车间洗胶塞、烘盘岗位安全规范为了保障冻干车间的生产质量和员工的生命财产安全,特制定以下洗胶塞、烘盘操作规范:一、洗胶塞岗位操作规范1.1 操作前检查1.确认前次生产洗胶塞、清洗设备已清理干净。
2.检查自己的私人防护用品是否配备完整,如防护手套、口罩等。
同时,确保其他操作人员的防护措施已经到位。
3.检查洗胶塞机设备运行状况是否正常,并检查水、电、燃气等设备安全。
1.2 操作流程1.将洗胶塞机设备开启,启动洗胶塞工艺流程。
2.等待洗胶塞完成后,使用合适的工具取出塞子。
3.取出的塞子放入特定的储存箱中等待检查。
4.执行清理操作,将洗胶塞机及其周边清洁。
1.3 操作结束1.操作结束后,要将设备关闭并登记任务完成情况。
2.清除个人工作区域内的杂物及废料,并将工具设备进行归位存放。
3.洗胶塞储存箱进行清理,并移至储存区域。
二、烘盘岗位操作规范2.1 操作前检查1.确认工作区间范围内小工具材料的整洁和储存归位。
2.检查电器热风、烘盘机设备的电源进行输电检查。
3.确认工作区间范围内安全出口的畅通并与其他人员做好联系。
2.2 操作流程1.确认烘盘机设备运行状况是否正常及风温是否合适。
2.将被烘干产品均匀地铺在烘盘网上。
3.使用合适的工具把网上的产品进行梳理整理,使产品每层都能够呈现均匀状态。
2.3 操作结束1.烘干结束之后,要将设备及时关闭,等待烘盘机正常冷却后,再将产品移除。
2.清除个人工作区域内的杂物及废料,并将工具设备进行归位存放。
3.将空烘盘物品进行清理,进行下一次操作前进行储存。
以上便是冻干车间洗胶塞、烘盘岗位安全规范的操作流程和注意点,希望所有冻干车间的员工在操作过程中严格遵守这些规范,确保安全生产和一流品质。
胶塞类检验标准

3 产品混装 不同产品混装在一起。
4
包装材料不胶袋外箱、吸塑盘的规格尺寸不合要求,或未按规范 符 包装。
5 包装材损料破包装材料破损,难以对货物起到保护作用。
6.2现品票要求
1、 产品包装为胶袋包装,现品票粘在胶袋表面正中的位置;
2、 产品包装为纸箱包装, 现品票应粘在纸箱的右上角。
现品票参考格式:
胶塞类检验标准
1. 目的
制定本公司的检验标准和试验方法,确保本公司所有胶塞类材料 能满足研发设计、生产装配以及用户的使用要求。
2. 适用范围 本规程适用于本公司所有胶塞类材料的检验
3. 缺陷类别定义 A类严重缺陷(Critical Defect):产品存在对使用者的人身及
财产安全构成威胁的缺陷。 B类重缺陷(Major Defect):产品存在下列缺陷,为主要缺陷。 1) 功能缺陷影响正常使用; 2) 性能参数超出规格标准; 3) 导致客户拒绝购买的严重外观缺陷; 4) 包装存在可能危及产品形象的缺陷。 C类次要缺陷(Minor Defect):不影响产品使用,最终客户有可
能愿意让步接受的缺陷。 4. 检验条件及环境
1) 在自然光或60W-100W(照度达600~800Lux)冷白荧光灯照 明条件下检验;
2) 观察距离:300-350mm ; 3) 观察角度:水平方位45°±15°; 4) 检验时按正常要求的距离和角度扫描整个被检测面:10S
±5S; 5) 检验人员裸视或矫正视力1.0以上,不能有色盲、色弱者。 5. 抽样标准 抽样检验依GB2828-2003标准,取一般检验水平Ⅱ
AQL:A类缺陷为0
B类缺陷为0.65
C类缺陷为1.5
注:特殊项目(尺寸、可靠性)抽样方案为:S-1或具体规定数
胶塞标准要求与试验方法

胶塞标准要求与试验方法一.物理性能1.密合性(泄漏)试验开始前,将整个系统置于试验温度下进行状态调节。
将胶塞浸入20℃~30℃水中,内部施加高于大气压强50Kp的气压15秒。
检验胶塞空气泄漏。
将除气泡的蒸馏水充入胶塞,接至一个真空装置,使在23℃±1℃和在40℃±1℃下承受-20 Kp的压力15秒。
检验是否有空气进入胶塞。
结果:胶塞各结合处应无泄漏。
应不透过空气、微生物和液体,应无空气或水泄漏。
2.自密封性,穿刺落屑试验用针:外径0.8mm注射针并符合GB15811,长型和中型刃口均可。
注射器:符合GB15810,规格为2mL。
蒸馏水快速滤纸及布氏漏斗将胶塞23℃±1℃试验温度下下进行状态调节。
胶塞与适宜的管路(长不超过15cm)连接。
使管路末端置于快速滤纸及布氏漏斗上方,以使试验中的注入液经过滤纸过滤。
用丙酮擦拭注射针,晾干。
将注射器与1支注射针连接,充入水至注射器公称容量。
用装配好的注射针向胶塞的注射区反复穿刺,穿刺点分布应尽量均匀。
每穿刺5次,向胶塞内注射1mL水。
共穿刺10次,注入2 mL水。
更换1支新的注射针,重复穿刺,直至完成30次的穿刺次数。
从胶塞的锥头端施加50Kp的水压30秒,记录注射区形成的液滴。
结果:密封件经外径0.8mm注射针穿刺30次后,应能承受50Kp的水压,泄漏应≤1滴。
胶塞经外径0.8mm注射针穿刺30次后,落屑应≤1粒。
二.化学要求检验液(试验液)的制备: 按YY 0581-2005 输液用胶塞附录B.1的规定进行。
取20只灭过菌的、供使用状态下的胶塞,用适宜的方法将各胶塞剖开。
每个样品加10 mL的比例加水,在70℃±1℃下恒温24小时,将样品与液体分离,冷至室温,为检验液。
取同体积水置于玻璃容器中,同法制备空白对照液。
1、还原物质按GB 8368-2005附录B.2的规定试验,采用制备的胶塞检验液和同批空白液对照,所消耗的高锰酸钾溶液[C(KMnO4)=0.002mol/L]的体积之差应不超过2.0ml。
冻干胶塞标准
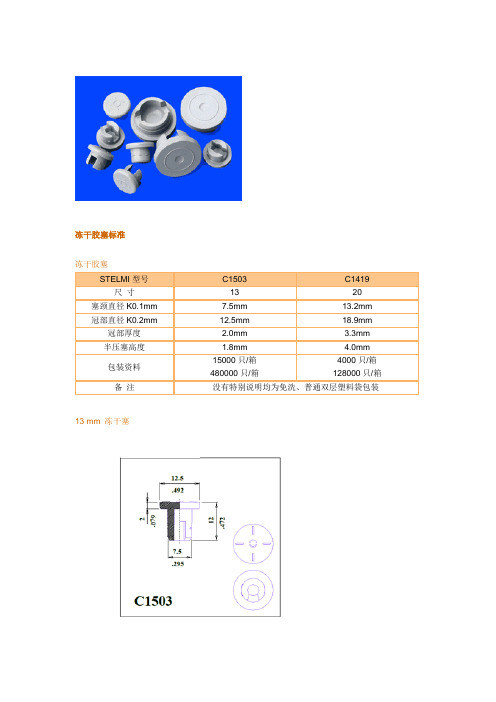
冻干胶塞标准冻干胶塞STELMI型号C1503 C1419 尺寸13 20 塞颈直径K0.1mm 7.5mm 13.2mm 冠部直径K0.2mm 12.5mm 18.9mm 冠部厚度 2.0mm 3.3mm半压塞高度 1.8mm 4.0mm包装资料15000只/箱480000只/箱4000只/箱128000只/箱备注没有特别说明均为免洗、普通双层塑料袋包装13 mm 冻干塞20 mm 冻干塞外观尺寸跳塞的潜在问题分析作者:华国平下面就冻干胶塞在半加塞过程中影响跳塞谈谈我们的想法。
冻干工艺是将配制的溶液,在冰冻状态下通过低压升华和解吸附的方法,使制品内水分减到使其在长时间内无法维持生物学或化学反应的水平。
为满足冻干而设计、生产的胶塞称之冻干胶塞,冻干过程见冻结真空干燥工艺过程曲线及制品干燥示意图。
冷冻干燥注射瓶塞简称冻干瓶塞,从图上可以看出,冻干制剂生产中胶塞有一个半加塞的和全压塞的过程,其中半压塞涉及到胶塞稳定性及跳塞的问题:1. 冻干瓶塞的尺寸:标准中的尺寸一类是适应药厂装配的需要;另一类是为满足临床使用由临床用户提出的。
主要是塞径直径、冠部直径、冠部厚度和总高度。
塞颈直径应考虑定位体(隔离体)尺寸,能够满足半加塞要求,与瓶口的尺寸匹配,如果塞颈过大,半加塞易跳塞;过小起不到半加塞目的,瓶塞会自动落下,瓶子与瓶塞的过盈量应充分考虑。
2. 冻干瓶塞的构型:由于冻干制剂工艺不同,瓶塞构型千变万化,有单叉、双叉、三叉、四叉、异形;隔离体有月牙形,线形等;导气槽有与瓶径内孔相通,多个导气槽不与内孔相通,如下图:导气槽与内孔通导气槽不与内孔通构型不一,会影响半压塞的稳定性,如单叉、四叉冻干瓶塞比两叉、三叉稳定性要好,但不利于瓶塞清洗(部分有死角)。
药品剂量无法全部利用,使用时要认方向不利于操作,从而影响患者的药量。
还有隔离体的尺寸以及分布,分布不匀、大小不一也会影响半加塞的稳定性。
3. 冻干瓶塞的邵氏硬度。
胶塞干燥温度

胶塞干燥温度
对于胶塞的干燥温度,具体要取决于所使用的具体胶水或密封剂的种类和制造商的建议。
不同类型的胶水和密封剂可能有不同的成分和配方,因此其最佳干燥温度会有所差异。
以下是一些常见类型的胶水和其大致的干燥温度范围:
1.普通胶水(PVA胶):
PVA胶通常在室温下(约20摄氏度)即可干燥。
室温条件下,它会形成坚固的胶合。
2.瞬干胶(Cyanoacrylate胶):
瞬干胶对温度较为敏感,一般在10摄氏度到25摄氏度之间最适宜。
低于10摄氏度时,干燥速度可能减缓。
3.硅胶:
硅胶通常在室温下即可干燥。
室温条件下,硅胶会逐渐固化形成柔软而耐用的密封。
4.环氧树脂:
环氧树脂的固化通常需要在较高的温度下进行,一般在20摄氏度到30摄氏度之间。
温度越高,固化速度越快。
5.聚氨酯胶:
聚氨酯胶在15摄氏度到25摄氏度之间的温度下通常能够迅速干燥。
温度较高时,固化速度可能更快。
请注意,这些温度范围是一般情况下的推荐值,具体的使用要求还需要参考制造商提供的产品说明书。
在实际使用过程中,可以通过
调整温度来控制胶水的干燥速度,但要注意不要超出产品的耐受范围。
此外,不同胶水可能对湿度、气压等环境条件也有一定的要求,因此在使用前最好详细阅读产品说明书以确保正确的使用。
冻干 fd 执行标准

冻干(Freeze-drying)是一种将液态物质冷冻并直接从固态空气中除去水分的过程。
冻干FD执行标准是指冻干产品在生产过程中需要遵循的一系列规范和要求,以确保产品质量和安全性。
在中国,冻干FD执行标准主要包括以下几个方面:
1. 国家标准:GB/T 26344-2010《食品工业用冻干设备》规定了食品工业用冻干设备的技术要求、试验方法、检验规则、标志、包装、运输和贮存。
2. 行业标准:如QB/T 2587-2003《食品工业用真空冷冻干燥设备》等,针对不同的食品冻干产品,还有相应的行业标准。
3. 企业标准:各生产企业根据自身产品特点和质量要求,制定的企业内部冻干产品生产标准。
4. 国际标准:如美国FDA(Food and Drug Administration)对冻干药品的生产和质量控制有严格的要求,需要遵循相应的国际标准。
在冻干FD执行标准中,主要涉及以下几个方面的内容:
1. 设备要求:包括冻干设备的结构、性能、安全等方面的要求。
2. 原料要求:对冻干产品的原料质量、来源、处理等方面有明确的规定。
3. 生产过程控制:对冻干过程中的温度、压力、时间等参数进行严格控制,确保产品质量。
4. 质量检验:对冻干产品进行全面的质量检验,包括外观、重量、水分含量、微生物限度等方面。
5. 包装和贮存:对冻干产品的包装材料、标签、贮存条件等进行规定,确保产品在保质期内保持良好品质。
注射用橡胶塞欧洲药典标准

欧洲药典-摘自《欧洲医药精粹》之欧洲药业标准第50节注射用橡胶塞非肠道药用瓶塞非肠道药用瓶塞由大分子弹性有机物经硬化而成。
本标准同样适用于粉针及冻干胶塞,但对于硅氧烷胶塞、层状胶塞或漆层胶塞却不适用。
胶塞是由天然橡胶及各种添加物通过聚合、缩聚反应而成。
胶塞中含有的天然成分及添加物的含量根据需要而定。
胶塞按等级分为Ⅰ类和Ⅱ类。
Ⅰ类胶塞符合高的要求,并优先选用;Ⅱ类胶塞的机械性能则适合于某些特定的用途(如:多次穿刺),由于其化学成分,Ⅱ类胶塞不被优先选用。
胶塞选用原则- 不吸收、渗透制剂,不影响制剂的成分。
- 不受制剂反作用改变稳定性及产生毒性。
- 胶塞在整个密封过程中需与制剂相容。
- 胶塞供应商必须提供胶塞成分给制剂生产商,以配合配伍性测试。
- 一旦胶塞成分有变,则应及时通知药品生产商,并重做配伍性测试。
因为配伍性部分或全部取决于化学成分的改变。
特点胶塞具有弹性,为半透明或不透明体,没有特定的颜色,最终颜色需由添加物决定。
这些添加物实际是大量的可逆膨胀产生的四氢呋喃。
它们是同源质的,不受闪蒸及偶发性物质的影响(比如纤维异粒,废橡胶)。
对于胶塞中橡胶类型的签定说明不在本标准范围内。
因此以下所举各种分析方法中,弹性胶塞及非弹性胶塞的签定没有作橡胶类型的区分。
每批胶塞在使用前都必须做配伍性测试。
多种方法可用于配伍性的测试。
如在萃取物中相对浓度测定,硫酸盐的测定及硫磺的测定,干馏物的红外吸光度测定及紫外吸光度测定。
规定取一横截面为1毫米2 -5毫米2 范围的弹性物,用手拉伸至原长的2倍,并保持1分钟,然后松开,该弹性物在30秒内可收缩至原长的1.2倍。
实验试验液S制备:用水清洗总面积约为100厘米2 的未经切割过的胶塞,然后放入一适当的玻璃容器中,加水浸没。
煮沸5分钟,用水反复洗涤5次。
将清洗后的胶塞放入一宽口三角杯中,加200ml水并称重。
用铝箔或硼硅玻璃烧杯盖住瓶口,在20分钟至30分钟内升温至121℃±2℃保持30分钟,30分钟内冷却至室温。
冻干胶塞水分标准

冻干胶塞水分标准《冻干胶塞水分标准:守护质量的关键密码》嘿,朋友们!想象一下,假如冻干胶塞的世界是一个奇妙的王国,那水分标准可就是这个王国的守护法典啦!不遵守这个法典,那可就要天下大乱喽!你能想象没有严格水分标准的冻干胶塞会引发怎样的“混乱”吗?这可绝对不是闹着玩的呀!一、“水分大作战:不能太湿也不能太干”在这个小标题下呀,咱可以说“在冻干胶塞的水分世界里,太湿就像陷入了沼泽,太干又像走进了沙漠,都不是好地方呀!”。
水分对于冻干胶塞来说至关重要呀!水分太多,那胶塞可能就会变得软趴趴的,失去了应有的韧性和密封性能,就像一个泄了气的皮球,这可怎么担当起保护药品的重任呢?而水分太少呢,又可能导致胶塞变得太脆,容易破裂,这就好比一个脆弱的玻璃娃娃,轻轻一碰就碎了。
所以呀,这个水分的度可得好好把握,就像走钢丝一样,要小心翼翼地保持平衡。
比如说,在生产过程中,要严格控制环境的湿度和温度,确保胶塞不会吸收过多的水分,同时在干燥环节又要恰到好处地去除水分,不能过度哦!二、“精准测量:水分的体温计”哇塞,这里可以讲“测量水分就像是给冻干胶塞量体温,得精确到小数点后几位才行呀!”。
要知道,准确测量冻干胶塞的水分可不是一件容易的事呀!这就像是要在一堆沙子里找出一粒特别的沙子一样困难。
但我们有各种厉害的“秘密武器”哦!比如精密的水分测定仪,它们就像是超级侦探,能敏锐地察觉到水分的细微变化。
而且呀,测量的方法和标准也得严格遵守,不能有丝毫的马虎。
就像医生给病人看病,诊断错了可不行呀!只有通过精准的测量,我们才能知道胶塞的水分是否符合标准,这可是保证质量的关键一步呀!三、“标准的坚守:质量的长城”哎呀呀,这里可以来一句“坚守水分标准,就是在为冻干胶塞的质量修筑坚固的长城呀!”。
这水分标准可不能只是说说而已哦,得真正地去坚守呀!就像战士坚守阵地一样,不能有丝毫的退缩。
生产企业要严格按照标准来操作,不能有任何的侥幸心理。
一旦发现水分不符合标准,那必须立刻采取措施,不能让有问题的胶塞流入市场。
冻干胶塞跳塞的原因

冻干胶塞跳塞的原因
冻干胶是一种常用于电子、医药等行业粘接的胶水,由于其具有较长的固化时间和高粘度,需要通过注射器注入到指定位置后在短时间内进行结固。
然而在使用中,我们有时会遇到一些问题,例如冻干胶塞跳塞的情况。
那么,这种情况可能是由哪些原因引起的呢?
首先,冻干胶的附着力十分强大,如果在注射器或注针上留有任何残留物,将会极大地影响胶水的流动性。
因此,在使用注射器或注针之前,我们必须保证其表面干净无污染,以免在注入中出现阻塞。
其次,冻干胶的配比十分重要,如果配比不当,容易导致胶水出现凝固或流动性不佳的情况。
因此,在使用冻干胶之前,我们应该仔细阅读说明书并按照标准进行配比。
另外,胶水的温度对其流动性也有很大的影响。
如果冻干胶的温度过低或过高,都会使其在注射时出现流动不畅或塞跳塞的情况。
因此,在使用之前,我们需要仔细调节胶水的温度,确保其达到最佳注射温度。
最后,注射器或注针的质量也会影响冻干胶的注入效果。
如果使用的注射器或注针不够优质,其表面可能存在微小的凹陷或残留物,这些细微的质量问题都会造成注射时的卡顿和塞跳塞的情况。
综上所述,冻干胶塞跳塞的原因可能包括注射器与注针残留物、胶水配比不当、胶水温度不合适、以及注射器或注针质量不够优质等多方面因素。
我们在使用过程中要仔细遵守使用说明,并保持注射器及注针的清洁、配比准确、温度适宜、质量过硬等措施,以确保冻干胶能够顺畅地注入预定位置,最终实现粘接的目的。
EP检测-欧洲药典3.2.9

3.2.9.注射用粉针和冻干粉末容器胶塞标准3.2.9. RUBBER CLOSURES FOR CONTAINERS FOR AQUEOUSPARENTERAL PREPARATIONS, FOR POWDERS AND FORFREEZE-DRIED POWDERS粉和冻干粉水肠外制剂胶塞材料通过高分子物质(弹性体)硫化(交联),加入合适的添加剂获得。
该规范也适用于粉和冻干粉在使用前立即被溶解在水中的封闭容器。
该规范不适用于硅橡胶制成的胶塞(在3.1.9处理,不封和油管的有机硅弹性体),夹层封闭或漆封。
弹性体由天然胶或合成物质的聚合,加聚或缩聚产生。
主要组成部分和各种添加剂的性质(例如硫化剂、促进剂、稳定剂、色素)取决于成品所需的属性。
Rubber closures for containers for aqueous parenteral preparations for powders and for freeze-dried powders are made of materials obtained by vulcanisation (cross-linking) of macromolecular organic substances (elastomers), with appropriate additives. The specification also applies to closures for containers for powders and freeze-dried products to be dissolved in water immediately before use.The specification does not apply to closures made from silicone elastomer (which are dealt with in 3.1.9. Silicone elastomer for closures and tubing), to laminated closures or to lacquered closures. The elastomers are produced from natural or synthetic substances by polymerisation, polyaddition or polycondensation. The nature of the principal components and of the various additives (for example vulcanisers, accelerators, stabilisers, pigments) depends on the properties required for the finished article.胶塞材料可以分为两类:Ⅰ类胶塞符合严格要求,是首选;Ⅱ类胶塞有着适用于特殊用途(如多孔冲孔)的机械性能,但因为它们的化学组成,不能满足第一类那样的需求。
冻干制品质量标准

冻干制品质量标准
冻干制品质量标准可以根据具体产品的性质和食品安全要求进行制定,以下是一般情况下冻干制品常见的质量标准:
1. 外观:冻干制品应具有均匀的外观,无异物、杂质和变质迹象。
2. 水分含量:水分含量应符合产品规定的范围,通常要求在2%以下。
3. 总菌落数:冻干制品的总菌落数应符合卫生标准要求,一般要求在1000 CFU/g以下。
4. 大肠菌群:大肠菌群数量应符合卫生标准要求,一般要求为不检出。
5. 沙门氏菌:沙门氏菌应不得检出。
6. 霉菌和酵母菌:霉菌和酵母菌数量应符合卫生标准要求,一般要求在100 CFU/g以下。
7. 添加剂残留物:冻干制品中的添加剂残留物不能超过国家或地区相关标准规定的限量。
8. 营养成分:冻干制品中的营养成分(如蛋白质、脂肪、碳水化合物、维生素等)应符合产品规定的要求。
请注意,以上标准仅为一般情况下的参考,实际标准应根据具体产品的特性和相关法规进行制定。
注射用冷冻干燥无菌粉末用溴化丁基橡胶塞标准

注射用冷冻干燥无菌粉末用溴化丁基橡胶塞本标准适用于直接与注射用冷冻干燥无菌粉末接触的溴化丁基橡胶塞的检验。
【外观】取本品数个,照附表检查法检查,应符合规定。
【鉴别】* (1)取本品适量剪成小颗粒,称取2.0g,置于30ml坩埚中,加碳酸氢钠2.0g均匀覆盖试样,置电炉上,缓缓加热至炭化,放冷,置高温炉300℃加热至完全灰化,取出,放冷,加水10ml使溶解,过滤,取滤液1.5ml,置于试管中,加硝酸酸化,加入硝酸银试液1滴,应产生淡黄色沉淀。
(2)除另有规定外,照包装材料红外分光光谱测定法(YBB00262004)第四法测定,应与对照图谱基本一致。
【穿刺落屑】取本品10个,照注射剂用胶塞、垫片穿刺落屑测定法(YBB00332004)第二法对照法测定,落屑数应不得过5粒。
【穿刺力】取本品10个,照注射剂用胶塞、垫片穿刺力测定法(YBB00322004)第二法测定,穿刺瓶塞所需的力均不得过10N。
【胶塞与容器密合性】取本品10个,置烧杯中,加水5分钟,取出,在70℃干燥1小时,备用。
另取10个与之配套的注射液瓶,加水至标示容量,用上述胶塞、垫片塞紧或封紧,再加上与之配套的铝盖或铝塑盖,压盖。
放入高压灭菌器中,121℃±2℃,保持30分钟,冷却至室温,放置24小时,将上述样品倒置,放入含有10%亚甲兰溶液的容器中,置于带抽气着装置的容器中,抽真空度为25kPa,维持30分钟,真空装置恢复至常压,再放置30分钟,取出,用水冲洗瓶外壁,观察,亚甲兰溶液不得渗入瓶内。
【自密封性】取胶塞与容器密合性项下样品,采用符合注射剂用胶塞、垫片穿刺力测定法(YBB00322004)第二法中注射针,向胶塞不同穿刺部位垂直刺穿胶塞,每个胶塞穿刺3次,每穿刺10次后更换注射针。
将上述样品倒置,放入含有10%亚甲兰溶液的容器中,置于带抽气着装置的容器中,抽真空度为25kPa,维持30分钟,真空装置恢复至常压,再放置30分钟,取出,用水冲洗瓶外壁,观察,亚甲兰溶液不得渗入瓶内。
冷冻干燥卤化丁基橡胶塞标准

冷冻干燥卤化丁基橡胶塞标准冷冻干燥卤化丁基橡胶塞标准1. 冷冻干燥卤化丁基橡胶塞的定义冷冻干燥卤化丁基橡胶塞是一种用于医药领域的塞子材料,具有较高的化学稳定性和耐用性。
它通常用于药品瓶口的密封,以确保药品的质量和安全性。
2. 冷冻干燥卤化丁基橡胶塞的特性- 化学稳定性:冷冻干燥卤化丁基橡胶塞具有很高的化学稳定性,能够在各种药物成分的环境下保持其原有的性质,不会因受到药物成分的影响而发生变化。
- 耐用性:由于其优良的耐腐蚀性和抗老化性能,冷冻干燥卤化丁基橡胶塞能够在长期使用中保持其原有的弹性和密封性能。
- 密封性:冷冻干燥卤化丁基橡胶塞具有较好的密封性能,能够有效地防止外界空气和微生物的进入,保证药品的质量和安全性。
3. 冷冻干燥卤化丁基橡胶塞的标准目前,冷冻干燥卤化丁基橡胶塞的生产和使用已经被纳入了相关的国际标准和行业标准中。
这些标准主要包括了对于原材料的要求、制造工艺的规范、产品性能的检测等内容,旨在确保冷冻干燥卤化丁基橡胶塞的质量和稳定性。
4. 对冷冻干燥卤化丁基橡胶塞的个人观点和理解冷冻干燥卤化丁基橡胶塞作为药品包装中重要的密封材料,对于药品的质量和安全性起着至关重要的作用。
在我看来,更加严格的标准有助于确保冷冻干燥卤化丁基橡胶塞的质量和稳定性,为医药行业提供更加可靠的保障。
总结冷冻干燥卤化丁基橡胶塞作为一种用于医药领域的塞子材料,在药品包装中发挥着至关重要的作用。
通过严格的标准和规范,可以确保冷冻干燥卤化丁基橡胶塞的质量和稳定性,进而保障药品的质量和安全性。
以上就是对冷冻干燥卤化丁基橡胶塞的全面评估和相关文章的撰写,希望能够满足您的要求。
冷冻干燥卤化丁基橡胶塞作为医药领域中的重要密封材料,其质量和稳定性对于药品的质量和安全至关重要。
在目前的医药行业中,对于药品包装材料的质量和标准要求越来越高,以确保药品在生产、储存和输送过程中的质量和安全性。
冷冻干燥卤化丁基橡胶塞的标准和相关要求也被提高和严格化。
冻干车间洗胶塞、烘盘岗位安全规范

冻干车间洗胶塞、烘盘岗位安全规范
在冻干食品生产领域,洗胶塞、烘盘是非常重要的工作流程,然而这也是工人容易发生安全事故的岗位之一。
为了保障工人的安全,必须制定相应的安全规范并严格执行。
胶塞洗净规范
1.工作人员必须进行严格的操作规范培训,确保其理解胶塞洗净工艺流
程和注意事项。
2.操作人员必须佩戴防护手套,并进行消毒处理后再进行操作。
3.操作前应先检查设备是否安装牢固,有无锋利的边角或磨损情况,工
件是否清洗干净。
4.操作人员必须将手伸入洗液中,将胶塞浸泡于清洗液中,确保胶塞完
全浸泡。
5.操作结束后,清洗液和器材必须清理干净,各操作人员应按标准程序
消毒并更换液体。
烘盘操作规范
1.烘盘工作流程一定要得到技术员的审核并进行技术指导。
2.操作人员需要穿着干净的工作服,并进行防护手套和口罩等安全防护
措施。
3.烘盘必须放置在平整且稳固的工作台面上,必须确保进行固定。
4.确保烘盘的加热设备是否正常,回火烘烤防止高温直接对干品进行高
温干烤。
5.操作人员必须在操作时将其手插入烘盘内,操作时必须特别注意触摸
烤盘的位置、时间和温度等操作注意事项。
6.烘盘操作完成后,必须关闭设备和通风装置,然后将器具和产品清洗
干净,以防止产品污染和器具可以长期保持稳定的操作性能。
在冻干车间洗胶塞、烘盘岗位上,安全问题是非常突出和重要的。
为了保障工人的安全,必须执行相应的操作规范,从而防止安全问题的发生。
同时,所有工作人员应该增强安全意识,加强安全宣传和教育,使他们在工作时更加注意安全,从而保证生产工作的顺利进行。
affco标准冻干标准

affco标准冻干标准affco标准冻干标准一直以来都被业界广泛认可,其优异的品质和稳定的性能使其成为许多行业的首选。
冻干技术作为一种现代化的生产工艺,在食品、药品、化妆品等领域都有着重要的应用价值。
affco标准冻干标准不仅仅是一种简单的生产标准,更是一种对产品质量和安全性的保障。
在食品行业中,affco标准冻干标准被广泛应用于水果、蔬菜、肉类等食品的冻干加工过程中。
通过冻干技术,食品中的水分被冻结并转变成蒸汽,从而保留了食品原有的营养成分和口感。
与传统的烘干方法相比,冻干技术能够更好地保持食品的品质,延长其保质期,受到了消费者的青睐。
在药品领域,affco标准冻干标准也被广泛应用于药品的生产过程中。
冻干技术可以有效地保留药品的活性成分,提高药品的稳定性和生物利用度。
通过冻干技术,药品可以更好地保存和运输,确保药品的质量和安全性。
affco标准冻干标准的实施,为药品行业的发展提供了有力支持。
在化妆品领域,affco标准冻干标准也有着重要的应用价值。
冻干技术可以有效地提取植物精华和活性成分,保留化妆品的原生态,提高其功效和稳定性。
通过冻干技术,化妆品可以更好地渗透皮肤,达到更好的护肤效果。
affco标准冻干标准的实施,为化妆品行业的创新和发展注入了新的动力。
总的来说,affco标准冻干标准在各个行业中都发挥着重要的作用,为产品的质量和安全性提供了有力保障。
随着科技的不断进步和人们对品质和安全的要求不断提高,冻干技术将会在未来得到更广泛的应用和推广。
affco标准冻干标准的实施,将会为各个行业的发展带来更多的机遇和挑战,推动行业的不断创新和进步。
希望通过不懈的努力和持续的创新,affco标准冻干标准能够更好地满足市场和消费者的需求,为行业的可持续发展贡献力量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
冻干胶塞标准
冻干胶塞
STELMI型号C1503 C1419 尺寸13 20 塞颈直径K0.1mm 7.5mm 13.2mm 冠部直径K0.2mm 12.5mm 18.9mm 冠部厚度 2.0mm 3.3mm
半压塞高度 1.8mm 4.0mm
包装资料
15000只/箱
480000只/箱
4000只/箱
128000只/箱
备注没有特别说明均为免洗、普通双层塑料袋包装13 mm 冻干塞
20 mm 冻干塞
外观尺寸
跳塞的潜在问题分析
作者:华国平
下面就冻干胶塞在半加塞过程中影响跳塞谈谈我们的想法。
冻干工艺是将配制的溶液,在冰冻状态下通过低压升华和解吸附的方法,使制品内水分减到使其在长时间内无法维持生物学或化学反应的水平。
为满足冻干而设计、生产的胶塞称之冻干胶塞,冻干过程见冻结真空干燥工艺过程曲线及制品干燥示意图。
冷冻干燥注射瓶塞简称冻干瓶塞,从图上可以看出,冻干制剂生产中胶塞有一个半加塞的和全压塞的过程,其中半压塞涉及到胶塞稳定性及跳塞的问题:
1. 冻干瓶塞的尺寸:标准中的尺寸一类是适应药厂装配的需要;另一类是为满足临床使用由临
床用户提出的。
主要是塞径直径、冠部直径、冠部厚度和总高度。
塞颈直径应考虑定位体(隔离体)尺寸,能够满足半加塞要求,与瓶口的尺寸匹配,如果塞颈过大,半加塞易跳塞;过小起不到半加塞目的,瓶塞会自动落下,瓶子与瓶塞的过盈量应充分考虑。
2. 冻干瓶塞的构型:由于冻干制剂工艺不同,瓶塞构型千变万化,有单叉、双叉、三叉、四叉、
异形;隔离体有月牙形,线形等;导气槽有与瓶径内孔相通,多个导气槽不与内孔相通,如下图:
导气槽与内孔通导气槽不与内孔通
构型不一,会影响半压塞的稳定性,如单叉、四叉冻干瓶塞比两叉、三叉稳定性要好,但不利于瓶塞清洗(部分有死角)。
药品剂量无法全部利用,使用时要认方向不利于操作,从而影响患者的药量。
还有隔离体的尺寸以及分布,分布不匀、大小不一也会影响半加塞的稳定性。
3. 冻干瓶塞的邵氏硬度。
冻干瓶塞要求一定的硬度,邵氏硬度≥ 53 为宜,国外邵氏硬度有38 ,偏低。
但国外玻瓶尺寸均一性比较好,有的瓶口有凹槽,∮13 系列冻干塞径下方 1.5mm 处有密封线,可以保证瓶子与胶塞的密合性。
4. 硅化程度:冻干瓶塞与普通注射瓶塞的瓶子一样,但冻干瓶塞与瓶口过盈量与注射瓶塞要大,建议普通 A 级( 1/2A 级)硅化即可,硅化过大,易跳塞。
半加塞不稳定,不利于全压塞。
其二,真空干燥时易落塞,起不到真空时干燥的作用。
5. 半加塞的速度以及加塞的深度,半加塞的速度与精确度要确定,尤其是冻干瓶塞要有一定加塞深度和加塞的成功率。
一般胶塞深入瓶口的内深度要求为 2mm —4mm ,半加塞成功率应在 80% 以上。
6. 加塞机的压力设定:通常要做玻璃瓶压塞压力试验 : 油泵液压压力应设定在 18 — 20Mpa 以上,在此压力下进行压塞试验,通过外观检查,确定油压压塞系统设定的压力是否适合于制品配套的胶塞。
压力不到,易跳塞;压力过大,易使玻璃瓶破损。
(建议在真空箱中压负压压塞)
7. 保持瓶内有一定的真空度:为了确保瓶内的无菌条件,并使瓶塞容易完全压入瓶内,一般在冻干箱内进行胶塞全压塞工序之前,应维持瓶内一个微小的真空度(约 6.6 × 10 3 pa )。
当然,影响冻干制品半压塞、全压塞因素很多,我们看到半加塞胶塞不稳定,产生偏差,不利于全压塞或跳塞现象的分析只是局部的,还需胶塞厂、药厂、临床用户反馈。
对冻干瓶塞的结构、性能进一步分析,设计出合理尺寸,除符合国际标准外,还应开发适应我国玻璃瓶、铝盖、冻干设备的瓶塞,满足用户的要求。
江阴兰陵瓶塞有限公司。
