第八章 羧酸及其衍生物ppt课件
合集下载
有机化学-羧酸及其衍生物

O
O
R C OH + R C OH
OO R C O C R + H2O
2
COOH + (CH3CO)2O
(
CO )2O + CH3COOH
乙酐(脱水剂)
4个或5个碳原子的二元酸加热就能脱水生成 环状(稳定的五元或六元)酸酐。
O C OH
C OH O
150℃
COOH COOH
230 ℃
CH2 COOH H2C
◦ 单酐:在羧酸的名称后加酐字; ◦ 混酐:将简单的酸放前面,复杂的酸放后面再加酐
字; ◦ 环酐:在二元酸的名称后加酐字。
O
O
H3C C
H3CH2C C
O
O
H3C C O
乙酸酐
H3C C O
乙酸丙酸酐
O
C O
C
O
邻苯二甲酸酐
酯是根据形成它的羧酸和醇来命名,称为“某酸某酯”.
O H3C C OCH3
N-甲基乙酰胺
O NH2
苯甲酰胺
O CH3-C-N
CH3 CH3
N,N-二甲基乙酰胺
二、化学性质
(1) 水解 羧酸衍生物水解生成相应的羧酸
O
反 RC Cl
应
OO
活 性
RC O CR
依
O
次 RC OR
减
弱O
RC NH2
+ H OH
O RC OH +
HCl O
RC OH
ROH NH3
(2)醇解
◦ 酰氯、酸酐和酯与醇或酚作用,主要产物是酯。
◦ 芳香族羧酸:羧基与苯环支链相连,以脂肪族为母
体,芳基做取代基;羧基与苯环相连,苯甲酸常为
医学有机化学--第八章羧酸及其衍生物

COOH COOH
O O
180℃
O +H O 2
3、酯的生成
C6H5CH2CH2CH2COOH
H2SO4 回流
+ CH3CH2OH
+ H2O
C6H5CH2CH2CH2COOC2H5
羧酸与伯醇和绝大多数仲醇反应生成酯时,醇脱氢,羧 酸脱羟基。
O C O C
=
=
R OH + H
O C
18
O
R'
H
+
18
第八章
羧酸及其衍生物
(Carboxylic acid and
carboxylic acid derivatives )
分子中含有羧基(-COOH)的有机物称为羧酸。 羧酸分子中羧基上的羟基被取代后的产物称为羧 酸衍生物。
第一节
羧 酸
一、羧酸的结构、分类和命名
(一)羧酸结构
O R C
R C
O
O H
O
O O O
COOH
+ SOCl2
O O O
+ SO2
+HCl
COCl
应用:药物合成
2.酸酐的生成 羧酸在脱水剂(P2O5)作用下 或加热, 羧基间失水生成酸酐。
O CH3 C OH
O + HO C CH3
P2O5
O CH3 C O
O C CH3 + H2O
具有五元环或六元环的酸酐,可由二元酸加热分子内 失水而得。
C CH3
+
H2O
2CH3COOH
O RC OR'
O
+ H2O
H+ 或OH
O O
180℃
O +H O 2
3、酯的生成
C6H5CH2CH2CH2COOH
H2SO4 回流
+ CH3CH2OH
+ H2O
C6H5CH2CH2CH2COOC2H5
羧酸与伯醇和绝大多数仲醇反应生成酯时,醇脱氢,羧 酸脱羟基。
O C O C
=
=
R OH + H
O C
18
O
R'
H
+
18
第八章
羧酸及其衍生物
(Carboxylic acid and
carboxylic acid derivatives )
分子中含有羧基(-COOH)的有机物称为羧酸。 羧酸分子中羧基上的羟基被取代后的产物称为羧 酸衍生物。
第一节
羧 酸
一、羧酸的结构、分类和命名
(一)羧酸结构
O R C
R C
O
O H
O
O O O
COOH
+ SOCl2
O O O
+ SO2
+HCl
COCl
应用:药物合成
2.酸酐的生成 羧酸在脱水剂(P2O5)作用下 或加热, 羧基间失水生成酸酐。
O CH3 C OH
O + HO C CH3
P2O5
O CH3 C O
O C CH3 + H2O
具有五元环或六元环的酸酐,可由二元酸加热分子内 失水而得。
C CH3
+
H2O
2CH3COOH
O RC OR'
O
+ H2O
H+ 或OH
羧酸及其衍生物ppt课件

RCOCl + R'MgCl
RCOOR"+ R'MgCl
RCOR' (fast)
RCOR'
(1) R'MgCl (2) H2O
R' R C OH R'
酸酐与Grignard 试剂的反应在低温下也可得到酮。
2.2.3 还原
催化氢化或用LiAlH4作还原剂,酰卤、酸酐、酯可被还原成醇,酰胺 则被还原成胺。 2.2.4 酯的缩合反应 • Claisen缩合:
2.2 化学性质 2.2.1 亲核取代反应 (水解、醇解、氨解等)
O R C
L
O O
+
Nu
R
C Nu
L
RCNu
+
L
反应活性: RCOCl > (RCO)2O > RCOOR’ > RCONH2 > RCONR’2
水解: RCOCl (RCO)2O RCOOR’ RCONH2 醇解: RCOCl (RCO)2O + R’OH RCOOR’ + HCl RCOOR’ + RCOOH + H2O RCOOH + HCl 2 RCOOH (加热) (催化) (催化、回流) RCOOH + R’OH RCOOH + NH3
一元羧酸:
HCOOH 甲酸
CH3COOH 乙酸
CH3CHCH2COOH
COOH
CH3C CH3
CHCOOH
Cl
3-甲基-2-丁烯酸
3-(对-氯苯基)丁酸
苯甲酸
二元羧酸:
COOH
CHCOOH
HOOCCOOH
RCOOR"+ R'MgCl
RCOR' (fast)
RCOR'
(1) R'MgCl (2) H2O
R' R C OH R'
酸酐与Grignard 试剂的反应在低温下也可得到酮。
2.2.3 还原
催化氢化或用LiAlH4作还原剂,酰卤、酸酐、酯可被还原成醇,酰胺 则被还原成胺。 2.2.4 酯的缩合反应 • Claisen缩合:
2.2 化学性质 2.2.1 亲核取代反应 (水解、醇解、氨解等)
O R C
L
O O
+
Nu
R
C Nu
L
RCNu
+
L
反应活性: RCOCl > (RCO)2O > RCOOR’ > RCONH2 > RCONR’2
水解: RCOCl (RCO)2O RCOOR’ RCONH2 醇解: RCOCl (RCO)2O + R’OH RCOOR’ + HCl RCOOR’ + RCOOH + H2O RCOOH + HCl 2 RCOOH (加热) (催化) (催化、回流) RCOOH + R’OH RCOOH + NH3
一元羧酸:
HCOOH 甲酸
CH3COOH 乙酸
CH3CHCH2COOH
COOH
CH3C CH3
CHCOOH
Cl
3-甲基-2-丁烯酸
3-(对-氯苯基)丁酸
苯甲酸
二元羧酸:
COOH
CHCOOH
HOOCCOOH
有机化学 8-1 羧酸及其衍生物

(1)
(2)
3
2
4
1
5
2.羟基的取代反应
羧酸分子中的羟基可以被卤素(-X) 、酰氧基(-OCOR) 、烷氧基(-OR) 和氨基(-NH2) 等取代分别生成酰卤、酸酐、酯和酰胺等羧酸的衍生物。
酰卤 酸酐 酯
酰胺
(1)酰氯的生成
羧酸与三氯化磷 (PCl3)、五 氯 化 磷 (PCl5) 或 二 氯 亚 砜 (SOCl2) 等卤化试剂反应得到酰氯 。 酰氯是有机合成中很重要的酰基化试剂。
取代基为供电子基时使酸性减弱; 取代基为吸电子基时使酸性增强。
COOH COOH COOH COOH
NO2
Cl
OCH3
pKa
3.42
3.97
4.20
4.47
将下列化合物按照酸性从大到小排序 (1) HCOOH H2CO3 H2O CH3COOH C2H5OH (2) 苯甲酸 对溴苯甲酸 对甲基苯甲酸 对硝基苯甲酸 对羟基苯甲酸
1、增加某一原料的投料量; 2、不断移走反应的的生成物(除去水或移走反应生成的酯)
苯 水
CH3COOH 1 1
+
: :
C2H5OH 1 10
H
CH3COOC2H5 67% 97%
+ H2O
用含有同位素18O的乙醇与乙酸进行酯化,发现18O存在于生成的酯 分子中,而不在水中, 说明反应生成的水是由羧酸的羟基和醇的氢形成的,羧酸的酰氧 键发生了断裂。
环戊基乙酸
邻苯二甲酸 α-萘乙酸
β-苯基丙烯酸 (肉桂酸)
命名下列化合物或写出结构式
CH2COOH (1) OH (2) COOH COOH (3) CH CCH2COOH (4) 反-4-甲基环己烷甲酸
有机化学羧酸及其衍生物PPT课件

脱羧反应
RCCOH
酸性
H
羧羟基被取代(加成.消除)的反应 (羧酸转化为其衍生物的反应)
α-H被取 代的反应
1、羧酸的酸性
RCO2H H2CO3
OH
ROH
pka ~5
6.4
10
16
RCO2H
RCOO- + H +
由于羧酸根负离子具有很好的稳定性而使羧羟基氢
易于离解使羧酸显酸性。
(1)取代基对羧酸酸性的影响
所以羧酸在水中的溶解度比相应的醇大。 甲酸、乙酸、丙酸、丁酸与水互溶。
而对于醇,从正丁醇起在水中的溶解度显著降低。
随着羧酸相对分子质量的增加,其疏水烃基的比例增大,在水
中的溶解度逐渐减小。
高级脂肪羧酸几乎不溶于水,而易溶于醇、醚等有机溶剂。
芳香羧酸在水中的溶解度都很小。
四、羧酸的化学性质
O
还原反应
丁二酸 (琥珀酸)
顺丁烯二酸(马来酸)
命名芳香族羧酸和脂环族羧酸时,通常将芳环或脂环作为脂肪族羧酸 的取代基来命名。
α-萘乙酸中的“α”是指萘环的α位,而不是乙酸的α-碳原子。
环戊基乙酸
邻苯二甲酸 α-萘乙酸
β-苯基丙烯酸 (肉桂酸)
命名下列化合物或写出结构式
(1)
CH2COOH (2)
COOH (3) CH CCH2COOH
3.54
2.74
c、诱导效应随着碳链的延长迅速减弱
O2NCH2COOH 1.08
CH3CH2CHCOOH Cl
pka 2.86
CH3CHCH2COOH Cl
4.05
CH2CH2CH2COOH Cl
4.52
15
大学第八章 羧酸和羧酸衍生物

增强, 供电子取代基使酸性减弱。
O
O
O
Gr
C O H
H-C
O-H
Gw C
O
H
Gr: releasing group
Gw: withdrawing group
供电子基 减弱酸性
广东药学院
吸电子基 增强酸性
18
O2N-CH2COOH H-COOH
pKa
CH3-COOH
4.76
1.68
3.77
FCH2CO2H ClCH2CO2H BrCH2CO2H ICH2CO2H CH3CO2H
广东药学院
12
五、羧酸的化学性质
. 脱羧反应; 4 氧化与还原
*3.α-H 的反应
O C H O
1. 酸 性
(Ar)R
2.亲核取代
广东药学院
RCO-X RCOOCOR RCO-OR RCO-NH2
酰卤 酸酐 酯 酰胺
13
(一) 羧酸的酸性与成盐(重点) Ka: 10-4~10-5
可用pH试纸或石蕊试纸检验出其水溶液的酸性。 共轭大π键的形成使羧酸根的键长完全平均化, 增加了羧基负离子的稳定性,有助于H+的离解。
127pm
R R
H H
R R
+ H+
127pm
广东药学院
14
羧酸能与碱中和生成羧酸盐和水。利用羧酸与 NaHCO3反应放出CO2,可以鉴别、分离苯酚和羧酸。
NaOH CO2H NaHCO3
COONa
H2O
H2O CO2
CO2Na
羧酸盐与强的无机酸作用, 又可转化为原来的羧酸。
RCOONa
HCl
广东药学院
第八章 羧酸(carboxylic acid)及其衍生物
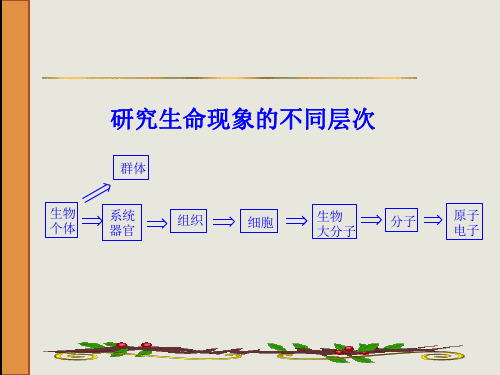
b
e
CC
a
d
b
d
CC
a
e
Z-型 (优先基团a和d在双键同侧) E-型 (优先基团a和d在双键异侧)
(三)基团次序规则
1.原子不同时,原子序数大者为优先。对 同位素,原子量大者为优先。
-I>-Br>-Cl>-SH>-OH>-NH2>-CH3>-D>-H 2.若比较的两个基团的第一个原子相同时,
则比较与该原子后面直接相连的原子, 直到比出大小为止。 -CH3 < -CH2CH3 < CH(CH3)2
(六)二元羧酸热解(pyrolysis)
HOOCCOOH
HCOOH + CO2
HOOCCH2COOH
CH3COOH + CO2
COOH COOH
丁二酐
COOH COOH
COOH
O O + H2O OO
O + H2O 戊二酐 O
O + H2O + CO2
COOH
COOH COOH
O + H2O + CO2
COOH
2.水解法
KCN RX CH3CH2OH RCN H2O/H+
RCOOH
3. 格氏试剂法
Mg/乙醚 RBr
CO2 低温 RMgBr
RCOOMgBr H2O/H+
RCOOH
己二酸是合成尼龙66的原料,试 用丁二烯为原料合成己二酸。
+ Cl2
COOH H2/Ni
Cl NaCN
Cl COOH
CN H2O/H+
H COOH HOOC
羧酸及其衍生物—羧酸的酸性(有机化学课件)

羧酸酸性及其影响因素2. 影响酸性的因素 NhomakorabeaKa
R-COOH
负离子越稳定,越有利于平衡右移 R-COO- + H+
R是吸电子基 羧基负离子上的负电荷进一步分散 稳定性↗,酸性↗ R是给电子基 羧基负离子上的负电荷进一步集中 稳定性↘,酸性↘
羧酸酸性及其影响因素 2. 影响酸性的因素
例1
酸性依次增大 饱和一元羧酸的烃基(R)连有给电子基团(如-CH3)时,酸性减弱;连有吸电子基团 (如-X,-NO2等)时,酸性增强,吸电子基团数目越多,酸性越强。
羧酸的酸性
青霉素
青霉素是常见的抗生素。它是一种有机酸,不溶于水。在制药工业中,制成青霉素的钠盐或钾盐, 增大其在水中的溶解度,以便配制成水剂或注射液。
酸性
目录
CONTENT
01
羧酸酸性及其 影响因素
02
羧酸酸性的应用
01
羧酸酸性及其 影响因素
羧酸酸性及其影响因素
1. 羧酸的酸性大小
Ka
R-COOH
R-COO- + H+
[ H +] [ R C O O -] Ka =
[R C O O H ]
pKa = -lgKa pKa 则酸性
羧酸酸性及其影响因素 1. 羧酸的酸性大小
R-COOH
H2CO3
OH
H2O R-OH
pKa 3.5~5
6.37
10.0 14 16~19
结论:羧酸 > 碳酸 > 苯酚 > 水 > 醇
小结
100% 80% 60% 40% 20%
100% 80% 60% 40% 20%
思考
OH
《羧酸及其衍生物 》课件

沸点和熔点
羧酸通常具有较高的沸点和熔 点,这取决于分子间的氢键形 成。
酸性
羧酸在水中可与碱发生中和反 应,产生相应的盐。
羧酸的化学性质
酯化反应 氧化反应 酰化反应
羧酸与醇反应生成酯,常用于合成香料和涂料。
羧酸可以被氧化剂氧化为相应的醛、酮或羧酸。
羧酸与胺类化合物反应生成酰胺,常用于药物合 成。
羧酸衍生物的合成方法
农业工业
在食品工业中,羧酸及其盐被用作防腐剂和增味剂。
羧酸衍生物被广泛用于制备农药和肥料,以提高农 作物的产量和质量。
结论和总结
通过本课件,我们了解了羧酸及其衍生物的基本概念、结构与分类、物理性质、化学性质、合成方法以及应用 领域。希望这些内容对大家的学习和工作有所帮助。
1
卤代羧酸
通过将羧酸与卤化物反应,生成相应的卤代羧酸。
2
酸酐
通过羧酸与酸性还原剂反应,生成相应的酸酐。
3
酯化反应
通过羧酸与醇反应,生成相应的酯。
羧酸及其衍生物的应用领域
化学工业
羧酸及其衍生物广泛用于制备染料、塑料和涂料等 化学产品。
制药工业
羧酸衍生物被广泛应用于药物合成和药物交付系统 的设计。
食品工业
《羧酸及其衍生物》PPT 课件
本课件将介绍羧酸及其衍生物的基本概念、结构与分类、物理性质、化学性 质、合成方法以及应用领域,旨在通过生动的内容让大家更好地理解羧酸及 其衍生物。
羧酸的基本概念
羧酸是一类分子中含有羧基(-COOH)的有机化合物,具有酸性。它们在许多生物和化学过程中起着重要的作 用。
羧酸的结构与分类
脂肪酸
由长链烃基与羧基组成,常见于天然油脂和脂 肪中。
羧酸盐
(推荐)《羧酸及羧酸衍生物》PPT课件

醋酸
酪酸
安息香酸
肉桂酸
COOH
H COOH C
H COOH C
COOH
乙二酸 (草酸)
C H COOH
顺丁烯二酸 (马来酸)
C HOOC H
反丁烯二酸 (富马酸)
上页 下页
退出
10.1.2 羧酸的制法
(1)烃类氧化 烷烃:R C H 2 C H R 2' O2、Mn1O202℃R C O O H + R C O ' O H
烯烃: C H C 3 H = C H C H 3K M n O 4 2 C H C 3 O O H
C H = 2 C H C H 3+ 3 O / 2 2 M o O 4003 ℃ C H = 2 C H C O O H + H O 2
芳烃: CH3
KMnO4 CH3
COOH COOH
C(CH3)3
H+或 O H
R C N + H2 O
R C O O H + N H3
例:
C H 2 = C H C N+ H O 2 H 2 S O 4 C H 2 = C H C O O H+ N H 3
丙 烯 酸 8 8 %
C H 2 C N+ H O 2 H 2 S O 4
C H 2 C O O H + N H 3
C (H 3 ) C 3 B r 干 M 醚 gC (H 3 ) C 3 M g B r( ( 2 1 C H ) ) O O 3 + 2 C (H 3 ) C 3 C O O H
B r M g
M g B r( 1 C ) O 2
干 醚
( 2 H ) O 3 +
羧酸及其衍生物 ppt课件

K2SO4+2MnSO4+10CO2+ 8H2O
13.6.2 己二酸--合成纤维“尼龙-66”原料.
脱水脱羧 加热
O ‖
苯酚
环己醇
己二酸
ppt课件
环戊酮
33
环己烷
环己酮
◆二元酸加热后的变化规律----Blanc规则: 在可能成环时总是较易形成较稳定的五元或六元环状化合物。
HOOCCOOH HOOCCH2COOH
比较下列各组物质的酸性强弱:
①FCH2COOH; ClCH2COOH; BrCH2COOH; ICH2COOH;
CH3COOH
② HCOOH; CH3COOH; CH3CH2COOH; (CH3)3CCOOH
③ Cl3CCOOH; Cl2CHCOOH; ClCH2COOH
Cl Cl Cl ④ CH3CH2CHCOOH; CH3CHCH2COOH; CH2CH2CH2COOH; CH3CH2CHCOOH ⑤PhCOOH; CH3COOH; CH3CH2COOH
HCOOH
CO2 + H2
ppt课件 30
13.5.2 乙酸(醋酸) • 发酵法--食醋 • 工业制备(甲醇,乙醇,乙烯,乙炔或轻油氧化):
13.5.3 丙烯酸 丙烯酸的制备--丙烯气相氧化:
CH2=CH—CH3
O2,MoO3
280~360℃,0.2~0.3MPa
CH2=CH—COOH
• 丙烯酸具有羧酸和烯烃双重性质。双键易发生氧化
CH 2COOH
CH2COOH
CH=CHCOOH
苯乙酸
3-苯丙烯酸 (-苯丙烯酸,肉桂酸)
-萘乙酸
2. 羧基直接与苯环相连——苯甲酸作为母体, 环上其它基团作为取代基.
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
δ 1 0 . 5 ~ 1 3 H =
◆羧酸的化学性质
H αH 卤 代 O α = R C C O H H
脱 羧 反 应
酸 性
羟 基 被 取 代
1.酸性
①羟基O上电子云密度下降,O-H键变弱,容易断 裂,电离出质子(H+),故表现为有一定的酸性。 ②p-共轭使羧酸根负离子中氧负离子的负电荷均匀 地分散在两个氧原子上,使羧酸根负离子更稳定,容 易生成;也使羧酸的酸性增强。
羧酸的酸性强弱
与分子结构有关
。
C l B r
> > C H C O O H C H C O O H C H C O O H 2 2 2 F
p K . 6 6 a2
Y-CH2COOH
2 . 8 6
2 . 9 0
取代基Y 吸电子能力越强,相应的羧
酸酸性也越强。取代基Y供电子能力越强,酸性越弱
rC l F C H = C H C H Y 2 I B 3 H 2 . 8 6 2 . 5 7 . 3 5 3 2 . 9 4 p K a . 1 8 4 . 8 7 4 . 7 64
第八章 羧酸及 其衍生物
§8.1
羧酸
◆羧酸的分类与命名
分类:可分为一元、二元、多元羧酸
或脂肪酸、芳香酸等
根据来源命名:甲酸又叫蚁酸;乙酸又叫
醋酸;苯甲酸又叫安息香酸。
系统命名法:-COOH是最优官能团
H C H C H C O O H C H C H C O O H C 2 3
丙烯酸 2-丁烯酸
吸电子取代基增多时,也使相应羧酸的酸性增加。
C l C H C O H C l C H C O H C l C C O H 2 2 2 2 3 2 p K a 2 . 8 6
烷基的影响: HCOOH pKa 3.75 H3COOH (CH3)2CHCOOH (CH3)3CCOOH 4.76 4.86 5.05
酸酐
O
O C H 3C X
酰卤
O O CH 3 C NH 2 C H 3 C OR
酰胺 酯
(1) 酰卤 RCOX 的生成 除HCOOH外,羧酸可PCl3、PCl5、SOCl2作用,羧 酸中的羟基被氯原子取代生成酰氯。如: b.p. 118℃ 75℃ 52℃ 200℃分解
+ C H C O C l + 3 C H C O O H P C l H P O 3 3 33 3 3
IR谱: OH伸缩振动—
二聚体:2500~3300cm-1(宽而散);
单体: 3550cm-1(气态或非极性溶 剂的稀溶液)。
C=O伸缩振动—脂肪族羧酸:1700~1725cm-1
芳香族羧酸:1680~1700cm-1
NMR谱: RCH2COOH R2CHCOOH RCOOH
δ 2 ~ 2 . 6 H =
离出质子(H+),故表现为有一定的酸性
◆羧酸的物理性质
O O H H H R C O H O H
=
H O O R R C C O O H
=
=
羧酸是极性分子,能与水形成氢键,故低级一元酸可与
水互溶,但随M↑,在水中的溶解度↓,从正戊酸开始在水中 的溶解度只有3.7 %,>C10的羧酸不溶于水。
b.p: 羧酸 > M 相同的醇。
HOO C
=
HOO C
=
HOO C
=
>
C
pKa
N O O
=
O N O
=
>
I
只 有 I无 C
3.49 4.20
3.42
值得注意的是: 取代基处于邻位时,无论这个取代基是吸电子
基还是供电子基(-NH2除外),都将使酸性↑,
产生这种现象的原因较为复杂,诸如立体效应、 氢键等。总称为邻位效应。
Hale Waihona Puke C O O H1 . 2 6
0 . 6 4
吸电子取代基离羧基距离越近时,诱导效应增强,
羧酸酸性也增强。当取代基与羧基相距三个碳原子
以上时,诱导效应的影响,就非常小了。
CH3 CH2 CH2COOH Pka =4.81
C H C H C H C O O H> C H C H C H C O O H> C H C H C H C O O H 3 2 3 2 2 2 2 C l C l C l
亚磷酸不易挥发,故该法适用于制备低沸点酰氯。
+ C O O H P C l 5
+ + H C l C O C l P O C l 3
b.p.
249℃
197℃
105.3℃
磷酰氯沸点较低(105.3℃),故适用于制备高沸点酰氯
N O 2 + S O C l C O O H 2
N O 2
S O + H C l C O C l+ 2
α
βα
γ βα
p K . 8 2 a 2
4 . 4 1
4 . 7 0
苯甲酸的酸性:比一般的脂肪 酸(甲酸除外)的酸性强。
◆苯环上取代基对羧酸酸性的影响
取代苯甲酸的酸性与取代基的种类有关, 也与 取代基在苯环上的位置有关。取代基在对位时可 通过诱导效应或共轭效应影响苯甲酸的酸性,而 在间位时则只通过诱导效应起作用。
CH
CHCOOH
COOH
β-苯基丙烯酸 肉桂酸 2-环己烯基甲酸
取代酸
◆羧酸的结构
H O H C C H OH
H 3C C O
OH
⑴由于p-π共轭作用,羰基上电子云密度升高,羰基碳 上正电性降低;因此羰基与亲核试剂的反应活性降低。 不能再与HCN等亲核试剂进行加成反应。 ⑵羟基O上电子云密度下降,O-H键变弱,容易断裂,电
该法的副产物均为气体,有利于分离,且产率较高。
选用何种方法,取决于原料、产物与副产物之间的
沸点差(沸点差越大,越容易分离)。酰卤易于水解,故 不能用水洗的方法除去反应中的无机物。
(2) 酸酐的生成
除HCOOH外,羧酸与脱水剂[P2O5或(CH3CO)2O] 共热,两分子羧酸则发生分子间脱水生成酸酐。 OP O O O O 2 5 + + C R C R C O H H O R O C R H O 2 △
C O O H
C O O H
C O O H
C O O H
<
N H 2 C H 3
<
4.39 4.19
<
C l
<
N O 2
pKa 4.92
3.97
3.42
与取代基对苯酚酸性的影响规律一致
2.羧羟基被取代的反应 (羧酸衍生物的合成)
H R C C H O 羟 基 被 取 代 = O H
酸 性
O C H C C O C H 3 3
O RC O
=
O RC O
1 2 O
RC 1 2 O
=
大多数羧酸的酸性 pKa值在 3.5-5之间,比盐
酸、硫酸等无机强酸弱,强于苯酚 ( pKa=10 ) 、 碳 酸 ( pKa=6.3 ) 和 醇 (pKa=16-19)。
羧酸可分解碳酸氢钠生成二氧化碳,而苯酚
则不能。可鉴别羧酸及苯酚。
◆羧酸的化学性质
H αH 卤 代 O α = R C C O H H
脱 羧 反 应
酸 性
羟 基 被 取 代
1.酸性
①羟基O上电子云密度下降,O-H键变弱,容易断 裂,电离出质子(H+),故表现为有一定的酸性。 ②p-共轭使羧酸根负离子中氧负离子的负电荷均匀 地分散在两个氧原子上,使羧酸根负离子更稳定,容 易生成;也使羧酸的酸性增强。
羧酸的酸性强弱
与分子结构有关
。
C l B r
> > C H C O O H C H C O O H C H C O O H 2 2 2 F
p K . 6 6 a2
Y-CH2COOH
2 . 8 6
2 . 9 0
取代基Y 吸电子能力越强,相应的羧
酸酸性也越强。取代基Y供电子能力越强,酸性越弱
rC l F C H = C H C H Y 2 I B 3 H 2 . 8 6 2 . 5 7 . 3 5 3 2 . 9 4 p K a . 1 8 4 . 8 7 4 . 7 64
第八章 羧酸及 其衍生物
§8.1
羧酸
◆羧酸的分类与命名
分类:可分为一元、二元、多元羧酸
或脂肪酸、芳香酸等
根据来源命名:甲酸又叫蚁酸;乙酸又叫
醋酸;苯甲酸又叫安息香酸。
系统命名法:-COOH是最优官能团
H C H C H C O O H C H C H C O O H C 2 3
丙烯酸 2-丁烯酸
吸电子取代基增多时,也使相应羧酸的酸性增加。
C l C H C O H C l C H C O H C l C C O H 2 2 2 2 3 2 p K a 2 . 8 6
烷基的影响: HCOOH pKa 3.75 H3COOH (CH3)2CHCOOH (CH3)3CCOOH 4.76 4.86 5.05
酸酐
O
O C H 3C X
酰卤
O O CH 3 C NH 2 C H 3 C OR
酰胺 酯
(1) 酰卤 RCOX 的生成 除HCOOH外,羧酸可PCl3、PCl5、SOCl2作用,羧 酸中的羟基被氯原子取代生成酰氯。如: b.p. 118℃ 75℃ 52℃ 200℃分解
+ C H C O C l + 3 C H C O O H P C l H P O 3 3 33 3 3
IR谱: OH伸缩振动—
二聚体:2500~3300cm-1(宽而散);
单体: 3550cm-1(气态或非极性溶 剂的稀溶液)。
C=O伸缩振动—脂肪族羧酸:1700~1725cm-1
芳香族羧酸:1680~1700cm-1
NMR谱: RCH2COOH R2CHCOOH RCOOH
δ 2 ~ 2 . 6 H =
离出质子(H+),故表现为有一定的酸性
◆羧酸的物理性质
O O H H H R C O H O H
=
H O O R R C C O O H
=
=
羧酸是极性分子,能与水形成氢键,故低级一元酸可与
水互溶,但随M↑,在水中的溶解度↓,从正戊酸开始在水中 的溶解度只有3.7 %,>C10的羧酸不溶于水。
b.p: 羧酸 > M 相同的醇。
HOO C
=
HOO C
=
HOO C
=
>
C
pKa
N O O
=
O N O
=
>
I
只 有 I无 C
3.49 4.20
3.42
值得注意的是: 取代基处于邻位时,无论这个取代基是吸电子
基还是供电子基(-NH2除外),都将使酸性↑,
产生这种现象的原因较为复杂,诸如立体效应、 氢键等。总称为邻位效应。
Hale Waihona Puke C O O H1 . 2 6
0 . 6 4
吸电子取代基离羧基距离越近时,诱导效应增强,
羧酸酸性也增强。当取代基与羧基相距三个碳原子
以上时,诱导效应的影响,就非常小了。
CH3 CH2 CH2COOH Pka =4.81
C H C H C H C O O H> C H C H C H C O O H> C H C H C H C O O H 3 2 3 2 2 2 2 C l C l C l
亚磷酸不易挥发,故该法适用于制备低沸点酰氯。
+ C O O H P C l 5
+ + H C l C O C l P O C l 3
b.p.
249℃
197℃
105.3℃
磷酰氯沸点较低(105.3℃),故适用于制备高沸点酰氯
N O 2 + S O C l C O O H 2
N O 2
S O + H C l C O C l+ 2
α
βα
γ βα
p K . 8 2 a 2
4 . 4 1
4 . 7 0
苯甲酸的酸性:比一般的脂肪 酸(甲酸除外)的酸性强。
◆苯环上取代基对羧酸酸性的影响
取代苯甲酸的酸性与取代基的种类有关, 也与 取代基在苯环上的位置有关。取代基在对位时可 通过诱导效应或共轭效应影响苯甲酸的酸性,而 在间位时则只通过诱导效应起作用。
CH
CHCOOH
COOH
β-苯基丙烯酸 肉桂酸 2-环己烯基甲酸
取代酸
◆羧酸的结构
H O H C C H OH
H 3C C O
OH
⑴由于p-π共轭作用,羰基上电子云密度升高,羰基碳 上正电性降低;因此羰基与亲核试剂的反应活性降低。 不能再与HCN等亲核试剂进行加成反应。 ⑵羟基O上电子云密度下降,O-H键变弱,容易断裂,电
该法的副产物均为气体,有利于分离,且产率较高。
选用何种方法,取决于原料、产物与副产物之间的
沸点差(沸点差越大,越容易分离)。酰卤易于水解,故 不能用水洗的方法除去反应中的无机物。
(2) 酸酐的生成
除HCOOH外,羧酸与脱水剂[P2O5或(CH3CO)2O] 共热,两分子羧酸则发生分子间脱水生成酸酐。 OP O O O O 2 5 + + C R C R C O H H O R O C R H O 2 △
C O O H
C O O H
C O O H
C O O H
<
N H 2 C H 3
<
4.39 4.19
<
C l
<
N O 2
pKa 4.92
3.97
3.42
与取代基对苯酚酸性的影响规律一致
2.羧羟基被取代的反应 (羧酸衍生物的合成)
H R C C H O 羟 基 被 取 代 = O H
酸 性
O C H C C O C H 3 3
O RC O
=
O RC O
1 2 O
RC 1 2 O
=
大多数羧酸的酸性 pKa值在 3.5-5之间,比盐
酸、硫酸等无机强酸弱,强于苯酚 ( pKa=10 ) 、 碳 酸 ( pKa=6.3 ) 和 醇 (pKa=16-19)。
羧酸可分解碳酸氢钠生成二氧化碳,而苯酚
则不能。可鉴别羧酸及苯酚。
