第07章--氨基酸、多肽、蛋白质和酶类药品检验
氨基酸、多肽及蛋白质类药物分析方法

氨基酸、多肽及蛋白质类药物分析方法1. 引言氨基酸、多肽及蛋白质类药物是一类重要的生物大分子,广泛应用于医学、生物学和药物研发领域。
分析方法的研发和优化对于确保药物的质量和安全性至关重要。
本文将介绍氨基酸、多肽及蛋白质类药物分析方法的原理、常用技术和应用。
2. 氨基酸分析方法2.1 色谱法色谱法是最常用的氨基酸分析方法之一。
其中,离子交换色谱法(Ion-exchange chromatography)和高效液相色谱法(High-performance liquid chromatography, HPLC)是最常用的技术。
离子交换色谱法基于氨基酸的电荷性质,通过固定相上的阴离子交换树脂将氨基酸分离。
而HPLC则利用溶液中氨基酸的亲水性质,通过不同流动相的梯度洗脱将氨基酸分离。
2.2 光谱法光谱法基于氨基酸的吸光特性,常用的有紫外-可见光谱法(UV-Vis spectroscopy)和红外光谱法(Infrared spectroscopy, IR)。
紫外-可见光谱法利用氨基酸在特定波长下的吸光度差异进行分析,而红外光谱法则通过氨基酸吸收、发射或散射红外光的特性进行定性和定量分析。
3. 多肽分析方法3.1 质谱法质谱法是多肽分析的主要方法之一。
质谱法利用质谱仪对多肽进行分析,可以进行结构鉴定、定性和定量分析。
常用的质谱方法包括基质辅助激光解析电离飞行时间质谱(Matrix-Assisted Laser Desorption/Ionization Time-of-Flight Mass Spectrometry, MALDI-TOF-MS)和液相色谱-质谱联用(Liquid Chromatography-Mass Spectrometry, LC-MS)。
3.2 磁共振波谱法磁共振波谱法(Nuclear Magnetic Resonance, NMR)提供了多肽的结构信息。
通过分析多肽所产生的NMR信号,可以揭示多肽的空间构象和相互作用等重要信息。
氨基酸、多肽、蛋白质和酶类药品检验.

一氨基酸类药品检验
氨基酸类药物由于其结构上有羧基和氨, 故在进行含量测定时常用下列几种分析方 法。
**1、酸碱滴定法
谷氨酸(glutamic acid)、门冬氨酸(aspartic acid)和赖氨酸(lysine)等氨基酸,其分子结 构中均有羧基,故对其原料药一般采用氢 氧化钠滴定液滴定。
**4、碘量法或溴量法
示例一盐酸半胱氨酸水合物( cysteine hydrochloride hydras)的测定 因其分子结构中含有-SH基,可用碘量法测定。 例二 ,胱氨酸( L-cystine)的测定 因其分子结构中含有-S-S-基,可用溴量法测 定。
5、HPLC或氨基酸自动分析仪
根据蛋白质的性质和结构选用不同 的测定方法。
1、定氮法 2、电泳法 3、生物检定法P183
四常用的酶类药物
常用的酶类药物有胰酶( pancretin)、胃蛋 白酶(pepsin)、尿激酶(urokinase)、糜蛋白 酶( chymotrysin)、弹性酶(elastase)等。
**2、非水溶液滴定法
甘氨酸(glycine)、丝氨酸(serine)、缬氨酸(valine)、亮 氨酸(leucine)、精氨酸(arinine)、丙氨酸(alanine)和色氨 酸(tryptophen)等氨基酸,因其分子结构含有氨基,故对 其原料药,中国药典和卫生部以及地方药品标准一般采用 在非水溶剂中高氯酸滴定液测定含量。 **根据酸碱的质子学说:一切能给出质子的物质为酸,能 接受质子的物质为碱。弱碱在酸性溶剂中碱性显得更强, 而弱酸在碱性溶剂中酸性显得更强,因此本来在水溶液中 不能滴定的弱碱或弱酸,如果选择适当的溶剂使其强度增 加,则可以顺利滴定。氨基酸有氨基和羧基,在水中呈现 中性,假如在冰醋酸中就显示出碱性,因此可以用高氯酸 进行滴定。
蛋白质和多肽类药物的分析及检测方法
第32页,共37页
第33页,共37页
第页,共37页
第37页,共37页
第17页,共37页
第18页,共37页
第19页,共37页
第20页,共37页
第21页,共37页
第22页,共37页
第23页,共37页
第24页,共37页
第25页,共37页
第26页,共37页
第27页,共37页
第28页,共37页
第29页,共37页
第30页,共37页
第31页,共37页
第1页,共37页
第2页,共37页
第3页,共37页
第4页,共37页
第5页,共37页
第6页,共37页
第7页,共37页
第8页,共37页
第9页,共37页
第10页,共37页
第11页,共37页
第12页,共37页
第13页,共37页
第14页,共37页
第15页,共37页
第16页,共37页
蛋白质和多肽类药物的分析及检测方法
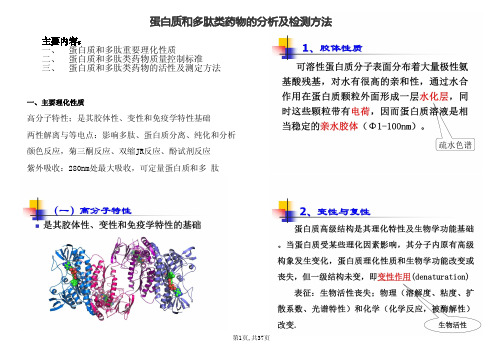
主要内容: 一、 蛋白质和多肽重要理化性质 二、 蛋白质和多肽类药物质量控制标准 三、 蛋白质和多肽类药物的活性及测定方法
一、主要理化性质
高分子特性;是其胶体性、变性和免疫学特性基础 两性解离与等电点:影响多肽、蛋白质分离、纯化和分析 颜色反应,菊三酮反应、双缩JR反应、酚试剂反应 紫外吸收:280nm处最大吸收,可定量蛋白质和多 肽
多肽类药物的氨基酸检测方法

应 用 科 技
多肽 类药物 的氨 基 酸检 测 方法
王 丽 莉
( 哈 尔滨吉象隆生物技 术有 限公 司, 黑龙 江 哈 尔滨 1 5 0 0 0 0 )
摘 要: 多肽 类 药物 的氨 基 酸组 分 测定 步骤 : 多肽 的 水解 方 法一 衍 生一 H P L c检 测 。 简述 多肽 药物 的 水解 方式 及衍 生方 法 。 关 键词 : 氨 基 酸组 分 ; 柱 前衍 生 法 ; 多肽 药 物 多 肽类 药 物 是 由 2 0 种 氨 基 酸按 照 一定 的顺 序 通过 肽 键 、二 硫 多 肽 药物 的 氨基 酸组 分 分 析大 多 数采 用柱 前 衍 生 。 键 连接 成 一 长链 或 环 状结 构 ,常具 备 仪螺 旋 、 B 折 叠 或 不 规 则卷 曲 2 . 2 P I T C柱前 衍 生氨 基 酸分 析 法[ 2 ] 的二级 结 构 。多肽 的一 级结 构 决定 了药 物 的 高级 结 构及 功 能 。分析 本 法 系根 据 氨基 酸 与 异硫 氰 酸 苯  ̄ ( P I T C ) 反应 , 生 成 有 紫外 响 多 肽 类 药 物 的氨 基 酸 组 成 是进 行 多 肽 类 药 物结 构确 证 不 可 缺 少 的 应 的 氨基 酸 衍 生物 苯 氨 基硫 甲酰 氨基 酸 ( P T C 一 氨基酸 ) , P T C 一 氨基 部 分 。氨 基 酸组 成 分析 的步 骤 :多肽 的水 解 方法 一 衍 生一 H P L C检 酸 经反 相 高效 液 相 色谱 分 离后 用 紫 外检 测 , 在 一 定 的范 围 内其 吸光 测。 值 与氨 基 酸浓 度 成正 比。 本 方 法 的线性 浓 度 范 围为 0 . 0 2 5 ~ 1 . 2 5 1 x m o l / 1多 肽 的水解 方 法 m l , 本法 检 验操 作 比较复 杂 。 虽然 多 肽 的氨 基酸 组 成 分析 方 法 较多 , 且 趋 向更灵 敏 、 更精确 、 2 - 3 A Q C柱 前衍 生 分 析法 更 简便 、 更快速 , 但还 没 有 一 种 方 法可 以单 独 适 用 于 所 有 氨 基酸 残 本法 系根 据 氨 基 酸 与 6 一 氨基喹啉一 N 一 羟 基 琥 珀酰 亚 氨 基 氨 基 基 的检 测 , 并 且 很 多 因 素 如温 度 、 时间、 水解 试 剂 、 水 解 方 法及 多肽 甲酸 酯( A Q C) 反应 , 生成有 紫外 与荧光响应 的不 对称尿素衍生 物 样 品中 添加 剂等 对 水解 程 度 均有 影 响 。 常 用 的水 解方 法 作 简要 介 绍 ( A Q C 一 氨基酸 ) , A Q C 一 氨基酸经反相高效液相色谱后用 紫外或荧 光 如下 : 检测 , 在 一定 的范 围 内其 吸光 值 与 氨基 酸 浓 度成 正 比。本 方 法 的 线 1 . 1酸性 水 解 l 1 1 性浓 度 范 围为 2 . 5 ~ 2 0 0 n m o l / m l 。 酸性水解是应用最为广泛水解方法 , 可以使大多数氨基酸残基 2 . 4 O P A和 F M O C柱 前 衍生 氨 基酸 分 析法 完全水解。 最通 用 的水 解 剂是 6 m o l / L H C 1 。 级 氨 基 酸 与邻 苯 二醛 ( O P A) 反应 , 生 成在 3 3 8 n m 波长 下 有 吸 条件 : 6 m o l / L H C 1 、 真空 、 l 1 0 o C, 水解 时 间 为 2 O 一 2 4 h 。即可 用 于 收 的 O P A 一 氨基酸 ; 二级 氨基 酸与 F MO C反 应 , 生成在 2 6 2 n m 波 长 液 相 水解 模 式也 可 用 于气 相 水解 模 式 。但 在 该 条 件下 , 天冬 酰 胺 和 下有 吸 收 的 F MO C 一 氨基 酸 ,生成 的氨 基酸 衍 生 物 通过 高 效 液 相 色 谷氨 酰 胺分 别 被完 全 水解 为 天 冬氨 酸 和 谷氨 酸 , 色 氨 酸 则被 完 全 破 谱 分 离后 用 紫 外或 荧 光检 测 。 2 . 5 D N F B柱 前 衍生 氨 基酸 分 析法 坏 ,半胱 氨 酸先 用 二 硫代 二 丙酸 、 4 一 乙烯 吡啶 或碘 代 乙 酸保 护 后 水
多肽、蛋白质类药物的质量研究和质量标准建立
5.31 lO.3 8.97
20.44 30.79 34.5
0 OH
O
lI
Ho—P
O
)H
U P
%)
O
I|
Ho—P—O
O
— O OiPIO H
0H
0H
GMP
。∥扒d一
o儿
1}
CM[P
∥久—√一一 ∥火吲
OH
O
P
●
O
蛐i州办
O
M』H
N/=i:\
HO HO
GR
F
5.FU
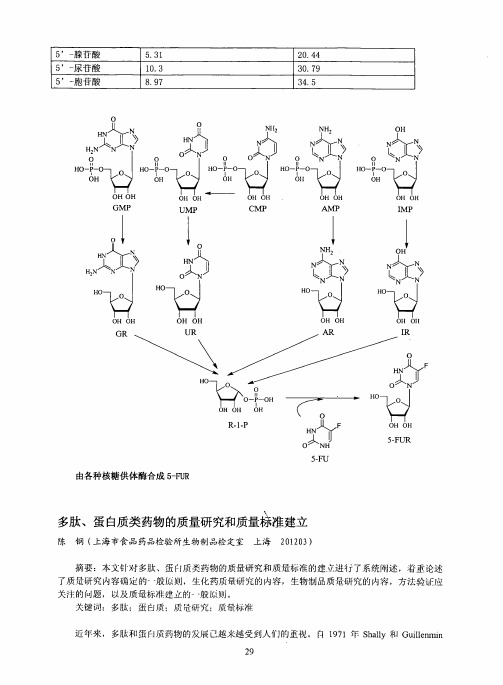
由各种核糖供体酶合成5-FUR
作者: 作者单位: 陈钢 上海市食品药品检验所生物制品检定室 上海 201203
本文链接:/Conference_6681585.aspx
、
多肽、蛋白质类药物的质量研究和质量标准建立
陈钢(上海市食品药品检验所生物制品检定室上海201
203)
摘要:本文钊‘对多肽、蛋Fj质类药物的质量研究和质量标准的建立进行了系统闸述,着重论述 了质量研究内容确定的一‘般历i则,生化药质量研究的内容,生物制品质量研究的内容,方法验证应 关注的I’uJ题,以及质量标准建立的一一般原则。 关键词:多肽:蛋白质;质最研究;质最标准
一、质量研究内容确定的一般原则
药物的质量研究足质奄标准制订的旗础。质量研究的内容应尽可能全面,既要考虑一1般性要求,
义要有针对性。确定质疑研究内容的1般历i则,应根据所研制药物的特性、所采用的制各I:艺、药
物的稳定性数据来定,生物制晶还要根据所使用的生物原材料及_『:艺束确定。
二、生化药质量研究的内容
五、质量标准建立的一般原则
质量标准建立的一般原则:质鼍标准主要由检测项F1、分析方法和限度组成:在全面、有针对 性的质最研究基础上,充分考虑药物的安伞。陀和有效性,以及生产、流通、使用各个环节的影响, 确定控制产品质量的项日和限度:质趟标准应能反映产品特征和质量变化,有效控制产品批f刚质最, 验证生产T艺的稳定性;所用的分析方法应经过方法学验证,具有一‘定的适用性和重现性,同时还 应考虑原料药和其制剂质量标准的关联性。 多肽药物质量标准项F1一‘般有,外观性状;比旋度;氨基酸分析;反离子的含量;水分:多肽 纯度:多肽序列;残留溶剂;氟化物残留量;肽图;多肽的结构;生物或免疫活性;多肽含量等。 提取物药物质量标准项FI应尽可能用理化检测,不能用的应以工艺、安全。件检测和效价测定(或 活一P_-I-:fN定)结合来控制质量。 蛋白质药物以重组治疗蛋白药品为例,质韪标准项F1 1般有,比活;肽图;纯度(HPLC);纯 度(SDS—PAGE);分子量;等电点;最大的紫外吸收波长;残留DNA;残留宿主细胞蛋白:残留抗 生素:N端氮基酸序列:细菌内毒素等
食品分析与检验蛋白质与氨基酸的测定

食品分析与检验蛋白质与氨基酸的测定蛋白质与氨基酸的测定在食品分析与检验领域中具有重要意义。
蛋白质是食品中重要的营养组分,而氨基酸是构成蛋白质的基本单元,对于评价食品的品质和安全性具有重要意义。
本文将介绍蛋白质与氨基酸的测定方法及其在食品分析与检验中的应用。
蛋白质的测定方法主要有几种:生物测定法、光谱法和色谱法。
其中,生物测定法主要是通过测定食品中的氮元素含量来间接测定蛋白质含量。
常用的方法有凯氏氮法、造浆法和改良Kjeldahl法等。
光谱法主要是通过根据蛋白质的特征光吸收谱测定其含量。
常用的方法有紫外-可见光谱法、荧光光谱法和红外光谱法等。
色谱法是通过分离和检测蛋白质的各种成分来测定其含量。
常用的方法有凝胶过滤层析法、液相色谱法和气相色谱法等。
氨基酸是构成蛋白质的基本单元,对于评价蛋白质的营养价值和品质具有重要作用。
氨基酸的测定方法主要有色谱法和生物传感器方法。
其中,色谱法是目前最主要的氨基酸定量方法,其主要包括高效液相色谱法和气相色谱法。
高效液相色谱法常用于氨基酸的定性和定量分析,具有灵敏度高、选择性好和分析速度快的特点;气相色谱法通常用于氨基酸的定性分析,具有高分离能力和分析速度快的优势。
生物传感器方法是一种新兴的氨基酸测定方法,通过利用生物传感器对氨基酸的选择性响应来测定其含量。
生物传感器方法具有灵敏度高、反应快和操作简便等特点。
在食品分析与检验中,蛋白质与氨基酸的测定具有广泛的应用。
首先,蛋白质含量是评价食品营养价值的重要指标之一、通过测定食品中蛋白质的含量,可以评估其蛋白质营养价值和食品质量。
其次,氨基酸是判定食品蛋白质种类和品质的重要指标。
通过测定食品中各种氨基酸的含量,可以评价蛋白质的品质和营养价值。
此外,蛋白质与氨基酸的测定还可以用于食品的伪标问题的检验,如检验食品中是否含有非法添加的蛋白质或氨基酸衍生物。
综上所述,蛋白质与氨基酸的测定在食品分析与检验中具有重要意义。
通过选择合适的测定方法,可以准确、快速地测定食品中的蛋白质含量和氨基酸组成,从而评价食品的品质、安全性和营养价值。
氨基酸分析指导原则

附件:氨基酸分析指导原则草案公示稿氨基酸分析指导原则氨基酸分析系指采用适宜的方法测定蛋白质、多肽或其他药物制剂中氨基酸组成和/或含量。
药品中氨基酸分析通常采用基于高效液相色谱法分离的衍生化法,涉及样品的水解、衍生化反应、分离检测和数据处理等操作。
本指导原则概述了药品中氨基酸分析的基本要求、蛋白质和多肽样品的水解、常用测定方法及其数据分析,为药品中氨基酸的分析提供指导。
1 基本要求1.1仪器氨基酸分析使用的仪器通常是高效液相色谱仪或氨基酸分析仪。
高效液相色谱仪适用于柱前衍生化产物的分离检测;对于柱后衍生化法,由于离子交换分离过程的复杂性和对柱后衍生化反应装置的特殊要求等,一般使用商品化的氨基酸分析仪。
1.2内标物氨基酸分析常采用内标法,内标物应是非天然存在的一级氨基酸,易于获取且价格便宜,在水解过程保持稳定,其色谱响应应与浓度成线性关系,具有独特的保留时间且与待测氨基酸能有效分离。
常用的内标物包括正亮氨酸、α-氨基丁酸、正缬氨酸、肌氨酸和硝基酪氨酸等。
内标物应在水解前或衍生化反应前添加到氨基酸混合物中,以消除由于水解、衍生化、取样、进样、溶液稳定性和色谱条件变化所导致的差异。
1. 3方法验证用于品种项下的氨基酸分析方法,包括样品水解,应参照分析方法验证指导原则(通则9101)进行方法学验证。
1.4水解管的清洗与要求为避免如手套粉末和指纹残留物等对分析结果的影响,水解管应清洗干净。
或使用一次性的水解管。
清洗方法:将水解管用1mol/L盐酸溶液中煮沸1小时,或将其浸泡在浓硝酸或浓盐酸-浓硝酸(1:1)混合液中1小时,再依次用高纯水、HPLC级甲醇冲洗,烘干并密封保存,以免再次污染。
2 蛋白质和多肽样品的水解蛋白质或多肽样品中的氨基酸是以结合形式存在,必须经过水解处理,形成游离氨基酸后才能进行氨基酸分析。
水解方法主要有酸水解,同时辅以碱水解。
酸水解中使用最广泛的是盐酸水解,所得氨基酸不消旋,但该方法引起一些氨基酸的破坏或部分破坏,如色氨酸被破坏,丝氨酸、苏氨酸和半胱氨酸被部分破坏,门冬酰胺和谷氨酰胺脱酰胺分别转化为门冬氨酸和谷氨酸。
氨基酸、多肽、蛋白质和酶类药品检验

1、碘滴定法(也称直接碘量法)
电位比EӨI2/I—低的还原性物质,可以直接用I2的 标准溶液滴定的并不多,只限于较强的还原剂,如:
S2-、SO32-、Sn2+、S2O32医-、学ppAt sO32-、SbO33-等。
8
剩余碘量法
在供试品中先加入一定量、过量的碘滴定液, 待I2与测定组分反应完全后,再用硫代硫酸 钠滴定液滴定剩余的碘,根据与药物作用的 碘的量来计算药物含量的方法。
此外,加入过量的KI,可以加快反应的速度和 提高反应的完全程度。
2.反应时溶液的温度不能高,一般在室温下进行。 因度的分升。解高保。温存度Na增2S大2OI23的溶挥液发时性,,室降温低升淀高粉,指加示速剂Na的2S灵2O敏3
3.析出碘的反应最好在带塞的碘量瓶中进行,滴
定切勿剧烈摇动。
医学ppt
医学ppt
3
非水溶液滴定法
非水溶液滴定法是在非水溶剂中进行滴定的方法。 主要用来测定有机碱及其氢卤酸盐、磷酸盐、硫酸 盐或有机酸盐,以及有机酸碱金属盐类药物的含量。 也用于测定某些有机弱酸的含量。
非水溶剂的种类 (1) 酸性溶剂 有机弱碱在酸性溶剂中可显著地增强其相对碱
度,最常用的酸性溶剂为冰醋酸。 (2) 碱性溶剂 有机弱酸在碱性溶剂中可显著地增强其相对酸
I2十2S2O32—=2I—+S4O62—
本法可测定矿石中0.5%以上的铜。
医学ppt
14
2.钡盐中钡的测定
能 涤将后B,a在2用+H沉A稀淀c-H为NCaBAla溶cC缓r解O冲4,。溶加沉液淀入中经过,过量C滤rKO、I42,洗—
医学ppt
9
2、滴定碘法(间接碘量法)
电位比EӨI2/I—高的氧化性物质,可在一定的条件 下,用碘离子来还原,产生相当量的碘,然后用 Na2S2O3标准溶液来滴定析出的I2,这种方法叫做间 接碘量法或称为滴定碘法。例如K2Cr2O7在酸性镕液 中与过量的KI作用,析出的I2用Na2S2O3标准溶液滴 定。
氨基酸、多肽及蛋白质类药物分析方法 (2)

氨基酸、多肽及蛋白质类药物分析方法
氨基酸、多肽和蛋白质类药物的分析方法通常涵盖以下几
个方面:
1. 色谱分析方法:氨基酸、多肽和蛋白质类药物的分析常
常使用色谱技术,如高效液相色谱(HPLC)和气相色谱(GC)。
对于氨基酸和小肽的分析,常采用反相或离子交
换柱进行分离,并使用紫外或荧光检测器进行检测。
对于
大肽和蛋白质的分析,常采用尺寸排阻色谱(SEC)或离子交换色谱(IEC)进行分离,同时结合质谱进行定性与定量分析。
2. 质谱分析方法:质谱是氨基酸、多肽和蛋白质类药物研
究中常用的分析技术之一。
常用的质谱技术包括质谱成像(MSI)、质谱测定(MS)、质谱显微镜(MSM)等。
3. 免疫分析方法:免疫分析方法常用于蛋白质的定量分析,如酶联免疫吸附试验(ELISA)、免疫层析等。
免疫分析方
法依赖于特异性抗体与目标蛋白结合形成复合物,通过测定复合物的信号强度或荧光强度来定量。
4. 生化分析方法:利用酶促反应对氨基酸、多肽和蛋白质进行定量分析的方法,如酶标记法、比色法、发光法等。
5. 其他分析方法:还有一些特殊的分析方法,如核磁共振(NMR)、电泳等,也可以用于氨基酸、多肽和蛋白质类药物的分析研究。
需要根据具体的药物、样品和分析目的选择合适的分析方法,并结合这些方法的优势和特点进行分析。
多肽类药物的氨基酸检测方法

多肽类药物的氨基酸检测方法多肽类药物的氨基酸组分测定步骤:多肽的水解方法→衍生→HPLC检测。
简述多肽药物的水解方式及衍生方法。
标签:氨基酸组分;柱前衍生法;多肽药物多肽类药物是由20种氨基酸按照一定的顺序通过肽键、二硫键连接成一长链或环状结构,常具备α螺旋、β折叠或不规则卷曲的二级结构。
多肽的一级结构决定了药物的高级结构及功能。
分析多肽类药物的氨基酸组成是进行多肽类药物结构确证不可缺少的部分。
氨基酸组成分析的步骤:多肽的水解方法→衍生→HPLC检测。
1 多肽的水解方法虽然多肽的氨基酸组成分析方法较多,且趋向更灵敏、更精确、更简便、更快速,但还没有一种方法可以单独适用于所有氨基酸残基的检测,并且很多因素如温度、时间、水解试剂、水解方法及多肽样品中添加剂等对水解程度均有影响。
常用的水解方法作简要介绍如下:1.1 酸性水解[1]酸性水解是应用最为广泛水解方法,可以使大多数氨基酸残基完全水解,最通用的水解剂是6 mol/L HCl。
条件:6 mol/L HCl、真空、110℃,水解时间为20~24h。
即可用于液相水解模式也可用于气相水解模式。
但在该条件下,天冬酰胺和谷氨酰胺分别被完全水解为天冬氨酸和谷氨酸,色氨酸则被完全破坏,半胱氨酸先用二硫代二丙酸、4-乙烯吡啶或碘代乙酸保护后水解方可测定,酪氨酸部分被水解液所破坏,丝氨酸和苏氨酸被部分水解。
有些脂肪族氨基酸残基间的肽键难于裂解,可以通过延长水解时间如水解92h甚至120h来解决。
1.2 碱性水解碱性水解一般选用NaOH和KOH作为水解剂。
该水解方法是HCl水解的互补法。
因为碱水解时,多数氨基酸遭到破坏或外消旋化,仅色氨酸是稳定的。
所以此法仅限于测定色氨酸。
1.3 酶水解用一组蛋白酶水解肽链,特别适用于对化学水解敏感的氨基酸如天冬酰胺和谷氨酰胺的测定。
水解过程中氨基酸不发生消旋化,几乎可以保持所有的组成氨基酸不被破坏。
但是因为酶水解条件温和,对天冬酰胺、谷氨酰胺等皆无破坏作用,且反应需要较长的时间,水解不完全,酶本身也是蛋白质,对样品的测定结果可能会有干扰。
酶类药物检测实验报告

一、实验目的1. 掌握酶类药物的基本性质和检测方法。
2. 学会使用沉淀试验和动物试验检测酶类药物的活性。
3. 熟悉酶类药物在生产和应用中的质量控制。
二、实验原理酶类药物是一类生化产品和微生物发酵产品,具有生物催化作用。
在生产和应用过程中,为确保产品质量,需要对其进行检测。
本实验采用沉淀试验和动物试验两种方法检测酶类药物的活性。
沉淀试验:胃蛋白酶在适宜条件下,能将蛋白质分解为氨基酸,使溶液中的蛋白质发生沉淀。
通过观察沉淀情况,可判断酶类药物的活性。
动物试验:透明质酸酶能水解粘多糖,使粘多糖溶液变清。
通过观察粘多糖溶液的变化,可判断酶类药物的活性。
三、实验材料与仪器1. 实验材料:酶类药物样品、蛋白质溶液、粘多糖溶液、生理盐水、生理盐酸、氢氧化钠、硫酸铵、葡萄糖、苯酚、三氯乙酸、氯化钠、氯化钾、磷酸二氢钠、磷酸氢二钠、盐酸、硫酸铜、硫酸锌、葡萄糖酸钙、柠檬酸、硼砂、乙醇、丙酮等。
2. 实验仪器:显微镜、天平、pH计、酸度计、电热恒温水浴锅、水浴箱、试管、烧杯、移液管、滴定管、比色皿、蒸馏水等。
四、实验方法1. 沉淀试验(1)将酶类药物样品溶解于生理盐水中,配制成一定浓度的溶液。
(2)取适量蛋白质溶液,加入试管中,用生理盐水稀释至适宜浓度。
(3)取酶类药物溶液,加入蛋白质溶液中,混合均匀。
(4)观察溶液中蛋白质是否发生沉淀,记录沉淀情况。
2. 动物试验(1)将酶类药物样品溶解于生理盐水中,配制成一定浓度的溶液。
(2)取适量粘多糖溶液,加入试管中,用生理盐水稀释至适宜浓度。
(3)取酶类药物溶液,加入粘多糖溶液中,混合均匀。
(4)观察粘多糖溶液是否变清,记录变化情况。
五、实验结果与分析1. 沉淀试验实验结果显示,酶类药物溶液加入蛋白质溶液后,观察到明显的沉淀现象。
这说明酶类药物具有活性,能够分解蛋白质。
2. 动物试验实验结果显示,酶类药物溶液加入粘多糖溶液后,观察到粘多糖溶液变清。
这说明酶类药物具有活性,能够水解粘多糖。
中药化学辅导——氨基酸、蛋白质和酶类

中药化学辅导——氨基酸、蛋白质和酶类
氨基酸(aminoacids)蛋白质(proteins)和酶类(enzymes)蛋白质是高分子量的化合物,由α一氨基酸组成。
这些氨基酸约有30 种,具r一ch(NH2)一COOH的通式。
有的氮在环中。
酶是生活有机体内具有特殊催化能力的蛋白质,它们大多能溶于水,不溶于乙醇等有机溶剂。
蛋白质的性质不稳定,遇酸、碱、热或某些试剂作用都可沉淀,例如将含蛋白质的水溶液加热至沸或在含蛋白质的溶液中加入乙醇等溶剂,或加入中性盐类(如氯化钠)或醋酸铅等试剂,都可使蛋白质沉淀,中草药中蛋白质可据此种性质提取或去除。
中草药中氨基酸与蛋白质成分的存在与否可用以下方法检查,药材冷水提取液1m1,加0.2%茚三酮试液2~3滴,摇匀,在沸水浴中加热5分钟,如显蓝、蓝紫或紫红色为正反应。
蛋白质与酶等在制备中草药制剂时一般都被视为杂质而除去,因糖浆中有大量蛋白质时就易霉坏,注射剂中有蛋白质时易产生混浊以及注射后产生疼痛或更强烈的副作用。
但最近也发现有一些蛋白质、氨基酸与酶都有生物活性作用,如从栝楼根(天花粉)中提得的天花粉蛋白质可用于人工引产与治疗绒毛膜上皮癌,(即恶性葡萄胎),蕨萝蛋白酶用于抗水肿与抗炎,南瓜子中提得的南瓜子氨酸(cucurbitine)可用于抑制血吸虫、绦虫、蛲虫的生长,使君子中的使君子氨酸(quisqualicacid)可驱蛔虫等。
氨基酸、多肽、蛋白质、酶和核酸

O A RCHCOBu-t 接肽 NH2
H3+O 去保护基
O NH2 R R'CHCHNCHCOOBu-t
使用的酸为:CF3COOH HBr / HOAc A代表: R'CHCOOH
NH2
三 侧链的保护
当氨基酸的侧链带有某些官能团时,在合成多肽时,有时也 需要加以保护,保护的方法,要视具体情况而定。
S
S
牛催产素
第五节 多肽的合成
一 二 三 四 氨基的保护 羧基的保护 侧链的保护 接肽方法
1 混合酸酐法 3 碳二亚胺法 5 固相接肽 2 活泼酯法、 4 环酸酐法、
多肽合成必须解决下面四个问题 1.氨基保护 2. 羧基保护 3. 侧链保护 4. 接肽方法 保护基必须具备的条件 (1)易在预定的部位引入 (2)在某特定的条件下,保护基很易除去 (3)引入和除去保护基时,分子中的其它部位 不会受到影响,特别是已接好的肽键。
例如:
HSCH2 C6H5CH2Cl + ZNHCHCOOR
Na, NH3(l)
去保护基
上保护基
CH2SCH2C6H5 ZNHCHCOOR
CH2SH ZNHCHCOOR
空气中氧化
CH2S ZNHCHCOOR
SCH2 ZNHCHCOOR
巯基经常用苯甲基保护,保护基可以在钠、液氨作用下除去。
四 接肽的方法
O NK
CH2(COOEt)2
O
Br2 CCl4
BrCH(COOEt)2
O
O
N-CH(COOEt)2 O
ClCH2CH2SCH3 Na
烷基化
COO NH-C-CH2CH2SCH3 O COO
COOEt N-C-CH2CH2SCH3 COOEt O
2010版药典氨基酸检测方法

附录XX 氨基酸分析法氨基酸分析法是指用于测定蛋白质、肽及其他药物制剂的氨基酸组成或含量的方法。
根据氨基酸组成分析可以对蛋白质及肽进行鉴别,氨基酸分析法可用于确定蛋白质、肽及氨基酸的含量,及测定可能存在于蛋白质及肽中的非典型氨基酸。
进行氨基酸分析前,必须将蛋白质及肽水解成单个氨基酸,具体水解方法由各品种项下规定。
蛋白质及肽水解后,其氨基酸分析过程与用于其他药物制剂中游离氨基酸的分析过程相同。
本法包括四种柱前衍生法,分别为异硫氰酸苯酯(PITC)法、6-氨基喹啉-N -羟基琥珀酰亚氨基氨基甲酸酯(AQC)法、邻苯二醛(OPA)和9-芴甲基氯甲酸甲酯(FMOC)法、2,4-二硝基氟苯(DNFB)法,以及一种茚三酮柱后衍生法。
不同的品种应针对自身所含的氨基酸种类及各氨基酸的含量选择适宜的氨基酸分析方法并做相应的方法学验证。
由于本法衍生过程中衍生溶液量较少,且容易挥发,外标法极易出现较大的误差,建议采用内标法进行测定,内标的确定由各品种项下规定。
在本法中,由于半胱氨酸或胱氨酸的衍生产物不稳定,因此对于含半胱氨酸或胱氨酸的样品衍生后应尽快测定,或者在衍生前对半胱氨酸或胱氨酸进行适当的处理,使其转化为稳定地产物(如磺基丙氨酸或半胱氨酸-硫代丙酸)后再衍生测定,具体方法由各品种项下规定。
在测定过程中,可根据所用的仪器、色谱柱品牌、色谱柱的长度及要分离的氨基酸种类,对流动相的有机溶剂和洗脱梯度作适当调整以获得较好的分离度。
第一法PITC柱前衍生氨基酸分析法本法系根据氨基酸与异硫氰酸苯酯(PITC)反应,生成有紫外响应的氨基酸衍生物苯氨基硫甲酰氨基酸(PTC-氨基酸),PTC-氨基酸经反相高效液相色谱分离后用紫外检测,在一定的范围内其吸光值与氨基酸浓度成正比。
本方法的线性浓度范围为0.025~1.25μmol/ml。
试剂(1)流动相A 0.1mol/L醋酸钠溶液(取无水醋酸钠8.2g,加水900ml溶解,用冰醋酸调pH至6.5,然后加水至1000 ml)-乙腈(93:7)。
氨基酸多肽蛋白质和核酸

§一、氨基酸
一、简介: 蛋白质水解→α -氨基酸 天然--有旋光性,L-构型。 (S)
R CH COOH H2N
半光氨酸例外 (R )型。
COOH H2 N H CH2SH
COOH HO H CH3 L-乳酸
COOH H2N H R L-氨基酸
Organic Chem
20种常见氨基酸:
结构 名称 甘氨酸 缩写 Gly 等电点 5.97
H
COOCH2C6H5
H2O,OH
H2 / Pd,C (更常用 ) COOH + C6H5CH3
Organic Chem
NH2的保护:
NH2 -CO2 R HOOCNH CHCOOH + C6H5CH3 H2 / Pd O C6H5CH2O C Cl O (H3C)3CO C N3 O C6H5CH2O C NH O (H3C)3CO C NH HCl NH2 R -CO2 HOOCNH CHCOOH + C(CH3)3
缩写
Gln
等电点
5.56
天冬酰胺
Asn
5.07
*蛋氨酸
Met
5.74
丝氨酸
Ser
5.68
Organic Chem
结构
N H HO COOH
名称
脯氨酸
缩写
pro
等电点
6.30
NH2 CH2CH COOH
酪氨酸
Tyr
5.66
NH2 CH2CH COOH *色氨酸 N H
Trp
5.89
II 酸性
NH2 HOOC CH2CH COOH
继续降解……自动化分析 (多肽不太长时可靠) 只能测几十个氨基酸的顺序
蛋白质和多肽的氨基酸序列测定

酰胺化的C端残基,将对活性多肽的研究有很大的帮助。 C端测序技术仍处于研究和发展阶段,虽然该技术还不尽完善,但对
于确认表达蛋白的C端是否正确,以及判断在表达、纯化过程中是否发 生了不必要的加工大有帮助。
当前你正在浏览到的事第二十一页PPTT,共二十一页。
第二步通常是在氨基酸残基上衍生了一个生色基团,通过高效液相色
谱进行分离分析。 本章将就蛋白质和多肽的N端、C端氨基酸序列分析 的原理和方法、进行序列分析前蛋白质和多肽样品的准备作一介绍。
当前你正在浏览到的事第二页PPTT,共二十一页。
第一节 N端分析原理
一、耦 联
蛋白质和多肽的自由α—氨基经与异硫氰酸苯酯(PITC)试
由于选择性对C端羧基进行耦联修饰并从C端逐一将氨基酸残基切下 较N端测序困难,在过去的近20年里,虽然为数不少的蛋白质化学家致
力于C端测序研究,但目前仍不能和N端测序技术程度媲美。蛋白质化学
工作者曾利用羧肽酶分析C端氨基酸残基,但是由于不同的羧肽酶对个 别氨基酸残基有选择性,使用时仍有一定困难。
最近,由于对化学法测定C端技术进行了一系列改进,已有了自动化C
耦联试剂PITC本身也将发生下列副反应,形成一些“杂质”。测序完成 后,电脑将每个循环的产率处理,得出起始产率(initial yield)和重复产 率 (repetitive yield),其中通过起始产率可以估计蛋白质的真实含量, 有时可以推测N端是否封闭(和氨基酸组成分析测得的含量相差甚远),而
%。因此,经过50次循环后,PTH—氨基酸分析谱中将出现较多杂峰,
影响正确辨认,也就是说对于一般蛋白质最多能分析至N端第50个氨基 酸左右,欲知全顺序,则需将蛋白质降解成一系列肽段分析后再拼接。 ①对于有些蛋白质由于含有较多的对Edman反应敏感的残基或肽键,裂 解效率将更低。 ②循环至Ser和Thr时产率突然降低,这是因为在进行这两个氨基酸残基 分析前一个循环中,三氟乙酸除起裂解作用外,可能与Ser和Thr上的羟 基反应,继而部分封闭Ser和Thr的N端—氨基。 ③另外,丝氨酸和苏氨酸的PTI-{{汀生物也会部分转化成其他产物,造 成产率的降低。
氨基酸多肽蛋白质酶和核酸

α-螺旋
β-折叠
在二级结构的基础上,多肽链间通过氨基酸残基侧链的
相互作用而进行盘旋和折叠,因而产生的特定的三维空间结 构,这称为三级结构,也称为蛋白质的亚基。
各个亚基在低聚蛋白中的空间排布及相互作用,称为蛋 白质的四级结构。
蛋白质的生理活性是由二级、三级、四级结构来决定的。
此时您正浏览在第21页,共36页。
S
S
牛催产素
此时您正浏览在第18页,共36页。
多肽合成必须解决下面四个问题 1.氨基保护 2. 羧基保护 3. 侧链保护 4. 接肽方法
保护基必须具备的条件 (1)易在预定的部位引入 (2)在某特定的条件下,保护基很易除去
(3)引入和除去保护基时,分子中的其它部位 不会受到影响,特别是已接好的肽键。
RCHO + HCN +NH3
-
H3+O
RCHCOO
NH3 _+
+
RCHCN
NH2 _+
改进方法: 用NH4CN or NH4Cl+KCN代替HCN+NH3 应 用: 合成比原料醛多一个碳的氨基酸
此时您正浏览在第13页,共36页。
二 赫尔--乌尔哈--泽林斯基α-溴化法
RCH2COOH
Br2
P
三 盖布瑞尔法
2 H3NCH2COO
O
NH HN
2分子甘氨酸
O 2,5-二嗪哌酮
O
HOOCCH2CH2CHCOO-
- H2O
N+H3
+
NH2
COO-
谷氨酸
焦谷氨酸
此时您正浏览在第7页,共36页。
氨基酸的特殊性质
一 等电点
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氨基酸、多肽、 氨基酸、多肽、蛋白质和 酶类药品检验
氨基酸类药物含量测定常用的方法 1.酸碱滴定法 酸碱滴定法
示例1: 示例 :谷氨酸的 含量测定 示例2: 示例 :赖氨酸片 中赖氨酸的测定
2.非水溶液滴定法 非水溶液滴定法
示例: 示例:酪氨酸的 含量测定
3.定氮法 定氮法
示例: 示例:天门酰氨 片的含量测定
HPLC(高效液相色谱)
柱的类型: 柱的类型: 固定相: 固定相:
检测器类型: 检测器类型: 流动相: 流动相:
氨基酸自动分析仪
一种专门用来分析氨基酸的自 动化的液相色谱仪。 动化的液相色谱仪。
原理: 原理:蛋白质经盐酸水解 成为游离氨基酸, 成为游离氨基酸,经氨基 酸分析仪的离子交换柱分 离,与茚三酮溶液产生颜 色反应, 色反应,再通过分光光度 计比色测定氨基酸含量。 计比色测定氨基酸含量。 一份水解液可同时测定天 精氨酸等16 冬,苏,丝,精氨酸等 种氨基酸。 种氨基酸。
多肽类药品检测
1.酸碱滴定法 酸碱滴定法 2.紫外分光光度法 紫外分光光度法 3.效价测定法(略) 效价测定法( 效价测定法 示例一: 示例一:抑肽酶效价的测定 示例二: 示例二:杆菌肽效价的测定
蛋白质类药品的检验 定氮法 电泳法(重点介绍) 电泳法(重点介绍) 生物检定法
电泳: 电泳:是指带电粒子在电场中向与其自身带相反电 荷的电极移动的现象。 荷的电极移动的现象。 醋酸纤维素薄膜电泳:以醋酸纤维薄膜为支持物。 醋酸纤维素薄膜电泳:以醋酸纤维薄膜为支持物。 它是纤维素的醋酸酯, 它是纤维素的醋酸酯,由纤维素的羟基经乙酰化而 制成。它溶于丙酮等有机溶液中, 制成。它溶于丙酮等有机溶液中,即可涂布成均一 细密的微孔薄膜,厚度以 为宜。 细密的微孔薄膜,厚度以0.1mm—0.15mm为宜。 为宜 特点:操作简单、灵敏度高,样品用量少。 特点:操作简单、灵敏度高,样品用量少。电泳时 间短,一般电泳 即可, 间短,一般电泳45—60min即可,加上染色,脱色, 即可 加上染色,脱色, 整个电泳完成仅需90min左右。 左右。 整个电泳完成仅需 左右
2.钡盐中钡的测定 钡盐中钡的测定 在 HAc-NaAc 缓 冲 溶 液 中 , CrO42— 能将Ba 沉淀为BaCrO4。沉淀经过滤、洗 沉淀经过滤、 能将 2+沉淀为 涤 后 , 用 稀 HCl 溶 解 , 加 入 过 量 KI , Cr2O72—将I—氧化为 2,析出的 2,以淀粉为 氧化为I 析出的I 指示剂用Na 标准溶液滴定。 指示剂用 2S2O3 标准溶液滴定 。 反应式 如下: 如下: Ba2++ CrO42—=BaCrO4 ↓(黄) 黄 2BaCrO4+4H+=2 Ba2++H2Cr2O7+H2O Cr2O72—+6I—+14H+=3I2+2Cr3++7H2O I2+2S2O32—=2I—+S4O62—
3.在间接碘量法中, 当析出碘的反应完成后 , 应 在间接碘量法中,当析出碘的反应完成后, 在间接碘量法中 立即用Na 进行滴定(避免 的挥发和I 避免I 立即用 2S2O3 进行滴定 避免 2 的挥发和 — 被空气氧 化)。 。 (二)应用实例 1.铜矿石中铜的测定 铜矿石中铜的测定 矿石经HCl、HNO3、溴水和尿素处理成溶液后、 溴水和尿素处理成溶液后、 矿石经 、 掩蔽试样中的Fe 使其形成稳定的FeF63用 NH4HF2掩蔽试样中的 3+, 使其形成稳定的 络合物, 并调节溶液的pH为 络合物 , 并调节溶液的 为 3.5—4.0, 加入 与 Cu2+ , 加入KI与 反应,析出的I 标准溶液滴定, 反应,析出的 2,用Na2S2O3标准溶液滴定,以淀粉为 指示剂,反应式如下: 指示剂,反应式如下: 2Cu2++4I—=2CuI↓+I2 I2十2S2O32—=2I—+S4O62— 本法可测定矿石中0.5%以上的铜。 以上的铜。 本法可测定矿石中 以上的铜
剩余碘量法
在供试品中先加入一定量、过量的碘滴定液, 在供试品中先加入一定量、过量的碘滴定液, 与测定组分反应完全后, 待I2与测定组分反应完全后,再用硫代硫酸 钠滴定液滴定剩余的碘, 钠滴定液滴定剩余的碘,根据与药物作用的 碘的量来计算药物含量的方法。 碘的量来计算药物含量的方法。
2、滴定碘法(间接碘量法 、滴定碘法 间接碘量法 间接碘量法) 电位比E 高的氧化性物质, 电位比 ӨI2/I—高的氧化性物质 , 可在一定的条件 下,用碘离子来还原,产生相当量的碘,然后用 标准溶液来滴定析出的I Na2S2O3 标准溶液来滴定析出的 2 , 这种方法叫做间 接碘量法或称为滴定碘法。 例如K 接碘量法或称为滴定碘法 。 例如 2Cr2O7 在酸性镕液 中与过量的KI作用 析出的I 作用, 中与过量的 作用 , 析出的 2 用 Na2S2O3 标准溶液滴 定。 Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O I2+2S2O32—=2I-+S4O62— 利用这一方法可以测定很多氧化性物质,如 利用这一方法可以测定很多氧化性物质 如 ClO3- 、 ClO- 、 CrO42- 、 IO3- 、 BrO3- 、 SbO43- 、 MnO4- 、 MnO2 、AsO43-、NO3-、NO2-、Cu2+、H2O2等等,以 等等, 及能与CrO42-生成沉淀的阳离子 , 如 Pb2+、 Ba2+等 , 生成沉淀的阳离子, 及能与 所以滴定碘法的应用范围相当广泛。 所以滴定碘法的应用范围相当广泛。
赖氨酸片中赖氨酸的测定中
1)为什么要用 为什么要用NaOH调节 为7.0? 调节pH为 ? 为什么要用 调节 2)加入甲醛溶液的作用? )加入甲醛溶液的作用? 3)是直接滴定还是其他的滴定方式? )是直接滴定还是其他的滴定方式?
非水溶液滴定法
非水溶液滴定法是在非水溶剂中进行滴定的方法。 非水溶液滴定法是在非水溶剂中进行滴定的方法。 主要用来测定有机碱及其氢卤酸盐、磷酸盐、 主要用来测定有机碱及其氢卤酸盐、磷酸盐、硫酸 盐或有机酸盐,以及有机酸碱金属盐类药物的含量。 盐或有机酸盐,以及有机酸碱金属盐类药物的含量。 也用于测定某些有机弱酸的含量。 也用于测定某些有机弱酸的含量。 非水溶剂的种类 (1) 酸性溶剂 有机弱碱在酸性溶剂中可显著地增强其相对碱 最常用的酸性溶剂为冰醋酸。 度,最常用的酸性溶剂为冰醋酸。 (2) 碱性溶剂 有机弱酸在碱性溶剂中可显著地增强其相对酸 最常用的碱性溶剂为二甲基甲酰胺。 度,最常用的碱性溶剂为二甲基甲酰胺。
碘量法的主要误差来源, 一是I 易挥发, 二是I 碘量法的主要误差来源 , 一是 2 易挥发 , 二是 易被空气中的氧所氧化。 易被空气中的氧所氧化。 为防止I 挥发,应采取以下措施: 为防止 2挥发,应采取以下措施: 1. 加入过量 ,KI与I2形成 3—,以增大 2的溶解 加入过量KI, 与 形成I 以增大I 降低I 的挥发性,提高淀粉指示剂的灵敏度。 度,降低 2的挥发性,提高淀粉指示剂的灵敏度。 此外, 加入过量的KI, 此外 , 加入过量的 KI , 可以加快反应的速度和 提高反应的完全程度。 提高反应的完全程度。 2.反应时溶液的温度不能高,一般在室温下进行。 反应时溶液的温度不能高, 反应时溶液的温度不能高 一般在室温下进行。 因升高温度增大I 的挥发性, 因升高温度增大 2的挥发性 , 降低淀粉指示剂的灵敏 保存Na 溶液时, 室温升高, 加速Na 度 。 保存 2S2O3 溶液时 , 室温升高 , 加速 2S2O3 的分解。 的分解。 3.析出碘的反应最好在带塞的碘量瓶中进行,滴 析出碘的反应最好在带塞的碘量瓶中进行, 析出碘的反应最好在带塞的碘量瓶中进行 定切勿剧烈摇动。 定切勿剧烈摇动。
为防止I 被空气中的氧所氧化, 应采取以下措施: 为防止 - 被空气中的氧所氧化 , 应采取以下措施 : 1.避光 光线能催化 —被空气氧化。 避光 光线能催化I 被空气氧化。 2.溶液 值的影响 S2O32—与I2之间的反应必须 溶液pH值的影响 溶液 在中性或弱酸性溶液中进行。 因为在碱性溶液中, 在中性或弱酸性溶液中进行 。 因为在碱性溶液中 , I2 将会发生下述副反应: 与S2O32—将会发生下述副反应: S2O32—+4I2+10 OH—=2SO42—+8I—十5H2O 而且, 在碱性溶液中还会发生歧化反应: 而且,I2在碱性溶液中还会发生歧化反应: 3 I2+6OH—=IO3—+5I—+3H2O 如果在强酸性溶液中, 溶液会发生分解: 如果在强酸性溶液中,Na2S2O3溶液会发生分解: S2O32—+2H+=SO2+S↓+ H2O 同时, 在酸性溶液中也容易被空气中的O 氧化: 同时,I—在酸性溶液中也容易被空气中的 2氧化: 4I—+4H++O2=2I2+2H2O
示例一: 示例一:三氨 示பைடு நூலகம்一: 示例一:盐酸 基酸注射液-341 基酸注射液 半胱氨酸水合物 示例二: 示例二:六氨 的测定 基酸注射液400 基酸注射液 示例一: 胱氨 示例一:L-胱氨 酸的测定 6.氨基酸自动分析 氨基酸自动分析
仪
碘量法
原理:半胱氨酸分子中含有- , 原理:半胱氨酸分子中含有-SH, 在酸性 条件下,与过量的碘作用, 条件下,与过量的碘作用,剩余的碘用硫代 硫酸钠溶液滴定。由硫代硫酸钠溶液所消耗 硫酸钠溶液滴定。 的量,间接求出硫化物的含量。 的量,间接求出硫化物的含量。 注意:滴定条件,指示剂,碘滴定液, 注意:滴定条件,指示剂,碘滴定液, Na2S2O3 标液配制
碘量法常用淀粉作指示剂 , 碘量法常用 淀粉作指示剂, 淀粉与碘作 淀粉作指示剂 用形成蓝色络合物,灵敏度很高,即使在 5×10—6 mol/L溶液中亦能看出。 溶液中亦能看出。 × 溶液中亦能看出 淀粉指示剂应在近终点时加入,因为当 淀粉指示剂应在近终点时加入, 溶液中有大量碘存在时, 溶液中有大量碘存在时 , 碘可被吸附在淀粉 表面,影响终点的正确判断。 表面,影响终点的正确判断。 碘滴定液(0.1mol/L) 碘滴定液 I2=253.81 12.69g→1000ml 配制】 取碘13.0g,加碘化钾 加碘化钾36g与水 与水50ml 【配制】 取碘 加碘化钾 与水 溶解后,加盐酸3滴与水适量使成 滴与水适量使成1000ml, 溶解后,加盐酸 滴与水适量使成 , 摇匀,用垂熔玻璃滤器滤过。 摇匀,用垂熔玻璃滤器滤过。
