1-3典型蛋白质结构分子的功能和代谢-血红蛋白
第2章 第3节蛋白质的三级结构和肌红蛋白

第一章蛋白质第三节蛋白质的三级结构与肌红蛋白生物大分子案例:人类自然憋气的极限时间2013年07月11日武汉东湖海洋世界水下芭蕾表演案例2:抹香鲸的1.5小时⏹抹香鲸对巨乌贼的嗜好产生了“龙涎香”李新梅湖南大学生物学院李新梅湖南大学生物学院⏹抹香鲸体内的肌红蛋白含有率是陆栖哺乳动物的8-9倍抹香鲸肉牛肉⏹案例:为什么从肉的颜色可以判断是否肉新鲜?新鲜的肌肉是氧合肌红蛋白的鲜红色李新梅湖南大学生物学院一、为什么肌红蛋白具有贮存氧的功能?1、肌红蛋白通过辅基血红素与氧结合⏹肌红蛋白由一条153个氨基酸的多肽链,含有血红素辅基李新梅湖南大学生物学院主要结合氧和贮存氧部分是血红素辅基的亚铁O 2与肌红蛋白血红素的亚铁结合,结合后亚铁价态不改变93位的组氨酸血红素的结构和位置⏹肌红蛋白多肽链折叠形成一种近似于球状(1)疏水裂隙保证血红素中的亚铁价态不变⏹由于疏水作用力驱动,多肽链折叠成球状构象,疏水性氨基酸通常位于球蛋白的内部李新梅湖南大学生物学院(水化层⏹主要因素3、肌红蛋白的球状构象是由八个a-螺旋组成的三级结构⏹8个a-螺旋分别称为A,B ,C,D ,E ,F ,G ,H –血红素位于E 和F 螺旋之间学习小结习题⏹二、蛋白质的三级结构⏹利用全世界的闲置计算资源来预测蛋白质的形状,尝试得到最低能量的状态李新梅湖南大学生物学院1、什么是蛋白质的三级结构?2、三级结构的特征αα 超二级结构⏹具有活性的球状蛋白质至少具备三级结构李新梅湖南大学生物学院3、三级结构的结构配件是什么?维持力是什么呢?丙糖磷酸异构酶(侧面观)丙糖磷酸异构酶(顶)丙酮酸激酶βαβ超二级结构构成的球状蛋白ββ超二级结构大豆胰蛋白酶抑制剂玉红氧还蛋白木瓜蛋白酶结构域2⏹β β β β形成的希腊钥匙3、维持三级结构的力有哪些?维持三级结构的力⏹⏹⏹(((学习小结李新梅湖南大学生物学院4⏹(5)案例分析:–新鲜肉类的颜色取决于名为“肌红蛋白”,可分为脱氧肌红蛋白、氧合肌红蛋白和高铁肌红蛋白三种形态–肉类加工行业有不法商贩通过使用二氧化硫使肉类保鲜,其机制是什么?李新梅湖南大学生物学院。
典型蛋白质结构分子的功能和代谢溶酶体

溶酶体
一.溶酶体的结构类型 二.溶酶体的功能 三.溶酶体的发生
一、
(一) 溶酶体膜的特征: 1.嵌有质子泵,形成和维持溶酶体中酸性的内环境; 2.具有多种载体蛋白用于水解的产物向外转运; 3.膜蛋白高度糖基化,可能有利于防止自身膜蛋白的降
解。 (二)溶酶体的标志酶: 酸性磷酸酶(acid phosphatase)
溶酶体通过自(体吞)噬泡分解其内容物来实现 对细胞内各组分的再利用,也通过胞吞作用实现对其 它物质的利用。
溶酶体降解蛋白质无选择性,其抑制剂对非正常 蛋白质或短寿命酶无快速降解的效应,这防止了饥饿 状态下蛋白质的加速度崩溃。
许多正常的和病理的活动经常随伴溶酶体活性的 升高。糖尿病会刺激溶酶体的蛋白质分解,产后子宫 的萎缩(9天内从2kg降到50 g)是溶酶体活性增高的结 果。很多慢性炎症,如类风湿性关节炎等,引起溶酶 体酶的细胞外释放,其酶会损坏周围的组织。
次级溶酶体 引自http://www.uni-mainz.de
3、残体
又称后溶酶体 (post-lysosome) 已失去酶活性,仅留 未消化的残渣故名, 残体可通过外排作用 排出细胞,也可能留 在细胞内逐年增多, 如肝细胞中的脂褐质。
肝细胞中的脂褐质 引自《细胞生物学超微结构图谱》1989
动物细胞溶酶体系统示意图
三、
(一)发生途径
(二) 分选途径多样化
(三)酶的加工方式多样化
糖侧链的部分水解、膜蛋白等
(一) 溶酶体的发生过程
(二)分选途径多样化
依赖于M6P的分选途径的效率不高,部分溶酶体酶通 过运输小泡直接分泌到细胞外 ; 在细胞质膜上也存在 依赖于钙离子的M6P受体,同样可与胞外的溶酶体酶结 合,通过受体介导的内吞作用,将酶送至前溶酶体中 ,M6P受体返回细胞质膜,反复使用。
血红蛋白的结构和功能介绍

血红蛋白氧合时和去氧时结构明显不同,特别是α 和β亚基的相互作用发生变化 按接触界面分2种 装配接触: α1β1和α2β2中α β的接触 BGH 滑动接触: α1β2和α2β1中α β的接触C G FG
二聚体半分子
• 当Hb因氧合作用而发生构象变化时,主要是 滑动接触发生改变。
• 血红蛋白可看成是两个相同的二聚体半分子 组成:α1β1-甲基对和α2β2-甲基对。
HisE7
•称为远端组氨 酸。
•它在血红素基 于氧结合的一侧, 不与Fe (II)成 键,但与O2分 子紧密接触,形 成一个空间位阻 区域。
这个位阻区域对降低血红素对CO的亲和力起重 要作用
血红蛋白
α-亚基(2) β-亚基(2)
α-珠蛋白 血红素 β-珠蛋白
血红蛋白是杂四聚体
• 血红蛋白分子由2个α亚基和和2个β亚基构成 • 血红蛋白的三维结构近似球形,4个亚基占据相当
鲍林是著名的量子化学家,他在化学的多 个领域都有过重大贡献。曾两次荣获诺贝 尔奖(1954年化学奖, 1962年和平奖)
Kendrew J.C.(1917) 英国生物物理和分子生 物学家,在1957年和 1960年用X衍射分析了 肌红蛋白的三维结构。
英国剑桥医学研究院Max Perutz 通过分析血红蛋白 晶体的X射线衍射结果,确 定了人类血红蛋白的三维结 构。
主要类型:
(1)镰状细胞病 (2)不稳定血红蛋白病 (3)血红蛋白M病 (4)氧亲和力改变的血红蛋白病
异常血红蛋白病的分子基础 ——珠蛋白基因突变
主要类型: (1)单个碱基置换 (2)移码突变 (3)密码子的缺失和插入 (4)融合基因
地中海贫血
——珠蛋白链合成数量不平衡
最初发现在地中海地区居住的人群发病率特别 高而得名,实际上世界各地都有发生,非洲和东 南亚也比较常见。
.蛋白质的结构与功能

三、蛋白质的三级结构(tertiary structure)
(二)氨基酸的分类
1.按R基的化学结构分为脂肪族、芳香族、杂环、杂环亚氨基酸四类 。
2.按R基的极性和在中性溶液的解离状态分为非极性氨基酸、极性不 带电荷、极性带负电荷或带正电荷的四类。 带有非极性R(烃基、甲硫基、吲哚环等,共9种):甘(Gly)、丙 (Ala)、缬(Val)、亮(Leu)、异亮(Ile)、苯丙(Phe)、甲硫 (Met)、脯(Pro)、色(Trp) 带有不可解离的极性R(羟基、巯基、酰胺基等,共6种):丝(Ser) 、苏(Thr)、天胺(Asn)、谷胺(Gln)、酪(Tyr)、半(Cys) 带有可解离的极性R基(共5种):天(Asp)、谷(Glu)、赖(Lys )、精(Arg)、组(His),前两个为酸性氨基酸,后三个是碱性氨 基酸。
(一)氨基酸的结构通式
组成蛋白质的20种氨基酸有共同的结构特点 :
1.氨基连接在α- C上,属于α-氨基酸(脯氨 酸为α-亚氨基酸)。
2.R是側链,除甘氨酸外都含手性C,有D型和L-型两种立体异构体。天然蛋白质中的 氨基酸都是L-型。
注意:构型是指分子中各原子的特定空间排布,其变化要 求共价键的断裂和重新形成。旋光性是异构体的光学活性 ,是使偏振光平面向左或向右旋转的性质,(-)表示左 旋,(+)表示右旋。构型与旋光性没有直接对应关系。
20世纪30年代末,L.Panling 和R.B.Corey应用X射线衍射分 析测定了一些氨基酸和寡肽的晶体结构,获得了一组标准 键长和键角,提出了肽单元(peptide unit)的概念, 还提出 了两种主链原子的局部空间排列的分子模型(α-螺旋)和 (β-折叠)。
蛋白质的结构和功能的关系

蛋白质结构与功能的关系摘要:蛋白质特定的功能都是由其特定的构象所决定的,各种蛋白质特定的构象又与其一级结构密切相关。
天然蛋白质的构象一旦发生变化,必然会影响到它的生物活性。
由于蛋白质的构象的变化引起蛋白质功能变化,可能导致蛋白质构象紊乱症,当然也能引起生物体对环境的适应性增强!现而今关于蛋白质功能研究还有待发展,一门新兴学科正在发展,血清蛋白组学,生物信息学等!本文仅就蛋白质结构与其功能关系进行粗略阐述。
关键词:蛋白质分子一级结构、空间结构、折叠/功能关系、蛋白质构象紊乱症;分子伴侣正文:1、蛋白质分子一级结构和功能的关系蛋白质分子中关键活性部位氨基酸残基的改变,会影响其生理功能,甚至造成分子病(molecular disease)。
例如镰状细胞贫血,就是由于血红蛋白分子中两个β亚基第6位正常的谷氨酸变异成了缬氨酸,从酸性氨基酸换成了中性支链氨基酸,降低了血红蛋白在红细胞中的溶解度,使它在红细胞中随血流至氧分压低的外周毛细血管时,容易凝聚并沉淀析出,从而造成红细胞破裂溶血和运氧功能的低下。
另一方面,在蛋白质结构和功能关系中,一些非关键部位氨基酸残基的改变或缺失,则不会影响蛋白质的生物活性。
例如人、猪、牛、羊等哺乳动物胰岛素分子A链中8、9、10位和B链30位的氨基酸残基各不相同,有种族差异,但这并不影响它们都具有降低生物体血糖浓度的共同生理功能。
蛋白质一级结构与功能间的关系十分复杂。
不同生物中具有相似生理功能的蛋白质或同一种生物体内具有相似功能的蛋白质,其一级结构往往相似,但也有时可相差很大。
如催化DNA复制的DNA聚合酶,细菌的和小鼠的就相差很大,具有明显的种族差异,可见生命现象十分复杂多样。
2、蛋白质分子空间结构和功能的关系蛋白质分子空间结构和其性质及生理功能的关系也十分密切。
不同的蛋白质,正因为具有不同的空间结构,因此具有不同的理化性质和生理功能。
如指甲和毛发中的角蛋白,分子中含有大量的α-螺旋二级结构,因此性质稳定坚韧又富有弹性,这是和角蛋白的保护功能分不开的;而胶原蛋白的三股π螺旋平行再几股拧成缆绳样胶原微纤维结构,使其性质稳定而具有强大的抗张力作用又如细胞质膜上一些蛋白质是离子通道,就是因为在其多肽链中的一些α-螺旋或β-折叠二级结构中,一侧多由亲水性氨基酸组成,而另一侧却多由疏水性氨基酸组成,因此是具有“两亲性”(amphipathic)的特点,几段α-螺旋或β-折叠的亲水侧之间就构成了离子通道,而其疏水侧,即通过疏水键将离子通道蛋白质固定在细胞质膜上。
蛋白质的结构和功能

蛋白质的结构和功能蛋白质是生命体中最重要的类别之一,也是细胞的基本组成部分之一。
蛋白质的结构与功能密切相关,对于理解蛋白质的重要性以及其功能的多样性具有重要意义。
本文将就蛋白质的结构与功能进行详细阐述。
一、蛋白质的结构蛋白质是由氨基酸的多肽链组成的,而氨基酸是蛋白质的构成单元。
不同的氨基酸组合形成了不同的氨基酸序列,从而赋予了蛋白质不同的结构和功能。
蛋白质的结构包括了四个层次,分别是:一级结构、二级结构、三级结构和四级结构。
1. 一级结构:一级结构是指氨基酸的线性排列方式。
氨基酸通过肽键连接在一起,形成多肽链。
每个氨基酸都与相邻的两个氨基酸通过肽键相连,形成一个多肽链。
2. 二级结构:二级结构是指多肽链的局部折叠方式。
常见的二级结构有α-螺旋和β-折叠。
α-螺旋是一种螺旋状的结构,其中氨基酸通过氢键相互连接。
β-折叠是一种折叠的结构,其中多肽链在平面上折叠成β片。
3. 三级结构:三级结构是指蛋白质整个空间结构的折叠方式。
蛋白质的三级结构是由一段多肽链的不同区域折叠而成。
三级结构的形成通常受到氢键、离子键、范德华力等相互作用的影响。
4. 四级结构:四级结构是指两个或多个多肽链之间的空间排列方式。
多肽链之间通过非共价键相互连接,形成一个完整的蛋白质分子。
多肽链之间的相互作用包括氢键、离子键、范德华力等。
二、蛋白质的功能蛋白质具有多种不同的功能,这取决于其结构和氨基酸序列的不同。
1. 结构功能:蛋白质作为细胞的基本组成部分,可以提供细胞的结构支持。
例如,肌肉组织中的肌动蛋白负责肌肉的收缩,细胞膜上的蛋白质起到维持细胞形态和细胞信号传递的作用。
2. 酶功能:蛋白质中的酶可以催化化学反应。
酶可以加速化学反应的速率,使得细胞内的代谢过程能够正常进行。
例如,消化系统中的酶可以加速食物的消化过程。
3. 运输功能:蛋白质可以通过细胞膜或血液循环,将物质从一个地方运输到另一个地方。
例如,血液中的血红蛋白可以运输氧气到身体各个器官。
血红蛋白的结构和功能

血红蛋白的结构和功能血红蛋白是人体中非常重要的一种蛋白质,它存在于红细胞中,起到了携带和运输氧气的关键作用。
本文将重点介绍血红蛋白的结构和功能,揭示其在氧气运输中的重要作用。
一、血红蛋白的结构血红蛋白是由四个亚基组成的复合蛋白,每个亚基都含有一个非常重要的组分——血红蛋白色素,也就是我们通常所说的“血红素”。
每个血红蛋白分子中包含一个血红蛋白色素和四个蛋白质亚基,其中两个亚基称为α亚基,另外两个亚基称为β亚基。
血红素是一种由铁离子与含有铁的环结构组成的物质,它使得血红蛋白呈现出红色。
当氧气结合到血红蛋白上时,血红素的结构会发生变化,形成氧合血红蛋白(oxyhemoglobin),这时血红蛋白呈现出鲜红色。
而在氧气释放出来后,血红蛋白则变成脱氧血红蛋白(deoxyhemoglobin)。
二、血红蛋白的功能血红蛋白的主要功能是携带和输送氧气。
当我们呼吸时,肺部会吸入氧气,这些氧气分子会通过血液运输到全身各个组织和器官。
血红蛋白中的血红素会与氧气结合,形成氧合血红蛋白,从而将氧气从肺部输送到各个细胞,满足细胞呼吸的需求。
除了输送氧气外,血红蛋白还能够携带二氧化碳。
当细胞进行代谢作用时,会产生大量的二氧化碳,这些二氧化碳需要被清除掉,否则会对身体产生危害。
血红蛋白可以与二氧化碳结合,形成碳酸血红蛋白(carbaminohemoglobin),将二氧化碳从细胞带到肺部,最终通过呼吸排出体外。
除了携氧和携带二氧化碳外,血红蛋白还具有一定的酸碱平衡作用。
当体内酸碱度不平衡时,血红蛋白可以接受或释放氢离子,以维持血液的酸碱平衡。
三、血红蛋白的变异和相关疾病血红蛋白在不同个体中可能存在着一定的变异,这些变异可导致一些与血红蛋白相关的疾病。
例如,镰状细胞性贫血是由于血红蛋白分子中的突变导致红细胞形状异常,从而影响其正常功能。
这种疾病会导致红细胞出现变形,降低氧气的运输能力,引发贫血等症状。
此外,血红蛋白变异还可能导致其他类型的贫血,包括地中海贫血等。
蛋白质的结构 和 功能

蛋白质的结构和功能蛋白质是生物体内一类重要的生物大分子,它在细胞的结构和功能中发挥着重要的作用。
蛋白质的结构和功能紧密联系,其结构决定了其功能。
本文将从蛋白质的结构和功能两个方面进行探讨。
一、蛋白质的结构蛋白质的结构是由氨基酸残基通过肽键连接而成的多肽链。
氨基酸是蛋白质的基本组成单元,它由一种氨基基团、一种羧基和一个侧链组成。
蛋白质的结构可以分为四个层次:一级结构、二级结构、三级结构和四级结构。
1. 一级结构:一级结构是指蛋白质的氨基酸序列。
氨基酸的不同顺序决定了蛋白质的种类和特性。
例如,胰岛素由51个氨基酸组成,胰岛素的一级结构决定了它具有调节血糖的功能。
2. 二级结构:二级结构是指蛋白质中氨基酸残基的局部空间排列方式。
常见的二级结构有α螺旋和β折叠。
α螺旋是由氨基酸的肽键形成的螺旋结构,形状类似于螺旋状的弹簧。
β折叠是由氨基酸的肽键形成的折叠结构,形状类似于折叠的纸扇。
二级结构的形成对于蛋白质的稳定性和功能至关重要。
3. 三级结构:三级结构是指蛋白质整个分子的空间排列方式。
蛋白质的三级结构由多个二级结构单元相互作用而形成。
这些相互作用包括氢键、离子键、范德华力以及疏水效应等。
三级结构的稳定性和形状决定了蛋白质的功能。
4. 四级结构:四级结构是指由多个蛋白质分子通过非共价键结合而形成的复合物。
多个蛋白质分子通过相互作用形成稳定的功能单位。
例如,血红蛋白由四个亚基组成,每个亚基都与其他亚基相互作用,形成一个稳定的四聚体。
二、蛋白质的功能蛋白质作为生物体内的重要分子,在细胞的结构和功能中发挥着多种作用。
1. 结构功能:许多蛋白质在细胞中起到构建细胞结构的作用。
例如,胶原蛋白是皮肤、骨骼和血管等结缔组织的重要组成部分,维持了细胞的结构稳定性。
肌动蛋白和微丝蛋白是细胞骨架的主要成分,参与了细胞的形态维持和运动。
2. 酶功能:许多蛋白质具有酶活性,可以催化生物体内的化学反应。
酶是生物体内调控代谢的关键分子。
第六章蛋白质结构与功能的关系

与氧结合时血红蛋白的变构过程
1.血红素中铁原子的变化
高自旋状态
低自旋
(非氧合,原子半径较大) (氧合,原子半径较小)
2.血红素铁的微小移动导致血红 蛋白构象的转换
3.氧合血红蛋白和去氧血红蛋白 代表不同的构象态
• (1)T态(紧张态) 和氧的亲和力高,是氧 合血红蛋白的形式。
• (2)R态(松弛态)和氧的亲和力底,是去氧 血红蛋白的形式。
(1)亲缘关系越近,AA顺序的同源性(相似性)越大。
不同生物与人的细胞色素C相比较AA差异数目
黑猩猩 0
鸡、火鸡 13
牛猪羊 10
海龟 15
狗驴 11
小麦 35
粗糙链孢霉43
酵母菌 44
(2)尽管不同不同生物间亲缘关系差别很大,但与细胞色素C 功能密切相关的AA顺序却有共同之处,即保守顺序不变。
c
换 ◇ 3.氧合血红蛋白和去氧血红蛋白代表不同的构
象态
1.氧合血红蛋白显著改变Hb的四 级结构
• 图6-10
装配接触 α1β1和相同的α2β2接触。 涉及螺旋B、G、H和非螺旋段GH拐弯的 30多个残基,接触面大,对亚基的装 配很重要。当血红蛋白从去氧变为氧 合形式时它们不变。
滑动接触 α1β2和相同的α2β1接触。 涉及螺旋C、G、H和非螺旋段FG拐弯的 19个残基,当血红蛋白因氧合作用而 发生构象变化时,这些接触也发生改 变。
• 微环境的作用:固定血红素基;保护血红素铁免遭氧化; 为O2提供一个合适的结合部位.
(四) 02的结合改变肌红蛋白的构象
• 去氧血红蛋白中的Fe(Ⅱ)只有 5个配体,并位于卟啉环上方 0.055nm。当氧结合时, Fe(Ⅱ)被拉回到卟啉环平面, 离卟啉环平面仅为0.026 nm。 这种结构的改变对肌红蛋白意 义不大,但显著的改变了血红 蛋白的性质,改变了四聚体的 亚基间的作用,是之具有别构 作用。
血红蛋白的分子结构

血红蛋白的分子结构血红蛋白是一种存在于人体红细胞中的重要蛋白质,它不仅能够携带氧气,还能够赋予血液鲜红的颜色。
血红蛋白分子结构的独特之处在于它的四个亚单位,每个亚单位都含有一个铁原子,这种结构使得血红蛋白能够与氧气结合并运输到全身各个组织和器官。
血红蛋白分子由四个相似的亚单位组成,每个亚单位都由几百个氨基酸残基构成。
这些亚单位之间通过非共价键相互连接,形成一个稳定的蛋白质结构。
每个亚单位内部的氨基酸序列是高度保守的,这意味着它们的排列顺序在不同物种中基本相同。
血红蛋白分子结构的关键在于其含有的铁原子。
每个亚单位中的铁原子能够与一个氧气分子发生强烈的相互作用,形成氧合血红蛋白。
当氧气与血红蛋白结合时,血红蛋白的结构会发生变化,使其更容易与其他氧气分子结合,从而增加了氧气在血液中的运输能力。
血红蛋白分子结构的独特性还体现在其对其他气体的亲和力上。
除了氧气,血红蛋白还能够与二氧化碳和一氧化碳等气体结合。
当血红蛋白与二氧化碳结合时,它会帮助将二氧化碳从组织和器官中带回到肺部,进而被排出体外。
而血红蛋白与一氧化碳的结合则是有害的,因为一氧化碳会与血红蛋白结合形成一种稳定的化合物,从而影响氧气的输送和供应。
血红蛋白分子结构的研究对于了解氧气的运输和供应机制至关重要。
科学家们通过对血红蛋白结构的深入研究,不仅揭示了血红蛋白如何与氧气结合和释放,还发现了一些与血红蛋白相关的疾病,如贫血和血红蛋白病。
血红蛋白的分子结构是一种复杂而精巧的蛋白质结构,它不仅能够携带氧气,还能够与其他气体发生相互作用。
通过对血红蛋白分子结构的研究,我们能够更好地理解氧气在人体中的运输和供应过程,并为相关疾病的治疗提供新的思路和方法。
蛋白质结构与功能的关系

这种由蛋白质分子发生变异所导致的 疾病,称为“分子病”。
四、蛋白质的空间结构
蛋白质分子的多肽链并非呈线形伸展,而是折叠、盘曲 构成特有的比较稳定的空间结构。 蛋白质的生物学活性和理化性质主要决定于完整的空间 结构,因此仅仅测定蛋白质分子的一级结构并不能完全 了解蛋白质分子的生物活性和理化性质。例如球状蛋白 质( 如血浆中的白蛋白、球蛋白和酶等 )和纤维状蛋白质 (角蛋白、胶原蛋白和纤维蛋白等 ),前者溶于水,后者 不溶于水,显而易见,此种性质不能仅用蛋白质的一级 结构的氨基酸排列顺序来解释。 蛋白质的空间结构是指蛋白质的二级、三级和四级结构。
定的二级结构,若干二级结构再组合成完整的三
级结构,成为蛋白质的一个分子。三级结构已经
是蛋白质的独立单位,可以具有其生物活性;但 有些蛋白质分子,可以再次聚合若干其它的单元 分子成为聚合体,进而形成四级结构,有更复杂
的调节功能。
蛋白质的分子结构
一级结构:是指氨基酸在肽键中的排列顺序和二硫
键的位置,肽链中氨基酸间以肽键为连接键。
五、蛋白质空间结构与功能的关系 (一)肌红蛋白与血红蛋白的结构
(二)血红蛋白的构象变化与结合氧
Hb 与 Mb 一样能可 逆地与 O 2 结合, Hb 与 O2结合后称为氧合Hb。 氧合 Hb 占总 Hb 的百分 数(称百分饱和度)随 O2浓度变化而改变。
肌红蛋白(Mb)和血红蛋白(Hb)的氧解离曲线
你了解什 么是蛋白质吗?
一、蛋白质的功能
1.贮存:生物体内的离子、小分子、代谢物可与蛋白质结合贮存于体内,如血红蛋白通 过血红素携带氧分子、肝脏中的铁蛋白贮存铁质。 2.生物反应的催化作用:这种蛋白质称为酶,几乎所有的生物体中的化学反应都是由酶 催化。 3. 运输:运输小至电子,大至巨型分子等各种物质到体内各处,例如运铁蛋白运送铁质; 血红蛋白运送氧气;有些蛋白质在细胞膜上形成气孔或通道让离子通过细胞膜;而蛋白 质本身要穿过细胞膜时,也需要其它蛋白质的帮助。 4. 传递信息:在神经细胞的接合处,蛋白质担任某些传递神经信号所需的小分子的接受 器;另外,一些生物反应的进行必须由组织、器官之间的信号来控制,携带这些信号的 分子称为激素,大部分的激素是蛋白质,如胰岛素;也有一些蛋白质担任激素的接受器。 5. 抗体:免疫系统的产物,可以用来与外部入侵的细菌或是病毒结合。
蛋白质的结构与功能的关系

蛋白质的结构与功能的关系蛋白质是生物体中最为重要的大分子有机化合物,担负着各种重要功能。
它们在生体内参与调节代谢、传递信息、结构支持、运输物质等多种生物学过程。
蛋白质的具体功能与其结构密切相关,而蛋白质的结构可以分为四个层次:初级结构、二级结构、三级结构和四级结构。
本文将从这四个层次出发,探讨蛋白质结构与功能之间的关系。
初级结构初级结构是指蛋白质中的氨基酸序列,是蛋白质最基本的结构。
蛋白质的功能很大程度上取决于其氨基酸序列。
氨基酸的种类和排列方式决定了蛋白质的化学性质和功能。
例如,氨基酸中的亲水性残基可以使蛋白质具有溶解性,从而在水相中发挥作用。
此外,氨基酸序列还决定蛋白质的电荷分布,从而影响其与其他分子之间的相互作用。
二级结构二级结构是指蛋白质链中多肽链的局部区域的空间形态。
常见的二级结构有α-螺旋和β-折叠。
二级结构通过氢键等非共价作用力将多肽链上的氨基酸残基连接在一起,形成特定的结构。
这些结构对蛋白质的稳定性和功能起着至关重要的作用。
例如,α-螺旋结构能够增加蛋白质的稳定性,在蛋白质的结构支持和受体配体结合中起到关键作用。
三级结构三级结构是指蛋白质的整体立体结构。
它由氨基酸链的二级结构之间的相互作用所决定。
三级结构的形成几乎由所有非共价作用力共同作用所致,例如氢键、离子键、范德华力和疏水相互作用等。
蛋白质的功能和稳定性取决于其三级结构的正确折叠。
任何对蛋白质结构的破坏可能导致蛋白质失去原有的功能。
四级结构四级结构是指两个或多个亚基(多肽链或聚合物链)在空间上的组织方式。
它表示了蛋白质分子中不同亚基之间的关系。
多肽链的组装形成蛋白质的四级结构,进一步决定了蛋白质的功能。
例如,酶的四级结构决定了其底物与催化活性位点的特异性结合。
综上所述,蛋白质的结构与功能之间密不可分。
蛋白质的功能依赖于其特定的结构,而蛋白质的特定结构是由其氨基酸序列决定的。
初级结构决定了氨基酸的种类和排列方式,二级结构形成了局部的空间结构,三级结构决定了整体立体结构,而四级结构则表示了不同亚基之间的组织方式。
第4章蛋白质结构与功能的关系

抗原
某些低分子量的物质可以与抗体结合, 但它们本身不能刺激抗体的产生。如果 它们与大分子紧密结合,则能刺激抗体 的产生。这些小分子物质称为半抗原 (hapten)。
几乎所有外来的蛋白质都是抗原,并且 每种蛋白质都能诱导特异抗体的产生。 一个人得体内在任一个给定时刻大约有 10000种抗体存在。
四、免疫球蛋白
免疫球蛋白的结构 免疫球蛋白G 立体结构模型 抗体的特点 抗原 抗原抗体的作用
免疫球蛋白的结构
免疫球蛋白G
人的免疫球蛋白可分为五大类,其分子量范围 从150000到950000道尔顿。免疫球蛋白 M(IgM)是对一个抗原作出反应时产生的第一 个抗体。
免疫球蛋白G(IgG)是一类最简单的免疫球蛋白。 IgG含有两条相同的高分子量的重链(heavy chain)和两条相同的低分子量的轻链(light chain)。
血红素
3.氧气与肌红蛋白的结合
肌红蛋白中血红素铁在第5配位与珠蛋白 F8位His(称近侧His)的咪唑N结合, 当肌红蛋白结合氧变成氧合肌红蛋白时, 第6配位被O2分子占据。在血红素氧结 合部位一侧还有E7位His(称远侧His), 与O2分子能紧密接触,被结合的O2夹在 E7位His和亚铁原子之间。
1.血红蛋白的结构
脊椎动物的血红蛋白由四个多肽亚基组 成,两个是一种亚基 ,两个是另一种 亚基β 。每个亚基都有一个血红素基和 一个氧结合部位。血红素同肽链的连接 是血红素的Fe原子以配位键与肽链分子 中的组氨酸咪唑基的氮原子相连。
血红蛋白
2.氧结合引起血红蛋白构象变化
氧结合对亚基构象的影响与肌红蛋白类似。 当Fe原子移动时,拖动近侧His(F8)并 进而引起相应螺旋和拐弯的位移。 这些移动传递到亚基界面,引发构象重调, 导致维系去氧血红蛋白四级结构的链间盐 桥断裂、亚基间空隙变窄并挤出BPG分子 等变化。
蛋白质的一级结构与功能的关系

❖ Gly、Pro、Asp、Ser是β转角最强生成者,
❖
Ile、Val、Leu是β转角最强破坏者。
❖ 一级结构决定了三级结构:
❖
如牛胰核糖核酸酶
❖ 一级结构决定了四级结构:
❖
如血红蛋白的四级结构,见球状蛋白质。
.蛋白质的一级结构与其构象及功能的关系
❖ 蛋白质一级结构是空间结构的基础, 特定的空间构象主要是由蛋白质分子 中肽链和侧链R基团形成的次级键来 维持,可根据一级结构的特点自然折
❖ 些次级键对于维系Hb分子空间构象 有重要作用,例如在四亚基间的8对 盐键(见前图—血红蛋白结构与亚基 间连接示意),它们的形成和断裂将 使整个分子的空间构象发生变化。
蛋白质的空间结构与功能的关系
❖ 血红蛋白(Hb)为例加以说明(Hb的结构如图所示)
❖
Hb由4条肽链组成:2α、2β,功能是运载O2;在去氧
系组合时,就可形成多种多样的空间结构和不同生物学活性的蛋白质分子。
二、蛋白质的空间结构
❖ 蛋白质分子的多肽链并非呈线形伸展,而是折叠和盘曲构成特有的比较稳定的空 间结构。蛋白质的生物学活性和理化性质主要决定于空间结构的完整,因此仅仅 测定蛋白质分子的氨基酸组成和它们的排列顺序并不能完全了解蛋白质分子的生 物学活性和理化性质。例如球状蛋白质(多见于血浆中的白蛋白、球蛋白、血红 蛋白和酶等)和纤维状蛋白质(角蛋白、胶原蛋白、肌凝蛋白、纤维蛋白等), 前者溶于水,后者不溶于水,显而易见,此种性质不能仅用蛋白质的一级结构的 氨基酸排列顺序来解释。
❖
迄今已有约一千种左右蛋白质的一级结构被研究确定,如胰岛素,胰核糖核酸酶、胰蛋白酶等。
❖
蛋白质的一级结构决定了蛋白质的二级、三级等高级结构,成百亿的天然蛋白质各有其特殊的生物
蛋白质家族了解蛋白质的分类和家族

蛋白质家族了解蛋白质的分类和家族蛋白质家族:了解蛋白质的分类和家族蛋白质是生命体内非常重要的基础性分子,它们在细胞内发挥着各种各样的功能。
为了更好地理解蛋白质,人们将其按照结构和功能的不同特点进行分类,并将相似结构和功能的蛋白质归为同一个家族。
本文将介绍蛋白质的分类和家族,并带领读者深入了解这些动人的分子世界。
一、蛋白质的分类蛋白质根据其结构和功能的不同特点,可以被分为以下几类。
1. 结构蛋白质(Structural proteins):结构蛋白质是组成细胞和组织结构的重要成分,它们帮助构建细胞骨架和维持细胞的形状稳定。
典型的结构蛋白质包括胶原蛋白、肌动蛋白等。
2. 酶(Enzymes):酶是一类能够加速生化反应速率的蛋白质分子,是生物体内各种代谢和生物合成过程中不可或缺的催化剂。
例如,葡萄糖酶能够催化葡萄糖分子的降解。
3. 抗体(Antibodies):抗体是免疫系统中起主要作用的蛋白质,它们能够识别并结合到入侵生物体的病原体,起到防御和清除病原体的作用。
4. 运输蛋白(Transport proteins):运输蛋白负责细胞膜的物质转运工作,它们将各种需求物质,如氧气和营养物质,通过细胞膜传递到细胞内。
血红蛋白就是一种重要的运输蛋白。
5. 激素(Hormones):激素是一类在生物体内起到调节和控制生理功能的蛋白质。
例如,胰岛素是一种调节血糖水平的激素。
二、蛋白质的家族蛋白质家族是指具有相似结构和功能的蛋白质的集合,归类于同一家族的蛋白质通常具有相似的序列、结构和功能特征。
1. 传递蛋白家族(Transporter Families):这个家族包括了调节物质在细胞膜上的传输的蛋白质,例如离子通道、载体蛋白等。
2. 酶家族(Enzyme Families):酶家族是指具有相似催化反应的关键位点和类似催化机制的蛋白质。
例如,激酶家族负责对细胞信号进行磷酸化修饰。
3. 膜蛋白家族(Membrane Protein Families):这个家族包括那些富含膜区域的蛋白质,它们在细胞膜上起到传递信号、离子转运等功能。
蛋白质结构与功能解析

蛋白质结构与功能解析蛋白质是生物体中最为重要的有机分子之一,它们在组织结构、物质转运、代谢调控等方面发挥着重要的作用。
蛋白质的功能与其结构密切相关,因此了解蛋白质的结构特点对于揭示其功能机制具有重要意义。
本文将对蛋白质的结构与功能展开解析。
一、蛋白质的结构层次蛋白质的结构层次分为四个层次:一级结构、二级结构、三级结构和四级结构。
1. 一级结构:一级结构指的是蛋白质由多个氨基酸残基的线性排列组成,通过肽键相连。
来自于胺基的N端和羧基的C端组成一条线性序列,这种线性序列决定了该蛋白质的氨基酸组成。
2. 二级结构:二级结构是指蛋白质中相邻氨基酸残基之间的非共价相互作用而形成的结构。
其中最为典型的二级结构是α-螺旋和β-折叠。
α-螺旋是由多个氢键构成的螺旋状结构,而β-折叠则是由平行或反平行的β链相互作用而形成的片状结构。
3. 三级结构:三级结构是指蛋白质链上存在的立体空间的整体折叠方式。
蛋白质中的氨基酸残基之间可以通过非共价的相互作用力,如疏水作用、静电相互作用、氢键等,相对稳定地形成具有特定空间的结构。
4. 四级结构:四级结构是指蛋白质通过多肽链的相互组装而形成的复杂结构。
多肽链可以通过非共价相互作用力以及其他辅助因素的参与,形成完整的功能性蛋白质。
二、蛋白质的功能蛋白质的功能多种多样,以下是几个常见的蛋白质功能类型。
1. 结构蛋白质:结构蛋白质主要参与细胞和组织的结构形成,提供细胞内外的支持和保护。
例如胶原蛋白是皮肤、骨骼和肌肉的重要结构组分,肌动蛋白则参与肌肉的收缩。
2. 酶蛋白质:酶蛋白质是调节各种化学反应的催化剂。
它们能够降低反应的能垒,加速生化反应的进行。
例如胰岛素是一种激素蛋白质,能够促进葡萄糖的转运和利用。
3. 抗体蛋白质:抗体蛋白质具有高度特异性,能够与病原体和其他入侵物质结合,触发免疫反应,保护机体免受疾病的侵害。
4. 运输蛋白质:运输蛋白质能够将物质从一个位置转运到另一个位置,例如血红蛋白能够将氧气运输到身体各个组织。
血红蛋白 结构功能

血红蛋白结构功能血红蛋白是一种重要的蛋白质,它在人体内起着关键的结构和功能作用。
本文将从血红蛋白的结构和功能两个方面进行阐述。
一、血红蛋白的结构血红蛋白是由四个亚基组成的大分子复合物,每个亚基中含有一个血红素分子。
血红蛋白的结构可以分为四级:一级结构是由氨基酸序列组成的多肽链;二级结构是通过氢键形成的α螺旋和β折叠;三级结构是亚基之间的空间排列关系;四级结构是四个亚基的组合形成的四聚体。
血红蛋白的亚基中有两种类型:α亚基和β亚基。
α亚基和β亚基分别含有一个血红素分子,血红素是一种由铁离子和呼吸色素组成的环状结构。
每个血红蛋白分子可以结合四个氧分子,因此血红蛋白在运输氧气方面具有重要作用。
二、血红蛋白的功能血红蛋白在人体内具有两个主要的功能:氧运输和二氧化碳运输。
1. 氧运输:血红蛋白通过与氧分子的结合来运输氧气。
当氧气从肺部到达血液中时,它会与血红蛋白中的铁离子结合,形成氧合血红蛋白。
氧合血红蛋白在动脉中运输氧气到身体各个组织和细胞,然后在组织和细胞中释放氧气。
这种氧的运输和释放过程是通过血红蛋白分子结构的变化来完成的。
2. 二氧化碳运输:血红蛋白还能运输二氧化碳。
当细胞代谢产生二氧化碳时,它会被血液中的水分转化为碳酸氢根离子。
这些离子会与血红蛋白中的部分氨基酸结合形成碳酸血红蛋白。
碳酸血红蛋白可以通过血液循环将二氧化碳带到肺部,然后从肺部呼出体外。
血红蛋白的氧亲和力是其功能的重要特性之一。
氧亲和力受多种因素影响,包括温度、pH值、二氧化碳浓度等。
当氧分子结合到血红蛋白上时,它会促使其他氧分子更容易结合,这被称为协同效应。
这种协同效应使得血红蛋白在肺部吸氧和组织释放氧方面更加高效。
总结起来,血红蛋白是一种具有重要结构和功能的蛋白质。
它通过运输氧气和二氧化碳来维持人体的正常代谢。
血红蛋白的结构决定了它的功能,而其功能的调节又与其结构密切相关。
对血红蛋白结构和功能的深入研究有助于理解氧气和二氧化碳的运输机制,对相关疾病的治疗和预防也具有重要意义。
蛋白质的分子结构与血红蛋白.
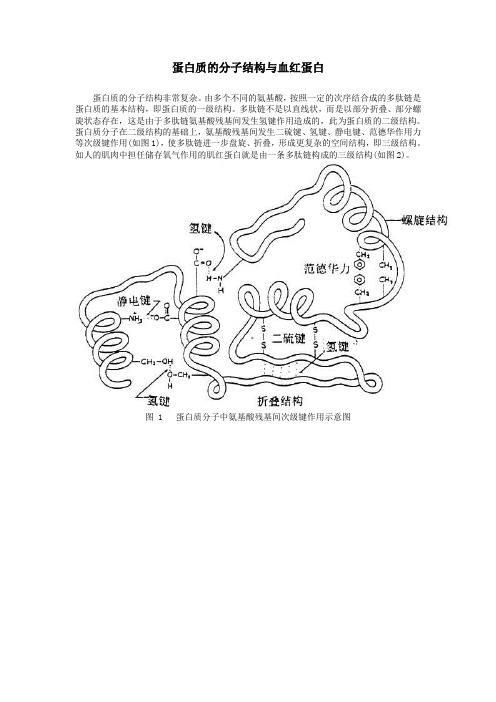
蛋白质的分子结构与血红蛋白蛋白质的分子结构非常复杂。
由多个不同的氨基酸,按照一定的次序结合成的多肽链是蛋白质的基本结构,即蛋白质的一级结构。
多肽链不是以直线状,而是以部分折叠、部分螺旋状态存在,这是由于多肽链氨基酸残基间发生氢键作用造成的,此为蛋白质的二级结构。
蛋白质分子在二级结构的基础上,氨基酸残基间发生二硫键、氢键、静电键、范德华作用力等次级键作用(如图1),使多肽链进一步盘旋、折叠,形成更复杂的空间结构,即三级结构。
如人的肌肉中担任储存氧气作用的肌红蛋白就是由一条多肽链构成的三级结构(如图2)。
图 1 蛋白质分子中氨基酸残基间次级键作用示意图图 2 肌红蛋白质三级结构示意图有些蛋白质是由二条或二条以上的多肽链组成的,即具有一、二、三级结构的多肽链,依靠次级键作用,相互缔合在一起,组成一个功能单位,这就是蛋白质的四级结构。
例如血红蛋白是由四条多肽链组成的──二条α链(每条α链含141个氨基酸残基)和二条β链(每条β链含146个氨基酸残基)。
每条多肽链的螺旋结构形成一个疏水性的空间,可保护血红素分子不与水接触,Fe2+不被氧化。
Fe2+位于血红素卟啉环的中央,与卟啉环的4个吡咯基、O2及多肽链上的组氨酸形成六配位体。
每个血红蛋白分子可逆结合4个氧分子,每克血红蛋白可结合1.34 mL氧气(如图3)。
图 3 血红蛋白结构示意图血红蛋白也能与一氧化碳结合,而且结合力较氧气大200倍,只要空气中一氧化碳含量达到千分之一左右,就可使血液中的血红蛋白有一半左右结合成一氧化碳合血红素,人便会因缺氧窒息而死亡。
在一些物理和化学因素如振荡、加热、射线辐照、化学试剂等的作用下,均可使蛋白质的结构遭到破坏,失去它的生理功能,这就是蛋白质的变性作用。
如甲醛水溶液(也称福尔马林)中的甲醛可与多肽链上的氨基发生作用,使蛋白质变性并凝固,再也不易腐烂变质,依此原理可以制作永久保存的动物标本。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
胆红素葡糖醛酸二酯 +
UDP
胆红素葡糖醛酸二酯的结构
H
H
H HHH
H
ON
N
N
H
N
O
CH2
CH2
CO
COOH
H H OH
OO H
OH
H
H HO
CH2 CH2 CO O
O H H HO
COOH H
H OH
OH H
*排泄
结合胆红素从肝细胞毛细胆管排泄 入胆汁中,再随胆汁排入肠道。
三、胆红素在肠道中的变化和胆色 素的肠肝循环
HO N
N
N
N
OH
成 反 应
d-尿胆素
H HHH
HO N
N
PP
中胆素原
+4H
HHHH HH
N
N
OH
2H
中胆素
H
H
PP
H
H 2H 粪胆素
粪胆素原
*胆素原的肠肝循环
肠道中有少量的胆素原可被肠粘膜细
胞重吸收,经门静脉入肝,其中大部分再
随胆汁排入肠道,形成胆素原的肠肝循环
(bilinogen
enterohepatic
circulation)。
胆红素的形成与胆素原的肠肝循环
单核-吞噬细胞
血液
胆红素
血红蛋白
珠蛋白 血红素
Y蛋白 胆红素-Y蛋白 Z蛋白 胆红素-Z蛋白
CO O2
胆红素-清蛋白
UDPGA 肝
Fe3+ NADPH
葡糖醛酸胆红素
胆绿素 NADPH
胆红素
胆素原
门静脉
胆素原的 肠肝循环
胆道
胆素原 O2 胆素 (尿)
➢ 血红蛋白是的二聚体,因为和相互作用比与,和 之间的相互作用强得多。
血红蛋白的功能
可与氧可逆结合; 血红素-血红素相互作用; 血红蛋白与H+、CO2. DPG相互作用。
胆色素代谢与黄疸
Metabolism of Bile Pigment and Jaundice
胆色素的概念
胆色素(bile pigment)是体内铁卟 啉化合物的主要分解代谢产物,包括胆 红素、胆绿素、胆素原和胆素等。
两种胆红素的区别
项目
别名
与葡萄糖醛酸结合 与重氮试剂反应 水中溶解度 经肾随尿排出 通透细胞膜对脑的 毒性作用
游离胆红素 间接胆红素 血胆红素
未结合 慢或间接反应
小 不能
大
结合胆红素 直接胆红素
肝胆红素 结合
迅速直接反应 大 能
无
黄疸(jaundice)
概念 高胆红素血症 黄疸 隐形黄疸
种类(按血清胆红素的来源) 溶血性黄疸 (hemolytic jaundice) 肝细胞性黄疸(hepatocellular jaundice) 阻塞性黄疸(obstructive jaundice)
• 意义 增加胆红素在血浆中的溶解度,限制
胆红素自由通过生物膜产生毒性作用。
• 竞争结合剂 如磺胺药,水杨酸等
二、胆红素在肝中的转变
*摄取 胆红素可以自由双向通透肝血窦肝细胞
膜表面进入肝细胞
*转运 在胞浆胆红素与配体蛋白结合
内质网
*转化
部位:滑面内网质 反应:结合反应(主要的结合物为UDP葡
一、胆红素的生成与转运
*胆红素(bilirubin)来源
体内的铁卟啉化合物——血红蛋白、肌 红蛋白、细胞色素、过氧化氢酶及过氧化物 酶。
※约80%来自衰老红细胞中血红蛋白的分解。
*胆红素生成过程
• 部位
肝、脾、骨髓单核-巨噬细胞系统细胞微 粒体与胞液中
• 过程 血红蛋白
血红素+珠蛋白
胆红素 氨基酸
• 胆红素的性质 亲脂疏水,对大脑具有毒性作用
CH=CH2 CH3
H3C
Ⅰ α Ⅱ CH=CH2
NN
Fe
血红素
胆 红
H3C
N Ⅳ
N Ⅲ CH3
素 的
CH2 CH2 COOH
CH2 CH2 COOH
生 成
CO Fe3+
O2 NADPH
+
血红素加氧酶系 H +程
HO
Ⅱ N
C H
肾
O2 粪胆素 (粪便)
肠道
胆素原
葡糖醛酸胆红素 胆红素
葡糖醛酸
四、血清胆红素与黄疸
*正常血清胆红素浓度 1~16mol/l (0.1 ~1mg/dl) 4/5为游离胆红素,其余为结合胆红素
*两种胆红素 结合胆红素:与葡萄糖醛酸结合的胆红素称为结 合胆红素,又称直接胆红素。
游离胆红素:未与葡萄糖醛酸结合的胆红素称为 游离胆红素,又称间接胆红素。
Ⅲ N H
C H
Ⅳ
N
C H
Ⅰ OH 胆绿素 N
胆绿素还原酶 (胞液)
NADPH + H +
MV
MP
PM
MV
HO N
C H
N H
C H2
N H
C H
OH 胆红素
N
(醇式)
O OH
98o
C O HN
HN
N H NH O O HO C
胆红素空间结构示意图
*胆红素的转运
• 运输形式 胆红素-清蛋白复合体
萄糖醛酸,UDPGA) 酶:UDP-葡萄糖醛酸基转移酶 产物:主要为双葡萄糖醛酸胆红素,另有
少量单葡萄糖醛酸胆红素、硫酸胆红素, 统称为结合胆红素
葡糖醛酸胆红素的生成
胆红素
+ UDP -葡糖醛酸
胆红素葡糖醛酸一酯
+ UDP -葡糖醛酸
UDP-葡糖醛 酸基转移酶
UDP-葡糖醛 酸基转移酶
胆红素葡糖醛酸一酯 +
*过程
肠菌
结合胆红
游离胆红素
素
葡萄糖醛酸
还
原
氧化
胆素
胆素原
﹡胆素原:中胆素原,粪胆素原,d -尿胆素原
﹡胆 素:i -尿胆素,粪胆素, d -尿胆素
H
H HHH
H
HO N
N
N
N OH
胆
素 原
PP
+8H
胆红素
与 HO
H HH
N
N
H H HH N
H N
OH
+8H
胆
H
H
素 的 生
PP
d-尿胆素原
2H
H HHH H H H H HH
各种黄疸时血、尿、粪中某些指标的改变
指标
正常
溶血性黄疸
血清胆红素 总量 结合胆红素 游离胆红素
尿三胆 尿胆红素 尿胆素原 尿胆素
粪便颜色
1mg/dl 00.8mg/dl 1mg/dl
(一)溶血性黄疸 (肝前性黄疸)
是由于红细胞在单核- 吞噬细胞系统破坏 过多,超过肝细胞的摄取转化和排泄能力,造 成血清游离胆红素浓度过高所致。
(二)肝细胞性黄疸(肝原性黄疸)
由于肝细胞破坏,其摄取转化和排泄胆红素 能力降低所致。
(三)阻塞性黄疸(肝后性黄疸)
各种原因引起的胆汁排泄通道受阻,使胆 小管和毛细血管内压力增大破裂,致使结合胆 红素逆流入血, 造成血清胆红素升高所致。
典型蛋白质结构分子的功能与 代谢
血红蛋白
血红蛋白是个四聚体蛋白
Max Perutz经过二十多年的努力通过X-射线晶体图确定了马 血红蛋白的结构。成年人的血红蛋白是一个由两个亚基和两个 亚基两种类型亚基组成的四聚体。和都很类似于肌红蛋白 ,只是肽链稍微短一点。和隔着一个空腔彼此相向。 ➢ 每个亚基是由141个氨基酸残基组成,而每个亚基有146个 氨基酸残基。无论是还是亚基,它们的三级结构几乎与肌红 蛋白相同。
