第十一章 元素化学
九年级化学第十一章第二节化学肥料

铵态氮肥的检验:
实验 取少量氮肥于试管 中,加入少量氢氧 化钠或氢氧化钙溶 液,微热. 把湿润的红色石蕊 试纸放在试管口 现象 结论
产生有刺激 说明该氮 性气味的能 肥是铵态 使湿润的红 氮肥 色石蕊试纸 变蓝色
施用铵态氮肥应注意:
不能跟熟石灰,草木灰等 碱性物质混合使用,否则会发 生反应放出氨气,降低肥效.
• 将氮气转化为氮的化合物的方法。 • 自然界中氮的固定: • 途径一:有根瘤菌的豆科植物
• 途径二:雷雨肥庄稼
N2+O2 2NO+O2
3NO2+H2O
放电
2NO 2NO2 2HNO3+NO
(二)磷肥
1、磷肥的作用:磷是植物体内核酸、蛋白质和酶等 多种重要化合物的组成元素。磷肥能促进作物根系发 达,增强抗寒抗旱能力,还能促进作物提早成熟,穗 粒增多,子粒饱满。 2、常用的磷肥:主要是磷酸盐,如磷矿粉 [Ca3(PO4)2]、 钙镁磷肥(主要成分磷酸钙和磷酸镁)、过磷酸钙[磷 酸二氢钙Ca(H2PO4)2和CaSO4的混合物]、重过磷酸钙 [Ca(H2PO4)2]等。
2、农作物生长需要氮,磷,钾等营养元素.下列化 肥中,属于复合肥料的是(A)
A、KNO3 C、Ca(H2PO4)2 B、CO(NH2)2 D、K2SO4
3、取下列化肥与熟石灰粉末混合,研磨后,能闻到 刺激性气味的是( C ) A、氯化钾;B、碳酸钾;C、硫酸铵;D、磷酸钙
化肥 种类 氮肥
物
质 在植物生活中的 作用
含氮17%,白色晶 体,水溶液碱性 (pH=8.2-8.4)。受热 易分解(保存在干燥 阴冷处),使肥效消 失,易吸湿水解,结 块。 肥效快。土壤对其中的铵的吸附量大。 施肥后需覆土或灌溉,以减少氨挥发。不 与碱性物质(熟石灰)混合使用
无机化学 第11章 卤族元素

11.2.3 卤素单质的制备
(氧化手段的选择)
电解 F2 (g) 电解: 2KHF 2 2KF+ H2 + F2 + HF Cl2 (g) 工业 (电解):
电解 2NaCl+ 2H2O H2 + Cl2 + 2NaOH
实验室:
MnO2 + 4HCl浓 MnCl 2 + Cl2 (g) + 2H2O 也可用KMnO4 、 K2Cr2O7等氧化剂。 15
7
解:(1)
2 1
BrO
-
BrO
3
0.4556
Br2
1.0774
Br
-
3
0.6126 - 0.4556× -1.0774× 6 1 1)V (0.6126 × 1= = 0.5357V 4 (0.4556 1 + 1.0774 1)V 2 = = 0.7665V 2 (0.6126 6 - 1.0774 1)V 3 = = 0.5196V 8 5
不能用复分解反应法 (X=Br,I) KX + H2SO 4(浓) HX + KHSO4
2HBr + H2SO 4 (浓) SO 2 + Br2 + 2H2O
8HI + H2SO (浓) H2S + 4I2 + 4H2O 4
能否选用其他酸用复分解反应制备HBr和HI?
21
卤化物的键型及性质的递变规律: 同一周期:从左到右,阳离子电荷数 增大,离子半径减小,离子型向共价型过 渡,熔沸点下降。 例如: NaCl MgCl2 AlCl3 SiCl4 b.p./℃ 1465 1412 181(升华) 57.6 同一金属不同卤素:AlX3 随着X半径 的增大,极化率增大,共价成分增多。 例如: 离子键 共 价 型 AlF3 AlCl3 AlBr3 AlI3 b.p./℃ 1260 178(升华) 263 360 24
第11章卤素

基本要求
制备和性质 2、掌握卤化氢的还原性、酸性、稳定性的变 化规律和卤化氢的制备 3、掌握氯的含氧酸及其盐的酸性、氧化性、 稳定性的变化规律。
1、熟悉卤素单质的
作业
P346 2 、4 、 5
冷
漂白粉
次氯酸盐的漂白作用是基于次氯酸的氧化性
次卤酸盐的热稳定性:
ClO- > BrO- > IO-
例如次氯酸盐微热就发生歧化反应: 350K 2ClO-======Cl-+ClO3次溴酸盐在常温于就可以歧化,次碘酸盐根本就不 能存在于溶液中。
2.氯酸及其盐 卤酸: 酸性:(比次卤酸强 )
E(XO 3 / X )/V
HBrO
减弱
HIO
2.8×10-8 2.0×10-9 2.3×10-11
1.33
减弱 减弱
0.99
强氧化性 热稳定性(差):
注:热稳定性很低,只存在于水溶液中,在室温下见光或稍 浓即分解。
制备: 次氯酸 Cl2 +H2O (冷) 2Cl2 +2HgO+H2O HClO (稀) +HCl 2HClO(浓)+HgO.HgCl2
3.高卤酸及其盐 高卤酸: 酸性:比卤酸强 HClO4 最强 HBrO4 强 H5IO6 弱
酸性增强 E0A / V
氧化性:(都是强氧化剂)
1.19
比氯酸弱
1.763
1.60
稳定性:比卤酸稳定
均已获得纯物质,稳定性好。
浓HClO4溶液是强氧化剂,固体 高卤酸盐是强氧化剂,但稀HClO4
偏高碘酸 HIO4
五、拟卤素(简介)
拟卤素──性质与卤素单质相似的某些原子团称为拟卤素。
无机化学第十一章非金属元素二氧硫氮磷碳硅硼

第十一章 非金属元素(二)氧 硫 氮 磷 碳 硅 硼
过氧化氢浓溶液和蒸气对人体都有较强的刺激作用 和烧蚀性。30%过氧化氢接触皮肤时,会使皮肤变白并 有刺痛感。 过氧化氢蒸气对眼睛粘膜有强烈的刺激作用。人体 若接触浓的过氧化氢,须立即用大量的水冲洗。
氧化物的键型 离子型、共价型和过渡型 多数金属(特别是ⅠA,ⅡA,ⅢA,ⅢB,ⅣB及第 一过渡系的金 属)氧化物都是由离子键形成的离子化合 物,其固体属离子晶体,具有较高的熔点、沸点和硬 度。 对于金属性不强的金属的氧化物如 PbO,SnO等虽主要表现为共价性,但 因晶体为层状结构而具有较高的熔点。
第十一章 非金属元素(二)氧 硫 氮 磷 碳 硅 硼 元素氧化物的酸碱性呈现以下递变规律: (1) 同周期元素最高氧化值的氧化物从左往右,碱性 递减,酸性递增; (2) 同族元素,相同氧化值的氧化物从上往下,酸 性递减,碱性递增 ( 这一规律在 d 区表现不明显 ) 。 (3) 同一元素,不同氧化值的氧化物,其氧化值 从低到高,碱性递减,酸性递增。
第十一章 非金属元素(二)氧 硫 氮 磷 碳 硅 硼
第一节氧及其化合物
氧 氧是地壳中含量最多的元素,氧有 3 种同位素:
能形成O2和O3两种单质。
第十一章 非金属元素(二)氧 硫 氮 磷 碳 硅 硼
氧分子结构
· · · 表示由3个电子构成的π键,称为3电子π键。 简式表明O2分子中存在叁键,即一个σ键和两个3电子 π键。每个3电子π键中有1个未成对电子,2个π键则 有2个未成对电子,并且自旋平行,致使O2表现出顺磁 性。 3电子π键比2电子π键弱得多,键能约为其1/2, 故O2的化学性质比较活泼。
第十一章 非金属元素(二)氧 硫 氮 磷 碳 硅 硼
学习指南 第一节 氧及其化合物 第二节 硫及其化合物 第三节 氮及其化合物 第四节 磷及其化合物 第五节 碳、硅、硼及其化合物 习题 习题参考答案
第11章 重要的生命元素

• 氧化镁俗称苦土,是一种碱性白色粉末,难溶于 水,但可与水反应生成Mg(OH)2。氧化镁熔点约 为2850℃,可作耐火材料、润滑剂以及抑酸剂等 使用。
• 氧化钙俗称生石灰,是一种白色块状或粉末状碱 性放固出体 大。 量它 的微 热溶。于氧水化,钙可熔与点水为作26用15生℃成,C具a有(O强H)吸2, 湿性,可作耐火材料和干燥剂。
2. 钠和钾
(1)金属钠和钾 与水反应可释放出大量热 ;
(2) 氢氧化钠(钾) LiOH为中强碱外,其余均为强碱 ; 碱金属氢氧化物中以NaOH最重要。氢氧化钠又称
烧碱,它是实验室常用的重要试剂,也是重要的工 业原料。它能除去空气中的酸性物质如二氧化碳、 二氧化硫、二氧化氮、硫化氢等,NaOH易于融化, 能溶解某些金属氧化物和非金属氧化物,因此常用 于溶解矿物试样。
Fe Ca Mg K Ti
质量分数/% 1.50 1.48 1.39 1.08 0.22
11.1.2 元素的分类
1.金属和非金属元素
按长式周期表中硼—硅—砷—碲—砹和铝—锗— 锑—钋之间的对角线来区分。 位于对角线左下方的都是金属元素; 右上方的都是非金属元素。 对角线附近的锗、砷、锑、碲称为准金属元素。
11.1 元素概述
11.1.1 元素的分布
地球上天然存在的元素主要存在于岩石圈、水圈和 大气圈。
元素在地壳中的含量称为丰度,常用质量 分数表示。
11-1地球上分布最广的10种元素的质量分数
元素符号
O H Si Al Na
质量分数/% 52.32 16.95 1 6.67 5.53 1.95
元素符号
稀有元素也可继续分为:轻稀有金属、高熔点 稀有金属、分散稀有元素、稀有气体、稀土金属、 放射性稀有元素等。
第2-11谰系和锕系

Sm(4f66s2),Eu(4f76s2),Tm(4f136s2),Yb(4f146s2)能形 成+II氧化态即Sm(4f6),Eu(4f7),Tm(4f13),Yb(4f14) 。
从4f电子层结构来看,其接近或保持全空、半满 及全满时的状态较稳定(也存在热力学及动力学因素)。
Ln原子半径和离子半径 Ln原子半径 210 Ln离子半径 115
二、电子构型:特征是什么?
原子序数 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 元素 镧 铈 镨 钕 钷 钐 铕 钆 铽 镝 钬 铒 铥 镱 镥 符号 La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
4f0
4f1 4f3 4f4 4f5 4f6 4f7 4f7 4f9 4f10 4f11 4f12 4f13 4f14 4f14
57 La La 58 Ce Ce 59
57 58 59
Rb
Y
40 Zr 41 Nb 42 Mo 43
Tc 44 Ru
45 Rh 46 Pd 47 Ag 48 Cd 49
In
50 Sn 51 Sb 52 Te 53
Nd61Pm 60 Nd PrPr
60
61 Pm 62 Sm 63 Eu 64 Gd 65
三、氧化态 +3氧化态是所有Ln元素的特征氧化态。
它们失去三个电子所需的电离势较低,即能形成 稳定的+3氧化态。
有些虽然也有+2或+4氧化态,但都不稳定。 Ce(4f15d16s2),Pr(4f36s2),Tb(4f96s2),Dy(4f106s2)能形 成+IV氧化态即Ce(4f0),Pr(4f1),Tb(4f7),Dy(4f8) 。
第11章 自然元素大类

物理性质
颜色条痕均为金黄色,随Ag含量的增
高而逐渐变浅;含Cu时,颜色变深。金属光泽。无
解理。硬度2.5-3。相对密度19.3。强延展性。熔点
1062℃。热和电的良导体。化学性质稳定,不溶于 酸,只溶于王水。火烧不变色。
成因及产状 用中。
形成于高、中温热液作用和变质作
鉴定特征
金属色、强金属光泽,相对密度大,
低硬度,强延展性;化学性质稳定,火烧不变色。
易与黄铜矿黄铁矿相混淆,区别方法:金条痕呈金
黄色,黄铜矿黄铁矿条痕为黑色;金具强延展性,
黄铜矿黄铁矿具脆性;黄铜矿黄铁矿溶于热硝酸,
金不溶。
主要用途
自然金几乎是Au的唯一来源。是世界
性的“硬通货”。因其稳定性、导热导电性、延展
氧化条件下不稳定,形成赤铜矿、孔雀石、蓝铜矿
等。
鉴定特征
铜红色,表面氧化膜呈棕黑色,强延
展性,相对密度大,易溶于稀硝酸,常与孔雀石、
蓝铜矿伴生。
主要用途 聚集量大时可作为铜矿开采。
树枝状自然铜
三、自然半金属元素类
自然铋(Bi)
化学组成 成分较纯
结晶形态 物理性质
三方晶系。主要呈粒状、片状、致密 新鲜断面呈微带浅黄的银白色,在空
石墨(C)
化学组成
结晶形态 物理性质
成分纯净者极少,含有各种杂质。
六方晶系。单晶体呈片状或板状,完 颜色条痕均为钢灰色至铁黑色。半金
整的极少,通常呈鳞片状,块状或土状集合体。 属光泽至金属光泽。极完全解理。硬度1-2。相对密
度2.21-2.26。解理片具挠性。有滑感,易污手。导 热性好。
成因及产状
成因及产状
主要产于与基性、超基性岩有关的
高考总复习化学课件第十一章第1节原子结构和性质

(4)价电子排布式为 5s25p1 的元素位于第五周期第 ⅠA 族,是 s 区元素。( )
(5)共价化合物中,成键元素电负性大的表现为负价。 ()
(6)电负性越大,非金属性越强,第一电离能也越大。 ()
(7)电负性大于 1.8 的一定为非金属,小于 1.8 的一定 为金属。( )
(8)电负性差值大于 1.7 时,一般形成离子键,小于 1.7 时,一般形成共价键。( )
成:
,可见该元素核外有 7 个电
子,为氮元素,其元素符号为 N。
(2)B-、C+的电子层结构都与 Ar 相同,即核外都有 18 个电子,则 B 为 17 号元素 Cl,C 为 19 号元素 K。
(3)D 元素原子失去 2 个 4s 电子和 1 个 3d 电子后变成 +3 价离子,其原子的核外电子排布式为 1s22s22p63s23p63d64s2 即 26 号元素 Fe。
(3) 电 子 排 布 图 : 方 框 表 示 原 子 轨 道 , 用 “↑” 或 “↓”表示自旋方向不同的电子,按排入各能层中的各 能级的先后顺序和在轨道中的排布情况书写。
核外电子排布图能直观地反映出原子的核外电子的 自旋情况以及成对电子对数和未成对的单电子数。
5.电子的跃迁与原子光谱 (1)电子的跃迁。
(4) 根 据 题 意 要 求 , 首 先 写 出 电 子 排 布 式 : 1s22s22p63s23p63d104s1,该元素为 29 号元素 Cu。
答案:(1)N (2)Cl K (3)Fe 1s22s22p63s23p63d64s2
或 [Ar]3d64s2 (4)Cu 1s22s22p63s23p63d104s1 或[Ar]3d104s1
(2)(2016·全国卷Ⅰ)基态 Ge 原子的核外电子排布式 为[Ar]__________,有________个未成对电子。
高中化学第十一章 物质结构与性质知识点总结
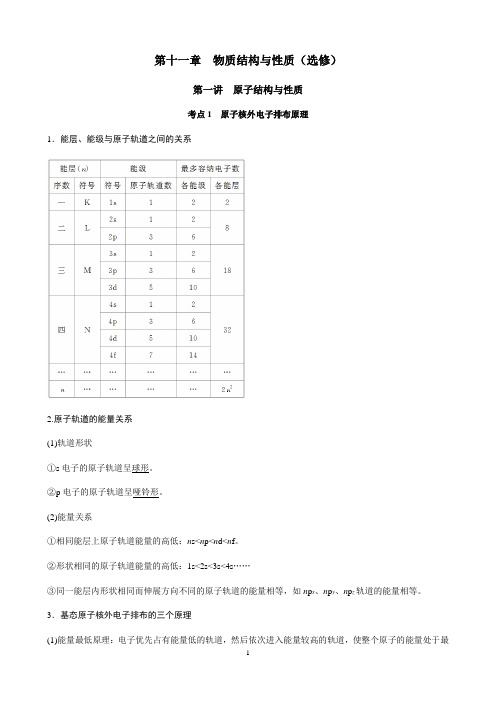
第十一章物质结构与性质(选修)第一讲原子结构与性质考点1原子核外电子排布原理1.能层、能级与原子轨道之间的关系2.原子轨道的能量关系(1)轨道形状①s电子的原子轨道呈球形。
②p电子的原子轨道呈哑铃形。
(2)能量关系①相同能层上原子轨道能量的高低:n s<n p<n d<n f。
②形状相同的原子轨道能量的高低:1s<2s<3s<4s……③同一能层内形状相同而伸展方向不同的原子轨道的能量相等,如n p x、n p y、n p z轨道的能量相等。
3.基态原子核外电子排布的三个原理(1)能量最低原理:电子优先占有能量低的轨道,然后依次进入能量较高的轨道,使整个原子的能量处于最低状态。
即原子的核外电子排布遵循构造原理能使整个原子的能量处于最低状态。
如图为构造原理示意图:(2)泡利原理:在一个原子轨道中,最多只能容纳2个电子,并且它们的自旋状态相反。
(3)洪特规则:当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同。
洪特规则特例:当能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量最低,如:24Cr的电子排布式为1s22s22p63s23p63d54s1。
4.原子(离子)核外电子排布式(图)的书写(1)核外电子排布式:按电子排入各能层中各能级的先后顺序,用数字在能级符号右上角标明该能级上排布的电子数的式子。
如Cu:1s22s22p63s23p63d104s1,其简化电子排布式为[Ar]3d104s1。
(2)价电子排布式:如Fe原子的电子排布式为1s22s22p63s23p63d64s2,价电子排布式为3d64s2。
价电子排布式能反映基态原子的能层数和参与成键的电子数以及最外层电子数。
(3)电子排布图:方框表示原子轨道,用“↑”或“↓”表示自旋方向不同的电子,按排入各能层中的各能级的先后顺序和在轨道中的排布情况书写。
无机化学第十一章

四、配位化合物的分类
配合物通常可分为简单配合物、螫合物和多核 配合物三种类型。 (1)简单配合物: 在简单配合物的分子或离子 中只有一个中心原子,每个配体中只有一个配位原 子与中心原子结合。 (2)螯合物: 螫合物的分子或离子中,配体为 多齿配体,中心原子与多齿配体形成环状结构。 (3)多核配合物: 多核配合物的分子或离子中 含有两个或两个以上的中心原子,一个配位原子同 时与两个中心原子结合。
(四)配位数
配位个体中直接与中心原子结合的配位原子的 数目称为中心原子的配位数。 影响中心原子配位数的主要因素有: (1)中心原子的价层电子组态:第二周期元素 的价层最多容纳 4 对电子,其配位数最大为 4 ;第 三周期及以后周期的元素,其配位数常为 4 和 6。 (2)空间效应:中心原子的体积越大,配体的 体积越小时,中心原子结合的配体越多,配位数也 越大。 (3)静电作用:中心原子的电荷数越多,对配 体的吸引力越强,配位数就越大;配体所带负电荷 越多,配体之间的排斥越大,则配位数变小。
2 E (d ) 3E (d ) 0 E (d ) E (d ) Es,o
由以上两式可解得:
E (d ) 0.6 Es,o E (d ) 0.4 Es,o
2.d 轨道在四面体负电场中的分裂
在配位数为 4 的四面体配位个体中,四个配体 位于正四面体的四个顶点上,与立方体的八个顶点 每隔一个顶点有一个配体的情况相同。
配位化合物是由给出孤对电子或多个不定域 电子的一定数目的离子或分子和具有接受孤对电 子或多个不定域电子的空位的原子或离子按一定 的组成和空间构型所形成的化合物。 通常把一定数目配体与中心原子所形成的复 杂分子或离子称为配位个体,含有配位个体的化 合物称为配合物。
分析化学-第十一章p区元素

硫代硫酸盐的性质
(1). 还原性
2S2O32+ + I2
S4O62– + 2I–
(2). 配位能力
Ag+ + 2S2O32– (过量)
O
[Ag(S2O3)2]3–
O
M S S O(单齿) S S O(双齿)
O
MO
(3). 遇酸分解 S2O32– + 2H+
S + SO2 + H2O
Supplement:多硫化物
二.氧、硫
1. 氧分子的结 构 分子 轨道理论简介
分子轨道能级示意图(a)和分子轨道图(b)
σ 2 px
*
*
2py 2pz
2px’ 2py’ 2pz’ 2py 2pz 2px’ 2py’ 2pz’
2s
σ 2 px
σ *2s
2s
2s’
σ 2s
σ *1s
1s
1s’
σ1s
O2 分子轨道和原子轨道能量关系
540 900 1290 1360
=
Z r2
2. 硅
天然硅化合物主要有 SO2 和硅酸盐。 SO2 可溶于 NaOH 或者 Na2CO3 溶液,生成可溶性硅酸盐。所以,和溶液不能用玻璃 容器,尤其不能用磨口玻璃容器盛装。
SO2 可溶于氢氟酸,生成气态 SiF4,因此可以用氢氟酸在玻 璃上雕花
SO2 + 4HF
多聚磷酸
NO3– 的检出反应
3NO3– + 8Al + 5OH– + 18H2O NO2– 的检出反应
NH2
3NH3(g) + 8[Al(OH)4]–
HAc + NO2- +
江苏省高邮市龙虬初级中学中考化学 第11章 元素化合物

元素化合物知识教学目标1.掌握酸碱盐的性质和用途;中和反应及其应用;2.了解酸的组成特点,知道浓硫酸的稀释方法;3.掌握碳酸盐、铵盐的检验方法。
4.水的电解、净化和防止污染的方法;5.知道食品中的有机物;淀粉、葡萄糖、蛋白质的化学性质。
重点难点酸碱盐的性质和用途课前准备备课和学生导学案教学过程设计个性设计一、知识准备1.自主完成下列练习检查酸和碱的性质掌握程度。
酸物理性质(浓)化学性质盐酸硫酸浓硫酸具有的特殊的化学性质。
稀释浓硫酸时要将。
碱物理性质化学性质烧碱熟石灰下列气体可用NaOH固体来干燥的气体有()A.SO2 B.O2 C.HCl D.NH3酸性溶液中性溶液碱性溶液石蕊试液酚酞试液PH共同含有的微粒————2.是有机物。
食品中存在营养素,其中有机高分子化合物有蛋白质(能、不易)溶于水,在盐溶液中溶解能力,在遇到、、、会发生化学变化而变性。
检验淀粉用,现象。
检验葡萄糖用并加热,现象。
3.常见的化肥有、、、、氨水是一种肥显性,NH4H2PO4名称是,是肥。
使用化肥是不可将铵态氮肥与混用,理由是,以氯化铵为例写出反应的化学方程式。
二、探究与释疑例1、下列各组转化中,一定条件下均能一步实现的组合是()A.①② B.②③ C.①③ D.①②③例2、下列各组物质,能在pH= 1的溶液中大量共存,且形成无色溶液的是()A.NaNO3 HCl Na2SO4 B.NaNO3 NaCl CuSO4C.NaCl Na2SO4 Na2CO3 D.NaOH CaCl2 Na2CO3例3、某同学做“证明鸡蛋壳的主要成分是碳酸盐,并收集纯净的气体”的实验。
设计了如下方案进行实验:(1)描述A中发生的现象:。
(2)根据我们所学的知识,你认为A装置和装置相连并产生什么现象时就足以说明鸡蛋壳的主要成分是碳酸盐?。
写出该装置中发生反应的化学方程式:(3)该同学想要收集一瓶纯净的该气体,进一步验证它的性质。
连接上述装置的顺序是:(填写各接口字母)。
上大 无机化学A 第十一章氧族元素

O O
4、H2O2的检验
O
在酸性溶液中过氧化氢能使重铬酸盐生成二过氧 合铬的氧化物,即Cr(O2)2O或CrO5,生成的CrO5显蓝 色,在乙醚中比较稳定,检验时在乙醚层中显蓝色, 可以相互检验。 4H2O2+H2Cr2O7===2Cr(O2)2O+5H2O 2Cr(O2)2O+7H2O2+6H+===2Cr3++7O2↑+10H2O
氧族通性
氧族元素的氧化态
电子构型
O S Se Te Po [He]2s22p4 [Ne]3s23p4 [Ar]4s24p4 [Kr]5s25p4 [Xe]6s26p4
常见氧化态
-2,-1,0, -2,-1,0,+2,+4,+6 -2,0,+4,+6 -2,+2,0,+4,+6 +2,+6
第二节 氧、臭氧
升华硫
单质硫
弹性硫
斜方硫和单斜硫都易溶于CS2、苯和环已烷 中,都是由S8环状分子组成的。在这个环状分子 中,每个硫原子以sp3杂化轨道与另外两个硫原子 形成共价单键相联结。
S8环状结构
此外还有升华硫、弹性硫等。
硫化氢、硫化物及多硫化物
一、硫化氢 实验室制备 FeS+H2SO4(稀)===FeSO4+H2S↑ 2、结构 与H2O相似,但极性弱、无氢键。 3、弱酸性 硫化氢水溶液具有弱酸性: Ka1=9.1×10-8、Ka2=1.1×10-12。 4、一些重要反应 硫化氢的水溶液比气体硫化氢更具有还原性,氧化剂能把 它氧化成S或硫酸,但不能氧化成SO2。 H2S+I2===S+2H++2IH2S+4Br2+4H2O===H2SO4+8HBr 2MnO4- +5H2S+6HCl===2MnCl2+2Cl-+5S+8H2O
无机化学PPT课件 元素化学 s区元素 p区元素 d区元素 ds区元素

第 三 部 分 元 素 化 学•熟悉元素性质与电子层结构的关系 •掌握单质和重要化合物的性质•了解它们在医药中的应用结束无机化学 2014/12/1 §12-15 : 2从上到下 半径增大 电离能减小 电负性减小第一节 s 区元素概述第十一章 s 区元素ⅠA ns 1 Li Na K Rb Cs ⅡA ns 2 Be Mg Ca Sr Ba碱金属 碱土金属从左到右,半径减小电离能增大 电负性增大除Li 和Be 外,多数金属形成离子化合物。
p273结束 无机化学 2014/12/1 §12-15 : 7NaHCO 3:小苏打,用于治疗胃酸过多和酸中毒; CaCO 3: 珍珠、钟乳石、贝壳的主要成分;Na 2SO 4·10H 2O : 中药称芒硝或朴硝,作缓泻剂; Na 2SO 4 :中药称玄明粉或元明粉,作缓泻剂; BaSO 4: 重晶石,难溶于水、酸、碱,能强烈吸收X 射线,因无毒用作胃肠造影剂之“钡餐”; BaCl 2:剧毒(致死量0.8g )。
CaSO 4·2H 2O 生石膏,内服清热泻火; CaSO 4· H 2O 熟石膏(煅石膏, 烧石膏)粉末遇水膨胀硬化,石膏绷带,外敷治疗烫伤疥疮等。
MgSO 4·7H 2O :又称泻盐,作缓泻剂。
四、重要的盐类 p28112结束无机化学 2014/12/1 §12-15 : 8 五、对角线规则 p282在周期表s 区和p 区,某元素与左上方或右下方的元素及其化合物的性质相似。
例如:Be 和Al 的还原性相近; Be(OH)2和Al(OH)3 均为两性;例如:LiCl,、MgCl 2 都是共价化合物; LiOH 、Mg(OH)2都是中强碱,微溶于水Li Be B C Na Mg Al Si结束 无机化学 2014/12/1 §12-15 : 9VIIA 族 n s 2n p 59F 17Cl 35Br 53I 85At一、卤族元素的通性 (p284)(1) 是非极性分子,难溶于水,易溶于有机溶剂及碘化钾溶液中:KI + I 2 = KI 3 碘酒(碘酊)(p306习题3) F 2→I 2 的熔点、沸点、密度增大。
第十一章碱金属和碱土金属

第十一章 碱金属和碱土金属Chapter 11 Alkali and Alkali-earth Metals[教学要求]1、掌握碱金属和碱土金属的性质与结构、性质与存在、制备、用途之间的关系。
2、掌握碱金属和碱土金属氧化物的性质和类型以及氢化物的性质。
3、掌握碱金属和碱土金属氢氧化物的溶解度和碱性以及盐类溶解度,热稳定性等性质的变化规律。
4、一般掌握锂铍的特征,对比和镁的相似性等了解对角线规则。
[教学重点]1.碱金属、碱土金属的单质、氧化物、氢氧化物、重要盐类的性质。
2.碱金属、碱土金属性质递变的规律。
[教学难点]碱金属、碱土金属的氢氧化物性质递变规律。
[教学时数] 4学时 [教学内容]§11-1 碱金属元素及其化合物 Alkali Metals and their CompoundsLithium (Li) Sodium (Na) Potassium (K)Rubidium (Rb) Cesium (Cs) Francium (Fr)它们之所以有碱金属元素之称,是由于它们的氢氧化物都易溶于水(除了LiOH 的溶解度较小之外)的强碱。
一、General Properties1.Valence electron of alkali metals:(1) 其氧化数为+1,不会有其它正氧化态。
因为碱金属的第二电离势特别大,有可能出现-1氧化态。
即-→+M e M 。
在无水、无氧条件下,可以制得低氧化态的非寻常化合物,如钠化物。
钠在乙二胺和甲胺中所形成的溶液具有导电性,可以观察到Na -的光谱带,说明主要的导电体应是钠电离出的Na + 和Na -,即-+++−−−−→−Na Na Na 223NH CH en 2Na(s) + C 20H 36O 6[Na(C 20H 36O 6)]+·Na-(2) 由于价电子数少,所以碱金属原子之间的作用力比绝大多数其他金属原子之间的作用力要小,因此碱金属很软,低熔、沸点,且半径大、密度小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
HO2-==== H+ + O2 2- Ka2==10-25
(3)、氧化还原性
O2 还原剂H 2 O2 氧化剂H 2 O
酸性介质 H2O2 + 2H+ + 2e === 2H2O =1.77V(Ox) O2+2H++2e ===H2O2 碱性介质 = 0.682V( Re )
(ClO3-/Cl-)= 1.451V
3、高氯酸及其盐 HClO4 (无H2O)是无色、粘稠状液体,是已知酸中最强 的酸。也是一种强氧化剂,是常用的分析试剂。 7Ce2(SO4)3+2HClO4+7H2SO4==14Ce(SO4)2+Cl2+8H2O
Mg(ClO4)2是非常好的干燥剂,干燥能力是硅胶的15倍。
HO2-+ H2O + 2e === 3OH- = 0.88V(Ox)
O2 + H2O + 2e === HO2-+ OH- = -0.076V( Re )
H2O2 的氧化性比还原性要显著,因此,常用作氧化剂, 不会引入新杂质。 Cr(OH)4-+H2O2 == CrO42-
CrO42-+H++H2O2+乙醚 === CrO5(蓝色)
§11.1.2 卤化氢(HX) 1、酸性 除HF外,均为强酸,并且酸性依次增强。
2、还原性 HI>HBr>HCl>HF §11.1.3 氯化物与水的反应
1、一般金属(+2、+3价态)分级水解,生成碱式盐 及HCl; SnCl2+H2O===Sn(OH)Cl(白)+HCl SbCl3+H2O===SbOCl(白)+2HCl BiCl3+H2O===BiOCl(白)+2HCl
O + O2 === O3
O3 ==== O2 + O
(2)
(3)
臭氧层吸收太阳的240~310nm 的紫外辐射,而成为地球的 “保护伞”。
3、O3的性质 O3 + 2H+ + 2e === O2 + H2O A=2.07V O3 + H2O + 2e === O2 + 2OH- B=1.24V ( 酸性溶液) ( 碱性溶液)
NH4Cl == HCl + NH3 (NH4)2SO4 == NH4HSO4 + NH3
NH4NO3 == N2O + 2H2O (200℃)
2、氮的氧化物、含氧酸及其盐 (1)、氮的氧化物(NOx) 氮可以形成多种氧化物:N2O,NO,N2O3, N2O3(或N2O4),N2O5
强氧化性 A/V: NO3- +0.80 NO2 +1.07 HNO2 +0.98 NO +1.59 N2O +1.77 N2 +0.27 NH4+
第十一章、元素化学
§11.1 卤族元素(卤素) §11.1.1 卤素单质的化学性质
最突出的是氧化性。除碘外,均为强氧化剂。
电对 F2/F- Cl2/Cl- Br2/Br- I2/I-
/V
2.87
1.36
1.08
I2
0.535
氧化性 F2 > Cl2 > Br2 >
还原性 F - < Cl - < Br - < I –
4、硫代硫酸钠(大苏打、海波) (1)、 中等强度的还原剂 2S2O32- + I2===S4O62-+2I- (2)、 很强的配位能力
AgBr(s) + 2S2O32-===[Ag(S2O3)2]3-+Br-
5、过硫酸盐
过二硫酸及其盐都不稳定,过二硫酸的氧化性比硫酸 强 得 多 。 过 硫 酸 盐 在 酸 性 溶 液 中 能 将 Mn2+ 氧 化 为 MnO4-. 2Mn2+ + 5S2O82-+ 8H2O == 2 MnO4-+10SO42-+16H+
4、氯的含氧酸及其盐性质的递变规律 含氧酸 HClO HClO2 HClO3 HClO4 热稳定性增大 含氧酸盐 MClO MClO2 MClO3 MClO4
--------------------------------------- 氧化性减弱
氧化物水合物酸碱性的判断 R----O---------H 酸式离解 R--------O----H 碱式离解 含氧酸酸性强度的判断
2) 同一元素
高氧化值 > 低氧化值
3) 同一元素(氧化值相同) 含水少 > 含水多
H2S2O7 > H2SO4
§11.2 氧 和 硫 §11.2.1 O3 1、结构 中心原子采取sp2杂化,形成2个 键及1个π34键。3个O原子 呈V形排列。 2、臭氧层 O2 ==== O + O (1)
如何学好元素化学?
总的原则:突出重点,总结规律,注意特性, 加强联系,善于对比,重视实践。
头脑里要有“一条线”和“一张表”
“一条线” 结构—性质—用途—检验
“一张表”—元素周期表
对于单质: 硬度最大的是C(金刚石); 熔点最高的是C(金刚石),熔点最低的是He; 沸点最高的是W,沸点最低的是He; 导电性最强的是Ag。 对于金属: 硬度最大的是Cr; 熔、沸点最高的是W,熔、沸点最低的是Hg; 导电性最强的是Ag。
取代反应: 2NH3 + 2Na ==2NaNH2 + H2
用途 检查Cl2管道是否漏气:3 Cl2 + 2NH3 == N2 + 6HCl HCl + NH3 == NH4Cl(白烟) (2)、铵盐
由于 NH4+与 K+的半径差别不大,故铵盐在晶型、颜色、 溶解度等方面都与其相应的钾盐相似。但是铵盐有其特 殊的性质,即热稳定性差,极易分解。
HnROm m-n 为非羟基氧原子数
m-n 0 1 2 Ka1 <10-8 10-2—10-4 103 酸强度 弱 中强 强 实 H3PO4 HClO3 H2SO4 例 HClO H3BO3
3
108
很强
HClO4
非金属含氧酸酸性强弱变化规律 1)同主族,不同周期 2周期 >> 3周期 ~ 4周期 >> 5周期
3) 难溶于浓HCl,但溶于浓HNO3 ;
CuS Cu2S Ag2S As2S3 As2S5 4) 仅溶于王水。 HgS Hg2S (2)、 水解性
Al2S3 + 6H2O === 2Al(OH)3 + 3H2S
§11.2.3 硫的重要含氧化合物 1、 SO2 大气中的SO2主要是由燃烧含硫的煤和石油 等来的。就排放量来说,它仅次于 CO ,每年 排入大气中的 SO2 高达 1.5 亿吨。空气中的 SO2 含 量 不 得 大 于 0.02mg/L 。 人 为 排 放 的 SO2 和 NOx是形成酸雨的两种主要物质。 SO2的分子结构跟O3相似,呈V形,也有大 键(34)。
强氧化剂、消毒剂,用来处理污染物,如CN-,不 仅效率高,而且不带来二次污染。 O3 + CN-=== OCN- + O2 OCN-+ O3 === CO2 + 1/2N2 + O2
§11.2.2 氧族元素的氢化物 1、H2O2(双氧水) (1)、 不稳定性 2H2O2 ==== 2H2O + O2 rHm=-198kJ/mol (2)、 弱酸性 H2O2 ==== H++HO2- Ka1==2.2×10-12(25℃)
2、H2SO3及其盐 亚硫酸是中强酸,分两步离解: H2SO3===H++HSO3- Ka1==1.54×10-2 HSO3-===H++SO32- Ka2==1.02×10-7 亚硫酸及其盐既有氧化性,也有还原性。 酸性介质 H2SO3 + H+ + 4e=== S + 3H2O H2SO3+H2O-2e==SO42-+4H+ =0.45V(Ox) =0.20V(Re )
§11.3 氮族元素
§11.3.1 氮的重要化合物 1、氨和铵盐 (1)、氨的化学性质
加合反应: H+ + :NH3 == NH4+
Ag+ + 2NH3 == [Ag(NH3)2]+ 氧化还原反应: 氨在纯净的氧气中燃烧, 4NH3 + 3O2 == 2N2 + 6H2O 在Pt催化及800℃下,4NH3 + 5O2 == 4NO + 6H2O
2、硫化氢和氢硫酸 H2S 为大气污染物中毒性很大的污染物之一,空气 中允许最大含量为0.01mg/L. H2S 的水溶液叫氢硫酸,是二元弱酸,分两步离 解。 H2S是较强的还原剂。
3、金属硫化物
(1)、 难溶性 根据它们在酸中溶解的情况,可分为四类:
1)不溶于水,但溶于稀HCl;Ksp>10-24 MnS ZnS FeS CoS NiS 2) 不溶于水和稀盐酸,但溶于浓HCl ;10-30<Ksp<10-25 SnS SnS2 PbS Bi2S3 Sb2S3 Sb2S5 CdS
