(仅供参考)硼替佐米说明书
硼替佐米 PPT课件

【药品名称】
药品名(中):注射用硼替佐米 英文名:Bortezomib for Injection
剂型剂量
剂型:注射剂(粉针)
剂量:每瓶含有3.5mg硼替佐米的无菌冻 干粉末。
【贮藏】
在25℃(15~30℃)避光处保存。
药效学
硼替佐米是26S蛋白酶体抑制剂,通过阻 断细胞内多种调控细胞凋亡及信号传导的 蛋白质的降解,导致肿瘤细胞死亡。
心理护理
多发性骨髓瘤仍是目前不可治愈的恶性血液病, 常规的联合化疗只能暂时缓解病情,化疗1年生 存率也不超过30%。护理人员在患者入组前均提 供有关MM疾病诊治的基本知识并给予情感关怀 和心理支持,让患者树立战胜疾病的信心和勇气。 在使用硼替佐米靶向药物治疗之前,均给予患者 心理疏导并签署知情同意书,告知患者应用硼替 佐米的治疗原则,联合用药可能出现的副反应、 严重不良事件及防治措施,从根本上解除患者的 紧张情绪和恐惧心理,以使患者最大限度地配合 治疗,提高疗效。
化疗方案
由于硼替佐米对初治多发性骨髓瘤也具有显著疗 效,目前已成为多发性骨髓瘤首选治疗药物。通 常与皮质激素(地塞米松或泼尼松)、沙利度胺、 化疗药物(马法兰或阿霉素或表阿霉素等)联合 应用。联合应用明显优于单药应用,且疗效持续 时间长,可明显延长患者生存期。常用的方案有 PAD方案(硼替佐米、阿霉素或表阿霉素、地塞 米松)、VD方案(硼替佐米、地塞米松)、VDT 方案(VD方案基础上加上沙利度胺)、V-MP 方案(硼替佐米、马法兰、泼尼松)、V-MPT (在V-MP方案基础上加上沙利度胺)、V-MDT (将V-MPT中的泼尼松换为地塞米松)等。
【适应症】
用于多发性骨髓瘤患者的治疗,此患者在使用 本品前至少接受过两种治疗,并在最近—次治疗 中病情还在进展。硼替佐米对多种肿瘤,尤其是 血液肿瘤中的多发性骨髓瘤、套细胞型淋巴瘤及 其他B细胞类型淋巴瘤(弥漫大B细胞型、滤泡细 胞型、小淋巴细胞型/慢性淋巴细胞白血病、边 缘区淋巴瘤)、霍奇金淋巴瘤有较强的抗肿瘤活 性。另外,硼替佐米与化疗药物联合应用治疗急 性髓细胞性白血病、急性淋巴细胞白血病、成人 T淋巴细胞白血病、浆细胞白血病均取得不同程 度疗效,目前处于临床试验阶段
万珂的药品介绍

万柯药品介绍2006年9月21日,西安杨森的全新肿瘤治疗药物——万珂在国内上市。
万珂是目前全球惟一批准用于临床治疗的蛋白酶体抑制剂,它的应用将为多发性骨髓瘤的治疗带来希望。
多发性骨髓瘤(MM)占血液系统恶性肿瘤发病率的第二位。
该病常见于老年人群,随着人口老龄化,其发病率也有所增加。
传统化疗方案治疗多发性骨髓瘤的效果不佳,中位生存期仅3年,尽管大剂量化疗后自体干细胞移植等新方法使缓解率和生存期有所改善,但该病仍无法治愈,最终会出现耐药性复发。
近10年来,治疗缓解率或缓解期及总生存率没有明显提高,患者急需新的治疗方法。
西安杨森最近引进的万珂是全球第一个以蛋白质酶体为标靶治疗目标的癌症用药,它不像其他靶向治疗药物那样只是针对某个异常蛋白干预肿瘤细胞多环节异常中的一环,而是开启了肿瘤细胞通向凋亡的大门。
其作用的泛素蛋白酶体通道在2004年获得了诺贝尔化学奖。
目前,万珂被视为治疗复发性与顽固型多发性骨髓瘤的突破性疗法,研究显示此药可减缓、逆转或停止曾接受两种以上疗法但失败的患者病情继续恶化。
该药由美国千年制药公司研制开发,目前已经在全球46个国家上市。
2005年刚获得诺贝尔化学奖的一项科研发现,今年已转化成治疗肿瘤的药物。
这种名为万珂的蛋白酶体抑制剂近日已通过国家食品药品监管局的快速通道审核,批准用于治疗多发性骨髓瘤。
人体细胞内的蛋白酶体能调节正常细胞的生长。
但当蛋白酶体超出它的正常生理作用时,就会引发各种肿瘤。
这种情况下它可以减弱对癌细胞的生长抑制,减少癌细胞的凋亡。
因此科学家通过药物来抑制蛋白酶体,以达到阻止肿瘤生长,导致癌细胞凋亡的目的,促进正常细胞生长,恢复正常细胞的平稳状态。
这种由美国强生和千年公司进一步研发的蛋白酶体抑制剂,尽管目前只限于血液系统的第2大恶性肿瘤———骨髓瘤,但是科学家已经把它看做是治疗癌症的突破疗法,其作用机理也应该适用于其他癌症。
Bortezomib(VELCADE,PS-341)研究进展蛋白酶体是具有多催化活性位点的蛋白酶复合体,负责包括细胞周期调控蛋白和细胞凋亡蛋白在内的胞内绝大多数蛋白质的降解。
硼替佐米Bortezomib杂质
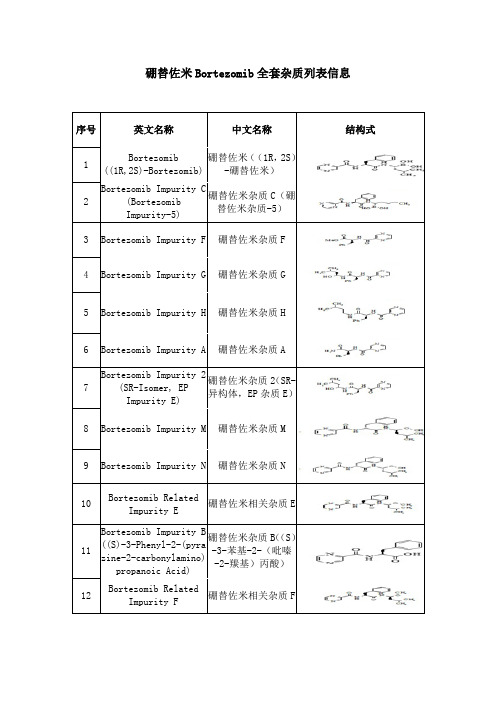
硼替佐米Bortezomib 全套杂质列表信息序号英文名称 中文名称 结构式 1 Bortezomib ((1R,2S)-Bortezomib) 硼替佐米((1R ,2S )-硼替佐米)2 Bortezomib Impurity C (Bortezomib Impurity-5)硼替佐米杂质C (硼替佐米杂质-5) 3 Bortezomib Impurity F 硼替佐米杂质F4 Bortezomib Impurity G 硼替佐米杂质G5 Bortezomib Impurity H 硼替佐米杂质H6 Bortezomib Impurity A 硼替佐米杂质A7 Bortezomib Impurity 2 (SR-Isomer, EP Impurity E)硼替佐米杂质2(SR-异构体,EP 杂质E )8 Bortezomib Impurity M 硼替佐米杂质M 9 Bortezomib Impurity N 硼替佐米杂质N10Bortezomib Related Impurity E 硼替佐米相关杂质E 11 Bortezomib Impurity B ((S)-3-Phenyl-2-(pyra zine-2-carbonylamino)propanoic Acid)硼替佐米杂质B ((S )-3-苯基-2-(吡嗪-2-羰基)丙酸) 12 Bortezomib Related Impurity F硼替佐米相关杂质F13 Bortezomib Impurity 4 硼替佐米杂质4 14 Bortezomib Impurity 5 硼替佐米杂质5 15 Bortezomib Impurity 6 硼替佐米杂质6 16 Bortezomib Impurity 7 硼替佐米杂质7 17 Bortezomib Impurity 8 硼替佐米杂质8 18 Bortezomib Impurity 9 硼替佐米杂质9 19 Bortezomib Impurity 10 硼替佐米杂质10 20 Bortezomib Impurity 11 硼替佐米杂质11 21 Bortezomib Impurity 12 硼替佐米杂质12 22 Bortezomib Impurity 13 硼替佐米杂质1323 Bortezomib Impurity 2 (Mixture of (1S,2R)-Isomer and (1R,2R)-Isomer) 硼替佐米杂质2(混合(1S ,2R )-异构体和(1R ,2R )-异构体)24 Bortezomib Impurtiy 14 硼替佐米杂质14 25 Bortezomib Impurity 2 (RR-Isomer) 硼替佐米杂质2(RR-异构体) 26 Bortezomib Impurity 3 硼替佐米杂质327 Bortezomib Impurity (R,R-Isomer) 硼替佐米杂质(R ,R-异构体)28 Bortezomib Impurity (R,S-Isomer) 硼替佐米杂质(R ,S-异构体)29 Bortezomib Impurity (S,S-Isomer) 硼替佐米杂质(S,S-异构体)。
硼替佐米治疗多发性骨髓瘤不良反应的护理

硼替佐米治疗多发性骨髓瘤不良反应的护理发表时间:2017-10-18T11:29:45.617Z 来源:《中国医学人文》2017年第7期作者:黎朝程玲[导读] 对症护理能辅助部分多发性骨髓瘤行硼替佐米治疗出现不良反应的病人完成治疗。
成都市第一人民医院四川成都 610000摘要:目的:总结多发性骨髓瘤病人应用硼替佐米出现不良反应的临床护理。
方法:对20例多发性骨髓瘤病人应用硼替佐米出现不良反应者进行对症护理。
结果:不良反应主要有疲乏、胃肠道反应、周围神经病变、骨髓抑制、带状疱疹等;完全缓解3例,部分缓解15例,因病人不良反应剧烈退出观察2例。
结论:对症护理能辅助部分多发性骨髓瘤行硼替佐米治疗出现不良反应的病人完成治疗。
关键词:多发性骨髓瘤;硼替佐米;不良反应;护理多发性骨髓瘤(MM)是恶性肿瘤,临床表现复杂,可见贫血、骨痛,溶血性骨质破坏、病理性骨折、肾功不全、神经症状等。
美国国家综合癌症网曾于2009年报道,多发性骨髓瘤诊治指南中推荐硼替佐米为一线用药。
硼替佐米是一种经过修饰的二肤基硼酸[1]。
2015年12月~2016年12月我科对多发性骨髓瘤病人经硼替佐米治疗所出现的不良反应给予对症护理,取得满意效果。
现将护理总结如下。
1.临床资料1. 1一般资料2015年12月~2016年12月我院血液科多发性骨髓瘤病人应用硼替佐米出现不良反应20例,男11例,女9例;年龄43岁~73岁,平均59岁;病程1年~4年;己确诊为多发性骨髓瘤而收入院治疗,应用硼替佐米治疗后出现疲乏、胃肠道反应、周围神经病变、骨髓抑制、带状疤疹等不良反应症状。
1. 2治疗方法硼替佐米的用量:按体表而积1. 3mg/m2计算;用法:于3 s~5s静脉注射完毕,第1天、第4天、第8天、第11天用药,然后停药10 d(第12天~第21天),3周为1个疗程。
每例病人接受1个~3个疗程。
2.结果临床疗效:完全缓解3例,部分缓解15例,因病人不良反应剧烈退出观察2例。
注射用硼替佐米的制备

注射用硼替佐米的制备全文共四篇示例,供读者参考第一篇示例:注射用硼替佐米,又称硼替佐米注射液,是一种用于麻醉和镇痛的药物,广泛应用于临床。
硼替佐米是一种苯并二氮䓬类镇静催眠药,能够减轻疼痛和焦虑,使患者在手术中处于安静和舒适的状态。
在制备硼替佐米注射液的过程中,需要严格遵循一定的标准操作规程,确保药物的质量和安全性。
硼替佐米注射液的制备过程主要由以下几个步骤组成:第一步:准备药物原料。
硼替佐米是一种合成药物,其主要原料为硼替佐米原料药及其辅料。
在开始制备过程之前,需要确保所使用的药物原料符合药典规定的质量要求,同时进行相关的化验检查。
第二步:称量和配制药物。
根据处方要求和药物配方,精确称取硼替佐米原料药及其辅料,并按照一定的比例进行混合和配制。
在称量和配制过程中,需要注意保持清洁,避免外界污染。
第三步:溶解和调整药物浓度。
将配制好的药物加入适量的溶剂中,进行搅拌和加热,使药物充分溶解。
同时,根据药物的需要,调整药物的浓度,并确保药物的稳定性和均匀性。
第四步:灭菌和包装。
将溶解好的药物溶液进行灭菌处理,以确保药物无菌。
然后将灭菌后的药物溶液进行包装,常用的包装方式有玻璃瓶、塑料瓶等,确保药物的保存和稳定性。
第五步:质量控制和检验。
制备完成的硼替佐米注射液需要进行严格的质量控制和检验,包括外观、溶解度、PH值、含量测定等指标。
只有符合标准要求的药物才能投放市场和使用。
总的来说,注射用硼替佐米的制备过程繁琐复杂,需要严格遵守药典规定和相关标准要求,以确保药物的质量和安全性。
同时,制备过程中需要注意操作规范,保持药品的无菌和稳定性,避免药物受到污染和变质。
只有这样,硼替佐米注射液才能在临床上发挥良好的疗效,为患者带来更好的治疗效果。
第二篇示例:硼替佐米,又称硼代瑞松,是一种非甾体类抗炎药,常用于治疗风湿性关节炎、类风湿性关节炎等疾病。
其主要作用机制是抑制炎症介质的合成,减少炎症反应,从而缓解疼痛和肿胀。
注射用硼替佐米说明书

表2:本品与美法如果在前一个疗程内观察到持续的4级中性粒细胞
减少症或血小板减少症,或血小板减少症伴出血 • 如果给予本品当日(除第1天外)的血小板计数
≤30×109/L或ANC≤0.75×109/L
2
剂量调整或延迟给药 考虑在后一个疗程减少美法仑剂量的25%。 应停用本品。
对于超过 8 个疗程的延续性治疗,可按标准方案给药。对于复发的多发性骨髓瘤患者,也可 以按每周 1 次给药、连续给药 4 周的维持方案(第 1、8、15 和 22 天),随后是 13 天的休息期(第 23 至 35 天)。
剂量调整以及重新开始治疗
当发生任何 3 级非血液学毒性或任何 4 级血液学毒性(不包括下面讨论的神经病变)时,应 暂停本品治疗。一旦毒性症状得到缓解,可以重新开始本品的治疗,剂量减少 25%(例如:1.3 mg/m2 降低到 1.0 mg/m2;1.0 mg/m2 降低到 0.7 mg/m2)。如果患者发生与本品治疗有关的神经性疼痛或 外周感觉神经病,建议按下表推荐的调整剂量进行治疗,主治医生应根据患者实际病情选择合适的 剂量调整方案。有因严重自主神经病变导致中断或停止治疗的报告。如果患者本身患有严重的神经 病变,只有权衡利弊后方可使用本品。
轻度 中度 重度
表5:肝功能损伤患者的推荐起始剂量调整表
胆红素水平 ≤ 1.0x ULN > 1.0x~1.5x ULN
> 1.5x~3x ULN
> 3x ULN
SGOT (AST) 水平 > ULN 任何值
任何值
任何值
起始剂量调整(单次 1.3 mg/m2,每周 2 次) 不变 不变
第一个治疗周期的剂量降至 0.7 mg/m2。根 据患者的耐受性,随后的治疗剂量增加至 1.0 mg/m2 或进一步降至 0.5 mg/m2。
硼替佐米应用

z. marginale MZL 3% 3%
folliculaire 22% 22%
follicular
autres others 6% 6% anaplasique T/null
type LLC small ly 8%
8%
anaplastic T/null 2% 2%
T péripherique manteau 6% mantle cell 7%
Study 2
硼替佐米联合R-CHOP-21 治疗初发 治疗初发MCL(Ⅱ期) 硼替佐米联合 (
患者
N = 36,中位年龄 66岁 (45-80) , 岁 III/IV期有 例 (94%) , 血清 期有34例 血清LDH升高有 例 (50%) 升高有18例 期有 升高有 IPI 评分 42% IPI 2, 47% IPI 3-5; 评分: MIPI评分中位占 评分中位占28% , 高危占 高危占39% 评分中位占
硼替佐米,一种治疗多发性骨髓瘤的新批准蛋白酶体抑制剂

专题文献本文受美国版权法保护。
未经授权不得复制。
购买批量再版权或请求复制,请发邮件至***************.硼替佐米,一种治疗多发性骨髓瘤的新批准蛋白酶体抑制剂:护理重要性Kathleen Colson, RN, BSN, BS, Deborah S. Doss, RN, OCN , Regina Swift, RN, BSN, Joseph Tariman, RN, APN, MN, BC, OCN○R, and Teri E. Thomas, RN多发性骨髓瘤(MM),一种浆细胞恶性肿瘤,大约占新诊血液病恶性肿瘤的14%。
化疗及干细胞移植方面的进展改善了存活率,但是MM仍然不可治愈。
一线蛋白酶体抑制剂硼替佐米(Velcade TM,千禧制药,剑桥,MA)已经被批准用于曾接受过至少2次既往治疗并于最近1次治疗后出现疾病进展的MM患者。
根据临床研究,大部分副反应可以通过标准干预进行控制。
最常见的毒副反应为体弱症状(疲劳,不适及衰弱),胃肠道紊乱(恶心,呕吐,腹泻及便秘),血小板减少症,周围神经病变,发热及贫血。
针对副反应的支持疗法及策略可以预防这些症状恶化,从而不必减量或延迟治疗。
肿瘤护士在保证硼替佐米合适及安全用药方面扮演重要角色,经常第一个识别副反应症状。
对患者进行预期副反应教育,并对其进行密切监测可以及时进行症状管理干预,保证患者舒适及安全性。
关键词:多发性骨髓瘤,周围神经病变,蛋白酶体多发性骨髓瘤是第二常见的血液病恶性肿瘤,根据美国肿瘤协会2004年的研究,在美国每年大约有15,270例新发病例及超过11,070例死亡病例。
该病属于B细胞抗体形成癌症,引发浆细胞增生无法控制。
恶性浆细胞侵袭骨髓及体内其它器官,浆细胞在血液中释放大量单克隆免疫球蛋白(M蛋白),一种异常抗体形式。
骨髓瘤细胞的扩散强导致多种并发症涉及骨,血液,肾及神经免疫系统(Kyle等,2003)。
该病常引发慢性症状如骨痛,低血钙水平,肾功能降低或衰竭,多重复发性感染,骨折,脊髓受压,贫血,血液凝固系统异常,周围神经病变症状,胃肠道紊乱,各种血细胞数异常降低(Rice & Sheridan,2001)。
硼替佐米相关杂质
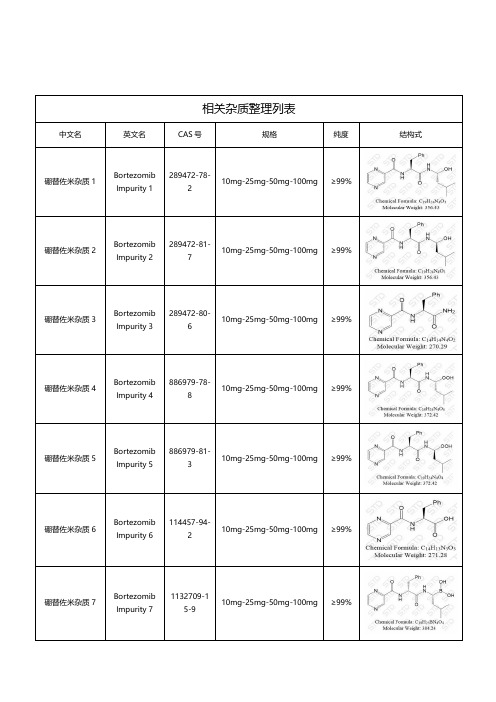
相关杂质整理列表中文名英文名CAS 号规格纯度结构式硼替佐米杂质1BortezomibImpurity 1289472-78-210mg-25mg-50mg-100mg ≥99%硼替佐米杂质2BortezomibImpurity 2289472-81-710mg-25mg-50mg-100mg ≥99%硼替佐米杂质3BortezomibImpurity 3289472-80-610mg-25mg-50mg-100mg ≥99%硼替佐米杂质4BortezomibImpurity 4886979-78-810mg-25mg-50mg-100mg ≥99%硼替佐米杂质5BortezomibImpurity 5886979-81-310mg-25mg-50mg-100mg ≥99%硼替佐米杂质6BortezomibImpurity 6114457-94-210mg-25mg-50mg-100mg ≥99%硼替佐米杂质7BortezomibImpurity 71132709-15-910mg-25mg-50mg-100mg ≥99%硼替佐米杂质8BortezomibImpurity 81132709-16-010mg-25mg-50mg-100mg ≥99%硼替佐米杂质9BortezomibImpurity 91132709-14-810mg-25mg-50mg-100mg ≥99%硼替佐米杂质12BortezomibImpurity 1273058-37-410mg-25mg-50mg-100mg ≥99%硼替佐米杂质13BortezomibImpurity 131608986-16-810mg-25mg-50mg-100mg ≥99%硼替佐米杂质15BortezomibImpurity 15275374-67-910mg-25mg-50mg-100mg ≥99%硼替佐米杂质22BortezomibImpurity 2284110-34-910mg-25mg-50mg-100mg ≥99%硼替佐米杂质23BortezomibImpurity 2385167-14-210mg-25mg-50mg-100mg ≥99%硼替佐米杂质26BortezomibImpurity 2618680-27-810mg-25mg-50mg-100mg ≥99%硼替佐米杂质27BortezomibImpurity 271446194-56-410mg-25mg-50mg-100mg ≥99%硼替佐米杂质28BortezomibImpurity 28862894-96-010mg-25mg-50mg-100mg ≥99%硼替佐米杂质38BortezomibImpurity 38390800-88-110mg-25mg-50mg-100mg ≥99%湖北扬信医药科技有限公司经营上万种杂质对照品(优势供应硫酸羟氯喹杂质、硝苯地平杂质、沙丁胺醇杂质、达格列净杂质、厄贝沙坦杂质、阿莫西林克拉维酸钾杂质、利伐沙班杂质、阿托伐他汀钙杂质、西格列汀杂质、利格列汀杂质等),并代理销售中检所、STD 、LGC 、TLC 、EP 、USP 、TRC 等多个品牌产品,提供上万种标准品对照品,真诚为您服务。
硼替佐米皮下注射的护理体会

82生物技术世界 BIOTECHWORLD多发性骨髓瘤(MM)是一种血液系统恶性疾病,以异常浆细胞增生为主要特征,常见临床表现为骨骼破坏、肾功能损伤、贫血、神经病变等,好发于老年患者,在靶向药物问世前,主要使用“VAD(长春新碱+多柔比星+地塞米松)”等方案治疗,疗效欠佳,完全缓解率不足10%,中位生存期为3年左右。
近期随着以硼替佐米为代表的靶向药物的问世,其临床疗效得到显著提高,完全缓解+部分缓解率可达75%以上[1]。
硼替佐米作为一种26S蛋白酶体糜蛋白酶样活性的可逆抑制剂,其靶向性好,对骨髓抑制轻,且不影响后续的自体造血干细胞动员及采集,目前已经被广泛的应用于多发性骨髓瘤患者中。
但是,该药物可导致严重的周围神经病变,临床表现为四肢“手套、袜套”样区域麻木及疼痛感,严重者可进一步导致瘫痪等严重并发症。
根据欧美国家的报道,硼替佐米导致的周围神经病变(Bortezomib-induced peripheral neuropathy,BIPN)发生率为30-40%[2],在东亚地区的发生率也与其类似[3]。
在欧美国家近期的临床研究中,尝试使用皮下注射硼替佐米以减轻其神经系统毒性,结果发现相比于静脉注射,皮下注射可以显著减少BIPN的发生率(38% vs 53%,P<0.05),与此同时,原发疾病的缓解率无明显改变[4]。
在中国,类似研究结果尚非常缺乏,对硼替佐米皮下注射的剂量、浓度、护理要求等尚无明确指南。
根据硼替佐米说明书,该药可用无菌生理盐水配置成最高浓度2.4mg/ml,在临床实践中,静脉注射浓度通常为1mg/ml,本中心根据皇家阿尔弗雷德王子医院骨髓瘤临床护理专家建议,采取静脉注射浓度,腹部轮换皮下注射,减轻不良反应的产生,在中国人群中评估其安全性及有效性,为进一步临床应用及护理规范提供支持。
1 材料及方法1.1 患者一般资料自2013年1月1日至2013年12月31日,浙江大学医学院附属第一医院多发性骨髓瘤诊治中心患者,入组标准为:1、多发性骨髓瘤患者,初诊时无明显外周神经病变表现,不需接受维持性肾脏替代治疗;2、接受至少1疗程静脉注射硼替佐米为基础的化疗治疗,原发疾病完全缓解或部分缓解(采用国际骨髓瘤工作组疗效标准[5]),需继续使用硼替佐米治疗;3、发生BIPN临床表现。
硼替佐米化疗方案治疗多发性骨髓瘤的近期疗效及相关因素分析

•3900«Mod Diagn Treat现代诊断与治疗2020Dec31(24)[2]翟华季,吴帆,张云飞•胺碘酮联合比索洛尔治疗冠心病室性心律失常患者疗效及可行性研究[J].现代医药卫生,2019,35⑶:426-42&[3]徐鹤•胺碘酮用于冠心病慢性心力衰竭合并室性心律失常的疗效分析[J].中国现代药物应用,2020,14(4):106-107.[4]朱顺海.门冬氨酸钾镁联合胺碘酮治疗冠心病室性心律失常的疗效以及对心电图PR间期和QRS时限的影响[J].临床医药文献电子杂志,2018,5(39):139-149.[5]薛瑁,吉鹏•评价胺碘酮治疗冠心病室性心律失常疗效与安全性[J].中西医结合心血管病杂志(电子版),2019,7(7):46-47.[6]黄小凤,谭小强•胺碘酮治疗冠心病慢性心力衰竭患者室性心律失常的效果[J]现代医学与健康研究,2018,2(21):67-6&[7]庞占琪,王涛,杨健.盐酸胺碘酮治疗冠心病室性心律失常的临床效果分析[J]冲国现代药物应用,2020,14(2):114-115.[8]张晓君,李莉,赵丽红.门冬氨酸钾镁联合胺碘酮治疗冠心病室性心律失常的疗效以及对心电图PR间期和QRS时限的影响[J].中国农村卫生,201&]50(24):93.[9]赵翌瑾,袁浩钧,孙清平.门冬氨酸钾镁联合胺碘酮治疗冠心病室性心律失常的临床疗效及其对心电图的影响[J].临床合理用药杂志, 2020,13(12):50-51.[10]冯圣娇,陈鹤•门冬氨酸钾镁与胺碘酮联合治疗急性心肌梗死并发室性心律失常的疗效观察[J].中国医院用药评价与分析,2018,18(3):354-355.[11]王艳英,王荣军•门冬氨酸钾镁联合胺碘酮治疗急性心肌梗死伴室性心律失常的疗效及安全性分析[J]•临床医药文献电子杂志, 2018,5(65):89-92.收稿日期:2020-08-14硼替佐米化疗方案治疗多发性骨髓瘤的近期疗效及相关因素分析谭卡I,何深打王瑾2(1.开封市中心医院血液内科;2.开封市第六人民医院感染科,河南开封475000)摘要:目的分析硼替佐米化疗方案治疗多发性骨髓瘤(MM)的近期疗效及相关因素。
神经痛或周围感觉神经病变的硼替佐米剂量调整-中国临床试验注册中心

研究者发起的临床研究硼替佐米+环磷酰胺+地塞米松(BCD)方案与硼替佐米+沙利度胺+地塞米松(BTD)治疗初治的AL淀粉样变性的随机对照研究研究方案研究方案编号:申办者:版本:日期:保密声明本文件包含的相关信息涉及商业机密和商业信息,这些商业信息属于保密内容或专有信息,若非法规要求,任何人不得擅自公开这些保密内容。
任何接触到该文件的个人应当了解文件的专有性或机密性,并不得擅自公开文件。
以上文件保密方面的限制条款将适用于未来提供给你的任何注明具有专有性或机密性的资料研究者同意本人已经认真阅读了本试验方案,并认可该方案涵盖了执行试验所需的所有必要内容。
本人将依据研究方案进行试验,并在指定时间内完成研究。
本人将向协助本人进行此次研究的所有人员提供本研究方案和全部相关资料的复本。
我将同他们就这些材料进行讨论,以确保他们完全了解有关试验药物及如何进行试验。
研究者签字:日期:________________________ 研究者姓名(打印或者印刷):_________________________研究单位名称及地址:___________________________________________电话号码:______________________________合作研究者签字:日期:______________________合作研究者签名(打印或者印刷):_____________________电话号码:_____________________*在进行试验期间如果研究者地址或电话号码改变,研究者会以书面形式发给申办者,并不需要修改方案。
摘要目的:评估硼替佐米+环磷酰胺+地塞米松(BCD)方案与硼替佐米+沙利度胺+地塞米松(BTD)治疗初治的原发系统性(AL型)淀粉样变性的疗效与安全性的差异。
研究设计概述:本研究为多中心、随机对照的临床研究,计划纳入120例初治的AL型淀粉样变性患者(每组60例),主要是为了评估硼替佐米+环磷酰胺+地塞米松(BCD)方案与硼替佐米+沙利度胺+地塞米松(BTD)治疗初治的AL型淀粉样变性的疗效与安全性的差异。
硼替佐米

给药过程护理
选择较粗直,且离心脏较近的血管建立静 脉通道,确信静脉穿刺成功、输液通畅后, 取0.9%氯化钠注射液3.5 ml稀释一瓶硼替 佐米(3.5 mg)。硼替佐米疗效确切,但 价格不菲,须严格掌握用法及用量,根据 患者体表面积吸取1.3 mg/m2所需剂量的硼 替佐米,3 s内快速静注体内,用药前后用 生理盐水冲洗静脉通道,既可保护好血管, 减轻药物刺激,又可避免与其他药物混合, 发生不良反应。
【不良反应】
主要副作用有周围神经病变,如肢体麻木、 感觉异常等,发生率在30%左右,停药后 可基本恢复正常或明显改善。其他常见副 作用有疲劳,血小板减少,贫血,中性粒 细胞减低,易发生感染,恶心、呕吐、腹 泻、便秘等胃肠道反应,患者多可耐受, 且停药后恢复正常。
【禁忌】
对硼替佐米、硼或者甘露醇过敏的患者禁 用。
硼替佐米是26S蛋白酶体抑制剂,通过阻 断细胞内多种调控细胞凋亡及信号传导的 蛋白质的降解,导致肿瘤细胞死亡。
【适应症】
用于多发性骨髓瘤患者的治疗,此患者在使用 本品前至少接受过两种治疗,并在最近—次治疗 中病情还在进展。硼替佐米对多种肿瘤,尤其是 血液肿瘤中的多发性骨髓瘤、套细胞型淋巴瘤及 其他B细胞类型淋巴瘤(弥漫大B细胞型、滤泡细 胞型、小淋巴细胞型/慢性淋巴细胞白血病、边 缘区淋巴瘤)、霍奇金淋巴瘤有较强的抗肿瘤活 性。另外,硼替佐米与化疗药物联合应用治疗急 性髓细胞性白血病、急性淋巴细胞白血病、成人 T淋巴细胞白血病、浆细胞白血病均取得不同程 度疗效,目前处于临床试验阶段
药物不良反应的观察及护理
消化道反应 表现为恶心、食欲下降甚至 呕吐,偶可出现轻度的腹痛、腹泻。对出 现上述症状的患者在应用下一剂量硼替佐 米治疗前,可给予止吐剂,如盐酸格拉司 琼3 mg,静滴,严重胃肠道反应者还可加 用奥美拉唑40 mg静滴,以减轻消化道不 良反应。同时嘱患者清淡饮食,少食多餐, 并注意清洁饮食,以避免加重可能出现的 胃肠道严重反应。
硼替佐米的波谱学数据解析

硼替佐米的波谱学数据解析冯小虎;于水涛;夏正君;陈再新【摘要】Ultraviolet (UV) spectrum, infrared (IR) spectrum, electrospray ionization-mass spectra (ESI-MS) and nuclear magnetic resonance (NMR) spectra (i.e., 1H NMR, 13C NMR, DEPT, 1H-1H COSY, 1H-13C HSQC and1H-13C HMBC) of bortezomib were collected and interpreted. All 1H and 13C NMR signals were assigned. The structure of the compound was preliminarily determined.%对抗肿瘤药硼替佐米的紫外吸收光谱(UV)、红外吸收光谱(IR)、电喷雾离子源-质谱(ESI-MS)、核磁共振(NMR)波谱(包括1H NMR、13C NMR、DEPT、1H-1H COSY、1H-13C HSQC和1H-13C HMBC)数据进行了解析,对其1H和13C NMR谱峰进行了全归属,通过多种谱学技术确证了硼替佐米的结构.【期刊名称】《波谱学杂志》【年(卷),期】2017(034)001【总页数】9页(P43-51)【关键词】核磁共振(NMR);归属;紫外光谱;红外光谱;硼替佐米;结构确证【作者】冯小虎;于水涛;夏正君;陈再新【作者单位】亚邦医药研究院,江苏常州 213145;亚邦医药研究院,江苏常州213145;亚邦医药研究院,江苏常州 213145;亚邦医药研究院,江苏常州 213145【正文语种】中文【中图分类】O482.53硼替佐米(bortezomib),商品名万珂(Velcade),是由美国Millennium制药公司研发的新型抗肿瘤药物.该药是26S蛋白酶体抑制剂,通过阻断细胞内多种调控细胞凋亡及信号传导的蛋白质的降解,导致肿瘤细胞死亡.2003年5月,硼替佐米获得美国药品与食品管理局(FDA)批准在美国上市,用于难治性、复发性多发性骨髓瘤(MM)的治疗.由于硼替佐米对初治多发性骨髓瘤也具有显著疗效,目前已成为多发性骨髓瘤的首选治疗药物.硼替佐米具有两个手性中心,化学式为C19H25BN4O4,化学名为[(1R)-3-甲基-1-[[(2S)-1-氧-3-苯基-2-[(吡嗪羧基)氨基]丙基]氨基]丁基]硼酸,其结构式如图1所示.目前关于硼替佐米的合成、药理及临床研究方面的文献报道较多[1-11],但未见有文献对其核磁共振氢谱(1H NMR)和核磁共振碳谱(13C NMR)信号进行全归属,并且没有文献结合二维NMR波谱进一步验证1H和13C NMR信号归属的正确性[12-18].本文测定了硼替佐米的紫外吸收光谱(UV)、红外吸收光谱(IR)、NMR波谱(包括1H NMR、13C NMR、DEPT、1H-1H COSY、1H-13C HSQC 和1H-13C HMBC)、电喷雾离子源-质谱(ESI-MS),对其所有的1H和13C NMR信号进行了归属,讨论了红外特征吸收峰所对应的官能团的振动形式,从而较完整提供了的硼替佐米的波谱数据和结构信息,为其进一步研究提供参考依据[19,20].1.1 仪器及试剂1.1.1 仪器紫外光谱采用岛津UV1601(日本岛津)测定.红外光谱采用NICOLET Impact 410型红外光谱仪(美国Nicolet公司)测定,KBr压片.质谱仪为Agilent 1100(美国Agilent公司).1H NMR、13C NMR、DEPT、1H-1H COSY、1H-13C HSQC和1H-13C HMBC谱均采用Bruker Avance AV 500型NMR谱仪(Bruker公司)测定,以DMSO-d6为溶剂,TMS为内标,二维谱采用反向检测探头.1H NMR的工作频率为500.13 MHz,90°脉冲宽度为9.8 μs,实验谱宽为6 009.6 Hz;13C NMR的工作频率为125.77 MHz,90°脉冲宽度为8.0 μs,实验谱宽为30 303.0 Hz;DEPT的工作频率及谱宽同13C NMR;1H-1H COSY 的F2(1H)和F1(1H)维的谱宽均为6 009.6 Hz,采样数据点阵t2×t1= 1 024×512,零填充后傅里叶变换点阵F2×F1= 2 048×1 042;HSQC的F2(1H)和F1(13C)维的谱宽分别为6 009.6 Hz和30 303.0 Hz,采样数据点阵t2×t1= 1 024×512;HMBC的F2(1H)和F1(13C)维的谱宽分别为6 009.6 Hz和30 303.0 Hz,JCH= 3.45 ms(JCH为一键碳氢偶合常数),采样数据点阵t2×t1= 1 024×256.1.1.2 试剂所用试剂均购自上海国药集团化学试剂有限公司,为分析纯.所有试剂均未经进一步提纯,直接使用.1.2 样品制备实验中的硼替佐米原料由亚邦医药研究院制备并提供.具体以3-甲基丁醛和R-(+)-1-苯乙胺为起始原料,通过缩合、选择性硼酸酯加成、氢化脱保护、与L-苯丙氨酸手性缩合、与2-羧基-吡嗪缩合和硼酸化等反应得到硼替佐米.利用高效液相色谱(HPLC)测试样品纯度为99.56%,符合结构鉴定所需的纯度.2.1 UV光谱分析样品分别以水溶液、0.1 mol/L盐酸(HCl)溶液、0.1 mol/L氢氧化钠(NaOH)溶液和甲醇为溶剂,其在中性水溶液中最大紫外吸收在270.0 nm,吸收带强度(摩尔吸收系数)为4 987.86,是由共轭π-π*或n→π*跃迁产生,表明分子中有芳环、羰基或共轭羰基存在;同时杂环中氮原子的未成键n电子的n→π*共轭作用产生的跃迁在270.0 nm附近也存在吸收.其酸性(0.1 mol/L HCl溶液)、碱性溶液(0.1 mol/L NaOH溶液)以及甲醇溶液中的紫外光谱与中性水溶液紫外光谱基本一致,表明硼替佐米分子中的生色团与助色团在不同pH环境中比较稳定.2.2 IR光谱分析红外吸收光谱中,3 574 cm-1(νO-H)表明分子中存在羟基.3 461 cm-1、3 299 cm-1(νN-HCO-NH)、1 656 cm-1(νC=OCO-NH)、1 523 cm-1(δN-HCO-NH)表明分子中仲酰胺结构片段的存在;3 009 cm-1、3 015 cm-1、3 034 cm-1(νC-HArH)(注:Ar表示芳环,下同)3个较弱的特征吸收峰,表明分子中存在芳环,可能是苯环和或芳杂环;1 600 cm-1、1 585 cm-1、1 500 cm-1、1 450 cm-1(νC=CPh)(注:Ph表示苯环,下同)是典型的苯环骨架振动吸收峰;702 cm-1(δC-HPh)进一步表明单取代苯环的存在;1 610 cm-1(νC=NPy)(注:Py表示吡嗪环,下同)表明分子中可能存在吡嗪环结构;2 955 cm-1(νC-HCH3)、2 928 cm-1(νC-HCH2)、1 467 cm-1(δC-HCH2)、1 397 cm-1(δC-HCH3)表明分子中存在CH3和CH2.具体的红外光谱数据及归属见表1.2.3 MS数据分析硼替佐米质谱采用ESI电离源,正离子检测的准分子离子峰质荷比(m/z)为407.4 [M+Na]+,负离子检测的准分子离子峰m/z为383.5[M-H]-.硼替佐米分子式为C19H25BN4O4,精确分子量为384.196 9,因此实际测量值与理论分子量一致.2.4 NMR谱图分析2.4.1 1H NMR和1H-1H COSY谱图分析结合1H-1H COSY谱图(图2)和文献[17,18],1H NMR谱中给出14组质子信号分析如下:高场区δH0.75 (3H, d, J = 2.2 Hz)和δH0.77(3H, d, J = 2.2 Hz)被归属为两组甲基质子,受邻位次甲基质子的偶合影响,均裂分为双重峰,由于受到邻近的硼酸羟基范德华力的弱去屏蔽效应影响,距离羟基较近的甲基略移向低场,因此δH0.75归属为H-10,δH0.77归属为H-11.δH1.20(1H, m)和δH1.31(1H, m)被归属为H-8a或H-8b,由于受邻位手性碳原子的影响,产生较大的同碳偶合,同时受邻近位即2位和9位质子的偶合作用,均裂分为多重峰.在1H-1H COSY谱中,δH1.55(1H, m)与H-8a、H-8b、H-10和H-11相关,因此被归属为H-9,受邻近位H-8a、H-8b、H-10和H-11的偶合作用,裂分为多重峰.在1H-1H COSY谱中,δH2.65(1H, m)与H-3、H-8a和H-8b相关,被归属为H-2,受邻位H-8a、H-8b以及H-3的偶合作用,裂分为多重峰.δH8.84(1H, br)在1H-1H COSY中与H-2相关,加D2O进行氢-氘(H-D)交换后,信号消失,因此被归属为活泼的酰胺质子H-3.δH3.08~3.18(2H, m)由于受到邻位手性碳原子的影响,产生较大的同碳偶合,同时受邻近位质子的偶合作用,裂分为多重峰,被归属为H-12.在1H-1H COSY谱中,δH4.93(1H, dd, J = 14.0, 8.4 Hz)与H-12相关,被归属为H-5.同时,δH4.93在1H-1H COSY中与δH8.87(1H, br)相关,而且在加入D2O进行H-D交换后,δH8.87信号消失,因此δH8.87(1H, br)被归属为活泼的酰胺质子H-6.在1H-1H COSY谱中,δH7.13(1H, t, J = 7.0 Hz)、δH7.19(2H, dd, J = 7.0, 7.2 Hz)和δH7.23(2H, d, J = 7.2 Hz)构成了一个质子偶合体系,根据化学位移和质子个数,被归属为苯环上的质子(H-14~18),其中H-14与H-18是磁等价质子,H-15与H-17是磁等价质子;受H-15与H-17的共同影响,H-16被裂分为三重峰,因此δH7.13(1H, t, J =7.0 Hz)被归属为H-16;受H-15和H-17的影响,H-14或H-18裂分为双重峰,因此δH7.23(2H, d, J =7.2 Hz)被归属为H-14或H-18;受H-16与H-14或H-18的影响,H-15或H-17被裂分为两个双重峰,因此δH7.19(2H, dd, J = 7.0, 7.2 Hz)被归属为H-15或H-17.在1H-1H COSY谱中,δH8.85(1H, br)与δH8.71(1H, br)强相关,而与δH9.09(1H, br)弱相关,因此δH8.85(1H, br)被归属为H-22;根据与H-22相关信号的强弱,δH8.71(1H, br)被归属为H-21,δH9.09(1H, br)被归属为H-24.具体的1H NMR和1H-1H COSY数据及归属见图2与表2.2.4.2 13C NMR,DEPT,HSQC和HMBC谱图分析13C NMR和DEPT图谱(图3)表明,该分子结构中含2个伯碳——δC22.4和δC22.8,2个仲碳——δC37.2和δC39.8,11个叔碳——δC24.9、δC42.8、δC51.6、δC126.4、δC128.0(包含2个碳原子)、δC129.2(包含2个碳原子)、δC143.2、δC143.4和δC147.6,4个季碳——δC136.8、δC144.0、δC162.4和δC172.7.δC22.4在1H-13C HSQC谱(图4)中与H-10直接相关,1H-13C HMBC谱(图5)显示其与H-8、H-9、H-11有远程相关,被归属为C-10.δC22.8在HSQC谱中与H-11直接相关,HMBC谱显示其与H-8、H-9、H-10有远程相关,被归属为C-11.δC24.9在HSQC谱中与H-9直接相关,HMBC谱显示其与H-2、H-8、H-10、H-11有远程相关,被归属为C-9.δC37.2在HSQC谱中显示与H-12相关,该亚甲基中两个质子为磁不等价核,HMBC谱显示其与H-5、H-6、H-14(或H-18)有远程相关,被归属为C-12.δC39.8在HSQC谱显示与H-8a和H-8b相关,该亚甲基中两个质子也为磁不等价核,HMBC谱显示其与H-2、H-9、H-10、H-11有远程相关,归属为C-8.δC42.8在HSQC谱中显示与H-2相关,HMBC谱显示其与H-3、H-8、H-9有远程相关,由于受邻位硼原子的影响,13C NMR信号峰较弱,被归属为C-2.δC51.6在HSQC谱显示与H-5相关,HMBC谱显示其与H-6和H-12有远程相关,被归属为C-5.δC126.4在HSQC谱中显示与H-16直接相关,HMBC谱显示其与H-14(H-18)和H-15(H-17)有远程相关,被归属为C-16.δC128.0在HSQC谱中显示与H-15(H-17)直接相关,HMBC谱显示其与H-14(H-18)、H-16有远程相关,由于取代苯环对称性,两个13C核化学位移相同,被归属为C-15和C-17.δC129.2在HSQC谱中显示与H-14(H-18)直接相关,HMBC谱显示其与H-12、H-15(H-17)、H-16有远程相关,被归属为C-14和C-18.δC136.8在HSQC谱中无相关信号,HMBC谱显示其与H-5、H-12、H-14(H-18)、H-15(H-17)有远程相关,被归属为C-13.δC143.2在HSQC谱中与H-21直接相关,HMBC谱显示其与邻位H-22有远程相关,与对位H-24没有远程相关,被归属为C-21.δC143.4在HSQC谱中与H-24相关,HMBC谱显示其与间位H-22有远程相关,与对位H-21没有远程相关,被归属为C-24.δC144.0在HSQC谱中无相关信号,HMBC谱显示其与H-21、H-24有远程相关,被归属为C-19.δC147.6在HSQC谱中与H-22相关,HMBC谱显示其与邻位H-21,间位H-24有远程相关,被归属为C-22.δ 162.4在HSQC 谱中无相关信号,HMBC谱显示其与H-5、H-6、H-24有远程相关,被归属为C-7.δC172.7在HSQC谱中无相关信号,HMBC谱显示与H-2、H-3、H-5、H-6、H-12有远程相关,被归属为C-4.具体的13C NMR、DEPT、HSQC和HMBC数据及归属见图3、图4、图5与表3.通过UV、IR、ESI-MS、1H NMR、13C NMR、DEPT、1H-1H COSY、1H-13C HSQC和1H-13C HMBC等谱图的测定和解析,对硼替佐米的结构进行了全面地分析和验证.通过ESI-MS确定了硼替佐米的分子式;紫外吸收图谱显示出特征官能团;红外光谱给出各基团的特征吸收;通过NMR谱的测定和解析,对硼替佐米的1H和13C NMR信号进行了全归属,从而确证了硼替佐米的结构.【相关文献】[1] LAWRENCE J M, JACK H L, WENGEN W, et al. Chemical and biological evaluation of dipeptidyl boronic acid proteasome inhibitors for use in prodrugs and pro-soft drugs targeting solid tumors[J]. J Med Chem, 2011, 54(13): 4365-4377.[2] JANCA, MICHAL, DOBROVOLNY, et al. Methods for preparing bortezomib and intermediates used in its manufacture: WO, 004350[P]. 2009-01-09.[3] LI Z, MAO H, ZHONG J F. Graphical synthetic routes of bortezomib[J]. Chinese Journal of Pharmaceuticals, 2012, 43(5): 393-395.李忠, 毛化, 钟静芬. 硼替佐米合成路线图解[J]. 中国医药工业杂志, 2012, 43(5): 393-395.[4] MELISSA A B, CHIHUI A, JONATHAN A E. Asymmetric copper-catalyzed synthesis of γ-amino boronate esters from N-tert-butanesulfinyl aldimines[J]. J Am Chem Soc, 2008,130(22): 6910-6911.[5] FU L H, WANG L, YU Y C, et al. Induction of acute myelogenous leukemia cell apoptosis by bortezomib and its effect on SALL4 geneExpression[J]. Chin Pharm J, 2012, 47(4):274-278.傅雷华, 王兰, 喻依川, 等. 硼替佐米诱导急性髓性白血病细胞凋亡及对SALL4基因表达的影响[J]. 中国药学杂志, 2012, 47(4):274-278.[6] PICKERSGILL I F, BISHOP J, KOELLNER C, et al. Synthesis of boronic ester and acid compounds: WO, 097809[P]. 2005-10-20.[7] PALLE, RAGHAVENDRACHARYULU V, KADABOINA, et al. Bortezomib and process for producing same: WO, 036281[P]. 2009-03-19.[8] 赛福伦公司. 蛋白酶体抑制剂及其制备、纯化和应用的方法:中国, 102725300 A [P], 2012-10-10.[9] BRUCE D D, MOHAMED I, SANKAR C, et al. Discovery of a potent, selective, and orally active proteasome inhibitor for the treatment of cancer [J]. J Med Chem, 2008, 51(4):1068-1072.[10] MARINE P, MARIE-AGNÈS L, JEAN S, et al. Further characterization of a putative serine protease contributing to the c-secretase cleavage of b-amyloid precursor protein[J]. Bioorg Med Chem, 2013, 21(4): 1018-1029.[11] RAO, DHARMARAJ, RAMACHANDRA, et al. Process for preparing of bortezomib:WO, 041324[P]. 2014-03-20.[12] CONG Y W, LUAN C F, CHEN H, et al. Synthesis of bortezomib[J]. Chinese Journal of New Drugs, 2014, 23(6): 698-700.丛艳伟, 栾春芳, 陈宏, 等. 硼替佐米的合成[J]. 中国新药杂志, 2014, 23(6): 698-700.[13] 千禧药品公司. 硼的酯和酸化合物的合成:中国, 200580017645.5 [P], 2007-05-09.[14] 孙江涛. 一种硼替佐米的合成方法:中国, 101812026 B [P], 2013-08-28.[15] ANDREY S I, ANNA A Z SERGEY V S. A convergent approach to synthesis of bortezomib: the use of TBTU suppresses racemization in the fragment condensation[J]. Tetrahedron, 2009, 65(34): 7105-7108.[16] SATISH K, VENUGOPAL V D, PARENDU D R, et al. Process for the Preparation of Bortezomib: US, 0085277[P]. 2013-04-04.[17] ZHENG D Q, ZHANG L J, ZHANG Z Y. Synthesis of bortezomib[J]. Chinese Journal ofPharmaceuticals, 2015, 46(3): 227-229.郑德强, 张利剑, 张治云. 硼替佐米的合成[J]. 中国医药工业杂志, 2015, 46(3): 227-229.[18] JI A C, HAN H, WANG C Q, et al. Synthesis of bortezomib[J]. Pharmaceutical and Clinical Research, 2014, 22(2): 121-123.纪安成, 韩航, 王超群, 等. 硼替佐米的合成工艺改进[J]. 药学与临床研究, 2014, 22(2): 121-123.[19] 宁永成. 有机化合物结构鉴定与有机波谱学[M]. 北京:科学出版社, 2000.[20] 赵天增. 核磁共振图谱[M]. 北京:北京大学出版社, 1982.。
硼替佐米

【注意事项】
万珂请在医生指导下使用。万珂为抗肿瘤药物,配制时应小心,戴手套操作以防皮肤接触。
【禁忌】
对硼替佐米、硼或者甘露醇过敏的患者禁用万珂。
【儿童用药】
儿童使用万柯药物,是否有副作用尚不明确。
【老年用药】
参加万珂临床试验的202名患者中,35%的患者≥65岁。65岁以上和65岁以下患者的显效率分别为19%和32%。256名患者安全性分析显示,对于50岁以下患者、51—65岁患者、65岁以上患者,3级和4级不良事件的发生率分别为74%、80%和85%。
【药物过量】
万珂对猴子的心血管安全性药理学临床试验研究显示,静脉注射的致死量与血压下降、心率增加、收缩力增加,及末梢致死性低血压有关。给猴子注射万珂3.0mg/m2或更高剂量(约为临床推荐剂量的2倍),在给药后1小时出现进行性低血压,12~14小时内死亡。
在临床试验中,尚无药物过量的报告。给成人注射的最高剂量达到每周2.0mg/m2。如药物过量,应监测患者的生命体征,并采取适当的支持治疗以维持血压和体温。
万珂尚无特殊的解救药。
【
贮藏】
万珂在25℃(15~30℃)避光处保存。
【包装】
1瓶/盒;32瓶/箱
【有效期】
24个月
【生产企业】
万珂厂家1:Ben Venue Laboratories Inc. (美国)
注册证号:BH20050308 规格: 3.5mg 包装规格: 32瓶/箱
分包装企业名称 西安杨森制药有限公司
国药准字:J20050042 规格: 3.5mg 包装规格: 1瓶/盒
硼替佐米+地塞米松联合血液透析治疗多发性骨髓瘤肾病的临床研究

硼替佐米+地塞米松联合血液透析治疗多发性骨髓瘤
肾病的临床研究
谢先顺,丁婷*,陈艳华,王柏琦 南华大学附属第二医院肿瘤血液内科,湖南 衡阳 421001 [摘要] 目的:研究硼替佐米+地塞米松(VD方案)联合血液透析(HD)治疗多发性骨髓瘤肾病的临床效果,旨在为更好地治疗多发性骨髓瘤肾 病患者提供有效的理论依据。方法:回顾性分析2016年1月至2018年1月我院收治的40例多发性骨髓瘤肾病患者的临床资料,按不同治疗方 法将其分成对照组和研究组(每组20例)。对照组给予VD方案治疗,研究组在对照组的基础上联合血液透析(HD)治疗。观察并比较两组患 者临床疗效、血清肌酐、血钙、血尿酸、血清免疫球蛋白、轻链蛋白定量水平以及不良反应的具体情况。结果:研究组患者治疗后临床总 有效率显著高于对照组(95.00% vs 70.00%)(P<0.05);治疗后,研究组与对照组血清肌酐、血钙、血尿酸等指标水平均较治疗前明显降低, 且研究组各指标降低程度大于对照组(P<0.05);治疗后,两组血清免疫球蛋白水平与治疗前比较明显下降(P<0.05),研究组轻链蛋白定量水 平降低程度大于对照组(P<0.05);对照组不良反应发生率高于研究组(30.00% vs 5.00%)(P<0.05)。结论:VD方案联合HD对多发性骨髓瘤肾 病患者具有良好的临床疗效,能明显改善多发性骨髓瘤肾病患者临床症状以及相关指标水平,且安全性高。 [关键词] 硼替佐米;地塞米松;血液透析;多发性骨髓瘤肾病;临床价值 [中图分类号] R983 [文献标识码] A [文章编号] 1672-2809(2019)09-00
Myeloma Nephropathy with VD regimen (Bortezomib
神经痛或周围感觉神经病变的硼替佐米剂量调整-中国临床试验注册中心

研究者发起的临床研究硼替佐米+环磷酰胺+地塞米松(BCD)方案与硼替佐米+沙利度胺+地塞米松(BTD)治疗初治的AL淀粉样变性的随机对照研究研究方案研究方案编号:申办者:版本:日期:保密声明本文件包含的相关信息涉及商业机密和商业信息,这些商业信息属于保密内容或专有信息,若非法规要求,任何人不得擅自公开这些保密内容。
任何接触到该文件的个人应当了解文件的专有性或机密性,并不得擅自公开文件。
以上文件保密方面的限制条款将适用于未来提供给你的任何注明具有专有性或机密性的资料研究者同意本人已经认真阅读了本试验方案,并认可该方案涵盖了执行试验所需的所有必要内容。
本人将依据研究方案进行试验,并在指定时间内完成研究。
本人将向协助本人进行此次研究的所有人员提供本研究方案和全部相关资料的复本。
我将同他们就这些材料进行讨论,以确保他们完全了解有关试验药物及如何进行试验。
研究者签字:日期:________________________ 研究者姓名(打印或者印刷):_________________________研究单位名称及地址:___________________________________________电话号码:______________________________合作研究者签字:日期:______________________合作研究者签名(打印或者印刷):_____________________电话号码:_____________________*在进行试验期间如果研究者地址或电话号码改变,研究者会以书面形式发给申办者,并不需要修改方案。
摘要目的:评估硼替佐米+环磷酰胺+地塞米松(BCD)方案与硼替佐米+沙利度胺+地塞米松(BTD)治疗初治的原发系统性(AL型)淀粉样变性的疗效与安全性的差异。
研究设计概述:本研究为多中心、随机对照的临床研究,计划纳入120例初治的AL型淀粉样变性患者(每组60例),主要是为了评估硼替佐米+环磷酰胺+地塞米松(BCD)方案与硼替佐米+沙利度胺+地塞米松(BTD)治疗初治的AL型淀粉样变性的疗效与安全性的差异。
