物化相平衡总复习题库48页PPT
物理化学-相平衡习题汇总

第5章 相平衡复习、讨论基本内容:➢ 相:体系内部物理性质和化学性质完全均匀的一部分。
气相、液相、固相 ➢ 相数:体系内相的数目Φ≥1➢ 相图:描述多相体系状态随浓度、温度、压力等变量的改变而发生变化的图形➢ 均相体系:只有一相的体系Φ=1 ➢ 多相体系:含多相的体系Φ>1➢ 凝聚体系:没有(或不考虑)气相的体系 ➢ 物系点:相图中表示体系总组成的点 ➢ 相点:表示某一个相的组成的点➢ 液相线:相图中表示液相组成与蒸气压关系的曲线 ➢ 气相线:相图中表示气相组成与蒸气压关系的曲线 ➢ 步冷曲线:冷却过程温度随时间的变化曲线T-t➢ 独立组分数:C = S - R - R',S 为物种数,R 为体系中各物种之间独立的化学平衡关系式个数,R’为浓度和电中性限制条件的数目。
对于浓度限制条件,必须是某个相中的几种物质的浓度之间存在某种关系时才能作为限制条件。
C=1单组分体系,C=2二组分体系。
若没有化学变化:C=S ;含单质的体系且R ’=0:C=N ;含单质的体系且S>N :R = S – N 。
➢ 自由度:确定平衡体系状态所需要的独立强度变量的数目f ≥0➢ 最低(高)恒沸点:对拉乌尔定律正(负)偏差很大的双液系的T —x 图上的最低(高)点。
恒沸点时气相组成与液相相同,具有纯物质的性质,一定压力下恒沸混合物的组成为定值(f*=C-Φ+1=1-2+1=0)。
➢ 最低(高)恒沸混合物:最低(高)恒沸点对应的混合物。
恒沸物是混合物而不是化合物➢ 会溶温度(临界溶解温度):部分互溶双液系相图上的最低点或最高点 ➢ 转熔温度:不稳定化合物分解对应的温度➢ 共轭层:部分互溶双液系相图上的帽形区内溶液为两层➢ 相律:平衡体系中相数、独立组分数与变量数之间的关系f = C - Φ + n ➢ 杠杆规则:液相的物质的量乘以物系点到液相点的距离,等于气相的物质的量乘以物系点到气相点的距离。
Bn BBn n l ×(X B -x B )=n g ×(y B -X B )单组分体系相图(p-T):水、CO 2、C二组分体系相图(T-x):液-液体系:简单的低共熔混合物形成化合物稳定的化合物不稳定的化合物形成固溶体完全互溶固溶体部分互溶固溶体有一低共熔点有一转熔温度完全互溶理想的非理想偏差不很大正偏差很大 负偏差很大部分互溶具有最高会溶温度具有最低会溶温度同时有最高和最低会溶温度没有会溶温度不互溶液-固体系:基本要求:1. 明确基本概念(相、相数、组分数、自由度;S 、R 、R ’、f 、C 、Φ)2. 能熟练运用相律f=C-Φ+n (n 通常为2,在限制T 或p 时<2,也可能>2,见后面例题“NaCl 水溶液与纯水达成渗透平衡”)3.会用杠杆规则(适用于任何两相区)求两相平衡体系中两相的组成和量4.熟悉二组分体系的相图(会确定图中点、线、面的相态、相数、自由度等)5.熟悉相图规律、基本相图➢两相区的两侧是两个不同的单相区,两相区包含的两种相态就是两个单相区的相态➢三相线的两端分别顶着两个单相区、中间与另一个单相区相连➢在临界点以下,任何两个相数相同的相区都不可能上下相邻(相区交错规则)6.能够由步冷曲线画相图,或由相图画步冷曲线(相图中的两相平衡线与步冷曲线的转折点对应;三相线与步冷曲线的平台对应)。
物化相平衡复习习题

选择题1. 二元恒沸混合物的组成(A)固定(B) 随温度而变(C) 随压力而变(D) 无法判断答案:C2. 一单相体系, 如果有3种物质混合组成, 它们不发生化学反应, 则描述该系统状态的独立变量数应为(A) 3个(B) 4个(C) 5个(D) 6个答案:B。
F=C-P+2=3-1+2=43.通常情况下,对于二组分物系能平衡共存的最多相为(A) 1 (B) 2 (C) 3 (D) 4答案:D。
F=2-P+2=4-P,F不能为负值,最小为零。
当F=0时P=4。
4.正常沸点时,液体蒸发为气体的过程中(A) ΔS=0 (B) ΔG=0 (C) ΔH=0 (D) ΔU=0 答案:B。
此为可逆过程故ΔG=0。
5. 以下各系统中属单相的是(A) 极细的斜方硫和单斜硫混合物(B) 漂白粉(C) 大小不一的一堆单斜硫碎粒(D) 墨汁答案:C。
6. NaCl(s), NaCl水溶液及水蒸汽平衡共存时, 系统的自由度(A) F=0 (B) F=1 (C) F=2(D) F=3 答案:B。
F=C-P+2,C=2,P=3,故F=2-3+2=1。
7. 如果只考虑温度和压力的影响, 纯物质最多可共存的相有(A) P=1 (B) P=2 (C) P=3(D) P=4答案:C。
F=C-P+2=1-P+2=3-P,当F最小为零时P=3。
7. 对于相律, 下面的陈述中正确的是(A) 相律不适用于有化学反应的多相系统(B) 影响相平衡的只有强度因素(C) 自由度为零意味着系统的状态不变(D) 平衡的各相中, 系统包含的每种物质都不缺少时相律才正确答案:B8. 关于三相点, 下面的说法中正确的是(A) 纯物质和多组分系统均有三相点(B) 三相点就是三条两相平衡线的交点(C) 三相点的温度可随压力改变(D) 三相点是纯物质的三个相平衡共存时的温度和压力所决定的相点答案:D9. 用相律和Clapeyron 方程分析常压下水的相图所得出的下述结论中不正确的是(A) 在每条曲线上, 自由度F=1 (B) 在每个单相区, 自由度F=2(C) 在水的凝固点曲线上, ΔHm(相变)和ΔVm的正负号相反(D) 在水的沸点曲线上任一点, 压力随温度的变化率都小于零答案:D10. 二组分系统的最大自由度是(A) F=1 (B) F=2 (C) F=3 (D) F=4答案:C。
物理化学 第六章 相 平 衡 课件

第六章相平衡§6-1 相律1.基本概念(1)相和相数相:系统中物理性质和化学性质完全相同的均匀部分称为相,系统中相数目为相数。
相数用“P”表示。
相的确定:气体:无论有多少种物质都为一相液体:根据相互的溶解性可为一相、二相、三相固体:由固体的种类及晶型决定(固熔体除外)(2)自由度和自由度数自由度:能够维系系统原有相数,而可以独立改变的变量叫自由度,这种变量的数目叫做自由度数,用“F”表示。
说明:a)在一定范围内,任意改变F不会使相数改变。
b)自由度数和系统内的物种数和相数有关。
2.相律物种数:系统中所含独立物质的数目,用“S”表示。
依据:自由度数=总变量数-非独立变量数=总变量数-方程式数相律表达式:F = C – P + 2式中C = S –R- R’称组分数R 独立反应的方程式数R’独立限制条件3.几点说明(1) 每一相中均含有S种物质的假设,不论是否符合实际,都不影响相律的形式。
(2) 相律中的2表示整体温度、压强都相同。
(3) F = C – P + 2是通常的形式。
(4) 凝聚相系统的相律是F = C – P + 1§6.2单组分系统相图相图:表示相平衡系统的组成与温度、压力之间的图形。
单组分系统一相:P=1 则F=1-1+2=2(T,P)双变量系统二相:P=2 则F=1-2+2=1(T或P)单变量系统三相:P=3 则F=1-3+2=0 无变量系统1.水的相平衡实验数据由数据可得:(1)水与水蒸气平衡,蒸气压随温度的升高而增大;(2)冰与水蒸气平衡,蒸气压随温度的升高而增大;(3)冰与水平衡,压力增大,冰的熔点降低;(4)在0.01℃和610Pa下,冰、水和水蒸气共存,三相平衡。
2. 水的相图单相区:液态水,水蒸气,冰双相线:OA —液固共存线,冰的熔点曲线OB —气固共存线,冰的饱和蒸气压曲线OC —气液共存线,水的饱和蒸气压曲线三相点:冰、水和水蒸气共存相图的说明(1) 冰在熔化过程中体积缩小,故水的相图中熔点曲线的斜率为负,但大多数物质熔点曲线的斜率为正。
物理化学第五章-相平衡PPT课件

第6页/共82页
5.2 相律
相律(phase rule)
F=C–P+2
相律是相平衡体系中揭示相数P ,独立组分数C和
自由度 F之间关系的规律,可用上式表示。式中2
通常指T,p两个变量。相律最早由Gibbs提出,所 以又称为Gibbs相律。如果除T,p外,还受其它力
场影响,则2改用n表示,即:
F=C–P+n
2021/7/14
第10页/共82页
水的相图
2021/7/14
第11页/共82页
水的相图
OA 是气-液两相平衡线,即水的蒸气压曲线。它 不能任意延长,终止于临界点。临界点T 647 K , p 2.2107 Pa ,这时气-液界面消失。高于临界温 度,不能用加压的方法使气体液化。
OB 是气-固两相平衡线,即 冰的升华曲线,理论上可延长 至0 K附近。
斜率为正。
OC线 dp H fus m
dT T V fus
fusH 0, fusV 0
斜率为负。
第20页/共82页
5.4 二组分理想液态混合物的气-液平衡相图
p-对x图于二和组分T体-x系图,C=2,F=4-P 。P至少为1,则 F
最多为3。这三个变量通常是T,p 和组成 x。所以要
表示二组分体系状态图,需用三个坐标的立体图表示。
在液相线和气相线之间的梭 形区内,是气-液两相平衡。
2021/7/14
第25页/共82页
T-x图
(2) T-x图 亦称为沸点-组成图。外压为大气压力,当溶
液的蒸气压等于外压时,溶液沸腾,这时的温度 称为沸点。某组成的蒸气压越高,其沸点越低, 反之亦然。
T-x图在讨论蒸馏时十分有用,因为蒸馏通常 在等压下进行。T-x图可以从实验数据直接绘制。 也可以从已知的p-x图求得。
物理化学课件第六章节相平衡

热力学性质测定
利用热力学仪器测量物质的热容、 熵、焓等热力学性质,推算相平衡 常数。
相分离实验
观察不同条件下物质是否发生相分 离,确定相平衡状态。
计算方法
热力学模型法
利用热力学模型计算相平衡常数, 如van der Waals方程、 Redlich-Kister方程等。
表达式
ΔU = Q + W
应用
计算封闭系统中能量的变化,以及热量和功之间的转换关系。
热力学第二定律
热力学第二定律定义
自然发生的反应总是向着熵增加的方向进行,即系统总是向着更 加混乱无序的状态发展。
表达式
ΔS ≥ 0
应用
判断反应自发进行的方向,以及热量传递和转换的方向。
热力学第三定律
热力学第三定律定义
液液相平衡的应用
液液相平衡是指两种不同物质液体之 间达到平衡状态的过程。
液液相平衡在工业上有广泛应用,如 石油工业中的油水分离、化学工业中 的萃取过程等。
液液相平衡的原理
当两种液体混合达到平衡时,各组分 的浓度不再发生变化,系统达到动态 平衡状态。
05 相平衡的实验测定与计算 方法
实验测定方法
蒸气压测定
分子模拟法
利用计算机模拟分子运动,计算 分子间的相互作用力和相平衡常
数。
统计力学法
利用统计力学原理计算相平衡常 数,如Maxwell
分子动力学模拟
模拟分子在相平衡状态下的运动轨迹,分析分子 间的相互作用和排列方式。
Monte Carlo模拟
通过随机抽样方法模拟分子在相平衡状态下的分 布和排列,计算相平衡常数。
界面张力
相界面上的物质传递是相平衡的重要特征之一,界面张力的大小对于物 质在相界面上的吸附、溶解和传递等过程具有重要影响。研究界面张力 有助于深入理解相平衡的机制和规律。
(物化课件)4.相平衡

f=C–P+2
* 式中 “2” 指的是温度和压力 * 定温过程或定压过程 f’ = C – P + 1
* 定温和定压过程 f’、 f ” ---- 条件自由度
f”=C–P
练习题: (1)在一个抽真空的容器中放有适量的H2O(l)、I2(l)和CCl4(l) 水和四氯化碳在液态时完全不互溶, I2可分别溶于水和CCl4(l) 中,容器上部气体中三者皆存在,达到平衡后此体系的
2)组分数C---- 足以确定平衡体系中所有各相组 成所需要的最少数目的独立物质的数量 (1≤C≤S)
注:独立组分的浓度在体系的各相中独立变 化而 不受其他物质的影响
C = S – R – R´
R --- 体系中独立的化学平衡数 (可以是化学反应、电离平衡、酸碱平衡、 沉淀溶解平衡、配位平衡, 但不包括相平衡 ). R´--- 体系中独立的浓度关系数 ( 注:只有 在同一相中才能用此条件)
1. 反应前只有HI . 2. 反应前有等物质的量的H2 (g) 和 I2 (g) . 3. 反应前有任意量的 H2 (g) , I2 (g) 和 HI (g) 解: 1. S = 3 , R = 1 , R´ = 1 , C = 1
2. S = 3 , R = 1 , R´ = 1 , C = 1 3. S = 3 , R = 1 , R´ = 0 , C = 2
例如: 水以单相存在时,
f=2
水和水蒸气两相平衡共存时, f = 1
水、冰、水蒸气三相共存时 , f = 0
T=273.16K P=611Pa
p/kPa C A
101.325
固 0.611
B
液 O气
0.0098
100 t / ℃
2020年整理物理化学(胡英)配套第4章相平衡4汇编PPT课件

lnP Pl R fHfm T 2,ATf (3) P / Pl = 1 xB 代入 (3):
ln1(xB)R fHfT m 2,ATf
(理想溶液或稀溶液) 稀溶液: 0 xB 1
ln (1xB) xB
ln1(xB)R fHfT m 2,ATf
ln (1xB) xB 代入上式:
Tf
复杂的二元液固相图
t* b, A
t* f, A
t* f, C
t
* b,
B
t
* f,
B
E2 E1
A
C
B
xB
由三个基本类型的相图组合而
成的较复杂的相图
读图要点:
把复杂的相图分 解为基本类型的 相图
1 2
3
4
5
7
8
6
9
练习
组分A与B可以形成以下几种稳定化合物:A2B, AB, AB2, AB3,则此A-B系统的低共熔点最多为 几个?并绘出恒压相图示意图。
ln P P A *sH R m ,( A T fT fT fT f) sH R m ,A f2 T T f …② (sHm,A:摩尔升华热)
lnPA * Pl
vH R m,A fT 2Tf
(1)
lnP PA * sH R m,A fT 2Tf (2)
① ②:
P ln
Pl
RfHT fm 2,ATf
纯溶剂和固态纯溶剂的蒸气压均为 PA*, 化学势相等,平衡可逆。 n Tf* 即为纯溶剂的凝固点。
• Tf 为溶液的凝固 点。在此温度下, 溶液和固态纯溶 剂的蒸气压均为 P,AC 线为过冷 液态纯溶剂的蒸 气压曲线。
• 由图看出,在溶液的凝固点 Tf,过冷纯液态 溶剂的蒸气压为 Pl 。
物理化学教学课件第五章相平衡

第三节 二组分系统的气-液平衡相图
(三)二组分完全互溶双液系相图的应用—— 精馏亦称分馏,是将二组分系统中完全互溶的组分A和B进行分离的一种工 艺,在工业上的应用非常广泛。其基本原理如图5-9所示。
第三节 二组分系统的气-液平衡相图
二、二组分液态部分互溶系统气-液平衡相图
当两种液体的化学性质差别 较大时,其相互溶解的情况与系 统的温度、压力和组成密切相关 ,在一定的温度、压力和组成范 围内两种液体可以完全互溶,也 可以部分互溶或者完全不互溶。
第三节 二组分系统的气-液平衡相图
A和B的气相组成分别用yA和yB表示,则有yA+yB=1。由式(5-12)可得
第三节 二组分系统的气-液平衡相图
2.杠杆规则 对组B进行物料衡算,则有
式(5-17)、式(5-18)均称为杠杆规则关系式。利用杠杆规则的 杠杆规则不仅对气液相平衡适用,在其他系统中的任意两相共存 区都成立,如液-液、液-固、固-固的两相平衡。
第三节 二组分系统的气-液平衡相图
三、二组分液态完全不互溶的气-液平衡相图
若两种液体的化学性质差别 很大,彼此间相互溶解的程度非 常小时,可以近似认为两液体完 全不互溶,如水汞、水二硫化碳
组成相图如图5-15所示。图中T*A 、TB*分别表示两个纯液态组分水 、汞的沸点。
第四节 二组分系统的固-液平衡相图
第四节 二组分系统的固-液平衡相
2.
第四节 二组分系统的固-液平衡相
2.
二组分固态部分互溶系 统相图还有具有一转熔温度( 转变温度)这种类型,如CdHg、Pt-W、AgCl-LiCl 系统,这类系统相图如图525所示。此相图形状与气相 组成位于两液相组成同一侧 的部分互溶二组分混合物的 气–液平衡相图相似。
物化第6章+相平衡

§6.1 相 律 相律用来确定相平衡系统中有几个独立改变的变量— 相律用来确定相平衡系统中有几个独立改变的变量 —自由度 自由度 一、自由度数 1、独立变量 相平衡系统发生变化时,系统的温度、压力及每 相平衡系统发生变化时,系统的温度、
个相的组成均可发生变化。但并不是说所有变量都是独立变量。 个相的组成均可发生变化。但并不是说所有变量都是独立变量。如 一个A 二组分系统,要想描述其组成,我们用一个x 即可, 一个A-B二组分系统,要想描述其组成,我们用一个xB即可,因为 另一个变量x =1- 具有一定的函数关系,它只有一个独立变量。 另一个变量xA=1-xB具有一定的函数关系,它只有一个独立变量。而 对一个三组分系统的组成则可用xA、xB来描述,而xC可以用xC=1-xA对一个三组分系统的组成则可用x 来描述, 可以用x =1表示,它有二个独立变量。类推可得一个相中若含有S xB表示,它有二个独立变量。类推可得一个相中若含有S种物质时 需要有S ,需要有S-1种物质的相对含量来描述该相的组成。
例如,纯水在气、液两相平衡时,温度、 例如,纯水在气、液两相平衡时,温度、压力均可以 改变,但其中只有一个变量(如T)可以独立改变,另一 改变,但其中只有一个变量( 可以独立改变, 个变量( 是不能独立改变的,它是前一个变量( 个变量(p)是不能独立改变的,它是前一个变量(T)的 函数,这个函数关系即克拉佩龙方程 克拉佩龙方程。 函数,这个函数关系即克拉佩龙方程。如果在温度改变时 压力变量不按函数变化,也独立改变, ,压力变量不按函数变化,也独立改变,则必然要有一个 相消失,而不能维持原有两相平衡。因此, 相消失,而不能维持原有两相平衡。因此,我们说这一系 统的自由度数为1 统的自由度数为1。 又如任一组成的二组分盐水溶液与水蒸气两相平衡系 可以改变的变量有三个:温度、 统,可以改变的变量有三个:温度、压力和盐水溶液的组 但水蒸气压力是温度和溶液组成的函数, 成。但水蒸气压力是温度和溶液组成的函数,或者说溶液 的沸腾温度是压力和溶液组成的函数。 的沸腾温度是压力和溶液组成的函数。故这个系统的自由 度数为2 度数为2。
物理化学 相平衡101页PPT

6
、
露
凝无游氛源自,天高风
景
澈
。
7、翩翩新 来燕,双双入我庐 ,先巢故尚在,相 将还旧居。
8
、
吁
嗟
身
后
名
,
于
我
若
浮
烟
。
9、 陶渊 明( 约 365年 —427年 ),字 元亮, (又 一说名 潜,字 渊明 )号五 柳先生 ,私 谥“靖 节”, 东晋 末期南 朝宋初 期诗 人、文 学家、 辞赋 家、散
53、 伟 大 的 事 业,需 要决心 ,能力 ,组织 和责任 感。 ——易 卜 生 54、 唯 书 籍 不 朽。——乔 特
55、 为 中 华 之 崛起而 读书。 ——周 恩来
文 家 。汉 族 ,东 晋 浔阳 柴桑 人 (今 江西 九江 ) 。曾 做过 几 年小 官, 后辞 官 回家 ,从 此 隐居 ,田 园生 活 是陶 渊明 诗 的主 要题 材, 相 关作 品有 《饮 酒 》 、 《 归 园 田 居 》 、 《 桃花 源 记 》 、 《 五 柳先 生 传 》 、 《 归 去来 兮 辞 》 等 。
1
0
、
倚
南
窗
以
寄
傲
,
审
容
膝
之
易
安
。
谢谢!
51、 天 下 之 事 常成 于困约 ,而败 于奢靡 。——陆 游 52、 生 命 不 等 于是呼 吸,生 命是活 动。——卢 梭
物理化学课件2013习题课 第五章相平衡

点,在T-x图上有最低恒沸点,见图(b) 。
(c)对Raoult定律产生负偏差,在p-x图上有最低点, 在T-x图上有最高恒沸点,见图(c) 。
(2)部分互溶双液系的气液平衡的T-x图如下,最常见 的为具有最高会溶点的类型,图中帽形区为单相区,ab 为连接线,c为物系点,a和b为相点,表示一对共轭溶 液的组成。
(1)图中l,s,g都是单相区,Φ =1,f=2,在一定范围内, 同时改变温度和压力,不会引起相数的变化。
(2)AO', BO', CO'线是两个面 的交界线,呈两相平衡, Φ = 2,f=1。温度和压力中只有一 个是可以独立变动的。这三条 线的斜率由Clapeyron方程算得:
dp H dT TV
f ΦCn
若温度和压力中有一个已经固定,则相律可表示为:
f*ΦC1
若温度和压力都固定,则相律为:
f**ΦC0
f*和f**称为条件自由度。相律是一个定性规律,它可 以指示相平衡系统中有几个相,但不能指出有哪些相。 相律可以指导如何去识别由实验绘制的相图。
二.单组分系统两相平衡
(1)Clapeyron方程
1. 部分互溶的三液体系统
(1)有一对部分互溶的三液体系统。帽形区内为两 相区,帽形区外为单相区,ab为连接线,a和b为相 点,表示一对共轭溶液的组成。O点为两相转变为一 相的临界点。如下图(a)所示。 (2)有两对部分互溶的系统。如下图(b)所示。 (3)有三对部分互溶的系统。如下图(c)所示。 此类相图在萃取分离过程中有重要作用。
所示。 (b)形成稳定化合物(又称具有相合熔点的化
合物),如下图(c)所示。 (c)形成不稳定化合物(又称具有不相合熔点
物化ppt课件专题培训
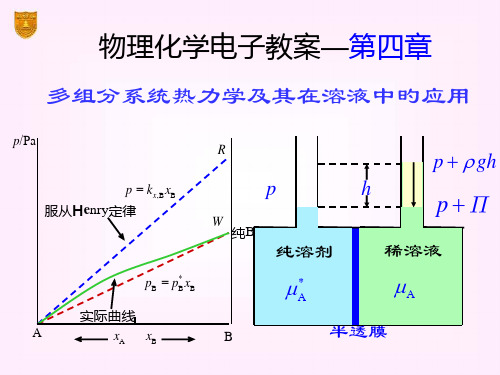
§4.2 多组分系统旳构成表达法
2. B旳质量分数 wB (Mass fraction of B)
wB def
m(B) mA
A
即B旳质量 m(B) 与混合物旳质量之比
wB 旳单位为1
§4.2 多组分系统旳构成表达法
3. B旳浓度 cB (又称为 B旳物质旳量浓度)
cB def
定义化学势
B
def
U ( nB )S,V ,nc (cB)
第一种基本公式就可表达为:
dU TdS pdV BdnB B
化学势旳定义
U U (S,V , n1, n2, , nk )
同理,
H H (S, p, n1, n2, , nk )
A A(T ,V , n1, n2, , nk )
Байду номын сангаас
B
G ( nB
)T , p,nc (cB)
化学势在判断相变和化学变化旳方向和程度方面
有主要作用。
化学势在相平衡中旳应用
设系统有α和β两相,在等温、等压下, β 相 中有极微量旳B种物质 dnB 转移到α相中
系统Gibbs自由能旳变化值为
dG dG dG B dnB B dnB
α相所得等于β相所失,即: dnB dnB
称为溶质B旳摩尔分数,又称为物质旳量分数。
摩尔分数旳单位为1
气态混合物中摩尔分数常用 yB 表达
在溶液中,表达溶质浓度旳措施有:
(1)溶质B旳质量摩尔浓度mB
Molality of solute B
mB def
nB m(A)
mB bB
溶质B旳物质旳量与溶剂A旳质量之比称为 溶质B旳质量摩尔浓度。
物化-相平衡总复习题库资料共50页文档

16、自己选择的路、跪着也要把它走 完。 17、一般情况下)不想三年以后的事, 只想现 在的事 。现在 有成就 ,以后 才能更 辉煌。
18、敢于向黑暗宣战的人,心里必须 充满光 明。 19、学习的关键--重复。
20、懦弱的人只会裹足不前,莽撞的 人只能 引为烧 身,只 有真正 勇敢的 人才能 所向披 靡。
拉
60、生活的道路一旦选定,就要勇敢地 走到底 ,决不 回头。 ——左
56、书不仅是生活,而且是现在、过 去和未 来文化 生活的 源泉。 ——库 法耶夫 57、生命不可能有两次,但许ቤተ መጻሕፍቲ ባይዱ人连一 次也不 善于度 过。— —吕凯 特 58、问渠哪得清如许,为有源头活水来 。—— 朱熹 59、我的努力求学没有得到别的好处, 只不过 是愈来 愈发觉 自己的 无知。 ——笛 卡儿
