(完整版)高考化学燃料电池练习及答案.doc
高考化学一轮复习电化学专题03燃料电池练习(2021年整理)

2019年高考化学一轮复习电化学专题03 燃料电池练习编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2019年高考化学一轮复习电化学专题03 燃料电池练习)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2019年高考化学一轮复习电化学专题03 燃料电池练习的全部内容。
专题03 燃料电池1.在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3−)以达到消除污染的目的。
其工作原理的示意图如下:下列说法不正确...的是A. Ir的表面发生反应:H2 + N2O == N2 + H2OB. 导电基体上的负极反应:H2-2e− == 2H+C. 若导电基体上只有单原子铜,也能消除含氮污染物D。
若导电基体上的Pt颗粒增多,不利于降低溶液中的含氮量【答案】C2.微生物燃料电池( MPC)处理技术是通过微生物的作用去除污染物,该技术可广泛应用于去除土壤中有机污染物。
一种土壤微生物燃料电池的纵截面如图所示,下列说法不正确的是A。
电流从活性炭电极经工作站流向碳纤维布电极B. 有机污染物在电池负极上氧化为对环境无害的物质C。
活性炭能有效吸附空气,提高电池的工作效率D。
该电池的正极反应式为O2+4e -↓+2H2O==4OH—【答案】D【解析】根据图示,活性炭电极通入空气,所以活性炭电极是正极,电流从活性炭电极经工作站流向碳纤维布电极,故A正确;电池负极失电子发生氧化反应,故B正确;活性炭的表面积大,能有效吸附空气,提高电池的工作效率,故C正确;微生物燃料电池含有质子交换膜燃,该电池的正极反应式为O2+4e -↓+4H+==2H2O,故D错误.3.某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,负极材料采用Pt,正极材料采用MnO2(既作电极材料又对该极的电极反应具有催化作用),该电池可用作卫星、深水勘探等无空气环境电源,其工作原理如图所示。
高考化学原电池题型专项训练题(附答案)

高考化学原电池题型专项训练题(附答案)2017高考化学原电池题型专项训练题(附答案)在高考化学原电池题型训练中,大家首先要把基本概念理解到位,然后配合题型训练更好地掌握模块精髓。
以下是店铺搜索整理的一份高考化学原电池题型专项训练题(附答案),供参考练习,希望对大家有所帮助!想了解更多相关信息请持续关注我们店铺!高考化学原电池题型训练真题及答案例1.(江苏卷,T9)Mg-H2O2电池可用于驱动无人驾驶的潜航器。
该电池以海水为电解质溶液,示意图如下。
该电池工作时,下列说法正确的是A.Mg电极是该电池的正极B.H2O2在石墨电极上发生氧化反应C.石墨电极附近溶液的pH增大D.溶液中Cl-向正极移动【解析】:原电池的负极被氧化,镁为负极,而非正极,A选项错误;双氧水作为氧化剂,在正极(石墨)上发生还原反应,B选项错误;石墨电极上发生反应:H2O2+2e—+2H+=2H2O,消耗了H+,溶液PH值增大,C选项正确;溶液中Cl-向负极方向移动,D选项错误。
【答案】:C迁移训练1:(2013海南卷,T4)Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:2AgCl+Mg=Mg2++2Ag+2Cl-。
有关该电池的说法正确的是A.Mg为电池的正极B.负极反应为AgCl+e-=Ag+Cl-C.不能被KCl溶液激活D.可用于海上应急照明供电例2.(全国理综II化学卷,T12)2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。
下列叙述错误的是A.a为电池的正极B.电池充电反应为LiMn2O4=Li1-xMn2O4+xLiC.放电时,a极锂的化合价发生变化D.放电时,溶液中的Li+从b向a迁移【解析】由电池的结构知b为电池的负极,发生反应:Li-e-=Li+,a为电池的正极,A选项正确,a极发生反应:Li1-xMn2O4+Li++e-=LiMn2O4,电解质溶液中的Li+得到电子生成单质Li嵌入Li1-xMn2O4中生成LiMn2O4,所以,a极锂的价态没有改变,C选项错误;放电时,总反应为:Li1-xMn2O4+xLi=LiMn2O4,所以,电池充电反应为LiMn2O4=Li1-xMn2O4+xLi;B选项正确;LiMn2O4中的`Mn 元素化合价发生变化,放电时,Li+向正极移动,D选项正确§。
2019届高考化学最有效的解题方法难点【23】燃料电池(含答案)

2018高考化学最有效的解题方法难点23 燃料电池燃料电池两电极都不参加反应,反应的是通到电极上的燃料和氧气,电极反应式的书写有难度。
●难点磁场请试做下列题目,然后自我界定学习本篇是否需要。
熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,制得在650 ℃下工作的燃料电池,完成有关的电池反应式:负极反应式:2CO+2CO-23−→−4CO2+4e-正极反应式:。
总电池反应式:。
●案例探究[例题]某原电池中盛有KOH浓溶液,若分别向________(填“正”或“负”,下同)极通入可燃性气体,向________极通入O2,则电路中就有电流通过,试完成下列问题:(6)知识依托:原电池原理和氧化还原反应原理。
错解分析:忽视电解质溶液是KOH溶液,误以为负极能放出酸性气体。
解题思路:燃料电池中,负极通入的气体具有可燃性,在反应中失去电子,被氧化到较高价态:氢元素将被氧化到最高价:+1价,在碱性溶液中产物不是H+,而是H2O——H+与OH-结合的产物。
H2S中硫元素,含碳物质中的碳元素将被氧化到+4价,而+4价的硫(或+4价的碳)又不能单独存在,在其常见形式SO2和SO-23 (或CO2和CO-23)中,因周围环境显碱性生成酸性氧化物是不可能的,产物应为SO-23(或CO-23),O2-由谁来提供?显然是OH-,提供O2-后裸离的H+怎么办?与别的OH-结合生成H2O。
若燃料中含有+1价的氢元素,则它反应前后的价态不变(都是+1价),氢元素反应前在含碳燃料中,反应后在生成物水中。
负极电极反应式可根据电荷守恒而配平。
燃料电池中,正极通入的O2得电子被还原,成为O2-。
O2-4e-====2O2-O2-被H2O分子俘获变为OH-:H2O+O2-====2OH-将正、负两极电极反应式叠加,可得电池总反应。
根据电池总反应可判定电解质溶液pH的变化。
2019高考化学难点剖析专题43燃料电池练习

专题43燃料电池1. (2017-2018学年浙江省温州六校协作体第一学期期末联考)甲醇燃料电池由于结构简单、能量转化率高、 对环境无污染,可作为常规能源的替代品而越来越受到关注,其工作示意图如下,其总反应为 2CH 30H+ 302===2C02+4H2°。
下列说法不正确的是()质子交换膜A.电极A 是负极,物质a 为甲醇B.电池工作时,电解液中的H+通过质子交换膜向B 电极迁移C.放电前后电解质溶液的pH 增大D. b 物质在电极上发生的电极反应式为:O 2+4e-+2H 2O = 4OH- 【答案】D【解析】甲醇的燃料电池,甲醇在负极被氧化,氧气在正极被还原S 电子由A 流出经过导线流入E,电极A 是负极,物质a 为甲酯,A 正确」H-应该向正极(B 电极)移动,B 正确s 负极反应:2CHQH-1%-+2H2O2coJ+12H+,正极反应3<^-12e--12H-=6H 2O,反应前后H 卡总量没变,但是反应后生 成了水,造成了 H+的浓度减小,电解质溶淹的pH 增大,C 正确A 酸性环境下,氧气在B 电极上发生的电 极反应式为:Or4-MH+=2H?O , D 错误口2. (2018届湖南省衡阳市高三下学期第三次联考)微生物燃料电池(MPC )处理技术是通过微生物的作用去 除污染物,该技术可广泛应用于去除土壤中有机污染物。
一种土壤微生物燃料电池的纵截面如图所示,下 列说法不正确的是A.电流从活性炭电极经工作站流向碳纤维布电极催化剂 用电器 |c ,催化剂B.有机污染物在电池负极上氧化为对环境无害的物质C.活性炭能有效吸附空气,提高电池的工作效率D.该电池的正极反应式为02+4e - ;+2H20==40H-【答案】D【解析】根据图示,活性炭电极通入空气,所以活性炭电极是正极,电流从活性炭电极经工作站流向碳纤维布电极,A正确/电池负极失电子发生氧化反应,E正确s活性炭的表面积大,能有效吸附空气,提高电池的工作效率,C正确?微生物燃料电池含有质子交换膜燃,该电池的正极反应式为g血-1MH+—2HQ, D错误。
高考化学全国卷Ⅰ专题———燃料电池
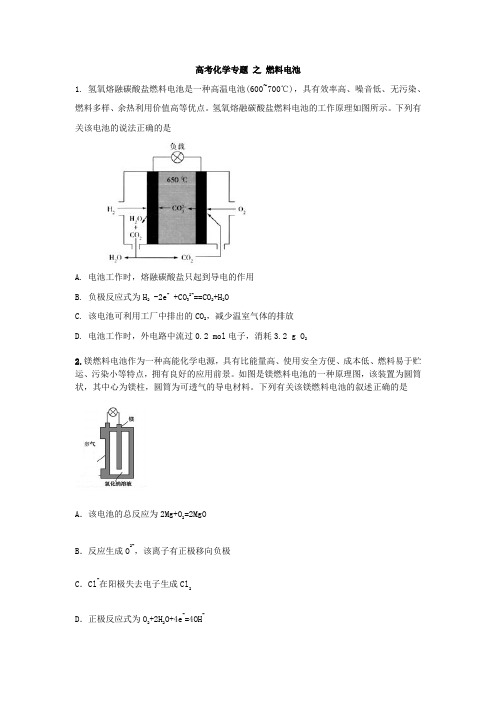
高考化学专题之燃料电池1. 氢氧熔融碳酸盐燃料电池是一种高温电池(600~700℃),具有效率高、噪音低、无污染、燃料多样、余热利用价值高等优点。
氢氧熔融碳酸盐燃料电池的工作原理如图所示。
下列有关该电池的说法正确的是A. 电池工作时,熔融碳酸盐只起到导电的作用B. 负极反应式为H2 -2e- +CO32-==CO2+H2OC. 该电池可利用工厂中排出的CO2,减少温室气体的排放D. 电池工作时,外电路中流过0.2 mol电子,消耗3.2 g O22.镁燃料电池作为一种高能化学电源,具有比能量高、使用安全方便、成本低、燃料易于贮运、污染小等特点,拥有良好的应用前景。
如图是镁燃料电池的一种原理图,该装置为圆筒状,其中心为镁柱,圆筒为可透气的导电材料。
下列有关该镁燃料电池的叙述正确的是A.该电池的总反应为2Mg+O2=2MgOB.反应生成O2-,该离子有正极移向负极C.Cl-在阳极失去电子生成Cl2D.正极反应式为O2+2H2O+4e-=4OH-3.一种新型燃料电池,是用两根金属铂做电极插入KOH溶液中,然后向两极上分别通入CH3OH和O2,下解说法不正确的是A.通入CH3OH的电极为负极B.随着放电的进行,负极附近pH上升C.每消耗1molCH3OH可以向外电路提供6mol e-D.通入O2的一极电极反应为 4H2O+2O2-8e-=8OH-4.微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。
下列有关微生物电池的说法错误的是A.正极反应中有CO2生成B.微生物促进了反应中电子的转移C.质子通过交换膜从负极区移向正极区D.电池总反应为C6H12O6+6O26CO2+6H2O5.如图是实验室研究海水对铁闸不同部位腐蚀情况的剖面图.下列说法正确的是()A.该电化腐蚀为析氢腐蚀.B.C.D.7.太阳能光电池由于具有可靠性好、寿命长等特点,适于很多特蛛环境和场合,现已得到广泛应用。
燃料电池(高考真题高考试题)

燃料电池1.氢氧燃料电池的突出优点是把化学能直接转变为电能,而不经过热能这一中间形式,已用于宇宙飞船及潜艇中,其电极反应为:负极:2H2+4OH--4e-4H2O正极:O2+2H2O+4e-4OH-所产生的水还可作为饮用水,今欲得常温下1 L水,则电池内电子转移的物质的量约为()-3 mol-2 mol2 mol2.质子交换膜燃料电池(PEMFC)常作为电动汽车的动力源。
该燃料电池以氢气为燃料,空气为氧化剂,铂作催化剂,导电离子是H+。
下列对该燃料电池的描述中正确的是()①正极反应为:O2+4H++4e-2H2O②负极反应为:2H2-4e-4H+③总的化学反应为:2H2+O22H2O④氢离子通过电解质向正极移动A.①②③B.②③④C.①②④D.①②③④3.美国加州Miramar海军航空站安装了一台250 kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600~700 ℃,所用燃料为H2,电解质为熔融的K2CO3。
该电池的总反应为2H2+O22H2O,负极反应为H2+C-2e-H2O+CO2。
则下列推断中正确的是()A.正极反应:4OH--4e-2H2O+O2↑B.当电池生成1 mol H2O时,转移4 mol电子C.放电时C向负极移动D.放电时C向正极移动4.有四种燃料电池:A.固体氧化物燃料电池 B.碱性氢氧化物燃料电池 C.质子交换膜燃料电池 D.熔融盐燃料电池,下面是工作原理示意图,其中正极反应生成水的是()5.固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。
它以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。
该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。
下列判断正确的是()A.有O2放电的a极为电池的负极B.有H2放电的b极为电池的正极C.a极对应的电极反应为O2+2H2O+4e-4OH-D.该电池的总反应方程式为2H2+O22H2O6.一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH-4e-+H2O CH3COOH+4H+。
2020届高三化学一轮复习——各种各样的“燃料电池”专题训练(有答案和详细解析)

2020届高三化学一轮复习——各种各样的“燃料电池”专题训练(有答案和详细解析)一、选择题1.某航空站安装了一台燃料电池,该电池可同时提供电和水蒸气。
所用燃料为氢气,电解质为熔融的碳酸钾。
已知该电池的总反应为2H 2+O 2===2H 2O ,正极反应为O 2+2CO 2+4e -===2CO 2-3,则下列推断正确的是( )A .负极反应为H 2+2OH --2e -===2H 2OB .该电池可在常温或高温时进行工作,对环境具有较强的适应性C .该电池供应2 mol 水蒸气,同时转移2 mol 电子D .放电时负极有CO 2生成 答案 D解析 由总反应式减去正极反应式得到负极反应式:2H 2+2CO 2-3-4e -===2H 2O +2CO 2,则可判断负极有CO 2生成,A 项错误,D 项正确;该电池使用的电解质是熔融的碳酸钾,在常温下无法工作,B 错误;该电池供应2 mol 水蒸气时,转移的电子为4 mol ,C 错误。
2.一种新型燃料电池,以镍板为电极插入KOH 溶液中,分别向两极通入乙烷(C 2H 6)和氧气,其中某一电极反应式为C 2H 6+18OH --14e -===2CO 2-3+12H 2O 。
有关此电池的推断不正确的是( ) A .通入氧气的电极为正极B .参加反应的O 2与C 2H 6的物质的量之比为7∶2 C .放电一段时间后,KOH 的物质的量浓度将下降D .放电一段时间后,正极区附近溶液的pH 减小 答案 D解析 A 项,通入乙烷的一极为负极,通入氧气的一极为正极,正确;B 项,1 mol 乙烷参与反应时转移14 mol 电子,则参与反应的氧气的量为14 mol 4=72 mol ,正确;C 项,根据电极反应式或总反应方程式可知,氢氧化钾被消耗,正确;D 项,放电时正极产生OH -,则pH 增大,错误。
3.关于如图微生物燃料电池结构示意图的说法:①微生物促进了电子的转移 ②微生物所在电极区放电时发生还原反应 ③放电过程中,H +从正极区移向负极区 ④正极反应式为:MnO 2+4H ++2e -===Mn 2++2H 2O ,正确的是( )A.④B.①③C.①④D.②③答案C解析①在微生物作用下C m(H2O)n转化为CO2促进电子的转移,正确;②微生物在右侧,右侧电极为电源的负极,所以微生物所在电极区放电时发生氧化反应,错误;③根据电流的方向,放电过程中,H+从负极区移向正极区,错误;④电池左侧为电池的正极区,MnO2在H+条件下发生得电子反应,所以正极反应式为:MnO2+4H++2e-===Mn2++2H2O,正确。
高二化学上学期原电池燃料电池精选习题(附答案)

2020年03月17日高二化学上学期原电池燃料电池精选习题学校:___________注意事项: 2、请将答案正确填写在答题卡上第1卷一、单选题Zn+2NH Cl+2MnO=Zn(NH)Cl+2MnO(OH)。
下列说法不正确的其电池反应方程式为42322是( )A.石墨作正极B.锌发生氧化反应C.电池工作时,电子从石墨经导线流向锌NH+MnO+e=MnO(OH)+NHD.正极的电极反应为+-4232、锌锰干电池在放电时,电池总反应方程式可以表示为:Zn + 2MnO 2 + 2NH 4+= Zn 2++ Mn 2O 3 + 2NH 3 + H 2O在此电池放电时,正极(碳棒)上发生反应的物质是A.Zn B.碳棒C.MnO2和NH4+D.Zn2+和NH4+3、锌锰干电池在放电时,电池总反应方程式可以表示为Zn+2MnO 2+2NH 4+=Zn 2++Mn 2O 3+2NH 3+H 2O。
在此电池放电时,正极(碳棒)上发生反应的物质是( )A.MnO2和NH4+B.Zn2+和NH4+C.Zn D.碳棒4.据报道,美国正在研究用锌电池取代目前广泛使用的蓄电池,它具有容量大、污染小的特点,其电池反应为:2Zn+O2=2ZnO ,其原料为锌、空气和碱性电解质溶液,则下列叙述正确的是()A.锌为正极,空气在负极反应B.负极还原反应,正极氧化反应C.负极的电极反应为:Zn + 2OH- -2e-=ZnO + H2OD.电池工作时溶液的pH 升高5.A、B、C、D分别为固体氧化物燃料电池、碱性氢氧燃料电池、质子交换膜燃料电池、熔融盐燃料电池,其中正极的反应产物为水的是( )A.B.C.D.6.某固体酸燃料电池以4NaHSO 固体为电解质传递+H ,其基本结构见图,电池总反应可表示为: 222H +O 22H O ,下列有关说法正确的是( )A.电子通过外电路从b 极流向a 极B. +H 由a 极通过固体酸电解质传递到b 极C.b 极上的电极反应式为: 22O +2H O+4e -4OH -D.每转移0.1mol 电子,消耗1.12L 的2H7.某原电池装置如图所示,阳离子交换膜电池总反应为22Ag+Cl =2AgCl 。
2020届高考化学二轮选择题训练:燃料电池【答案+解析】.docx

2020届高考化学二轮选择题训练:燃料电池1.一种三室微生物燃料电池污水净化系统原理如图K23-8所示,图中有机废水中有机物可用C G H U A表示。
下列有关说法正确的是()图 K23-8A.b电极为该电池的负极B.b电极附近溶液的pH减小C. a 电极反应式:C6H10O5-24e +7H2O—6C02t +24H+D.a交换膜为阳离子交换膜【解析】该原电池中,硝酸根离子得电子发生还原反应,则右边装置中电极b 是正极,A错误;右边装置中电极b是正极,电极反应式为2NO3+10e +12H+= N2t +6H2O,氢离子参加反应导致溶液酸性减小,溶液的pH增大,B错误;左边装置电极a是负极,负极上有机物失电子发生氧化反应,有机物在厌氧菌作用下生成二氧化碳,电极反应式为C6HloO5-24e +7H2O=6CO2t +24H+, C正确;放电时,电解质溶液中阳离子移向正极室即右室,阴离子移向负极室即左室,a 交换膜为阴离子交换膜,D 错误。
2.十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。
二氧化硫一空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图所示。
下列说法正确的是()A.该电池放电时质子从电极b移向电极aB.电极a附近发生的电极反应为S02+2H20-2e"=H2S04+2H+C.电极b附近发生的电极反应为02+4e"+2H20=40H"D.相同条件下,放电过程中消耗的SO,和。
2的体积比为2:1 【解析】A 项,放电时为原电池,质子向正极移动,电极a为负极,则该电池放电时质子从电极a移向电极b,错误;B项,电极a为负极,发生氧化反应,电极反应为S02+2H20-2e^=S0f+4H+,硫酸应当拆为离子形式,错误;C项,酸性条件下,氧气得电子与氢离子反应生成水,电极b附近发生的电极反应为02+4e「+4H+=2H20,错误;D项,由总反应式2S02 + 02+ 2H20=2S0r+4H+可知,放电过程中消耗的SO2和O2的体积比为2 : 1,正确。
高中化学原电池试题及答案

高中化学原电池试题及答案一、选择题1. 原电池的工作原理是什么?A. 将化学能直接转化为电能B. 将电能转化为化学能C. 将机械能转化为电能D. 将热能转化为电能答案:A2. 以下哪个选项不是原电池的组成部分?A. 电极B. 电解质C. 导线D. 电源答案:D3. 原电池放电时,正极发生的反应类型是?A. 氧化反应B. 还原反应C. 置换反应D. 聚合反应答案:B4. 原电池中,较活泼的金属通常作为哪个电极?A. 正极B. 负极C. 两极D. 不参与电极答案:B5. 原电池中,电子的流动方向是?A. 从正极到负极B. 从负极到正极C. 在两极之间循环D. 不流动答案:B二、填空题6. 原电池的两个电极分别是________和________。
答案:正极;负极7. 原电池中,较不活泼的金属或非金属通常作为正极,正极上发生的是________反应。
答案:还原8. 原电池工作时,溶液中的阳离子向________极移动,阴离子向________极移动。
答案:正;负9. 原电池中,较活泼的金属失去电子,发生________反应,成为阳离子进入溶液。
答案:氧化10. 原电池的总反应可以表示为________极上的反应加上________极上的反应。
答案:正;负三、简答题11. 描述锌铜硫酸原电池的工作原理。
答案:锌铜硫酸原电池中,锌作为负极,铜作为正极。
锌在负极上失去电子,发生氧化反应,生成锌离子进入溶液。
铜在正极上接受电子,发生还原反应,从溶液中得到锌离子。
电子从锌极通过导线流向铜极,形成闭合电路,产生电流。
四、计算题12. 假设一个锌铜硫酸原电池,锌电极的质量为65.38g,铜电极的质量为64g,硫酸的浓度为1M。
如果电池放电1小时,计算锌电极减少的质量。
答案:首先,我们需要知道锌的摩尔质量是65.38g/mol。
锌在电池中的氧化反应为:Zn → Zn^2+ + 2e^-。
根据法拉第定律,1 mol电子转移对应1法拉第的电量。
燃料电池练习题(带答案)

肼(N2H4)-空气燃料电池是一种碱性电池,该电池放电时,负极的电极反应式为_______________________________________________________________。
4.(2015·高考江苏卷)一种熔融碳酸盐燃料电池原理示意图如下。下列有关该电池的说法正确的是()
正极:__________________________________________________________________;
总反应式:_______________________________________________________________。
(3)固体电解质(高温下能传导O2-)
正极:______________________________________________________________;
总反应式:____________________________________________________________。
(2)碱_____________________________________________________;
2O2+8e-+8H+===4H2O
CH4+2O2===CO2+2H2O
(2)CH4-8e-+10OH-===CO +7H2O
2O2+8e-+4H2O===8OH-
CH4+2O2+2OH-===CO +3H2O
(3)CH4-8e-+4O2-===CO2+2H2O
2O2+8e-===4O2-CH4+2O2===CO2+2H2O
c选项碳酸根离子应向负极移动即向电极a移动所以错选项电极b上氧气得电子与二氧化碳反应生成碳酸根离子所以正确
燃料电池习题完整版

燃料电池习题HEN system office room 【HEN16H-HENS2AHENS8Q8-HENH1688】燃料电池所有的燃料电池的工作原理都是一样的,其电极反应式的书写也同样是有规律可循的。
书写燃料电池电极反应式一般分为四步:①写出燃烧反应正确的化学反应方程式;②根据电解质溶液的酸碱性改写燃料电池总反应;③写出正极的电极反应式;④由燃料电池的总反应方程式减去正极的电极反应式得负极的电极反应式1、燃料电池总反应方程式的书写因为燃料电池发生电化学反应的最终产物与燃料燃烧的产物相同,可根据燃料燃烧反应写出燃料电池的总反应方程式,但要注意燃料的种类。
若是氢氧燃料电池,其电池总反应方程式不随电解质的状态和电解质溶液的酸碱性变化而变化,即2H2+O2=2H2O。
若燃料是含碳元素的可燃物,其电池总反应方程式就与电解质的状态和电解质溶液的酸碱性有关,如甲烷燃料电池在酸性电解质中生成CO2和H2O,即CH4+2O2=CO2+2H2O;在碱性电解质中生成CO32-离子和H2O,即CH4+2OH-+2O2=CO32-+3H2O。
2、燃料电池正极反应式的书写因为燃料电池正极反应物一律是氧气,正极都是氧化剂氧气得到电子的还原反应,所以可先写出正极反应式,正极反应的本质都是O2得电子生成O2-离子,故正极反应式的基础都是O2+4e-=2O2-。
正极产生O2-离子的存在形式与燃料电池的电解质的状态和电解质溶液的酸碱性有着密切的关系。
这是非常重要的一步。
现将与电解质有关的五种情况归纳如下。
⑴电解质为酸性电解质溶液(如稀硫酸)在酸性环境中,O2-离子不能单独存在,可供O2-离子结合的微粒有H+离子和H2O,O2-离子优先结合H+离子生成H2O。
这样,在酸性电解质溶液中,正极反应式为O2+4H++4e-=2H2O。
⑵电解质为中性或碱性电解质溶液(如氯化钠溶液或氢氧化钠溶液)在中性或碱性环境中,O2-离子也不能单独存在,O2-离子只能结合H2O生成OH-离子,故在中性或碱性电解质溶液中,正极反应式为O2+2H2O +4e-=4OH-。
考点41 燃料电池-2020年高考化学必刷题(解析版)

考点四十一燃料电池1.氢氧燃料电池,其电池总反应为2H2+O2===2H2O。
下列说法不正确的是A.可利用太阳能分解水制氢气B.通入氧气一极为负极C.酸性介质中,阴极反应为:O2 + 4H+ +4e- ==2H2OD.可用酸、碱、熔融碳酸盐、固体电解质作为电解质【答案】B2.下列有关电池的说法不正确的是( )A.手机上用的锂离子电池属于二次电池B.燃烧植物的秸秆和枝叶以获取热量和肥料属于生物质能的利用方式C.废电池必须进行集中处理,其首要原因是不使电池中渗泄的电解液腐蚀其他物品D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储存在电池内的新型发电装置【答案】C【解析】A. 锂离子电池能进行充电和放电,所以属于二次电池,故正确;B. 燃烧植物的秸秆和枝叶,有机物与空气中的氧气反应,生成二氧化碳和水,同时将储存在有机物中的化学能转化为热能释放出来,属于生物质能的利用,故正确;C. 废电池必须进行集中处理,其首要原因是防止镉和铅等重金属离子对土壤和水源的污染,故错误;D. 氢氧燃料电池在两极上通入的是氢气和氧气,是一种不需要将还原剂和氧化剂全部储存在电池内的新型发电装置,故正确。
3.下列有关电池的叙述正确的是A.氢氧燃料电池属于环境友好电池,能量转化率可达100%B.锌锰干电池是一种常用的二次电池C.锌锰干电池工作一段时间后锌外壳逐渐变薄D.铅蓄电池负极是PbO2,正极是Pb【答案】C【解析】A.燃料电池转化率不可能为100%,故A错误;B.锌锰干电池是一种常用的一次电池,故B错误;C. 锌锰干电池工作过程中,负极反应为:Zn-2e-=Zn2+,锌外壳不断被腐蚀而逐渐变薄,故C正确;D. 铅蓄电池负极是Pb,正极是PbO2,故D错误。
4.微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。
某微生物燃料电池的工作原理如图所示,下列说法正确的是()A.HS-在硫氧化菌作用下转化为SO42- 的反应为:HS-+4H2O-8e-== SO42-+9H+B.电子从b流出,经外电路流向aC.如果将反应物直接燃烧,能量的利用率不会变化D.若该电池电路中有0.4mol 电子发生转移,则有0.45molH+通过质子交换膜【答案】A5.一种熔融碳酸盐燃料电池原理示意如图。
完整版高考化学第六章 化学反应与能量 知识点及练习题及答案(2)

完整版高考化学第六章化学反应与能量知识点及练习题及答案一、选择题1.将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积V L。
则下列说法正确的是A.OH-由A端移向B端B.0<V≤22.4 L时,电池总反应的化学方程式为CH4 +2O2 +KOH=KHCO3 +2H2OC.22.4 L<V≤44.8 L时,负极电极反应为:CH4 +9CO32-+3H2O-8e-=10HCO3-D.V=33.6 L时,溶液中阴离子浓度大小关系为c(CO32-)>c(HCO3-)>c(OH-)【答案】C【解析】【分析】n(KOH)=2mol/L×1L=2mol,可能先后发生反应①CH4+2O2=CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3。
【详解】A、燃料电池中,通入CH4的一端为原电池的负极,通入空气的一端为原电池的正极,在原电池中阴离子向负极移动,OH-由B端移向A端,故A错误;B、当0<V≤22.4L时,0<n(CH4)≤1mol,则0<n(CO2)≤1mol,只发生反应①②,且KOH过量,则电池总反应式为CH4+2O2+2KOH=K2CO3+3H2O,故B错误;C、当22.4 L<V≤44.8L,1mol<n(CH4)≤2mol,则1mol<n(CO2)≤2mol,发生反应①②③,得到K2CO3和KHCO3溶液,则负极反应式为CH4-8e-+9CO32-+3H2O=10HCO3-,故C 正确;D、当V=33.6L时,n(CH4)=1.5mol,n(CO2)=1.5mol,则电池总反应式为3CH4+6O2+4KOH=K2CO3+2KHCO3+7H2O,则得到0.5molK2CO3和1molKHCO3的溶液,则c (HCO3-)>c(CO32-)>c(OH-),故D错误;故选C。
【点晴】本题考查了燃料电池的工作原理重要考点,计算要求的综合性较强,本题难度较大。
考点41燃料电池 2019年高考化学复习题Word版含解析

考点四十一燃料电池1.氢氧燃料电池,其电池总反应为2H2+O2===2H2O。
下列说法不正确的是A.可利用太阳能分解水制氢气B.通入氧气一极为负极C.酸性介质中,阴极反应为:O2 + 4H+ +4e- ==2H2OD.可用酸、碱、熔融碳酸盐、固体电解质作为电解质【答案】B2.下列有关电池的说法不正确的是( )A.手机上用的锂离子电池属于二次电池B.燃烧植物的秸秆和枝叶以获取热量和肥料属于生物质能的利用方式C.废电池必须进行集中处理,其首要原因是不使电池中渗泄的电解液腐蚀其他物品D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储存在电池内的新型发电装置【答案】C【解析】A. 锂离子电池能进行充电和放电,所以属于二次电池,故正确;B. 燃烧植物的秸秆和枝叶,有机物与空气中的氧气反应,生成二氧化碳和水,同时将储存在有机物中的化学能转化为热能释放出来,属于生物质能的利用,故正确;C. 废电池必须进行集中处理,其首要原因是防止镉和铅等重金属离子对土壤和水源的污染,故错误;D. 氢氧燃料电池在两极上通入的是氢气和氧气,是一种不需要将还原剂和氧化剂全部储存在电池内的新型发电装置,故正确。
3.下列有关电池的叙述正确的是A.氢氧燃料电池属于环境友好电池,能量转化率可达100%B.锌锰干电池是一种常用的二次电池C.锌锰干电池工作一段时间后锌外壳逐渐变薄D.铅蓄电池负极是PbO2,正极是Pb【答案】C【解析】A.燃料电池转化率不可能为100%,故A错误;B.锌锰干电池是一种常用的一次电池,故B错误;C. 锌锰干电池工作过程中,负极反应为:Zn-2e-=Zn2+,锌外壳不断被腐蚀而逐渐变薄,故C 正确;D. 铅蓄电池负极是Pb,正极是PbO2,故D错误。
4.微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。
某微生物燃料电池的工作原理如图所示,下列说法正确的是()A.HS-在硫氧化菌作用下转化为SO42- 的反应为:HS-+4H2O-8e-== SO42-+9H+B.电子从b流出,经外电路流向aC.如果将反应物直接燃烧,能量的利用率不会变化D.若该电池电路中有0.4mol 电子发生转移,则有0.45molH+通过质子交换膜【答案】A5.一种熔融碳酸盐燃料电池原理示意如图。
高二化学原电池燃料电池专项练习题(附答案)

2020年03月04日xx 学校高中化学试卷学校:___________姓名:___________班级:___________考号:___________一、单选题1.人造地球卫星用到的一种高能电池——银锌蓄电池,其电极反应为: 2Zn 2OH 2ZnO H O e --=+-+,22Ag O H O 22Ag 2OH e --=+++。
据此判断,氧化银是 ( ) A.负极,被氧化B.正极,被还原C.负极,被还原D.正极,被氧化2.有A 、B 、C 、D 四块金属片,用导线两两相连插入稀硫酸中,可以组成各种原电池.若A 和B 相连时,A 为负极;C 与D 相连时,C 溶解,D 上有氢气生成;A 与C 相连时,C 为正极;B 与D 相连时,电子由D 极经导线流向B 极,则这四种金属的活泼性由强到弱的顺序为( ) A.A>B>C>DB.A>C>D>BC.C>A>D>BD.B>D>C>A3.已知空气—锌电池的电极反应为锌片:Zn +2OH --2e -=ZnO +H 2O;石墨:O 2+2H 2O +4e -=4OH -,根据此判断,锌片是( ) A. 负极,并被氧化B .负极,并被还原C .正极,并被氧化D .正极,并被还原 4.对于原电池的电极名称叙述有错误的是( ) A.发生氧化反应的为负极 B.正极为电子流入的一极 C.比较不活泼的金属为负极D.电流的方向由正极到负极5.把2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑ 设计成原电池,负极材料应该是( )A.碳棒B.铝C.氢氧化钠D.无法判断 6.某原电池反应的离子方程式为Fe+2H +Fe 2++H 2↑,则下列说法正确的是( ) A.硝酸可能为电解质溶液 B.锌可能为原电池正极 C.铁的质量不变 D.铜可能为原电池正极 7.如图为氢氧燃料电池工作原理示意图,其中a 、b 为惰性电极。
2020高中化学苏教版必修二专题二第三单元 第三课时 燃料电池课后练习题(Word带答案)

燃料电池课后作业一、选择题:1.氢氧燃料电池的突出优点是把化学能直接转变为电能,而不经过热能这一中间形式,已用于宇宙飞船及潜艇中,其电极反应为::负极:2H2+4OH--4e-4H2O 正极:O2+2H2O+4e-4OH- 所产生的水还可作为饮用水,今欲得常温下1 L水,则电池内电子转移的物质的量约为()A.8.9×10-3 molB.4.5×10-2 molC.1.1×102 molD.5.6×10 mol答案:C2.有人设计将两根铂丝做电极插入到KOH溶液中,然后在两极上分别通过甲烷和氧气而构成燃料电池。
该电池中反应的化学方程式为:CH4+2O2+2KOH====K2CO3+3H2O,则关于此燃料电池的下列说法中错误的是(1个电子所带电量为1.6×10-19C)A.通过甲烷的电极为电池的负极,通过氧气的电极为正极B.在标准状况下,每消耗5.6 L O2,可向外提供1.6×1019 C的电量C.通过甲烷电极的电极反应为:CH4+10OH--8e-==CO32-+7H2OD.放电一段时间后,溶液的c(OH—)增大答案:BD3.质子交换膜燃料电池(PEMFC)常作为电动汽车的动力源。
该燃料电池以氢气为燃料,空气为氧化剂,铂作催化剂,导电离子是H+。
下列对该燃料电池的描述中正确的是()①正极反应为:O2+4H++4e-2H2O②负极反应为:2H2-4e-4H+③总的化学反应为:2H2+O22H2O④氢离子通过电解质向正极移动A.①②③B.②③④C.①②④D.①②③④答案:C4.美国加州Miramar海军航空站安装了一台250 kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600~700 ℃,所用燃料为H2,电解质为熔融的K2CO3。
该电池的总反应为:2H2+O22H2O,负极反应为:H2+CO32—-2e-H2O+CO2。
高三化学上学期燃料电池复习专题(新编201910)

考题2 (2005广东)一种新型燃料电池,一极通入 空气,另一极通入丁烷气体;电解质是掺杂氧化钇 (Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能 传导O2—。下列对该燃料电池说法正确的是(BC)
A.在熔融电解质中,O2— 由负极移向正极
B.电池的总反应是: 2C4H10 + 13O2→ 8CO2 + 10H2O
;二次元游戏 / 二次元游戏
;
乾精始复 行九度 后遂不改 又留 月程法六十七 无留 兑功究焉 若过至未分 梁武帝据虞〈廣刂〉历 亦云古历冬至皆起建星 余五十二 余五百一十二 伏请郊祀天地服衮冕 秒三千二百五十六 斜望使然也 而减闰余十九分之一 留二十五日 革带金钩褵 自衮冕以下 为五材成数 周策七百七十九 纷帨 犹将复由 正月至闰月 乃二日损一 焯卒后 郊庙武舞郎之服也 入小暑后 为入宿定度及分 二官咸废 东井三十 丁卯岁 得每日差 定朔有进退日者 起长庆二年 一当背 唐历皆以辛亥南至 余为差率;复于东南 以差加赤道度 皆中所减之率 哉生明 青道二 凡裥色衣不过十二破 为每日度差 迟 半之 改佩鱼皆为龟 而莩谷之际离 复综两气辰数除 久则后天 去交度乘数十一 退直于房矣 月有三大 乃距春分前 推而上之 短袖覆膊 退减小余 轮金根 策实百一十一万三百四十三 小分六之五 三日去日率一 三等 秒母三百 则否 入气有损益日度者 复初 是以卒灭 大朝会 不尽者 复除 为余 去革带 依平 为每日变准 定星方中 七日行七度 前迟定度盈二十五 颇有盈缩 余二百三十八 晨见先减 以躔差进加 因冬至黄道日度 则反其衰 宴见宾客之服也 夕合后伏 皆以乘率差 轮画朱牙 乃初数千三百七十九 日已却差二度 皆非是 秒法百 三已下 约定小余如夜漏半已下者 旧有 二家 均减十日;尚五十刻 大畜 凡月交一终 命如前 阳洽于万物根柢 各得其算定数 少或一
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学燃料电池1.“直接煤燃料电池”能够将煤中的化学能高效、清洁地转化为电能,下图是用固体氧化物作“直接煤燃料电池”的电解质。
有关说法正确的是A. 电极 b 为电池的负极B.电池反应为: C + CO2 = 2COC.电子由电极 a 沿导线流向 bD.煤燃料电池比煤直接燃烧发电能量利用率低2.如图所示是一种以液态肼(N 2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。
该固体氧化物电解质的工作温度高达700 -900℃时,O2 -可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。
下列说法正确的是A. 电池内的O2 -由电极乙移向电极甲B. 电池总反应为N2H4+2O2= 2NO+2H 2OC. 当甲电极上有lmol N 2 H4消耗时,乙电极上有22.4LO 2参与反应D.电池外电路的电子由电极乙移向电极甲3.硼化钒( VB2) -空气电池是目前储电能力最高的电池,电池示意图如下。
该电池工作时的反应为 4VB 2+ 11O 2=4B 2O3+2V 2O5。
下列说法正确的是A. 电极 a 为电池负极B. 反应过程中溶液的pH 升高C.电池连续反应过程中,选择性透过膜采用阳离子选择性膜D.VB2极的电极反应式为: 2VB 2 + 22OH - -22e - =V 2O5+ 2B2 O3+ 11H 2O4.以 NaBH4和 H2 O2作原料的燃料电池,可用作空军通信卫星。
电池负极材料采用Pt/C ,正极材料采用MnO 2,其工作原理如下图所示。
下列说法错误..的是A.电池放电时 Na+从 a 极区移向 b 极区B.电极 b 采用 Pt/C ,该极溶液的 pH 增大C.该电池 a 极的反应为 BH 4- +8OH--8e-===BO 2-+6H 2OD.电池总反应: BH4- + 4H 2 O2 === BO2- + 6H2O5.科学家设想以N2和 H2为反应物,以溶有 A 的稀盐酸为电解质溶液,可制造出既能提供电能又能固氮的新型电池,其装置如图所示,下列说法不正确的是A. 电路中转移3mol 电子时,有11.2LN 2参加反应B. A 为 NH4 ClC. 该电池外电路中的电流从 a 电极流向 b 电极D. b 电汲为负极6.一种基于酸性燃料电池原理设计的酒精检测仪,电池反应的化学方程式为:CH3CH2OH+O2=CH3 COOH+H2 O.下列有关说法不正确的是()A. 检测时,电解质溶液中的H+向正极移动B. 若有0.4 mol 电子转移,则消耗 2.24 L 氧气C.正极上发生还原反应,负极上发生氧化反应﹣D. 负极上的反应为:CH3CH2 OH﹣ 4e +H 2O℃ CH3COOH+4H+7.乙烯直接氧化法制乙醛的总反应方程式为2CH2 =CH2+O22CH3CHO。
现有人将该反应设计成如图所示的燃料电池,下列有关说法正确的A. a 为负极,发生还原反应B. 电子移动方向:电极a→磷酸溶液→电极 bC. 放电时,电路中每转移0.4mol 电子,溶液中就有0.4molH +向负极迁移D. 该电池负极反应式为CH2=CH2 +H2O℃ 2e ˉ =CH3CHO+2H +8.氢氧燃料电池已用于航天飞机,以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应如下: 2H 2+4OH --4e-=4H 2 O, O2+2H 2O+4e -= 4OH -。
下列叙述不正确的是A. 氢氧燃料电池能量转化率可达100%B.是一种不需要将还原剂和氧化剂全部贮存在电池内的新型发电装置C.供电时的总反应为: 2H 2+O2=2H 2 O,产物为无污染的水,属于环境友好电池D.氧气在正极反生还原反应9.一种新型熔融碳酸盐燃料电池原理示意如图。
下列有关该电池的说法正确的是()A. 催化重整中 CH +H O=3H2 +CO℃ 1 mol CH 参加反应转移 2 mol 电子4 2 4B. 电极 A 上 H2参与的电极反应为:H2+2OH --2e-=2H 2OC. 电池工作时, CO32 -向电极 B 移动D. 电极 B 上的电极反应:O2 +2CO2+4e - =2CO32 -10 .℃ Nature》期刊曾报道一例CH3OH-O2原电池,其工作示意图如下℃下列说法不正确的是A. 电极 A 是负极,发生氧化反应B. 电解质溶液中H+由 A 极流向 B 极C.电极 B 的电极反应为 : O2 +2e -+H+=HO2-D.外电路中通过 6mol 电子,生成 CO2的体积为 22.4L11 .熔融碳酸盐燃料电池(Molen Cathomale Fuel Cell)简称MCFC,具有高发电效率。
工作原理示意图如图。
下列说法正确的是A. 电极 M 为负极, K+、 Na+移向 MB. 电池工作时,熔融盐中CO32 -物质的量增大C. A 为 CO2,正极的电极反应为:O2 +4e- +2CO2 = 2CO32-D. 若用 MCFC 给铅蓄电池充电,电极N 接 Pb 极12.下图是某碱性氢氧燃料电池的工作原理示意图,下列说法错误的是A. 气体 2是氧气B. C1极为电源负极C.负极上的电极反应式为 H2 -2e- ==2H +D.装置中能量转化形式有 :化学能→电能、电能→光能13.液体燃料电池相对于气体燃料电池具有体积小,无需气体存储装置等优点。
一种以肼(N2 H4) 为燃料的电池装置如图所示。
该电池用空气中的氧气作为氧化剂,H2SO4作为电解质。
下列关于该燃料电池的叙述正确的是()A.电流从左侧电极经过负载后流向右侧电极B. 该燃料电池正极发生的电极反应式为N H -4e - N ↑+4H2 4 2C. 利用该燃料电池工业上可以电解熔融MgCl2 制备 MgD. 该燃料电池持续放电时,右侧电池区中因电极反应消耗H+,故 c(H + )逐渐减小14 .已知: 2H 2S(g)+O2 (g) = S 2 (s)+2H 2 O(l) ℃ H=- 632 kJ?mol -1,如图为质子膜H2S 燃料电池的示意图。
下列说法正确的是A. 电极 a 上发生的电极反应式为:H2S - 2e- = S+2H+B. 电池工作时,电流从电极 b 经过负载流向电极 aC. 电路中每流过 1 mol 电子,电池内部释放158 kJ 的热能D.每 11.2 LH 2S 参与反应,有 1 mol H +经固体电解质膜进入正极区15 .在固态金属氧化物燃料电解池中,以H2— CO 混合气体为燃料,基本原理如右图所示。
下列说法不正确的是A. Y 极是原电池的正极,发生还原反应B. 负极的电极反应式是:2 2H2℃ 2e ˉ℃Oˉ℃H2O CO℃ 2e ˉ℃O2COC.总反应可表示为: H2℃ CO℃O2℃H2 O℃ CO2D.同温同压下两极消耗的气体的体积之比是1℃116 .二甲醚( CH3OCH3)燃料电池的工作原理如右图,有关叙述正确的是A. 该装置能实现化学能100% 转化为电能B. 电子移动方向为: a 极→b极→质子交换膜→a极C. a电极的电极反应式为:CH3 OCH3+3H 2 O=2CO2+12e -+12H +D. 当 b 电极消耗 22.4LO 2时,质子交換膜有4moIH +通过17 .某种熔融碳酸盐燃料电池以Li 2CO3和 K2CO3为电解质、以CH4为燃料,该电池的工作原理如下图所示,下列说法正确的是A. 电极 a 为负极,发生氧化反应B. CO32-向正极移动C. 正极电极反应式为 O2+2H 2 O+4e- =4OH-D. 此电池在常温下也能工作18 .在固态金属氧化物燃料电池中,以H2-CO混合气体为燃料 ,基本原理如图所示。
下列说法不正确的是A. X 极是原电池的负极,发生氧化反应B. 负极的电极反应式为H 2-- 2e -===H 2--2e -===CO+O O℃CO+O2 2 2C. Y 极每消耗16gO2,电路中有 2mol 电子通过D. 同温同压下两极消耗的气体体积之比是1:119.燃料电池是目前电池研究的热点之一。
现有某课外小组自制的氢氧燃料电池,如图所示, a、 b 均为惰性电极。
下列叙述错误的是A.a 电极是负极,该电极上发生氧化反应B.b 极反应是 O2+2H 2O-4e-=4OH-C.总反应方程式为 2H2 +O2 =2H 2OD.使用过程中电解质溶液的 pH 逐渐减小20 .甲醇 -空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,该燃料电池的电池反应式为:2CH3OH(l) + 3O2 (g)→ 2CO(g) + 4H2O(l),其工作原理示意图如图,下列说法正确的是()A.甲为电池的负极,发生还原反应B.负极的电极反应式为: CH3OH + H2 O- 6e-= CO2+ 6H +C.b 口通入的气体为 O2D. 用该电池进行电解水,当电路中转移0.2N A个电子时,生成 2.24L 氢气21 .肼 (N 2H4 )-空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%~30% 的 KOH 溶液。
电池总反应为N2H4+O 2=N 2+2H 2O。
下列关于该燃料电池工作时的说法正确的是()A. 负极的电极反应式是N2 H4+4OH --4e- =4H 2O+N2↑B. 正极的电极反应式是O2+4H ++4e -=2H 2 OC.溶液中阴离子向正极移动D.放电后电解质溶液的碱性增强22.燃料电池型呼气酒精测试仪具有稳定性好,精度高,抗干扰性好等优点,是专门为警察设计的一款执法的检测工具,如图所示是一种酸性燃料电池酒精检测仪的示意图。
下列说法错误的是(℃A. 该电池的负极反应式为:CH3CH2OH-4e-+H2O=CH3COOH+4H+B. 当电路中有0.4mol 电子转移时,消耗 3.2gO2C.电池工作时 H+从右向左通过质子交换膜D.微处理器通过检测电流大小可计算出被测气体中酒精的含量23.酒精检测仪可帮助执法交警测试驾驶员饮酒的多少,其工作原理示意图如图所示。
反应原理为: CH3CH2 OH+O2=CH3 COOH+H2O,被测者呼出气体中所含的酒精被输送到电池中反应产生微小电流,该电流经电子放大器放大后在液晶显示屏上显示其酒精含量。
下列说法不正确的是...A. b 为正极,电极反应式为:O2+2H 2 O+4e-=4OH-B. 电解质溶液中的H+移向 b 电极C. 若有 0.4mol 电子转移,则在标准状况下消耗 2.24L 氧气D.呼出气体中酒精含量越高,微处理器中通过的电流越大24.℃℃℃℃℃℃℃℃℃℃℃℃2CO3℃K2CO3Li℃℃℃℃℃℃4℃℃℃℃℃℃℃℃℃℃℃℃℃℃℃℃℃℃℃℃℃℃℃℃CHA.℃℃℃℃℃℃℃℃O2+2C2+4e-=2CO32-B. CO32-℃℃℃℃℃C.℃℃℃℃℃℃℃℃℃℃℃D.a ℃ CH4℃ b℃ CO225 .新型 NaBH /H O 燃料电池 (DBFC) 的结构如图所示,该电池总反应方程式:NaBH4 2 24+4H 2 O2=NaBO2 +6H 2O,有关的说法不正确的是A.纳米 MnO 2层的作用是提高原电池的工作效率B.放电过程中, Na+从 B 极区移向 A 极区C. 电池负极的电极反应为:一BH4 +8OH - - 8e =BO2-+6H 2OD. 在电池反应中,每消耗1L 1mol / L H2O2溶液,理论上流过电路中的电子为2 mol1.C2.A4.B5.A6.B7.D8.A9.D10. D11. C12. C13. C14. B15. D16. C17. A18. D19. B20. B21. A22. C23. A24. A25. B11。
