超高速离心法提取细胞外泌体
外泌体提取的方法

外泌体提取的方法外泌体是一种小型的胞外囊泡,它们由细胞释放出来,带有许多生物分子,如蛋白质、RNA和DNA等。
这些外泌体在很多生物体中都被发现,包括植物、动物和微生物等,而研究它们已经成为了一个热门课题。
因此,外泌体提取方法的研究也愈发重要。
1. 已有的外泌体提取方法目前已经开发出了几种外泌体提取方法,包括差速离心、密度梯度离心和超滤等。
这些方法每一种都有其优点和限制。
下面将分别介绍这三种方法。
差速离心法这是当前最常用的外泌体提取方法。
差速离心法利用一个多步骤的过滤和离心过程来提取外泌体。
此方法通过圆盘刷子离心除去大的细胞残留和细胞碎片,然后再通过速度梯度离心 Pellet 小径的微粒(包括外泌体)。
最终,被Pellet收集的微粒经过洗涤和再次离心以获得纯化的外泌体。
但这种方法也存在一些问题。
例如:外泌体含量极小,容易堵塞过滤器,处理时间也较长等。
密度梯度离心法这种方法是通过使用梯度浓度离心的离心管来纯化和分离外泌体。
这种方法可以强制微粒沉降到其密度梯度离心中与之匹配的密度位置。
密度高的梯度位置收集纯化的外泌体。
但是,密度梯度离心法也存在一些限制,由于梯度的浓度特性,产生相当多的上清液需要处理。
超滤法超滤法可以使用聚酰胺膜筛,把自然和添加的物质、基质等从水或反向微乳液中移除。
超滤法是一种最新的外泌体提取方法。
此方法是通过微孔膜以外泌体大小排除液体中的大分子物质,而留下外泌体和其他小分子在膜上。
最后,外泌体可以从膜上收集。
但是此方法也存在缺陷,需要更昂贵的设备,如超滤膜和超滤器等。
2. 未来发展方向虽然以上方法都有其优点和缺陷,但随着技术的发展和研究的深入,可能会出现新的外泌体提取方法,以更快捷、更准确、更方便的方式提取外泌体。
例如,利用氮氧化物处理方法,可以在不使用离心机和过滤器的情况下,快速提取外泌体。
这种方法可以在较少的研究时间内提取足够数量的外泌体。
随着技术的不断发展,人们希望设计出更加高效的方法,以便更好地应用于外泌体的研究中,更广泛地使用这些方法,并更好地理解外泌体的分子机制。
细胞外泌体提取方法

外泌体提取详细步骤及方法1、差速离心差速离心仍然是最常见的外泌体分离技术之一。
该方法包括几个步骤,包括低速离心去除细胞和凋亡碎片;更高速离心以消除更大的囊泡;最后高速离心沉淀外泌体:300×g离心10分钟,取上清。
2000×g离心10分钟,取上清。
10,000×g离心30分钟,取上清。
100,000×g,在4℃下持续离心90分钟,去掉上清,留下的沉淀PBS重悬后,再次以100,000×g离心90分钟。
2、密度梯度离心该方法将超速离心与蔗糖密度梯度相结合,实现外泌体与非囊泡颗粒分离,例如蛋白质和蛋白质/RNA聚集体。
因此,该方法将囊泡与不同密度的颗粒分开,能够提取含量低的外泌体。
但是,合适的离心时间非常重要,否则如果它们具有相似的密度,则仍可在外泌体中发现污染颗粒。
3、尺寸排阻色谱尺寸排阻色谱(Size-exclusion chromatography,SEC)是基于大小而非分子量实现分离大分子。
该技术应用填充多孔聚合物微球的柱子,分子根据其直径通过微球,半径小的分子需要更长的时间才能通过色谱柱的孔隙迁移,而大分子则从色谱柱中更早地洗脱。
尺寸排阻色谱可以精确分离大小分子。
此外,可以将不同的洗脱溶液应用于该方法。
与离心方法相比,色谱分离已被证明具有更多优势,因为通过色谱分离的外泌体不受剪切力的影响,这可能会改变囊泡的结构。
目前,SEC是一种广泛接受的分离血液和尿液中外泌体的技术。
不过,该方法耗时较长,不适合大量样本处理。
4、过滤超滤膜也可用于分离外泌体。
根据外泌体的大小,从蛋白质和其他大分子中分离外泌体。
最常见的过滤膜具有0.8μm、0.45μm或0.22μm的孔径,可用于收集大于800nm、400nm或200nm的外泌体,也有设计成微柱多孔硅纤毛结构以分离40-100nm外泌体:不过,该方法由于过滤膜的粘附,可能会损失外泌体,并且过滤时的压力和剪切力,可能会使外泌体变形受损。
外泌体是什么?外泌体检测方法

外泌体是什么?外泌体检测方法外泌体是什么?外泌体(exosome)是是一种能被大多数细胞分泌的微小膜泡,这种微小膜泡中含有细胞特异的蛋白、脂质和核酸,能作为信号分子传递给其他细胞从而改变其他细胞的功能。
从细胞中提取外泌体后可以通过透射电镜来分析exosome的大小、形态等,再经过Western Blot可以分析特定蛋白在exosome中的表达情况。
外泌体中的蛋白、RNA和脂肪成分特异,并且携带了一些重要的信号分子,其在多种疾病的早期诊断中发挥着重要的作用。
如何提取外泌体?外泌体的提取方法有很多,例如超速离心法、密度梯度离心、超滤离心、PEG-base沉淀法、磁珠免疫法和试剂盒提取。
实验室常用的提取方法是如下两种:1、超速离心法(差速离心)超离法是常用的外泌体纯化手段,采用低速离心、高速离心交替进行(如图所示),可分离到大小相近的囊泡颗粒。
超离法因操作简单,获得的囊泡数量较多而广受欢迎,但过程比较费时,且回收率不稳定(可能与转子类型有关),纯度也受到质疑;此外,重复离心操作还有可能对囊泡造成损害,从而降低其质量。
2、试剂盒提取近几年来,市场上已出现各种商业化的外泌体提取试剂盒,有的是通过特殊设计的过滤器过滤掉杂质成分,有的则采用空间排阻色谱法(SEC)进行分离纯化,也有的则利用化合物沉淀将法外泌体沉淀出来。
这些试剂盒不需要特殊设备,随着产品不断更新换代,提取效率和纯化效果逐渐提高,因而逐渐取代超速离心法并推广开来。
有些试剂盒操作简便,不用超速离心,同时可获得高纯度和高回收率的外泌体。
外泌体粒径分析、浓度检测外泌体粒径分析方法为纳米颗粒跟踪分析(Nanoparticle tracking Analysis, NT A),其原理是对每个颗粒的布朗运动进行追踪和分析,结合Stockes-Einstein 方程式计算出纳米颗粒的流体力学直径和浓度。
NT A技术已被外泌体研究领域认可为外泌体表征手段之一。
相较于其他表征方式,NT A技术的样本处理更简单、更能保证外泌体原始状态、检测速度更快。
外泌体提取方法比较

外泌体提取方法比较外泌体是一种细胞外膜囊泡,通过一系列特殊的细胞分泌机制,从宿主细胞中释放出来。
外泌体中富含多种生物活性分子,如蛋白质、核酸、脂质和代谢产物等,对细胞间信息传递、免疫反应、炎症调节等生理和病理过程具有重要作用。
因此,外泌体的提取和分离成为研究其功能和应用的重要步骤。
目前常用的外泌体提取方法包括差速离心、超滤、密度梯度离心、覆膜及抗体磁珠法等。
以下将对这些方法的原理、优缺点进行详细介绍。
1.差速离心法:差速离心是一种简单且常用的外泌体提取方法。
它是通过逐步增加离心力,将细胞碎片和大颗粒物质从上清液中分离出来,最后得到外泌体的方法。
优点是操作简单、效果可靠,适用于大规模外泌体提取。
缺点是纯度较低,提取得到的外泌体中可能夹杂有其他细胞碎片和蛋白质聚集体。
2. 超滤法:超滤法是利用滤膜孔径选择性筛选颗粒物质的方法。
通常使用滤孔直径为20-100 nm的滤膜进行过滤,将大颗粒物质和细菌滤出,实现外泌体的提取。
优点是简便快速,可以得到较高纯度的外泌体。
缺点是容易因滤膜堵塞导致提取效果不佳,并且只能得到一部分外泌体。
3.密度梯度离心法:密度梯度离心法是根据物质密度的差异进行分离的方法。
通常使用等体积或等体积百分比的梯度溶液(如葡萄糖或蔗糖)进行离心,不同密度的物质会在梯度中分层沉淀。
外泌体的密度较低,往往在低密度梯度中聚集。
优点是可以分离得到高纯度的外泌体,并且可以细致分离不同类型的外泌体。
缺点是操作复杂,耗时较长。
4.覆膜法:覆膜法是指通过将培养基中的细胞和碎片离心去除后,直接在细胞上清液上方加入覆盖材料(如覆膜、多孔膜等),使外泌体通过覆盖材料进入上清液的方法。
优点是操作简单,不需要额外的离心步骤。
缺点是提取得到的外泌体纯度较低,可能夹杂有其他颗粒物质。
5.抗体磁珠法:抗体磁珠法是利用表面覆盖特定抗体的磁性微珠,通过与外泌体表面标记物质的特异性结合来实现外泌体的提取。
优点是提取效果稳定,纯度较高,可以选择性地提取一些类型的外泌体。
(完整版)外泌体提取方法总结

1、细胞培养上清:即在4℃下,首先300×g离心10 min,吸取上清液,然后2 000×g离心10 min;吸取上清液后,10 000×g 高速离心30 min,吸取上清液;140000×g超速离心90 min;除去上清液,所获得的沉淀即为外泌体。
用PBS缓冲液洗涤沉淀并重悬后,140 000×g 再次离心90 min,100 μL PBS缓冲液重悬沉淀,冻存于-80℃备用。
2、将小鼠或人血收集在1.5mL管中,并使其在37℃下凝结1小时而不进行抗凝。
此后,将其以2,000×g离心持续10分钟获得血清。
接着将血清以3,000×g离心10分钟。
将上清液以无菌PBS 以1:1的比例稀释并离心再次以10,000×g保持30分钟,然后以200,000×g进行2小时超速离心。
将颗粒在a中洗涤大量PBS,通过0.2-μm注射器过滤器过滤,并以200,000×g离心1小时,然后收集沉淀并重悬于PBS或PBS中用于后期功能或生化测定的培养基。
3、为了从体液(例如尿液,支气管肺泡灌洗液,血清,血浆,肿瘤腹水)中纯化外泌体,只需通过常规方法收集液体即可。
血浆用紫色的管子,EDTA抗凝,血清的话不抗凝直接离心。
在4°C下在玻璃瓶中储存长达5天,直至进行外泌体纯化。
外泌体纯化的原理与从组织培养条件培养基开始时的原理相同,但由于某些流体的粘度,必须稀释它们,并增加离心的速度和长度。
该方案已在作者的实验室中用于从人血浆中纯化外泌体(Caby等,2005)。
基本方案1中指出的所有预处理也适用于该方案。
材料液体(例如,血浆:通过Ficoll离心与血细胞分离;淋巴,血清,尿液,细支气管灌洗或肿瘤腹水)磷酸盐缓冲盐水(PBS;附录) 2A)冷冻离心机50毫升聚丙烯离心管0.22微米过滤装置(如Steritop,Millipore)超速离心机和固定角度或摆动式转子(见表3.22.1)适用于超速离心机转子的聚合物管或聚碳酸酯瓶(见表3.22) 0.1)注意:所有离心均应在4℃下进行。
最常用的外泌体提取方法

最常用的外泌体提取方法外泌体作为近几年来的研究热点,受到了科研工作者的青睐及追捧。
由于外泌体内携带有大量的miRNA, 少量lncRNA,Mrna 以及DNA蛋白质成为液体活检的潜力无限的研究对相。
所以,获得纯度高、内容物完整的外泌体非常之重要,那么,外泌体的提取方法也显得尤为重要。
一、差速离心法差速离心法可以说是最传统最普遍的外泌体提取方法。
原理是:首先低速离心以除去细胞和细胞凋亡碎片;随后,高速离心以去除大囊泡;最后高速离心以沉淀外泌体。
具体步骤是: 以下所有步骤都在4℃下进行,1、300×g 10min,弃沉淀,去除细胞2、2000×g 20min,弃沉淀,去除死细胞3、10,000×g 30min ,弃沉淀,去除细胞碎片等亚细胞成分4、10,000×g 70min,弃上清,沉淀即为外泌体5、PBS(每10ml细胞培养液用30mlPBS重悬)清洗沉淀物,混匀, 10,000×g 70min6、l ml PBS溶解沉淀(外泌体),立即使用或置于-80℃备用。
7、一般超速离心法会结合密度梯度离心,这样得到的外泌体更纯,具体做法第4步后蔗糖梯度离心,10,000×g 70min,以去除密度大于1.21g/ml的颗粒。
优点是:成本低,操作简单,获得的囊泡数较多。
缺点是:耗时耗力(需用时8-30h,并且每次只能处理6个样本),获得的外泌体纯度不是很高,高速及重复离心也会对外泌体产生很大的伤害,并且不适用于如血浆和血清等粘性液体生物样本。
二、密度梯度离心法该方法由于比较繁琐,用的较少。
原理是:像所有的脂质小囊泡一样,外泌体可以悬浮于特定密度梯度的蔗糖中,其密度范围1.13g/ml-1.21g/ml,将要分离外泌体的样本液体置于梯度蔗糖介质上,随后通过离心将外泌体分离。
此法获得的外泌体纯度较高,但步骤繁琐,耗时,对离心时间极为敏感。
具体步骤是:收集培养2d的上清液。
外泌体的分离鉴定

外泌体的分离鉴定[摘要]外泌体,细胞间物质信息的传递者,在细胞生物学以及分子生物学领域中,扮演着越来越重要的角色。
然而目前对于外泌体的分离鉴定还存在一定的困难,因此本文对外泌体的分离鉴定方法进行综述,为外泌体的进一步研究提供更有效的方法。
近年来,越来越多的证据表明外泌体对于细胞生物学以及医学研究方面具有重要的价值,而由于外泌体的体积结构方面的因素,其分离纯化还存在很大的困难,目前比较常用的分离方法有差速离心法、密度梯度离心法、超滤离心法、免疫磁珠法、多聚物沉降法等。
1. 差速离心法陈绍倩[1]等人以白血病细胞系K562细胞为材料,采用多步离心的方法成功地提取到了的外泌体。
此种实验方法操作不是很复杂,实验设备要求相对简单,拥有超速离心机和细胞培养设备即可,是一种比较简便的提取外泌体的方法,基本可以满足实验研究的要求。
但分离纯度不是很高,并且经过多次离心对外泌体的理化性质造成一定的影响。
2. 密度梯度离心法像所有的脂质小囊泡一样,外泌体悬浮于特定密度梯度的蔗糖中,其密度范围从 1.13g/ml 到1.210g/ml ,将细胞混悬液或匀浆置于蔗糖介质的顶部,通过重力或离心力场的作用使细胞分层、分离,从而将外泌体从混杂的物质如蛋白聚集物或细胞凋亡的核小体碎片等中分离出来[2] 。
崔焱[3] 等人根据其这一特性,从大量培养的肿瘤细胞上清中分离纯化外泌体,并对此进行了电镜鉴定; 在得到大量较高纯度的外泌体的基础上,将其加入含有白细胞介素-2(1L-2 )的淋巴细胞培养体系中,观察其对淋巴细胞增殖的影响。
3. 超滤离心法王伟[4] 等人以树突状细胞为实验材料,基于对外泌体物理特性,大小以及密度的了解,将超滤离心分离外泌体的方法与传统的分级离心法进行了比较,通过实验证明超滤离心法耗时少,产量和纯度都得到了很大程度的提高,是一种比较高效的制备外泌体的方法。
4. 免疫磁珠法将具有磁性的磁珠表面包被特殊的抗体,细胞表面抗原能与连接有磁珠的特异性抗体结合,在外加磁场中,通过抗体与磁珠相连的细胞被吸附而滞留在磁场中,无该种表面抗原的细胞由于不能与磁珠结合而不能在磁场中停留,从而使细胞得以分离。
外泌体提取方法及鉴定分析研究进展

外泌体提取方法及鉴定分析研究进展外泌体是细胞分泌的一种微小膜泡,包含了多种生物活性分子,如蛋白质、核酸和脂质等。
近年来,随着生物技术的不断发展,外泌体提取方法和鉴定分析研究取得了显著的进展。
本文将对外泌体提取方法及鉴定分析研究进展进行简要综述。
外泌体是由细胞分泌的一种直径约30-100nm的膜泡,由细胞内吞摄取并加工处理形成。
外泌体在细胞间通讯、物质运输以及疾病诊断等方面具有重要作用。
化学法是一种常用的外泌体提取方法,主要采用离心和沉淀相结合的方法。
首先将细胞培养液进行高速离心,去除细胞和较大的膜泡,然后加入沉淀剂沉淀获得外泌体。
该方法的优点是操作简单、提取量较大,适合大量样本的处理。
但是,该方法纯度较低,可能会影响后续的鉴定和分析。
生物法是一种利用细胞表面标志物进行免疫吸附的外泌体提取方法。
将外泌体进行免疫吸附,再通过洗脱得到纯度较高的外泌体。
该方法的优点是纯度高、对细胞损伤小,适用于珍贵样本的提取。
但是,该方法操作复杂,提取量较小,需要大量的抗体。
基因工程法是一种利用细胞表达特定基因的外泌体提取方法。
将目的基因转染到细胞中,通过表达特定膜蛋白,诱导细胞分泌出外泌体,再对其进行纯化和提取。
该方法的优点是纯度高、提取量较大,适用于具有特定功能的外泌体提取。
但是,该方法需要特定的基因工程技术和细胞系,操作较为复杂。
蛋白质组学在外泌体研究中的应用不断深入。
通过蛋白质组学技术,可以鉴定外泌体中的蛋白质种类、相对丰度以及修饰情况等。
通过比较不同条件下外泌体蛋白质组学的差异,可以研究外泌体的生物学特征和功能。
随着二代测序技术的不断发展,基因序列分析在外泌体研究中也得到广泛应用。
通过对外泌体中的核酸进行测序,可以鉴定其中的基因序列和表达水平。
通过比较不同条件下外泌体基因序列的差异,可以研究外泌体在细胞间通讯和疾病诊断等方面的作用。
转录组测序转录组测序可以分析外泌体中的mRNA、lncRNA和miRNA等转录本。
exosomes外泌体实验方案.docx

外泌体分离提纯草案By 朱旭峰一、以超高速离心的方法来分离外泌体(细胞上清)1.1细胞培养液(CM)是来自无菌的80%-90%的培植细胞,并用浓度比1:1.000的蛋白酶抑制剂混合。
(sigma)1.2快速地将CM用0.22μm 的过滤筛(Millipore)过滤,来分离完整地细胞和残渣。
超速离心于120,000_g (Sorvall WX ULTRA SERIES,rotor A-641) 4 ℃ . 2 小时1.3用1mL 冷的 PBS 重悬和清洗小囊泡,再次超速离心 120,000_g(Sorvall WX ULTRA SERIES, rotor A-641) 4 ℃ . 2 小时1.4再用100μL 冷的 PBS 重悬后转移到低粘附的管中1.5快速地使用或置于-80℃中待用为检测外泌体的蛋白浓度,取2μL的样品置于卡上,用Direct Detect™(Millipore)2材料a)细胞培养液b)蛋白酶抑制(Sigma)c)过滤筛(Millipore)d)冷的 PBSe)低粘附的管f)Direct Detect™(Millipore)二、以超高速离心的方法来分离外泌体(人血浆)1.1在提取外泌体之前应该向血浆里添加1;500浓度比的蛋白酶抑制剂(Sigma)1.2将上清液移至一个新的管中离心200*g 20分钟 4℃1.3小心地再将上清液移至新的管中离心 10000*g 30分钟于4℃来去除较大的囊泡、1.4此阶段的样品可以1.5将样品用0.22μm的注射器滤筛(Millipore)过滤并且离心110000g(Sorvall WX ULTRA SERIES, rotor F65L) 2小时 4℃1.6用冷的PBS重悬后再次超速离心(110,000g, 1 h, 4 ℃).,1.7将外泌体小心干燥并且用冷的PBS重悬1.8外泌体应该立即使用或-80摄氏度冷藏2.材料a)蛋白酶抑制(Sigma)b)过滤筛(Millipore)c)冷的 PBSd)低粘附的管e)Direct Detect™(Millipore)三、ExoQuick TM化学沉淀法1.1ExoQuick TM的使用要按照厂家提供的说明书来实行1.2该试剂盒可以简单地提取CM,人血浆,和血清里的外泌体,只需用倒相管按照所指示的量来加入ExoQuick TM试剂盒里的溶液1.3溶液孵化过夜,在4℃温和的摇晃1.4在流式细胞仪缓冲液中洗涤1.5试剂盒里的带荧光的免疫磁珠已经被绑定,用流式细胞仪鉴定即可(BD Biosciences) 配合使用CellQuest 的软件。
如何分离纯化、鉴定外泌体
如何分离纯化、鉴定外泌体外泌体相关研究逐渐从小众走向大众,受到越来越多的关注,涌现了一大批的外泌体课题。
但大家还是感觉外泌体研究好难啊!为什么呢?首要原因就在于该领域里还木有统一的、简单可行且纯度很高的分离方法。
今天就来给大家聊一聊如何搞定外泌体研究中的第一步。
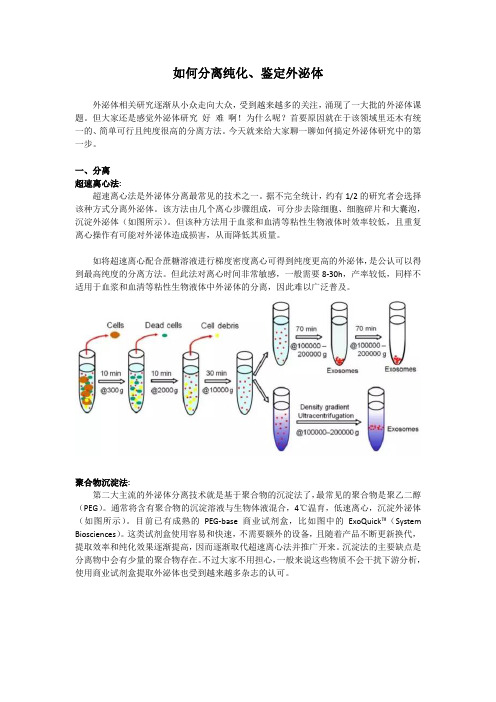
一、分离超速离心法:超速离心法是外泌体分离最常见的技术之一。
据不完全统计,约有1/2的研究者会选择该种方式分离外泌体。
该方法由几个离心步骤组成,可分步去除细胞、细胞碎片和大囊泡,沉淀外泌体(如图所示)。
但该种方法用于血浆和血清等粘性生物液体时效率较低,且重复离心操作有可能对外泌体造成损害,从而降低其质量。
如将超速离心配合蔗糖溶液进行梯度密度离心可得到纯度更高的外泌体,是公认可以得到最高纯度的分离方法。
但此法对离心时间非常敏感,一般需要8-30h,产率较低,同样不适用于血浆和血清等粘性生物液体中外泌体的分离,因此难以广泛普及。
聚合物沉淀法:第二大主流的外泌体分离技术就是基于聚合物的沉淀法了,最常见的聚合物是聚乙二醇(PEG)。
通常将含有聚合物的沉淀溶液与生物体液混合,4℃温育,低速离心,沉淀外泌体(如图所示)。
目前已有成熟的PEG-base商业试剂盒,比如图中的ExoQuick™(System Biosciences)。
这类试剂盒使用容易和快速,不需要额外的设备,且随着产品不断更新换代,提取效率和纯化效果逐渐提高,因而逐渐取代超速离心法并推广开来。
沉淀法的主要缺点是分离物中会有少量的聚合物存在。
不过大家不用担心,一般来说这些物质不会干扰下游分析,使用商业试剂盒提取外泌体也受到越来越多杂志的认可。
二、鉴定外泌体的鉴定是继分离后又一个困扰研究者的问题。
如果大家看过外泌体研究相关的文献,就肯定对一张图印象深刻。
不错,想发外泌体文章,光找到高效率的分离方法还不够,要过的第二关就是证明你分离得到的就是外泌体。
鉴定方式不外乎就是下面这三种:1. 形态学(电镜);2. 粒子大小(径粒分析);以及3. 标志蛋白(WB)。
【干货分享】外泌体提取的3种超速离心方法(内含赠书福利)

献中具体的各阶段离⼼⼒和时间⼤同⼩异,主要可以参考参考⽂献1。
超速离⼼提取外泌体流程⽰意图可见进阶版中的第1-5步。
基于蔗糖垫的超速离⼼如果对外泌体的纯度要求较⾼,但⼜不想做密度梯度离⼼那么⿇烦,⼤家可以⽤基于蔗糖垫的超速离⼼⽅法。
这⾥以提取细胞上清中外泌体为例,给⼤家详细提供⼀个protocol蔗糖垫⽰意图新鲜收集细胞上清,以300 g、4度、离⼼10 min,去除细胞、死细胞,离⼼后取上清;10 min,去除细胞碎⽚,离⼼后取上清;注:常有⼩伙伴问细胞上清不能及时处理,该怎么保存。
此步骤后的上清可于提取外泌体为佳;若需长期保存,可冻存于-80度,解冻时4度慢融。
切记不经⼀⼆步离⼼去除细胞、死细胞、细胞碎⽚就直接保存,会严重影响后⾯提取的外泌体的组分。
度、离⼼30 min,去除⼤膜泡,离⼼后取上清;就在于密度梯度怎么弄了。
碘克沙醇密度梯度离⼼⼯作流程⽰意图密度梯度的制作⽬前主要利⽤蔗糖或者碘克沙醇(iodixanol)。
以碘克沙醇为例,可以买到OptiPrep density gradient medium,按照40%、20%、10%、5%配好,⼩⼼依次铺到离⼼管中,最上层加浓缩的细胞上清或⾎浆/清。
在5-10-20-40%碘克沙醇密度梯度中,外泌体主要富集在第6、7个fractions中有⼩伙伴会对⽤什么类型转⼦有疑问。
超速离⼼常⽤两种转⼦:⽔平转⼦和固定⾓转⼦。
⽔平转⼦也叫⽔平转头(如下图左)。
在离⼼过程中,离⼼管与轴之间的⾓度从开始 0°变成⽔平转⼦90°,停⽌时⼜成为0°。
固定⾓转⼦也叫定⾓转⼦、定⾓转头(如下图右)。
在离⼼过程中,离⼼管与轴之间的⾓度是固固定⾓转⼦定的,通常在20°到45°之间。
离⼼时,样品会⾸先沉淀到离⼼管侧壁,然后下滑⾄离⼼管的外侧底部聚集。
⽔平转⼦(左)与定⾓转⼦(右)这2种转⼦区别,⼤家看下⾯的图解就明⽩了。
所以,普通超速离⼼既可以⽤定⾓转⼦也可以⽤⽔平转⼦,如果离⼼管透明度不⾼,定⾓的离⼼最后沉淀在管底的侧⾯,有易于观察的优势(外泌体量多可⾁眼观察时);但是主要还是看个⼈习惯。
真正的外泌体:如何利用超速离心法纯化外泌体

真正的外泌体:如何利用超速离心法纯化外泌体细胞作为我们生命最小的单位,我们有宏观的沟通,他们自然也有微观的沟通。
而这细胞的“语言”,就是外泌体系统。
外泌体系统的意义简单的来说,细胞通过分离自己的一部分膜,把自己“情话”(核酸,蛋白等)包裹成外泌体释放出去,最后融入到别的细胞里进行沟通。
对于我们人类来说,破解了外泌体系统等于破解了细胞沟通的密码,对于我们生命科学发展意义非凡。
用超速离心法纯化外泌体研究和应用外泌体的第一步,那一定是得先把这些小家伙给抓住。
虽外泌体分离市场上百花齐放。
但这些分离技术都在纯度上不尽人意。
得到最纯的外泌体,揭开他们背后的故事,超速离心技术是最好的选择。
近日,麻省综合医院(MGH)的研究人员开发的一款新型微流体装置。
该装置可以利用微流控技术快速检测血液中癌症细胞来源的外泌体,以此作为癌症诊断手段。
通讯作者Shannon Stott教授说,他们的设备能够从在血液中数十亿细胞外囊泡中挑选出肿瘤特异的细胞外囊泡。
这将为未来癌症诊断及监控提供新的方法。
诱导成纤维细胞的迁移和增殖以及胶原的合成近年来的更多研究表明干细胞在再生医学中具有巨大的治疗潜力,通过分泌抗炎、抗纤维化和促血管生成活性的因子,如可溶性分子(生长因子、细胞因子)或细胞外囊泡(微粒子、外泌体)等来改善创面愈合过程。
近年来还出现了新的趋势——单独使用干细胞外泌体。
外泌体被包裹在坚硬的双层膜中,双层膜保护外泌体的内容物,使外泌体能够在组织中长距离移动。
干细胞外泌体因在上皮组织的增殖、迁移、再生、炎症和瘢痕控制等方面的作用,有望成为“无细胞的细胞治疗”工具。
已有研究表明外泌体是干细胞旁分泌作用的主要介质,它们的内容物(mRNA、microRNA、各种抗凋亡和促血管生成因子)被发现可诱导成纤维细胞的迁移和增殖以及胶原的合成。
外泌体避免皮肤衰老损伤紫外线损伤和老化会影响细胞外基质胶原蛋白和弹性蛋白,这两者都是防止皮肤脱水以及保持皮肤紧致和弹性的关键。
血清外泌体提取方法(一)

血清外泌体提取方法(一)血清外泌体提取方法1. 超速离心法•使用超速离心机将血清样本离心,离心速度一般在10,000 g以上。
•离心后,将上清液转移到新的离心管中,避免沉淀物的干扰。
2. 滤膜法•将血清样本通过0.22微米的滤膜过滤器进行过滤,以去除大部分细胞和碎片。
•过滤后的上清液就是富含外泌体的样本,可以用于进一步提取和研究。
3. 差速离心法•使用差速离心机,先进行低速离心,去除大部分细胞和碎片。
•然后将上清液转移到新的离心管中,进行高速离心,富集外泌体。
•最后将上清液转移至新的离心管中,以去除杂质,得到纯净的外泌体样本。
4. 密度梯度离心法•制备不同密度梯度的离心液,将血清样本与离心液混合。
•使用超速离心机进行离心,外泌体会在不同密度梯度的离心液层中分布。
•取出目标密度层中的外泌体,进行后续研究。
5. 抗体亲和法•利用特定的抗体对外泌体表面的蛋白进行识别和结合。
•通过结合特定的抗体,可以将外泌体与其他细胞碎片和蛋白质区分开来。
•进一步使用离心等方法,将外泌体富集提取。
6. 生物素链霉亲和法•将生物素链霉素与其他蛋白结合,并加入血清样本中。
•生物素链霉素会特异性地结合外泌体表面上的生物素结合受体。
•利用生物素链霉素的亲和性,将外泌体富集提取出来。
7. 电泳法•使用凝胶电泳将血清样本进行分离。
•外泌体会在凝胶中迁移,形成独特的带状图案。
•通过裁剪目标带进行提取和研究。
以上是一些常用的血清外泌体提取方法,每种方法都有其优缺点和适用范围。
在选择方法时,需要根据实验目的和具体情况进行综合考虑。
8. 静电荧光法•利用外泌体表面的电荷性质,通过静电作用将外泌体富集提取。
•常用的静电荧光染料有山萸苷、草酸黄等,可与外泌体表面的负电荷相互吸引。
•通过荧光信号的增强,可以富集和检测外泌体。
9. 残余血小板法•血浆中存在大量的残余血小板,这些血小板上富集有很多外泌体。
•使用低速离心法去除大部分细胞和碎片后,对残余血小板进行高速离心,获取外泌体样本。
采用高速离心及ExoQuick-TC法提取小鼠骨髓间充质干细胞来源外泌体比较及鉴定

采用高速离心及ExoQuick-TC法提取小鼠骨髓间充质干细胞来源外泌体比较及鉴定韩金秀;李宏远;撒亚莲;严丹;贺继刚【摘要】比较及鉴定超高速离心法及ExoQuick-TC法提取小鼠骨髓间充质干细胞来源外泌体.采用BCA蛋白检测可见ExoQuick-TC法提取的外泌体蛋白含量高于超高速离心法提取的蛋白含量.Exosome Antibodies,Array & ELISA Kits检测可见ExoQuick-TC法提取外泌体的纯度优于超高速离心法提取的纯度.两种方法提取的外泌体电镜下形状无差异,随机选取3个电镜视野进行计数可见ExoQuick-TC法提取外泌体数量多于超高速离心法提取外泌体. ExoQuick-TC法提取的外泌体具有更高的产量及纯度.%To compare ultracentrifugation and ExoQuick-TC in identifying the characteristics of exosomes extracted from mouse bone marrow mesenchymal stem cells.BCA protein assay revealed that the protein contents in the ExoQuick-TC-extracted exosomes were higher than those in the ultracentrifugation-extracted exosomes.Analysis using exosome antibodies, array, and ELISA kits indicated that the purity of the ExoQuick-TC-extracted exosomes was higher that of the ultracentrifugation-extracted exosomes.Electronmicroscopy demonstrated that the morphological characteristics of the ExoQuick-TC-extracted exosomes did not significantly differ from those of the ultracentrifugation-extracted exosomes.Three electron microscope visual fields were randomly selected to count the number of exosomes.Results showed that the number of the ExoQuick-TC-extracted exosomes was more than that of the ultracentrifugation-extracted exosomes.Therefore, the production andpurity of ExoQuick-TC-extracted exosomes are higher than those of ultracentrifugation-extracted exosomes.【期刊名称】《安徽医科大学学报》【年(卷),期】2017(052)004【总页数】4页(P611-614)【关键词】外泌体;小鼠骨髓间充质干细胞;超高速离心;ExoQuick-TC法【作者】韩金秀;李宏远;撒亚莲;严丹;贺继刚【作者单位】昆明理工大学附属云南省第一人民医院心脏大血管外科,昆明650032;昆明理工大学附属云南省第一人民医院心脏大血管外科,昆明 650032;昆明理工大学附属云南省第一人民医院基础研究所,昆明 650032;昆明理工大学附属云南省第一人民医院重症医学科,昆明 650032;昆明理工大学附属云南省第一人民医院心脏大血管外科,昆明 650032【正文语种】中文【中图分类】R654.2外泌体是由多种细胞分泌的一种大小介于40~100 nm的细胞外囊泡中的一种[1-2]。
外泌体提取要几步?

外泌体提取要几步?外泌体(exosomes)是活细胞分泌的直径约为30-150nm的膜性囊泡,准确来讲,外泌体是一类由细胞释放的细胞外囊泡。
根据其生物合成或释放途径可以对细胞外囊泡进行分类:1.外泌体(exosomes):起源于内吞途径,直径为30-150nm,其密度约为1.11-1.19g mL-1;2.微粒/微囊泡(microparticles):直接从质膜释放,直径约100-1000nm;3.凋亡小体(apoptoticbody/bleb):由细胞凋亡产生,直径约为50nm-2um;4.肿瘤小泡(large oncosomes):由肿瘤细胞释放产生,直径约1-10um;5.以及其他各种EV亚群;外泌体广泛存在于多种体液中,包括血液、唾液、尿液和母乳。
起初人们认为它是一种细胞的废弃物,并未受到足够的重视。
2013年的诺贝尔生理或医学奖颁给了三位科学家,他们分别是美国科学家James E.Rothman、Randy W.Schekman以及德国科学家Thomas C.Südhof,以表彰他们发现细胞内部囊泡(外泌体等)运输调控机制,使外泌体的研究达到全新的高度。
研究发现外泌体能够运载其内源性的蛋白质、脂质、各种代谢酶、mRNA和其他非编码RNA如Mircrorna等,参与重要的细胞间通信过程,尤其在免疫应答/肿瘤侵袭过程中参与重要作用;同时,外泌体的类型和水平,以及携带的蛋白、脂类、mRNA、miRNA、DNA 可以作为生物标志物,作为疾病诊断的依据;外泌体具有脂质双层膜结构,对内容物具有很好的保护作用,可以用作药物载体靶向特定细胞或组织。
如前所述,外泌体存在于多种体液,因此细胞培养的胎牛血清中往往含有外泌体,对于实验研究造成影响。
为了避免外来外泌体体的污染,细胞在正常含有血清的培养基中培养一定时间,贴壁细胞密度在60%-70%,去除原有培养基,换为新的不含外泌体的培养基或者无血清培养基并继续培养24-48小时。
外泌体提取方法小结

外泌体提取方法小结随着近几年大家对外泌体的认识和了解,外泌体吸引了诸多科学家的注意力,因其能够为癌症早期诊断和治疗提供有意义的生物标记物。
那么对于研究外泌体的科学家来说,第一步,提取外泌体至关重要,今天我们分享一篇关于外泌体的提取方法到底对后续研究有什么影响?是否能给在做外泌体研究的你带来一些帮助。
这些年我们一起提取过的外泌体!外泌体通常是30-120纳米的微小膜泡,具有脂质双分子结构,来自于几乎所有正常细胞和肿瘤细胞中多泡体(MVB)的管腔膜,它们被认为通过从原始细胞中装载蛋白质、代谢物和核酸(mRNA,miRNA)等物质,参与细胞之间的交流。
这些蛋白质、代谢物和核酸(mRNA,miRNA)可以在与细胞膜融合后释放到细胞外间隙。
外泌体上可以检测到许多细胞表面膜蛋白,其中一些可用于癌症的早期检测、诊断和预后。
常用的外泌体分离方法是超速离心,这种方法非常耗时耗力且需要一台超速离心机。
例如还有其他的一些方法,免疫亲和,超滤法,化学聚合沉降法和凝胶过滤层析(size-exclusion chromatography,SEC)。
SEC是一种分离血液蛋白质中外泌体的理想方法。
尽管有报道说这种过滤层析的方法本身有最低的外泌体载量的限制,但是SEC还是被广泛应用于临床样本的分析。
Table:外泌体的提取方法比较血液样本外泌体我该如何选方法?此研究中比较了3种分离方法,第一种包括使用多次超速离心的方法(UC方法),第二种方法商业qEV凝胶过滤层析柱,第三种方法也是120分钟的超速离心+qEV凝胶过滤层析柱过滤。
在使用层析过滤(SEC)这种方法时,每个SEC柱子过滤0.5mL 的稀释血清,每个组分的洗脱液(0.5mL)被收集起来,然后每个组分中的蛋白通过使用BCA法测浓度,发现第9和第10次洗脱下来的蛋白与前面第8次的量多出很多。
如下图统计图所示。
另外,通过投射电子显微镜发现3种方法从人血清中分离的外泌体具有相近的形态学和相似的大小分布。
不同离心方法提取及鉴定精浆外泌体的效果比较

不同离心方法提取及鉴定精浆外泌体的效果比较郭文彬;张万松;杨诚;卞军;杨建昆;刘存东;亓涛;王春艳【摘要】目的超速离心法、ExoPerfectTM-MU法和PEG6000法比较提取精浆外泌体的应用报道较少.文中旨在比较及鉴定超速离心法,ExoPerfectTM-MU法及PEG6000法提取的精浆外泌体,为外泌体的研究提供不同的选择方法.方法收集2017年3月至7月南方医科大学南方医院检验中心30例正常志愿者的精浆样本.随机平均分成3份,分别采用超速离心法,ExoPerfectTM-MU法及PEG6000法获取提取物,随后采用纳米颗粒跟踪分析仪分析其大小,透射电子显微镜观察其形态,蛋白印迹法检测其典型标志蛋白质.结果超速离心法提取的精浆外泌体中CD63、TSG101含量[(3.29±0.22)、(0.84±0.03)]最多,其次分别是ExoPerfectTM-MU法[(3.25±0.17)、(0.75±0.02)]、PEG6000法[(2.62±0.06)、(0.54±0.10)],差异有统计学意义(P<0.05).纳米颗粒跟踪分析仪结果提示MODE曲线线性流畅,精浆外泌体直径大小较为集中,粒径峰值平均值分别为105、102、115 nm,差异无统计学意义(P>0.05).PEG6000法提取精浆外泌体的浓度、电镜下数量[(11.90±1.78)×108/mL、(4.7±1.7)个]较超速离心法[(21.20±0.98)×108/mL、(7.0±1.6)个],ExoPerfectTM-MU法[(19.74±1.45)×108/mL、(6.0±1.63)个]均明显降低(P<0.01);ExoPerfectTM-MU法离心时间[(30±5)min]较超速离心法、PEG6000法[(140±20)、(120±10)min]明显缩短(P<0.001).结论超速离心法、ExoPerfectTM-MU法、PEG6000法均能成功提取及鉴定精浆外泌体.超速离心法、ExoPerfectTM-MU法外泌体产量较多,ExoPerfectTM-MU法简捷方便.根据不同试验的实际需要,选择合适高效的外泌体提取方法尤为重要.【期刊名称】《医学研究生学报》【年(卷),期】2019(032)002【总页数】5页(P158-162)【关键词】精浆;外泌体;超速离心;ExoPerfectTM-MU;PEG6000【作者】郭文彬;张万松;杨诚;卞军;杨建昆;刘存东;亓涛;王春艳【作者单位】510630 广州,南方医科大学第三附属医院泌尿外科;510630 广州,南方医科大学第三附属医院泌尿外科;510630 广州,南方医科大学第三附属医院泌尿外科;510630 广州,南方医科大学第三附属医院泌尿外科;510630 广州,南方医科大学第三附属医院泌尿外科;510630 广州,南方医科大学第三附属医院泌尿外科;510515 广州,南方医科大学南方医院检验中心;510515 广州,南方医科大学南方医院检验中心【正文语种】中文【中图分类】R5670 引言外泌体是一种能被机体内大多数细胞分泌的微小膜泡,具有脂质双层膜,直径大约30~150nm[1⁃4]。
血浆外泌体超速离心分离的策略优化(内含赠书福利)

血浆外泌体超速离心分离的策略优化(内含赠书福利)外泌体是 30-120 nm 大小的膜结合囊泡,起源于所有类型的正常细胞和肿瘤细胞中的多泡体(MVB) 的腔膜。
据信,它们通过从原始细胞加载货物蛋白、代谢物和核酸(mRNA、miRNA)来参与细胞间通讯,这些蛋白质、代谢物和核酸(mRNA、miRNA)可以在与质膜融合后释放到细胞外空间。
在外泌体中可以检测到许多细胞表面膜蛋白,其中一些可用于癌症的早期检测、诊断和预后。
这使得体液来源的外泌体成为近些年研究的热点。
目前研究主要集中在尿液、脑脊液和血液来源的外泌体成分作为疾病标志物的开发上,而血液来源的外泌体又是目前研究中使用最多、涉及疾病最为广泛的类型。
但是相比于尿液和脑脊液,血液的成分更加复杂,大量的游离蛋白和脂蛋白颗粒对外泌体的分离构成了挑战。
如何拿到较为纯净的血液来源外泌体用于后续研究是很多初入外泌体领域研究者们所面临的最大困难。
针对这一问题,今天与初入外泌体领域的朋友们分享一篇技术探讨性的文章。
大家通常使用血清或者血浆作为外泌体分离的原材料,其中血浆更佳,这是因为血清在制备过程中会激活血小板从而掺入血小板来源的细胞外囊泡,这可能会影响后续的下游分析。
今天分享的文章就是以血浆(serum)作为研究材料进行技术探讨的。
虽然,梯度密度离心被认为是血浆外泌体分离纯化的最优策略,但是该方法需要配置密度梯度,操作略复杂。
针对刚刚开始外泌体研究的朋友们来说,是否有折中的策略呢?这篇文章提出了一种优化的超速离心策略,并将这一策略与凝胶排阻层析策略进行了比较,取得了不错的结果。
注:文章中对比的不同分离策略这篇文章以“Comparisonof an Optimized Ultracentrifugation Method versus Size-Exclusion Chromatographyfor Isolation of Exosomes from Human Serum”为题,发表在《J Proteome Res》上。
