氧化反应合成醛酮炔烃通过硼氢化作用
酮

三、烯烃的臭氧化及类似的氧化
四、烯、炔的硼氢化-氧化(Brown反应)
五、亚甲基氧化
1、取代芳烃的亚甲基氧化
取代芳烃的亚甲基可被多种试剂氧化成酮。高锰酸钾、重铬酸钾、过氧化叔丁 醇等都是有效的氧化剂。 催化下的空气氧化虽然转化率不高,但具有简便、经济的特点,适用于工业生 产,三氧化铬是常用的催化剂。此外,电化学氧化法也可以把芳烃的亚甲基氧化成 酮。 在五氟苯硒酸催化下,下列化合物被叔丁基过氧化氢定量地氧化成酮
冰片烯在乙酐、吡啶和DMF中,被氧化成β—冰片烯酮,产率达97%
3、酮的亚甲基氧化
酮的亚甲基氧化是α-二酮的重要合成方法。常用的氧化剂是二氧化硒的二 氧杂环己烷、乙酸、乙酸酐、水或乙醇溶液。 在水或醇中,二氧化硒被转化为亚硒酸或亚硒酸二烷基酯。此外,硝酸铊 亦是有效试剂。
六、烯烃的氧化(wacker反应)和炔烃的氧化 1、烯烃的氧化- wacker反应
在三氧化铬存在下,对乙基苯甲酸甲酯被空气氧化成对乙酰基苯甲酸甲酯
在含有Ce(皿)/Ce(1V)和硫酸的Pb—PbO2电解池中,乙苯被氧化成苯乙酮 产率达93%。
2、丙烯的亚甲基氧化
丙烯的亚甲基亦可被氧化成αβ—不饱和酮。常用的氧化剂有铬试剂如三氧化铬—乙 酸、三氧化铬吡啶、PCC、PDC、高碘酸钠、催化量的铬试剂或高锰酸钾/叔丁醇也 可以氧化烯丙位亚甲基,反应具有良好的区域选择性。 室温下,胆固醇乙酸酯用PDC/BuOOH氧化,仅7-亚甲基被选择氧化
OH NC Cl BCl3 H2O
OH
O Cl
+
86%
四、酚酯和芳酰胺的重排
酚酮可在三氯化铝存在下由酚与酰氯反应制得。但是,为了避免由于酚铝的形成 而引起的复杂性,更方便的方法是先制得相应的酚酯,继而在Lewis酸催化下重排 生成酚酮。常用的催化剂有三氯化铝、四氯化锡、四氯化钛、二氯化锌、三氟化硼 以及氟化氢、多聚磷酸等。
炔烃,为分子中含有碳碳三键的碳氢化合物的总称

炔烃·编辑炔烃,为分子中含有碳碳三键的碳氢化合物的总称,是一种不饱合的碳氢化合物,简单的炔烃化合物有乙炔(C2H2),丙炔(C3H4)等。
工业中乙炔被用来做焊接时的原料。
碳氢化合物官能团·碳碳三键分子通式·CnH2n-2(其中n为非1正整数)1炔烃简介编辑炔烃(拼音:quētīng;英文:Alkyne)是一类有机化合物,属于不饱和烃。
其官能团为碳-碳三键(-C≡C -)。
通式CnH2n-2,其中n为非1正整数。
简单的炔烃化合物有乙炔(C2H2),丙炔(C3H4)等。
炔烃原来也被叫做电石气,电石气通常也被用来特指炔烃中最简单的乙炔。
“炔”字是新造字,音同缺(quē),左边的火取自“碳”字,表示可以燃烧;右边的夬取自“缺”字,表示氢原子数和化合价比烯烃更加缺少,意味着炔是烷(完整)和烯(稀少)的不饱和衍生物。
简单的炔烃的熔点、沸点,密度均比具有相同碳原子数的烷烃或烯烃高一些。
不易溶于水,易溶于乙醚、苯、四氯化碳等有机溶剂中。
炔烃可以和卤素、氢、卤化氢、水发生加成反应,也可发生聚合反应。
因为乙炔在燃烧时放出大量的热,炔又常被用来做焊接时的原料。
“炔”字是新造字,音同缺(quē),左边的火取自“碳”字,表示可以燃烧;右边的夬取自“缺”字,表示氢原子数和化合价比烯烃更加缺少,意味着炔是烷(完整)和烯(稀少)的不饱和衍生物。
2炔烃轨道编辑炔烃的碳原子2S轨道同一个2P轨道杂化,形成两个相同的SP杂化轨道。
堆成地分布在碳原子两侧,二者之间夹角为180度。
乙炔碳原子一个SP杂化轨道同氢原子的1S轨道形成碳氢σ键,另一个SP杂化轨道与相连的碳原子的SP杂化轨道形成碳碳σ键,组成直线结构的乙炔分子。
未杂化的两个P轨道与另一个碳的两个P轨道相互平行,“肩并肩”地重叠,形成两个相互垂直的π键。
3分子结构编辑分子中含有碳碳三键的碳氢化合物的总称,碳氢化合物。
炔烃是含碳碳三键的一类脂肪烃。
4物理性质编辑炔烃的熔沸点低、密度小、难溶于水、易溶于有机溶剂,一般也随着分子中碳原子数的增加而发生递变。
有机化学的合成小结

有机化学合成小结~~不完全版对于烷烃的合成,主要涉及四种方法,如下:一、RX的还原1、使用RMgX格氏试剂RX在无水乙醚中与镁反应,可得格氏试剂,在活泼氢物质存在的条件下,如水,MgX部分可被H代替,从而生成烷烃。
通式为:RX+Mg→RMgX,RMgX+H2O→RH 比如1-溴丙烷,可通过该反应合成丙烷。
2、使用LiAlH4这是一个比较好的选择性还原剂。
RX+ LiAlH4→RH,RX + LiAlD4→RD如:2-碘戊烷,在LiAlH4存在下还原,I可被H代替,产物为戊烷。
3、使用LiBH4-LiH混合物,这是还原RX的专用试剂。
如:2-硝基-4-氯戊烷,在该条件下,可被还原成2-硝基戊烷。
二、烯烃或炔烃的还原这类反应需要催化剂catalyst,一般为使用Ni、Pd、Pt等。
对于烯烃:催化加氢(H2+catalyst),可得顺式产物,这一点在还原环烯烃时显得尤为重要,这主要与其反应机理有关,可参阅本blog中相关内容。
对于炔烃:使用催化加氢,可得烷烃,但在这里要注意,不能使用lindlar催化剂,使用lindlar催化剂只能得到顺式的烯烃,得不到烷烃。
三、C原子的加成1、科瑞-豪斯合成通式:RX+ Li→RLi;RLi+ CuI→R2CuLi;R2CuLi+R'X→R-R'注意:为了提高产率,R'X最好使用伯卤代烃,而RX则不限制。
合成的可以是对称的烷烃,也可是不对称的烷烃。
2、武兹合成2RX +Na→R-R,该方法只用来合成对称结构的烷烃,使用的RX必须为伯卤代烃,即便如此,产率也是非常低的。
3、生成环丙烷环,这种方法须使用CH2N2与紫外线照射四、RX在Zn和HX存在下还原(补充)Zn中有两个远离核的电子,可作为电子给予体,反应发生在Zn金属的表面,机理比较复杂。
烯烃的合成,主要有四种方法。
一、RX的消除(X=Cl、Br、I)一般使用的条件为碱的醇溶液,加热。
-X与相邻C上的H以HX形式脱离,这里要注意消除所遵循的规律:扎衣采夫。
有机化学的合成小结

有机化学合成小结~~不完全版对于烷烃的合成,主要涉及四种方法,如下:一、RX的还原1、使用RMgX格氏试剂RX在无水乙醚中与镁反应,可得格氏试剂,在活泼氢物质存在的条件下,如水,MgX部分可被H代替,从而生成烷烃。
通式为:RX+Mg→RMgX,RMgX+H2O→RH 比如1-溴丙烷,可通过该反应合成丙烷。
2、使用LiAlH4这是一个比较好的选择性还原剂。
RX+ LiAlH4→RH,RX + LiAlD4→RD如:2-碘戊烷,在LiAlH4存在下还原,I可被H代替,产物为戊烷。
3、使用LiBH4-LiH混合物,这是还原RX的专用试剂。
如:2-硝基-4-氯戊烷,在该条件下,可被还原成2-硝基戊烷。
二、烯烃或炔烃的还原这类反应需要催化剂catalyst,一般为使用Ni、Pd、Pt等。
对于烯烃:催化加氢(H2+catalyst),可得顺式产物,这一点在还原环烯烃时显得尤为重要,这主要与其反应机理有关,可参阅本blog中相关内容。
对于炔烃:使用催化加氢,可得烷烃,但在这里要注意,不能使用lindlar催化剂,使用lindlar催化剂只能得到顺式的烯烃,得不到烷烃。
三、C原子的加成1、科瑞-豪斯合成通式:RX+ Li→RLi;RLi+ CuI→R2CuLi;R2CuLi+R'X→R-R'注意:为了提高产率,R'X最好使用伯卤代烃,而RX则不限制。
合成的可以是对称的烷烃,也可是不对称的烷烃。
2、武兹合成2RX +Na→R-R,该方法只用来合成对称结构的烷烃,使用的RX必须为伯卤代烃,即便如此,产率也是非常低的。
3、生成环丙烷环,这种方法须使用CH2N2与紫外线照射四、RX在Zn和HX存在下还原(补充)Zn中有两个远离核的电子,可作为电子给予体,反应发生在Zn金属的表面,机理比较复杂。
烯烃的合成,主要有四种方法。
一、RX的消除(X=Cl、Br、I)一般使用的条件为碱的醇溶液,加热。
-X与相邻C上的H以HX形式脱离,这里要注意消除所遵循的规律:扎衣采夫。
硼氢化钠法-概述说明以及解释

硼氢化钠法-概述说明以及解释1.引言1.1 概述硼氢化钠法是一种重要的有机合成方法,它以硼氢化钠为还原剂,针对具有羰基官能团的化合物进行加氢反应。
这种方法由于其高效、选择性强以及对功能团容忍度高等优点,广泛应用于有机合成领域。
硼氢化钠法的原理基于硼氢化钠的还原作用。
硼氢化钠可以与羰基化合物中的羰基碳原子发生加成反应,形成烷基硼酸盐或醇盐。
这种反应是通过硼氢化钠中的氢原子被羰基氧原子上的氧原子所取代而实现的。
当还原反应完成后,硼氢化产生的化学物质可以通过水解或其他反应转化为目标产物。
硼氢化钠法的应用非常广泛。
它可以用于合成醇、醚、胺等有机化合物,并可用于各类羰基化合物的加氢反应。
这种方法在药物合成、天然产物合成、高分子材料合成等领域都得到了广泛应用。
硼氢化钠法不仅对功能团具有很好的容忍度,还能够在温和的条件下完成反应,减少了副反应的发生,并提高了产物纯度。
总之,硼氢化钠法是一种重要的有机合成方法,具有高效、选择性强、容忍度高等优点。
随着有机化学领域的不断发展和需求的增加,硼氢化钠法有着广阔的应用前景。
未来的研究可以针对其催化剂、反应条件等方面进行进一步的优化和改进,以提高反应的效率和产物的选择性。
1.2 文章结构文章结构如下:本文总共包括三个部分:引言、正文和结论。
引言部分,主要概述了硼氢化钠法的背景和重要性,并介绍了本文的文章结构。
首先概述硼氢化钠法的基本原理和应用领域。
接着介绍了文章的结构,提及本文将首先解释硼氢化钠法的原理,然后探讨其应用。
最后,明确了本文的目的,即总结硼氢化钠法的优点,并展望其未来的发展。
正文部分,将详细介绍硼氢化钠法的原理和应用。
首先,会对硼氢化钠法的原理进行深入阐述,包括其反应机理、主要步骤和相关实验条件等方面的内容。
其次,将探讨硼氢化钠法在不同领域的应用,如有机合成、金属还原、催化剂制备等。
通过真实案例和实验研究,展示硼氢化钠法在各个应用领域的优势和潜力。
结论部分,将综述硼氢化钠法的优点,并对其未来的发展进行展望。
第六章 炔烃

114第六章 炔烃分子中含有碳碳叁键的烃叫做炔烃。
碳碳叁键可位于碳链中的任意位置。
开链炔烃的分子通式为C n H 2n-2 。
碳碳叁键位于碳链一端的炔烃称之为单取代或末端炔烃。
6.1 炔烃的结构与烯烃的碳碳双键相比,炔烃的碳碳叁键经历了不同的杂化。
在此杂化过程中,碳的2s 轨道和三个2p 轨道中的一个进行杂化。
每个杂化轨道含有1/2 s 轨道和1/2 p 轨道的成分。
这些杂化轨道称之为sp 轨道。
由于sp 轨道的s 成分增加,乙炔中碳氢键的极性比乙烷和乙烯中的大很多。
乙烯的pK a 值大约在44,而乙炔的pK a 值大约在25,所以末端炔烃在一些特定的情况下,可以当成弱酸,尽管酸性甚至比水还弱很多。
碳碳叁键是两个sp 杂化的碳原子相互之间形成的。
碳原子中的两个sp 杂化轨道沿一轴线呈180 o 伸展 ,该轴线与非杂化的2p x 和2p y 轨道垂直。
当两个sp 杂化碳原子相互靠近时,sp-sp σ 键形成,于是每个碳原子其它两个p 轨道之间就以肩并肩方式重叠,形成两个相互垂直的π键,如图6.1所示。
因此,乙炔C 2H 2是一个线形分子,四个原子都排布在同一条直线上。
由于此线形特性,环状炔烃至少含有十个碳原子才能消除过多的张力。
此外,围绕炔烃叁键部分的电子云密度要比乙烷、乙烯大得多。
与烯烃类似,炔烃容易与亲电试剂相互作用。
(a)(b)图6.1 乙炔的模型(a )乙炔 sp 杂化示意图(b)乙炔的电子云结构模型乙炔碳碳叁键的长度为120pm,键能大约是836 kJ/mol,所以碳碳叁键是已知的键能最大,键长最短的碳碳键。
表格6.1 乙烷,乙烯,乙炔的共价键参数乙烷乙烯乙炔C-C 键键能(KJ)C-C 键长度(pm) 154 134 120C-H 键键能(KJ) 410 444 506C-H键长度(pm) 110 108 106 很明显可以看出(836-368) 并不是(607-368)的两倍,而且实验结果表明,要打开乙炔中的π键需要大约318 KJ/mol的能量,而对于乙烯需要268KJ/mol,所以我们可以得到结论,炔烃与亲电试剂的反应比烯烃与亲电试剂的反应要迟钝。
硼氢化反应,氧化反应

硼氢化反应,氧化反应在有机化学中,硼氢化-氧化反应是烯烃与硼烷加成,再被氧化生成醇的两步有机化学反应。
氢和羟基通过顺式加成生成顺式产物。
硼氢化-氧化反应是一个反马氏反应,羟基加成到取代基较少的碳上。
在有机合成中,这是一个常用的反应。
反应一般按如下形式进行:该反应常用四氢呋喃(THF)作为溶剂,有时也用其他的非极性非质子化溶剂。
它分为两步:在第一步中,甲硼烷(BH3)与双键加成生成烷基硼,称为烯烃的硼氢化反应。
第二步中,烷基硼在碱性条件下与过氧化氢作用生成醇,BH2基团被氧化为羟基,这一步称为烷基硼的氧化反应。
硼氢化反应反应中使用的硼烷为乙硼烷(B2H6),常温下以无毒无色气体形式存在。
在乙硼烷中,有两个氢原子各以一对电子与两个硼原子成BHB氢桥键(三中心二电子大Π键)。
电子的离域使硼原子达到八隅体结构,同时降低了硼的亲电性。
由于含有空余的p轨道,乙硼烷是一个强的路易斯酸。
由于迅速的二聚反应,并不存在单独的BH3分子。
然而,当乙硼烷溶于醚或胺中时,可以形成稳定的配合物,其中氧原子或氮原子作为路易斯碱提供孤对电子与硼形成配位键。
这些物质的性质与硼烷相同。
BH3的四氢呋喃或乙醚溶液通常比乙硼烷气体使用更方便,因此在实验室中较为常见。
硼烷与烯烃的加成是一个协同反应,双键的断裂与新键的生成同时进行。
过渡态理论可以更清楚地显示反应的历程:(请点击查看原图,比较大)由于该含硼基团将被羟基取代,所以第一步是立体决定的一步。
硼将加成在与较少取代基相连的碳上。
在过渡态中,多取代的碳上带有少量正电荷,类似碳正离子。
一般而言,多取代的碳上带正电荷比少取代的碳稳定。
如果硼烷进攻另一个多取代的碳,将是少取代的碳带上正电荷,不利于稳定。
但有时在空间位阻的影响下,硼烷也会加成到少取代的碳上。
硼烷将继续进行类似的反应直到所有的三个氢原子被烃基所取代,即一分子硼烷可与三分子烯烃进行反应。
所以有时使用只有一个氢原子的硼烷(R2BH)进行反应,例如一种被广泛用于硼氢化反应的硼氢化试剂9-BBN,它与烯烃反应有选择性,可以只进攻位阻较小的双键。
《有机化学》(第四版)复习提纲

有机化学复习提纲《有机化学》(第四版)第一章绪论1、有机化合物的定义。
2、碳原子的SP、SP2、SP3杂化轨道的杂化原理和共价键的构成方式。
3、诱导效应的概念。
4、酸碱的概念。
第二章饱和烃:烷烃和环烷烃1、烷烃的命名。
脂环烃、桥环烃、螺环烃的命名方法。
2、环烷烃的环结构与稳定性的关系。
3、取代环已烷的稳定构象。
4、烷烃的卤代反应历程(自由基型取代反应历程)。
5、烷烃的卤代反应取向与自由基的稳定性。
6、脂环烃的取代反应。
7、脂环烃的环的大小与开环加成活性关系。
8、取代环丙烷的开环加成规律。
9、环烯烃的π键加成与α-氢的卤代反应区别。
第三章不饱和烃:烯烃和炔烃1、碳-碳双键、碳-碳三键的组成。
2、π键的特性。
3、烯烃、炔烃的命名;烯烃的Z,E-命名法,烯炔的命名。
4、烯烃、炔烃的加氢催化原理及其烯烃、炔烃的加氢反应活性比较。
5、炔烃的部份加氢——注意区分顺位部分加氢和反位部分加氢的条件或试剂。
6、何谓亲电加成?(烯烃中被亲电试剂进攻的不饱和碳上电子密度越高,亲电加成活性越大)7、烯烃、炔烃可以与哪些试剂进行亲电加成,这些加成有哪些应用。
8、烯烃亲电加成反应机理。
9、亲电加成反应规律(MalKovniKov规律)。
10、烯烃、炔烃与HBr的过氧化物效应加成及其规律。
(惟一只有溴化氢才能与烯烃、炔烃存在过氧化物效应,其它卤化氢不存在过氧化物效应。
)11、烯烃亲电加成与炔烃亲电加成活性的比较。
12、不同结构的烯烃亲电加成活性的比较——不饱和碳上电子密度越高的烯烃或越容易生成稳定碳正离子的烯烃,亲电加成反应的活性越大。
13、碳正离子的结构和碳正离子的稳定性之间的关系——正电荷越分散,碳正离子就越稳定。
14、烯烃经硼氢化—氧化水解在合成醇上的应用;炔烃经硼氢化—氧化水解在合成醛或酮上的应用。
15、碳-碳双键的α-碳上有支链的烯烃与卤化氢加成时的重排反应。
(P88)16、烯烃与次卤酸加成及加成规律。
炔烃与水加成及重排产物。
常见有机化学反应方程式总结

有机化学反应方程式一、烯烃1、卤化氢加成 (1)CHCH 2RHXCHCH 3RX【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】CH 2CH 3CH +CH 3CH 3X +CH 3CH 3X+H +CH 2+C3X +CH 3X主次【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排 (2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】CH 2CH3BrCH CH 2BrC H 3CH +CH 3C H 3HBrBrCH 3CH 2CH 2BrCH BrCH 3C H 32、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】CH2CH 33H 323H 32CH CH 2CH 3HBH 2CH CH=CH (CH 3CH 2CH 2)3B-H 3CH 2CH 2C22CH 3CH 2B OCH 2CH 2CH 3H 3CH 2CH 2CCH 2CH 2CH 3+OH -OHB-OC H 2CH 2CH 3CH 2CH 2CH 3H 3CH 2CH 2OBOC H 2CH 2CH 3CH 2CH 2CH 3OC H 2CH 2CH 3HOO -B(OCH 2CH 2CH 3)3B(OCH 2CH 2CH 3)3+3NaOH 3NaOH3HOC H 2CH 2CH 33+Na 3BO 32【例】CH 31)BH 32)H 2O 2/OH-CH 3HH OH3、X 2加成C CBr /CClCC BrBr【机理】CC CC Br BrC CBr +CC Br OH 2+-H +CC Br OH【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
硼氢化反应及应用

硼氢化反应及应用13142223 黄山芩摘要:烯烃与乙硼烷(B2H6)作用,可以得到三烷基硼,然后将氢氧化钠水溶液和过氧化氢溶液加到反应混合液中,可以得到醇,这一反应称为硼氢化反应,是重要的合成反应之一。
加成产物反马氏规则,它是制备醇特别是伯醇的一个好方法。
关键词:烯烃、烃基硼烷、顺式加成、制伯醇、反马氏、不重排正文:一、硼氢化反应1961年,布朗(Brown C H)发现硼烷与,反应中烯烃或炔烃在醚中容易反应生成烃基硼烷,烃基硼烷可以继续与烯烃生成二烃基或三烃基硼烷,反应中硼烷的B-H键断裂,硼和氢分别加到两个不饱和碳原子上,所以该反应通常称为硼氢化反应(hydoboration)。
H.C.Brown由于这一反应的发现和研究与G.Witing共享。
1979年诺贝尔化学奖。
反应如下:R-CH=CH2 + HBH2→RCH2CH2BH3 →→ (RCH2CH2)3B一烷基硼三烷基硼硼氢化反应机理:当烯烃与硼烷进行硼氢化反应时,在溶剂醚的作用下,(BH3)2首先变成单硼烷BH3与醚形成络合物(即醚中氧原子的电子对进入B的空轨道)即:在(BH3)2是个缺电子中心,它作为亲电试剂进攻烯烃富电子的π键,烯烃的π电子进入B的轨道而形成π络合物,然后形成一个四中心的过渡态形成a或π电子逐步与B 形成B-C键,BH3中的一个H带着一对电子转移到带有部分正电荷的C2上形成C-H键,RBH2的另外两个H经过相同反应得到R3B:常用的硼烷是甲硼烷(BH3),由于甲硼烷只有留个价电子,极不稳定,通常二聚形成乙硼烷(B2H6),所以,实际上乙硼烷是最简单的硼烷。
乙硼烷有氢化铝和氟化硼在乙醚中反应制备,也可以有硼氢化钠和硫酸等质子酸或Lewis酸作用制得,硼烷在提供电子的溶剂如醚、硫醚、叔胺中可形成稳定的络合物。
硼氢化反应在室温下即可进行,操作简便,反应速度快,大多可得到满意的产率。
烃基硼烷可作为试剂或中间体,可以制备很多有价值的化合物,在有机化学中应用广泛,具有重要的理论和实践意义。
硼氢化氧化反应操作

硼氢化氧化反应操作全文共四篇示例,供读者参考第一篇示例:硼氢化氧化反应是一种重要的有机合成方法,通常用于合成醇、醛、羧酸等化合物。
这种反应基于硼氢化合物和氧气之间的氧化还原反应,是一种高效、选择性好的合成方法。
本文将介绍硼氢化氧化反应的基本操作步骤以及注意事项。
硼氢化氧化反应的基本操作步骤如下:1. 实验准备:首先需要准备实验所需的硼氢化合物、溶剂、催化剂等试剂和设备。
确保实验室通风良好,操作台面整洁,并戴好实验手套和护目镜等防护装备。
2. 反应条件优化:根据反应物性质的不同,需要优化反应的温度、反应时间、催化剂种类和用量等条件。
通常,硼氢化氧化反应在惰性气氛下进行,并加入合适的催化剂提高反应效率。
3. 反应操作:将硼氢化合物和氧气通入反应器中,根据实验设计合理控制反应条件。
反应结束后,将反应溶液用适当的方法进行处理,通常采用萃取或蒸馏等分离纯化方法。
4. 产物检测:使用色谱和质谱等仪器对产物进行鉴定和分析,确保合成产物的纯度和结构,同时对未反应的原料和副产物进行定量分析。
硼氢化氧化反应是一种重要的有机合成方法,在合成药物、涂料、染料和材料等领域具有广泛的应用。
但在进行硼氢化氧化反应时,也需注意以下几点:1. 安全防护:硼氢化合物具有易燃、易爆的性质,操作时需小心避免火花和静电,严禁与氧气直接接触;同时要保持实验室通风良好,防止有毒气体的积聚。
2. 反应控制:硼氢化氧化反应是一种高温高压下进行的催化氧化反应,要严格控制反应温度和压力,避免发生不可逆的副反应和不受控制的爆炸。
3. 催化剂选择:选择合适的催化剂对硼氢化氧化反应的选择性和效率起着关键作用,需要仔细优化反应条件及催化剂种类和用量。
硼氢化氧化反应是一种重要的有机合成方法,在合成有机化合物和功能分子方面具有广泛的应用前景。
通过合理的反应条件设计和催化剂优化,能够有效提高硼氢化氧化反应的选择性和效率,为有机合成化学提供有力支持。
在进行硼氢化氧化反应时,务必注意安全防护和实验操作规范,确保实验顺利进行,并获得理想的合成产物。
硼氢反应
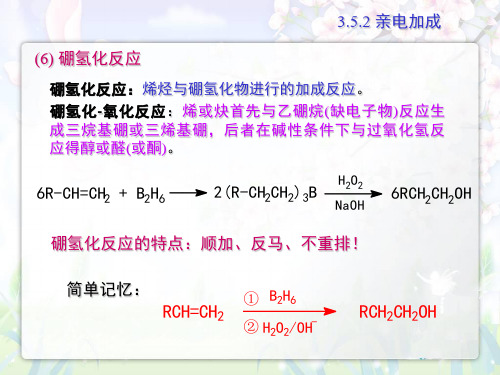
H CH3
OH H
(顺加)
(CH3)3C H
H C=C
C(CH3)3
① B2H6 ,醚 ② H2O2/OH-
(CH3)3CCH2-CHC(CH3)3 OH
(不重排)
有机合成上常用硼氢化反应制备伯醇,该法操作简便、产率高。
3.5.2 亲电加成
炔烃也有硼氢化反应:
C2H5C
CC2H5
B2H6,0 。C
思考题:烯烃有无亲核加成?乙烯能否与CH3OK反应?
3.5 烯烃和炔烃的化学性质
3.5.4 氧化反应
不饱和烃的 氧化反应
(1) 环氧化反应 (2) 高锰酸钾氧化 (3) 臭氧化 (4) 催化氧化
(1) 环氧化反应
3.5.4 烯烃的氧化反应
有机过酸
C=C
C---C O
O
常用的过酸有: H-C-O-O-H
例:
CH
CH + CH3OH
20%KOH水溶液 ,P
机理:
CH2=CH-OCH3
甲氧基乙烯 or甲基乙烯基醚
在碱性条件下,有:
CH3OH + KOH
CH3OK + H2O
强亲核试剂
பைடு நூலகம்
CH3O-带有负电荷,是一个强的亲核试剂:
可离解为 CH3O- + K+
CH CH + CH3O-
HC-=CH-OCH3 CH3OH CH2=CH-OCH3 + CH3O-
R C=C R'
R" +
H
O3
R O R" CC
H2O
R'
H
OO
R
5.2.4 炔烃的亲电加成——硼氢化-氧化、还原反应
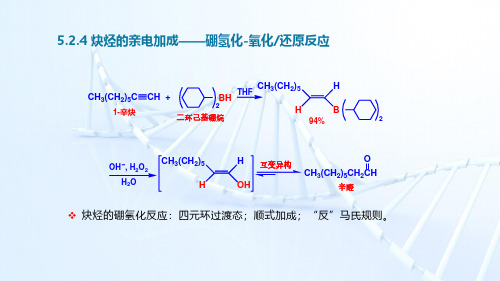
炔烃的硼氢化反应:四元环过渡态;顺式加成;“反”马氏规则。
CH 3(CH 2)5C CH +2THFHB CH 3(CH 2)5H 2二环己基硼烷94%OH , H 2O 2H OH CH 3(CH 2)5H 互变异构CH 3(CH 2)5CH 2CH辛醛O BH H 2O 1-辛炔H 3(CH 2)5CCH +2THF H BCH 3(CH 2)5H 2二环己基硼烷94%OH , H 2O 2H OHCH 3(CH 2)5H互变异构CH 3(CH 2)5CH 2CH 辛醛O BH H 2O1-辛炔5.2.4 炔烃的亲电加成——硼氢化-氧化/还原反应如果采用无取代基的硼烷,两个 键会被连续硼氢化。
为了使反应停止在烯基硼烷阶段,须使用带有位阻较大的取代基的硼烷试剂。
烯基硼烷在碱性条件下经H 2O 2氧化后得到相应的烯醇,再互变异构为醛或酮。
C C R HHOHOHC CR H HO CCR HHO+ H 2OOHHCH 2CHR+ OH烯醇式(enol form )O::::::::烯醇负离子(stabilized "enolate" ion )醛酮式(keto form )5.2.4 炔烃的亲电加成——硼氢化-氧化/还原反应端炔经硼氢化—氧化水解后得到醛,不对称的内炔经硼氢化—氧化水解后得到酮的混合物。
CH 3CH 2C CH +CH 3CH CH 3CH CH 32BH C C CH 3CH 2H H B CHCH 3CH CH 32CH 3OH , H 2O 2H 2OC C CH 3CH 2H H OH CH 3CH 2CH 2CH OR'C CR"① R 2②2O 2, OH , H 2OC R'O CH 2R"+C R'CH 2OR"H 3CH 2CCH +CH 3CH CH 3CH CH 32BH C C CH 3CH 2H H B CHCH 3CH CH 32CH 3OH , H 2O 22C C CH 3CH 2H H OHCH 3CH 2CH 2OCH3C CCH3C CH3CH CH3BR2CH3COO HC CH3CHCH3HR2B HR2B HC C(H3C)2HCH CH3 DCH3COO D0 o C4-甲基-2-戊炔炔烃的硼氢化—还原:产物为Z型烯烃,双键C 原子上的两个H 原子,分别来自硼烷和乙酸。
四醋酸铅、硼氢化钠与碳碳双键反应

四醋酸铅、硼氢化钠与碳碳双键反应一、概述四醋酸铅(Pb(OAc)4)和硼氢化钠(NaBH4)是有机合成中常用的试剂,它们在有机合成领域中有着重要的地位。
其中,四醋酸铅能够作为氧化剂,为多种反应提供了便利的条件;硼氢化钠则是一种经典还原剂,可用于还原含氧、硫、氮等元素的化合物。
在碳碳双键反应中,四醋酸铅和硼氢化钠的作用机理及其反应过程备受关注。
本文将从这一角度出发,对四醋酸铅、硼氢化钠与碳碳双键反应进行深入探讨。
二、四醋酸铅与碳碳双键反应四醋酸铅能够将不饱和碳碳双键上的氢原子去除,生成相应的不饱和化合物。
四醋酸铅可以将烯烃氧化成环氧化合物,即对称过氧化物。
四醋酸铅还可以将不饱和碳碳双键上的氢原子氧化成羟基或醛基。
这些反应为有机合成提供了重要的手段和途径。
三、硼氢化钠与碳碳双键反应硼氢化钠是一种经典的还原剂,可将含有碳碳双键的化合物还原成相应的饱和化合物。
硼氢化钠主要通过其还原性氢原子与双键上的碳原子发生反应,从而将双键还原成饱和的碳碳键。
硼氢化钠在有机合成中有着广泛的应用,是许多重要反应的关键试剂之一。
四、四醋酸铅、硼氢化钠与碳碳双键反应的应用1. 酮醇异构化反应在有机合成中,酮醇异构化是一种重要的反应,可以通过四醋酸铅和硼氢化钠来实现。
四醋酸铅可以将醇氧化成醛,而硼氢化钠能将醛还原成醇,从而实现酮醇异构化反应。
2. 羟醛化反应四醋酸铅与碳碳双键的氧化反应可实现烯烃的羟醛化。
四醋酸铅将烯烃氧化成环氧化合物,然后通过还原反应得到羟醛。
3. 双键还原反应硼氢化钠在有机合成中常用于烯烃、炔烃等含双键化合物的还原反应。
它能够将双键上的碳原子还原成相应的饱和碳原子,生成烷烃和烯烃。
五、结论四醋酸铅和硼氢化钠作为有机合成中重要的试剂,对碳碳双键反应有着重要的应用。
它们可以通过氧化和还原反应影响碳碳双键的构型和结构,为有机合成提供了广阔的发展空间。
深入研究四醋酸铅、硼氢化钠与碳碳双键反应的机理和应用,有助于推动有机合成化学的发展,促进新型化合物的合成与应用。
炔的硼氢化氧化原理

炔的硼氢化氧化原理炔的硼氢化氧化是一种重要的有机合成方法,可以通过该反应将炔转化为醛或酮。
其原理主要涉及到炔分子与硼氢化钠或硼氢化铝反应生成硼醇,然后再通过氧化剂将硼醇转化为醛或酮的过程。
炔是一类含有碳碳三键的化合物,由于其特殊的结构,炔在化学反应中具有独特的性质。
炔的硼氢化氧化反应基于硼氢的亲电性和炔化合物的亲核性,通过硼氢的加成和氧化反应来实现对炔分子的转化。
在炔的硼氢化氧化反应中,首先需要将硼氢化剂添加到炔分子中。
硼氢化剂一般选用硼氢化钠(NaBH4)或硼氢化铝(LiAlH4)。
由于硼氢化钠和硼氢化铝都是亲电性的试剂,它们能够反应中碳碳三键上的π电子,形成硼醇的中间体。
硼氢化钠和硼氢化铝分别与炔中的炔基反应,生成硼醇。
硼醇是一个含有含有硼-氧键的化合物,它具有较高的反应性。
接下来,在硼醇中加入氧化剂,使其氧化为醛或酮。
常用的氧化剂有次氯酸盐(NaOCl)、三氟乙酸酐(TFAA)等。
这些氧化剂能够将硼醇的硼氧键氧化为醛或酮中的氧原子。
硼醇经过氧化反应后,形成了具有醛或酮功能团的产物。
这样,通过炔的硼氢化氧化反应,可以将炔转化为醛或酮。
不同的炔和硼氢化剂、氧化剂的选择,可以得到不同的醛或酮产物。
炔的硼氢化氧化反应是一种较为常用的有机合成方法,它具有灵活性和高效性,可以在实验室中广泛应用。
该反应为有机合成提供了一种新途径,能够构建碳碳键和碳氧键,生成复杂有机分子。
此外,通过选择不同的硼氢化剂和氧化剂,可以实现对产物的选择性控制,使之得到特定结构的醛或酮。
炔的硼氢化氧化反应在药物合成、天然产物合成等领域具有广泛的应用前景。
总之,炔的硼氢化氧化反应是通过硼氢化剂的加成和氧化剂的作用,将炔转化为醛或酮的过程。
该反应原理简单而灵活,可以在有机合成中实现特定功能团的引入和复杂分子的构建。
炔烃的硼氢化反应

炔烃的硼氢化反应炔烃是指具有碳碳三键的碳氢化合物,它们可以通过硼氢化反应得到相应的稳定的乙烯基硼烷化合物。
炔烃的硼氢化反应是一种重要的有机合成方法,被广泛应用于有机化学、药物化学、材料化学等领域。
炔烃的硼氢化反应的机理比较复杂,通常涉及一系列不同的化学反应步骤。
在一般的硼氢化反应中,有两个显著的步骤:第一个步骤是LiAlH4(或NaBH4)的还原作用,即用氢化物物种来氢化炔烃;第二个步骤是硼烷或甲硼烷(或其他的硼试剂)与金属盐的反应,将乙烯基硼烷转化为稳定的烷基硼烷或氢氧化物。
实际上,炔烃的硼氢化反应的具体细节和反应条件取决于所使用的炔烃和硼试剂,以及是否需要对反应产物进行后续化学反应。
但总体来说,炔烃的硼氢化反应是一种非常有用的有机合成方法,它能够为有机合成化学家提供一种可靠、高效、低成本的方法来合成复杂分子。
此外,炔烃的硼氢化反应还可以与其他反应结合使用,以产生更加复杂的有机分子。
例如,在环加成反应中,炔烃硼氢化物可以作为合成环内硼烷的重要起始物质,从而合成其他具有有机合成应用价值的炔烃广义物质。
在炔烃的硼氢化反应中,选用合适的试剂和反应条件可以有效地控制反应的产物,这也是需要注意的。
如对于迭代硼氢化反应,应选择较弱的还原剂(如LiAlH4),并逐渐增加反应时间和温度,以便获得理想的产物选择性。
同时,从环境保护意义上讲,应考虑反应溶剂、催化剂等的选择,以便在反应过程中减少对环境的污染。
综上所述,炔烃的硼氢化反应是一种广泛应用于有机化学、药物化学、材料化学等领域的重要有机合成方法。
合理地选择试剂和反应条件可以控制反应的产物,从而加快化学反应的速度和提高产物选择性。
同时,炔烃的硼氢化反应还可以与其他反应结合使用,以产生更加复杂的有机分子。
醛酮的制备

醛酮的制备醛酮的制备1.炔烃的水合和胞二卤代物的水解①炔烃水合:适合于端炔或对称的炔。
用硼氢化一氧化法进行水合,由末端炔可以制得醛。
②胞二卤代物水解:2.由烯烃制备①烯烃的氧化②氢甲醛化法(Hydroformylation)不对称烯烃主要产物直链烃基醛,对称烯烃可得单一产物。
三、由芳烃侧链α-H的氧化①控制氧化条件,氧化剂不要过量。
② CrO3-醋酐作氧化剂二乙酸酯不易连续被氧化③4.由醇氧化或脱氢① Na2Cr2O7② CuO③ CrO3-吡啶(萨瑞特试剂)——CrO3(C5H5N)2氧化很好地控制在生成醛的阶段,且双键不受影响。
④ [(CH3)2CH-O]3Al (欧芬脑氧化法)双键不受影响⑤ CrO3-H2SO4(琼斯试剂)不饱和仲醇可得到相应的不饱和酮。
5.傅瑞德尔-克拉夫茨(Friedel-Crafts)酰基化是制备芳酮的重要方法,优点是不发生重排,产物单一,产率高。
可通过分子内酰基化制备环酮思考题:如何由芳烃制备?6.盖德曼-柯赫(Gattermann-Koch)反应在催化剂存在下,芳烃和HCl,CO混合物作用,可以制得芳醛该反应叫盖德曼-柯赫反应,它是一种特殊的傅氏酰基化反应。
如果芳环上有烃基、烷氧基,则醛基按定位规则导入,以对位产物为主。
如果芳环上带有羟基,反应效果不好,如果连有吸电子基,则反应不发生。
7.瑞默-梯曼反应(Reimer-Tiemann)苯酚在NaOH存在下和CHCL作用,生成酚醛。
3主要生成邻位产物:瑞默-梯曼(Reimer-Tiemann)反应按下列机理进行,首先氯仿在碱溶液中形成二氯卡宾:此外,二氯卡宾还可以攻击(ⅰ)的带甲基的碳原子,形成环己二烯酮衍生物:上的氢是来自溶剂,然后苯环在把一个氢给予溶剂,为了(ⅳ)或(ⅴ)中-CHCl22证实这点,肯普在含氚的水(THO)中进行了Reimer-Tiemann反应,生成的水杨醛中,醛基含有99.6%的氚只有不到0.4%的氚在苯环上,这表明醛基的氢是来自溶剂,即:8.维路斯梅尔反应(Vilsmeier-Haack反应)通常是指应用N,N-二取代甲酰胺和POCl3使芳环(主要是酚类和芳胺类)甲酰化反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Confidential
We Are Determined To Serve You Better
10
2.3.2 DMSO-(COCl)2氧化
(Swern Oxidation )
Swern氧化目前是该类氧化方法中最为常用的一种。各种酰氯 及亚硫酰氯都可作为作为DMSO的活化剂,而由草酰氯活化 的DMSO对醇的氧化最为合适。 该反应一般在中性条件下进 行,可应用于各类对酸敏感的底物。
We Are Determined To Serve You Better
6
2.1.3 PCC (Pyrindium Chlorochromate)氧化
PCC易于合成和保存,操作简单,是将伯醇和仲醇氧化成 醛和酮的应用最广的氧化方法。PCC中所用的碱除吡啶外, 也可以是其它碱,且随着碱性部分碱性的增强,氧化的选择 性也提高。其中,DMAP·HCrO3Cl为适用于烯丙醇类及苄醇 类的选择性氧化试剂。
常用的铬(VI)试剂主要有三氧化铬(CrO3)、重铬酸、铬酸酯 [CrO2(OCOR)2]、铬酰氯(CrO2Cl2)等。为了控制醇不被过度氧 化,化学家已经开发了种种氧化方法,最常用的方法有Jones氧化 法(Cr2O3/H2SO4/acetone)、Collins氧化法(Cr2O3·2Py)PCC (Pyrindium Chlorochromate)及PDC(Pyrindium Dichromate) 氧化法等。
Collins氧化法是在Sarett氧化法(以吡啶为溶剂)基础上的改进, 以二氯甲烷为溶剂氧化伯醇为醛
C. Collins, W. W. Hess, Org. Syn. 52, 5 (1972); R. W. Ratcliffe, ibid. 55, 84 (1976).).
Confidential
Confidential
We Are Determined To Serve You Better
2
2.由醇合成醛酮
由醇合成醛酮是有机合成中的一类非常重要的反应。
伯醇的氧化可以得到醛。由于醛处于醇与羧酸的中间氧化状态, 就必须选择适当的氧化剂加以控制,不致氧化过度而生成羧酸。
仲醇的氧化得到酮。但仲醇过度氧化可以导致分子开裂。由叔 醇的氧化开裂、转位等反应也能合成酮,但实用范围不大。
O R OH
O R R1
Confidential
We Are Determined To Serve You Better
5
2.1.2 Collins氧化(CrO3·2Py)
Collins氧化法是利用CrO3-pyridine配合物将伯醇和仲醇依次 氧化成醛(和/或酸)和酮的方法。
OH
CrO3
O
C5H5N
We Are Determined To Serve You Better
9
2.3 用DMSO氧化
DMSO可由各种亲电试剂(E)活化后与醇反应,生成烷氧基 硫盐,接着发生消除,生成醛或酮。
S O +E
R1R2CHOH SOE
R1 SO
R2
R1 S +O
R2
亲电试剂有DCC,(CH3CO)2O, (CF3CO)2O, SOCl2,(COCl)2等.
醇的氧化就必须从所使用氧化剂氧化性的强弱、醇分子的结构 以及反应条件等多个方面考虑。本部分主要讨论铬氧化剂活性 MnO2、DMSO试剂、氧铵盐、高价碘化物等氧化剂在醇氧化 合成醛酮反应中的应用。
Confidential
We Are Determined To Serve You Better
3
2.1 铬(VI)试剂
Confimined To Serve You Better
8
2.2 用活性MnO2氧化
活性MnO2广泛用于氧化与β-不饱和基团(三键,双键、芳香 环)的α位的醇(烯丙醇,苄醇等)。对于烯丙醇,其氧化条 件温和,不会引起双键的异构化。MnO2的活性(国产与进口) 及溶剂的选择对反应至关重要,常用的溶剂有二氯甲烷、乙醚、 石油醚、己烷、丙酮等。
Confidential
Boc
N
O
OH
DMSO, (COCl)2 i-Pr2NEt
TBSO
OH
MnO2, CH2Cl2
TBSO
O
Confidential
(Organic Syntheses, Coll. Vol. 9, p.136; Vol. 73, p.44)
HO
O
MnO2
N
N
(Organic Syntheses, Coll. Vol. 7, p.102; Vol. 62, p.111)
Confidential
We Are Determined To Serve You Better
4
2.1.1 Jones氧化(CrO3/H2SO4/acetone)
Jones试剂通常可以将伯醇氧化成酸,把仲醇氧化成酮
R OH
OH R R1
CrO3/ aq H2SO4 acetone
CrO3/ aq H2SO4 acetone
经典化学合成反应讲座(10)
醛酮的合成
化学合成部:马汝建
CONFIDENTIAL
药明康德新药开发有限公司
前言
醛和酮是一类重要的有机化合物,其合成在有机合成中占 有非常重要的地位。醛和酮的合成方法繁多,新合成途径 也层出不穷。本部分主要以官能团的转换为主线,依次讨 论了由醇、卤化物,甲基、亚甲基、羧酸及其衍生物、烯 烃、炔烃、醚及环氧化合物、胺、硝基化合物等转换为醛 酮的方法。
HO
OH
DMAP, HCrO3Cl
HO
O
PCC的氧化以均相反应为主,但有的方法是将催化剂吸附于硅胶、 氧化\铝等无机载体或离子交换树脂等有机高分子载体上,对醇 作非均相催化氧化。后处理简单并可控制反应的选择性。
Confidential
We Are Determined To Serve You Better
7
2.1.4 PDC(Pyrindium Dichromate)氧化
PDC的氧化能力较PCC强,其氧化作用一般在中性条件下进 行,而PCC则需在酸性中进行。因此,对酸不稳定的化合物 用PCC氧化时,必须在醋酸钠存在下进行。PDC的氧化一般在 二氯甲烷中进行,如在DMF中进行时,氧化性增强,能将伯 醇最终氧化成酸。PDC的氧化操作基本和PCC相同,这里不 再举例说明。
