第二讲 配位化合物
配位化合物的讲义

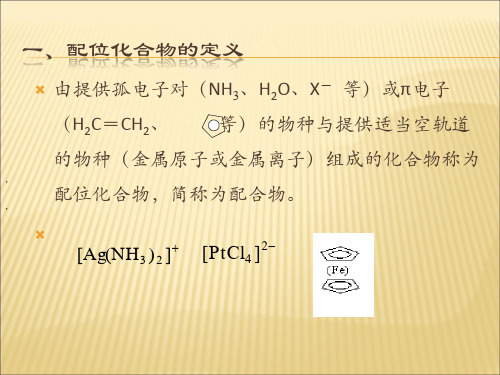
配位化合物的讲义第一节配位化合物的基本概念(一)配位共价键由一个原子单方面提供l对电子与另一个有空轨道的原子(或离子)共用而形成的共价键,称为配位共价键(coordinate bond),简称配位键.在配位键中,提供电子对的原子称为电子对的给予体;接受电子对的原子称为电子对的接受体.配位键常用"→"表示,箭头指向电子对的接受体.例如,铵离子(NH)可看作是氨NH3分子与H+离子结合形成的.在氨分子中,氮原子的2p轨道上有一对没有与其他原子共用的电子,这对电子称为孤对电子,氢离子上具有1s空轨道.在氨分子与氢离子作用时,氨分子上的孤对电子进入氢离子的空轨道,与氢共用,形成配位键.在铵离子中,虽然1个N→H键和其他3个N-H键的形成过程不同,但一旦形成了铵离子,这4个氮氢键的性质完全相同.配位键是一种特殊的共价键,广泛存在于无机化合物中.凡一方有空轨道,另一方有未共用电子对时,两者就可能形成配位键.例如:HNO3,H2SO4及其盐中均存在着配位键.(二)配位化合物配位化合物简称配合物,是一类组成复杂,发展迅速,应用广泛的化合物.1.配位化合物的概念配位化合物是一类含有配位单元的复杂化合物.通常以酸,碱,盐形式存在,也可以电中性的配位分子形式存在.如[Cu(NH3)4]SO4,K4[Fe(CN)6],[Fe(CO)5]等.配位单元一般是指由金属原子或金属离子与其他分子或离子以配位键结合而形成的复杂离子或化合物.如[Cu(NH3)4]2+,[Fe(CN)6]4-,[Fe(CO)5],[PtCl2(NH3)2]等.离子型配位单元又称为配离子.根据配离子所带电荷的不同,可分为配阳离子和配阴离子,如[Cu(NH3)4]2+,[Fe(CN)6]4-.含有配位单元的化合物称为配位化合物(coordination compound).习惯上把配离子也称为配合物.2.配位化合物的组成配位化合物的核心是配位单元.通常把配位化合物分为内界和外界两个部分.内界是配离子,外界是反离子,内界和外界之间以离子键结合.现以硫酸四氨合铜(Ⅱ)为例来说明配合物的组成.(1)中心原子(或离子) 在配离子(或配位分子)中,接受孤对电子的阳离子或原子统称为中心原子(central atom).中心原子位于配位化合物的中心位置,是配合物的核心部分,也称为配合物的形成体.中心原子必须具有空轨道,可以接受孤对电子.常见的中心原子多为副族的金属离子或原子.如[Cu(NH3)4]2+的中心原子Cu2+,[Fe(CO)5]的中心原子Fe等.(2)配位体和配位原子在配合物中,与中心原子以配位键结合的阴离子或中性分子称为配位体(ligand),简称配体.如[Cu(NH3)4]SO4,K4[Fe(CN)6]和[Fe(CO)5]中的NH3,CN-和CO都是配位体.配位体中能提供孤对电子与中心原子以配位键相结合的原子称为配位原子(ligating atom).如NH3中的N,CN-中的C,CO中的C.常见的配位体有:NH3,H2O,CN-,SCN-,Cl-等.常见的配位原子有:N,O,C,S,Cl等.按配位体中配位原子的多少,配位体可分为单齿配位体和多齿配位体.含有一个配位原子的配位体为单齿配位体(monodentate ligand);含有两个或两个以上配位原子的配位体为多齿配位体(polydentate ligand).如:乙二胺乙二胺四乙酸根离子多齿配位体与中心原子形成的配合物也称为螯合物(chelate).(3)配位数在配合物中,与中心原子结合成键的配位原子的数目称为配位数(coordination number).如K4[Fe(CN)6]中有6个C原子与Fe2+成键,Fe2+的配位数是6.而[Cu(en)2] (OH)2中配位体en是双齿配位体,因此Cu2+的配位数是4而不是2.若配位体有两种(或两种以上),则配位数是配位原子数之和.如[Pt(NO2)2(NH3)4]Cl2中Pt4+的配位数是6.(4)配离子的电荷配离子的电荷数等于中心原子与配位体电荷数的代数和.例如,在[Cu(NH3)4]SO4中,配离子的电荷数为: +2,写作[Cu(NH3)4]2+.在K4[Fe(CN)6]中,配离子的电荷数为:-4,写作[Fe(CN)6]4-.由于配合物是电中性的,因此,外界离子的电荷总数和配离子的电荷总数相等,符号相反,所以配离子的电荷数也可以根据外界离子来确定.3.配合物的命名配合物的命名与一般无机化合物的命名原则相同.(1)配合物的命名顺序阴离子在前,阳离子在后,像一般无机化合物中的二元化合物,酸,碱,盐一样,命名为"某化某","某酸","氢氧化某"和"某酸某".(2)配离子的命名顺序配位体数目(中文数字表示)—配位体名称—合—中心原子名称—中心原子氧化值(罗马数字表示).有的配离子可用简称.(3)配位体命名顺序若配位体不止一种,则先无机配位体,后有机配位体;先阴离子,后中性分子.若均为中性分子或均为阴离子,可按配位原子元素符号英文字母顺序排列.不同配位体之间以圆点"·"分开,复杂的配位体名称写在圆括号中,以免混淆.下列是一些配合物的命名实例:[Ag(NH3)2]+ 二氨合银(Ⅰ)配离子 (银氨配离子)[Fe(CN)6]3- 六氰合铁(Ⅲ) 配离子[Fe(CO)5] 五羰基合铁(0)[Pt(NO2)2(NH3)4]2+ 二硝基·四氨合铂(Ⅳ)配离子[Co(NH3)5H2O]3+ 五氨·一水合钴(Ⅲ)配离子[Ag(NH3)2]OH 氢氧化二氨合银(I)[Cu(NH3)4]SO4 硫酸四氨合铜(Ⅱ)K3[Fe(CN)6] 六氰合铁(Ⅲ)酸钾 (铁氰化钾或赤血盐)H2[PtCl6] 六氯合铂(Ⅳ)酸[Pt(NO2)2(NH3)4]Cl2 二氯化二硝基·四氨合铂(Ⅳ)[Co(NH3)5H2O]Cl3 三氯化五氨·一水合钴(Ⅲ)第二节配合物的稳定性一,配离子的离解平衡将氨水加到硝酸银溶液中,则有[Ag(NH3)2]+配离子生成,反应式为:Ag++2NH3→[Ag(NH3)2]+此反应称为配合反应(也叫络合反应).由于配离子是由中心离子和配位体以配价键结合起来的,因此,在水溶液中比较稳定.但也并不是完全不能离解成简单离子,实质上和弱电解质类似,也有微弱的离解现象.(一)配合物的稳定常数配合物的稳定性,可以用生成配合物的平衡常数来表示,例如:应用化学平衡原理,可得:K值越大,表示形成配离子的倾向越大,此配合物越稳定.所以配离子的生成常数又称为稳定常数(Ks).(二)不稳定常数在水溶液中,[Ag(NH3)2]+是稳定的,不过像其他弱电解质一样也有少数[Ag(NH3)2] +发生离解,可用下式表示:则平衡常数表达式为:K不稳值愈大,表示配离子离解愈多,故称K不稳为配离子的不稳定常数. Ks和K 不稳互成倒数.二,配合平衡的移动金属离子Mn+和配位体A-生成配离子MA x (n-x)+,在水溶液中存在如下平衡:根据平衡移动原理,改变Mn+或A-的浓度,会使上述平衡发生移动.若在上述溶液中加入某种试剂使Mn+生成难溶化合物,或者改变Mn+的氧化状态,都会使平衡向左移动.若改变溶液的酸度使A-生成难离解的弱酸,也可使平衡向左移动.配合平衡同样是一种相对的平衡状态,它同溶液的pH值,沉淀反应,氧化还原反应等都有密切的关系.(一)与酸度的关系根据酸碱质子理论,所有的配位体都可以看作是一种碱.因此,在增加溶液中的H+浓度时,由于配位体同H+结合成弱酸面使配合平衡向右移动,配离子平衡遭到破坏,这种现象称为酸效应,例如:配位体的碱性愈强,溶液的pH值愈小,配离子愈易被破坏.金属离子在水中,都会有不同程度的水解作用.溶液的pH值愈大,愈有利于水解的进行.例如:Fe3+在碱性介质中容易发生水解反应,溶液的碱性愈强,水解愈彻底(生成Fe(OH)3沉淀).因此,在碱性介质中,由于Fe3+水解成难溶的Fe(OH)3沉淀而使平衡向右移动,因而[FeF6]3-遭到破坏,这种现象称为金属离子的水解效应.(二)与沉淀反应的关系当向含有氯化银沉淀的溶液中加入氨水时,沉淀即溶解.当在上述溶液中加入溴化钠溶液时,又有淡黄色的沉淀生成.由于AgBr的溶解度比AgCl的溶解度小得多,因而Br-争夺Ag+的能力比Cl-的大,所以能产生AgBr沉淀而不能产生AgCl沉淀.沉淀剂与金属离子生成沉淀的溶解度愈小,愈能使配离子破坏而生成沉淀.(三)与氧化还原反应的关系配合反应的发生可以改变金属离子的氧化能力.例如:当PbO2(Pt+)与盐酸反应时,其产物不是PbCl4,而是PbCl2和Cl2.但是当它形成[PbCl6]2-配离子后,Pb就能保持它的+4氧化态.配合反应影响氧化还原反应的方向.例如,Fe3+可以把I-氧化成I2:在加入F-后,由于生成[FeF6]3-,减少了Fe3+的浓度,使平衡向左移动.当我们考查配合反应对氧化还原反应的影响时,不仅要注意配离子的形成,而且还要注意配离子的稳定性.第三节螯合物(内络合物)一,螯合物的概念螯合物又称内络合物,是螯合物形成体(中心离子)和某些合乎一定条件的螯合剂(配位体)配合而成具有环状结构的配合物."螯合"即成环的意思,犹如螃蟹的两个螯把形成体(中心离子)钳住似的,故叫螯合物.形成螯合物的第一个条件是螯合剂必须有两个或两个以上都能给出电子对的配位原子(主要是N,O,S等原子).第二个条件是每两个能给出电子对的配位原子,必须隔着两个或三个其他原子,因为只有这样,才可以形成稳定的五原子环或六原子环.例如,在氨基乙酸根离子(H2N-CH2-COO-)中,给出电子的羟基氧和氨基氮之间,隔着两个碳原子,因此它可以形成稳定的具有五原子环的化合物.四原子环在螯合物中是不常见的,六原子以上的环也是比较少的.中心离子有一定的电荷数,同时也有一定的配位数.Cu(Ⅱ)带有二个正电荷,它的配位数为4.氨基乙酸根离子(H2N-CH2-COO-)既有氨基氮,都能给出电子对;氨基氮能满足中心离子的配位数,羟基氧则能使配位数和电荷数同时得到满足,因此Cu 2+和两个(H2N-C H2-COO-)螯合后,得到的是中性分子二氨基乙酸合铜(Ⅱ)(简称氨基乙酸酮)[Cu(H 2N-CH2-COO)2]由于羟基氧带有负电荷,故它与Cu 2+形成的配键通常用"-"表示. 螯合物的特殊稳定性是环形结构带给它们的特征之一.环愈多使螯合物愈稳定.通常所说的"螯合反应"就是指由于螯合而使化合物具有特殊的稳定性.由于螯合物的特殊稳定性,已很少能反映金属离子在未螯合前的性质.金属离子在形成螯合物后,在颜色,氧化还原稳定性,溶解度及晶形等性质发生了巨大的变化.很多金属螯合物具有特征性的颜色,而且这些螯合物可以溶解于有机溶剂中.利用这些特点,可以进行沉淀,溶剂萃取分离,比色定量等分析分离工作.二,螯合剂常用的螯合剂是氨螯合剂,是一类似以氨基二乙酸[HN(CH2COOH)2]为基体的螯合剂,它以N,O为螯合原子,与金属离子螯合时形成环状的螯合物.最常用的氨羧螯合剂是EDTA(乙二胺四乙酸或其二钠盐的统称).它的结构是:乙二胺四乙酸是四元酸,如果用Y表示它的酸根,则乙二胺四乙酸可以简写成H4Y. 由于乙二胺四乙酸在水中的溶解度比较小,而其二钠盐在水中的溶解度却比较大.因些在实际应用中人们常采用EDTA二钠盐.EDTA二钠盐含有2分子结晶水,用简式Na2H2Y·2H2O表示它.EDTA是四元酸,它在水中是分步离解.除碱金属离子外,EDTA几乎能与所有的金属离子形成稳定的金属螯合物.并且,在一般情况下,不论金属离子是几价,1个金属离子都能与1个EDTA酸根(Y4-)形成可溶性的稳定螯合物.例如:式中M表示金属离子,右上角的数字和符号表示离子的离子价.虽然,除碱金属离子外,各金属离子大多数能与EDTA形成螯合物,但它们的稳定性差别很大.EDTA是应用最广的一种氨羧螯合剂,用EDTA标准液可以滴定几十种金属离子,这个方法就称EDTA滴定法.目前所谓螯合滴定法主要是指EDTA滴定.三,螯合物在医学上的应用螯合物在自然界存在得比较广泛,并且对生命现象有着重要的作用.例如,血红素就是一种含铁的螯合物,它在人体内起着送氧的作用.维生素B12是含钴的螯合物,对恶性贫血有防治作用.胰岛素是含锌的螯合物,对调节体内的物质代谢(尤其是糖类代谢)有重要作用.有些螯合剂可用作重金属(Pb2+, Pt2+,Cd2+,Hg2+)中毒的解毒剂.如二巯基丙醇或EDTA二钠盐等可治疗金属中毒.因为它们能和有毒金属离子形成稳定的螯合物,水溶性螯合物可以从肾脏排出. 有些药物本身就是螯合物.例如,有些用于治疗疾病的某些金属离子,因其毒性,刺激性,难吸收性等不适合临床应用,将它们变成螯合物后就可以降低其毒性和刺激性,帮助吸收.另外在生化检验,药物分析,环境监测等方面也经常用到螯合物.。
《配位化合物》课件

负离子
非金属元素形成的阴离子在配合物中带有负 电荷。
稀土金属配离子
稀土金属作为特殊的金属离子在配合物中具 有重要的应用价值。
配合物的合成方法
直接溶液法
通过将金属离子和配体直接 溶解在溶剂中形成配位化合 物。
配体置换法
通过将原有配体置换为新的 配体来合成具有不同结构和 性质的配位化合物。
3 重要性
配位化合物广泛应用于医药、化妆品、催化剂等众多领域。
配位基概述
配体定义
配体是指能够通过一个或多 个配位键与金属离子结合的 化学物质。
配位键
配位键是指配体与金属离子 之间共享的电子对。
配位数
配位数指配位中心金属离子 周围配位体的个数。
金属配离子概述
正离子
金属离子在配合物中带有正电荷。
零价配离子
气相法
通过在气相中使金属原子与 配体反应生成配位化合物。
配合物的分类
1 单核配合物
配位中心金属离子与多 个配体结合形成。
3 簇合物
多个金属离子通过配位 键相互连接形成。
配位数与配位几何
1
配位几何
2
配位几何是指配合物中配体排列的空
间结构。
3
六配体
4
六配体通常呈现八面体或六面体配位 几何。
《配位化合物》PPT课件
本课件旨在介绍配位化合物的基本概念和性质,以及其在不同领域的应用。 通过清晰的内容和生动的图像,希望您能对配位化合物有一个全面而深入的 了解。
初识配位化合物
1 定义
配位化合物是指通过配位键将中心金属离子与一个或多个配体结合形成的化合物。
2 历史
配位化合物的研究始于18世纪,为现代配位化学的奠基。
配位化合物.pptx

为一类具有特征化学结构的化合物,由中心原子(或离子,统称中 心原子)和围绕它的分子或离子(称为配位体/配体)完全或部分 通过配位键结合而形成。
包含由中心原子或离子与几个配体分子或离子以配位键相结合 而形成的复杂分子或离子,通常称为配位单元。凡是含有配位单 元的化合物都称作配位化合物。研究配合物的化学分支称为配位 化学。
配合物是化合物中较大的一个子类别,广泛应用于日常生活、 工业生产及生命科学中,近些年来的发展尤其迅速。它不仅与无 机化合物、有机金属化合物相关连,并且与现今化学前沿的原子 簇化学、配位催化及分子生物学都有很大的重叠
一、配位化合物的概念
配位化合物,简称配合物。是无机化学研究的 主要对象之一,它是一类复杂、特点多样、应 用广泛的化合物。 它与医学有密切关系,生物体内的金属离子大 多以配合物的形式存在,在生命活动中起着极 其重要的作用。
二、配位化合物的组成
• 1.内界和外界 • 配合物一般由内界和外界两部分组成。 • 内界:即配位单元,是配合物的特征部分 • 外界:除内界以外的部分 • 以硫酸四氨合铜(II)为例说明内界和外界
(一)内界 1.中心离子 2.配体和配位数 3.配离子 (二)外界
三、配离子和配合物的命名
1.配离子的命名顺序 配位数目(用一、二、三、四等 +配体+合=中心离子+ 化合价(用罗马数字表示)+离子 如:书P33 2.配合物的命名 原则:阴离子在前,阳离子在后 如:书P33-34
第二章-配位化合物

D M A C B
D M A B C
DD MM AA D M A C B BC CB
镜面
D C B M A
固定一个配体(D)后 在空间不能 另三个配体具有相反的 完全重合 螺旋(顺反时针)的排列
互为镜像的关系
4个配体不同的四面体配合物具有手性
六配位络合物[M(A2B2C2)]的异构现象复杂
C B A M C A B B A M B C A C A B M A C B C A C M A B C B A A M B C C B
配离子的定义
配离子:由金属原子与中性分子或者阴离 子结合形成的复杂离子叫做配离 子(络离子)。 中心原子:其中的金属原子是配离子形成 体或中心原子, 配体:其中的H2O、NH3、Cl-等叫做配体。
我们把像[Cu(H2O)4]2+、[Cu(NH3)4]2+、 [CuCl4]2-这样的复杂离子叫做配离子。
。
4-3 配合物的价键理论
价键理论认为,配位键的形成是配位原子的孤对电子进 入中心原子的空轨道,并杂化成一种规则的多面体。
3d 4s
Ni [Ar] Ni [Ar] ..
N 2+
氮原子的孤对电子 进入镍离子的 一个4s轨道 3个4p轨道 .. .. .. 形成sp 3 杂化轨道 N N N
H3N NH3 Ni H3N NH3
五氯化-羟•二[五氨合铬(Ⅲ)]
( -表示“桥联基团” )
例:
OH / \ [(H2O)4Fe Fe (H2O)4]SO4 \ / OH
硫酸二( -羟基)•二[四水合铁(Ⅱ)]
习题:下列配合物具有正方形或八面体的几 何构型,问其中哪个CO32-离子作为螯合剂? (1) [Co(NH3)5CO3]+ (2) [Co(NH3)4CO3]+ (3) [Pt(en)CO3] (4) [Pt (en) (NH3) CO3]
什么是配位化合物

什么是配位化合物?配位化合物是指由一个或多个配位体(ligand)与一个中心金属离子(或原子)通过配位键(coordination bond)结合形成的化合物。
在配位化合物中,配位体通过共用电子对与中心金属离子形成配位键,将其固定在配位体的周围形成配位球形结构。
1. 配位体:配位体是能够提供一个或多个电子对给中心金属离子的分子或离子。
配位体通常是具有孤对电子的原子或分子,包括有机分子如胺、醇和酸以及无机分子如氨、水和卤素离子等。
配位体通过配位键与中心金属离子结合,形成稳定的配位化合物。
2. 配位键:配位键是指配位体与中心金属离子之间的共用电子对。
配位键通常是通过配位体中的孤对电子与中心金属离子中的空轨道形成。
这种共用电子对的形成使得配位体与中心金属离子之间形成了较强的化学键。
配位键可以是单个配位体提供一个电子对形成的单配位键,也可以是多个配位体提供多个电子对形成的多配位键。
根据配位键的数量,配位体可以分为单齿配位体、多齿配位体和桥配位体等。
3. 配位球形结构:配位化合物中的配位体通过配位键与中心金属离子结合,形成了一个稳定的配位球形结构。
在这个结构中,中心金属离子被配位体包围,形成一个多面体的结构。
配位球形结构的形状和几何构型取决于配位体的种类和数量,以及中心金属离子的电子构型。
常见的配位球形结构包括八面体、四方体、正方形平面、三角双锥等。
这些不同的结构对于化合物的性质和反应有重要影响。
配位化合物具有许多特点和性质。
首先,配位化合物通常具有良好的溶解性和热稳定性,因为配位键是较强的化学键。
其次,配位化合物的颜色通常取决于中心金属离子的电子结构和配位体的取代情况。
这使得配位化合物在催化、荧光和生物活性等领域具有重要应用。
此外,配位化合物还可以通过改变配位体的种类和数量来调节其性质和功能,如选择性吸附、储能和分子识别等。
配位化合物是化学中的重要概念,对于理解过渡金属化学、配位化学和配位聚合物等领域具有重要意义。
配位化合物
配位数
2 3 4 4 5 5 6 6
中心 杂化方式
构型
实例
sp sp2 sp3 dsp2 dsp3 sp3d sp3d2 d2sp3
直线形 [ Ag( NH3)2 ]+ 三角形 [ Cu(CN)3 ]2- 四面体 [ Zn(NH3)4 ]2+ 正方形 [ N(i CN)4 ]2-
三角双锥 [ F(e CO)5 ] 三角双锥 [ Fe(SCN)5 ]2-
2 溶剂合异构
当溶剂分子取代配位基团而进入配离子的内界所
产生的溶剂合异构现象。与电离异构极为相似, 最熟悉 的例子是:
[Cr(H2O)6]Cl3 [Cr(H2O)5Cl]Cl2·H2O [Cr(H2O)4Cl2]Cl·2H2O 在配合物的内界,各含有6、5、4个配位水分子 和0、1、2个配位氯离子, 在配合物的外界各含有0、1 、2个溶剂合水分子和3、2、1个可电离的氯离子。这 些异构体在物理和化学性质上有显著的差异,如它们的 颜色分别为绿、蓝绿、蓝紫。
4p 4s
dsp2杂化
Ni(CN)24
八面体构型
对于F-,H2O等配体而言,配位原子F,O的电负性大, 不易给出孤对电子对,所以对中心体的3d轨道上的 电子不发生明显的影响,因此3d轨道上的电子排布 情况不发生改变 ,形成外轨型配合物。
对于CN-,CO等配位体而言,配位原子C的电负性小, 较易给出孤对电子对,对中心体的3d轨道发生重大 影响,从而使3d发生了电子重排,腾出能量较低的 内层(n-1)d轨道与ns,np轨道杂化,形成内轨型配合 物。
en
en
AACoe Nhomakorabea enCo
en
en
[Co(en)3])
A M
化学中的配位化合物知识点

化学中的配位化合物知识点配位化合物是指由一个或多个配体与一个中心金属离子或原子形成的化合物。
配位化合物在化学中具有重要的地位,广泛应用于催化剂、药物、化妆品、材料等领域。
本文将介绍配位化合物的定义、配体、配位数、结构和性质等方面的知识点。
一、定义配位化合物是由一个或多个配体与一个中心金属离子或原子通过配位键相连而形成的化合物。
配位键是指配体上的一个或多个原子通过共用电子对与中心金属离子或原子形成的化学键。
二、配体配体是指能够通过配位键与中心金属离子或原子形成化学键的化合物或离子。
配体可以是简单的阴离子、分子或配合物,常见的配体有水分子(H2O)、氨分子(NH3)、氯化物离子(Cl-)等。
三、配位数配位数是指中心金属离子或原子周围配体的个数。
配位数决定了配合物的结构和性质。
一般情况下,配位数为2或4的配合物呈平面结构,配位数为6的配合物呈八面体结构。
四、结构配位化合物的结构多样,常见的几何构型有线性、正方形、八面体等。
配合物的结构与配位数、中心金属离子的价态、配体的性质等因素有关。
五、配合物的性质配合物具有许多特殊的性质,包括颜色、磁性、溶解度等。
其中,颜色是由于配合物的电子结构所引起的。
许多过渡金属离子在配位化合物中呈现出丰富多彩的颜色。
六、常见的配位化合物1. 水合物:即配位化合物中的水分子,常见于许多金属离子的溶液中,如CuSO4·5H2O(硫酸铜五水合物);2. 氨合物:即配位化合物中的氨分子,常见于许多过渡金属离子的配合物中,如[Co(NH3)6]Cl3(六氨合三氯钴);3. 配位聚合物:由多个配位单元组成的大分子化合物,如蓝色胆矾[Cu(NH3)4][Fe(CN)6](铜铁氰合物);4. 配位聚合物:由两个或多个中心金属离子和对应的配体组成的化合物,如[Fe2(CN)6]4-(四氰合二铁)。
综上所述,配位化合物是化学中的重要概念,对于理解化学反应、催化剂、材料科学等领域具有重要意义。
配位化合物.-PPT

二、外轨型配合物和内轨型配合物
(4) 内轨型配合物和外轨型配合物的差别 配位键的键能: 内轨型 > 外轨型 配合物的稳定性:内轨型 > 外轨型 稳定常数: 内轨型 > 外轨型
三、配合物的磁矩
顺磁性与反磁性: 测磁矩判断内外轨型配合物: 外轨型配合物,中心原子的电子结构不发生改变, 未成对电子数多,µ 较大。 内轨型配合物,中心原子的电子结构发生了重排, 未成对电子数减少, µ 较小。
二、外轨型配合物和内轨型配合物
(1)外轨型配合物:中心原子用外层轨道接纳配 体电子,形成的配合物。 例如:[Zn(NH3)4]2+ 配体 :NH3
3s 3p 3d 4s 4p
Zn2+
[Zn(NH3)4]
3
2+
NH3
sp 杂化,正四面体构型
NH3
Zn2+ NH3
NH3
二、外轨型配合物和内轨型配合物
4-
杂化轨道形式与配合物的空间构型
配位 数 2 3 4 4 5 5 6 空间构型 杂化轨 道类型 sp 直线形 sp2 平面三角 形 sp3 正四面体 dsp2 四方形 dsp3 三角双锥 d 4s 四方锥 sp3d2 八面体 实例 Ag(NH3)2+ Ag(CN)2– Cu(CN)32 – HgI3– Zn(NH3)42+ Cd(CN)42– Ni(CN)42– Ni(CN)53– Fe(CO)5 TiF52– FeF63– AlF63- SiF62PtCl64-
位 H中心离子与配体之间的化学作用力叫做配位键, N Cu O C 2 外 2 中 配 配 一般是中心原子接受配体中的某原子的孤对电子形成 原 Cu 配 SO 界 4 心 H 的。中心原子周围的配位原子的个数叫做配位数。 子 2C 位 位 位 O 离 O 原 原体 数 H子 NH3 子 3N含配位键的结合物都可以统称配合物。配合物不 子 一定是离子,也可以是中性分子。 C C 乙氨酸铜 配合物 O H配体中只有一个配位原子叫单齿配体,有多个配 2
配位化合物和配位化学

配位化合物和配位化学在化学领域中,配位化合物是指由一个或多个配体与一个中心金属离子或原子形成的化合物。
配位化合物在化学研究和工业应用中占据着重要地位,其结构和性质的研究对于理解化学反应机理和设计新型功能材料具有重要意义。
本文将介绍配位化合物的基本概念、结构特点和应用。
一、配位化合物的定义和特点配位化合物的定义是指由一个或多个配体与一个中心金属离子或原子形成的化合物。
配体是指能够用一个或多个供体原子通过配位键与金属形成配位络合物的分子或离子。
配位键是通过配位化学中的配位原理形成的。
典型的配位键包括金属与配体中供体原子之间的共价键、离子键和金属与配体之间的范德华力等。
配位化合物的结构特点是中心金属离子或原子周围被配体所包围,形成一个或多个配位位点。
在配位化合物中,中心金属离子或原子通过配位键与配体相连接,形成一个稳定的配位络合物。
配位络合物的结构可以通过X射线晶体学、核磁共振等技术手段进行表征。
二、配位化合物的分类根据配位化合物的结构和性质特点,可以将其分为以下几类:1. 单核配位化合物:指只含有一个中心金属离子或原子和一个配体形成的配位化合物。
例如,[Co(NH3)6]3+是一个单核配位化合物,其中Co3+是中心金属离子,六个氨分子是配体。
2. 多核配位化合物:指含有两个或更多中心金属离子或原子与一个或多个配体形成的配位化合物。
例如,[Fe2O(NH2)4(H2O)2]2+是一个多核配位化合物,其中包含两个铁离子和六个氨基甲酸分子作为配体。
3. 配位聚合物:指由大量配体通过配位键连接形成的高分子化合物。
例如,聚合氯化铁是一种配位聚合物,其中氯化铁离子通过氯化物配体进行连接。
4. 双核配位化合物:指由两个中心金属离子或原子和一个或多个配体形成的配位化合物。
例如,[Cu2(H2O)2(OAc)4]是一个双核配位化合物,其中包含两个铜离子和四个乙酸根离子作为配体。
三、配位化合物的应用配位化合物在生物学、材料科学、环境保护等领域中具有广泛的应用价值。
2.2.5 配位键与配位化合物(二)

(2)配合物的空间构型价键理论引用了轨道杂化的概念,对配合物的空间构型作了很好的解释。
轨道杂化的方式、空间排布决定了配位键的空间排布,也决定了配位离子或配合物分子的几何构型。
配合物形成时,用于接纳来自与配体的孤对电子的空轨道,是中心离子(原子)经轨道杂化后的价层空轨道。
取决于的其价电子构型和配体的配位能力强弱共同决定了配位离子或配合物分子的空间构型配位数构型图形实例及其中心原子d电子数2(sp) 直线型(D∞h) [Ag(NH3)2]+, [Cu(CN)2]−d10 3(sp2)三角形(D3h) [HgCl3]−d104 (sp3) 四面体(T d) [Zn(CN)4]2−d10, [FeCl4]−d5 (dsp2)平面正方形(D4h) [Ni(CN)4]2−d8, [Cu(NH)4]2+d9 5 ( sp3d) 三角双锥(D3h) [Fe(CO)5] d8(d2sp3)四方锥(C4v) [Ni(CN)5]3−d8,6 ( sp3d2) 八面体(O h) [Co(NH3)6]2−d6, [PtCl6]−d6外轨型配位键,外轨型配合物(高自旋配合物)Ag +4d 10中心离子提供的空轨道由外层原子轨道杂化而成的杂化轨道形成。
配位数为2的外轨型配合物[Ag(NH 3)2]+中心离子采取sp 杂化几何构型为直线型,键角180°, σ键(3)内轨型配合物和外轨型配合物Ni 2+3d 84s 0配位数为4的外轨型配合物[Ni(NH 3)4]2+几何构型:正四面体,键角109°28’Fe3+3d 54s 0 配位数为6的外轨型配合物[FeF 6]3-这类配合物中,中心离子提供的空轨道由外层原子轨道杂化而成——外轨型配合物/高自旋配合物。
Fe3+3d54s0配位数为6的内轨型配合物[Fe(CN)6 ]3-内轨型配位键,内轨型配合物(低自旋配合物)几何构型:正八面体Cu 2+3d 94s 0配位数为4的内轨型配合物[Cu(NH 3)4]2+几何构型:平面四边形这类配合物中,中心离子提供的空轨道由内层原子轨道杂化而成——内轨型配合物/低自旋配合物。
配位化合物

配位化合物10-配位化合物10.1定义和总则10.11定义配位化合物(简称配合物)是由可以给出孤对电子或多个不定域电子的一定数目的离子或分子(称为配体)和具有接受孤对电子或多个不定域电子的空位的原子或离子(统称中心原子)按一定的组成和空间构型所形成的化合物。
这种由一定数目的配体结合在中心原子周围所形成的配位个体可以是中性分子,也可以是带电荷的离子。
中性配位个体就是配合物,带电荷的配位个体称配离子,带正电荷的配离子称配阳离子,带负电荷的称配阴离子。
含有配离子的化合物统称配合物。
与中心原子直接相连的原子叫配位原子。
配体可能配位的原子的数目用单齿、而齿、三齿等表示。
只含有一个配位原子的配体叫单齿配体。
一个多齿配体通过两个或两个以上的配位原子与一个中心原子连接的称为螯合配体或螯合剂。
连接于一个以上中心原子的配体,称为桥联基团(简称桥基)。
中心原子可以桥基连接,也可以互相直接连接。
中心原子连接的数目,用单核、双核、三核、四核等表示。
10.12命名总则对配位个体命名时,配位体名称列在中心原子之前,不同配体名称之间以中圆点(·)分开,在最后一个配体名称之后缀以“合”字。
若配合物为配离子化合物,则命名时阴离子在前,阳离子在后,与无机盐的命名一样。
若位配阴离子的化合物,则在配阴离子与外界阳离子之间用“酸”字连接,若外界为氢离子,则在配阴离子之后缀以“酸”字。
例如:K[PtCl3NH3] 三氯·氨合铂酸(1-)钾三氯·氨合铂(II)酸钾[Co(NH3)3H2O]Cl3三氯化五氨·水合钴三氯化五氨·水合钴[Co(N3)(NH3)3]SO4硫酸叠氮·五氨合钴硫酸叠氮·五氨合钴10.2一般配位化合物的化学式和命名10.21中心原子在配位个体的化学式中,应列出中心原子的符号(结构式除外),再列出阴离子和中性配体,将整个配位个体的化学式括在方括号“[]”中。
普通化学-配位化合物

金属及配位化合物
第二节 配位化合物的组成,分 类,命名 一.配位化合物与配合反应
中心形成体:金属离子或原子处于配离子或配合 分子的中心位置。简称中心离子或中心原子。 配合体:与中心离子相配位的中性分子或负离子。
二 配合物的组成 [Cu(NH3) 4]SO 4 K 4[Fe(CN) 6]
1.配合物的解离如同强电解质: [Cu(NH3)4]SO4→[Cu(NH3)4]2++SO42-
配离子的解离如同弱电解质:
[Cu(NH3)4]2+ 2 平衡常数:
Cu2++4NH3
4 {c(Cu2 )/c Θ }{c(NH3 )/c Θ } Ky(不稳,[Cu(NH3)4]2+) 2 Θ c([Cu(NH ) ] )/ c 3 4 56
例: 用1升NH3溶液来溶解0.1molAgCl固体,该 NH3溶液的浓度为多少? 设AgCl固体正好全部溶解时溶液中C(NH3)为 X AgCl(s) +2NH3==[Ag(NH3)2] + +Cl – 溶解时 X 0.1 0.1 代入平衡关系式:(利用上题的K值) K ° = C[Ag(NH3)2] ×C(Cl–)/C 2(NH3) 0.1×0.1 /X2=2.02×10-3 X=2.2(mol.dm-3) 注意:此X并非最终结果!
[Ag(NH3)2]+ 二氨合银(I)离子 [Zn(CN)4] 2四氰合锌(II)离子 [Co(NH3)5Cl] 2+ 一氯五氨合钴(III)离子 [Pt(NH3)2(OH)2Cl2] 二氯二羟基二氨合铂(IV)
[Cu(NH3)4]SO4 硫酸四氨合铜(II) [Co(NH3)5Cl]Cl2 二氯化一氯五氨合钴(III) [Co(NH3)3(H2O)Cl2]OH 氢氧化二氯一水三氨合钴(III) [Pt(NH3)4(NO2)Cl]CO3 碳酸一氯一硝基四氨合铂(IV) K3[Fe(CN)6] 六氰合铁(III)酸钾(赤血盐) K4[Fe(CN)6] 六氰合铁(II)酸钾(黄血盐)
配位化合物.-PPT

的四配位络合物几乎全是四面体形的。
镍离子与镍试剂形成的配合物
4-
杂化轨道形式与配合物的空间构型
配位 数 2 3 4 4 5 5 6 空间构型 杂化轨 道类型 sp 直线形 sp2 平面三角 形 sp3 正四面体 dsp2 四方形 dsp3 三角双锥 d 4s 四方锥 sp3d2 八面体 实例 Ag(NH3)2+ Ag(CN)2– Cu(CN)32 – HgI3– Zn(NH3)42+ Cd(CN)42– Ni(CN)42– Ni(CN)53– Fe(CO)5 TiF52– FeF63– AlF63- SiF62PtCl64-
例题
1、命名下列化合物:
(1)K4[Ni(CN)4]
(3)[Ir(ONO)(NH3)5]Cl2 解:(1)四氰合镍(0)酸钾
(2)(NH4)2[FeCl5(H2O)]
(4)Na2[Cr(CO)5]
(2)五氯· 一水合铁(Ⅲ)酸氨 (3)二氯化亚硝酸根· 五氨合铱(Ⅲ) (4)五羰基合铬(Ⅱ)酸钠
[Co(en)3]SO4 硫酸三乙二胺合钴(Ⅱ) [Pt(NH3)6]Cl4 四氯化六氨合铂(Ⅳ) K4[Fe(CN)6] 六氰合铁(Ⅱ)酸钾 H[AuCl4] 四氯合金(Ⅲ)酸 [Co(NH3)3H2OCl2]Cl 氯化二氯一水三氨合钴(Ⅲ) [Co(NH3)4(NO2)Cl]2CO3 碳酸一氯硝基四氨合钴(Ⅲ)
例如:[FeF6]
Fe2+
4–
sp d 杂化, 八面体构型,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
解:中心离子的电价数为+3,故应形成6配体配合物;
3种配体形成配合物的强弱次序是:Br-≤CO3=<NH3; CO3=(•O-CO-O•)既可是单齿配体又可是双齿配体.
①
OCO2
NH3
NH3
NH3 Co NH3
2.3.2 水合异构
分子式相同但水合数不同的配合物称为水合异构。
如
[Cr(H2O)6]Cl3 (紫色),
[CrCl(H2O)5]Cl2•H2O (亮绿色),
[CrCl2(H2O)4]Cl•2H2O (暗绿色)。 26
2.3.3 键合异构
两可配体采用不同的配位原子与中心离子键合而成 的不同配位化合物称为键合异构。如
19
2.1.1 顺-反异构
同种配体处于相邻位 置者称为顺式异构体, 同种配体处于对角位 置者称为反式异构体。
MA2B2类型的平面正 方型配合物具有顺反 异构体。如 [Pt(NH3)2Cl2]。
20
MA2B4类型的四角双锥配合物也具有顺反异构体。 如[Co(NH3)4Cl2]+配离子。
21
2.1.2 面-经异构
2.2.2 旋光仪工作原理简介(复习)
由于该异构体具有旋光性,故又称为旋光异构。若 使偏正面逆时针旋转时则称为左旋 (异构) 体, 反之 称为右旋 (异构) 体,分别在冠名前加L 和D表示。
24
【例2】 MA2B2C2类型的化合物具有几种几何异构体?
C
C
C
B
C
B A
M
B A
A B
M
AA CB
M
A B
晶体场理论把配体看成点电荷或偶极子,由这些点电 荷或偶极子形成一个特定的电场作用在中心原子的 d轨道上,使轨道能量发生变化。
分子轨道理论认为电子围绕整个配合物体系的分子轨 道运动,它综合了价键理论和晶体场理论,是当前 用得最广泛的理论。
29
3.1 几个相关的背景知识
3.1.1 物质的磁性
n012345 /0 0 1.73 2.83 3.87 4.90 5.92
示,并加上小括号;
配位体个数用中文一、二、三…表示;“一”可
省略;配体之间用“•”相隔。
16
【例1】 写出下列配合物的名称
① [Fe(CN)6]4-
六氰合铁(Ⅱ)配离子
② K4[Fe(CN)6]
六氰合铁(Ⅱ)酸钾
③ [Cu(NH3)4]SO4 硫酸四氨合铜(Ⅱ)
④ Na3[Ag(S2O3)2] 二(硫代硫酸根)合银(I)酸钠
铜氨配离子 银氨配离子 氯铂酸钾 铁氰化钾(赤血盐) 亚铁氰化钾(黄血盐)
18
2 配合物的异构现象
在化学上,我们将化合物的分子式相同而结构、性 质不同的现象称为同分异构现象。对于配合物来说, 常见的异构现象有几何异构、旋光异构、电离异构、 水合异构等。
2.1 几何异构(立体异构)
多种配体在中心原子(离子)周围所处的相对位置 不同而导致的异构现象称为配合物的几何异构。具 不同配位数、不同配体种类的配合物可有不同数量 的异构体。
其它条件相同时,溶液的温度越高,越难形成高配
位数的配合物。
15
1.5 配合物的命名
配合物的命名方式与无机物的命名方式相近
命名顺序:从后向前或从右向左; 内、外界之间加“酸”或“化”分开;外界卤素
X-用“化”分开;
配体与中心离子(原子)之间加“合”分开; 中心离子氧化数可紧跟中心离子后用罗马字母表
双核配合物
OC CO Co
OC CO
COCO Co COCO
金属簇状配合物
1.4 配位数和影响配位数大小的因素
直接同中心原子或离子配位的配位原子的数目称为该配
合物的配位数。
配位数的多少与中心原子、配体和环境等许多因素有关。
在其它因素不变的情况下,有:
14
配体相同时,中心原子的半径越大,可能的配位数
中心离子或原子:配合物中心离子或原子是配合物
的核心,它们必须具有空的价轨道,通常是金属(尤其 是周期表中的过渡金属) 离子或原子。
配体:含有孤对电子的分子或离子均可作为配体的
配位原子。
中心离子/原子与配体在周期表中的分布见表2。 Nhomakorabea9
1.2.2 配合物的结构
M(Metal)表示中心原子 或离子,L(Ligand)表示 配体,l 称为配体数(直接 同核配位的配体数目),X 代表外界阴离子,K代表 外界阳离子。
配位化合物
(Coordination Compounds)
南京工业大学 许岩教授
1
荀 丽 多 彩 的 宝 石
2
从左到右:黄色 (yellow) – [ Co(NH3)6]3+
橙色 (orange) – [Co(NH3)5NCS]2+
红色 (red)
– [Co(NH3)5H2O]3+
紫色 (purple) – [Co(NH3)5Cl]2+
Br
Ⅰ
OCO2
NH3 Co NH3
Br
NH3
NH3
Ⅱ
Ⅲ
NH3
NH3
O
NH3 Co O C O Br
NH3
② 首先通过AgBr沉淀法确定第Ⅲ种异构体;然后再通过测
定偶极矩区分Ⅰ和Ⅱ(Ⅰ的偶极矩更小).
28
3 配合物的化学键理论
解释配位键的理论有三种:价键理论、晶体场理论 和分子轨道理论。
价键理论由L.C.Pauling提出并发展起来的,该理论认 为配合物是在Lewis酸碱之间的反应生成的,配体上 的电子对转移到金属的杂化原子轨道上生成配位键。
atomic structure, and bonding,
the theory of acids and base8s.
1.2 配合物的定义、组成与结构
1.2.1 配合物 (coordination compounds)的定义
由配体与中心原子或离子,按一定的组成和空间构
型相结合而成的化合物或离子。早期称络合物 (complex compounds)。
MA3B3异构体中,若A、B两种配体各自连成互相平 行的平面者称为面式异构体,反之若两平面互相垂直 则称为经式异构体。
22
2.2 镜像异构(旋光异构)
2.2.1 镜像异构
当两种化合物的 组成和相对位置 皆相同,但它们 互为镜像关系, 象左右手一样不 能重合,这种异 构称为手性异构 或镜像异构。
23
⑤ [Co(en)3]2(SO4)3 硫酸三(乙二胺)合钴(Ⅲ)
⑥ [Cr(OH)3H2O(en)] 三羟•水•乙二胺合铬(Ⅲ)
⑦ Ni(CO)4
四羰基合镍
⑧ [Cr(H2O)4Cl2]Cl 氯化 二氯•四水合铬(Ⅲ)
17
Note: 某些配位化合物的习惯名称
[Cu(NH3)4]2+ [Ag(NH3)2]2+ K2[PtCl6] K3[Fe(CN)6] K4[Fe(CN)6]
后来,维尔纳用假设和实验证明了自己理论的正确,并获 得了1913年的诺贝尔化学奖 。而约尔更生做了一个有诚信的科 学家应该做的事: 发表了实验结果, 说明自己的理论是错的。
5
1 配位化合物的基本概念
1.1 配位键──一种新的成键类型(复习)
离子键:电负性相差较大(>1.7)的金属元素与非
金属元素分别变成具稳定的(八电子构型)正、负 离子后,通过离子间的静电引力而形成分子。
C C
M
CA BA
M
C B
C
B
A
A
B
三反式
一反二顺式
三顺式
M(AABBCC)有5种几何异构体
还有其它类型的异构体吗?
三反式;三顺式; 一反二顺式; 一顺二反式?
25
2.3 结构异构
2.3.1电离异构(离子异构)
配合物中具有相同的分子式但不同的配位阴离子 (因而水溶液中产生不同的离子)的配位化合物。 如[Co(NH3)5Br]SO4和[Co(NH3)5SO4]Br。
越多;
中心离子的电荷数越高,可能的配位数越多。当中
心离子的氧化数分别为+1,+2,+3时,可能的配位数 通常为2,4或6,6等。如Cu(NH3)2+,Cu(NH3)42+;
中心离子相同时,配体的体积越大,配位数越低。
如AlF63-,AlCl4-;
其它条件相同时,配体的浓度越高,越易形成高配
位数的配合物;
绿色 (green)
– [Co(NH3)4Cl2]+
3
Alfred Werner (1866~1919)
瑞士无机化学家,配位化
学奠基人。
1890 年 与 A.R. 汉 奇 一 起 提
出氮的立体化学理论;
1893 年 提 出 络 合 物 的 配 位
理论和配位数的概念;
1893 年 提 出 化 合 价 的 副 价
根据磁学理论,物质的磁性大小可用磁矩 表示,它与
物质所含的未成对电子数 n 之间的关系可表为
=[n(n+2)]1/20 或 0称为波尔磁子。
3.1.2 电子自旋配对能
/0=[n(n+2)]1/2
当两个自旋方向相反的电子配对进入同一轨道时需消耗 一定的能量,称之为电子自旋配对能,记为P(依赖于 中心原子的轨道,P = 15000 cm-1 ~ 30000 cm-1)。这与洪 特法则在本质上是一致的。
10
1.3 配合物的分类
1.3.1 按配体种类来分
卤合配合物(以F-、Cl-、Br-、I-为配体) 含氧配合物(如以H2O为配体) 含氮配合物(如以NH3为配体) 含碳配合物(如以CN-、 CO为配体) 其它(含硫、含磷;金属有机化合物等)
