沉淀滴定测定酱油中氯化钠含量实验报告
KJ07酱油中氯化钠含量的测定(精)

溶度积常数
沉淀溶解平衡:含有难溶强电解质的饱和溶液中,存在 着未溶固体与其溶解生成的离子之间的平衡。 Ag++Cl- → AgCl↓ Ag++SCN- → AgSCN↓
AgCL(s) Ag CL Ksp 1.561010
2 12 Ag2CrO ( s ) 2 Ag CrO Ksp 2 . 0 10 4 4
项目4 酱油中氯化钠含量的分析测定
—— 沉淀滴定分析
任务一 难溶电解质沉淀溶解平衡 任务二 沉淀滴定分析(银量法)
任务三 重量分析法的应用
任务一 难溶电解质的沉淀溶解平衡
能用于沉淀滴 定的反应应具 备的条件?
1、沉淀反应进行完 全 2、反应按照确定的 化学计量关系进行 3、反应速率快 4、有合适的指示终 点的方法
c 加入滴定剂( AgNO3 )体积为19.98ml时:
[Cl-] = 0.1000×(20.00-19.98)/(20.00+19.98) = 5.4 ×10-5 mol/L pCl 溶液pCl=4.27 d 化学计量点,反应完全,即加入 滴定剂体积为20.00ml [Cl-] =[Ag+]=1.25 ×10-5 溶液pCl=4.87 e 化学计量点后,加入滴定剂20.02ml
所以滴定时更要剧烈摇动,否则会引入较大的误差。
莫标准溶液直接滴定 Cl- 、 Br- 和 CN- 的
反应,而不适用于滴定I-和SCN-,
思考:莫尔法能否 用氯化钠标准溶液 来滴定溶液中银离 子的含量?比如测 铜银合金中银含量
佛尔哈德法(铁铵钒指示剂法 ) 在酸性介质中,直接法测定Ag+ 原理:
KSP可以衡量难溶盐的溶解度大小,KSP越小,表示沉淀反应进行的越完 全,那么小到什么程度才能满足分析测定的要求呢?
电位滴定法测定酱油中氯化钠含量

实验材料 酱 油 样 品 购 自市 场 袋 装 杭 州 产
测 定方法
· ·
,
定液 中 测 位 变化 达
一
和
离子 浓 度 稍 有 变 化 即 可 得
,
到 很 大 的 响 应 电位 值 变 化 两 拐 点 间 的 电
,
次 结果为
,
士
,
标 准 溶 液 体 积 和 电位 毫 伏 数 接 着 每滴 加
.
,
,
说明
,
不 受 样 品 种类 的 影
" '
,
标准溶液
,
响 另 外 将 本 法 与 二 级 微 商 法 〔 〕比 较 结 果
都大 于
次 标准 偏 差 为
,
.
,
本 法 不 受样 品色 泽干 扰 终 点 突
,
跃 范 围宽 灵 敏 准 确 是 替代指 示 剂 法 的 理 想 方 法 关 镇 词 酱油 氯化钠 电 位 滴 定法
,
中图 分 类
,
士
,
说明
一 磁 搅 拌 子 置 烧 杯 于 电磁 搅 拌 器 上 将 甘 汞 电极 接 在
,
重现性很好
计 的 负接 线 柱 上 银 电 极 接 在
,
为 了确证 方 法 的通 用性 又 进 一 步 试 验
,
加水稀释至
,
玻棒搅拌 下 用 液滴定至呈现桔红色 记 下
,
标 准 溶 液 按 下 述 电位 滴 定 法
验证 时 结果 一致 仅 器 型 银 电极 和 型酸度计
,
(完整word版)酱油中NaCl含量的测定

酱油中NaCl含量的测定学院/专业/班级:_________________________姓名:____________实验台号:__________ 教师:____________【实验目的】1.熟悉沉淀滴定法的基本操作;2.了解实验原理,过程及注意事项;3.掌握沉淀滴定法对实际样品酱油的分析。
【实验原理】以K2CrO4作为指示剂,用AgNO3标准溶液在中性或弱碱性溶液中对Cl-进行测定,形成溶解度较小的白色AgCl沉淀和溶解度相对较大的砖红色Ag2CrO4沉淀。
溶液中首先析出AgCl沉淀,至接近化学计量点时,Cl-浓度迅速降低,沉淀剩余Cl-所需的Ag+则不断增加,当增加到生成Ag2CrO4所需的Ag+浓度时,则同时析出AgCl及Ag2CrO4沉淀,溶液呈现砖红色,指示到达终点。
反应式如下:化学计量点前Ag++Cl-=AgCl↓(白色)(Ksp=1.8×10-10)化学计量点时2Ag++CrO42-=Ag2CrO4↓(砖红色)(Ksp=2.0×10-12)【实验仪器及试剂】实验仪器:移液管(2ml、25ml)、吸量管(10ml)、锥形瓶(250ml)、容量瓶(10ml、100ml、250ml)、烧杯(100ml)、分析天平;实验试剂:蒸馏水、0.05 mol/L AgNO3溶液、NaCl基准物、K2CrO4(固体)【实验步骤】1、NaCl标准溶液的配制用减量法称取0.70至0.73g(精确至0.1mg)的NaCl基准物于烧杯中,加适量水溶解,移入250ml的容量瓶中,定容摇匀。
2、50g/L铬酸钾指示剂溶液的配制称取K2CrO40.5g,溶于水中,移入10ml容量瓶中,加水定容,摇匀,待用。
3、硝酸银标准溶液的标定用移液管各移取上述25.00ml上述NaCl标准溶液于三个标号好的锥形瓶中,再各向其中加入25ml水和1ml K2CrO4溶液。
在不断摇动下用待标定硝酸银溶液滴定至刚刚出现稳定的浅橙色即为终点,记录数据。
实验4-6-4(酱油中NaCl含量的测定)

实验4-6 设计性实验题目:酱油中NaCl含量的测定学院/专业/班级:______________________________ 姓名:____________ 小组成员:_______________________________________________________________________实验台号:教师评定:____________ 【所提供的信息】样品为市售某品牌酱油,原料及辅料有:水、食用盐、大豆、小麦粉、白砂糖、食品添加剂(谷氨酸钠、焦糖色、山梨酸钾、5'-肌苷酸二钠、5'-鸟苷酸二钠)、天然香料。
其中氯化钠含量约为20 g/100 mL②用银量法测出氯离子含量,即可得到氯化钠含量;●方案设计时要考虑到酱油颜色、共存成分及pH的影响,以保证测定结果的准确性。
❍AgNO3价格昂贵,为节约成本,方案中Ag+标准溶液浓度控制在0.05 mol/L左右(常用浓度为0.1 mol/L),滴定体积控制在10 mL左右!❍允许采取其他可行的测定方案,但需事前与教师沟通以确定实验室是否可提供相应条件。
【所提供的仪器及试剂】仪器:电子分析天平(0.1 mg)、台秤(0.1 g)、常用滴定分析仪器一套、25 mL棕色酸式滴定管、电加热板、漏斗架、玻璃漏斗、定性滤纸注意:如果方案中用到其他仪器要注明!若实验室无法提供则应修改实验方案!②试剂:浓HNO3(约16 mol/L)、0.05 mol/L AgNO3溶液、NaCl基准物、KSCN(固体)、NH4Fe(SO4)2(固体)、K2CrO4(固体)、KMnO4(固体)注意:如果方案中用到其他试剂要注明,实验室只按市售的形式(固体或浓溶液如浓硫酸)提供,若实验室无法提供则应修改实验方案!【实验方案设计要求】在保证实验准确度要求的前提下,要尽量节约使用试剂及试样;②方案中标准溶液浓度、称样质量和滴定体积等要尽量符合化学分析法的要求;●方案完成后要根据已知条件估算各步骤中消耗滴定剂的体积以确保方案合理并做到心里有数;❍关键或需特别注意的操作应在“注意事项”中列出;⏹最终结果以每100 mL酱油中NaCl的质量表示(g/100 L )。
实验12莫尔法测定酱油中NaCl的含量(讲稿)

实验十莫尔法测定酱油中NaCI的含量一、实验目的1、学会AgN03标准溶液的配制和标定方法;2、掌握莫尔法测定可溶性氯化物的原理及方法。
二、实验原理某些可溶性氯化物中氯含量的测定常采用莫尔法。
在中性或弱碱性条件下,以K2CQ4为指示剂,用AgNO3标准溶液进行滴定,主要反应如下:Ag+ + Cl-= AgCI J (白色)2 Ag++ CrO42- = Ag z CrO q J (砖红色)由于AgCI的溶解度小于Ag2CrO4,根据分步沉淀的原理,溶液中首先析出AgCI沉淀。
当AgCI定量沉淀后,稍微过量的Ag + 即与CrO42-形成砖红色的Ag2CrO4沉淀,它与白色的AgCI沉淀一起,使溶液略带橙红色即为终点。
滴定必须在中性或弱碱性液中进行,最适宜pH范围为6.5〜10.5。
如果有铵盐存在,溶液的pH需控制在6.5〜7.2之间。
指示剂的用量对滴定准确度有影响,一般以5 >10-3moI L-1为宜。
凡是能与Ag+生成难溶性化合物或络合物的阴离子都干扰测定。
如:PO43-、ASO43-、SO32-、CO32-、C2O42-、S2-等。
大量Cu2+、Ni2+、Co2+等有色离子将影响终点观察。
凡是能与CrO42-指示剂生成难溶化合物的阳离子也干扰测定。
女口:Ba2+、P$+能与CrO42-分别生成BaCrO4和PbCrO4沉淀。
Al3+、Fe3+、Bi3+、Sf+等高价金属离子在中性或弱碱性液中易水解产生沉淀,会干扰测定。
AgN03标准溶液既可以用直接法配制,也可以用间接法配制。
间接法配制的AgNO3标准溶液可用NaCI基准试剂标定。
三、仪器和试剂1、仪器:50ml酸式滴定管1支;25ml移液管1支;5ml吸量管1 支;250ml容量瓶1个;100ml容量瓶1个;250ml锥形瓶3个;50〜100mL烧杯1个;玻璃棒2根;洗耳球1个;小滴瓶1个;洗瓶1个。
2、试剂:AgNO3标准溶液(待标定);酱油试样;5%aCrO4溶液;NaCl基准试剂。
酱油中氯化钠含量的测定实验报告

酱油中氯化钠含量的测定实验报告
实验目的:测定酱油中氯化钠的含量。
实验原理:氯化钠是酱油中的重要成分,可以通过重量法测定酱油中氯化钠的含量。
测定原理是将酱油样品溶解后,用氯化银溶液滴定,氯化钠与氯化银反应生成沉淀,终点时沉淀不再形成,此时滴定液中的氯离子与酱油中的氯离子相当,从而计算出酱油中氯化钠的含量。
实验步骤:
1.取一定量的酱油样品(约10 mL),加入50 mL锥形瓶中。
2.用去离子水定容至50 mL。
3.取20 mL的酱油样品溶液,加入滴定瓶中。
4.用去离子水定容至50 mL。
5.取1 mL的氯化银溶液加入滴定瓶中。
6.用去离子水定容至50 mL。
7.用氯化钠标准溶液进行滴定,直至溶液由无色变为浑浊的白色
沉淀出现。
8.记录滴定液的体积。
实验数据处理:
1.计算酱油样品中氯化钠的质量:m(NaCl) = V(Cl-) × C(NaCl)
× M(NaCl)
其中,V(Cl-)为氯化银标准溶液滴定液的体积,C(NaCl)为氯化钠标准溶液的浓度,M(NaCl)为氯化钠的摩尔质量。
2.计算酱油样品中氯化钠的含量:w(NaCl) = m(NaCl) / m(s)
其中,m(s)为酱油样品的质量。
实验结果:经过3次实验测定得出,酱油中氯化钠的平均含量为2.1%。
结论:本实验采用重量法测定了酱油中氯化钠的含量,实验结果表明酱油中氯化钠的含量为2.1%。
酱油中氯化钠含量测定

试剂
c(NH4SC N)=0.02 mol/L的
NH4SCN 溶液
任务一:0.02000mol/L的AgNO3标准溶液的配制 任务二:0.02mol/L的NH4SCN溶液的配制与标定
任务三:酱油试样的称量 与氯化钠含量的测定
任务一:0.02000mol/L的AgNO3标准溶液的配制
1 配制方法
所用试剂与仪器
NH4SCN固体
ቤተ መጻሕፍቲ ባይዱ
实验步骤
1、配制c(NH4SCN)=0.02mol/L的NH4SCN标准溶液500ml
称取0.80g NH4SCN,溶于200ml蒸馏水中,转入 500ml试剂瓶中,稀释至500ml,摇匀,待标定。
称取 NH4SCN
250 ml
不含Cl-的蒸馏
实验步骤
2、NH4SCN溶液的标定 准确移取0.02000mol/LAgNO3溶液25.00ml于
250ml锥形瓶中,加5mL 6mol/L的HNO3溶液,加1mL8 %铁铵矾指示剂,在剧烈摇动下,用NH4SCN溶液滴定 至出现淡红色并继续振荡不再消失为止。记录消耗 NH4SCN溶液的体积为V1。平行测定四次。
加5mL 6mol/L的HNO3溶液, 加1mL8%铁铵矾指示剂
NH4SCN溶液滴定 呈微红色
记录消耗NH4SCN标准溶液的 体积为V2,平行测定三次。
氯化钠的含量
注意事项
1、操作过程应避免阳光直接照射 。 2、AgNO3试剂及其溶液具有腐蚀性,破坏皮肤组织,注意切记
接触皮肤及衣服。 3、配置AgNO3标准溶液的蒸馏水应无Cl-,否则配成的AgNO3标准
溶液会出现白色浑浊,不能使用。 4、实验完毕后,盛装AgNO3标准溶液的滴定管、容量瓶及锥形
沉淀滴定测定酱油中氯化钠含量实验报告

沉淀滴定法测定酱油中的氯化钠含量一、实验目的1. 熟悉沉淀滴定法的基本操作;2. 了解实验原理,过程及注意事项;3. 掌握沉淀滴定法对实际样品酱油的分析。
二、实验原理以K2CrO4作为指示剂,用AgNO3标准溶液在中性或弱碱性溶液中对Cl-进行测定,形成溶解度较小的白色AgCl沉淀和溶解度相对较大的砖红色Ag2CrO4沉淀。
溶液中首先析出AgCl沉淀,至接近反应等当点时,Cl-浓度迅速降低,沉淀剩余Cl-所需的Ag+则不断增加,当增加到生成Ag2CrO4所需的Ag+浓度时,则同时析出AgCl及Ag2CrO4沉淀,溶液呈现砖红色,指示到达终点。
反应式如下:等当点前 Ag++ Cl- = AgCl↓(白色)(Ksp= 1.8×10-10)等当点时 2Ag++ CrO42-= Ag2CrO4↓(砖红色)(Ksp= 2.0 ×10-12)三、实验仪器及试剂实验仪器:移液管(2 ml、5 ml)、锥形瓶(250 ml)、容量瓶(10 ml、250 ml)、烧杯(100 ml)、分析天平实验用品:蒸馏水、铬酸钾、硝酸银、NaCl(干燥)(所用试剂均为分析纯)四、实验步骤1、0.1 mol/L硝酸银标准溶液的配制称取AgNO34.2500 g,溶于水中,移入250 ml容量瓶内,加水至刻度,摇匀,待用。
2、0.01 mol/L硝酸银标准溶液的配制用移液管吸取25 ml 0.1 mol/L AgNO3溶液于250 ml 容量瓶中,用水稀释至刻度。
3、50g/L铬酸钾指示剂溶液的配制称取K 2CrO 4 0.5 g ,溶于水中,移入10 ml 容量瓶中,加水至刻度,摇匀,待用。
4、待测样品的滴定准确移取酱油5.00 ml 至250 ml 容量瓶中,加水至刻度,摇匀。
吸取2.00 ml 稀释液置于250 ml 的锥形瓶中,加100 ml 水及1 ml 50 g/L 的K 2CrO 4溶液,混匀。
酱油中氯化钠的测定

实验一酱油中氯化钠的测定一.实验目的1.了解食品分析前的预处理方法;2.了解滴定方法在食品分析中的应用。
二.实验原理在含有一定量NaCl的酱油中,加入过量的AgNO3,这时试液中有白色的氯化银沉淀生成和未反应掉的AgNO3,用硫酸铁铵作指示剂,用硫氰酸钠标准溶液滴定到刚有血红色出现,即为滴定终点,反应式如下:NaCl + AgNO3→ AgCl↓ + NaNO3 + AgNO3(剩余)AgNO3(剩余) + NH4SCN → AgSCN↓ + NH4NO33NH4SCN + FeNH4(SO4)2→ Fe(SCN)3 + 2(NH4)2SO4三.实验试剂⒈NaCl基准试剂。
在500~600℃高温炉中灼烧半小时后,放置干燥器中冷却。
也可将NaCl 置于带盖瓷坩埚中,加热,并不断搅拌,待爆炸声停止后,继续加热15min,将坩埚放入干燥器中冷却后备用。
⒉0.1mol/L AgNO3溶液。
称4.2g左右AgNO3,加不含Cl-的蒸馏水微热溶解,稀至250mL,放在棕色瓶于暗处保存。
⒊0.1mol/L NH4SCN。
称取1.9g A·R的NH4SCN,用水溶解后,稀至500mL,于试剂瓶待用。
⒋FeNH4(SO4)2 10%(100mL内含6mol/L HNO3 25mL)。
⒌K2CrO4:5%水溶液。
⒍硝基苯。
⒎HNO3 (1:1),若含有氮的氧化物而呈黄色时,应煮沸驱除氮化合物。
四.实验步骤⒈AgNO3溶液的标定。
准确称取1.4621g基准NaCl置于小烧杯中,用蒸馏水溶解后,定量转入250mL容量瓶中稀释至刻度,摇匀。
用移液管移取NaCl溶液25.00mL于250mL锥形瓶中,加入25mL水,用1mL吸量管加入1.00mL 5%K2CrO4溶液,在不断摇动下,用AgNO3滴定至呈现砖红色,即为终点,再重复滴定二份,根据所消耗的AgNO3的体积和NaCl标准溶液浓度计算AgNO3的浓度。
⒉NH4SCN溶液的标定。
沉淀滴定测定酱油中氯化钠含量实验报告(总4页)

沉淀滴定测定酱油中氯化钠含量实验报告(总4页)第一页一、实验目的1. 学习沉淀滴定法的操作方法;2. 学习如何准确使用实验仪器和设备,如计量瓶、管子等;3. 掌握测定酱油中氯化钠含量的方法。
二、实验原理沉淀滴定法是一种常用的分析化学方法。
其基本原理是利用析出沉淀和滴定剂之间的反应,并以终点作为分析化学定量分析的依据。
本实验采用沉淀滴定法测定酱油中氯化钠含量。
氯化银对溶液中的氯化物有较大的亲合力,在适宜条件下常与氯化物生成白色沉淀,反应式如下:AgNO3 + NaCl → AgCl↓ + NaNO3根据化学计量法则可知,每当加入一定量的含氯化钠的酱油样品,剩余氯化钠的质量就减小一定量,反应较多生成的氯化钠可以用氯化银溶液滴定。
当氯化钠已经足够转化成氯化银的时候,余下的氯离子就与氯化银缺少反应,氯离子与银离子已近达到化学计量量,此时氯化银沉淀不再形成,溶液呈现悬浮状态,称此时为终点,此值表示酱油中的氯化钠含量。
三、实验器材及试剂1. 天平:量程为0.0001g;2. 滴定仪:二分度值0.05mL;3. 量筒:50mL;4. 酱油:样品;5. 氯化银溶液:0.1M;6. 氢氧化钠溶液:2 mol/L。
第二页四、实验步骤1. 取一定量的酱油样品,加入适量的氢氧化钠溶液,搅拌均匀;2. 将氯化银溶液定量滴定至出现微浑的浑浊滴,缓慢滴加直至终点。
3. 记录滴定所需的氯化银溶液的体积和样品的质量,计算样品中氯化钠的含量。
五、实验结果实验数据如下:样品质量(g)滴定体积(mL)1 0.9109 13.202 0.7090 10.803 1.6324 24.80计算结果如下:样品滴定体积(mL)氯化钠含量(%)1 13.20 1.102 10.80 0.893 24.80 2.07六、误差分析本实验中出现误差的原因主要有以下几点:1. 酱油样品抽取不均匀,导致测量结果不准确。
2. 在滴定中滴定速度难以控制,滴定剂滴入速度过慢或过快均会导致结果不准确。
酱油氯化钠含量的测定

项目二酱油中氯化钠含量的测定一、实验原理用硝酸银标准溶液滴定样品中的氯化钠,生成氯化银沉淀,待全部氯化银沉淀后,多滴加的硝酸银与络酸钾指示剂生成络酸银使溶液呈橘红色即为终点。
由硝酸银标准滴定溶液消耗量计算氯化钠的含量。
二、仪器和试剂铁架台、25ml 棕色滴定管、烧杯、锥形瓶、无水氯化钠、硝酸银、络酸钾溶液(50g/L )。
三、实验步骤(1)样品的处理:量取酱油3ml 加入装有50ml 水的烧杯中,加入10g 活性炭在80℃水浴30min 进行脱色处理并进行过滤,重复几次到酱油为澄清透明或带有淡黄色的液体为止。
将滤液转移至100ml 容量瓶中,备用。
(2)硝酸银的配制:准确称取1.75g 左右硝酸银固体加水溶解后转移至100ml 棕色容量瓶,备用。
(3)硝酸银的标定:准确称取0.585g 烘干后的无水氯化钠加适量蒸馏水溶解,然后加入4-5滴铬酸钾指示剂,用配制的硝酸银溶液进行滴定,记录滴定所消耗的硝酸银溶液的体积。
做三次平行,同时做空白实验。
(4)样品溶液的滴定:吸取5.0mL 的脱色后稀释液于250mL 锥形瓶中,加30mL 水及1mL 铬酸钾溶液,混匀。
在白色瓷砖的背景下用0.1mol/L 硝酸银标准滴定溶液滴定至初显桔红色。
平行滴定三次,同时做空白试验。
四、结果计算(1)硝酸银溶液的标定按下式计算:Mv v m c ⨯-⨯=)10000(式中: c ——标定的氯化钠溶液的浓度,mol/L ;m ——无水氯化钠的质量准确数值,g ;v ——滴定消耗硝酸银标准滴定溶液的体积,mL ;0v ——空白试验消耗硝酸银标准滴定溶液的体积,mL ;M ——氯化钠的摩尔质量,g/mol 。
(2)样品中氯化钠含量按下式计算:式中:X ——样品中氯化钠的含量,g/100mL ;1V ——滴定样品稀释液消耗硝酸银标准滴定溶液的体积,mL ;V 2——空白试验消耗硝酸银标准滴定溶液的体积,mL ;C ——硝酸银标准滴定溶液的浓度,mol/L ;0.0585——1.00mL 硝酸银标准滴定溶液相当于氯化钠的质量,g 。
酱油中NaCl含量的测定

酱油中NaCl含量的测定学院/专业/班级:_________________________姓名:____________实验台号:__________ 教师:____________【实验目的】1.熟悉沉淀滴定法的基本操作;2.了解实验原理,过程及注意事项;3.掌握沉淀滴定法对实际样品酱油的分析。
【实验原理】以K2CrO4作为指示剂,用AgNO3标准溶液在中性或弱碱性溶液中对Cl-进行测定,形成溶解度较小的白色AgCl沉淀和溶解度相对较大的砖红色Ag2CrO4沉淀。
溶液中首先析出AgCl沉淀,至接近化学计量点时,Cl-浓度迅速降低,沉淀剩余Cl-所需的Ag+则不断增加,当增加到生成Ag2CrO4所需的Ag+浓度时,则同时析出AgCl及Ag2CrO4沉淀,溶液呈现砖红色,指示到达终点。
反应式如下:化学计量点前Ag++Cl-=AgCl↓(白色)(Ksp=1.8×10-10)化学计量点时2Ag++CrO42-=Ag2CrO4↓(砖红色)(Ksp=2.0×10-12)【实验仪器及试剂】实验仪器:移液管(2ml、25ml)、吸量管(10ml)、锥形瓶(250ml)、容量瓶(10ml、100ml、250ml)、烧杯(100ml)、分析天平;实验试剂:蒸馏水、0.05 mol/L AgNO3溶液、NaCl基准物、K2CrO4(固体)【实验步骤】1、NaCl标准溶液的配制用减量法称取0.70至0.73g(精确至0.1mg)的NaCl基准物于烧杯中,加适量水溶解,移入250ml的容量瓶中,定容摇匀。
2、50g/L铬酸钾指示剂溶液的配制称取K2CrO40.5g,溶于水中,移入10ml容量瓶中,加水定容,摇匀,待用。
3、硝酸银标准溶液的标定用移液管各移取上述25.00ml上述NaCl标准溶液于三个标号好的锥形瓶中,再各向其中加入25ml水和1ml K2CrO4溶液。
在不断摇动下用待标定硝酸银溶液滴定至刚刚出现稳定的浅橙色即为终点,记录数据。
酱油中NaCl含量的测定

酱油中NaCl含量的测定学院/专业/班级:_________________________姓名:____________实验台号:__________教师:____________【实验目的】1.熟悉沉淀滴定法的基本操作;2.了解实验原理,过程及注意事项;3.掌握沉淀滴定法对实际样品酱油的分析。
【实验原理】以K2CrO4作为指示剂,用AgNO3标准溶液在中性或弱碱性溶液中对Cl-进行测定,形成溶解度较小的白色AgCl沉淀和溶解度相对较大的砖红色Ag2CrO4沉淀。
溶液中首先析出AgCl沉淀,至接近化学计量点时,Cl-浓度迅速降低,沉淀剩余Cl-所需的Ag+则不断增加,当增加到生成Ag2CrO4所需的Ag+浓度时,则同时析出AgCl及Ag2CrO4沉淀,溶液呈现砖红色,指示到达终点。
反应式如下:化学计量点前Ag++Cl-=AgCl↓(白色)(Ksp=1.8×10-10)化学计量点时2Ag++CrO42-=Ag2CrO4↓(砖红色)(Ksp=2.0×10-12)【实验仪器及试剂】实验仪器:移液管(2ml、25ml)、吸量管(10ml)、锥形瓶(250ml)、容量瓶(10ml、100ml、250ml)、烧杯(100ml)、分析天平;实验试剂:蒸馏水、0.05 mol/L AgNO3溶液、NaCl基准物、K2CrO4(固体)【实验步骤】1、NaCl标准溶液的配制用减量法称取0.70至0.73g(精确至0.1mg)的NaCl基准物于烧杯中,加适量水溶解,移入250ml的容量瓶中,定容摇匀。
2、50g/L铬酸钾指示剂溶液的配制称取K2CrO40.5g,溶于水中,移入10ml容量瓶中,加水定容,摇匀,待用。
3、硝酸银标准溶液的标定用移液管各移取上述25.00ml上述NaCl标准溶液于三个标号好的锥形瓶中,再各向其中加入25ml水和1ml K2CrO4溶液。
在不断摇动下用待标定硝酸银溶液滴定至刚刚出现稳定的浅橙色即为终点,记录数据。
实验一 酱油中氯化钠含量测定——

空白实验:
五、结果计算
0.05NAgNO3溶液的准确浓度:0.041mol
样品中氯化钠含量: (1) C 0.041(V1-V2)
样
= (2) m= C样×58.5×10 1000
V样
V1是滴定样品消耗的硝酸银的体积 V2 是滴定空白消耗的硝酸银的体积
×100(稀释10倍) (克)
(每100毫升酱油中的氯化钠含量)
样品中的氯化钠能与硝酸银反应生成乳白色沉淀: Ag++Cl-══AgCl↓(白) 当反应到达终点时,稍过量的硝酸银能与铬酸钾 反应生成砖红色沉淀从而指示终点: 2Ag++CrO42-══Ag2CrO4↓(砖红) 因此,可用铬酸钾作指示剂、硝酸银滴定来测定 氯化钠含量。
三、实验试剂
仪器试剂:
六、思考题 1、食盐在我们生活中有什么作用? 2、过多食用食盐对身体有什么危害?
AgNO3 0.05mol NaCl A.R. K2CrO4 2% 分析天平 滴定装置 移液管 2.0ml 20.0ml 容量瓶 2.0ml 2个—4个 玻棒、洗耳球等。
四、实验步骤
样品处理:准确吸取酱油样品5.00ml,于50ml容量瓶 中用蒸馏水定容。 样品测定:
实验一 酱油中氯化钠含量测定—— 莫尔法
一、实验目的
学习食品分析中常用的检测方法 滴 定法 学习酱油中氯化钠含量测定——莫尔法
沉淀滴定法测定卤汁中氯化钠的含量

沉淀滴定法测定卤汁中氯化钠的含量卤汁中氯化钠含量的测定用铬酸钾作指示剂的银量法,但影响该方法灵敏度的因素很多,铬酸钾的加人量,溶液的酸度,温度及观察红色出现的方法等。
特别由于被测定的对象有颜色存在使得测定时必须加人一定量的铬酸钾才可准确指示终点,这使得每次测定要做空白试验。
本文滴定前在溴麝香香草酚蓝的指示下,用稀NaOH溶液调节体系的pH值,以荧光黄作沉淀吸附指示剂,银量法测定了卤汁中的氯化钠含量。
1.试剂及样品1.1 0.1%的荧光黄乙醇溶液将0.1g分析纯荧光黄Ⅱ溶于100mL的无水乙醇中。
1.2 0.1mol/L的硝酸银标准溶液‘称取分析纯AgNO3约13.0g ,溶于蒸馏水中,移入1L容量瓶内,加蒸馏水至刻度,待标定。
氯化钠分析纯NaCl在105℃烘箱内干燥两小时。
2%的糊精溶液1g糊精溶于沸腾的50ml蒸馏水中,冷却。
0.05%的溴麝香香草酚蓝指示溶液将0.1g分析纯溴麝香香草酚蓝溶于3.2ml 0.05mol/L的NaOH水溶液中,加水至200ml.0.1mol/L 氢氧化钠溶液分析纯NaOH 0.4g 溶于100ml 蒸馏水中。
2 实验方法2.1 标定精确称取约0.1g干燥的NaCl ,置于250ml锥形瓶中,加蒸馏水25ml ,待溶解后加入荧光黄指示液20滴及5mL糊精溶液,用待标定的AgNO3溶液滴至溶液呈浅桔红色为终点。
2.2滴定精确移取卤汁5.00mL至100ml容量瓶中,加蒸馏水至刻度。
移取10.00ml稀释液至100ml锥形瓶中,加10ml蒸馏水及2滴溴麝香香草酚蓝指示液,用0.1mol/L 的NaOH溶液调节体系约显绿紫色后,加人20滴荧光黄及5ml糊精溶液,用AgNO3。
标准济液滴至呈浅桔红色为终点。
3 计算硝酸银标准溶液的浓度可用下式计算:式中C— AgNO3标准溶液的浓度G— NaCl的准确重量V—AgNO3标准溶液的耗用量(L)。
58.45—NaCl的分子量卤汁中氯化钠含量用下式计算式中:X——卤汁中NaCl的含量(g/100ml) C——AgNO3标准溶液的溶度(mol/L)V'——滴定时耗用AgNO3的体积(L)V——实际所取卤汁的体积(mL)58.45——NaCl的分子量。
沉淀滴定分析水中氯离子的测定 酱油中氯化钠含量的测定

2、酱油中氯化钠含量的测定
在0.1~1mol/L的HNO3介质中,加入过量的AgNO3标准滴定溶 液,加入铁铵矾 指示 剂,用NH4SCN标准滴定溶液返滴定过量的 AgNO3 ,至出现红色指示终点,反应式:
2、用福尔哈德法测定氯离子时,加入邻苯二甲酸二丁酯的目的是在用力 摇动下,有机溶剂将AgCl沉淀包住,使AgCl沉淀与外部溶液隔开,防止 沉淀转化变成溶解度更小的AgSCN沉淀,如果发生转化,滴定体积将会 增加,测定结果偏低。
AgNO3
VNH4SCN
(mol / L)
2、酱油中氯化钠含量的测定
NaCl
(C AgNO3
VAgNO3
CNH4SCN VNH4SCN ) M NaC(l g
V酱油
25 250
/
L)
六、注意事项
1、操作过程应避免阳光直接照射。
2、福尔哈德法在0.1-1mol/L的硝酸性条件下进行的;若在碱性条件下,银 离子发生水解,铁离子也发生水解。
NH4SCN标准 溶液滴定至微
红色
计算NH4SCN 标准溶液的
浓度
(二) 酱油中氯化钠含量的测定 1、酱油样品的稀释
准确吸取酱油试样 2.0mL于小烧杯中
定容于250.00mL容量 瓶中,摇匀,待测。
(二) 酱油中氯化钠含量的测定 2、酱油样品的测定
准确移取上述酱 油试样 25.00mL
于锥形瓶中
Ag+ + Cl- → AgCl (白色,Ksp=1.8 × 10 -10) Ag+ + SCN- → AgSCN (白色,Ksp=2.0 × 10 -12)
关于酱油中氯化钠的检测
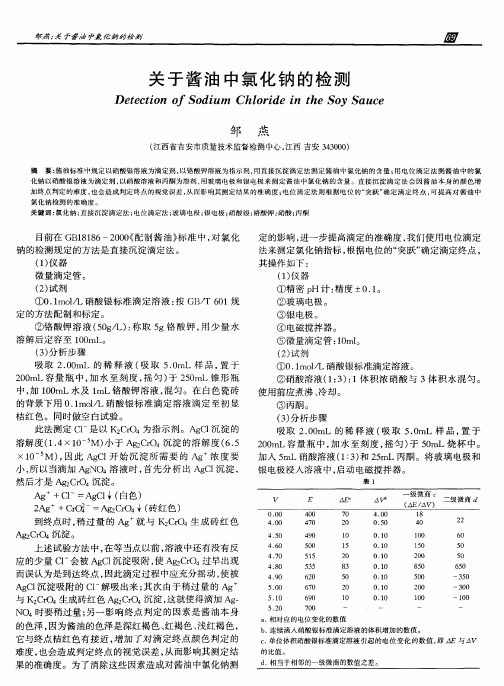
E △ 7 0 2 O
1 O 1 5 2 O
△ 4. 0 O O. O 5
O. O 1 0. O 1 O. O 1
微商
/ V A
二级微商
2 2 6 0 5 0
5 0
到终 点时 , 过 量 的 Ag 稍 就 与 K C O 2 r 4生成 砖 红 色 A 2 r4 淀 。 gC O 沉 上述试 验方 法 中 , 等 当点 以前 , 液 中还有 没有 反 在 溶 应 的少量 C 一 被 A C 沉 淀吸 附 , A 2 r 过早 出现 l会 gl 使 gCO4 而误认 为 是到 达终 点 , 因此滴 定过 程 中应充分 摇 动 , 被 使 A C 沉 淀吸 附 的 C 一 吸 出来 ; 次 由于稍 过 量 的 Ag g1 l解 其 与 K2 r 生 成砖 红 色 A e r 4 淀 , CO4 gCO 沉 这就 使得 滴加 Ag —
摘 要: 酱油标 准中规 定以硝酸银溶液 为滴定剂 , 以铬酸钾溶液 为指示剂 , 直接沉 淀滴 定法测定酱油 中氯 化钠 的含量 ; 电位滴定法测 酱油 中的氯 用 用
化钠 以硝酸银溶液 为滴定剂 , 以硝酸溶液和丙酮为溶剂 , 用玻璃 电极和银 电极来 测定酱油 中氯化钠 的含量 。直接沉淀滴定法 会因酱 油本 身 的颜 色增
邻燕 : 于酱 浊 中氯 化 钠 的捡 潮。 关
关 于 酱 油 中 氯 化 钠 的 检 测
Deet n o o im hoiei h o a c t i fS du C lrd nteS yS u e co
邹 燕
( 江西 省吉安市 质量 技术监督 检测 中心 , 江西 吉安 33 0 ) 4 0 0
1 8 4 0
l 0 o t 0 5
酱油中氯化钠含量的测定

莫尔法测定酱油中食盐的含量10级化学师范一班【摘要】:酱油中食盐含量的测定方法已有报道,主要有莫尔法佛尔哈德法电位滴定法氯离子选择电极法等,根据已学过的的知识将莫尔法进行改进并进行实验,改进后的莫尔法能很好的解决脱色问题,其余的方法均需脱色处理,操作较繁琐。
【关键词】:酱油;食盐含量;电位滴定法;氯离子选择电极法;莫尔法【引言】:钠摄入过多尿中钠钾比值增高是高血压、食管癌、充血性心力衰竭、卒中的发病危险因素。
酱油是人们食盐的重要来源,其食盐含量就应该得到重视。
含量过少,达不到调味要求,且易变质;太多则味苦而不鲜,造成品质不佳,并且会对人的身体健康造成危害,因此酱油中食盐含量与人类健康密切相关,其含量的测定也就显得格外重要。
目前国内外普遍采用容量法、电位滴定法、铬酸钾指示剂和原子吸收法等,在GB18186-2000《配制酱油》标准中,AgCl沉淀对Cl- 的吸附以及酱油本身的色泽使终点不易判断,影响其测定结果的准确度,本实验在此基础上,自行改进了莫尔法测量酱油中的食盐含量,对酱油的质量控制和市场监测有着重要的指导意义。
【试剂与仪器】:仪器:棕色酸式滴定管一支、250mL锥形瓶3个、250mL容量瓶1个、滴管一支、量筒、吸量管(移液管)、洗耳球。
试剂:酱油、4mol/L硝酸、4mol/L 氢氧化钠溶液、5%高锰酸钾溶液、0.0500mol/L硝酸银溶液。
【实验原理】:莫尔法是在中性或弱碱性(pH=6.5~10)溶液中,以K2CrO4作指示剂,用AgNO3标准溶液直接滴定Clˉ。
由于AgCl的溶解度比AgCrO4小,根据分步沉淀原理,溶液中首先析出AgCl白色沉淀。
当AgC1定量析出后,微过量的Ag+,即与CrO42-生成砖红色的Ag2CrO4沉淀,它与AgCl沉淀一起,使溶液略带橙红色即为终点。
最重要的还是对酱油进行脱色处理,加入硝酸煮沸后缓慢滴加高锰酸钾振荡至无色后加入氢氧化钠溶液,加入适量水稀释并滴定。
酱油中氯化钠含量测定

酱油中氯化钠含量的测定一、实验目的1、学习及认识掌握滴定法测定酱油中的氯化钠的基根源理及操作要点。
2、学会滴定法的基本操作技术。
二、实验原理在中性或弱碱性溶液中,以K 2CrO 4为指示剂,用AgNO 3标准溶液进行滴定。
由于AgCl 的溶解度小于Ag 2CrO 4的溶解度,所以,当AgCl 定量积淀后,即生成砖红色的积淀,表示达到终点,其化学反应式以下:Ag ++Cl -=AgCl ↓(白色)2Ag +2-=Ag 2CrO 4↓(砖红色)+CrO 4 在不含氯化钠以外氯化盐的待测溶液中,以 K 2CrO 4为指示剂,用已知浓度的AgNO 3溶液测定其Cl -,再由Cl -按必然换算关系获取待测物料的氯化钠盐含量。
三、主要仪器及药品试剂1、仪器:棕色酸式滴定管、250mL 锥形瓶、250mL 容量瓶、100mL 容量瓶、2mL 移液管、1mL 移液管、100mL 量筒、天平2、药品及试剂:(1)0.02mol/L 硝酸银标准溶液:称取1.7gAgNO 3溶于蒸馏水并稀释至500mL ,转入棕色试剂瓶中暗处保存(2)5%K 2CrO 4溶液(指示剂):称取5g 铬酸钾K 2CrO 4溶于少量水中,用上述AgNO 3溶液滴加至有红色积淀生成,混匀。
静置12h 过滤,滤液转入100mL 容量瓶中,用蒸馏水稀释至刻度(3)NaCl 基准物质 (4)酱油四、操作步骤1、0.02mol/LAgNO 3溶液的配制与标定①在台秤上称取1.7gAgNO 3,溶于500mL 不含C1-的水中,将溶液转入棕色细口瓶中,置暗处保存,以减缓因见光而分解的作用。
②正确称取0.2000gNaCl 基准物质于250mL 烧杯中,加100mL 水溶解,定量转入250mL 容量瓶中,加水稀释至标线,摇匀。
③正确移取20.00mLNaCl 标准溶液于250mL 锥形瓶中,加20mL 水,1mL5%K 2CrO 4溶液,在不断摇动下用AgNO 3溶液滴定,至白色积淀中出现砖红色,即为终点。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
沉淀滴定法测定酱油中的氯化钠含量
一、实验目的
1. 熟悉沉淀滴定法的基本操作;
2. 了解实验原理,过程及注意事项;
3. 掌握沉淀滴定法对实际样品酱油的分析。
二、实验原理
以K
2CrO
4
作为指示剂,用AgNO
3
标准溶液在中性或弱碱性溶液中对Cl-进行测
定,形成溶解度较小的白色AgCl沉淀和溶解度相对较大的砖红色Ag
2CrO
4
沉淀。
溶
液中首先析出AgCl沉淀,至接近反应等当点时,Cl-浓度迅速降低,沉淀剩余Cl-
所需的Ag+则不断增加,当增加到生成Ag
2CrO
4
所需的Ag+浓度时,则同时析出AgCl
及Ag
2CrO
4
沉淀,溶液呈现砖红色,指示到达终点。
反应式如下:
等当点前 Ag++ Cl-= AgCl↓(白色)(K
sp
= ×10-10)
等当点时 2Ag++ CrO
42-= Ag
2
CrO
4
↓(砖红色)(K
sp
= ×10-12)
]
三、实验仪器及试剂
实验仪器:移液管(2 ml、5 ml)、锥形瓶(250 ml)、容量瓶(10 ml、250 ml)、烧杯(100 ml)、分析天平
实验用品:蒸馏水、铬酸钾、硝酸银、NaCl(干燥)(所用试剂均为分析纯)
四、实验步骤
1、 mol/L硝酸银标准溶液的配制
称取AgNO
3
4.2500 g,溶于水中,移入250 ml容量瓶内,加水至刻度,摇匀,待用。
2、 mol/L硝酸银标准溶液的配制
用移液管吸取25 ml mol/L AgNO
3
溶液于250 ml 容量瓶中,用水稀释至刻度。
3、50g/L 铬酸钾指示剂溶液的配制
称取K 2CrO 4 0.5 g ,溶于水中,移入10 ml 容量瓶中,加水至刻度,摇匀,待用。
{
4、待测样品的滴定
准确移取酱油 ml 至250 ml 容量瓶中,加水至刻度,摇匀。
吸取 ml 稀释液置于250 ml 的锥形瓶中,加100 ml 水及1 ml 50 g/L 的K 2CrO 4溶液,混匀。
在白色瓷砖的背景下用 mol/L 的AgNO 3标准溶液滴定至出现浅桔红色,同时做空白试验。
5、硝酸银标准溶液的标定
准确称取干燥NaCl 0.1170 g ,于250 ml 的锥形瓶中,加100 ml 水溶解,及1 ml 50g/L 的铬酸钾溶液,混匀。
在白色瓷砖的背景下用 mol/L 的AgNO 3标准溶液滴定至出现浅桔红色。
五、实验数据记录及处理
1、酱油中氯化钠的含量用下式计算:
3(AgNO )c V 58.45
X 50V '
⨯⨯=
⨯
式中:X ——酱油中NaCl 的含量(g/L )
3(AgNO )c ——AgNO 3标准溶液的浓度(mol/L ) V ——滴定时消耗AgNO 3标准溶液的体积(L )
}
V'——实际所取酱油的体积(L ) ——NaCl 的分子量
表一 酱油中氯化钠滴定
2、标定后AgNO 3标准溶液的浓度用下式计算:
3NaCl
(AgNO )m c
100058.45V
=
⨯⨯∆
表二 硝酸银标准溶液的标定
六、实验结果及讨论
本次实验用以铬酸钾为指示剂的银量法测定酱油中的氯化钠含量,影响该方法灵敏度的因素很多,主要有以下几个方面:
1、指示剂的加入量。
由于K
2CrO
4
溶液呈黄色,其用量直接影响终点误差,浓度颜
色影响终点观察。
一般在100 ml 溶液中加入 2 ml 浓度为 50g/L 的 K
2CrO
4
溶
液,测定终点误差在滴定分析所允许的误差范围内。
2、酱油本身的颜色。
由于酱油本身色泽很深,测定时稀释一百倍及用白色瓷砖增强背景对比度,但存留的色泽仍会严重干扰终点的准确判定。
3、溶液的酸度。
对于酱油中NaCl含量的测定,因有铵盐的存在,溶液的PH值不能超过,否则会产生NH
3
而影响测定。
所以溶液的PH值最好控制在~之间。
4、滴定时振动溶液的程度。
因AgCl沉淀对溶液中的Cl-有显著的吸附作用,在等
当点前,(等当点前:Ag++Cl-=AgCl 白色沉淀;等当点时:2Ag++CrO
42- = Ag
2
CrO
4
砖红色沉淀)Cl-浓度因被吸附而降低,会导致Ag
2CrO
4
提前与等当点前析出,故
在滴定过程中,应剧烈振动溶液,使被吸附的Cl-解析出来和Ag+作用,从而确保检验结果的准确性。
5、本次实验未测定回收率,因此会影响实验的准确度。
