氧化还原反应习题课.ppt.Convertor
氧化还原反应ppt课件

氧化还原反应在环境科学中有着重要的应用,如污水处理、大气污染治理等。
在污水处理中,可以通过氧化还原反应将有毒有害物质转化为无害或低毒物质,如用臭氧、过氧化氢等强氧化剂将有毒有机物氧化成二氧化碳和水。
在大气污染治理中,可以通过氧化还原反应将污染物转化为无害或低毒物质,如用催化转化器将汽车尾气中的一氧化碳和氮氧化物转化为二氧化碳和水。
详细描述
总结词
在氧化还原反应中,氧化剂和还原剂的配比关系决定了反应的方向和程度。
详细描述
氧化剂是能够提供电子的物质,而还原剂是能够接受电子的物质。它们的配比关系决定了反应的进行方向,即电子转移的方向。正确配比的氧化剂和还原剂能够使反应顺利进行,达到平衡状态。
氧化还原反应的应用
03
在有机合成中,氧化反应可以将醇氧化成醛、酮或羧酸,而还原反应则可以将醛还原成醇或酮。
答案:略
解析:这道题主要考察了氧化还原反应中电子转移的计算,需要利用化合价的变化来计算:计算下列氧化还原反应中电子转移的数目。
THANKS
感谢观看
03
注意个人防护措施,如佩戴化学防护眼镜、穿着实验服等。
01
实验安全
02
熟悉实验中使用的化学品的性质和危险性,遵循安全操作规程。
熟悉急救措施和消防器材的使用方法,确保在紧急情况下能够迅速应对。
环境保护
妥善处理实验废弃物,按照实验室规定分类存放和处置。
合理使用化学试剂,避免浪费和污染环境。
提倡绿色化学理念,优化实验条件和流程,减少对环境的负面影响。
氧化还原反应的习题与解析
05
1
2
3
习题一:判断下列氧化还原反应中哪些是氧化剂,哪些是还原剂,哪些是非氧化还原反应。
《氧化还原反应》优质ppt人教3

() A.FeCl3>Cl2>I2 C.I2>Cl2>FeCl3
B.Cl2>FeCl3>I2 D.Cl2>I2>FeCl3
B
已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+====Fe3++Ce3+
、
Sn2++2Fe3+===2Fe2++Sn4+
根据上述两个方程式判断各物质的还原性由
强到弱的顺序是( A.Sn2+、Fe2+、Ce3+
+6
H2SO4(浓) 氧化性
主族非金属元素
最高正价 = 最外层电子数(O、F除外)
最高负价 = 最外层电子数-8
最高正价 + |最高负价| =8
例如:Cl最高价+7价,最低价-1 HClO4 、 HCl
中间价:HC+l5O3、 HC+l3O2 、HC+l1 O
测评:P43 1 测评:P42 例2(1)
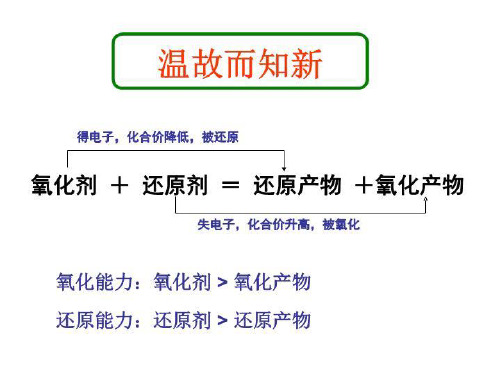
⑵还原性越强,说明该物质越易失去电子。
规律2、判断物质具有氧化性、还原性的方法:
(1)运用元素的化合价进行判断: 当元素处于最高价态时,只具有氧化性 当元素处于最低价态时,只具有还原性 当元素处于最中间价态时,既有氧化性又有还原性
化合价 代表物
S元素的性质
-2
H2S 还原性
0
+4
S
SO2
既有氧化性又有还原性
已知反应:SO2+2H2S=3S+2H2O,则:
(1)氧化剂是 SO2 ,还原剂是 H2S ; (2)氧化产物与还原产物的物质的量之比是:2:1 ; (3)当有32g硫生成时,转移的电子数是 4/3 NA ,还 原剂的质量是 68/3 g ;
《氧化还原反应》PPT课件(完美版)

应属于氧化还原反应,但不属于四种基本反应类型中的
任何一种。
《 氧 化 还 原 反应》 PPT课件
《 氧 化 还 原 反应》 PPT课件
(2)有单质参加或生成的反应一定是氧化还原反应吗?
提示:不一定。反应3O2
2O3中有单质参加或生
成,但元素的化合价没有变化,不属于氧化还原反应。
《 氧 化 还 原 反应》 PPT课件
《 氧 化 还 原 反应》 PPT课件
《 氧 化 还 原 反应》 PPT课件
2.文字表述
(1)置换反应_一__定__是氧化还原反应。(填“一定”“不 一定”或“一定不”,下同) (2)复分解反应__一__定__不___是氧化还原反应。 (3)化合反应和分解反应_不__一__定__是氧化还原反应。 ①有单质参加的化合反应_一__定__是氧化还原反应。
(4)Na2O+H2O====2NaOH属于氧化还原反应。( ) 提示:×。此反应中各元素的化合价均没有发生变化,因 此为非氧化还原反应。
《 氧 化 还 原 反应》 PPT课件
《 氧 化 还 原 反应》 PPT课件
【情境·思考】 《中国诗词大会》是央视首档全民参与的诗词节目,节 目以“赏中华诗词、寻文化基因、品生活之美”为基 本宗旨,力求通过对诗词知识的比拼及赏析,带动全民 重温那些曾经学过的古诗词,分享诗词之美,感受诗词 之趣,从古人的智慧和情怀中汲取营养,涵养心灵。
《 氧 化 还 原 反应》 PPT课件
《 氧 化 还 原 反应》 PPT课件
(3)当反应中有一种元素被氧化时,一定有另一种元素 被还原。 ( ) 提示:×。可能是同种元素化合价的升降,如 2H2O2====2H2O+O2↑。
《 氧 化 还 原 反应》 PPT课件
氧化还原反应(最新版)PPT

知识铺垫
新知预习
自主测试
一、从不同角度分析氧化还原反应1.从得氧、失氧的角度认识氧化还原反应反应:2CuO+C 2Cu+CO2↑(1)CuO失氧,发生了还原反应,该物质是氧化剂。(2)C得氧,发生了氧化反应,该物质是还原剂。结论:从得氧、失氧的角度看,一种物质得到氧被氧化,另一种物质失去氧被还原的反应叫做氧化还原反应。
探究一
探究二
素养脉络
随堂检测
D项,HgS中汞元素由+2价降到0价,转移2e-,O2中氧元素由0价降到-2价,转移2×2e-,且均为得电子,而HgS中硫元素化合价由-2价升高到+4价,失6e-,正确的表示方法为
探究一
探究二
素养脉络
随堂检测
探究一
探究二
素养脉络
随堂检测
1.古诗词是古人为我们留下的宝贵精神财富,下列诗句不涉及氧化还原反应的是( )A.野火烧不尽,春风吹又生B.春蚕到死丝方尽,蜡炬成灰泪始干C.粉身碎骨浑不怕,要留清白在人间D.爆竹声中一岁除,春风送暖入屠苏答案C解析A 、B两项中均涉及物质燃烧,D项中有火药爆炸,都属于氧化还原反应;C项中反应为CaCO3 CaO+CO2↑,无元素化合价升降,属于非氧化还原反应。
探究一
探究二
素养脉络
随堂检测
探究一
探究二
素养脉络
随堂检测
深化拓展1.双线桥法和单线桥法的书写步骤(1)双线桥法的书写步骤:
探究一
探究二
素养脉络
随堂检测
(2)单线桥法的书写步骤:
探究一
探究二
素养脉络
随堂检测
2.用双线桥法表示电子转移的方向和数目时的注意事项(1)箭头必须由反应物指向生成物,且两端对准同种元素。(2)在“线桥”上标明电子“得到”或“失去”,且得到与失去的电子总数必须相等,电子对的偏移也按得失处理。(3)电子转移数以a×be-形式表示,a表示发生氧化还原反应的原子个数,b表示每个原子得到或失去的电子数,当a=1或b=1时,要省略。(4)箭头方向不代表电子转移的方向,仅表示电子转移前后粒子的变化。3.用单线桥法表示电子转移的方向和数目时的注意事项(1)单线桥必须画在反应物中。(2)箭头指向得电子原子,箭尾指向失电子原子。(3)“线桥”上只标电子转移的数目,不标“得”“失”字样。
氧化还原反应PPT (精简)剖析

+5
-1
-1 0
(3)KClO3 + 6HCl == KCl + 3Cl2 ↑+ 3H2O
10/6/2020
失 5× e-
(2)“单线桥”法 2e-
△
CuO + H2 === Cu + H2O
12e-
2KClO3 =△== 2KCl + 3O2 ↑
注意:A、箭头由失电子元素指向得电子元素 。 B、只须标明电子转移总数。
练习:用“双线桥”法表示下列氧化还原反应电子转移的方向和数 目。
失1 × 2e-
0 +1
+2
0
(1)Fe + H2SO4 == FeSO4 + H2↑
得2×e-
得2×5e-
+7
-1
+2
0
(2)2KMnO4 + 16HCl == 2KCl+2MnCl2 + 5Cl2↑+ 8H2O
得1 × 5e-
失 10× e-
第二节 氧化还原反应
氧化还原反应 在初中我们也学过氧化反应和还原反应,
2Mg+O2=2MgO CuO+H2=H2O+Cu
氧化还原反应 一.氧化还原反应
1.从得失氧的角度分析
氧化反应:物质得到氧的反应 还原反应:物质失去氧的反应
CuO + H2 = H2O + Cu
CuO Cu 失去氧 还原反应
H2 H2O 得到氧 氧化反应
一种物质失去氧必有一种物质得到氧,在 同一个反应中既有还原反应又有氧化反应
氧化还原反应
氧化还原反应定义:
既有物质得到氧 又有物质失去氧
氧化还原反应习题课ppt课件
资金是运动的价值,资金的价值是随 时间变 化而变 化的, 是时间 的函数 ,随时 间的推 移而增 值,其 增值的 这部分 资金就 是原有 资金的 时间价 值
资金是运动的价值,资金的价值是随 时间变 化而变 化的, 是时间 的函数 ,随时 间的推 移而增 值,其 增值的 这部分 资金就 是原有 资金的 时间价 值
资金是运动的价值,资金的价值是随 时间变 化而变 化的, 是时间 的函数 ,随时 间的推 移而增 值,其 增值的 这部分 资金就 是原有 资金的 时间价 值
资金是运动的价值,资金的价值是随 时间变 化而变 化的, 是时间 的函数 ,随时 间的推 移而增 值,其 增值的 这部分 资金就 是原有 资金的 时间价 值
资金是运动的价值,资金的价值是随 时间变 化而变 化的, 是时间 的函数 ,随时 间的推 移而增 值,其 增值的 这部分 资金就 是原有 资金的 时间价 值
资金是运动的价值,资金的价值是随 时间变 化而变 化的, 是时间 的函数 ,随时 间的推 移而增 值,其 增值的 这部分 资金就 是原有 资金的 时间价 值
资金是运动的价值,资金的价值是随 时间变 化而变 化的, 是时间 的函数 ,随时 间的推 移而增 值,其 增值的 这部分 资金就 是原有 资金的 时间价 值
资金是运动的价值,资金的价值是随 时间变 化而变 化的, 是时间 的函数 ,随时 间的推 移而增 值,其 增值的 这部分 资金就 是原有 资金的 时间价 值
资金是运动的价值,资金的价值是随 时间变 化而变 化的, 是时间 的函数 ,随时 间的推 移而增 值,其 增值的 这部分 资金就 是原有 资金的 时间价 值
资金是运动的价值,资金的价值是随 时间变 化而变 化的, 是时间 的函数 ,随时 间的推 移而增 值,其 增值的 这部分 资金就 是原有 资金的 时间价 值
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氧化还原滴定法习题
1.计算1mol/L的HCL溶液中CCe4+=1.00×10-2 mol/L和CCe3+=1.00×10-3 mol/L时Ce 4+/ Ce 3+电对的电位。
2.在1mol/L的HCL溶液中,Cr2O72- /Cr3+电对的条件电位为1.00V,计算用固体亚铁盐将0.1000mol/L的KCr2O7还原至一半时的电位?
3.计算0.10mol/L的HCL溶液中As(Ⅴ)/As(Ⅲ)电对的条件电位。
4.计算MnO4-/Mn2+电对的电位与pH的关系,并计算pH=2.0和pH=5.0时的条件电位5.计算pH=10.0,CNH3=0.20mol/L的NH3-NH4CL缓冲溶液中,Zn 2+/Zn电对的电位。
6.计算pH = 10.0时,总浓度为0.10mol/L NH3-NH4CL的缓冲溶液中,Ag+/Ag电对的条件电位。
忽略离子强度的影响。
已知:Ag-NH3的lgβ1~lgβ2分别为3.24,7.05,NH4+的pKa=9.25,φθAg+/Ag=0.80(v)
7.计算pH=3.0,含有未络合EDTA的浓度为0.1000mol/L时,Fe3+/Fe2+的条件电极电位。
已知pH=3.0时的lgαY(H)=10.6,lgK(FeY- )=25.1,lgK(FeY2- )=14.32,φθ=0.77V,忽略离子强度。
8.根据电极电位计算下列反应的平衡常数
9.计算在1mol/L的H2SO4介质中,Ce 4+与Fe2+滴定反应的平衡常数及化学计量点时的电位?并计算滴定突跃范围?
10.计算1mol/L的H2SO4溶液中,用KMnO4滴定Fe 2+的平衡常数。
达到化学计量点时的CFe3+/ CFe2+为多少?
11. 称取0.1082g的K2Cr2O7,溶解后,酸化并加入过量的KI,生成的I2需用21.98ml的Na2S2O3溶液滴定,问Na2S2O3溶液的浓度为多少?
12.25.00mLKI溶液用稀盐酸及10.00mL,浓度为0.0500 mol/L的KIO3溶液处理,反应后煮沸驱尽所生成的I2 ,冷却,加入过量的KI与剩余KIO3反应,析出的I2用0.1010mol/L 的Na2S2O3 溶液滴定,消耗21.27mL,求KI溶液的浓度?
13.40.O0mL的KMnO4溶液恰能氧化一定重量的KHC2O4·H2C2O4·2H2O,同样重量的物质又恰能被30.00mL的KOH标准溶液(0.2000mol/L)所中和,试计算KMnO4的浓度?
14.测定水中硫化物,在50mL微酸性水样中加入20.00mL 0.05020mol.L的I2溶液,待反应完全后,剩余的I2需用21.16mL 0.05032mol/L的Na2S2O3溶液滴定至终点。
求每升废水中含H2S的克数。
15.设用0.2000mol/L的KMnO4溶液滴定2.500g双氧水,在标准状态下放出氧气50.40mL,求所需KMnO4溶液的毫升数和双氧水中H2O2的含量。
16.今有含As2O3和As2O5及惰性杂质的混合物,将其溶于碱溶液后再调节成中性,此溶液需用0.02500mol/L的I2溶液21.00mL滴定至终点。
然后再将所得溶液酸化,加入过量KI,析出的I2需0.07500mol/L的Na2S2O3 溶液30.00mL才能反应完全,求混合物中As2O3和As2O5的质量。
17.称取含有As2O3和As2O5的混合物1.500g,处理为需用0.05000mol/L的I2溶液30.00mL 滴定至终点。
如果将溶液酸化,加入过量KI,仍以淀粉为指示剂,析出的I2需用0.3000mol/L 的Na2S2O3 溶液30.00mL滴定至终点,求混合物中As2O3和As2O5的含量。
18. 将含KI试样1.000g溶于水,加10.00mL,浓度为0.05mol/L的KIO3溶液,反应后煮沸驱尽所生成的I2,冷却,加过量的KI与剩余KIO3反应,析出的I2用0.1008mol/L的Na2S2O3 溶液滴定,消耗21.14mL,求试样中的KI含量?
19.用K2Cr2O7法测定铁,称铁矿样0.2500g,预处理成Fe2+,滴定时消耗K2Cr2O7标准溶液23.68mL,此K2Cr2O7标液25.00mL在酸性介质中与过量的KI作用后析出I2,需消耗20.00mL的Na2S2O3溶液,试计算Fe2O3% 。
(已知TNa2S2O3/ I2=0.01587g/mL,I2 = 253.8,Fe2O3 =159.7)
20.称取苯酚样品0.4083g,用少量NaOH溶液溶解后转入250mL容量瓶中,稀释至刻度,混匀。
取25.00mL于碘量瓶中,加溴液(KBrO3 + KBr)25.00mL,再加盐酸和适量KI,用0.1084mol/L的Na2S2O3 溶液滴定,用去20.04mL至终点。
另取25.00mL溴液作空白,用去相同浓度的Na2S2O3 溶液41.60mL滴至终点,计算样品中苯酚的含量。
(一分子苯酚与三分子Br2反应生成三溴苯酚,苯酚分子量=94.11)
21.称铬钒Cr2(SO4) ·K2SO4·24H2O试样2.000g,用Na2O2处理使其中Cr氧化成CrO42-,酸化后分两等份。
一份加0.1000mol/L的(NH4)2SO4·FeSO4·6H2O溶液50.00mL后,用6.00mL K2Cr2O7溶液(1mL相当于0.008378g Fe)回滴;另一份加过量的KI,用0.2000mol/L 的Na2S2O3滴定析出的I2,问:(1)需Na2S2O3多少毫升?(2)试样中Cr%?
(已知CrO42- + 8H+ +3e === Cr3+ + 4H2O;Fe = 55.85,Cr = 52.00)
22.今有含PbO和PbO2试样,用高锰酸钾法滴定。
称取该样品1.234g,在酸性条件下加入20.00mL0.2500mol/L草酸溶液,先将PbO2还原为Pb2+,然后用氨水调溶液pH,使全部Pb2+形成PbC2O4沉淀,过滤后将溶液酸化,用KMnO4标准溶液滴定,共计用去0.04000mol/L KMnO410.00mL;再将沉淀溶于酸中,用同一KMnO4标准溶液滴定,共计用去30.00mL。
试计算PbO和PbO2试样的百分含量?(PbO =223.2,PbO2 =239.0)
23.分析某试样中的Na2S。
称取试样0.5000g,溶于水后,加入NaOH至弱碱性,加入过量的浓度为0.02000mol/L的KMnO4溶液25.00mL,S2-被氧化为SO42-,此时KMnO4被还原为MnO2,过滤除去,将滤液酸化,加入KI,用0.1000mol/L Na2S2O3滴定析出的I2,消耗7.50mL,求Na2S%?(M=78.04)
24.称取Pb3O4试样0.1000g,用HCL溶解,在热时加入0.02mol/L的K2Cr2O7溶液25.00mL,析出PbCrO4沉淀;冷后过滤,将PbCrO4沉淀溶解,加入KI和淀粉溶液,用0.1000mol/L Na2S2O3溶液滴定时消耗12.00mL,求试样中PbCrO4的含量。
(M=685.6)。
