药品溶液澄清度检查法
特殊杂质的检查

测定的主要条件 重氮化反应的速度受多种因素的影响,亚硝酸钠滴定液及反应生成的重氮盐也不够稳定,。 (1)加适量溴化钾加快反应速度:在盐酸存在下,重氮化反应历程为: NaNO2+HCl HNO2+NaCl HNO2+HCl NOCl+H2O NO+Cl- Ar-NH2 Ar-NH-NO Ar-N=N-OH Ar-N2+Cl- 慢 快 快
注意: 第一步反应的快慢与含芳伯氨基化合物 中芳伯氨基的游离程度有密切关系: 芳伯氨基的碱性较弱 在一定强度酸性溶液 中成盐比例较小 游离的芳伯氨基多 重氮化反 应速度就快;反之亦反。 KBr 使重氮化反应加速的原理 HCl+KBr KCl+HBr HNO2+HBr NOBr+H2O (1) 若供试液中仅含HCl,则: HNO2+HCl NOCl+H2O (2) (1)式的平衡常数比(2)式约大300倍,生 成NOBr量大的多从而加速了重氮化反应的进行。
检查方法 本品1.0g,加甲醇溶液(1 2)20ml溶解后,加碱性亚硝基铁氰化钠试液1ml,摇匀放置30min;如显色,与对乙酰氨基酚对照品1.0g加对氨基酚50 μg用同一方法制成的对照品比较,不得更深(0.005%) 对氨基酚对照溶液不稳定,应临用前新鲜配制。
溶液颜色与澄清度

二、药物颜色检查的意义,药物的颜色与以下三个因素有关:1、药物本身的化学结构。
有颜色药物的分子结构中一般具有不饱和碳链和不饱和碳环的共轭体系,颜色的深浅又与N、S、O等杂原子在这些共轭体系中的原子种类和数目有关。
2、制备工艺中的杂质也是药物颜色的重要引入因素。
另外部分药物在放置过程中,由于氧化、水解,络合、聚合等原因使药物的颜色逐渐加深,如见光易变色的药物维生素C、磺胺嘧啶、硫酸链霉素、葡萄糖、喹诺酮类药物等。
由此可以看出,颜色(溶液的颜色)检查是药物纯度检查的重要指标,其目的是:1、控制生产过程中可能引入的微量有色杂质;2、控制在贮藏过程中产生的有色杂质。
目前多国药典如中国药典(CP)、美国药典(USP)、英国药典(BP)和***药典(JP)等都收载药物颜色或溶液颜色检查项目。
因不同的制备工艺产生的杂质可能不同,这种不同可能会影响终产品的性状,终产品的颜色可能会有差别。
另外,药物在溶液状态下和固体状态下降解机理可能不同,因此,溶液的颜色与固体的颜色可能也会有差别。
三、国内外药物颜色的研究方法及其特点中国药典1990年版规定了两种溶液颜色检查方法,即对照比色法和分光光度法,2000年版中国药典中又增加了色差计法。
(一)对照比色法该方法以重铬酸钾(黄色)、硫酸铜(蓝色)、氯化钴(红色)三种溶液,按一定比例配制成黄色、黄绿色、橙黄色、橙红色、棕红色等5种色调的贮备液,并按规定配制成1-10号标准比色液。
对照比色法直观简便,但存在以下不足:1、以人的视觉作为最后评判依据,易受到主观因素的制约。
另外,在测定过程中由于周围环境及背景色对颜色的影响等,使检验标准的一致性不易控制。
2、有时供试液与标准液的色调可能不一致,即不能选择到适合于供试品颜色的色调,虽然该方法可满足大多数化学药物,但仍不能用于部分药物有色杂质的控制。
(二)分光光度法分光光度法指用一定量的供试品加溶剂(主要用水)溶解,按分光光度法于规定波长处测定,吸光度不超过规定值。
药分中各类药物的杂质
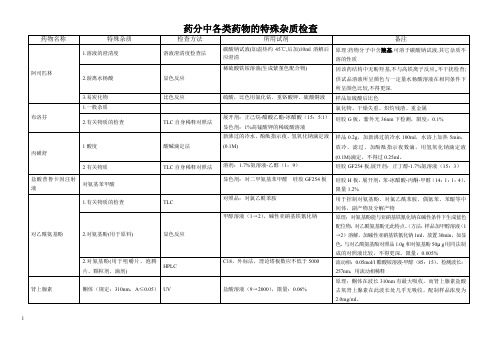
TLC
高低浓度对比法
盐酸吗啡
1.阿扑吗啡
碘试液
阿扑吗啡水溶液在碳酸氢钠碱性条件下,经碘试液氧化,生成水溶性绿色化合物,此产物能溶于乙醚,显深宝石红色,水层仍显绿色.(规定:50mg药物检查)
2.罂粟碱
稀盐酸、三氯化铁试液
罂粟碱在微酸性溶液中遇三氯化铁试液生成红色的罂粟铁
3.其他生物碱
司可巴比妥钠
1.溶液的澄清度
新沸过的冷水10ml
溶液应澄清
2.中性或碱性物质
同苯巴比妥
异烟肼
游离肼(斑点为鲜黄色,Rf约为0.3)
TLC
显色剂:乙醇制对二甲氨基苯甲醛(15min后检视)(异烟肼斑点为棕橙色,Rf约为0.21)
样品:水制成50mg/ml;对照品:硫酸肼(水制成0.2mg/ml,相当于游离肼50μg。在供试品主斑点前方与硫酸肼斑点相应的位置上不得显黄色斑点。
加90%乙醇30ml,水浴加热回流10min,溶液应澄清
5-羟甲基糠醛
UV
284nm处测定吸收度不得大于0.32
乳糖
蛋白质
硝酸汞试液
蛋白质遇硝酸汞试液产生白色沉淀
蔗糖
还原糖的检查
碱性枸橼酸铜试液,25%碘化钾溶液,硫酸溶液(1→5),硫代硫酸钠滴定液
钙盐的检查
钙离子能与草酸根离子生成沉淀
洋地黄毒苷
洋地黄皂苷
乙醇溶液,胆甾醇的乙醇溶液(1→200)2ml
10min内,不得发生沉淀
地高辛
洋地黄毒苷
TLC
对照品比较法
醋酸地塞米松
1.其他甾体
TLC
高低浓度对比法
显色剂:四氯唑蓝(为氧化剂)
2.硒
氧瓶燃烧法
澄清度检查法

澄清度检查法操作规程1 目的建立澄清度检查法操作规程,使其规范化、合理化。
2 范围适用于澄清度检查法的检验操作。
3 职责3.1 质量控制部检验人员对具体操作负责;3.2 质量保证部负责监督本规程的执行。
4 定义4.1 澄清:指供试品溶液的澄清度与所用溶剂相同,或不超过0.5号浊度标准液的浊度。
4.2 几乎澄清:指供试品溶液的浊度介于0.5号至1号浊度标准液的浊度之间。
5 内容5.1 概述与原理澄清度检查法系将药品溶液与规定的浊度标准液相比较,用以检查溶液的澄清程度,是利用药物与杂质在特定溶剂中溶解性能的差异而设计的检查项目,主要用于原料药与注射剂的质量控制。
浊度是一种光学效应,是光线与溶液中的悬浮颗粒相互作用的结果,它表征光线透过水层时受到障碍的程度。
5.2 仪器与用具5.2.1 比浊用玻璃管:内径15~16mm,平底,具塞,以无色、透明、中性硬质玻璃制成,要求供试品管与标准管的内径、标线刻度(距管底为40mm) 一致。
5.2.2 伞棚灯用可见异物检查法标准操作规范中第一法灯检法项下的检查装置,照度为1000 Lx。
5.3 试药与试液5.3.1 浊度标准贮备液的制备:称取于105℃干燥至恒重的硫酸肼1.00g置l00ml 量瓶中,加水适量使溶解,必要时可在40℃的水浴中温热溶解,并用水稀释至刻度,摇匀,放置4~6小时;取此溶液与等容量的10%乌洛托品溶液混合,摇匀,于25℃避光静置24小时,即得。
该溶液置冷处避光保存,在两个月内使用,用前摇匀。
5.3.2 浊度标准原液的制备:取浊度标准贮备液15.0ml,置l000ml量瓶中,加水稀释至刻度,摇匀,取适量,置lcm吸收池中,照紫外一可见分光光度法(SOP-QC-00-001-00)在550nm的波长处测定,其吸光度应在0.12~0.l5范围内。
本液应在48h内使用,用前摇匀。
5.3.3 浊度标准液的制备:取浊度标准原液与水,按下表配制,即得。
本液应临5.4 操作方法5.4.1 除另有规定外,将一定浓度的供试品溶液与该品种项下规定的浊度标准液,分别置于配对的比浊用玻璃管中,液面高度为40mm,在浊度标准液制备5min 后,于暗室内垂直同置于伞棚灯下,照度为1000 lx,从水平方向观察比较,用以检查溶液的澄清度或其浑浊程度。
澄清度检查操作规程
范围:原辅料、成品职员:检验室对本规程的实施负责正文:1.原理——澄清度是检查药品溶液的浑浊程度,即浊度。
药品溶液中如存在细微颗粒,当直射光通过溶液时,可引致光散射和光吸收的现象,致使溶液微显浑浊;所以澄清度可在一定程度上反映药品的质量和生产工艺水平。
澄清度检查法是用规定级号的浊度标准溶液与供试品溶液比较,以判定药品溶液的澄清度或浑浊程度。
2.仪器与用具2.1比浊用玻璃管内径15~16mm,平底,具塞,以无色硬质中性玻璃制成,要求供试品管与标准管的内径、标线刻度(距管底为40mm)一致。
2.2伞棚灯用澄明度检查装置,照度为1000Lx。
3.试药与试渡3.1硫酸肼和乌洛托品(分析纯)3.2浊度标准贮备液的制备称取硫酸肼1.00g置100ml量瓶中,加水适量使溶解,必要时可在40℃的水浴中温热溶解,并用水稀释至刻度,摇匀,放置4~6小时;取此溶液与等容量的10%乌洛托品溶液混合,摇匀,于25℃避光静置24小时,即得。
本液置冷处避光保存,可在两个月内使用,用前摇匀。
3.3浊度标准原液的制备取浊度标准贮备液15.0ml,置1000ml量瓶中,加水稀释至刻度摇匀,取适量、置1cm吸收池中,照分光光度法在550nm的波长处测定,其吸收度应在0.12~0.15范围内。
本液应在48小时内使用,用前摇匀。
3.3.1执行《紫外分光光度法标准操作规程》3.3.1执行《紫外分光光度计标准操作规程》3.4 浊度标准原液的的制备取浊度标准原液与水,按下表配制,即得。
本液应4.1除另有规定外,将一定浓度的供试品溶液与该品种项下规定的浊度标准液,分别置于配对的比浊用玻璃管中,液面高度为40mm,在浊度标准液制备5分钟后,同置黑色背景上,在漫射光下从比色管上方向下观察,比较,或置于伞棚下,照度为1000lx,从水平方向观察比较,用以检查溶液的澄清度或其浑浊程度。
4.2在进行比较时,如供试品溶液管的浊度接近标准管时,应将比浊管交换位置后再行观察。
澄清度检查法 2010年版药典第三增补本

文件编号执行日期澄清度检查法SOP-ZL-069 2014.05.01起草人审核人批准人起草日期审核日期批准日期版本号00 原文件有效期分发部门质量保证部质量控制实验室目的:制订溶液的澄清度检查法的检验操作规程。
适用范围:液体制剂。
责任人:检验员、实验室主任、质量保证部部长。
内容:澄清度检查法系将药品溶液与规定的浊度标准液相比较,用以检查溶液的澄清程度。
品种项下规定的“澄清”,系指供试品溶液的澄清度与所用溶剂相同,或不超过0.5号浊度标准液的浊度。
“几乎澄清”,系指供试品溶液的浊度介于0.5号至1号浊度标准液的浊度之间。
一、第一法(目视法)除另有规定外,按各品种项下规定的浓度要求,在室温条件下将用水稀释至一定浓度的供试品溶液与等量的浊度标准液分别置于配对的比浊用玻璃管(内径15~16mm,平底,具塞,以无色、透明、中性硬质玻璃制成)中,在浊度标准液制备5分钟后,在暗室内垂直同置于伞棚灯下,照度为1000lx,从水平方向观察、比较。
除另有规定外,供试品溶解后应立即检视。
第一法无法准确判定二者的澄清度差异时,改用第二法进行测定并以其测定结果进行判定。
浊度标准贮备液的制备称取于105℃干燥至恒重的硫酸肼1.00g,置100ml量瓶中,加水适量使溶解,必要时可在40℃的水浴中温热溶解,并用水稀释至刻度,摇匀,放置4~6小时;取此溶液与等容量的10%乌洛托品溶液混合,摇匀,于25℃避光静置24小时,即得。
该溶液置冷处避光保存,可在2个月内使用,用前摇匀。
浊度标准原液的制备取浊度标准贮备液15.0ml,置1000ml量瓶中,加水稀释至刻度,摇匀,取适量,置1cm吸收池中,照紫外-分光光度法(附录IV A),在550nm的波长处测定,其吸光度应在0.12~0.15范围内。
该溶液应在48小时内使用,用前摇匀。
浊度标准液的制备取浊度标准原液与水,按下表配制,即得。
浊度标准液应临用时制备,使用前充分摇匀。
级号0.5 1 2 3 4浊度标准原液/ml 2.50 5.0 10.0 30.0 50.0水/ml 97.50 95.0 90.0 70.0 50.0二、第二法(仪器法)供试品溶液的浊度可采用仪器法测定。
澄清度检查法

澄清度检查法澄清度检查法澄清度检查法系将药品溶液与规定的浊度标准液相比较,用以检查溶液的澄清程度,是利用药物与杂质在特定溶剂中溶解性能的差异而设定的检测项目,主要用于原料药与注射剂的质量控制。
包括第一法(目测法)和第二法(浊度仪法),除另有规定外,应采用第一法进行检查。
目测法原理浊度是一种光学效应,是光线与溶液中的悬浮颗粒相互作用的结果,它表征光线透过水层时受到障碍的程度。
是光线在水溶液中的透射或散射一种水质的物理参数。
2015版药典收载两种方法:目视法,浊度仪法(散射光式)方法详解1)第一法目视法是在室温条件下,将供试品溶液与等量的浊度标准液分别置于配对的比浊用玻璃管中,在暗室内垂直同置于伞棚灯下,照度为1000Ix,从水平方向观察、比较。
2)浊度标准贮备液的制备:105℃干燥至恒重的硫酸肼和乌洛托品按照药典进行配制,有效期为2个月。
3)浊度原液应及时在550nm波长处进行吸光度的测定,应在0.12~0.15范围内,有效期为48小时。
采用浊度标准原液及水按照药典制备0.5、1、2、3、和4号浊度标准液4)目视法检查照度为1000Ix,过高或过低均会造成干扰。
方法特点及适用性1)目视法由于操作简便快捷可作为首选方法,同时该方法可以进行有色供试品溶液的浊度判断。
2)对于无色供试品溶液,目视法无法准确判断其浊度是否符合标准规定时,或多人观测存在差异时,应采用第二法。
3)第二法仅适用于无色供试品溶液的浊度测定。
操作要点及注意事项1.除另有规定外,按各品种项下规定的浓度要求,在室温条件下用水或适宜的溶剂配制一定浓度的供试品溶液,一般采用振摇方式处理,确保供试品溶解完全。
同时平行配制相应的浊度标准液,供试品溶解后应立即检视。
2.目视法检查时,玻璃管应无磨损,应加强对伞棚灯照度的控制。
澄清度检查法

澄清度检查法■澄清度检查法系将药品溶液与规定的浊度标准液相比较,用以检查溶液的澄清程度。
■【增订】品种项下规定的“澄清”,系指供试品溶液的澄清度与所用溶剂相同,或不超过0.5号浊度标准液的浊度。
“几乎澄清”,系指供试品溶液的浊度介于0.5号至1号浊度标准液的浊度之间。
第一法(目视法)■除另有规定外,按各品种项下规定的浓度要求外,在室温条件下将用水稀释至一定浓度的供试品溶液与等量的浊度标准液分别置于配对的比浊用玻璃管(内径15~16mm,平底,具塞,以无色、透明、中性硬质玻璃制成)中,在浊度标准液制备5分钟后,在暗室内垂直同置于伞棚灯下,照度为1000lx,从水平方向观察、比较。
除另有规定外,供试品溶液溶解后应立即检视。
第一法无法准确判定二者的澄清度差异时,改用第二法进行测定并以其测定结果进行判定。
■【修订】照度标准贮备液的制备称取105℃干燥至恒重的硫酸肼1.00g,置100ml量瓶中,加水适量使溶解,必要时可在40℃的水浴中温热使溶解,并用水稀释至刻度,摇匀,放置4~6小时;取此溶液与等容量的10%乌洛托品溶液混合,摇匀,于25℃避光静置24小时,即得。
该溶液置冷处避光保存,可在2个月内使用,用前摇匀。
浊度标准原液的制备取浊度标准贮备液15.0ml,置1000ml量瓶中,加水稀释至刻度,摇匀,取适量,置1cm吸收池中,照紫外-可见分光度法(附录ⅣA),在550nm 的波长处测定,其吸光度应在0.12~0.15范围内。
该溶液应在48小时内使用,用前摇匀。
浊度标准液的制备取浊度标准原液与水,按下表配制,即得。
浊度标准液■第二法(仪器法)供试品溶液的浊度可采用仪器法测定。
、溶液中不同大小、不同特性的微粒物质包括有色物质均可使入射光产生透射和散射,通过测定透射光或散射光的强度,可以检查供试品溶液的浊度。
仪器测定模式通常有三种类型,透射光式、散射光式和透射光-散射光比较测量模式(比率浊度模式)。
1.仪器的一般要求采用适宜的散射光浊度仪,光源峰值波长约为860nm左右;测量范围应包含0.01~100NTU。
欧洲药典溶液颜色和澄清度通则

欧洲药典溶液颜色和澄清度通则1. 引言欧洲药典作为一个权威的药品标准,对药品的质量控制提供了指导。
其中,溶液的颜色和澄清度是评估溶液质量的重要指标之一。
本文将详细介绍欧洲药典对溶液颜色和澄清度的通则。
2. 溶液颜色的评估2.1 定义溶液颜色是指溶液在可见光范围内表现出来的颜色。
根据欧洲药典对于不同类型溶液颜色的要求,可以将其分为无色、淡黄、淡绿等多个等级。
2.2 测定方法根据欧洲药典规定,测定溶液颜色应使用比较法。
具体步骤如下: 1. 准备样品:按照规定配制好待测的溶液。
2. 准备参比样品:选择已知颜色等级的参比样品。
3. 对比观察:将待测样品与参比样品同时置于白底下观察,并进行比较。
4. 判断等级:根据与参比样品的颜色差异,判断待测溶液的颜色等级。
2.3 结果表达根据测定结果,将溶液的颜色等级用标准术语进行描述。
例如,无色溶液可以描述为”colorless”,淡黄色溶液可以描述为”pale yellow”。
3. 溶液澄清度的评估3.1 定义溶液澄清度是指溶液中无悬浮物或沉淀物的程度。
根据欧洲药典对于不同类型溶液澄清度的要求,可以将其分为清澈、微浑浊、浑浊等多个等级。
3.2 测定方法根据欧洲药典规定,测定溶液澄清度应使用目视法或仪器法。
具体步骤如下: 1. 目视法:将待测样品置于透明容器中,在自然光下观察,并与白底对比。
2. 仪器法:使用专用仪器(如透射分析仪)对待测样品进行测试,并记录测试结果。
3.3 结果表达根据测定结果,将溶液的澄清度等级用标准术语进行描述。
例如,清澈溶液可以描述为”clear”,微浑浊溶液可以描述为”slightly turbid”。
4. 溶液颜色和澄清度的控制4.1 原因分析溶液颜色和澄清度受多种因素影响,包括药品成分、生产工艺以及储存条件等。
针对不同的药品类型和应用要求,需要针对性地控制这些因素。
4.2 控制方法根据欧洲药典的要求,可以采取以下控制方法来保证溶液的颜色和澄清度: 1. 选择合适的原料:选择纯净、无杂质的原料,并避免使用容易导致颜色变化或悬浮物产生的原料。
2020版《中国药典》溶液澄清度与颜色检验操作规程
一、目的:制订详尽的工作程序,规范检验操作,保证检验数据的准确性。
二、范围:本标准适用于样品溶液澄清度与颜色的检查。
三、职责:1、检验员:严格按操作规程操作,认真、及时、准确地填写检验记录;2、化验室负责人:监督检查检验员执行本操作规程。
四、内容:1、溶液颜色检查法:1.1定义:本法系将药物溶液的颜色与规定的标准比色液比较,或在规定的波长处测定其吸光度。
品种项下规定的“无色”系指供试品的颜色相同于水或所用溶剂,“几乎无色”系指供试品溶液的颜色不深于相应色调0.5号标准比色液。
1.2仪器:纳氏比色管(25ml),全自动色差计1.3第一法除另有规定外,取各品种项下规定量的供试品,加水溶解,置于25ml的纳氏比色管中,加水稀释至10ml。
另取规定色调和色号的标准比色液10ml,置于另一25ml纳氏比色管中,两管同置白色背景上,自上向下透视;或同置白色背景前,平视观察,供试品管呈现的颜色与对照管比较,不得更深。
如供试品管呈现的颜色与对照管的颜色深浅非常接近或色调不完全一致,使目视观察无法辨别两者的深浅时,应改用第三法(色差计法)测定,并将其测定结果作为判定依据。
1.3.1比色用重铬酸钾溶液:精密称取在120℃干燥至恒重的基准重铬酸钾0.4000g,置500ml量瓶中,加适量水溶解并稀释至刻度,摇匀,即得。
每lml溶液含0.800mg的K2Cr207。
1.3.2比色用硫酸铜溶液:取硫酸铜约32.5g,加适量的盐酸溶液(1→40)使溶解成500ml;精密量取10ml,置碘量瓶中,加水50ml、醋酸4ml与碘化钾2g,用硫代硫酸钠滴定液(0.1mol/L)滴定,至近终点时,加淀粉指示液2ml,继续滴定至蓝色消失。
每lml硫代硫酸钠滴定液(0.1mol/L)相当于24.97mg的CuS04·5H20。
根据上述测定结果,在剩余的原溶液中加适量的盐酸溶液(1→40),使每lml溶液中含62.4mg的 CuS04·5H20,即得。
澄清度检查法

澄清度检查法(一)概述澄清度检查法(clarity test)是检查药品溶液的浑浊程度,即浊度。
药品溶液中如存在簇拥的细微颗粒,直射光通过溶液时可引致光散射和光汲取,致使溶液微显浑浊。
因此,澄清度可反映药品溶液中的微量不溶性杂质的存在状况,在一定程度上可反映药品的质量和生产工艺水平,对于供制备注射液用原料药物的纯度检查尤为重要。
(二)浊度标准液《中国药典》规定用浊度标准液作为澄清度检查的标准。
目前,各国药典均采纳福尔马肼标准浊度液。
以等体积的一定浓度的硫酸联氨()溶液与(乌洛托品)溶液混合,在一定浓度下缩合成福尔马肼,形成不溶于水、性质稳定的白色高分子混悬液。
1.原理在适当温度下,(乌洛托品)在偏酸性条件下水解产生,与肼缩合生成不溶于水的甲醛腙白色浑浊。
聚合反应如下: 2.浊度标准液的稳定性经缩聚反应后获得浊度标准贮备液,浊度标准贮备液在25℃下放置24小时,即得。
在冷处避光可保存2个月;经稀释所得的浊度标准原液应在48小时内用法。
3.标准液制备的影响因素 (1)除另有规定外,分析时应用法符合国家标准或药典要求的分析纯级试药、试剂;制备用水应澄清(浊度不超过0.02NTU),以去离子高纯水为宜,须要时可用0.45um孔径滤膜或G5垂熔玻璃漏斗滤过。
(2)浊度标准液混匀时,采纳旋转混匀法,避开振摇产愤怒泡,影响观看。
(3)据实验,光照对混悬液的形成有影响。
在阳光直射下形成的混悬液的浊度较低;在自然光或荧光灯下形成的混悬液,其浊度相近似;而在暗处形成的混悬液,其浊度最高。
(4)温度和时光对混悬液的形成也有影响。
在低温(1℃)反应不能举行,不产生沉淀;温度较高时形成的混悬液,其聚合物状态不稳定,易发生分解使浊度偏低;反应时光如不够充分,聚合反应不彻低也易使浊度偏低。
因此,应按规定严格控制反应温度和时光。
(5)试剂的含水量可挺直影响溶液的浓度。
鉴于南、北方气候的区域化差异较大,建议在湿度较大的地区,宜将试剂先经硅胶干燥剂(经140℃干燥3小时)干燥24小时后用法。
欧洲药典EP10.0溶液澄清度检查规范

欧洲药典EP10.0溶液澄清度检查规范<2.2.1液体的澄清度和乳光度>光被亚微观粒子吸收或散射、或光密度不均匀而产生的效果即为乳光。
当溶液中不存在任何粒子或不均匀性,就会得到清澈的溶液。
在下述条件下检查时,如果受检液体的透明度与水或所用溶剂的透明度相近,或者其乳光不比参考悬浮液I(见表2.2.1.-1)的乳光更明显,则认为该受检液体是透明的。
通过与规定的参考悬浮液I进行比较(见表2.2.1.-1),以目视法检查是否符合专论要求。
然而,一旦仪器的适用性如下所述建立,仪器方法也可用于确定是否符合专论要求,并使用参考悬浮液I-IV 和水或所用溶剂进行校准。
目视法使用相同的无色透明中性玻璃试管,底座平坦,内径为15-25 mm,将待检液体与下述新制备的参考悬浮液进行比较。
确保两个试管中各层的深度相同(约40 mm)。
制备参考悬浮液5分钟后,在漫射日光下比较液体,在黑色背景下垂直观察。
系统适用性。
光的扩散必须确保参考悬浮液I可以很容易地与水区分开,并且参考悬浮液II可以很容易地与参考悬浮液I区分开(见表2.2.1.-1)。
仪器法仪器法评估给透明度和乳光度提供了一种更具辨别力的测试手段,它不依赖于分析人员的视力。
数值结果对于过程控制和质量监控更有用,尤其是在稳定性研究中。
例如,可以从以前关于稳定性的数字数据外推,来确定给定批次的制剂是否会在有效期之前超过保质期限制。
比浊法和浊度法当以与入射光方向成直角的角度观察悬浮液时,由于悬浮液颗粒对光的散射(丁达尔效应),系统呈现乳白色。
进入混浊液体的光束的一部分被透射,另一部分被吸收,其余部分被悬浮颗粒散射。
悬浮颗粒的光散射效应可以通过观察透射光(比浊法)间接测量,也可以通过测量散射光(浊度法)直接测量。
比浊法和浊度法在低浊度范围内更可靠,浊度值和检测器信号之间存在线性关系。
随着浊度的增加,并非所有粒子都暴露在入射光下,其他粒子的散射或透射辐射在到达探测器的过程中会受到阻碍。
欧洲药典澄清度目视法

欧洲药典澄清度目视法欧洲药典(European Pharmacopoeia)是欧洲卫生部门公认的药品质量控制标准。
其中,澄清度(Clarity)是药品测试中重要的一个品质参数,目视法是常用的澄清度测试方法之一。
下面将详细介绍欧洲药典中关于澄清度目视法的相关内容。
1. 澄清度的原理和定义:澄清度是描述药物溶液的透明度及其中不可溶性物质的微粒数量和大小的参数。
药品溶液澄清度良好,可以确保药物在制造、运输和存储过程中的质量稳定性和安全性。
欧洲药典中将澄清度定义为药品溶液透明度的特性,通过目视法进行检测。
2. 目视法的步骤:(1)准备样品:选取规定体积的药品溶液样品,样品要求无色透明。
(2)准备比色皿:用干净的、透明的比色皿作为观察容器。
(3)观察澄清度:将样品倒入比色皿中,放置在白色背景下,通过目视检测样品的透明度。
观察时可以调整观察角度和光线条件以增加检测的准确性。
3. 结果评估:(1)合格:样品透明度良好,无任何浑浊、悬浮颗粒或沉淀。
(2)不合格:样品出现浑浊、悬浮颗粒或沉淀现象,即澄清度不合格。
4. 澄清度的限度要求:欧洲药典制定了不同药物的澄清度限度要求。
例如,对于注射用药品,澄清度要求高,通常要求样品无浑浊、无可见颗粒或微粒;而对于口服药品,澄清度要求相对较低,但仍需要保证样品足够清澈透明。
5. 数据记录和报告:在药品质量控制中,澄清度的目视检测结果需要记录并报告。
需要记录的信息包括样品的标识信息、测试环境的温度和光线条件以及检测人员的签名等。
报告时应标明澄清度的检测方法为目视法,并将检测结果与欧洲药典的澄清度限度要求进行比较。
需要特别指出的是,澄清度的目视检测方法有一定的主观性,检测结果受到个体主观判断和光线条件等因素的影响。
因此,在具体的药品质量控制中,除了目视法外,还需要结合其他仪器和测试方法进行综合评估和确认,以确保澄清度的准确性和可靠性。
综上所述,欧洲药典中关于澄清度的目视法是药品质量控制中重要的测试方法之一。
溶液澄清度与颜色标准

溶液澄清度与颜色标准
在化学实验和工业生产中,溶液的澄清度和颜色是两个重要的质量指标。
澄清度指的是溶液中悬浮物的含量,而颜色则是指溶液的透明度和色泽。
这两个指标直接影响着溶液的质量和适用性,因此对其进行准确的评估和控制是至关重要的。
首先,澄清度是衡量溶液中杂质含量的重要指标。
高澄清度的溶液通常更纯净,适用于各种实验和工业生产中需要高纯度溶液的场合。
澄清度的评估可以通过测定溶液中的浑浊度来进行,常用的方法包括浊度计和浑浊度计等。
在实验室中,科学家们会根据实验的需要,选择不同澄清度的溶液进行实验,以确保实验结果的准确性和可重复性。
其次,颜色是溶液外观的重要指标。
溶液的颜色可以受到溶质的性质、浓度和溶剂的影响。
在工业生产中,颜色的标准通常是根据国际标准色号或者客户需求来确定的。
比如,食品行业对于食品着色剂和食品添加剂的颜色有着严格的标准要求,而药品行业对于药物溶液的颜色也有着明确的规定。
因此,在生产过程中,需要对溶液的颜色进行精确的控制和调整,以满足不同行业的要求。
总之,溶液的澄清度和颜色标准是衡量溶液质量的重要指标,对于化学实验和工业生产都具有重要意义。
通过科学的方法对澄清度和颜色进行准确的评估和控制,可以确保溶液的质量达到要求,从而保证产品的质量和安全性。
阿司匹林中溶液的澄清度检查原理

阿司匹林中溶液的澄清度检查原理下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!阿司匹林中溶液的澄清度检查原理1. 澄清度检查的背景与意义。
药品溶液澄清度检查法

药品溶液澄清度检查法一目的:制定溶液澄清度检查法,规范溶液澄清度的测定的操作。
二适用范围:适用于溶液澄清度的测定。
三责任者:品控部。
四正文1 简述澄清度是检查药品溶液的浑浊程度,即浊度。
药品溶液中如存在细微颗粒,当直射光通过溶液时,可引致光散射和光吸收的现象,致使溶液微显浑浊;所以澄清度可在一定程度上反映药品的质量和生产工艺水平。
澄清度检查法(中国兽药典2005年版一部附录83页)是用规定级号的浊度标准溶液与供试品溶液比较,以判定药品溶液的澄清度或其浑浊程度。
2 仪器与用具2.1 比浊用玻璃管内径15~16mm,平底,具塞,以无色硬质中性玻璃制成,要求供试品管与标准管的内径、标线刻度(距管底为40mm)一致。
2.2 伞棚灯用澄明度检查装置(见注射剂标准操作规程中的澄明度检查法项下),照度为1000lx。
3 试药与试液3.1 硫酸肼和乌洛托品均应符合中国兽药典规定。
3.2 浊度标准贮备液的制备称取于105℃干燥至恒重的硫酸肼1.00g,置100ml量瓶中,加水适量使溶解,必要时可在40℃的水浴中温热溶解,并用水稀释至刻度,摇匀,放置4~6小时;取此溶液与等量的10%乌洛托品溶液混合,摇匀,于25℃避光静置24小时,即得。
本液置冷处避光保存,可在两个月内使用,用前摇匀。
3.3 浊度标准原液的制备取浊度标准贮备液15.0ml,置1000ml量瓶中,加水稀释至刻度,摇匀,取适量,置1cm吸收池中,照分光光度法(《按紫外分光光度法》执行),在550nm的波长处测定,其吸收度应在0.12~0.15范围内。
本液应在48小时内使用,用前摇匀。
3.4 浊度标准液的制备取浊度标准液与原液与水,按下表配制,即得。
本液应临用时制备,使用前充分摇匀。
4 操作方法4.1 除另有规定外,将一定浓度的供试品溶液与该药品项下规定的浊度标准液,分别置于配对的比浊用玻璃管中,液面高度为40mm,在浊度标准液制备5分钟后,同置黑色背景上,在漫射光下从比色管上方向下观察,比较,或置于伞棚灯下,照度为1000lx,从水平方向观察比较,用以检查溶液的澄清度或其浑浊程度。
中国药典和欧洲药典中关于溶液的澄清度和颜色检查的异同比较

中国药典和欧洲药典中关于溶液的澄清度和颜色检查的异同比较发布日20060717期栏目化药药物评价>>化药质量控制中国药典和欧洲药典中关于溶液的澄清度和颜色检查标题的异同比较作者张震部门正文内审评四部审评八室张震容关键词:中国药典,欧洲药典,溶液的澄清度和颜色,异同摘要:本文对中国药典2005年版和欧洲药典第5版中溶液的澄清度和颜色检查进行了异同比较,在以欧洲药典或某些进口标准为依据进行药品研发以及药品审评工作中时应注意其中的差别,不能简单套用。
溶液的澄清度和颜色检查是控制原料药和注射剂质量的重要指标,能在一定程度上反映药物的纯度,中国药典(以下简称CP)和欧洲药典(以下简称EP)中皆纳入了该项检查。
但不同药典中对溶液的澄清度和颜色检查的方法和限度仍有所差别,因而在以EP或某些进口标准为依据进行药品研发以及药品审评工作中时应注意其中的差别,并进行相应的修改,不能简单套用。
下文对CP2005年版和EP第5版中溶液的澄清度和颜色检查的异同进行了比较。
一、溶液的澄清度(CP2005二部附录IX B;EP5方法2.2.1)1、比较系统:CP和EP中皆采用1%硫酸肼溶液-10%乌洛托品溶液(1:1)的混合溶液作为浊度标准原液,皆采用目测法,二者没有区别。
2、浊度级号设置:CP中设置了1~4号浊度标准液,对应于EP 中的I~IV号浊度标准液,相同浊度级号(如:4号或IV号)的配制方法完全相同;不同之处在于CP还设置了0.5号浊度标准液,而EP 中则未设置该浊度级号。
3、“澄清”判定:CP中规定:“供试品溶液的澄清度与所用溶剂相同,或未超过0.5号浊度标准液”,则判为“澄清”;而EP中则规定“供试品溶液的澄清度与所用溶剂相同,或未超过I号浊度标准液”。
CP中的“澄清”的较EP 更为严格,要求我们在进口药的审评中对这点进行关注。
二、溶液的颜色(CP2005二部附录IX A;EP5方法2.2.2)CP中溶液的颜色检查法分为第一法(比色法)、第二法(分光光度法)和第三法(色差计法),其中比色法为较常用的方法,而分光光度法和色差计法较少使用,这里不作重点讲述;而EP中颜色检查法仅有比色法。
溶液颜色与澄清度检查规定

溶液颜色与澄清度检查规定
什么是伞棚灯
伞棚灯系列产品是严格按照中国药典--《澄清度检查法》和《溶液颜色检查法》设计制作完成的,是实验室物性常规检查的专业检测设备。
溶液颜色与澄清度检查规定
伞棚灯的创新点
伞棚灯的诞生,弥补了药典关于澄清度检查标准要求的设备空白;伞棚灯的诞生,弥补了我国药检人员在做澄清度检查和溶液颜色检查时背景光照度不均衡,聚中观察目标,减少杂散背景光色的干扰,提高观察者判别能力,减小检测窗口面积减少了大面积强光对检测人员眼睛的强烈刺激,无需在暗室的环境下操作,克服了现有澄明度仪的不足之处。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
药品溶液澄清度检查法
一目的:制定溶液澄清度检查法,规范溶液澄清度的测定的操作。
二适用范围:适用于溶液澄清度的测定。
三责任者:品控部。
四正文
1 简述
澄清度是检查药品溶液的浑浊程度,即浊度。
药品溶液中如存在细微颗粒,当直射光通过溶液时,可引致光散射和光吸收的现象,致使溶液微显浑浊;所以澄清度可在一定程度上反映药品的质量和生产工艺水平。
澄清度检查法(中国兽药典2005年版一部附录83页)是用规定级号的浊度标准溶液与供试品溶液比较,以判定药品溶液的澄清度或其浑浊程度。
2 仪器与用具
2.1 比浊用玻璃管内径15~16mm,平底,具塞,以无色硬质中性玻璃制成,要求供试品管与标准管的内径、标线刻度(距管底为40mm)一致。
2.2 伞棚灯用澄明度检查装置(见注射剂标准操作规程中的澄明度检查法项下),照度为1000lx。
3 试药与试液
3.1 硫酸肼和乌洛托品均应符合中国兽药典规定。
3.2 浊度标准贮备液的制备称取于105℃干燥至恒重的硫酸肼1.00g,置100ml量瓶中,加水适量使溶解,必要时可在40℃的水浴中温热溶解,并用水稀释至刻度,摇匀,放置4~6小时;取此溶液与等量的10%乌洛托品溶液混合,摇匀,于25℃避光静置24小时,即得。
本液置冷处避光保存,可在两个月内使用,用前摇匀。
3.3 浊度标准原液的制备取浊度标准贮备液15.0ml,置1000ml量瓶中,加水稀释至刻度,摇匀,取适量,置1cm吸收池中,照分光光度法(《按紫外分光光度法》执行),在550nm的波长处测定,其吸收度应在0.12~0.15范围内。
本液应在48小时内使用,用前摇匀。
3.4 浊度标准液的制备取浊度标准液与原液与水,按下表配制,即得。
本液应临用时制备,使用前充分摇匀。
4 操作方法
4.1 除另有规定外,将一定浓度的供试品溶液与该药品项下规定的浊度标准液,分别置于配对的比浊用玻璃管中,液面高度为40mm,在浊度标准液制备5分钟后,同置黑色背景上,在漫射光下从比色管上方向下观察,比较,或置于伞棚灯下,照度为1000lx,从水平方向观察比较,用以检查溶液的澄清度或其浑浊程度。
4.2 在进行比较时,如供试品溶液管的浊度接近标准管时,应将标准管交换位置,再行观察。
5 注意事项
5.1 制备澄清度检查用的浊度标准贮备液、原液和标准液,均应用澄清的水(可用0.45µm孔径滤膜或G5 熔玻璃漏斗滤过而得)
5.2 反应温度应保持在25±1℃。
5.3 用于配制供试品溶液的水,均应用注射用水或新沸放冷的澄清水。
5.4 供试品溶液配制后,应在5分钟内进行检视。
6 计算与记录
应记录供试品溶液制备方法、浊度标准液0.5级号的,即为澄清;如浅于或等于规定的景度标准液级号的,判为符合规定;如浓于规定浊度标准液级号的,则判为不符合规定。
