元素周期表2_碱金属共17页
素周期表和碱金属元素

从19世纪初道尔顿提出原子论开 始,经过众多科学家的努力,如 门捷列夫、莫斯莱等,元素周期 表逐渐完善和发展。
周期表结构与特点
结构
元素周期表由横行(周期)和纵行( 族)组成。横行按照电子层数递增的 顺序排列,纵行则按照最外层电子数 相同的元素进行归类。
特点
元素周期表具有周期性、重复性和预 测性。它揭示了元素性质随原子序数 的增加而呈现周期性变化,为化学研 究提供了重要依据。
05
碱金属元素重要化合 物及其应用
氧化物和氢氧化物
氧化物
碱金属元素与氧元素结合形成的氧化物,如锂氧化物(Li2O)、钠氧化物(Na2O)、钾氧化物(K2O) 等。这些氧化物具有较高的碱性,可以与酸反应生成盐和水。
氢氧化物
碱金属元素与氢氧根离子结合形成的氢氧化物,如氢氧化锂(LiOH)、氢氧化钠(NaOH)、氢氧化钾 (KOH)等。这些氢氧化物具有强碱性,可以中和酸性物质,广泛应用于化学工业、制药、冶金等领域。
THANKS
感谢观看
03
碱金属元素在周期表 中位置及特点
碱金属在周期表中位置
碱金属位于元素周期表的第ⅠA族, 包括锂(Li)、钠(Na)、钾(K)、 铷(Rb)、铯(Cs)和钫(Fr)六种 元素。
它们都是典型的金属元素,具有较低 的电离能和较大的原子半径。
碱金属原子半径变化规律
随着原子序数的增加,碱金属元素的原子半径逐渐增大。
未来发展趋势预测
随着科学技术的不断发展,人类对碱金属元素的认识将不 断深入,未来可能会发现更多具有特殊性质的碱金属元素 或碱金属化合物。
碱金属元素在能源、材料等领域具有广泛的应用前景。例 如,锂离子电池等新型电池的发展将推动碱金属元素的应 用不断拓展。
元素周期表-第二课时-碱金属

△
2NaHCO3 == Na2CO3 + H2O + CO2↑
△
2KHCO3 == K2CO3 + H2O + CO2↑
2Na2O2 + 2CO2 = 2Na2CO3 + O2
2K2O2 + 2CO2 = 2K2CO3 + O2
(3)与 盐溶液反应
碱金属与盐的水溶液反应时,首先是碱金 属与水反应生成碱ห้องสมุดไป่ตู้氢气,生成的碱可能再与 盐反应。
Rb 银白色,柔软 1.532
Cs 略带金属光泽, 1.879 柔软
熔点 /0C 180.5 97.81 63.65 38.89 28.40
沸点 /0C 1347 882.9 774 688 678.4
Li Na K Rb Cs
相
颜色
均为银白色(Cs略带金色)
硬度 似
柔软
密度
较小
点 熔沸点
较低
导电导热性
周期表中有112种元素已被发 现,如果将来发现114号元素他将 位于哪里????
答:114-2-8-8-18-18-32=28 由于第七周期有32种元素,因此他在第IVA族。
1、碱金属元素原子结构特点 填写下表
元素 元素 核电 名称 符号 荷数
原子结构 示意图
最外层 电子 原子半 电子数 层数 径/nm
相似性
递变性
除铯外都为银白色金属, 密度依次增大,熔沸点依 质软,熔沸点低,密度小 次降低
都易和氧气反应
和氧气反应生成物越来越 复杂
都和水反应生成碱(强碱)按照锂、钠、钾、铷、铯
特别注意:碱金属单质都不能从盐溶液中置换 出较不活泼金属。
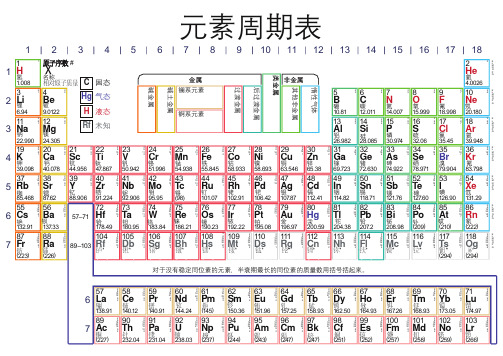
元素周期表

元素周期表元素周期表主族元素类金属▪硼 ( 5 ) ▪硅 ( 14 ) ▪锗 ( 32 ) ▪砷 ( 33 ) ▪锑 ( 51 )▪碲 ( 52 ) ▪钋 ( 84 )金属元素碱金属▪锂 ( 3 ) ▪钠 ( 11 ) ▪钾 ( 19 ) ▪铷 ( 37 ) ▪铯 ( 55 )▪钫 ( 87 )碱土金属▪铍 ( 4 ) ▪镁 ( 12 ) ▪钙 ( 20 ) ▪锶 ( 38 ) ▪钡 ( 56 )▪镭 ( 88 )其他金属▪铝 ( 13 ) ▪铟 ( 49 ) ▪镓 ( 31 ) ▪锡 ( 50 ) ▪铊 ( 81 )▪铅 ( 82 ) ▪铋 ( 83 )▪ Uut( 113 )▪ Uuq( 114 )▪ Uup( 115 )▪ Uuh( 116 )▪ Uus( 117 )非金属元素稀有气体▪氦 ( 2 ) ▪氖 ( 10 ) ▪氩 ( 18 ) ▪氪 ( 36 ) ▪氙 ( 54 )▪氡 ( 86 )▪ Uuo( 118 )卤族元素▪氟 ( 9 ) ▪氯 ( 17 ) ▪溴 ( 35 ) ▪碘 ( 53 ) ▪砹 ( 85 )其他元素▪氢 ( 1 ) ▪碳 ( 6 ) ▪氮 ( 7 ) ▪氧 ( 8 ) ▪磷 ( 15 )▪硫 ( 16 ) ▪硒 ( 34 )副族元素金属元素镧系▪镧 ( 57 ) ▪铈 ( 58 ) ▪镨 ( 59 ) ▪钕 ( 60 ) ▪钷 ( 61 )▪钐 ( 62 ) ▪铕 ( 63 ) ▪钆 ( 64 ) ▪铽 ( 65 ) ▪镝 ( 66 )▪钬 ( 67 ) ▪铒 ( 68 ) ▪铥 ( 69 ) ▪镱 ( 70 ) ▪镥 ( 71 )锕系▪锕 ( 89 ) ▪钍 ( 90 ) ▪镤 ( 91 ) ▪铀 ( 92 ) ▪镎 ( 93 ) ▪钚 ( 94 ) ▪镅 ( 95 ) ▪锔 ( 96 ) ▪锫 ( 97 ) ▪锎 ( 98 ) ▪锿 ( 99 ) ▪镄 ( 100 ) ▪钔 ( 101 ) ▪锘 ( 102 ) ▪铹 ( 103 )过渡金属▪钪 ( 21 ) ▪钛 ( 22 ) ▪钒 ( 23 ) ▪铬 ( 24 ) ▪锰 ( 25 ) ▪铁 ( 26 ) ▪钴 ( 27 ) ▪镍 ( 28 ) ▪铜 ( 29 ) ▪锌 ( 30 ) ▪钇 ( 39 ) ▪锆 ( 40 ) ▪铌 ( 41 ) ▪钼 ( 42 ) ▪锝 ( 43 ) ▪钌 ( 44 ) ▪铑 ( 45 ) ▪钯 ( 46 ) ▪银 ( 47 ) ▪镉 ( 48 ) ▪铪 ( 72 ) ▪钽 ( 73 ) ▪钨 ( 74 ) ▪铼 ( 75 ) ▪锇 ( 76 ) ▪铱 ( 77 ) ▪铂 ( 78 ) ▪金 ( 79 ) ▪钅卢( 104 )▪钅杜( 105 )▪钅喜( 106 )▪钅波( 107 )▪钅黑( 108 )▪钅麦( 109 )▪鐽 ( 110 ) ▪錀 ( 111 ) ▪鎶 ( 112 ) ▪汞 ( 80 )目录发展史概述发明者生平简介大学期间的探索攀登科学高峰正式发现元素周期表119号元素元素周期表简介IUPAC元素系统命名法元素的位置碱金属性质发展史概述发明者生平简介大学期间的探索攀登科学高峰正式发现元素周期表119号元素元素周期表简介IUPAC元素系统命名法元素的位置碱金属性质展开编辑本段发展史◆诞生:1869年,俄国化学家门捷列夫编制出第一张元素周期表◆依据:按照相对原子质量由小到大排列,将化学性质相似的元素放在同一纵行◆意义:揭示了化学元素之间的内在联系,成为化学发展史上的重要里程碑之一◆发展:随着科学的发展,元素周期表中未知元素留下的空位先后被填满。
元素周期表和碱金属元素

预测新元素的性质
根据元素周期表的规律,科学家可以预测尚未发现的新元素的性 质。
指导化学反应
通过元素周期表,可以预测不同元素之间的化学反应可能性,从 而指导化学实验。
材料科学
元素周期表在材料科学中有着广泛的应用,例如合金、催化剂等 的制备和优化。
02
碱金属元素的性质
碱金属元素的定义与特性
定义
碱金属元素是指在元素周期表中第一 族的金属元素,包括锂(Li)、钠 (Na)、钾(K)、铷(Rb)、铯 (Cs)和钫(Fr)。
用于制造锂电池,为便携式电 子设备提供能源。
铯
用于制造真空管、光电管等电 子器件,也用于某些特殊化学 反应的研究。
碱金属元素在工业生产中的应用
钠
钾
锂
铷
铯
用于生产氢氧化钠、氯 酸钠等化合物,这些化 合物在工业上有广泛的 应用,如处理废水、制 高农作物产 量;也用于制造其他钾 盐,如碳酸钾、硝酸钾 等,这些化合物在化工 、制药等领域有广泛应 用。
拓展应用领域
积极探索碱金属元素在新能源、 新材料、生物医学等领域的应用 潜力,推动相关产业的发展。
绿色可持续发展
发展环保、低碳的碱金属元素 生产和应用技术,减少对环境 的负面影响。
加强国际合作与交流
加强国际间的合作与交流,共 同推进碱金属元素的研究与应
用发展。
THANKS
感谢观看
04
碱金属元素的未来发展与挑战
碱金属元素的研究现状与进展
基础理论研究
通过实验和计算手段深入探究碱金属 元素的电子结构和性质,为新材料的 开发和应用提供理论支持。
化合物合成与性质研究
研究碱金属元素与其他元素的化合物 合成及其物理和化学性质,发掘潜在 的应用价值。
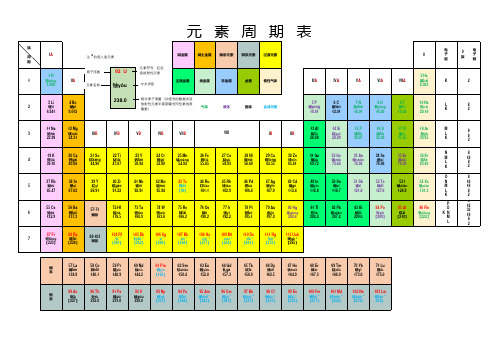
元素周期表(高清PDF版)
23 2
8 10
V 2 钒
24 2
8 11
2 Cr 铬
25 2
8 13
1 Mn 锰
26 2
8 13
2 Fe 铁
27 2
8 14
2 Co 钴
28 2
8 15
2 Ni 镍
29 2
8 16
30 2
8 18
31 2
8 18
32 2
8 18
33 2
8 18
34 2
8 18
35 2
8 18
36 2
8 18
2K 8L 18 M
Xe 18 7
氙
2K 8L 18 M 18 N 8O
P Q
101.07 102.91 106.42 107.87 112.41 114.82 118.71 121.76 127.60 126.90 131.29
55
56 2
8 18
2 8 18
72
73 2
8 18
74 2
8 18
75 2
8 18
76 2
2 Cu 1 Zn
2 Ga 3 Ge 4 As 5 Se
6 Br
7 Kr
8N O P
铜
锌
镓
锗
砷
硒
溴
氪
Q
39.098 40.078 44.956 47.867 50.942 51.996 54.938 55.845 58.933 58.693 63.546 65.38 69.723 72.630 74.922 78.971 79.904 83.798
37
38 2
8 18
5 Rb
《 元素周期表》课件

Cs 略带金属光泽, 1.879 柔软
熔点 /0C 180.5 97.81 63.65 38.89 28.40
沸点 /0C 1347 882.9 774 688 678.4
碱金属元素的性质与结构
相似性
递变性
名称
最外 层电 子数
物理 性质
化学 性质
电子 层数
密度Biblioteka 熔点沸点元素 性质
锂Li 钠Na
钾K 1
大段--入破时,只见吹笛人呼吸盘旋回转,指法粉碎如雨敲窗。再听笛声犹如千军万马撕杀奔吼,又如雨打沙滩辟 罗有声。游徒崾??馕豢腿死氪??ィ?哟瞬恢?侣洹?p>还有一次,李谟因故请假去越州。到了越州后,当地的达官名
素,推测砹或砹的化合物最不可能具有 士或设公宴、或设私宴请他,为的是能亲耳聆听到他吹奏的笛声。当时,正逢越州新有十几位生员考中了进士。这
A、砹化氢HAt很稳定 酒宴开始后,只见湖水澄碧、波光荡漾,芳草修林,景物非凡。李谟以手拂笛,立于船边。在桨声中,舟船渐
移湖心。此时轻云笼湖,微风拂浪,波澜陡起。李谟捧笛吹奏,笛声初发,风云齐开,水明林秀,上下澄碧,仿佛 如有鬼神之工使之如此!船上的宾客都赞叹不已,纷纷说:“就是敬天的神乐也没有这么大的神力啊!”独孤丈一言未 发。与会的人都脸现不快。李谟也认为这个老丈轻视自己,也怨愤不语。过了好一会儿,才又静思一曲吹奏出来。
铷Rb 铯Cs
单质
软 具有
白 轻
强还 逐
原性, 与大
渐
低
多数 非金
导 属、
增 多
水反
应
呈逐
增 大 趋
渐 降
势低
逐 渐 降 低
金 属 性 逐 渐 增 强
碱金属的原子结构示意图
元素周期表
K
2
L
8
K
2
11 Na
12 Mg
3
钠nà
镁měi
IIIB
IVB
VB
VIB
VIIB
VIII
22.99
24.31
13 Al
14 Si
15 P
16 S
17 Cl
18 Ar
M
IB
IIB
铝lǚ
硅guī
磷lín
硫liú
氯lǜ
氩yà
L
8 8
26.9828.09Biblioteka 30.9732.06
35.45
39.95
K
2
4
19 K 钾jiǎ 39.10
91.22
92.91
95.94
【98】
101.1
102.9
106.4
107.9
112.4
114.8
118.7
121.8
127.6
126.9
131.3
L
8
K
2
P
8
6
55 Cs 铯sè 132.9
56 Ba 钡bèi 137.3
57-71 镧系
72 Hf 铪hā 178.5
73 Ta 钽tǎn 180.9
107 Bh ������bō * 【264】
108 Hs ������hēi * 【277】
109 Mt ������mài * 【268】
110 Ds ������dá * 【281】
111 Rg ������lún * 【272】
112 Uub 鎶gē * 【285】
镧 系
57 La 镧lán 138.9
元素周期表-碱金属和卤素

碱金属和卤素对未来科技发展的影响
碱金属和卤素在许多领域中都有着广泛的应用,例如电子 、通讯、医疗等。随着科技的不断发展,这些元素将在更 多领域中发挥重要作用。
碱金属和卤素对未来科技发展的影响将越来越大,例如在 人工智能、量子计算等领域中,这些元素将发挥关键作用 。同时,随着新材料的不断涌现,碱金属和卤素在新材料 领域中的应用也将更加广泛。
THANKS FOR WATCHING
感谢您的观看
卤素元素具有强烈的氧化性和 化学反应活性,是化学反应的 重要参与者。
卤素元素在周期表中的位置
01
卤素元素在周期表中位于第17族 ,属于第2周期和第3周期的元素 。
02
卤素元素在周期表中的位置反映 了它们的电子结构和化学性质。
卤素元素的物理和化学性质
卤素元素具有较低的熔点和沸点,以 及较高的蒸气压。
卤素能够与金属发生置换反应, 生成相应的卤化物。
与非金属的反应
卤素能够与非金属发生取代反应, 如氯气与甲烷反应生成一氯甲烷和 氯化氢。
与水的反应
卤素与水反应会生成相应的氢卤酸 和次卤酸。
04 碱金属和卤素的应用
碱金属在工业中的应用
钠
用于制造氢氧化钠、氢气和钠的 化合物,如食盐、苏打等。
钾
用于制造钾肥、氢氧化钾、氢气 和钾的化合物,如硝酸钾等。
锂
用于制造锂电池、合金、氢气和 锂的化合物,如氢化锂等。
卤素在工业中的应用
氟
用于制造氟化物、氟代烃、 氟利昂等,还用作玻璃蚀刻 剂和某些反应的催化剂。
氯
元素周期表
越来越困难
稳定性↓ 还原性↓
三、位、构、性的关系
质子数Z 电子层数 最外层电子数
电子层数
=周期序数
决
定
最外层电子数
=主族序数
原子结构
元素性质由最
外层电子数和
决 电子层数共同
反
反
定
决定。主要由 原子最外层电
映
映 子数决定。
周期表中位置
相似性,递变性
元素性质
推断
7个周期 16个族
同一周期 同一主族
1 H →He 2
1
2 Li→Ne 8
2
3 Na→Ar 8
3
4 K →Kr 18
4
5 Rb→Xe 18
5
6 Cs→Rn 32
6
7 Fr→… 26
7
(2)族:
①概念:元素周期表共有18列。周期表中的第8、
9、10三个纵列是一个族,叫做第Ⅷ族,其余15
个纵列,每个纵列成为一族。共16个族。 ②族的分类及表示:七主七副一零族一Ⅷ族
M L k
8 8 2
4 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36
5 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54
57
6 55 56 - 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86
4、下表是元素周期表的一部分,针对所给的10种元素, 完成下列各小题。
主族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0 周期
2
①② ③
化学元素周期表

化学元素周期表百科名片化学元素周期表是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首创的,他将当时已知的63种元素依原子量大小并以表的形式排列,把有相似化学性质的元素放在同一行,就是元素周期表的雏形。
在周期表中,元素是以元素的原子序排列,最小的排行最先。
表中一横行称为一个周期,一列称为一个族。
现代化学的元素周期律是1869年的德米特里·伊万诺维奇·门捷列夫首创的。
19 13年英国科学家莫色勒利用阴极射线撞击金属产生X射线,发现原子序越大,X射线的频率就越高,因此他认为核的正电荷决定了元素的化学性质,并把元素依照核内正电荷(即质子数或原子序数)排列,经过多年修订后才成为当代的周期表。
常见的元素周期表为长式元素周期表。
在长式元素周期表中,元素是以元素的原子序排列,最小的排行最先。
表中一横行称为一个周期,一列称为一个族,最后有两个系。
除长式元素周期表外,常见的还有短式元素周期表,螺旋元素周期表,三角元素周期表等。
道尔顿提出科学原子论后,随着各种元素的相对原子质量的数据日益完善和原子价(化合价)概念的提出,就使元素相对原子质量与性质(包括化合价)之间的联系显露出来。
德国化学家德贝莱纳就提出了“三元素组”观点。
他把当时已知的54种元素中的15种,分成5组,每组的三种元素性质相似,而且中间元素的相对原子质量等于较轻和较重的两个元素相对原子质量之和的一半。
例如钙、锶、钡,性质相似,锶的相对原子质量大约是钙和钡的相对原子质量之和的一半。
法国矿物学家尚古多提出了一个“螺旋图”的分类方法。
他将已知的62种元素按相对原子质量的大小顺序,标记在绕着圆柱体上升的螺旋线上,这样某些性质相近的元素恰好出现在同一母线上。
这种排列方法很有趣,但要达到井然有序的程度还有困难。
另外尚古多的文字也比较暧昧,不易理解,虽然是煞费苦心的大作,但长期未能让人理解。
英国化学家纽兰兹把当时已知的元素按相对原子质量大小的顺序进行排列,发现无论从哪一个元素算起,每到第八个元素就和第一一个元素的性质相近。
碱金属

碱金属碱金属(jiǎn jīn shǔ)是元素周期表中第IA族元素锂﹑钠﹑钾﹑铷﹑铯﹑钫六种金属元素的统称,也是它们对应单质的统称。
(钫因为是放射性元素所以通常不予考虑)因它们的氢氧化物都易溶于水(除LiOH溶解度稍小外),且呈强碱性,故此命名为碱金属。
氢虽然是第IA 族元素,但它在普通状况下是双原子气体,不会呈金属状态。
只有在极端情况下(1.4兆大压力),电子可在不同氢原子之间流动,变成金属氢。
碱金属盐类溶解性的最大特点是易溶性,它们的盐类大都易溶于水。
已知LiF,Li2CO3,Li3PO4及固体Li2SiO3是难溶(微溶)的,少数大的阴离子的碱金属盐也是难溶的,如Na2C2H5N4O3(脲酸钠)、Na[Sb(OH)6](六羟基合锑酸钠)、K2PtCl6(氯铂酸钾)、KClO4(高氯酸钾)、KHC4H4O6(酒石酸氢钾)等。
它们在溶液中完全电离。
碱金属都是银白色的,比较软的金属,密度比较小,熔点和沸点都比较低。
他们生成化合物时都是正一价阳离子,碱金属原子失去电子变为离子时最外层一般是8个电子,但锂离子最外层只有2个电子。
在古代埃及把天然的碳酸钠叫做neter或nitrum,在洗涤时使用。
14世纪时,阿拉伯人称植物的灰烬为kali,逐渐演变到叫做碱,但这时钠和钾的区别还不清楚,统称为苏打(soda)。
一直到18世纪才分清从食盐得到的泡碱和从植物灰得到的钾碱不是同一种东西。
碱金属都能和水发生激烈的反应,生成强碱性的氢氧化物,随原子量增大反应能力越强。
在氢气中,碱金属都生成白色粉末状的氢化物。
碱金属都可在氯气中燃烧,而碱金属中只有锂能在常温下与氮气反应。
由于碱金属化学性质都很活泼,为了防止与空气中的水发生反应,一般将他们放在煤油或石蜡中保存。
碱金属都是活泼金属。
碱金属单质以金属键相结合。
因原子体积较大,只有一个电子参加成键,所以在固体中原子间相互作用较弱。
碱金属的熔点和沸点都较低,硬度较小(如钠和钾可用小刀切割)。
金属元素周期表

金属元素周期表金属元素周期表:金属顺序表为:k钾、Ca钙、Na钠、Mg镁、Al铝、Zn锌、Fe铁、Sn锡、pb铅、H氢、Cu铜、Hg汞、Ag银、pt铂、Au金,这是最常用的金属,需要背的,位于H氢前的金属是较活泼的金属,能和盐酸硫酸反应,氢后面的是不活泼金属。
化学元素周期表是根据原子序数从小至大排序的化学元素列表。
列表大体呈长方形,某些元素周期中留有空格,使特性相近的元素归在同一族中,如碱金属元素、碱土金属、卤族元素、稀有气体等。
金属元素位于元素周期表中,每一周期的第一个位置,也就是第一列。
扩展资料:金属活动性顺序表是指在通常状况下金属之间的由强到弱顺序。
而元素周期表是按元素原子的核电荷数的递增顺序,把电子层数相同的放在一横行(周期)里,把价电子数相同的放在一个纵行(族)里,得到的一个表叫元素周期表。
联系:在元素周期表中,同一周期里核电荷数的递增,金属性逐渐减弱;在同一族里,核电荷数的递增,金属性逐渐增强。
元素周期表背诵口诀技巧是什么?元素周期表背诵口诀:1.一价氢氯钾钠银,二价氧钙钡镁锌,三铝四硅五价磷,二三铁、二四碳,一至五价都有氮,铜汞二价最常见。
2.根据元素周期表的结构来记忆。
三短三长一未完,十八纵行十六族,七主族、七副族,还有一个零族和八族。
意思是周期表里一共有七个周期,其中三个长三个短,一个不完全的周期有十八个纵行,是十六族,其中七个主族,七个副族,一个零族和一个八族。
3.正一铜氢钾钠银,正二铜镁钙钡锌。
三铝四硅四六硫,二四五氮三五磷。
一五七氯二三铁,二四六七锰为正。
碳有正四与正二,再把负价牢记心。
负一溴碘与氟氯,负二氧硫三氮磷。
可以根据自己能够理解的方式来选择背诵。
口诀记忆法第一周期:氢氦――→侵害。
第二周期:锂铍硼碳氮氧氟氖――→鲤皮捧碳,蛋养福奶。
第三周期:钠镁铝硅磷硫氯氩――→那美女桂林留绿牙(有点恐怖)。
第四周期:钾钙钪钛钒铬锰――→嫁改康太反ge命铁钴镍铜锌镓锗――→铁姑捏痛新嫁者砷硒溴氪――→生气休克第五周期:铷锶钇锆铌――→如此一告你钼锝钌――→不得了铑钯银镉铟锡锑――→老把银哥印西堤碲碘氙――→滴点咸第六周期:铯钡镧铪――→彩色贝壳蓝色河钽钨铼锇――→但见乌鸦引来鹅铱铂金汞砣铅――→一白巾供它牵铋钋砹氡――→必不爱冬天第七周期:钫镭锕――→防雷啊!其中黑体是记忆的谐音,其余为记忆辅助用字。
元素周期表中的碱金属与碱土金属 (2)

安全防护措施
穿戴防护服和手 套,避免皮肤直 接接触碱金属和 碱土金属。
在专业人员的指导 下合理选用碱金属 和碱土金属,避免 摄入或吸入有害物 质。
保持工作场所通 风良好,避免长 时间在密闭空间 内操作。
定期进行体检, 及时发现和处理 健康问题。
感谢您的观看
汇报人:
了解碱金属和碱 土金属的盐类化 合物,有助于更 好地利用这些资 源,推动科学技 术的发展。
05
碱金属与碱土金属的用 途
在工业中的应用
碱金属:用于 制造电池、合 金和化工原料
等
碱土金属:用 于制造陶瓷、 玻璃、电子器
件等
碱金属和碱土 金属在工业中 具有广泛的应 用,是现代工 业发展的重要
支撑
碱金属和碱土 金属的化合物 在农业、医药 等领域也有着
06
碱金属与碱土金属的提 取与制备方法
提取方法
电解法:利用电解熔融的碱金属盐或碱土金属盐来提取碱金属或碱土金属 热还原法:利用还原剂在高温下还原碱金属或碱土金属的氧化物来提取 溶剂萃取法:利用有机溶剂从碱金属或碱土金属的盐溶液中萃取金属离子 离子交换法:利用离子交换剂将碱金属或碱土金属离子从溶液中交换出来
07
碱金属与碱土金属的毒 性与安全性
毒性及危害性
碱金属的毒性主要来自其与水的反应,生成氢氧化物和氢气,可能导致呼吸困难、窒 息等症状。
碱土金属的毒性较低,但其化合物如氧化物、氢氧化物等具有腐蚀性和刺激性,可能 对皮肤和呼吸道造成伤害。
碱金属和碱土金属的中毒症状可能包括恶心、呕吐、腹泻、呼吸困难等,严重时可能 导致死亡。
制备方法
电解法:利用电解熔融的碱金属或碱土金属盐,生成相应的金属和氯气
化学元素周期表

烯烃
不饱和烃
烯烃是一种不饱和烃,其分子中至少有一个碳碳 双键。
命名
烯烃的命名通常以“烯”为词根,根据其分子中 碳原子的数目来命名,如乙烯、丙烯、丁烯等。
性质
烯烃通常是无色、有刺激性气味、易燃的液体或 气体,具有不溶于水但可溶于有机溶剂的特性。
炔烃
01
不饱和烃
炔烃是一种不饱和烃,其分子中至少 有一个碳碳三键。
性质
碘元素是周期表中紫黑色固体,具有弱氧化性和腐蚀性,可与大多数金属形成碘化物。
用途
碘元素主要应用于化工、医药、农业和食品等领域,如碘化银用于人工降雨、碘化钾用于治疗甲状腺疾病、碘化钠用于农 业杀菌等。
05
过渡金属元素
钛元素
物理性质
钛是一种银白色过渡金属元素,具有轻盈的特性 ,是所有金属中最轻的。
溴元素由德国化学家巴里于19世 纪发现,并以其拉丁名 “brom”命名。
性质
溴元素是周期表中唯一的非金属 液体,具有强氧化性和腐蚀性, 可与大多数金属形成溴化物。
用途
溴元素主要应用于化工、医药、 电子和灭火等领域,如溴化银用 于摄影、溴化钠用于治疗神经病 痛、电子元件和灭火剂等。
碘元素
发现与命名
碘元素由法国化学家库特瓦于19世纪发现,并以其拉丁名“iod”命名。
砷(As)
砷是一种剧毒的重金属元素,长期接触砷会影响人体神经系统、心血管系统和造血系统的 正常功能,严重时可危及生命。
有害有机物
01
多氯联苯(PCBs)
多氯联苯是一种常见的有害有机物,长期接触PCB会引发肝脏损伤、
免疫系统抑制和神经系统损伤等多种健康问题。
02
二噁英(Dioxins)
二噁英是一种剧毒的有机化合物,长期接触二噁英会对人体免疫系统
高一化学《第四章第一节原子结构与元素周期表2---碱金属元素》

1. 碱金属元素 碱金属是一类化学性质非常活泼的 金属,在自然界中都以化合态存在。
四 原子结构与元素的性质
金属元素的原子最外层电子一般少于4个,在化学反应中容易失去 电子,具有金属性;
非金属元素的原子最外层电子一般多于4个,在化学反应中容易得 到电子,具有非金属性。
原子结构决定元素的性质
实验和观察
碱金属元素的化学性质
(2)在烧杯中加入一些水,滴入几滴酚酞溶液。切取一块绿豆大的 钾,用镊子夹取并投入水中(如图4-9),观察现象。
①实验现象:
相同点:金属浮在水面上;熔成闪亮的小球;四处游动;
发出嘶嘶的声响;反应后的溶液呈红色。
不同点:钾与水的反应有轻微爆炸声并着火燃烧
②化学方程式:2M+2H2O=2MOH+H2↑ (M:Na、K) 离子反应方程式:2M+2H2O=2M++2OH-+H2↑ ③实验结论:
(2)在烧杯中加入一些水,滴入几滴酚酞溶液。切取一块绿豆大的 钾,用镊子夹取并投入水中(如图4-9),观察现象。
①实验现象:
相同点:金属浮在水面上;熔成闪亮的小球;四处游动;
发出嘶嘶的声响;反应后的溶液呈红色。
不同点:钾与水的反应有轻微爆炸声并着火燃烧
②化学方程式:2M+2H2O=2MOH+H2↑ (M:Na、K) 离子反应方程式:2M+2H2O=2M++2OH-+H2↑
归纳整理 对照课本P95“表4-2 碱金属单质的主要物理性质”回答
1.1 碱金属单质的物理性质 (1)碱金属单质具有硬度____、密度____、熔点低的特点。随着元 素原子核电荷数的增加,碱金属单质的熔点和沸点逐渐_____。 (2)碱金属单质具有良好的_______、导____性、导____性,液态钠 可用作核反应堆的传热介质。
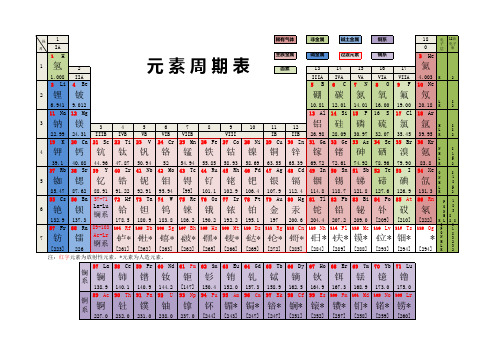
元素周期表(元素分族标注)
5铷
锶
钇
锆
铌
钼
锝
钌
铑
钯
银
镉
铟
锡
锑
碲
碘
氙N M
1 8
L
81
85.47 87.62 88.91 91.22 92.91 95.94 [99] 101.1 102.9 106.4 107.9 112.4 114.8 118.7 121.8 127.6 126.9 131.3 K 2
55 Cs 56 Ba 57-71 72 Hf 73 Ta 74 W 75 Re 76 Os 77 Ir 78 Pt 79 Au 80 Hg 81 Tl 82 Pb 83 Bi 84 Po 85 At 86 Rn P 1
4钾
钙
钪
钛
钒
铬
锰
铁
钴
镍
铜
锌
镓
锗
砷
硒
溴
氪N M
8 1
L
88
39.1 40.08 44.96 47.87 50.94 52 54.94 55.85 58.93 58.69 63.55 65.39 69.72 72.61 74.92 78.96 79.90 83.8 K 2
37 Rb 38 Sr 39 Y 40 Zr 41 Nb 42 Mo 43 Tc 44 Ru 45 Rh 46 Pd 47 Ag 48 Cd 49 In 50 Sn 51 Sb 52 Te 53 I 54 Xe O 8
6铯
钡
La-Lu
镧系
铪
钽
钨
铼
锇
ቤተ መጻሕፍቲ ባይዱ
铱
铂
金
汞
铊
铅
铋
钋
碱金属元素性质总结讲解
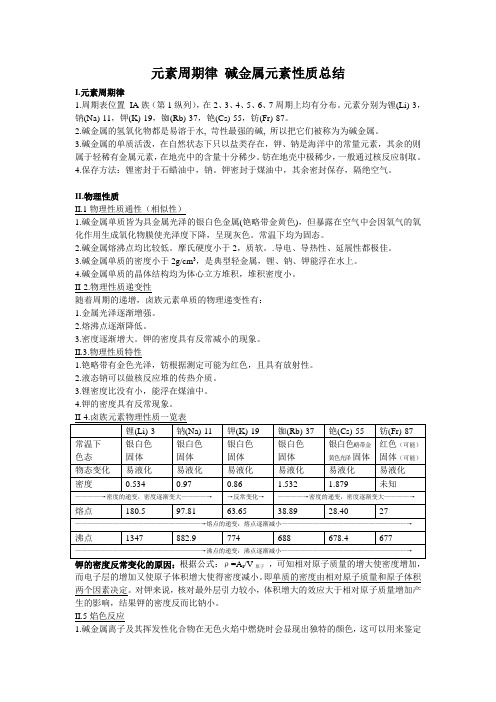
元素周期律碱金属元素性质总结I.元素周期律1.周期表位置IA族(第1纵列),在2、3、4、5、6、7周期上均有分布。
元素分别为锂(Li)-3,钠(Na)-11,钾(K)-19,铷(Rb)-37,铯(Cs)-55,钫(Fr)-87。
2.碱金属的氢氧化物都是易溶于水, 苛性最强的碱, 所以把它们被称为为碱金属。
3.碱金属的单质活泼,在自然状态下只以盐类存在,钾、钠是海洋中的常量元素,其余的则属于轻稀有金属元素,在地壳中的含量十分稀少。
钫在地壳中极稀少,一般通过核反应制取。
4.保存方法:锂密封于石蜡油中,钠。
钾密封于煤油中,其余密封保存,隔绝空气。
II.物理性质II.1物理性质通性(相似性)1.碱金属单质皆为具金属光泽的银白色金属(铯略带金黄色),但暴露在空气中会因氧气的氧化作用生成氧化物膜使光泽度下降,呈现灰色。
常温下均为固态。
2.碱金属熔沸点均比较低。
摩氏硬度小于2,质软。
.导电、导热性、延展性都极佳。
3.碱金属单质的密度小于2g/cm3,是典型轻金属,锂、钠、钾能浮在水上。
4.碱金属单质的晶体结构均为体心立方堆积,堆积密度小。
II-2.物理性质递变性随着周期的递增,卤族元素单质的物理递变性有:1.金属光泽逐渐增强。
2.熔沸点逐渐降低。
3.密度逐渐增大。
钾的密度具有反常减小的现象。
II.3.物理性质特性1.铯略带有金色光泽,钫根据测定可能为红色,且具有放射性。
2.液态钠可以做核反应堆的传热介质。
3.锂密度比没有小,能浮在煤油中。
4.钾的密度具有反常现象。
钾的密度反常变化的原因:根据公式:ρ=A r/V原子,可知相对原子质量的增大使密度增加,而电子层的增加又使原子体积增大使得密度减小。
即单质的密度由相对原子质量和原子体积两个因素决定。
对钾来说,核对最外层引力较小,体积增大的效应大于相对原子质量增加产生的影响,结果钾的密度反而比钠小。
II.5焰色反应1.碱金属离子及其挥发性化合物在无色火焰中燃烧时会显现出独特的颜色,这可以用来鉴定碱金属离子的存在,锂、铷、铯也是这样被化学家发现的。
