难溶电解质的溶解平衡
难溶电解质的溶解平衡

1、下列说法中正确的是( B ) A.不溶于不的物质溶解度为0 B.绝对不溶解的物质是不存在的
C.某离子被沉淀完全是指该离子在溶液中的
浓度为0
D.物质的溶解性为难溶,则该物质不溶于水
2、下列各组离子,在水溶液中能以较高浓度大 量共存的是( B) ① I- ClO- NO3- H+ ② K+ NH4+ HCO3- OH-
溶度积常数,简称溶度积。
MmAn的溶液:Ksp=[c(Mn+)]m · [c(Am-)]n
溶度积规则:在难溶电解质的溶液中,各离子浓度幂之
乘积称为离子积:Qc = [c(Mn+)]m · [c(Am-)]n Qc > Ksp,溶液处于过饱和溶液状态,生成沉淀。 Qc = Ksp,沉淀和溶解达到平衡,溶液为饱和溶液。 Qc < Ksp,溶液未达饱和,沉淀发生溶解。
对于一些用酸或其他方法也不能溶解的沉淀,可以 先将其转化为另一种用酸或其他方法能溶解的沉淀。锅 炉中水垢中含有CaSO4 ,可先用Na2CO3溶液处理,使 之转化为疏松、易溶于酸的CaCO3。 CaSO4 SO42- + Ca2+ + CO32-
CaCO3
三、溶度积和溶度积规则
溶解平衡常数(Ksp):在一定温度下,在难溶电解质的饱 和溶液中,各离子浓度幂之乘积Ksp为一常数,称为
③ SO42- SO32- Cl- OH-
④ Fe3+ Cu2+ SO42- Cl - ⑤ H+ K+ [Al(OH)4]- HSO3- ⑥ Ca2+ Na+ SO42- CO32A.①⑥ B.③④
C.②⑤
D.①④
3、以MnO2为原料制得的MnCl2溶液中常含有Cu2+、 Pb2+、Cd2+等金属离子,通过添加过量难溶电解 质MnS,可使这些金属离子形成硫化物沉淀,经 过滤除去包括MnS在内的沉淀,再经蒸发、结晶, 可得纯净的MnCl2。根据上述实验事实,可推知 MnS具有的相关性质是( C ) A.具有吸附性 B.溶解度与CuS、PbS、CdS等相同 C.溶解度大于CuS、PbS、CdS D.溶解度小于CuS、PbS、CdS
难溶电解质的溶解平衡

【实验3-5】
向MgCl2溶 液中滴加 NaOH溶液 向有白色沉淀的溶液中 滴加FeCl3溶液
静置
生成白 色沉淀
白色沉淀转变为红褐色
红褐色沉淀 析出,溶液 变无色
【实验3-4】
步骤 1mLNaCl和10 向所得固液混合物 滴AgNO3溶混 中滴加10滴0.1mol 合(均为0.1mol/L) /LKI溶液 向新得固液混合物 中滴加10滴0.1mol /L Na2S溶液
解: Ag2CrO4 2Ag+ + CrO42Ksp = [Ag+]2 ×[CrO42-]
[Ag ]
K sp [CrO 4 2 ]
3 -1 9.5 10 5 mol L
CrO42-沉淀完全时的浓度为1.0 ×10-5 molL-1 故有 12 Ksp 9.0 10 4 -1 3 [Ag ] 9.5 10 mol L [CrO 4 2 ] 1.0 105
可以看到: AgCl更难溶!
⑷溶度积常数的意义 一定温度下,当难溶电解质的化学式所表示的 组成中阴阳离子个数比相同时,Ksp越大的难溶 电解质在水中的溶解能力越强。
⑸Ksp的影响因素
难溶电解质本身的性质和温度
一般情况下,温度越高, Ksp越大。
例、 已知Ksp(AgCl)=1.810-10, 把足量的 AgCl放入1L 1 .0 mol /L的盐酸溶液中溶 解度是多少?(g/L)与在水中的溶解度相 比是大还是小?
小结:溶度积(Ksp)的应用
(1)已知溶度积求离子浓度: (2)利用溶度积计算难溶物的溶解度 (3)利用溶度积判断沉淀的溶解与生成
第三课时:
小组活动:10min;讨论并展示、评价以下问题: 如果误食了可溶性钡盐[如BaCl2、Ba(NO3)2 等],会造成钡中毒。中毒患者应尽快用5%的 Na2SO4溶液洗胃,随后导泻使钡盐尽快排出, 即可化险为夷。请用沉淀溶解平衡原理解释其 中的原因。 已知:Ksp(BaSO4)=1.1×10-10 ,5% 的 Na2SO4溶液中的c(SO42-)≈0.38mol/L,请通 过计算说明当胃液中的SO42-离子浓度达到该 数值时,能否有效解毒(即胃中的Ba2+浓度约 小于10-4 mol/L)呢 ?
难溶电解质的溶解平衡

请你利用沉淀溶解平衡的知识、Qc与Ksp的关系及所提 供的信息解释下列现象: -10 2 2
• 溶解平衡与化学平衡一样,受外界条件的影响而 发生移动。
3、特征:逆、等、动、定、变 4、影响因素:内因、外因(浓度、温度)
(1)内因:电解质本身的性质 (2)外因:遵循平衡移动原理 1)温度:升温,多数平衡向溶解方向移动 2)浓度:加水,平衡向溶解方向移动。 同离子效应
例1 :
• 石灰乳中存在下列平衡:
• 2.几点说明: • 溶解平衡的存在,决定了生成难溶电解质的反应 不能进行到底。 • 习惯上将生成难溶电解质的反应,认为反应完全 了,因对于常量的反应来说,0.01g是很小的。当 溶液中残留的离子浓度< 1 ×10-5mol/L时,沉淀 就达到完全。 • 难溶电解质的溶解度尽管很小,但不会等于0。如 Ag2S的溶解度为1.3×10-16g。
②溶度积规则
(1) Q c >Ksp 时,沉淀从溶液中析出(溶液过饱和),
体系中不断析出沉淀,直至达到平衡(此时Q c =Ksp ) (2) Q c =Ksp 时,沉淀与饱和溶液的平衡
(3) Q c <Ksp 时,溶液不饱和,若体系中有沉淀, 则沉淀会溶解直至达到平衡(此时Q c =Ksp )
二、沉淀溶解平衡的应用
则Ksp,
m+]n . [Bn-]m = [A AnBm
(3)溶度积与溶解度之间的关系 例1、已知Ksp,AgCl= 1.56 10-10, Ksp,Ag2CrO4= 9.0 10-12,试求AgCl和Ag2CrO4的溶解度(用g/L表示) 解:(1)设AgCl的浓度为S1(mol/L),则: AgCl(s) Ag+(aq) + Cl-(aq) 平衡 S1 S1 5 5 2 S 1 . 25 10 mol / L 1 . 25 10 143.5g / L K sp S1 1 (2)设Ag2CrO4的浓度为S2(mol/dm3),则: Ag2CrO4(s) 2Ag+(aq) + CrO42-(aq) 平 2S2 S2
难溶电解质的溶解平衡

由 Ksp(Ag2CrO4) = c (Ag )· c(CrO ) , 得 c(Ag ) = -12 1.9 × 10 KspAg2CrO4 -1 -5 -1 = mol· L =4.36×10 mol· L , 2- 0.001 cCrO4 生成 AgCl 沉淀需 c(Ag+)小于生成 Ag2CrO4 沉淀时所需 c(Ag+),故 Cl-先沉淀。刚开始生成 Ag2CrO4 沉淀时,c(Cl-) -10 KspAgCl 1.8×10 = = L-1=4.13×10-6 mol· L-1。 + -5 mol· cAg 4.36×10
难溶电解质溶解平衡
知识点一、沉淀溶解平衡 1.概念 在 一定温度 下,当难溶强电解质溶于水形 成 饱和溶液时, 沉淀溶解 速率和 沉淀生成 速率
相等的状态。
2.沉淀溶解平衡常数——溶度积
(1)溶度积(Ksp):
在一定温度下,难溶电解质的饱和溶液中,离子 浓度 幂的乘积 。 (2)表达式: MmNn(s) 对于沉淀溶解平衡: mMn+(aq)+nNm-(aq),
⑥给溶液加热,溶液的 pH 升高 ⑦向溶液中加入 Na2CO3 溶液,其中固体质量增加 ⑧向溶液中加入少量 NaOH 固体,Ca(OH)2 固体质量不变 A.①⑦ B.①②⑦⑧ C.③④⑤⑦ D.①③⑦⑧
5、溶度积与溶解度的关系: Ksp(AgCl)=1.77×10-10 Ksp(AgBr)=5.35×10-13 Ksp(AgI)=8.51×10-17 溶解度(mol/L):AgCl>AgBr>AgI 结论:同类型的盐若Ksp越小,溶解度越小 不同类型的盐的Ksp不能直接作为溶解度大 小的比较依据。 Ksp(Ag2CO3)=8.45×10-12 溶解度:AgCl<Ag2CO3
难溶电解质的沉淀溶解平衡
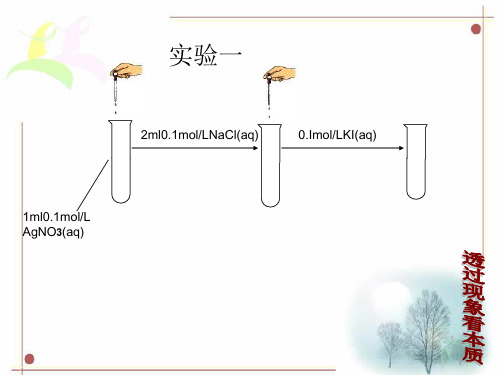
2ml0.1mol/LNaCl(aq)
0.Imol/LKI(aq)
1ml0.1mol/L AgNO3(aq)
一、 难溶电解质的溶解平衡
1、概念: 在一定条件下,当难溶电解质 v(溶解)= v (沉淀)时, 此时溶液中存在的溶解和沉淀间的动态平衡,称为沉 淀溶解平衡. 溶解平衡时的溶液是饱和溶液。
滴加0.5mol/L
Na2SO4(aq)
2C5a℃CO溶3解:1.度5 :×10-3g CaSO4:2.1 ×10-1g
注意:观察对比生成沉淀时Na2CO3(aq) 和Na2SO4(aq)的用量及实验现象。
水垢的主要成分:CaCO3、CaSO4、Mg(OH)2 如何除去水垢?
沉淀的溶解
实验三
CaCO3(S)
• 1、为什么医学上做胃部造影所服用的“钡餐”是 BaSO4而不是BaCO3?
• 2、为什么钙片的成分是CaCO3而不是CaSO4?
• 3、菠菜和豆腐为什么不宜同食?
• 4、如何预防肾结石[CaC2O4和Ca3(PO4)2]呢?
硬水的成分:是指含有较多Ca 、Mg 的水
——硬水的危害
1、全棉衣服或毛巾板结僵硬,多次洗涤后 颜色黯淡 。
2、洗澡后皮肤干燥、粗糙、发痒 。 3、热水器、增湿器、洗衣机等设备管路阻
塞、流量减小、寿命缩短 。
二、沉淀平衡的应用
沉淀的生成
实验二
滴加0.5mol/L
Na2CO3(aq)
CaCl2(aq) 0.5mol/L各1ml
①绝对不溶的电解质是没有的。
②同是难溶电解质,溶解度差别也很大。
b、外因:遵循平衡移动原理
①浓度: 加水,平衡向溶解的方向移动。 加入相同离子,平衡向沉淀方向移动。
难溶电解质的溶解平衡

2. 溶度积常数
(1)难溶电解质的溶度积常数的含义 AgCl(s) Ag+(aq) + Cl-(aq) 当溶解与结晶速度相等时,达到平衡状 态Ksp=C(Ag+)·C(Cl-) 为一常数,该常 数称为难溶电解质的溶度积常数,简称溶度 积。 (2)难溶电解质的溶度积常数用Ksp表示。 通式:AnBm(s) nAm+(aq) + mBn-(aq)
B. AgCl溶解度增大
C.溶液中C(Ag+)增大
②溶度积规则
(Ⅰ)Q c >Ksp 时,沉淀从溶液中析出 (溶液过饱和),体系中不断析出沉淀,直 至达到平衡(此时Q c =Ksp ) (Ⅱ)Q c =Ksp 时,沉淀与饱和溶液的平衡 (Ⅲ)Q c <Ksp 时,溶液不饱和,若体系 中有沉淀,则沉淀会溶解直至达到平衡 (此时Q c =Ksp )
例:下列情况下,有无CaCO3沉淀生成?已知 Ksp,CaCO3=4.96 10-9BaSO4、Ag2CrO4、Mg(OH)2、Fe(OH)3的溶度积表达式
3、溶度积与溶解度之间的关系
例1、已知Ksp,AgCl=1.5610-10, Ksp,Ag2CrO4=9.010-12, 试求AgCl和Ag2CrO4的溶解度(用g/L表示)
[OH ] 3
-
K sp [Fe ]
3
3
1
4.0 10 5 1 10
38
1.5 10 mol L
11
pH = 3.2
Mg2+开始沉淀的pH值为:
1.8 10 [OH ] ( ) ( ) 2 [Mg ] 0.1
-
K sp
1 2
11 1 2
1.3 10 mol L
难溶电解质的溶解平衡

(2)沉淀的方法
① 调pH值
如:工业原料氯化铵中混有氯化铁,使其溶解于水, 再加氨水调 pH值至7~8,可使Fe3+转变为Fe(OH)3沉淀 而除去。
Fe3+ + 3NH3•H2O = Fe(OH)3↓+3NH4+
• 练习:氢氧化铜悬浊液中存在如下平衡: Cu(OH)2(s) Cu2+(aq)+2OH-(aq),常温下其 Ksp=2×10-20, 某硫酸铜溶液里c(Cu2+ )=0.02mol· L-1,如要生成 Cu(OH)2,应调整溶液的pH使之大于( B ) A. 9 B. 5 C.14 D. 7
几种难熔电解质在25℃时的溶解平衡和溶度积:
AgCl(s)
AgBr(s) AgI(s)
Ag+ + Cl- Ksp= [c(Ag+)][c(Cl-)] = 1.8×10-10
Ag+ + Br- Ksp= [c(Ag+)][c(Br-)] = 5.0×10-13 Ag+ + IKsp= [c(Ag+)][c(I-)] = 8.3×10-17
3、沉淀的转化 实验:
(1)AgNO3 (2)MgCl2
NaCl
NaOH
AgCl
KI
AgI
Na2S
Ag2S
Mg(OH)2
FeCl3
Fe(OH)3
实质:溶解度小的沉淀转化为溶解度更小的
沉淀。两种沉淀的溶解度差别越大,沉淀越 容易转化。
【小结】
沉淀的生成、溶解、转化实质上都是沉淀溶解 平衡的移动的过程,其基本依据主要有: ①浓度:加水,平衡向溶解方向移动。 ②温度:升温,多数平衡向溶解方向移动。 ③加入相同离子,平衡向沉淀方向移动。
难溶电解质溶解平衡

A.盐酸
B.NaOH溶液
C.FeSO4溶液 D.H2S溶液
例2、下列说法正确的是 ( ) A.难溶电解质的溶度积越小,溶解度越大 B.可以通过沉淀反应使杂质离子完全沉淀 C.难溶电解质的溶解平衡是一种动态平衡 D.一定浓度的NH4Cl溶液可以溶解Mg(OH)2
3、沉淀的转化
(1)实质:沉淀溶解平衡的移动
新的平衡状态.
1.(2010·北京模拟)下列对沉淀溶解平衡的描述正确的是( ) A.反应开始时,溶液中各离子浓度相等 B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等且保
持不变 D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将
促进溶解
4、影响沉淀溶解平衡的因素 • (1)内因:电解质本身的性质 • ①绝度不溶的电解质是没有的 • ②同是难溶电解质,S差别很大 • ③易溶电解质的饱和溶液也存在溶解平衡 • (2)外因:遵循 平衡移动原理 • ① 浓度:加水,平衡向 溶解 方向移动。 • ② 温度:绝大数难溶盐的溶解是吸热过程,升
• A.达到沉淀溶解平衡时,AgCl沉淀生成和沉淀溶解不 断进行,但速率相等
• B.AgCl难溶于水,溶液中没有Ag+和Cl-
• C.升高温度,AgCl的溶解度增大
• D.向AgCl饱和溶液中加入NaCl固体,会析出AgCl沉 淀
5.将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓
AgNO3溶液,发生的反应为 A.只有AgBr沉淀
(2)一般规律:沉淀溶解平衡是溶解能力相对较 强的物质转化为溶解能力相对较弱的物质
例3.向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继 续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并 振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶解平衡20℃时,电解质在水中的溶解度与溶解性存在如下关系:(1)沉淀的生成①调节pH法②沉淀剂法(2)沉淀的溶解①酸溶解法②盐溶液溶解法③氧化还原溶解法(3)沉淀的转化溶度积和离子积(K sp Q c )A m B n(s) m A n+(aq)+n B m-(aq)判断:1.难溶电解质达到沉淀溶解平衡时,增加难溶电解质的量,平衡向溶解方向移动2.K sp(AB2)小于K sp(CD),则AB2的溶解度小于CD的溶解度。
即K sp小的物质其溶解能力一定比K sp大的物质的溶解能力小3.不可能使要除去的离子全部通过沉淀除去。
一般认为残留在溶液中的离子浓度小于1.0×10-5mol·L-1时,沉淀已经完全4.在一定条件下,溶解度较小的沉淀也可以转化成溶解度较大的沉淀5.溶解平衡一般是吸热的,温度升高平衡右移,K sp增大。
1.硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。
某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。
已知溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨电离常数K b=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol·L-1。
请回答:(1)写出A与氢氧化钠溶液反应的化学方程式:________________________________________________________________________。
(2)上述流程中两次使用试剂①,推测试剂①应该是__________A.氢氧化钠B.氧化铝 C.氨水D.水(3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是________________(任写一点)。
(4)H中溶质的化学式:______________。
(5)计算溶液F中c(Mg2+)=________(25 ℃时,氢氧化镁的K sp=5.6×10-12)。
2.AgCl的K sp=1.80×10-10,将0.002 mol·L-1的NaCl和0.002 mol·L-1的AgNO3溶液等体积混合,是否有AgCl沉淀生成?3.在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。
t℃时AgCl的K sp=4×10-10,下列说法不正确的是A.在t℃时,AgBr的K sp为4.9×10-13B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点变到b点C.图中a点对应的是AgBr的不饱和溶液D.在t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)的平衡常数K≈8164.硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下。
下列说法正确的是A.温度一定时,K sp(SrSO4)随c(SO2-4)的增大而减小B.三个不同温度中,313 K时K sp(SrSO4)最大C.283 K时,图中a点对应的溶液是饱和溶液D.283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液5.已知K sp(AgCl)=1.56×10-10,K sp(AgBr)=7.7×10-13,K sp(Ag2CrO4)=9.0×10-12。
某溶液中含有Cl-、Br-和CrO2-4,浓度均为0.010mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为A.Cl-、Br-、CrO2-4 B.CrO2-4、Br-、Cl-C.Br-、Cl-、CrO2-4 D.Br-、CrO2-4、Cl-6.某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示。
据图分析,下列判断错误的是A.K sp[Fe(OH)3]<K sp[Cu(OH)2]B.加适量NH4Cl固体可使溶液由a点变到b点C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和7.(1)相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:____________。
(2)2-2--某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入__________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=______________。
过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
练出高分1.下列说法不正确的是A.K sp只与难溶电解质的性质和温度有关B.由于K sp(ZnS)>K sp(CuS),所以ZnS在一定条件下可转化为CuSC.其他条件不变,离子浓度改变时,K sp不变D.两种难溶电解质作比较时,K sp越小的电解质,其溶解度一定越小2.把氢氧化钙放入蒸馏水中,一定时间后达到如下平衡:Ca(OH)2(s) Ca2+(aq)+2OH-(aq)。
加入以下溶液,可使Ca(OH)2减少的是A.Na2S溶液B.AlCl3溶液 C.NaOH溶液D.CaCl2溶液3.纯净的NaCl并不潮解,但家庭所用的食盐因含有MgCl2杂质而易于潮解。
为得到纯净的氯化钠,有人设计这样一个实验:把买来的食盐放入纯NaCl的饱和溶液中一段时间,过滤即得纯净的NaCl固体。
对此有下列说法,其中正确的是A.食盐颗粒大一些有利于提纯B.设计实验的根据是MgCl2比NaCl易溶于水C.设计实验的根据是NaCl的溶解平衡D.在整个过程中,NaCl的物质的量浓度会变大4.25 ℃时,PbCl2固体在不同浓度盐酸中的溶解度曲线如图。
在制备PbCl2的实验中,洗涤PbCl2固体最好选用A.蒸馏水B.1.00 mol·L-1盐酸C.5.00 mol·L-1盐酸D.10.00 mol·L-1盐酸5.已知:pAg=-lg c(Ag+),K sp(AgCl)=1×10-12。
如图是向10 mL AgNO3溶液中逐渐加入0.1 mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图像(实线)。
根据图像所得下列结论正确的是[提示:K sp(AgCl)>K sp(AgI)]A.原AgNO3溶液的物质的量浓度为0.1 mol·L-1B.图中x点的坐标为(100,6)C.图中x点表示溶液中Ag+被恰好完全沉淀D.把0.1 mol·L-1的NaCl换成0.1 mol·L-1 NaI则图像在终点后变为虚线部分6.在溶液中有浓度均为0.01 mol·L-1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:K sp[Fe(OH)3]=2.6×10-39;K sp[Cr(OH)3]=7.0×10-31;K sp[Zn(OH)2]=1.0×10-17;K sp[Mg(OH)2]=1.8×10-11。
当氢氧化物开始沉淀时,下列离子中所需pH最小的是A.Fe3+B.Cr3+C.Zn2+D.Mg2+7.已知25 ℃时,BaCO3的溶度积K sp=2.58×10-9,BaSO4的溶度积K sp=1.07×10-10,则下列说法不正确的是A.25 ℃时,当溶液中c(Ba2+)·c(SO2-4)=1.07×10-10时,此溶液为BaSO4的饱和溶液B.因为K sp(BaCO3)>K sp(BaSO4),所以无法将BaSO4转化为BaCO3C.25 ℃时,在含有BaCO3固体的饱和溶液中滴入少量Na2SO4溶液后有BaSO4沉淀析出,此时溶液中c(CO2-3)∶c(SO2-4)≈24.11D.在饱和BaCO3溶液中加入少量Na2CO3固体,可使c(Ba2+)减小,BaCO3的溶度积不变8.已知25 ℃时,Mg(OH)2的溶度积常数K sp=5.6×10-12,MgF2的溶度积常数K sp=7.4×10-11。
下列说法正确的是A.25 ℃时,向饱和MgF2溶液中加入饱和NaOH溶液后,不可能有Mg(OH)2生成B.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者c(Mg2+)大C.25 ℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大D.25 ℃时,Mg(OH)2固体在同体积同浓度的氨水和NH4Cl溶液中的K sp相比较,前者小9.已知298 K时,Mg(OH)2的溶度积常数K sp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13.0,则下列说法不正确的是A.所得溶液中c(H+)=1.0×10-13mol·L-1B.所得溶液中由水电离产生的c(OH-)=1×10-13mol·L-1C.所加烧碱溶液的pH=13.0D.所得溶液中c(Mg2+)=5.6×10-10mol·L-110下列有关说法中正确的是A.25 ℃时,CuS的溶解度大于MnS的溶解度B.25 ℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10-36mol·L-1C.因为H2SO4是强酸,所以反应CuSO4+H2S===CuS↓+H2SO4不能发生D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂11.已知25 ℃时,难溶化合物的饱和溶液中存在着溶解平衡,例如:AgCl(s) Ag+(aq)+Cl-(aq),Ag2CrO4(s) 2Ag+(aq)+CrO2-4(aq),且K sp(AgCl)=1.8×10-10,K sp(Ag2CrO4)=1.9×10-12。
(1)若把足量的AgCl分别放入①100 mL蒸馏水,②100 mL 0.1 mol·L-1NaCl溶液,③100mL 0.1 mol·L-1 AlCl3溶液,④100 mL 0.1 mol·L-1 MgCl2溶液中,搅拌后在相同温度下Ag+浓度由大到小的顺序是____________________________(填序号)。
(2)现用0.001 mol·L-1 AgNO3溶液滴定0.001 mol·L-1 KCl和0.001 mol·L-1 K2CrO4的混合溶液,试通过计算回答:Cl -和CrO 2-4中哪种先沉淀?__________。
