植物基因组DNA提取试剂盒(北京天根)培训资料
《植物DNA的提取》课件

CTAB法
优点: 适用于多种植物样品,提取的DNA纯度高。 缺点: 步骤繁琐,耗时较长。
琼脂糖法
优点: 简单快捷,适用于大批量样品。缺点: DNA 纯度较低,可能受到琼脂糖的干扰。
质量检测与保存方法
质量检测方法
通过电泳、比色法等进行DNA纯度和浓度的检测。
DNA保存方法
选择合适的冷冻保存方式,如-20°C或液氮保存, 以保证DNA的稳定性。
提取步骤
样品采集和预处理
选择适当的植物组织进行采集,并进行适当 的处理以保证DNA的完整性和纯度。
DNA裂解
利用酶或高温等方法,将DNA分解成更小的 片段。
细胞破碎
通过机械或化学手段破坏细胞壁,释放细胞 内的DNA。
DNA纯化
通过柱子层析、溶液沉淀等方法,去除杂质, 提取纯净的DNA。
Байду номын сангаас
提取方法的优缺点
应用前景
种质资源保护与利用
通过植物DNA的提取和分析,能够帮助我们更好地保护和利用植物的遗传资源。
基因组研究
植物DNA的提取是进行基因组研究的前提,有助于揭示植物的基因组结构和功能。
总结
DNA提取的意义和重要性
植物DNA的提取是深入研究植物遗传特性和进化历程的重要途径。
提取方法的优缺点
不同的提取方法各有优劣,选择合适的方法可以提高DNA提取效果。
应用前景和发展趋势
植物DNA的提取在农业、生物学等领域有着广阔的应用前景,并随着研究的深入不断发展。
参考文献
1. 张三, 李四. 植物DNA提取方法的优化与比较[J]. 生物工程学报, 2020, 36(4): 503-510.
2. Wang J, et al. Optimized DNA extraction methodology for PCR analysis of medicinal plant species[J]. Plant Molecular Biology Reporter, 2019, 37: 361-369.
实验一植物基因组DNA提取

DNA的紫外分光光度计检测
原理:核酸在260nm处有最大吸收峰 蛋白质在280nm处有最大吸收峰 盐和小分子在230nm处有最大吸收峰
OD260/OD280>1.7 OD260/OD230>2.0 1OD260=50 μg/mL DNA
思考题:
1. 如何检测和保证DNA的质量? 2. 基因组提取过程中注意事项有哪些?
植物基因组DNA的提取
பைடு நூலகம் 一、实验目的: 1. 了解真核生物基因组DNA提取的一般 原理。 2. 掌握DNA提取的方法和步骤。
二、一般原理
提取DNA的一般原理,是将分散好 的真核生物组织细胞在含SDS和蛋白酶K 的溶液中消化分解蛋白质,再用酚:氯仿: 异戊醇抽提的方法去除蛋白质,得到的 DNA经乙醇沉淀方法进一步纯化。
三、材料
玉米叶片
四、设备
移液器,冷冻高速离心机,台式高速离 心机,水浴锅,陶瓷研钵,1.5 mL 离心管。
五、试剂
1. 提取缓冲液: 100mmol/L Tris·Cl,20mmol/L EDTA,500mmol/L NaCl,1.5% SDS。
2. 氯仿:异戊醇:乙醇(80:4:16)。 3. TE缓冲液:10mmol/L Tris·Cl(pH8.0),
7.室温下12000rpm离心5 min。
8.吸取600ul上清液加入等体积的异丙醇,上下颠倒充 分混匀,观察絮状沉淀,后12000rpm离心5min。
9.倒去上清后用70%的乙醇清洗两次,每次在 12000rpm下离心1min。空气中干燥,后加入30ul 的TE(或ddH2O)缓冲液,充分溶解。
10.DNA用于后续实验研究或放于-20 ℃保存备用。
1mmol/L EDTA(pH8.0)。 4. 其他试剂:液氮,异丙醇,无水乙醇,70%乙醇,
TAKARA植物DNA提取试剂盒说明书

M 1 2 3 4 5 6 7 8 9 10 11 12 1 2 M
1.0 kbp 0.5 kbp
2.0 kbp
PCR 反应液 4 μl,1% Agarose 电泳,M:Wide-Range DNA Ladder(50~10,000 bp) 图 3 以提取的基因组 DNA 为模板进行 PCR 扩增的电泳图
图 1 从植物组织中提取的基因组 DNA 电泳图 -2-
表 1 从植物组织中提取的基因组 DNA 纯度*
样品名称
样品量
Sample No.
A260/A280
A260/A230
20 mg
1
拟南芥幼芽
2
3
50 mg
4
2.2
1.4
2.2
1.4
2.1
1.7
2.1
1.7
20 mg
5
6
西红柿幼芽
7
50 mg
8
图 5 以提取的基因组 DNA 为模板进行 PCR 扩增的电泳图
注:长时间存放可能会有夹杂物沉淀,尽量迅速进入 下一步操作。
12. 12,000 rpm 4℃离心 10 分钟。 13. 弃上清,注意不要吸取沉淀。
注:沉淀有时肉眼看不见。
14. 加入 1 ml 70%乙醇,清洗沉淀。 15. 12,000 rpm 4℃离心 3 分钟。 16. 弃上清,注意不要吸取沉淀。 17. 沉淀干燥,加入适量 TE Buffer(约 20 μl)溶解沉
2. 取出冻结的植物组织于室温放置 5 分钟左右,使其融解。 3. 轻微离心,将植物组织收集在 Microtube 底部。 4. 使用 Pipet Tip 尖端将植物组织按压 Microtube 底部 10 次左右,进行物理破碎。 5. 加入 400 μl 的 Extraction Solution 1,剧烈振荡 5 秒钟。如果植物组织仍滞留于 Microtube 底部,
植物基因组DNA的提取与检测

生命科学学院专业生物技术 2016级生技班666组姓名余梓棋同实验者黄剑宇黄少凯 2018年 5 月 8日题目:植物基因组DNA的提取与检测一.实验目的:1.了解真核生物基因组DNA提取的一般原理;2.掌握基因组DNA提取的方法和步骤。
二.实验原理1.液氮研磨:液氮能迅速将植物组织温度降到零度以下,使组织细胞变得脆而易碎,此时对植物组织进行研磨,能大大提高研磨的效率,植物组织迅速变为粉末状,增大表面积,提高提取植物DNA的效率。
2.SDS等离子型表面活性剂处理:SDS等离子型表面活性剂能溶解膜蛋白而破坏细胞膜,使核蛋白解聚,从而使DNA游离出来,且使DNA保持溶解溶液状态,易于分离3.苯酚和氯仿处理:苯酚和氯仿等有机溶剂能使蛋白质变性,并使抽提液分相,因核酸水溶性很强,经离心后即可从抽提液中除去细胞碎片和大部分蛋白质;4.异丙醇处理:上清液中加入异丙醇使DNA沉淀,离心后DNA沉淀于离心管底部,便于移去提取液。
而后将沉淀DNA溶于TE缓冲液中,即得植物基因组DNA溶液;5.DNA的琼脂糖凝胶电泳鉴定:带电荷的物质,在电场中的趋向运动称为电泳。
DNA的琼脂糖凝胶电泳可以分离长度为200bp至近50kb的DNA分子。
DNA的迁移率(U)的对数与凝胶浓度(T)之间存在反平行线性关系。
因此,要有效地分离不同大小的DNA片生命科学学院专业生物技术 2016级生技班666组姓名余梓棋同实验者黄剑宇黄少凯 2018年 5 月 8日段,选用适当的琼脂糖凝胶浓度是非常重要的。
三.实验材料及设备1.实验材料:新鲜的植物幼嫩叶片2.实验仪器:(1)研磨皿,10、100、1000μL取液器各一支,台式高速离心机,漩涡器;(2)电泳仪,电泳槽,样品槽模板(梳子),有机玻璃内槽,水平仪,取液器,微波炉,凝胶成像系统。
3.实验试剂:(1)植物DNA提取a.细胞提取液:100mmol/L Tris-HCl, pH8.0, 5mmol/L EDTA,500mmol/L NaCl, 1.25% SDS,1%β-巯基乙醇(去除酚类);b.氯仿:异戊醇(24:1);c.其它试剂:液氮、无水乙醇、 TE缓冲液、异丙醇、洗涤缓冲液;作用:氯仿可使蛋白质变性,有助于液相与有机相的分离。
植物DNA质粒DNA的提取以及载体构建ppt课件

1、质粒不是细菌生长所必需的遗传物质,可自行丢失或 人工处理而消除;
2、携带的遗传信息能赋予宿主菌某些生物学性状,有利 于细菌在特定的环境下生存;
3、能独立于染色体之外进行复制和遗传; 4、常包含编码对宿主有利的酶的基因;
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
6、将上清转移至干净的新离心管中,加入2/3体积的异丙醇或 2倍体积的无水乙醇,混匀,静置沉淀30min,10000r离心 10min;
7、将上清倒掉,倒置离心管使残液流尽,加入500µ75%酒精, 将沉淀摇起来放置5—10min,离心,倒掉酒精,重复一次;
8、倒置离心管使残液流尽,离心,用枪头将残液吸干,吹干, 溶于TE(10mM Tris-HCl;1mM EDTA PH=8.0);
• DNA的紫外检测通常使用荧光染料溴化乙锭,该物质含
有一个可以嵌入DNA的堆积碱基之间的平面基团,这个 基团的固定位置及其与碱基的密切接近,导致染料与 DNA结合并呈现荧光。
• 根据Marker的量及其荧光的强弱,可大致对检测的DNA
样品进行定量。
• 使用此法还有一个突出优点,即它可令操作者直观地获
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
一、植物DNA的提取
1、目的和意义 2、原理 3、试剂的准备 4、操作过程 5、DNA检测 6、注意事项 7、常见问题及解决办法
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
植物基因组DNA的提取

10、紫外检测仪。
五、实验操作方法和步骤 (一) 植物基因组DNA的提取
称取植物幼嫩叶子0.5g 65℃水浴保温1hr, 其间经常轻柔摇动 离心5,000g×5min 置于预热到65℃的研体中, 加少许石英砂;加入预热到 65℃的核酸提取缓冲液3ml 迅速研成匀浆 转移到7ml带盖离心管中
在DNA提取过程中必须始终注意以下几个关键问题: (1)DNA的二级结构和双链易受多种因素(如强酸、强碱、加热、低盐浓度、 有机溶剂、酰胺类、尿素等)的影响引起双链解开,即“变性”,因此抽提时 避免使用变性的条件。 (2)抑制内外源DNase的活力。DNase就象一把刀,它能把大分子的DNA切成碎 片,所以要加以杜绝,现可以通过多种途径来做到这一点:a、低温操作;b、 调节pH,使偏碱(pH8.0);c、抽提液中加表面活性剂;d、加螯合剂(EDTA) 除去酶的铺助因子(Mg2+),使酶活性丧失。 (3)防止化学降解。如过酸或过碱以及其它化学因素,会使DNA降解,一般综 合考虑,取pH8.0左右为宜。 (4)防止物理因素降解。如温度太高或机械张力剪切等,DNA分子特别大,极 易被机械张力拉断,甚至在细管中稍急一些的流动也会使DNA断裂,所以在抽 提过程中要特别注意这一点,操作过程要尽量简便、温和、减少搅拌次数,也 不要剧烈摇动。 (5)植物的次生代谢物(主要是胞质内的多酚类或色素类化合物)对核酸提 取有干扰作用。因此,一般尽可能选幼嫩的、代谢旺盛的新生组织作为提取 DNA的材料,这是因幼嫩的新生组织次生代谢物较少,DNA含量高,且易于破碎, 植物材料最好是新鲜的。
三、实验材料与试剂
1、实验材料 植物基因组DNA样品
2、实验试剂
⑴ ddH2O; ⑵ TE缓冲液(pH 8.0)。 四、实验器材与仪器 1、离心机、离心管(5ml)及离心管架; 2、微量移液器10ul、200ul、1000ul及枪头; 3、紫外分光光度计; 4、石英比色皿(0.5cm光径)或1cm光径的微量石英比色皿(50ul、100ul)。
植物基因组 DNA 提取试剂盒使用说明

植物基因组DNA提取试剂盒使用说明货号:D1500规格:50T/100T保存:室温(15℃-25℃)干燥保存,复检期12个月,2℃-8℃保存时间更长。
试剂盒内容:50T100TRNase A1ml1ml×2β-巯基乙醇250ul500ul溶液A20ml40ml溶液B7ml14ml溶液C30ml60ml漂洗液15ml15ml×2洗脱液10ml20ml吸附柱50个100个收集管50个100个说明书1份1份产品简介:本试剂盒采用可以特异性结合DNA的离心吸附柱和独特的缓冲液系统提取植物的基因组DNA。
离心吸附柱中采用的硅基质材料为本公司特有新型材料,能够高效、专一吸附DNA,可最大限度去除杂质蛋白及细胞中其他有机化合物。
提取的基因组DNA片段大,纯度高,质量稳定可靠。
使用本试剂盒提取的植物基因组DNA可用于各种常规操作,包括酶切、PCR、文库构建、Southern杂交等实验。
操作步骤:使用前先在漂洗液中加入无水乙醇,加入体积请参照瓶体上的标签。
所有离心步骤均为使用台式离心机在室温下离心。
1、植物组织预处理:取新鲜植物组织(不超过100mg)或干重组织(不超过20mg),于液氮中充分研磨至细粉状,让液氮自然挥发。
2、将研磨好的植物组织粉末迅速转移到预先装有400ul溶液A、20ul RNase A(10mg/ml)和5ulβ-巯基乙醇的离心管中,充分颠倒混匀,室温放置10min。
3、加入140ul溶液B,充分颠倒混匀,12000rpm离心10min,将上清转移至新离心管(约400-500ul),注意不要吸入沉淀。
4、加入和上清相同体积的溶液C,充分颠倒混匀,再加入和溶液C相同体积的无水乙醇,此时若出现絮状物,将絮状物吹散后一起加入吸附柱中,12000rpm离心5min,弃废液,一次加不完可分两次加入。
注意:如果吸附柱膜呈绿色或离心时有堵塞现象,可向吸附柱中加入600ul无水乙醇,并适当延长离心时间。
实验二植物基因组DNA的提取ppt课件

5.
保存
10000 r/min 离心10分钟
注意事项
➢ 在整个实验过程中应严格执行无菌操作; ➢ 部分药品有毒,操作中应注意安全防护; ➢ 磨样时最好是加液氮,磨样速度要快,使材料处于低
温状态 。 ➢ 刚投入水浴时可以稍快速的晃动,之后的晃动一定要
轻柔! ➢ 抽提时不要有太力振动,操作也要仔细,尽量避免
实验二植物基因组DNA的提取
背景知识
植物细胞中有哪些细胞器中含有DNA? 与动物细胞的差别?
背景知识
DNA的存在形式
背景知识
DNA的存在形式
背景知识
DNA的存在形式
核苷酸 双螺旋结构
+组蛋白 一级结构-核小体
二级机构-螺线管
三级结构-超螺旋管
四级机构-染色体
背景知识
DNA的存在形式
DNA的理化性质
实
验
离心机:3台/12管 水浴锅:65℃
仪 研钵:10个
器 移液枪(包括枪头)
实 新鲜菠菜叶片
验 材
十六烷基三甲基溴化铵(CTAB) 、三羟甲基氨基 甲烷(Tris)、乙二胺四乙酸二钠(EDTA-2Na)、 氯化钠、Tris饱和酚、异丙醇、β-巯基乙醇、
料 无水乙醇、氯仿、异戊醇、液氮、聚乙烯吡咯
无水乙醇、氯仿、异戊醇、液氮、聚乙烯吡咯烷酮(PVP-40)
1ml酚-氯仿-异戊醇
5mol/l EDTA
8ml
1ml酚-氯仿-异戊醇
酚1m:氯l酚仿-氯:异仿戊-异醇戊=注2醇5:2意4:1:4此0ml方法会把少量RNA提取出来,故后面通称核酸的提取。
取20ml前面配制的氯仿-异戊醇+20mlTris饱和酚
(TSP101)植物DNA提取试剂盒

(TSP101)植物DNA提取试剂盒Trelief T M Plant Genomic DNA Kit 植物基因组DNA提取试剂盒(通用型)TSP101本试剂盒采用独特的缓冲液系统配合特异性吸附 DNA的离心柱,可以从植物的根、茎、叶、花、果实、种子等样本中简单、快速、高效地提取基因组 DNA。
获得的基因组DNA完整性好、纯度高、质量稳定,是AFLP、RAPD、SSR 等分子标记,Southern 杂交,常规PCR,文库构建以及基因组测序等分子生物学实验的最佳选择。
试剂盒组成:TSP101-50 (50次) TSP101-200 (200次)RNase A Buffer BL Buffer gP1 Buffer gP2 Buffer PW20 ~ 25℃ 20 ~ 25℃ 20 ~ 25℃ 20 ~ 25℃ 20 ~ 25℃250μ l 13 ml 21 ml 8 ml 12 ml1 ml 55 ml 85 ml 31 ml 46 ml6个月 1年 1年 1年 1年 3个月 1年 3个月 1年 1年 1年第一次使用前加指定量乙醇13 ml 25 ml × 2Wash Buffer TE Buffer Spin Columns20 ~ 25℃ 20 ~ 25℃ 20 ~ 25℃第一次使用前加指定量乙醇 5 ml 50 个 50 个 1份 20 ml 200 个200 个 1份Collection Tubes(2.0ml) 20 ~ 25℃实验操作手册产品特点:简单快速:1 h内即可获得超纯的基因组DNA。
应用广泛:适用于各种植物组织,包括富含多糖、多酚等提取困难样本。
超纯:获得的DNA纯度高、完整性好,可直接用于各种分子生物学实验。
注意事项:1. 检查Buffer gP1 及Buffer Pw是否有固体析出,如有析出,请置于37℃水浴中溶解并摇匀。
2. Buffer PW及Wash Buffer首次使用前加入指定量的无水乙醇,各溶液使用后应及时盖紧盖子。
最新实验8 植物组织总DNA的提取资料讲解

称取样品,液氮研磨,加入预热的(65℃ ) CTAB及β-巯基乙醇
保温1h,期间不停的摇均
吸取上清液,移至新的离心管中,加入等体积氯仿:异戊醇(24:1),轻缓颠倒 混匀,10000rpm,10min
取上清液,移至新的离心管中,加等体积氯仿:异戊醇,颠倒混匀, 10000rpm,10min
取上清液,加入0.6-0.7V的异丙醇(预冷),后4 ℃ /-20 ℃保温沉淀
CTAB, SDS等离子型表面活性剂,能溶解细胞 膜和核膜蛋白,使核蛋白ห้องสมุดไป่ตู้聚,从而使DNA得以 游离出来。
再加入苯酚和氯仿等有机溶剂,能使蛋白质变性, 并使抽提液分相,因核酸(DNA、RNA)水溶性很强, 经离心后即可从抽提液中除去细胞碎片和大部分蛋 白质。上清液中加入异丙醇或乙醇使DNA沉淀,沉 淀DNA溶于双蒸水或TE溶液中,即得植物总DNA 溶液。之后可加入RNA酶降解其中的RNA,再用氯 仿除去RNA酶,得到较纯的DNA制剂。
(9)10000 rpm离心1 min后,立即倒掉液体,注 意勿将白色DNA沉淀倒出,将离心管倒立于铺开的 纸巾上; (10)60 sec后,直立离心管,加入720 µl的75% 乙醇及80 µl 5 M的醋酸钠,轻轻转动,用手指弹管 尖,使沉淀与管底的DNA块状物浮游于液体中; (11)放置30 min,使DNA块状物的不纯物溶解; (12) 10000 rpm离心1 min后,倒掉液体,再加 入800 µl 75%的乙醇,将DNA再洗 30 min;
实验8 植物组织总DNA的 提取
二、实验原理
通常采用机械研磨的方法破碎植物的组织和细 胞,由于植物细胞匀浆含有多种酶类(尤其是氧化 酶类)对DNA的抽提产生不利的影响,在抽提缓冲 液中需加入抗氧化剂或强还原剂(如巯基乙醇)以降 低这些酶类的活性。在液氮中研磨,材料易于破碎, 并减少研磨过程中各种酶类的作用。
植物基因组 DNA 提取

植物基因组D NA 提取2ml 离心管提取取新鲜叶片采用C TAB 法,按M urry 等{Murray, 1980 #9}的方法,略加改进,具体操作过程如下:1. 2.0 ml 离心管加入离心管盖大小新鲜叶片2片;2. 液氮充分研磨成粉末,加入900 µL CTAB 缓冲液;3. 65 ℃水浴1小时,期间摇匀3次;4. 置于4℃冰箱冷却至15 ℃以下;5. 加入900 µL25: 24:1 酚/氯仿/异戊醇,上下混匀2-5 分钟,保证样品与氯仿充分混合;6. 12,000 rpm 离心20-30 分钟;7. 取上清液约800 µL,加入预先加好的700 µL 异丙醇的1.5 ml 离心管中,轻轻上下颠倒混匀;8. -20℃冰箱静止30 分钟以上;9. 12,000 rpm 离心15-20 分钟,弃上清夜;10. 75%酒精洗涤沉淀,弃上清液,12,000 rpm 离心15-20 分钟;11. 风干D NA,让酒精挥发干净(4 小时以上或过夜);12. 加入100 µL 的纯水(含终浓度为1%RNase)溶解D NA;13. 放入37 ℃环境中,约60 分钟消化R NA;14. 取2 µL DNA 进行检测。
50ml 离心管提取取新鲜叶片采用C TAB 法,按M urry 等{Murray, 1980 #9}的方法,略加改进,具体操作过程如下:1. 取新鲜叶片在研钵用液氮研磨成粉末;2. 向50ml 离心管里加入叶片粉末,至刚好覆盖住管圆底部,加入20mlCTAB 缓冲液充分混匀;3. 65 ℃水浴1小时,期间摇匀3次;4. 取出,冷却至15 ℃以下;5. 加入20ml 的25: 24:1 酚/氯仿/异戊醇,上下混匀2-5min,保证样品与氯仿充分混合;6. 4500rpm 离心40 分钟;(如不需要抽提第2次,可直接到9步骤)7. 小心吸取上清液至新的50ml 离心管中,加入20ml 的氯仿溶液,混匀2-5min左右8. 4500rpm 离心40 分钟;9. 取上清液于50ml 离心管中,加入等体积的异丙醇,轻轻上下颠倒混匀,此时会看到絮状沉淀;10. -20℃冰箱静止30min 以上;11. 4500rpm 离心40min,弃上清夜;12. 加入5ml 的75%酒精洗涤沉淀,4500 rpm 离心30min,弃上清液;13. 风干D NA,让酒精挥发干净(4 小时以上或过夜);14. 加入约300 µL 的纯水(含终浓度为1%RNase)溶解D NA;15. 放入37 ℃环境中,约60min 消化R NA;16. 取2 µL DNA 进行检测。
植物基因组DNA提取

实验一植物基因组DNA提取一、目的与原理DNA是绝大多数生物(除少数RNA病毒外)储存、传递信息的生物大分子。
为了进行DNA 分子的体外重组,必须提取具有天然结构并具有一定长度的DNA大分子。
提取分离DNA大分子,有酚法,氯仿一异丙醇法、酶法、SDS法、CTAB法等方法。
主要操作都是围绕如何尽可能除尽结合蛋白质和多糖等杂质,本实验的目的是介绍CTAB法。
CTAB 法提取基因组DNA 原理:CTAB 是一种非离子去污剂。
CTAB 与核酸形成复合物,此复合物在高盐(>0.7mM)浓度下可溶,并稳定存在,但在低盐浓度(0.1-0.5 mM NaCl)下CTAB-核酸复合物就因浓度降低而沉淀,而大部分的蛋白质及多糖等仍溶解于溶液中。
经离心弃上清后,CTAB-核酸复合物再用75%酒精浸泡可洗脱掉CTAB。
二、实验材料、仪器和试剂(一) 实验材料:新鲜的植物叶片(水稻叶子),适量液氮(二) 试剂:(1)EDTA溶液(0.5M、pH=8.0、500 mL)(2)Tris·HCl溶液(1.0 M、pH=8.0、500 mL)(3)2%CTAB抽提液(pH=8.0、500 mL)①称取CTAB粉末10.000 g,NaCl粉末40.908 g,PVP 405.000 g;②0.5M EDTA溶液20 mL;1.0M Tris·Cl溶液50 mL;③定溶至500 mL,121℃高压灭菌后,常温放置,待用。
(4)1×TE缓冲液(pH=8.0、200 mL)(5)RNase(10 mg/mL)1.5 mL离心管(121℃高压灭菌),加入0.015 g RNase,15μL 1M Tris·Cl溶0.001305 gNaCl(几小粒),无菌ddH2O(重蒸水)定容至1.5 mL,100℃煮15min;低温放置,待用。
(RNaseA,Sigma,M=487.5)。
(三)仪器通风橱、天平、离心机、摇床、微量移液器、水浴锅、研钵三、植物组DNA提取步骤1.准备工作。
实验六植物基因组DNA提取(与“提取”相关文档)共7张PPT

Note:
1)提取植物基因组DNA的常用方法:CTAB法、SDS法、尿素法等
2)CTAB与核酸形成复合物,此复合物在高盐(>)浓度下可溶,并稳定 存在,但在低盐浓度()下因溶解度降低而沉淀,而此时大部分蛋白质及多 糖等仍溶解于溶液中。经离心沉淀后得到的CTAB-复合物用70%~75%的酒精 浸泡可洗脱掉CTAB。氯仿/异戊醇(24:1)抽提可去除蛋白质、多糖、色素 等,异戊醇或乙醇可用来沉淀DNA。
第7页,共7页。
7)加200~500μL TE溶ቤተ መጻሕፍቲ ባይዱDNA,溶解后在4℃保存备用。
8)在0.8%的琼脂糖凝胶(含溴化乙锭)上稳压电泳 (电压<5V/cm)检测基因组DNA。
第6页,共7页。
作
业
1 将你提取DNA的电泳图片附在实验结果里,并根据电泳图片分 析你所提的DNA质量如何。
2 DNA提取液中去污剂和螯合剂(如EDTA)的作用?
机械剪切 加经氯2)7离仿06心 /%5异〈℃沉乙戊水2淀醇〉浴后洗(3尽得0涤2m4到量2:i次n的,1减()C其T每抽少A间次B提温对-8复可m和溶合去i摇n物除)液荡用蛋,去离中7白7心00质D%管%~、N乙27-多A5醇3%次糖的,的,、鼓酒水色风精浴素或浸后等室泡取,温可出异下洗室戊干脱温醇破燥掉冷或DC坏却乙NTAA5醇。;mB可。in用;来沉淀DNA。
实验 六
▪ 植物基因组DNA提取
第1页,共7页。
▪ 一、实验目的
1、掌握提取DNA的方法,该方法提取的DNA可用作PCR模板、限制性酶切反 应和Southern印迹分析。
2、提取银杏叶片总DNA,并通过琼脂糖凝胶电泳分析检测所提取DNA的纯 度和完整性。
▪ 二、材料、试剂和仪器
产品简介DNaseI储存液的配制-天根生化科技(北京

产品简介本试剂盒可从植物组织,特别是富含多糖多酚或淀粉的植物组织(如棉花叶片,成熟水稻叶片,拟南芥种子,白松松针,香蕉,枇杷叶片,马铃薯块茎,苹果,梨,西瓜果肉,猕猴桃,月季,烟草,沙棘,百合等)中快速提取总RNA,可同时处理大量不同样品。
提取的总RNA纯度高,没有基因组、蛋白和其它杂质的污染,可用于RT-PCR、Real Time RT-PCR、芯片分析、Northern Blot、Dot Blot、PolyA 筛选、体外翻译、RNase 保护分析和分子克隆等多种下游实验。
预防RNase污染,应注意以下几方面:1. 经常更换新手套。
因为皮肤经常带有细菌,可能导致RNase污染。
2. 使用无RNase的塑料制品和枪头避免交叉污染。
3. RNA在裂解液SL中时不会被RNase降解。
但提取后继续处理过程中应使用不含RNase的塑料和玻璃器皿。
4. 配制溶液应使用RNase-Free ddH2O。
(将水加入到干净的玻璃瓶中,加入DEPC至终浓度0.1%( v/v),混匀后放置过夜,高压灭菌。
)RNA得率:使用前注意事项:1 操作前在SL中加入β-巯基乙醇至终浓度5%,如475 μl SL中加入25 μl β-巯基乙醇。
此裂解液最好现用现配。
配好的SL 4 ℃可放置一个月,裂解液SL在储存时可能会形成沉淀,如果有沉淀出现,请加热溶解后使用。
2 植物组织裂解是否充分直接影响到RNA提取的质量和产量,本试剂盒中提供的裂解液SL,适用于大多数植物组织的裂解,但有些植物组织(例如玉米的乳白色胚乳,红豆种子或小麦种子)或丝状真菌,由于次级代谢产物较特殊,异硫氰酸胍使样品产生沉淀,导致RNA提取效果不佳的现象,此时可以向TIANGEN 公司免费索取另一种裂解液HL,将解决该问题。
3 第一次使用前应在漂洗液RW中加入无水乙醇,加入量请参见瓶上标签。
DNase I储存液的配制将DNase I干粉(1500 U)溶解在550 μl RNase-Free ddH2O中,轻柔混匀,分装后-20℃贮存(可保存9个月)。
植物基因组DNA提取试剂盒(CTAB粗提法)

组成:
名称 试剂(A): CTAB 抽提液 试剂(B): 蛋白清除液 试剂(C): DNA 沉淀液 试剂(D): DNA 洗涤液 试剂(E): TE buffer 使用说明书
编号
NE0205 50T
250ml 500ml 250ml 250ml 10ml
NE0205 100T 500ml
2×500ml 500ml 500ml 20ml 1份
Storage
RT 避光 RT 避光 RT RT RT
操作步骤(仅供参考):
1、 取 5ml 或适量的 CTAB 抽提液置于或其他规格的离心管中,60℃预热。 2、 称取或适量新鲜植物组织或叶片,用预冷的液氮或干冰冷却研钵或匀浆器,将新鲜植物
组织或叶片粉碎成细粉末,将冷冻的组织转移至离心管中。 3、 向粉碎后的组织中加入预热的 CTAB 抽提液,充分混匀,温育,并不时混匀。 1、 加入等体积蛋白清除液,轻轻颠倒混匀,离心,回收上层水相(即上清液,该上清液中
含有所需 DNA)。 2、 转移上清液至新的离心管中,加入体积预冷的 DNA 沉淀液,轻轻混匀,室温静置使
核酸沉至管底。如果观察不到沉淀,可在室温下静置数小时至过夜。 3、 离心,轻轻弃上清液。 4、 在松散的 DNA 沉淀物上加入 DNA 洗涤液,室温静置,离心 轻轻弃上清液。 5、 自然干燥 DNA,加入 TE buffer,-20℃保存。TE buffer 体积越大,DNA 浓度越低。
北京雷根生物技术有限公司
植物基因组 DNA 提取试剂盒(CTAB 粗提法)
简介:
Leagene 植物基因组 DNA 提取试剂盒(CTAB 粗提法)是简单快速简便的提取植物总 DNA 的试剂盒,先将新鲜植物样本研磨破碎细胞壁,加入 CTAB 抽提液使细胞膜破裂同时 将核酸与植物多糖等杂质分开。该试剂盒中 CTAB 抽提液的有效成分为 CTAB(十六烷基三 乙基溴化铵),经蛋白清除液等去除蛋白,即可获得植物基因组 DNA,可进行酶切、PCR 等下游实验。
新型植物基因组DNA快速提取试剂盒操作方法及步骤说明书
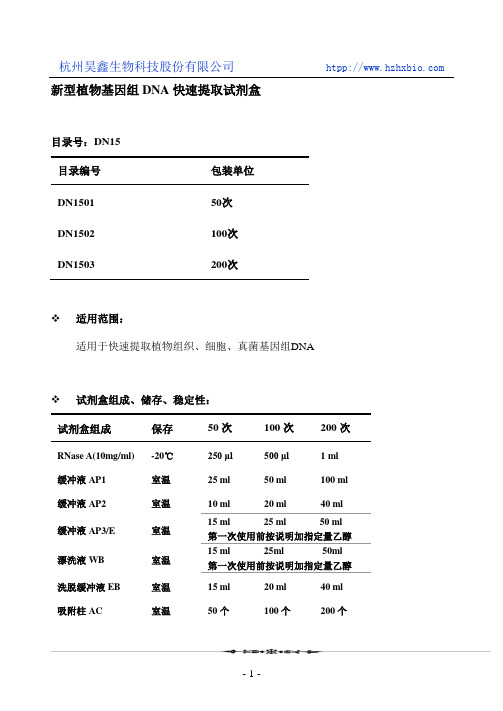
新型植物基因组DNA快速提取试剂盒目录号:DN15目录编号包装单位DN1501 50次DN1502 100次DN1503 200次适用范围:适用于快速提取植物组织、细胞、真菌基因组DNA试剂盒组成、储存、稳定性:试剂盒组成保存50次100次200次RNase A(10mg/ml) -20℃250 μl500 μl 1 ml 缓冲液AP1 室温25 ml 50 ml 100 ml 缓冲液AP2 室温10 ml 20 ml 40 ml缓冲液AP3/E 室温15 ml 25 ml 50 ml 第一次使用前按说明加指定量乙醇漂洗液WB 室温15 ml 25ml 50ml 第一次使用前按说明加指定量乙醇洗脱缓冲液EB 室温15 ml 20 ml 40 ml 吸附柱AC 室温50个100个200个收集管(2ml)室温50个100个200个本试剂盒在室温储存12个月不影响使用效果。
储存事项:1.裂解液AP1、AP3/E低温时可能出现析出和沉淀,可以在65℃水浴几分钟帮助重新溶解(AP3加入乙醇前可加热,加入乙醇后不可加热),恢复澄清透明后冷却到室温即可使用。
2.避免试剂长时间暴露于空气中产生挥发、氧化、pH值变化,各溶液使用后应及时盖紧盖子。
产品介绍:该试剂盒采用DNA吸附柱和新型独特的溶液系统,适合于从含酚类、多糖类和酶抑制物的植物样品中快速简单地提取基因组DNA。
可在30分钟内完成一个或多个100mg新鲜或20mg干燥的植物样品DNA的纯化工作。
提取过程不需要用到有毒的酚氯仿等有机物抽提,也不需要用到耗时的异丙醇或乙醇沉淀,并能快速高效地去除多糖类、酚类和酶抑制物等杂质,纯化的DNA可直接用于PCR、酶切和杂交等实验。
新鲜或干燥的植物组织(细胞)磨碎后经裂解液裂解;蛋白质、多糖、细胞残片被沉淀去除;然后基因组DNA在高离序盐状态下选择性吸附于离心柱内硅基质膜,再通过一系列快速的漂洗-离心的步骤, 进一步将多糖,多酚和细胞代谢物,蛋白等杂质去除,最后低盐的洗脱缓冲液将纯净基因组DNA从硅基质膜上洗脱。
植物基因组的提取实验一

04
实验安全措施和防护要求
实验操作应在通风橱或专业实验台上 进行,保证空气流通,减少有害气体 的危害。
对于易燃、易爆、易腐蚀的试剂和气 体,应严格按照规定存放和使用,避 免发生火灾、爆炸等安全事故。
避免直接接触化学试剂,尤其是腐蚀 性、有毒有害的试剂,应佩戴化学防 护眼镜、实验服、化学防护手套等防 护用品。
对于废弃物处理,应按照相关规定进 行分类处理,避免对环境和人体造成 危害。
实验废弃物的处理和环保要求
对于废液、废气等废弃物,应按照相关规定进行分类 处理,避免对环境和人体造成危害。
输标02入题
对于废液的处理,应按照废液的性质进行分类收集, 采用适当的方法进行中和、沉淀、氧化等处理,确保 废液达标排放。
01
03
对于实验过程中产生的固体废弃物,应按照废弃物的 性质进行分类收集,采用适当的方法进行焚烧、填埋
等处理,确保固体废弃物得到妥善处理。
04
对于废气的处理,应采用活性炭吸附、水洗等方法进 行处理,确保废气达标排放。
THANKS
感谢观看
破碎细胞
分离和收集
将破碎后的细胞碎片进行分离,收集 释放出来的基因组DNA。
通过破碎方法将植物细胞破碎,使基 因组DNA释放出来。
基因组的纯化和洗涤
01
02
03
去除杂质
通过离心、沉淀等方法去 除基因组中的杂质,如蛋 白质、多糖等。
洗涤和纯化
使用适当的洗涤剂和纯化 试剂对基因组进行洗涤和 纯化,进一步去除杂质和 提高基因组的纯度。
方法三
通过比较基因组学的方法,将目标植物基 因组与其他已知基因组进行比对,寻找基 因组的保守区域和变异区域。
实验结论和讨论
CTAB植物基因组DNA快速提取试剂盒操作方法及步骤说明书
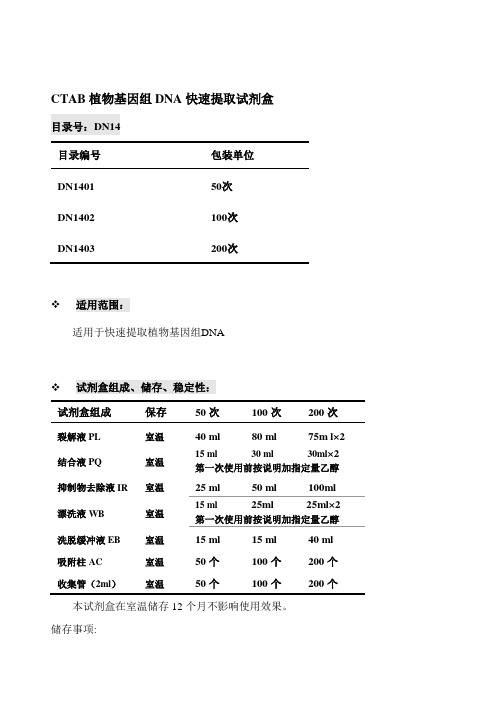
CTAB植物基因组DNA快速提取试剂盒目录号:DN14目录编号包装单位DN1401 50次DN1402 100次DN1403 200次❖适用范围:适用于快速提取植物基因组DNA❖试剂盒组成、储存、稳定性:试剂盒组成保存50次100次200次裂解液PL 室温40 ml80 ml 75m l×2结合液PQ 室温15 ml 30 ml 30ml×2第一次使用前按说明加指定量乙醇抑制物去除液IR 室温25 ml 50 ml 100ml漂洗液WB 室温15 ml 25ml 25ml×2第一次使用前按说明加指定量乙醇洗脱缓冲液EB 室温15 ml 15 ml 40 ml 吸附柱AC 室温50个100个200个收集管(2ml)室温50个100个200个本试剂盒在室温储存12个月不影响使用效果。
储存事项:1.裂解液PL、或者抑制物去除液IR低温时可能出现析出和沉淀,可以在55℃水浴几分钟帮助重新溶解,恢复澄清透明后冷却到室温即可使用。
结合液PQ盐酸胍浓度高,加入乙醇后可能出现一些沉淀不影响使用,直接取上清用。
2.避免试剂长时间暴露于空气中产生挥发、氧化、pH值变化,各溶液使用后应及时盖紧盖子。
❖产品介绍:改进的经典CTAB植物DNA抽提液内(添加多种针对植物特点的多糖、多酚去除成份)迅速裂解细胞和灭活细胞内核酸酶,氯仿抽提后通过离心清除多糖、多酚和蛋白质(根据需要,上清中还加入异丙醇离心沉淀基因组DNA,进一步去除其它各种杂质),然后基因组DNA在高离序盐状态下选择性吸附于离心柱内硅基质膜,再通过一系列快速的漂洗-离心的步骤,进一步将多糖、多酚和细胞代谢物、蛋白等杂质去除,最后低盐的洗脱缓冲液将纯净基因组DNA从硅基质膜上洗脱。
❖产品特点:1.离心吸附柱内硅基质膜全部采用进口特制吸附膜,柱与柱之间吸附量差异极小,可重复性好。
克服了国产试剂盒膜质量不稳定的弊端。
2.不需要使用有毒的苯酚等试剂,也不需要乙醇沉淀等步骤。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
植物基因组D N A提取试剂盒(北京天根)
植物基因组DNA提取试剂盒
1 取植物新鲜组织约100 mg或干重组织约30 mg,加入液氮充分研磨。
2 将研磨好的粉末迅速转移到预先装有700 μL 65℃预热缓冲液GP1的离心管中(实验前在预热的GP1中加入巯基乙醇,使其终浓度为0.1%),迅速颠倒混匀后,将离心管放在65℃水浴20 min,水浴过程中颠倒离心管以混合样品数次。
3 加入700 μL氯仿,充分混匀,12,000 rpm(~13,400×g)离心5 min。
注:若提取富含多酚或淀粉的植物组织,可在第3步前,用酚:氯仿/1:1进行等体积抽提。
4 小心的将上一步所得水层上相转入一个新的离心管中,加入700 μL缓冲液GP2,充分混匀。
5 将混匀的液体转入吸附柱CB3中,12,000 rpm(~13,400×g)离心30 s,弃掉废液。
(吸附柱容积为700μL左右,可分次加入离心。
)
6 向吸附柱CB3中加入500 μL缓冲液GD(使用前请先检查是否已加入无水乙醇),12,000 rpm(~13,400×g)离心30 s,倒掉废液,将吸附柱CB3放入收集管中。
7 向吸附柱CB3中加入600 μL漂洗液PW(使用前请先检查是否已加入无水乙醇),12,000 rpm(~13,400×g)离心30 s,倒掉废液,将吸附柱CB3放入收集管中。
8 重复操作步骤7。
9 将吸附柱CB3放回收集管中,12,000 rpm(~13,400×g)离心2 min,倒掉废液。
将吸附柱CB3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂
洗液。
注意:这一步的目的是将吸附柱中残余的漂洗液去除,漂洗液中的乙醇的残留会影响后续的酶反应(酶切、PCR等)实验。
10 将吸附柱CB3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50-200 μL洗脱缓冲液TE,室温放置2-5 min,12,000 rpm(~13,400×g)离心2 min,将溶液收集到离心管中。
注意:洗脱缓冲液体积不应少于50 μL,体积过小影响回收率。
洗脱液的PH值对于洗脱效率有很大影响。
若用水做洗脱液应保证其pH值在7.0-8.5范围内(可以用NaOH将水的pH值调到此范围),pH值低于7.0会降低洗脱效率;且DNA产物应保存在-20℃,以防DNA降解。
为增加基因组DNA的得率,可将离心得到的溶液再加入吸附柱CB3中,室温放置2 min,12,000 rpm (~13,400×g)离心2 min。
