第八讲吸附等温方程式(BET吸附).
BET的原理及使用方法

BET的原理及使用方法BET(Brunauer-Emmett-Teller)是一种常用的表征吸附物理性质的方法,它可以用来测量固体表面的比表面积。
本文将介绍BET原理及其使用方法。
BET原理:BET原理是基于吸附等温线为Langmuir等温线的假设,该假设认为吸附在固体表面上的分子是均匀分布的,且各个吸附位点之间没有相互作用。
基于这个假设,BET理论推导出了吸附等温线的表达式。
吸附等温线描述了在固体表面吸附分子的吸附量与相对气相压力的关系。
通常,BET等温线可以近似为一个H型曲线,即在低压下,吸附量随着压力的升高而增加,直至达到一个饱和吸附量,然后吸附量在较高压力下逐渐减小。
根据BET理论,可以通过测量不同相对气相压力下吸附量的变化来确定固体的比表面积。
BET使用方法:BET方法主要包括以下几个步骤:1.准备样品:将待测固体样品研磨成细粉末,然后通过烘干或者其他方法将样品中的水分等挥发性物质去除。
2.选择适当的吸附剂:通常,选择与待测样品相互作用较弱的气体作为吸附剂,例如氮气。
吸附剂的选择应该考虑到其与样品的化学性质以及实验条件。
3.测量吸附等温线:使用气体吸附仪器,例如比表面积分析仪,对样品进行吸附等温线测量。
实验过程中需要控制气体的流速、温度和压力,并进行相应的记录。
4.数据处理:将吸附等温线中的吸附量和相对气相压力的数据转化为BET等式的形式。
5.拟合曲线:根据BET等式,使用非线性拟合技术将实验数据拟合为BET等式,从而得到比表面积的数值。
需要注意的是,BET方法适用于固体样品的比表面积大于10平方米/克的情况。
对于具有较小比表面积的样品,可以考虑使用其他表征方法,如X射线衍射。
BET方法的应用:BET方法广泛应用于材料科学、化学工程、环境科学和生物科学等领域。
其中一些典型的应用包括:1.反应催化剂的性能评价:固体催化剂的催化活性与其表面积密切相关,通过BET方法可以评估催化剂的比表面积从而预测其催化性能。
第八讲 吸附等温方程式(BET吸附)

四、吸附等温方程式
p / p0 根据实验数据用 对 p / p0 做图, V (1 p / p0 )
若得直线,则说明该吸附规律符合BET公式,且通过
直线的斜率和截距便可计算出二常数Vm和C。
若吸附发生在多孔物质上,吸附层数就要受到限制,
设只有n 层,于是:
V Vm
C i xi
i 1
这说明x就是相对压力(即 x = p/p0)。将 x = p/p0代入,得到
V
Vm Cp ( p0 p )[1 (C 1) p / p0 ]
这就是著名的BET二常数公式。 Vm——表面盖满一个单分子层时的饱和吸附量,mL/g; C——常数。
四、吸附等温方程式
a1b2 Q1 QL C a b exp RT 2 1
(2)第二层及以后各层的吸附热都一样,而且等于液化热QL。
以S0、S1,S2…Si分别表示被0,1,2…i层分子所覆盖
的面积,如下图所示:
多分子层吸附示意图
则,S0=3个位置 S1=3个,S2=2个,S3=1个,S4=0个,S5=1个。
四、吸附等温方程式
达到平衡时,各种分子层覆盖的面积保持一定。例如,从空白 面积S0来看,吸附到S0上的速度要和S1层脱附的速度相等,在这种
p 2VL cos ln p0 rRT
pr,p0 ——与弯月液面、平液面平衡的蒸气压;VL ——液体的摩尔体积;
——液体的表面张力;
——润湿角(接触角)。
五、毛细凝聚现象
但是不管是否发生毛细凝聚,固体表面与蒸气共存时,
表面总会因吸附蒸气而形成吸附膜,在毛细孔壁上也一样,
也就是说,毛细凝聚是发生在吸附膜这个基础上的,据此 上式应修正为:
langmuir吸附等温式公式推导

langmuir吸附等温式公式推导20世纪20年代,美国物理学家伦纳德.兰姆瑞尔(Irving Langmuir)提出了一种称为吸附等温式公式(Langmuir Adsorption Isotherm)的理论模型,以描述吸附-脱附过程中表面上发生的各种反应。
该理论建立在可结合的颗粒的可逆吸附部分,以及吸附现象的等温性质。
它表明,当吸附颗粒呈等温状态时,它们与表面之间的能量变化将沿着固定的轨迹发生变化。
兰姆瑞尔(Langmuir)吸附等温式公式就是用来描述表面吸附现象的公式,以此可研究吸附反应的活性度。
该公式的表达式如下:质量平衡方程:q=Qmax.Ce^(Kq/RT)其中,Qmax代表最大吸附量,C为质量浓度,Kq为Langmuir吸附能常数,R为气体常数,T为温度。
由此可推导出:ln(q/Qmax)=Kq/RT-lnC此式即为兰姆瑞尔(Langmuir)吸附等温式公式,也称为兰姆瑞尔吸附平衡,它反映了吸附反应活性与温度、活性物质浓度等因素之间的关系。
兰姆瑞尔(Langmuir)吸附等温式公式主要用于解释吸附过程,即描述吸附物质在溶液或气体阶段中,通过自由结合与分散体之间的热力学过程而吸附到溶液或气体表面的能量变化情况。
从而与其他技术相结合,研究吸附现象的原因、机理和结果。
其他的吸附理论与模型,如Freundlich吸附模型、Gibbs共沉降模型,以及活性吸附模型,通常都是建立在兰姆瑞尔(Langmuir)吸附等温式公式的基础上的。
在工业应用中,兰姆瑞尔(Langmuir)吸附等温式公式可用于研究各种气体和液体系统吸附行为。
如膜过滤、膜分离等等,可广泛应用于环境工程、冶金工业等领域。
兰姆瑞尔(Langmuir)吸附等温式公式是水文学中的一种常用工具,它可以帮助研究者研究土壤水分贮存模式及其变化,以及水汽和热量贮存和渗透规律,对土壤水文学和气候研究具有重要意义。
综上所述,兰姆瑞尔(Langmuir)吸附等温式公式是一种用于描述吸附反应的等温关系式,它反映了吸附反应活性与温度、活性物质浓度等因素之间的改变关系。
吸附等温式

1 log P n
附均适 用
Freundlich等温式
从吸附速率计算Ea
Ea
RT
2
ln ra T
ra
d
dt
或
dV dt
,从实验求
Ea
2.303 RT1T2
T2 T1
lg ra2 lg ra1
测在二个T达到相同吸附量时的ra1和ra2,即得Ea
(1)、(2)称Elovich吸附和脱附速率公式 只讨论吸附,把P≈常数处理
d
dt
ka Peg / RT
aeg / RT
(3)
a为 = 0的吸附速率,即起始
eg / RT d
tadt0Fra bibliotek0 d
dt 0
RT eg / RT 1 at
斜率和截距∝T
吸附动力学
研究化学吸附和脱附的速率以及各种因素对它们的影响
意义
1、如果多相催化反应中反应物的吸附或产物的脱附是一系列 步骤中速率最慢的一步,那么如果知道哪些因素影响吸附或 脱附速率,就可得出机理性的反应速率方程 2、获得吸附和脱附速率的基本方程,得到上述三种等温式 3、将过渡态理论用于研究化学吸附和脱附速率,可从分子的 性质和一些基本常数来估算速率的大小,从而使我们对吸附 和脱附的机理有较为本质的了解
RT
ln
P
q0
Aln
1
ln
BP
A
RT
,ln
B
ln
b0
q0 RT
在一定T,A、B为常数
langmuir吸附等温式与bet吸附等温式的异同

Langmuir吸附等温式和BET吸附等温式都是描述气体或液体分子在固体表面上吸附的模型,但它们之间存在着一些明显的异同。
下面,我将从深度和广度的角度来探讨这两种吸附等温式的异同,并根据你的要求,以序号标注的方式呈现。
1. 定义和原理Langmuir吸附等温式是由Irving Langmuir提出的吸附理论,它假设吸附分子只能吸附在固体表面上的特定位置,且吸附分子之间不存在相互作用。
这种模型适用于单分子层吸附,通常用于描述表面活性剂和气体在固体表面上的吸附过程。
而BET吸附等温式则由Brunauer、Emmett和Teller共同提出,适用于多层吸附的情况。
相比Langmuir模型,BET模型考虑了多层吸附和吸附分子之间相互作用的影响,更贴近实际吸附过程的情况。
2. 参数和公式Langmuir吸附等温式的公式为:\[ \frac{q_{e}}{C_{e}} =\frac{{q_{\text{max}}K_{\text{L}}C_{e}}}{{1+K_{\text{L}}C_{e}}} \]其中,qe表示单位质量吸附剂上吸附的物质量,Ce表示在平衡时的吸附剂上物质的浓度,qmax为最大吸附量,KL为Langmuir常数。
而BET吸附等温式的公式则为:\[ \frac{1}{q_e(1-C_e)} = \frac{1}{q_m(1-C_e)} - \frac{C_e}{q_mB_0} \]其中,qe表示单位质量吸附剂上吸附的物质量,Ce表示在平衡时的吸附剂上物质的浓度,qm为吸附量最大值,B0为BET常数。
可以看出,Langmuir和BET模型的公式形式和参数设定有一定的区别,分别适用于单分子层吸附和多层吸附的情况。
3. 实验数据拟合在实际应用中,Langmuir和BET模型常常用于拟合吸附实验数据,以获得吸附等温线和吸附量等相关参数。
针对单分子层吸附的情况,Langmuir模型通常能够较好地拟合实验数据,给出较为准确的吸附量预测。
bet等温式属于五种吸附等温线中的类型

在研究物理化学领域时,我们经常会遇到各种吸附等温线类型的分类。
其中,bet等温式作为五种吸附等温线中的一种类型,具有其独特的特点和应用。
本文将深入探讨bet等温式的定义、特性和应用,并从不同角度进行全面评估,以便更好地理解这一主题。
一、bet等温式的定义bet等温式是由布鲁诺·保罗·贝特在1938年提出的吸附等温线类型之一。
它描述的是气体或液体在固体表面上的吸附情况,通常用来研究大面积吸附体系。
bet等温式的基本假设是固体表面上存在两种吸附位点,即吸附作用较弱的类型Ⅰ位点和吸附作用较强的类型Ⅱ位点。
根据这一假设,bet等温式能够较好地描述气体或液体在固体表面上的吸附行为。
二、bet等温式的特性1. 双层吸附:bet等温式假设固体表面上存在两种吸附位点,这导致了双层吸附的现象。
在低覆盖度下,气体或液体分子首先吸附在类型Ⅰ位点,形成单层吸附层;随着覆盖度的增加,分子继续吸附在类型Ⅱ位点,形成第二层吸附层。
这种双层吸附的特性是bet等温式的重要特点之一。
2. 吸附热:bet等温式可以通过吸附热来描述吸附过程中的能量变化。
根据bet等温式的理论,吸附热随着覆盖度的增加而减小,这与吸附类型Ⅰ位点和Ⅱ位点的吸附能力有关。
这种特性在实际应用中具有一定的意义,可以帮助我们更好地理解和控制吸附过程。
3. 吸附平衡:bet等温式还可以描述气体或液体在固体表面上的吸附平衡状态。
通过研究吸附等温线,我们可以了解吸附系统在不同温度、压力下的平衡状态,从而为工业生产和环境保护提供重要的参考依据。
三、bet等温式的应用1. 气体吸附分离:利用bet等温式的双层吸附特性,可以设计并优化气体吸附分离过程。
在石油化工行业中,通过合理选择吸附剂和操作条件,可以实现二氧化碳和甲烷等气体的有效分离和提纯。
2. 表面积测定:bet等温式广泛应用于固体材料的比表面积测定。
通过建立吸附等温线模型,可以准确地计算固体材料的比表面积,为材料表征和性能评价提供重要依据。
bet吸附等温线回滞环

bet吸附等温线回滞环
吸附等温线回滞环是指在吸附过程中,当吸附剂上的吸附物质浓度随着压力或浓度的变化而变化时,出现的吸附量随着压力或浓度的升高而先增加后减少的现象。
这种现象在等温条件下观察到,通常在吸附等温线上表现为闭合的环状结构,因此被称为吸附等温线回滞环。
从物理化学的角度来看,吸附等温线回滞环的出现是由于吸附剂表面上的吸附位点之间的相互作用导致的。
当吸附物质的浓度或压力增加时,开始占据吸附位点,使得吸附量增加。
然而,随着吸附位点的逐渐饱和,吸附速率减慢,最终导致吸附量不再随着浓度或压力的增加而继续增加,甚至开始减少,形成回滞环。
在工程和应用方面,吸附等温线回滞环的观察对于评估吸附剂的性能和选择适当的操作条件非常重要。
通过分析吸附等温线回滞环的形状和位置,可以了解吸附过程中的吸附动力学特征,如吸附速率、平衡吸附量等信息。
这对于优化吸附工艺、设计吸附设备以及预测吸附过程中的吸附量变化都具有指导意义。
总的来说,吸附等温线回滞环是吸附过程中的重要现象,对于
理解吸附动力学和优化工艺具有重要意义,需要通过实验和理论分析来全面理解其特性和影响因素。
BET方程的推导公式及运用

……(8)
……(9)
这就等于说第二层及以后各层中分子的蒸发-凝聚性质与其液体一样。也就 是说,BET将第二层及以后各层看成是液体。这是一种合理的近似,因为 自第二层起分子只与同类的分子接触,类似于液体的情形。
令
a1 E1 / RT y Pe b 1
P El / RT x e g
……(16)
若如在饱和蒸气压下吸附时,气体发生液化,表面的吸附 量是无限的。这样在P PO时,为了使V ∞,等式中的 分母趋于零,即x=1,就是:
于是:
P0 g
E1 / RT e 1
……(17)
P x P0
所以x就是此压。 将(18)式代人(16)式得:
……(18)
N A am S A s M 10 20
(m2〃g-1) ……(5)
式中:NA 为阿伏加德罗常数;M为被吸附气体的摩尔质量; sA 为被吸附气体分子的横截面积。 爱曼特和布鲁纳尔假定被吸附的吸附质在固体表面具有它在 液体或固体时的密度,并且每个门子同几个紧邻分子堆砌 在一起,于是对吸附质分子的截面积可按式求出
本实验所用重量法测量原理:吸附剂吸附气体(或蒸汽)后的增量 引起悬吊吸附剂样品的石英弹簧伸长,利用测高仪测量伸长来测量 吸附量a的变化。设石英弹簧在空载时吊篮所处的高度为h0 ;加上吸 附剂并经过脱气后的高度为h1 ;吸附平衡时的高度为h2 ,根据虎克 定律,平衡时吸附量a可表示为
K h2 h1 a K h1 h0
VmCP V P0 P 1 c 1P / P0
……(19)
固体比表面的测定 (BET重量法)
气相吸附重量法是建立在BET多分子层吸附理论基础上的一种测定 多孔物质比表面的方法,常用的BET二常数公式为
(完整word版)BET吸附-脱附曲线分析及含义

气体吸附等温线通常分为六种,其中五种(I-V)是由国际理论与应用化学会(IUPAC)所定义的。
I型等温线表示在低的相对压力(平衡蒸汽压与饱和蒸汽压的比值)时,材料具有很强的吸附能力进而达到平衡。
I型等温线通常被认为是在微孔或者单层吸附的标志,由于强的吸附作用。
(这可能也有化学吸附的作用,涉及到在吸附质与吸附剂表面的化学键作用,这里我们不讨论化学吸附)值得注意的是,孔的大小是根据他们的直径(或宽度)来进行分类的:微孔(小于2nm),中孔(2-50nm),大孔(大于50nm).鉴于大多数多孔固体是使用非极性气体(N2 Ar)进行吸附研究的,所以不太可能出现化学吸附作用。
因此,对于I型等温线的经典解释是材料具有微孔。
然而,I型等温线也有可能是具有孔径尺寸非常接近微孔的介孔材料.尤其是N2在77K 或者Ar在77K和87K圆柱孔情况下,I型等温线将在较低的相对压力(大约0.1作用)下达到平衡对于材料是微孔,从最近的一些报道结果得出的。
因此,当I型等温线没有在相对压力0.1处达到平衡,该材料有可能存在大量的中孔或者就是单独的中孔。
然而,这种I型分布有可能在某种程度上介孔孔径分布范围变宽。
这是因为分布高度均匀圆柱孔的材料可能展示出在相对压力低于0。
1或者更小时,可以在吸附等温线被识别(因此,这些等温线可以被分类成IV型等温线,下面我们会讨论)。
尽管,接近饱和蒸汽压的多层可能会十分不连续,但大孔材料大多是通过随着相对压力增加时,吸附量逐渐地增加的方式进行多层吸附。
这种不受限制的多层形成过产生了II型和III型等温线。
在这种情况下,吸附-脱附曲线重合;也就是说,没有发生滞后现象。
这主要取决于所测试的材料的性质,II型等温线是单层形成的明显特征,否则是在整个压力范围内都是凸起的III型等温线。
后者的行为可以观察到在吸附分子与吸附剂表面和被吸附物作比较时,吸附分子之间的作用是强相互作用。
在介孔材料多层吸附过程中,常常伴随有毛细管冷凝现象发生(IV和V型等温线)。
第8讲吸附等温方程式

四、吸附等温方程式
根据实验数据用
对
做图,
若得直线,则说明该吸附规律符合BET公式,且通过
直线的斜率和截距便可计算出二常数Vm和C。
若吸附发生在多孔物质上,吸附层数就要受到限制,
设只有n 层,于是:
四、吸附等温方程式
上式中有三个常数,因此称为BET三常数公式,当 n =1时,BET演变为Langmuir单分子吸附方程式。
四、吸附等温方程式
第Ⅱ类等温线的例子十分普通,例如许多固体在低温下 吸附N2、Ar、O2、CO等气体。第Ⅲ类等温线现象不常遇到, 最常见的水在炭黑上的吸附,这是因为水分子之间能形成比 较强烈的氢键,故表面一旦吸附了水分子,第二、三…层就 很易形成,较大的非极性有机蒸气分子在极性吸附剂上也常 得第Ⅲ类等温线,这可能与有机分子存在较大的Vander waals 引力有关。
若液体完全润湿孔壁,即θ=0°,cosθ=1,写成:
和
五、毛细凝聚现象
设孔都是一端开口半径为r的圆筒,r 的大小在中孔范围。因此,可以 应用kelvin公式,这样所得的吸附等温式如图所示:
存在毛细管凝聚时的等温线情形
图因中孔A的B线大代小表是低一压样下的的,吸故附在,可p处以等用温La线ng沿muBirC公垂式直或上BE升T公;式在表C示处 。毛通细常图孔认都中为被C在D填段A满B包区到括固图孔体中中的的微由弯孔a经月(如b面至果a有变处的平。话时因)将所θ=被增0°吸加,附的分故凝子a聚处填液的满体曲。,率当以压半及力径 达为到(r-pt’)时。,压发力生继了续毛升细高凝,聚弯现月象,面这的时曲与率p将与r降的低关(系图按中k虚elv线in公所式示处),理p。r =正p常0时情,况弯全月部面外的表曲压率力为因0由,p即’增平加面至。p0而引起的吸附量的增量。
第8讲--吸附等温方程式(BET吸附)

V
Vm Cp
( p0 p)[1 (C 1) p / p0 ]
这就是著名的BET二常数公式。 Vm——表面盖满一个单分子层时的饱和吸附量,mL/g; C——常数。
四、吸附等温方程式
C
a1b2 a2b1
exp
Q1 QL RT
从a,b的性质来看, a1b2 a2b1 ,所以
以S0、S1,S2…Si分别表示被0,1,2…i层分子所覆盖 的面积,如下图所示:
多分子层吸附示意图
则,S0=3个位置 S1=3个,S2=2个,S3=1个,S4=0个,S5=1个。
四、吸附等温方程式
达到平衡时,各种分子层覆盖的面积保持一定。例如,从空白 面积S0来看,吸附到S0上的速度要和S1层脱附的速度相等,在这种 动平衡下,空白面积保持不变。
C ixi
V
Vm
i 1
1 C
xi
i 1
xi x1 x2
x
因
i 1
1 x
i 1
ixi
x
d dx
i 1
xi
x (1 x)2
所以
V Vm
1
Cx
x1 x Cx
因为原假设在固体表面上的吸附层可以无限多,所以吸附量
所谓毛细凝聚现象是指液体蒸气在小于其饱和蒸气 压时而在固体毛细中发生液化而吸附的现象。前面讲过 kelvin公式,对于一端开口的半径为 r 的筒形毛细孔:
ln p 2VL cos
p0
rRT
pr,p0 ——与弯月液面、平液面平衡的蒸气压;VL ——液体的摩尔体积;
brunauer-emmett-teller(bet)方程_解释说明

brunauer-emmett-teller(bet)方程解释说明1. 引言1.1 概述在材料科学研究领域,吸附等温线是一种常用的表征物质吸附特性的方法。
Brunauer-Emmett-Teller(BET)方程是描述气体在固体表面上吸附行为的重要工具。
它被广泛应用于各个领域,如催化剂设计、环境污染控制和纳米材料开发等。
1.2 文章结构本文将首先介绍Brunauer-Emmett-Teller(BET)方程的基本概念和原理解释,然后讨论其在不同应用领域中的实际应用情况。
接着,我们将详细解析BET方程中的三个关键要点,包括BET等温吸附曲线的特征、分析方法以及参数与物理意义。
最后,通过一个实例探讨和案例分析,我们将展示如何设计实验、收集数据并进行数据分析和结果解释。
最后,在结论与展望部分,我们将总结研究成果,并提出存在的局限性及改进方向以及对未来研究的启示和建议。
1.3 目的本文旨在全面介绍Brunauer-Emmett-Teller(BET)方程,并深入探讨其在材料科学研究中的应用。
通过详细解析BET方程的特征、分析方法以及参数的物理意义,读者将能够更好地理解和运用该方程,进而在各自的研究领域中进行相关实验和数据分析。
同时,通过案例分析和实例探讨,读者还可以学习如何应用BET方程来解释实验结果,并获得结论与展望部分中提供的关于未来研究的启示与建议。
2. Brunauer-Emmett-Teller(BET)方程:2.1 简介:Brunauer-Emmett-Teller(BET)方程是用于描述吸附等温线的一种常用方法。
该方程最初由Stephen Brunauer、Paul Hugh Emmett和Edward Teller在1938年提出,因此得名。
BET方程基于分子吸附理论,可用于研究气体或液体分子在固体表面上的吸附行为。
2.2 原理解释:BET方程的核心原理是假设多层分子吸附均匀地覆盖在互相平行且均匀间隔的单层分子上。
BET的原理及使用方法

有一些物系(例如氮在各种聚合物上的吸附)出现逐渐弯曲的等温线,没有可识别的B点.在这
种情况下吸附剂和吸附质的相互作用是比较弱的。
Ⅳ型等温线:
低P/P0 区曲线凸向上,与Ⅱ型等温线类似。在较高P/P0区,吸附质发生毛细管凝聚,等温
线迅速上升。当所有孔均发生凝聚后,吸附只在远小于内表面积的外表面上发生,曲线平坦。
积。下图为:显示B点的II型典型等温线
(4)单点法
氮吸附时C常数一般都在50-300之间,所以在BET作图时截距常常很小。因此在比
较粗略的计算中可忽略,即把P/P0在0.20—0.25左右的一个实验点和原点相连,由它的
斜率的倒数计算Vm值,再求算比表面积
3.V-t作图法求算比表面
计算比表面积还可以用经验的厚层法(即t-Plot法)。此法在一些情况下可以分别求出不同尺寸
附等温线的测定范围内,达到吸附平衡后残留在死空间中的未被吸附的氪气量变化就会很大,可以
测得准确,因此氪气适合于低比表面固体的测定。
5.活性表面积的测定
BET法测定的是吸附剂总表面积,而通常是其中的一部分才有活性,这部分叫活性表面,可采
用“选择性化学吸附”方法测定活性表面的面积,如表面氢氧滴定方法。
许多高比表面积的吸附状是孔状的,对于这样的物质经常要区分外表面和内表面。外表面是指
独立颗粒或结块的外 围面积。但因为在原子尺度上,固体的表面很少是光滑的,因此要准确定义
是有困难的。一般约定为:外表面包括所有突出物以及那些宽度大于深度的裂缝的表面。 内表面
为所有深度大于宽度的裂缝、孔、洞的 壁。
7. 为孔体积、孔面积对孔半径的平均变化率与孔半径的关系,也有表示成孔分
脱附速率rd∝θ rd=kdθ
BET方程及其吸附线类型

催化原理作业题目:BET方程专业:指导教师:学生姓名:班级-学号:2015年9 月大连工业大学催化原理BET方程BET Equation作业完成日期2015 年9月7 日学院:轻工与化学工程学院专业:化学工程与技术学生姓名:班级学号:指导教师:评阅教师:2015 年9 月摘要S.Brunauer(布鲁尼尔)、P.Emmett(埃密特)和E.Teller(特勒)于1938年提出的BET多分子层吸附理论,其表达方程即BET方程,推导所采用的模型的基本假设是:一、固体表面是均匀的,发生多层吸附;二、除第一层的吸附热外其余各层的吸附热等于吸附质的液化热。
推导有热力学角度和动力学角度两种方法,均以此假设为基础。
本文主要介绍了BET方程的推导过程以及吸附测量比表面积的吸附等温线的类型和特征。
关键词:BET方程;比表面积;吸附等温线类型AbstractS.Brunauer (bruneel) P.Emmett (Emmett) and E.Teller (teller) in 1938 the bet multi molecular layer adsorption theory, the equations expressing the bet equation, the basic assumption of the derivation of the model is:, solid surface is uniform, the multilayer adsorption; second, in addition to the heat of adsorption of the first layer and other layers adsorption heat is equal to the adsorption heat of liquefaction. The two methods are based on the theory of thermodynamics and dynamics. This paper mainly introduces the derivation of the BET equation and the type and characteristics of the adsorption isotherm of the surface area.Key Words:BET equation; specific surface area; adsorption isotherm type目录摘要 (I)Abstract ..................................................................................................................... I I 第一章绪论. (1)1.1 BET方程简述 (1)1.1.1 BET理论 (1)1.1.2 BET方程的两个假定 (1)1.2 BET方程 (1)1.3 BET方程推导 (2)第二章BET比表面积 (4)2.1 比表面积 (4)2.2 BET比表面积原理公式 (4)2.3 吸附线类型 (5)在此处键入公式。
BET吸附-脱附曲线分析及含义
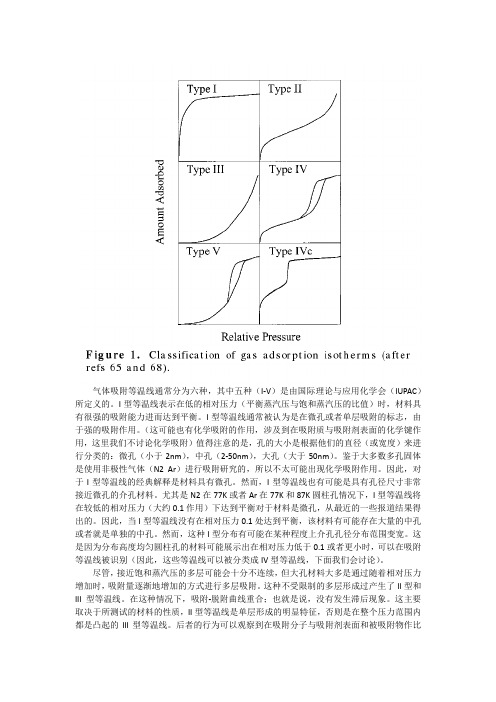
气体吸附等温线通常分为六种,其中五种(I-V)是由国际理论与应用化学会(IUPAC)所定义的。
I型等温线表示在低的相对压力(平衡蒸汽压与饱和蒸汽压的比值)时,材料具有很强的吸附能力进而达到平衡。
I型等温线通常被认为是在微孔或者单层吸附的标志,由于强的吸附作用。
(这可能也有化学吸附的作用,涉及到在吸附质与吸附剂表面的化学键作用,这里我们不讨论化学吸附)值得注意的是,孔的大小是根据他们的直径(或宽度)来进行分类的:微孔(小于2nm),中孔(2-50nm),大孔(大于50nm)。
鉴于大多数多孔固体是使用非极性气体(N2 Ar)进行吸附研究的,所以不太可能出现化学吸附作用。
因此,对于I型等温线的经典解释是材料具有微孔。
然而,I型等温线也有可能是具有孔径尺寸非常接近微孔的介孔材料。
尤其是N2在77K或者Ar在77K和87K圆柱孔情况下,I型等温线将在较低的相对压力(大约0.1作用)下达到平衡对于材料是微孔,从最近的一些报道结果得出的。
因此,当I型等温线没有在相对压力0.1处达到平衡,该材料有可能存在大量的中孔或者就是单独的中孔。
然而,这种I型分布有可能在某种程度上介孔孔径分布范围变宽。
这是因为分布高度均匀圆柱孔的材料可能展示出在相对压力低于0.1或者更小时,可以在吸附等温线被识别(因此,这些等温线可以被分类成IV型等温线,下面我们会讨论)。
尽管,接近饱和蒸汽压的多层可能会十分不连续,但大孔材料大多是通过随着相对压力增加时,吸附量逐渐地增加的方式进行多层吸附。
这种不受限制的多层形成过产生了II型和III型等温线。
在这种情况下,吸附-脱附曲线重合;也就是说,没有发生滞后现象。
这主要取决于所测试的材料的性质,II型等温线是单层形成的明显特征,否则是在整个压力范围内都是凸起的III型等温线。
后者的行为可以观察到在吸附分子与吸附剂表面和被吸附物作比较时,吸附分子之间的作用是强相互作用。
在介孔材料多层吸附过程中,常常伴随有毛细管冷凝现象发生(IV和V型等温线)。
BET吸附-脱附曲线分析及含义

气体吸附等温线通常分为六种,其中五种(I-V)是由国际理论与应用化学会(IUPAC)所定义的。
I型等温线表示在低的相对压力(平衡蒸汽压与饱和蒸汽压的比值)时,材料具有很强的吸附能力进而达到平衡。
I型等温线通常被认为是在微孔或者单层吸附的标志,由于强的吸附作用。
(这可能也有化学吸附的作用,涉及到在吸附质与吸附剂表面的化学键作用,这里我们不讨论化学吸附)值得注意的是,孔的大小是根据他们的直径(或宽度)来进行分类的:微孔(小于2nm),中孔(2-50nm),大孔(大于50nm)。
鉴于大多数多孔固体是使用非极性气体(N2 Ar)进行吸附研究的,所以不太可能出现化学吸附作用。
因此,对于I型等温线的经典解释是材料具有微孔。
然而,I型等温线也有可能是具有孔径尺寸非常接近微孔的介孔材料。
尤其是N2在77K或者Ar在77K和87K圆柱孔情况下,I型等温线将在较低的相对压力(大约0.1作用)下达到平衡对于材料是微孔,从最近的一些报道结果得出的。
因此,当I型等温线没有在相对压力0.1处达到平衡,该材料有可能存在大量的中孔或者就是单独的中孔。
然而,这种I型分布有可能在某种程度上介孔孔径分布范围变宽。
这是因为分布高度均匀圆柱孔的材料可能展示出在相对压力低于0.1或者更小时,可以在吸附等温线被识别(因此,这些等温线可以被分类成IV型等温线,下面我们会讨论)。
尽管,接近饱和蒸汽压的多层可能会十分不连续,但大孔材料大多是通过随着相对压力增加时,吸附量逐渐地增加的方式进行多层吸附。
这种不受限制的多层形成过产生了II型和III型等温线。
在这种情况下,吸附-脱附曲线重合;也就是说,没有发生滞后现象。
这主要取决于所测试的材料的性质,II型等温线是单层形成的明显特征,否则是在整个压力范围内都是凸起的III型等温线。
后者的行为可以观察到在吸附分子与吸附剂表面和被吸附物作比较时,吸附分子之间的作用是强相互作用。
在介孔材料多层吸附过程中,常常伴随有毛细管冷凝现象发生(IV和V型等温线)。
BET吸附-脱附曲线分析及含义
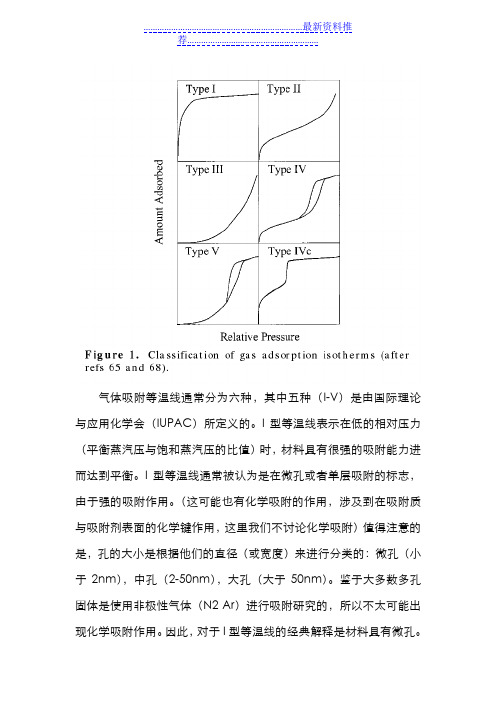
气体吸附等温线通常分为六种,其中五种(I-V)是由国际理论与应用化学会(IUPAC)所定义的。
I型等温线表示在低的相对压力(平衡蒸汽压与饱和蒸汽压的比值)时,材料具有很强的吸附能力进而达到平衡。
I型等温线通常被认为是在微孔或者单层吸附的标志,由于强的吸附作用。
(这可能也有化学吸附的作用,涉及到在吸附质与吸附剂表面的化学键作用,这里我们不讨论化学吸附)值得注意的是,孔的大小是根据他们的直径(或宽度)来进行分类的:微孔(小于2nm),中孔(2-50nm),大孔(大于50nm)。
鉴于大多数多孔固体是使用非极性气体(N2 Ar)进行吸附研究的,所以不太可能出现化学吸附作用。
因此,对于I型等温线的经典解释是材料具有微孔。
然而,I型等温线也有可能是具有孔径尺寸非常接近微孔的介孔材料。
尤其是N2在77K或者Ar在77K和87K圆柱孔情况下,I型等温线将在较低的相对压力(大约0.1作用)下达到平衡对于材料是微孔,从最近的一些报道结果得出的。
因此,当I型等温线没有在相对压力0.1处达到平衡,该材料有可能存在大量的中孔或者就是单独的中孔。
然而,这种I型分布有可能在某种程度上介孔孔径分布范围变宽。
这是因为分布高度均匀圆柱孔的材料可能展示出在相对压力低于0.1或者更小时,可以在吸附等温线被识别(因此,这些等温线可以被分类成IV型等温线,下面我们会讨论)。
尽管,接近饱和蒸汽压的多层可能会十分不连续,但大孔材料大多是通过随着相对压力增加时,吸附量逐渐地增加的方式进行多层吸附。
这种不受限制的多层形成过产生了II型和III型等温线。
在这种情况下,吸附-脱附曲线重合;也就是说,没有发生滞后现象。
这主要取决于所测试的材料的性质,II型等温线是单层形成的明显特征,否则是在整个压力范围内都是凸起的III型等温线。
后者的行为可以观察到在吸附分子与吸附剂表面和被吸附物作比较时,吸附分子之间的作用是强相互作用。
在介孔材料多层吸附过程中,常常伴随有毛细管冷凝现象发生(IV和V型等温线)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
p 2VL cos ln p0 rRT
pr,p0 ——与弯月液面、平液面平衡的蒸气压;VL ——液体的摩尔体积;
——液体的表面张力;
——润湿角(接触角)。
五、毛细凝聚现象
但是不管是否发生毛细凝聚,固体表面与蒸气共存时,
表面总会因吸附蒸气而形成吸附膜,在毛细孔壁上也一样,
也就是说,毛细凝聚是发生在吸附膜这个基础上的,据此 上式应修正为:
来解释第Ⅱ和第Ⅲ类曲线。
不同C值的BET吸附等温线
四、吸附等温方程式
当C值由大变小时,等温线逐渐由第Ⅱ类变为第Ⅲ类。 Q1 QL BET将这种临界点定为C = 1,由 C exp( ) RT 即Q1 = QL时,为临界点。
若C >1,即Q1 > QL, 即吸附质与吸附剂分子之间的作用力 大于吸附质为液体时分子间的引力,这时低压下曲线是凸的,于
§2
1 2
气相吸附
固体的表面积和孔
表征多孔性物质结构的物理量
3
4 5
吸附等温线的类型
吸附等温方程式
毛细凝聚现象
五、毛细凝聚现象
BET公式不能说明等温线的第Ⅳ、Ⅴ种类型,因为 这两类属于有毛细管凝聚作用的吸附。
所谓毛细凝聚现象是指液体蒸气在小于其饱和蒸气
压时而在固体毛细中发生液化而吸附的现象。前面讲过 kelvin公式,对于一端开口的半径为 r 的筒形毛细孔:
上式中有三个常数,因此称为BET三常数公式,当
n =1时,BET演变为Langmuir单分子吸附方程式。
(C / p0 ) p VmCx bp V Vm Vm (1 Cx) 1 (C / p0 ) p 1 bp
四、吸附等温方程式
当n =1时,BET可以解释第Ⅰ类等温线,即
Langmuir等温线,而当n >1时,BET公式可以用
p 2VL ln p0 rRT
和
p 2V ln p0 (r t ) RT
五、毛细凝聚现象
设孔都是一端开口半径为r的圆筒,r 的大小在中孔范围。因此,可以 应用kelvin公式,这样所得的吸附等温式如图所示:
存在毛细管凝聚时的等温线情形
因孔的大小是一样的,故在p处等温线沿BC垂直上升;在C处 通常认为在AB区固体的微孔(如果有的话)将被吸附分子填满。当压力达 图中CD段包括孔中由a经b至变平时所增加的凝聚液体,以及 毛细孔都被填满到图中的弯月面 a处。因θ=0°,故a处的曲率半径 到p’时,发生了毛细凝聚现象,这时与p与r的关系按kelvin公式处理。 为(r-t)。压力继续升高,弯月面的曲率将降低(图中虚线所示),pr = 正常情况全部外表压力因由 p’增加至p0而引起的吸附量的增量。 p0时,弯月面的曲率为0,即平面。
P 2VL cos ln P0 (r t ) RT
t ——吸附膜的厚度。
上式说明,当θ< 90°,即液体对毛细孔是润湿的,则pr < p0,即 液体在毛细孔中凝聚的压力小于正常(即平液面)的饱和蒸气压,
即在毛细管内发生凝聚所需的蒸气压低于所需正常的蒸气压,且 r
越小,pr 越低。
五、毛细凝聚现象
a2pS1 = b2S2exp(-QL/RT)
四、吸附等温方程式
第i层为:ai p Si-1 = bi Si exp(-QL/RT)
吸附剂的总面积:
S S0 S1 S 2 Si Si
i 0
相应地,被吸附气体的总体积V为
V V0 (1S1 2S 2 iSi ) V0 iSi '
因为原假设在固体表面上的吸附层可以无限多,所以吸附量
不受限制。只有当压力等于凝结液的饱和蒸气压(即p = p0)时,才
能V→∞使。从上式可知,只有x = 1,V→∞。因为
p x ( ) exp(QL / RT ) g
四、吸附等温方程式
所以将上述关系代入x得
p0 1 ( ) exp(QL / RT )或p0 g exp(QL / RT ) g
四、吸附等温方程式
BET理论认为,固体对气体的物理吸附是Vander waals
引力造成的后果。因为分子之间也有Vander wanls力,所以
分子撞在已被吸附的分子上时也有被吸附的可能,也就是
说,吸附可以形成多分子层。
四、吸附等温方程式
为了导出应用结果,他们作了两个重要假设:
(1)第一层的吸附热Q1是常数。
1 C xi
i 1
n
四、吸附等温方程式
n x ( 1 x ) 因为 x i 1 x i 1 n n n d d x ( 1 x ) i i ix x x x dx dx 1 x i 1 i 1 n
VmCx 1 (n 1) x n nxn 1 所以V (1 x) 1 (C 1) x Cx n 1
四、吸附等温方程式
p / p0 根据实验数据用 对 V (1 p / p0 )
p / p0
做图,
若得直线,则说明该吸附规律符合BET公式,且通过
直线的斜率和截距便可计算出二常数Vm和C。
若吸附发生在多孔物质上,吸附层数就要受到限制,
设只有n 层,于是:
V Vm
C i xi
i 1
n
C ix i 1 C x
i 1 i 1
所以
V Vm
因
i
x x x x 1 x i 1
i 1 2 d x i i ix x x 2 dx ( 1 x ) i 1 i 1
所以
V Cx Vm 1 x 1 x Cx
第八讲
吸附
四、吸附等温方程式
3. BET吸附等温式——多分子层吸附理论
这个理论是由Brunauer. Emmett和Teller在1938年将langmuire 单分子层吸附理论加以发展而建立起来的,而且迄今仍是规模 最大,影响最深、应用最广(特别是在固体比表面的测定上) 的一个吸附理论,虽然它在定量的方面并不很成功,但却能半 定量或至少定性地描述物理吸附的五类等温线,使我们对物理 吸附图像有了一个初步的正确认识。
(2)第二层及以后各层的吸附热都一样,而且等于液化热QL。
以S0、S1,S2…Si分别表示被0,1,2…i层分子所覆盖
的面积,如下图所示:
多分子层吸附示意图
则,S0=3个位置 S1=3个,S2=2个,S3=1个,S4=0个,S5=1个。
四、吸附等温方程式
达到平衡时,各种分子层覆盖的面积保持一定。例如,从空白 面积S0来看,吸附到S0上的速度要和S1层脱附的速度相等,在这种
吸附N2、Ar、O2、CO等气体。第Ⅲ类等温线现象不常遇到,
最常见的水在炭黑上的吸附,这是因为水分子之间能形成比
较强烈的氢键,故表面一旦吸附了水分子,第二、三…层就 很易形成,较大的非极性有机蒸气分子在极性吸附剂上也常 得第Ⅲ类等温线,这可能与有机分子存在较大的Vander waals 引力有关。 BET公式虽然考虑到毛细孔空间对吸附层数n 的限制,但 并未涉及毛细凝结现象,因此不能解释第Ⅳ和Ⅴ类等温线。
令
a2 p x ( ) p exp(Q2 / RT ) ( ) exp(QL / RT ) b2 g
则
S2 xS1
四、吸附等温方程式
S 3 xS2 x 2 S1
同理
S i x i 1S1
又因
S1 yS0 ,代入上式得: Si yxi 1 S0 Cxi S0
i 0
V0是1cm2(单位面积)表面上覆盖单分子层时所需气体的体积,所以
V V0 iSi / iSi S i 1单分子层时的吸附量为Vm,即Vm = SV0, 于是有
V V iSi / iSi Vm SV0 i 1 i 0
动平衡下,空白面积保持不变。
由分子运动论得,第一层情况: 吸附速度 = a1pS0 脱附速度 = b1S1exp(-Q1/RT)。(如果一个分子被吸附时放热Q1, 则被吸附分子中具有Q1以上的能量的分子就能离开表面而跃回气相, 接Boltzman 定律)。 则,a1pS0 = b1S1exp(-Q1/RT) 同样,在S1上的吸附速度等于从S2上的脱附速度,
式中
y a1 Q1 QL C ( ) g exp( ) x b1 RT
S Si S0 S1 Si S0 Si
于是:
i 0 i 1
S0 Cx S0 S0 (1 C x i )
i i 1 i 1
四、吸附等温方程式
应当指出,kelvin公式是自热力学导出的,因此严格而言,只适合
于r 远大于吸附分子的孔中的凝聚,即r >>t,这时液体的 和弯月面 都有平常的热力学意义。倘若孔和液体分子的大小相近,例如一个孔只
能容纳几个分子,则 和曲率半径的物理意义就不明确了。由于这个理
由,kelvin公式可能不适用于微孔,至少定量上有问题,可惜这一点往 往被忽视了。另一方面,对于大孔,由于 r 大, pr 与 p0十分接近,实验 很困难,因此kelvin公式只在处理中孔的凝聚作用时才最有用。 若液体完全润湿孔壁,即θ=0°,cosθ=1,写成:
是等温线为Ⅱ类,即S型;反之,若C <1,即Q1 < QL,则吸附质
与吸附剂分子间的吸引力小于吸附质为液体时分子之间的引力,
这时低压下曲线是凹的,这就是第Ⅲ类曲线。Jones的细致分析表
明,正确的临界点不是在C =1处,而是在C =2处。
四、吸附等温方程式
第Ⅱ类等温线的例子十分普通,例如许多固体在低温下
① 在-195.8℃这样的低温下,一般可避免化学吸附的干扰。
