第5章 非金属原子簇化合物
非金属原子簇化学

硼烷
• 由中此加,入设一想对在或闭两式对—电硼子烷,B就n可Hn得2到开式或网式的结构。事实上, 加入的电子的负电荷为形成氢 桥BHB及切向BH基团所补 偿.
• 若看把成中是性Bn的Hn开4- 加式4—个硼H烷+而Bn来H,n+4 那么这4个氢占BHB桥的位置 (图).
• 若看把成中是性Bn的Hn网6- 加式6—个硼H烷+而Bn来H,n+6 那么这6个氢占BHB桥或切向 B-H的位置(图).
硼烷
• 在B6H62-离子中,骨架的成键分子轨道数为(n+1 = 7),即7个. 骨架键的电子对数也为(n+1),即7 对.它们恰好充填在上述(n+1)个成键分子轨 道.
• 较高级的硼烷阴离子BnHn2-,虽然成键的分子 轨道数随n值的增加而增加,但情况仍和B6H62类似,即成键分子轨道数为(n+1),骨架键电子 对数也为(n+1).
硼烷
• 较大的Lewis碱倾向于劈开BH3部分
硼烷的性质
硼烷
• 硼烷的结构 • 三种典型的结构:
闭式 开式 网式
– *其它还有敞网式等结 构类型.
• 闭式-硼烷阴离子 • 通式:
BnHn2- (n=6 ---12) • 结构
硼烷
• 开式—硼烷 • 通式: BnHn+4 • 结构:
硼烷
• 网式—硼烷 • 通式: BnHn+6 • 结构
体骨架
硼烷
• 四个数表示硼烷中除外向B—H键外其它类型的化学键:
– s: 3c---2e B—H—B 键的数目 – t: 3c---2e B—B—B 键的数目 – y: 2c---2e B—B 键的数目 – x: 2c---2e B—H 键的数目
金属有机化学

金属有机化学基础第5章非过渡金属有机化合物第5章非过渡金属有机化合物⏹反应试剂:许多非过渡金属有机化合物是高活性、高选择性的有机合成试剂,如Grignard试剂、锂试剂、硼试剂等在现代有机合成中占有重要位置。
⏹辅助催化剂:过渡金属有机化合物是配位催化的催化剂,但也离不开非过渡金属有机化合物作为助催化剂,如著名的Ziegler-Natta催化剂中必须用一个非过渡金属有机化合物活化。
⏹合成方法:许多过渡金属有机化合物可借鉴合成非过渡金属有机化合物的方法并用非过渡金属有机化合物作为试剂来制备。
⏹反应性质:过渡金属有机化合物的一些基本化学性质、结构也与非过渡金属有机化合物密切相关。
第5章非过渡金属有机化合物⏹非过渡金属有机化合物的通用制法⏹碱金属有机化合物----有机锂⏹碱土金属有机化合物----有机镁⏹硼族有机化合物----有机铝和有机硼⏹金属与卤代烃反应的机理自由基反应–––非过渡金属易失去价电子,卤代烃接受了这个电子后生成烃基自由基,这是速度控制阶段。
Mꞏ+ R-X → M++ Rꞏ + X-●对第IA族金属,烃基自由基与另一个零价金属反应生成金属有机化合物,金属正离子与卤素负离子形成盐,如合成锂有机化合物。
Mꞏ+ R ꞏ→ MRM++ X-→ MXMꞏ+ R-X → M++ Rꞏ + X-●第IIA族金属失去一个价电子后与卤素负离子生成一价的盐,但这个金属上还有一个价电子,它立即与烃基自由基结合得到金属有机化合物,如合成Grignard试剂。
M ꞏ++ X-→ MX ꞏR ꞏ +MX ꞏ →RMX●与第IIA族金属一样,第14族金属先失去一个价电子后与卤素负离子形成RMX,但它是不稳定的,继续与卤代烃反应,得到第14族金属有机化合物。
[RMX] + RX → R2MX25.1.2 用非过渡金属有机化合物对金属烃基化反应这是由一种金属有机化合物制备另一种金属有机化合物的方法,也称为转金属化反应(Transmetalation)。
中级无机化学[第五章原子簇化合物] 山东大学期末考试知识点复习
![中级无机化学[第五章原子簇化合物] 山东大学期末考试知识点复习](https://img.taocdn.com/s3/m/9ac8ff1210a6f524ccbf8528.png)
山东大学化学院《中级无机化学》期末复习知识点总结
4.Wade 规则 K.Wade 提出骨架成键电子对数 b 与硼烷及其衍生物几何结构之间存在以下 关系:
n 为多面体的实际顶点数。 对于通式为[(CH)a(BH)pHq]d-的硼烷或硼烷阴离子,骨架成键电子对数为 式中:a 为 C 原子数;p 为 B 原子数;q 为除去 p 个 B—H 键、a 个 C—H 键中 的 H 原子外的 H 原子数;d 为所带电荷数。若顶点为 P 和 S 原子,电子数分别记 为 3 和 4。
山东大学化学院《中级无机化学》期末复习知识点总结
和 H2,但 B10H14,B10H102-,B12H122-在动力学上非常稳定。所有挥发性硼烷都有毒。 (4)化学键类型
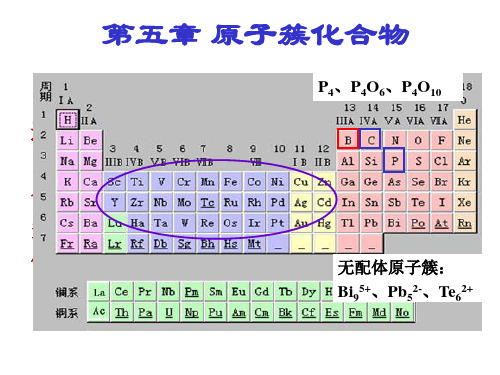
3.金属原子簇 金属原子簇:指金属原子通过金属一金属键直接键合形成多面体骨架的化合 物,其主要特征为含有金属一金属键。金属原子簇中重要配体有羰基、亚硝酰、 卤离子、羧酸,过渡后 p 区主族金属元素主要形成无配体簇。 (1)影响金属-金属键的主要因素 金属原子的 d 电子特性:原子化焓大的金 属易形成金属-金属键,因此重过渡金属比轻过渡金属更容易形成金属-金属键。 氧化态:低氧化态的金属易形成金属-金属键。 配体的性质:具有π电子接受性质、能有效降低金属原子 d 电子密度的配体 有助于形成金属一金属键。过渡元素均可形成金属羰基簇,只有前几族过渡元素 可形成低价卤化物簇和 S,Se,Te 化物簇。桥联配体有利于金属一金属键的形成。 (2)羰基的红外伸缩振动频率与配位方式的经验关系
山东大学化学院《中级无机化学》期末复习知识点总结
第五章 原子簇化合物
1.原子簇 原子簇:指原子间互相成键形成的笼状或多面体结构化合物,包括非金属原 子簇和金属原子簇。原子簇多面体大多数由三角面构成,多面体可以不完整。 2.硼原子簇 硼原子簇:指硼烷及其衍生物。硼烷(即硼氢化合物)中,B 原子至少与两个 同类原子键合。衍生物主要为 C,P,S 等非金属原子以及金属原子取代硼原子形 成的化合物。 (1)命名 称作某某硼烷。例如,B5H9:戊硼烷(9);B12H122-:闭式十二硼烷阴 离子(2-)。 硼原子数:10 以下以“甲"、“乙”等十个干支数表示,10 以上用“十一” 等表示。 氢原子数:在词干后括号内用阿拉伯数字表示,若只有一种结构则可不标。 结构类型:用“巢式一”等前缀表示。 硼烷阴离子的电荷:在词干后括号内用阿拉伯数字表示,不注氢原子数。 (2)制备 二元硼烷:由 NaBH4 制备 B2H6,用 B2H6 的热分解制备较高级硼烷,或通过硼 烷阴离子与三卤化硼或氯化氢反应制备较高级硼烷。 硼烷阴离子:通过 B2H6 或其他含 BH3 基团的硼烷与较低级的硼烷阴离子反应, 或由较低级硼烷阴离子的热解,制取较高级的硼烷阴离子。 (3)物理化学性质 大多数硼烷是液体或固体,少数为气体。富氢硼烷 BnHn+6 的稳定性不如贫氢硼烷 BnHn+4,硼烷阴离子最定。大多数硼烷与氧气猛烈反应(通 常爆炸),中性硼烷只有 B10H14 在空气中稳定。几乎所有硼烷都水解生成 B(OH)3
材料化学6

2021/4/9
切向氢
(a)B4H10,(b)B175H11
通过B2H6 通过裂解制备高级的硼烷
2B 2H 6 1 2 C 0B 4H 1 0H 2 5 B 4H 1 01 2 C 04 B 5H 1 13 H 2
目前,更多地是通过硼氢阴离子和三卤化硼或氯化氢的反应来 制取比较高级的硼烷 [ M ] B 3 H [ 8 ] B 3 0 C X 或 B 4 室 H 1 [ M 0 温 ] H [ 3 ] [ 固 B B 残 X ] H 体
酸三甲酯)和氢化钠反应制备NaBH4的方法: B (OC 3)3 H 4Na 2 H 5 C 0 Na4 B 3N H a3 OC
然后用NaBH4和BF3反应制备B2H6:
3 Na 4 4 B B 3 H F ( C 2 H 5 ) 2 O 2 B 2 H 6 3 Na 4 BF
2021/4/9
B2H6+ RCH=HCR
B(RCH2CH2R)3
硼氢化反应是制备一些列有机硼氢化合物的便利 方法,开辟有机合成新途径。
2021/4/9
12
硼烷的命名
硼烷的命名原则类似于烷烃, 根据化学式硼原子数在10 以内 的用干支词头表示, 超过10的用中文数字表示, 氢原子数用阿 拉伯数码表示在括弧中, 例: B4H10: 丁硼烷(10), B5H11: 戊硼烷(11),
特征:(1)多面体骨架
(2)电子的离域
2021/4/9
厦门大学中级无机化学第5章 原子簇化合物-1-20140507

高核簇举例
[Pt9(CO)18]2- = [Pt3(CO)3(μ2−CO)3]3
:Pt
高核簇举例
[Ga12R10]2R = C13H9
高核簇举例
Au55(PPh3)12Cl6
内层 中层 外层
1 + 12 + 42 = 55
Au原子由中心向外分3层 密堆积排列为球形
高核簇举例
[Al77R20]2R = N(SiMe3)2
M–M四重键的其他例子
CH3 C O OO CH3 C O
X O
CH3 C O H 2O O C CH3 OO CH3 C O OH2
四棱柱形
CH3 C O OO CH3 C O X
Mo
O C CH3 O O C
Mo
O
Re
O C CH3 O C CH3
Re
O
CH3
[Mo2 (RCO2)4] ([Mo2Cl8]4-)
Cr
O O C CH3
Cr
O
[Re2(RCO2)4X2]
[Cr2(CH3CO2)4(H2O)2]
四棱柱形 Cr2(O2CR)4的无限链状结构
K4[Mo2(SO4)4]·2H2O中[Mo2(SO4)4]4-的结构
四棱柱形
Pauling提出:
一组d5sp3杂化轨道
可用哪些化学手段 改变四棱柱M2L8双核簇的键级?
[Ta6X12]2+ √ 例:VIII、IB
原子化焓较大的过渡金属易成簇
M(–M–M–)(s) → M(g) ΔH
对应 M–M 键强度
2. 形成条件
② 配体 纯给电子配体与d 电子较少的过渡金属成簇 (如X-、S2-、含氧酸根) π 酸配体与几乎所有过渡金属成簇 (如CO、NO)
原子簇化合物(1)

BnHn+6 BH7 B2H8 B3H9 B4H10 B5H11 B6H12 B7H13 B8H14
B9H15 B10H16 B11H17 B12H18 B13H19 B14H20 B15H20
BnHn+4 BH5 B2H6 B3H7 B4H8 B5H9 B6H10 B7H11 B8H12
B9H13 B10H14 B11H15 B12H16 B13H17 B14H28
6个B, 3×6=18e,6个H用6个e, 余12 + 2(电荷), 7 = n + 1 对
五角双锥 (7) D5h
22
B8H82-
B9H92-
十二面体 (8) D2d
三顶三棱柱 (9) D3h 十四面体
23
B10H102-
B11H112-
双帽四方反棱 (10) D4d 十六面体
十八面体 (11) C2v
39
③ 阴离子(硼酸根)
B12H2-12
闭式的通式
十二氢- 闭式 - 十二硼酸根(2-)离子
④ 硼烷及衍生物的编号法则
选最高次对成轴,由上 → 下
40
↓4
↓4
↓5
双帽四方反棱 D4d
20 面体 I h
选最高次对成轴,由上→ 下
41
B10H14 骨架硼原子的编号
42
←C ←C
闭式-1,2-C2B10H12 杂原子编号最低
(1). 结构类型 闭合(closo) 巢式(nido) 蜘蛛式(arachno) 敞网式(hypho) 稠合式(conjuncto)
20
封闭型硼烷阴离子 BnHn2- (n = 6~12)
B4H42-
B5H52-
厦门大学材料科学基础二第五章3非化学计量化合物

,有:
1 2 O2 (g)
对于UO2+y ,有:
1 2
O2
(g)
VFe'' +2h +OO Oi'' +2h
湿化学分析法
重量分析
根据试样经过化学反应后生成产物的质量来计算试样的化 学组成。
容量分析
根据试样在反应中所需要消耗的标准试液的体积来计算试 样的化学组成。
化学分析法难以准确测定非化学计量化合物的组成,但 可用来测定非化学计量化合物中的金属原子(离子)是 过量或是欠量。
密度法
CaO溶入ZrO2生成的固溶体可能的机理:
生成置换型固溶体——阴离子空位模型
CaO ZrO2 Ca Zr'' +OO +VO
Zr1-xCaxO2-x
生成填隙型固溶体——阳离子填隙模型
2CaO ZrO2 Cai +2OO +Ca Zr'' Zr1–xCa2xO2
理论密度dt的计算:
dt
❖ 晶体中两个空位浓度[VA]和[VB]之间的乘积是一个定值。 ❖ 晶体中一种成分空位浓度和另一种成分的分压成正比。
透明陶瓷
基本特点
种类
氧化物陶瓷:Al2O3,Y2O3,MgO,TiO2,ZrO2 等 非氧化物陶瓷:AlN ,ZnS,CaF2 等
透明性好,能在高温高压下工作。 强度高,耐腐蚀。 介电性能优良、电导率低、热导性高。
依据
➢ 每一种物质的晶体都有其特定的结构。在一定波长 的X射线照射下,都能给出自己特有的衍射花样。 衍射线条的数目、位置以及强度,是该物质的特征, 因而可以成为鉴别物相的依据 。
获得晶格参数的信息
第5章 原子簇化合物
在这些异构体中, 若有两个碳原子, 则离得越远异构体越稳定。 加热不稳定的异构体往往发生异构重排。
2. CH基团上的H的弱酸性反应
2. 金属硼烷和金属碳硼烷 金属硼烷通常指硼烷骨架中的B原子被金属原子取代所得
的衍生物,即含有金属—硼键的化合物.
金属碳硼烷是由金属原子、硼原子以及碳原子组成骨架
多面体的原子簇化合物。
H2B H H H H BH2 +2L→2LBH3 (对称裂解)
H2B
BH2 +2L→[L2BH2]+[BH4]-(不对称裂解) 对称裂解生成BH3基团,不对称裂 解生成BH2+
裂解机理:
第一步 H2B H
BH2+L → H2B H L
H
BH3
第二步有两种不同的进攻位置: H2 B L H BH3 +L → 2LBH3 (对称裂解) 体积较大的Lewis碱有利于对称裂解 H 如C5H5N、(CH3)3N、(C2H5)O +L →[L2BH2]+[BH4]-(不对称裂解) BH3 体积较小的Lewis碱有利于不对称裂解 如NH3、OH-、CH3NH2
K[B6H11] + HCl
-110℃
(2) 硼烷阴离子的合成
1. BH缩聚法。用乙硼烷或其他含BH3基团的低级硼烷与硼 烷阴离子缩合, 如 BH4- + B2H6 B3H8- + H2
2. 低级硼烷阴离子盐的热解法。以B3H8-盐的热解为例:
△ [(CH3)4N][B3H8] [(CH3)3NBH3]+[(CH3)4N]2[B10H10] +[CH3)4N]2[B12H12] △ CsB3H8 Cs2B9H9 + Cs2B10H10 +Cs2B12H12
硼烷的定域处理
Lipscomb提出: 3c-2e(三中心两电子键) (定域)
中级无极化学习题

基础化学无机部分1章习题1.举例说明什么是拉平效应?为什么水不能区分H2SO4, HNO3, HClO4的酸性强弱,也不能区分O2-, NH2-, Ph3C-的碱性强弱?2.BrF3自电离产物是什么?用VSEPR写出BrF3和自电离产物的几何构型。
3.对非水液氨、醋酸和硫酸,写出:4.它们各自的自电离方程。
5.把CH3COOH分别置于上述三种溶剂中,各发生什么变化?写出反应方程式。
6.把b的三种溶液和纯溶剂相比,原溶剂的酸碱性各有何变化?溶质在各溶剂中是酸还是碱?7.为什么在强酸性溶剂中制备阳离子物种如I2+和Se82+,而在强碱性溶剂中制备阴离子物种如S42-, Pb94-?8.亚磷酸H3PO3的结构式可表示为P(OH)3和HPO(OH)2两种异构体,实验测得亚磷酸的pKa值为1.8,判断亚磷酸的结构应该是什么?次磷酸的pKa为2.00,写出其正确的结构式。
9.把NR3, S2-, NF3, O2-, NH3, OH-, NCl3, N3-按照碱性大小排序,并解释。
10.BH3和BF3都可和(CH3)2NPF2生成加合物,在一种加合物中,B原子和N相连,另一种则和P相连,绘出两种结构式,并说明形成两种结构的原因。
2章习题11.2价Ni配合物[Ni(PPh3)2Cl2]为顺磁性,Pt的类似配合物[Pt (PPh3)2Cl2]为反磁性,写出每种化学式的所有异构体。
12.讨论下两组异构体的偶极矩偶极矩情况:(a) 顺式和反式的MA2B4,(b)经式和面式的MA3B3。
13.绘出[Co(en)2Cl2]+、[Co(en)2NH3Cl]2+和[Co(en)(NH3)2Cl2]+的所有几何和光学异构体。
14.[Co(en)3 ]3+、[Ru(bpy)3]2+和[PtCl(dien)]+ (dien二乙三胺)中,哪些是手性化合物?15.Mo(CN)84-水溶液作13C的NMR表征,只得到一个峰,由此你得到什么结构信息?16.绘出五氨络钴(III)-μ-硫氰根-五氰络钴(III)的结构。
原 子 簇

Pd–Pd:2.829 Å rPd= 1.38 Å
Angew. Chem. Int. Ed., 2004, 43, 5029-5032.
K2PtCl4
SnCl2 cod
dba
CH3CO2Na
Pt(dba)2
XylNC
LL L M M (85%) LML L [M3L6] (d10 fragment)
园林美的概念及特征
❖ 美的含义
▪ 美在观念。就是说,决定事物美与不美的根据 是观念。
▪ 美在物本身。就是说,物之所以成为审美对象 ,是由物本身的自然属性所致。
▪ 美在感觉。就是说,事物的美与不美,决定于 主体的感觉,感觉到美,事物就美,感觉不到 美,事物就不美。
❖ 园林美的概念
▪ 园林美是一种以模拟自然山水为目的,把自然 的或经人工改造的山水、植物与建筑物按照一 定的审美要求组成的建筑综合艺术的美。它与 自然美、生活美和艺术美既有紧密联系又有区 别,是自然美、生活美与艺术美的高度统一。
园林构图的基本规律
❖比拟联想
▪ 摹拟 ▪ 对植物的拟人化 ▪ 运用园林建筑、雕塑造型产生的比拟联想 ▪ 遗址访古产生联想 ▪ 风景题名、题咏、对联、匾额、摩崖石刻所产
生的比拟联想
园林绿地构图的基本手法
❖园林造景
▪ 景与赏景 ▪ 园林赏景 ▪ 园林造景的方法
❖组景
▪ 景点与景区 ▪ 空间组织 ▪ 导游线和风景视线
3.1.1硼原子簇(硼烷)
通式:BnHn+4和 BnHn+6
B2H6
B4H10
乙硼烷 丁硼烷
目前发现的最简单硼烷为乙硼烷,B2H6。甲硼烷,BH3 虽然存在于H3B∙NH3,H3B∙PH3,H3B∙CO等Lewis酸-碱加 合物中,但到目前为止仍未分离出BH3。
高等无机化学第三章 非金属原子簇

Fullerene compound:
主要体现在笼内外的修饰上.
外主要是双键上的加成反应. 内则形成包合物. 1.离子型化合物: A3C60(A=K,Rb,Cs),晶体中含A+和C603-. exp. K3C60(面心立方). 混合型: K2RbC60, Rb2CsC60等. 此类化合物有超导性: K3C60的Tc=19.3K.
定(n+1),n为多面体顶点数目.
对于闭式硼烷:
n 对称性 5 6 7 7 8 8 9 9 10 10 11 11 12 12 13 Ih 成键MO 6
D3h Oh
D5h D2d D3h
D4h C2v
3.1.4
一.碳硼烷
硼烷衍生物
CH与BH-为等电子体,因此CH基团可取代硼烷中
部分BH-,形成碳硼烷(carborane).最初合成的为
2H3BO3 + 6H2↑
遇强氧化剂: B2H6 + 6Cl2
2BCl3 + 6HCl
B2H6 + 3O2
燃烧
B2O3 + 3H2O △H=-2137kJ· -1 mol
与Lewis碱反应,可发生分裂,形成环状化合物. B2H6在有机化学中有著名的硼氢化反应—乙硼 烷与不饱和烃反应生成烃基硼烷,该产物是有机合成 重要中间体,常用于C-H.C-O,C-X,C-N键的合成.
与C5H5-由p轨道组成的π体系非常相似.
→
→
1.2-C2B10H12
7.8-C2B9H12-
7.8-C2B9H112-
M.F.Harwthorne合成出了第一
个金属碳硼烷 2 C2H9H11- + FeCl2(无水)→ [C2H9H11)2Fe(Ⅱ) ]2-+2Cl(M.F.Harwthorne, J.Am.Chem.Soc, 87,1965)
基础化学无机部分

13. 绘出[Co(en)2Cl2]+、[Co(en)2NH3Cl]2+和[Co(en)(NH3)2Cl2]+的所有几何和光学异构体。
14. [Co(en)3 ]3+、[Ru(bpy)3]2+和[PtCl(dien)]+ (dien二乙三胺)中,哪些是手性化合物?
CH3CN (C2H5)2O PCl3 As(C6H5)3 CH3NC (C2H5)3N
9.分别写出Mn2(CO)10 和Co2(CO)8的桥式和非桥式结构。前者的CO伸缩振动频率谱带是2240?1980cm?1,后者的谱带范围是2071?2022cm?1,以及1860和1858cm?1。按照IR数据,指出正确的结构。
10. BH3和BF3都可和(CH3)2NPF2生成加合物,在一种加合物中,B原子和N相连,另一种则和P相连,绘出两种结构式,并说明形成两种结构的原因。
2章习题
11. 2价Ni配合物[Ni(PPh3)2Cl2]为顺磁性,Pt的类似配合物[Pt (PPh3)2Cl2]为反磁性,写出每种化学式的所有异构体。
(1) 2Ga + 3HgMe2 ==== 3Hg + 2 GaMe3
(2) Li4(CH3)4+ SiCl4=== LiCl + Si(CH3)4
(3) 2AlF3 + 2B(CH3)3==== Al2(CH3)6+2BF3
(4) 3GeCl4+ 2Al2(CH3)6==== 3Ge(CH3)4+4 AlCl3
5. 说明? 配体和? 酸配体的成键特征和不同,下列配体中,哪些是? 配体,哪些是? 酸配体:
第5章原子簇化合物-习题答案

BB 2c-2e
H
B
B
3c-2e
B
B
B
3c-2e
B
B
B
B
B
5c-6e
5.5 何谓拓扑图象?试画出B5H9的拓扑图。 解:所谓拓扑图像或拓扑图示,指在保持化学键不断裂的前提下将硼烷的立体图像平摊
在一个二维平面上所得的图像。B5H9的拓扑图如下:
5.6 运用 Wade 规则说明下列物种所属的结构类型(闭式,巢式,蛛网式,敞网式)
5.11 为什么第二、第三系列过渡金属元素比第一系列过渡金属元素更容易形成原子簇化合 物? 解:M-M 键主要靠 d 轨道重叠形成。当金属处于高氧化态时,d 轨道收缩,不利于 d
轨道的互相重叠,因此 M-M 键通常出现在金属原子处于低氧化态的化合物中。此外,d 轨道在空间的伸展范围是另一个重要因素。第二、第三系列过渡金属元素的 4d 和 5d 轨道在 空间的伸展范围大于第一系列过渡金属元素的 3d 轨道,更加利于 d 轨道重叠,因而第二、 第三系列过渡元素更容易形成原子簇。
成一个Re-Reσ键,另一个dp杂化轨道指向相反的方向,成为非键轨道。同时,两个Re原 子的dxz和dyz轨道在xz和yz平面内分别形成π键,而两个dxy轨道则“面对面”地重叠形成一 个δ键。结果在[Re2Cl8]2-中,Re与Re间形成了四重键。为了有利于形成δ键,有利于最大程 度形成π键,两个Re原子的配位Cl原子必须呈重叠构象。
非金属原子簇化学PPT课件

6
Fe4S4(NO)4
[Ge8V14O50(H2O)]12[Re3Cl12]3-
7
§3.3 非金属簇合物化学
Chemistry of Non-metal Clusters
原
子
簇
3.3-1
硼烷化学
化
Chemistry of Boranes
学
3.3-2
碳原子簇化学
Chemistry of Carbon Clusters
合成
(1)最初在1912——1936年间,德国的Alfred Stock及其合 作者
们通过酸 和硼化镁的作用,制备了B4H10、B5H9、B6H10 及
B10H14等一系列的硼烷以及它们的衍生物。
11
(2)到50年代,由于发展了方便地制备硼氢化钠反应来制 备
B(OCH3) 3 + 4NaH
250CNaBH4 + 3NaOCH3
H
B
B
上一张 下一张 返回 目1录6
H BB
的轨道重叠模型
17
B BB
的轨道重叠模型
18
分子轨道法处理
用分子轨道法处理硼烷结构,不是把骨架电子对固定在定域 键中,而是把参与骨架成键的原子轨道重新组合。
以 B6H62- 为例
p AO (12) s AO (6)
LUMO HOMO
19
Гσ=A1g+Eg+T1u
综上所述,硼烷中五个基本成键要素的要点如下:
(1)硼原子用于成键的轨道是: 4个sp3杂化轨道或 3 个sp2杂化轨道和一个p轨道
(2)硼原子的三种骨架键是: 正常的两个中心共价键 闭合三中心键 开放三中心键
高等无机化学第五章第一节

第5章 新型无机化合物
高等无机化学
例题[5-2] 推断B4H10(n=4,m=6)的结构(成键方式)。 从s+t=n,由于t=0,则s=n=4 从m=x+s,有x=m-s=6-4=2 从m=2s-2y,y=s-m/2=4-6/2=1 styx=4012,即B2H6分子包含4个三中心二电子B-H-B键 和6个(即n+x)二中心二电子B-H键, 一个B-B键。
(*BnHn+2系列所有氢化物不能单独作为一类硼烷,在此只为便于理解而存在 ) 第5章 新型无机化合物
高等无机化学
(2)B-H共价键的成键方式总结 用styx数分析法分析成键方式: (适用于非封闭型硼烷) ① 外向B-H键,对于BnHn+m,等于B原子数n个 ② 除外向B-H键,还有 s个三中心双电子B-H-B键 y个双中心双电子B-B键 t个三中心双电子键 研究发现三中心双电子键 不存在
为缺顶的五角双锥型构型
第5章 新型无机化合物
高等无机化学
其中向外的B-H键数=n=6, 三中心双电子B-H-B键(氢桥键)s= 4, 三中心双电子键(BBB)t=0 双中心双电子B-B键 y= 5, 非外向双中心双电子B-H键x=0 styx=4050
第5章 新型无机化合物
高等无机化学
③网型硼烷 通式是BnHn+6 其骨架成键电子对数为 (2n+6)/2=n+3。
第5章 新型无机化合物
高等无机化学
3、分类:
(1)非金属原子簇合物 (2)金属原子簇合物
第5章 新型无机化合物
高等无机化学
二、非金属原子簇化学
(一)硼烷 (二)硼烷的衍生物
第5章 新型无机化合物
高等无机化学
高等无机化学ppt课件.ppt

§1. 配合物电子光谱 §2. 取代反应机理 §3. 几种新型配合物及其应用 §4. 功能配合物
3
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
第三章:原子簇化合物
{ §1. 非金属原子簇化合物
镜面包含主轴:v
16
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
镜面垂直于主轴:h
N
N
C
h
一个分子只可能有一个 h镜面
17
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
9
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
§1.对称操作与对称元素
Symmetry Operations and Symmetry Elements
对称元素
n重旋转轴 镜面 反演中心 n重非真旋转轴 或旋转反映
6
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
第六章: 固体结构和性质
§1.固体的分子轨道理论 §2.固体的结构 §3.有代表性的氧化物和氟化物
7
病原体侵入机体,消弱机体防御机能 ,破坏 机体内 环境的 相对稳 定性, 且在一 定部位 生长繁 殖,引 起不同 程度的 病理生 理过程
反演中心
第5章非金属原子簇

几乎所有硼烷都对氧化剂极为敏感, 如B2H6 和B5H9 在室温下遇空气即激烈燃 烧, 放出大量的热, 温度高时可发生爆炸, 只有分子量较大的H10H14在空气中稳定。 除B10H14 不溶于水且几乎不与水作用 外, 其他所有硼烷在室温下都与水反应而 产生硼酸和氢。 BnHn2- 阴离子的化学性质比相应的中 性硼烷稳定。
一种简便的实验室合成法是把 NaBH4小心地加到浓H2SO4之中:
2NaBH4+2H2SO4 2NaHSO4+B2H6+2H2 工业上在高压下以AlCl3为催化剂, 以 Al和H2还原氧化硼制得: B2O3+2Al+3H2
压力, AlCl3
B2H6+Al2O3
较高级的硼烷一般可通过热解乙硼 烷来制备: 2B2H6 5B2H6 2B2H6
从开式硼烷结构变为网式结构可以 有两种方式,一是去掉一个相邻的顶, 一是去掉一个相对的顶,去掉的是哪一 个顶呢?
Wade从能量计算结果表明,去掉 的是相邻的顶。
4. 敞网式(hypho)-硼烷 除上述三种主要的硼烷以外, 还有
一种硼烷, 其“口”开得更大, 网敞得
更开, 几乎成了一种平面型的结构, 称
④ 对硼烷阴离子命名时,除上述规则① 和②外,还应在母体后的括号中指明 负电荷的数目。如:
B12H122- 闭式-十二硼烷阴离子(-2) 若同时还需指明氢原子,可直接在 结构类型后指出。 B12H122-闭式-十二氢十二硼酸根离子
(-2)
2. 性质
大多数硼烷易挥发(但B10H14 的熔、
沸点都较高, 在常温下为固体)。 所有挥发性硼烷都有毒。
3. 硼烷的反应 (1)与Lewis碱的反应 碱裂解反应
均裂
异裂
按什么方式裂解取决于使用的Lewis 碱。在裂解时, 第一步是一个L进行亲核 进攻:
中级无机化学北大10年第5章非金属原子簇

n+1
n+2
n+3 (Wade 规则)
三. 硼烷的骨架电子对规则(Wade’s rule)
Wade规则:骨架电子数, 化学式和分子形状之间的关系.
把硼烷中的所有化学键作为整体处理
由英国化学家Kenneth Wade 在1970s提出. 主要用于 三角形多面体(deltahedra)类型的化合物中. 骨架电子: 除每个B-H键以外的所有电子 B4H10 4个(B-H)键2 4 = 8个电子为非骨架电子, 其
B5H11 即 B5H5+6 骨架电子数= 5 2 +6 = 16 骨架电子对 = 5+3 = 8 (n+3, n为硼原子数)
硼烷结构和骨架电子对数的关系
结构 化学式 骨架电子对 实例
闭式(closo) 巢式(nido)
BnHn2 BnHn+4
n +1 n +2
B12H122 B5H9
蛛网式 (arachno) 敞网式 (hypho)
盆状二碳硼烷金属配合物
Inorganic Chemistry 2001, cover
Salute to Fred Hawthorne Icosahedral B12H122– 40 years
Pb52骨架电子对=5+1
Sn94骨架电子对= 9+2
Bi42-,Se42+
骨架电子对= 4+3
C8H8(立方烷)
2. 化学稳定性差(自燃, 水解) 3. 燃烧值大(G小) BnHm+O2 B2O3+H2O Hf (B2O3)= -1273 kJ.mol-1 4. 毒性大
3. 硼烷的制备:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5.3 硼烷衍生物
2.金属碳硼烷
强碱 1,2- C2B10H12 7,8- C2B9H12-
7,8- C2B9H12- +NaH 7,8- C2B9H112–+Na++H2
此阴离子的开口面上, 3个硼原子和 2个碳原子各提供1条sp3杂化 轨道, 轨道都指向多面体的假想第12个顶点, 共有6个离域电子。 这与环戊二烯阴离子的 π体系相似。按此思路,得到第一个金属 碳硼烷及系列化合物。
富勒烯的笼状结构系列
5.4 富勒烯(Fullerenes)化学
NMR 谱中,C60 仅有一条化学位移为142.7的峰, 表明分子 中所有的碳原子都是等效的。 C70形似橄榄球,相当于C60半球通 过10碳原子桥联形成,共有5种类型的C原子,结构复杂。
13C
138pm
145pm
5.4 富勒烯(Fullerenes)化学
5.3 硼烷衍生物
金属可以作为一个 多面体的顶点。 两个同样的开式碳硼 烷阴离子将一个金属 离子夹起来, 得到一 种夹心型的金属碳硼 烷。 如果金属还含有空 轨道, 它还可接收 其他的配体。
5.3 硼烷衍生物
3.金属硼烷
5.3 硼烷衍生物
5.3 硼烷衍生物
4.硼烷衍生物的应用
均相催化方面:对不饱和烃的氢化、氢硅化等反 应有优良的催化活性;
1.闭式(closo)
B
B B
B B
B
B
B
B
5.2 Wade规则
高元硼烷中的化学键 (5种)——styx规则
H B H HB B H H H B H H B H
表示方法: 巢(开)式
BnHn+4
s——4个BHB
t ——1个BBB y ——2个BB x ——0 个BH2 5个BH
8e
2e 4e 0e 10e
5.2 Wade 规则
5.2.2 多面体骨架电子对理论
骨架电子: 除B-H键以外的所有电子。把硼烷中的所有化学键作 为整体处理。 例如: B6H62– 18+6+2=26e 6个 B-H——12e——非骨架电子数 剩余 6 2 + 2=14e , 即骨架电子数为14 骨架电子对 = 6+1 = 7 (n+1, n为硼原子数) ——闭式 B5H11 即 B5H5+6 总电子数26 , 5个B-H—10e 非骨架电子数 骨架电子数= 26-10 = 16 骨架电子对 = 5+3 ——网式 B5H9 即 B5H5+4 总电子数24, 5个B-H—10e—非骨架电子数 骨架电子数= 24-10= 14 骨架电子对 = 5+2 ——开式
生物医学方面:硼烷和金属碳硼烷在医学领域中
的应用已有多年,近十年来合成的新型硼烷,具有
更高含量和足够安全性,可选择性识别并进入癌细
胞,从而实现硼中子俘获疗法。 其他:金属碳硼烷在构筑新型导电聚合物以及非 线性材料或者纳米纤维也将有进一步的发展前景。
5.4 富勒烯(Fullerenes)
具有闭式的空心笼形结构的碳原子簇,统称富勒烯。
5.2 Wade规则
5.2.1 硼烷中的化学键 Lipscomb用单晶XRD得出硼烷结构,提出: 3c-2e (三中心两电子)BHB键
硼烷中有两类氢:桥氢和端氢。端氢没有表现特殊的化学性质,桥氢比 较活泼,具有一定的酸性。
5.2 Wade规则
5.2.1 硼烷中的化学键
以B6H62-为例,共26 个价电子,它应形成6 个B-H 键, 3 个B-B双中心键和4 个3c-2e BBB键。
第5章
非金属原子簇化合物
5.1 硼烷
5.2 Wade 规则
5.3 硼烷衍生物
5.4 富勒烯化学
5.5 碳纳米管
原子簇
* F. A. Cotton: (1966)首次提出原子簇(cluster )的定 义 :含有M-M键的多核化合物 • 徐光宪(1982)建议定义:三个及以上有限的原子直 接键合构成以多面体骨架为特征的分子或离子。
5.1 硼烷
5.1.2 硼烷的结构
闭式:BnHn2由三角面组成完 整的多面体,硼原子 在多面体的各个顶点 上,每个硼上都连着 一个氢。 笼式
5.1 硼烷
5.1.2 硼烷的结构
开式(巢式):BnHn+4
可看作是闭式结构的多面体移去一个顶点(即BnHn2-再移
去一个BH单位)的结构,是不完全的或缺顶的多面体。
5.2 Wade规则
5.2.2 多面体骨架电子对理论 硼烷结构和骨架电子对数的关系
结构 化学式 骨架电子对 实例
闭式(closo)
巢式(nido) 蛛网式 (arachno)
BnHn2
BnHn+4 BnHn+6
n +1
n +2 n +3
B12H122
B5H9 B5H11
5.2 Wade规则
5.2.2 多面体骨架电子对理论
5.1 硼烷
硼烷的特殊结构
原子簇化合物通常是缺电子分子,总价电子数比各原子对 的成键轨道数的两倍要少。以B2H6为例,按6 个B−H、1 个B−B 共7 个成键轨道计,应有14 个价电子,而B2H6只有 12个。 B 原子的电子组态为B [He] 2s 2 2p1 ,经过计算,形成不等 性sp3杂化轨道。杂化后,生成4个杂化轨道,其中2个杂化 轨道与2个端氢以2c-2e键键合,还有1个电子及剩下的2个 杂化轨道可以成键。
碳硼烷的化学特性:
与硼烷比较,毒性小得多,而对空气和湿气稳定性大得多。
可用火箭燃料,它的硅氧烷聚合物是一类新型耐高温材料。
巢式碳硼烷(如巢式-[B9C2H11]2-)是极好的配位体。 碳原子上的端氢有明显酸性,易被金属离子取代。处于碳附 件(尤其邻位双取代)的硼原子上略带正电,更易发生亲核 进攻。从而获得数以千计种碳硼烷的衍生物。
s 3个BHB
2个BH
总电子:
戊硼烷(11)
4e
26e
styx表示:B5H11 (3203)
5.2 Wade规则
5.2.1 硼烷中的化学键 三种硼烷之间的相互转化关系
B6H62m=2
B5H9 m=4
B4H10 m=6
5.2 Wade规则
5.2.2 多面体骨架电子对理论
对于高对称的硼烷进行分子轨道处理获得了令人满意的结果,但低
①化学稳定性差别大(自燃、水解),燃烧值高
如乙硼烷在空气中自燃,放出大量的热
同时也极易在水中水解,产生氢气和大量的热
基于这种性质,硼烷有可能作为高能喷射燃料,用于火箭和 导弹上。
5.1 硼烷
5.1.3 硼烷的性质
②大多数硼烷易挥发(但B10H14的熔、沸点都较高, 在常温下为 固体)。 ③毒性大 纯硼烷的毒性很大,远远超过通常已知的毒物,如氰化氢、 光气(COCl2)等,因此现有的硼烷燃料不是纯硼烷而是硼烷 的衍生物。
碳原子采用s0.9p2.28杂化,轨道重叠 形成σ键,每个碳原子的三个σ键分别为 一个五边形的边和两个六边形的边,三 个σ键不共平面,键角约为108°或 120°,因此整个分子收拢为球状。每个 碳原子用剩下的一个p轨道互相重叠形 成一个含60个π电子的闭壳层电子结构,
因此笼内和笼外都围绕着π电子云。
5.1 硼烷
对硼烷及其一系列衍生物进 行了系统研究。利用低温XRD等 测定了多种硼烷结构,确定了硼 烷分子是一种“缺电子化合物”, 具有属于三中心两电子的笼状的 空间三维结构。圆满地阐明了BH-B和B-B-B键和硼烷分子的复 杂结构。他还通过数学方法推算 出硼烷及其离子可能存在的数目, 预示了它们的结构。
对称性的结构计算比较困难。
1971年英国化学家K.Wade在分子轨道理论的基础上提出了一个预
言硼烷、硼烷衍生物及其他原子簇化合物结构的规则。—Wade规则
除了Wade提出的规则,我国化学家唐敖庆提出的4n—F规则以及
徐光宪提出的nxc 格式等,根据上述规则可预测硼烷、碳硼烷的结 构,由于它们都涉及多面体骨架、电子对数的计算,故总称为多面体 骨架电子对理论。
5.1 硼烷
2. 硼烷的命名
① 通常硼原子<10时,用干支数来,硼原子数>10时,则用中 文数字词头来标明硼原子数;分子中的氢原子数则用阿拉伯 数字加圆括号直接写在化合物名称的后面。 如:B5H9 称为戊硼烷(9) ②用前缀表明结构类型(简单的常见硼烷可省略) ③对硼烷阴离子命名时, 在母体后的括号中指明负电荷的数目, 如: B12H122- 称为闭式-十二氢十二硼烷阴离子(-2)
加拿大蒙特利尔万国博览馆球形 圆顶薄壳建筑 Buckminster Fuller 设计
C60
C70
Kroto、Curl和Smalley通过验证C60的独特分子结构并揭示其 深远的潜在应用而分享了1996年的Nobel化学奖。
5.4 富勒烯(Fullerenes)化学
•球形富勒烯可简 写为 C2n,其中五 边形 12 个,六边 形n-10个 •目前发现最小的 富勒烯为C20
5.3 硼烷衍生物
重要的硼烷衍生物:碳硼烷、金属碳硼烷及金属硼烷
1.碳硼烷:
C ~ BH 是等电子体, 分子结构中C 可取代 BH
B5H9
C 2 H 2 200 C
1,5- C2B3H7 + 1,6- C2B3H7 + 2,4- C2B3H7
5.3 硼烷衍生物
C → BH,P →BH (或BH2), S →BH2 (或BH3)均为等电子体
1,2- C2B10H12 1-SB9H9 1-SB11H11
( B12H122– ) (B10H102) (B12H122)
1,2-CPB10H11 (B12H122)
碳硼烷与硼烷相似,可分为闭式、巢式、蛛网式结构。以 前两种为主。
