医院制剂配制和检验共42页
制剂室配制操作规程

品名规格理论数质检结果投料和产出的平衡情况:审查意见:质量管理人意见:批号成品数生产记录张数审查人:年月日质量管理负责人:年月日配制前清场年月日品名配制日期规格配制岗位1. 无剩余原、辅料。
清2. 无积水、积尘和非生产物品。
场3. 配制设备复位清洗。
4. 配制辅助设备,材料齐全。
确 5. 配制设备使用正常。
认清场者检查者生产品名理论投料 配制量实际产出 成品数异常情况处理意见成品收得率===批 号实际产出成品数量× 100%理论产量× 100%结论:记录人: 记录时间:规 格中药材处理制剂品名规格批号中药材品名来源(产地)数量外观质量真伪鉴别鉴别者预处理(挑、洗、切、研等)预处理后数量提取、精制方法或者过程精提后数量预处理日期预处理者精提日期精提者清场要求复核者复核者检查清况1、预处理和精提后中药材核对无误,清且妥善放置并标记2、彻底清扫操作场所,不得有原药材残留物。
3、机械设备、用具、盛器等清洁无异场物,并放置整齐。
4、关好门、窗、水、电。
清场者检查者称量与配制品名规格批号处方及称量配制过程煎煮第一次起止时间:原液总量:浓缩万ml 操作人:灌装人:理论产品数:第二次起止时间:浓缩液总量:万ml清场人:实际产品数:清场要求浓缩时间:小时检查人:贴签人:收得率:相对密度:检查结果:检查情况1. 剩余原、辅料全部归还原处。
2. 配料桶、夹层锅、称量器具、盛器等按规定方法处理,清场应清洁无异物。
3. 无积水、积尘、清洁、整齐,无非生产物品。
4. 管好门、窗、水、电。
清场人:检查人:检查结果:灌(分)装容器处理容器名称 规 格来源(厂家) 外 观 质 量质 量 检 查 质检者 处 理 数 使用数 处理日期 剩余容器处理 处 理 者 备 注:清场要求检查情况1. 用具、盛器等清洁, 放置整齐。
2. 操作场所无积水、积尘和非生产物品3. 关好门、窗、水、电。
清场者 检查者处 理 方 法清场年 月 日品 名 规 格应灌(分)装数 灌(分)装材料规格实灌(分)装数 量配制总量质检情况精洗瓶质量抽检 灌 (分) 装质量抽检灌(分)装时间 灌(分)装者清场要求至 , 共检查情况1. 剩余瓶、塞、膜妥善处理2. 过滤系统按规定处理好3. 机身清洁、无残留物清4. 无积水、积尘和异物5. 关好门、窗、水、电场清场者 检查者灌(分)装小时批装 数号量年月日品名规格成品数包装标签发放数标签发放人贴签(印字)人标签剩余数剩余标签处理剩余标签处理人备注:批号装箱数装箱单发放数装箱单发放人装箱人装箱单剩余数剩余装箱单处理剩余装箱单处理人清场要求检查情况清场1.成品全部按规定包装到位。
医院普通制剂配制常规

医院普通制剂配制常规第一条医院配制的制剂,只限于本单位临床和科研需要而市场上无供应或供应不足的药物制剂。
医院配制制剂,必须经上级卫生行政部门审查批准并发给《制剂许可证》,方可配制。
第二条配制制剂必须按照药典、卫生部标准、地方标准或卫生行政部门制定的医院制剂规范配制。
新制剂须经本院有关人员研究提出制订操作规程和质量标准,经药剂科主任及院药事委员会审查后,报市卫生局审批。
第三条配制制剂所用原料、辅料、溶媒以及直接接触药品的容器和包装材料,必须符合药用要求。
配制中草药制剂的原料,须经中草药品种鉴定无误。
第四条配制制剂前必须填写制剂生产记录表。
每批制剂必须有详细完整的记录,同时做好原料、辅料、仪器用具、包装材料等的准备工作。
包装用瓶及瓶塞均应清洗干净,经消毒烘干后备用。
第五条配制时,必须带口罩、帽子、穿工作服,要准确称量原料、辅料,并应有第二者仔细校对品名、质量和所需数量无误后,方可进行配制。
第六条对易发霉、失效、变质的制剂宜少量勤配,并可酌情加适当的稳定剂、防腐剂。
根据制剂性质酌加矫味剂、着色剂。
第七条配制挥发性有毒制剂应注意防护,毒性制剂应严加管理,密封单独贮存。
使用毒、麻和精神药品时,应按毒、麻和精神药品的管理条例执行。
第八条制剂配好后,应及时分装于适当容器内,贴上标签,并在标签上注明制剂的名称、含量、适应症、用法、用量、注意事项、产品批号和生产单位。
内服和外用药品的标签,应印有规定的标志。
不得将新配制的制剂与原存的制剂混合装瓶。
第九条制剂要按照规定进行质量检验,合格者凭医生处方使用,并定期检查贮存制剂质量。
不准将质量不合格的制剂提供临床使用。
第十条制剂浓度或含量的标示:1.用百分比表示,系指重量的比例。
溶液的百分比,除另有规定外,系指在溶液100ml中含有溶质若干克;醇的百分比是指20℃时容量的比例。
此外,按需要用下列符号表示:%(gg)表示溶液100g中含有溶质若干克;%(ml/ml)表示溶液100ml中含有溶质若干ml;%(ml/g)表示溶液100g 中含有溶质若干ml。
医院制剂处方设计与制备 ppt课件

(十四)避光剂
对氨苯甲酸 水杨酸苯酯 二氧化钛
(十五)退色剂
过氧化氢 白降汞 氢醌
(十六)光敏药物
1. 补骨脂 2. 甲氧沙林
(十七)皮质激素
1. 氢化可的松 2. 曲安奈德 3. 地塞米松 4. 丙酸氯倍他索 5. 倍他米松 6. 氟西奈德
三、外用制剂的剂型 及作用特点
(一)洗剂 (二)油剂 (三)糊剂 (四)膜剂 (五)涂剂、涂膜剂 (六)外用粉剂
急性肾衰
腹膜透析
慢性尿毒症 透析
中毒
血液透析
肾移植
一、腹膜透析液
➢ 腹膜透析的原理 P37 ➢ 腹膜透析液处方原则 P37~38
➢ 处方举例
甲液
氯化钠
5.5g
醋酸钠
5.0g
注射用水
加至100ml
乙液
葡萄糖
20g
氯化钙 Cacl2·2H2o 0.3g
氯化镁Mgcl2·6H2o 0.15gLeabharlann 注射用水加至900ml
医院药学
主任药师
第三章 医院制剂处方 设计与制备
精品资料
你怎么称呼老师?
如果老师最后没有总结一节课的重点的难点,你是 否会认为老师的教学方法需要改进?
你所经历的课堂,是讲座式还是讨论式? 教师的教鞭
“不怕太阳晒,也不怕那风雨狂,只怕先生骂我笨, 没有学问无颜见爹娘 ……”
“太阳当空照,花儿对我笑,小鸟说早早早……”
酮康唑、联苯苄唑。作用原理是抑制真 菌麦角甾醇等固醇的生物合成,损伤真 菌细胞和改变其通透性,致细胞内重要 物质漏出。 6. 特比萘芬
(六)抗病毒剂
1. 氟尿嘧啶 2. 碘苷 3. 酒石酸锑钾溶液 4. 酞丁安
(七)杀寄生虫剂
医院制剂配制规程

目的:制订标准配制规程,以提供生产车间组织生产和进行生产操作的依据。
适用范围:的生产。
责任:生产车间按该工艺规程组织生产和按该规程编制标准操作程序,生产部和药检室负责监督该规程的实施。
内容:(一)配制及包装容器的处理1、不锈钢药筛的处理使用《中华人民共和国药典》2010年版规定的药筛,使用后用软毛刷刷净药筛,必要时用水冲洗干净并及时晾干或烘干。
2、不锈钢容器的处理将不锈钢容器,用2—3%的碳酸钠溶液刷洗2次,用常水冲净,漓水,并冲洗内外壁,再用纯化水冲洗2次,用75%的乙醇擦拭。
将粉碎机、胶囊填充机用75%的乙醇擦拭。
3、其他制剂包装材料的处理所用空心胶囊应符合《中国药典》2010年版二部的规定。
包装用口服固体药用高密度聚乙烯瓶符合《中华人民共和国药品管理法》和《药品包装用材料和容器管理办法》(暂行)的规定。
(二)配料1、称量和过筛称量操作:投料前经二人核对原料准确无误后,方可投料。
配料前应按处方计算投料量,并经他人核对无误后,方可进行称量。
称量前应首先除去外包装。
过筛:供制胶囊的药物粉碎,药物应干燥、疏松、均匀。
2、配制将药物以散剂形式混匀备用。
胶囊剂的填充一般分为以下步骤:(一)空胶囊的选择:按药物剂量所占容积来选用空胶囊,选择1号空心胶囊。
(二)药物的处理:供制胶囊的药物粉碎,药物应干燥、疏松、均匀。
(三)药物的填充:采用半自动胶囊填充机填充。
3、注意事项制备胶囊剂应严格操作技术,保证制剂质量:A、制备时应注意卫生,操作时应带上手套或指套。
B、胶囊的装量差异应符合中国药典的规定。
C、胶囊应整洁,不得有粘结、变形、破裂或异臭等。
胶囊剂除另有规定外,均应密封贮存。
(三)包装1、包装将胶囊按标示装量准确点清数量,装入塑料瓶中,立即旋好瓶盖防止受潮。
2、贴签采用不干胶标签,按标签的使用管理办法,进行标签的领取,用打码机打印生产日期、产品批号、有效期。
贴签时,应将标签贴在包装的中部,注意贴正,边角要贴严;同时检查批号打印(漏印及字迹清楚否)使用(混批号否)情况。
化验室常用药品的配制和标定方法

化验室常用药品的配制和标定方法化验室中常用药品的配制和标定方法是保证实验准确性和安全性的重要步骤。
配制药品涉及药物的选取、称量、混合和溶解等步骤,而标定药品则是通过比较实验结果和标准物质的数量关系来确定待测物质的含量。
一、药品的配制方法1.药物的选取:根据实验需求,选择适当的药物。
选择时需注意药物的纯度、溶解度、稳定性等性质,确保药物能在实验条件下稳定并得到准确的结果。
2.药物的称量:按照实验所需药物的含量和浓度,使用电子天平准确称取药物。
在称量过程中,要避免外界干扰,尽量准确到小数点后一位。
3.药物的混合和溶解:根据实验的需要,将已称量好的药物溶解于适当的溶剂中,如水、乙醇或其他溶剂。
在溶解过程中,需充分搅拌,直到药物完全溶解为止。
如遇到难溶性药物,可适当加热或使用超声波溶解仪等辅助方法。
4.药品的过滤:对于混合溶液中可能存在的颗粒、杂质等,需经过滤器进行过滤,以保证药液的纯净度和透明度。
滤液通常用玻璃纤维滤纸或微孔膜滤纸进行过滤。
5.药品的保存:配制好的药液应妥善保存,避免受热、阳光直射、潮湿等因素影响,以防止药物的降解和失效。
一般应保存在阴凉、干燥的地方,避免与其他药物混放。
二、药品的标定方法1.标定溶液的配制:选择已知浓度的标准物质,并按照一定比例配制成标定溶液。
配制时应准确称量标准物质并溶解于适当的溶剂中,同时尽量保持配制溶液的稳定性和精确度。
2.药品的标定曲线绘制:将标定溶液依次加入多个容量瓶中,使每个容量瓶中含有不同浓度的标定溶液。
然后使用适当的分析方法(如光度法、电位滴定法等)测定每个容量瓶中标定溶液的浓度,得到标定曲线。
3.待测物质的测试:将待测物质溶解于溶剂中,然后使用相同的分析方法对其进行测试,测得相应的实验结果。
4.标定计算和结果分析:根据标定曲线和待测物质的实验结果,可以通过比较二者的数量关系,计算出待测物质的含量和浓度。
同时需要进行数据分析,评估实验结果的准确性和可靠性。
医院制剂质量检验

医院制剂质量检验药品检验标准操作规程医院制剂质量检验操作规程一、医院制剂化学检验操作规程1.为保证检验的质量,根据所制定的物料、中间品和成品质量标准,特编写检验操作规程。
2.中间品检验,按性状、鉴别、检查和含量测定进行检验。
成品检验做全项检测或重点项目检测[性状、鉴别、含量测定、检查(包括微生物限度或无菌检查)。
3.原辅料应根据制剂质量要求,参照相关质量标准进行检验。
4.药检室收到送检单,打印相应检品的原始记录单,针对要检验的项目内容,准备检验用试剂、器皿和所用的仪器(开机预热等)。
5.药检室收到检品,先检查性状,然后进行鉴别、一般检查、含量测定等,化学检验合格的成品,分装后进行微生物限度检查或无菌检查。
6.含量测定时精密称量供试品:①称量取样:用岛津AUY220分析天平精密称定,记录称量值,并填写设备使用登记,签字。
②容量取样:用相应体积的移液管,正确吸取供试液。
然后按照制剂质量标准含量测定项下内容进行操作。
读取测定值,记录数值,判断是否在含量限量范围内,并进行计算,记录计算结果(实际含量、相当于标示量%)。
7.含量测定结果符合要求的中间品或半成品,立即通知制剂室,以便继续生产;含量测定结果不符合要求的中间品或半成品,先检查排除检测的原因,在进行复检,结果仍未不合格的,立即通知制剂室,并协助制剂室查找不合格原因,进行调配或返工处理后,重新测定。
8.全部检测合格后,填写并出具检验合格报告。
9.检查结果不合格的成品,按不合格制剂处理程序处理。
检验报告注意事项:必须有检验人员、复核人员签名或盖章,必要时由检验单位盖章。
(一)原始记录:完整、真实、具体、清晰1、供试品情况(名称、批号、规格、数量、来源、外观、包装等)2、日期(取样、检验、报告等)3、检验情况(依据、项目、操作步骤、数据、计算结果、结论等)4、若需涂改,只可划线,重写后要签名5、记录完成后,需复核。
复核后的记录,属内容和计算错误的,由复核人负责;属检验操作错误的,由检验人负责。
《医疗机构制剂配制质量管理规范》(局令第27号)

《医疗机构制剂配制质量管理规范》(局令第27号)国家药品监督管理局令第27号《医疗机构制剂配制质量管理规范》(试行)于2000年12月5日经国家药品监督管理局局务会议通过,现予发布。
本规范自发布之日起施行。
二○○一年三月十三日医疗机构制剂配制质量管理规范( 试行 )第一章总则第一条根据《中华人民共和国药品管理法》的规定,参照《药品生产质量管理规范》的基本原则,制定本规范。
第二条医疗机构制剂是指医疗机构根据本单位临床需要而常规配制、自用的固定处方制剂。
第三条医疗机构配制制剂应取得省、自治区、直辖市药品监督管理局颁发的《医疗机构制剂许可证》。
第四条国家药品监督管理局和省、自治区、直辖市药品监督管理局负责对医疗机构制剂进行质量监督,并发布质量公告。
第五条本规范是医疗机构制剂配制和质量管理的基本准则,适用于制剂配制的全过程。
第二章机构与人员第六条医疗机构制剂配制应在药剂部门设制剂室、药检室和质量管理组织。
机构与岗位人员的职责应明确,并配备具有相应素质及相应数量的专业技术人员。
第七条医疗机构负责人对本《规范》的实施及制剂质量负责。
第八条制剂室和药检室的负责人应具有大专以上药学或相关专业学历,具有相应管理的实践经验,有对工作中出现的问题作出正确判断和处理的能力。
制剂室和药检室的负责人不得互相兼任。
第九条从事制剂配制操作及药检人员,应经专业技术培训,具有基础理论知识和实际操作技能。
凡有特殊要求的制剂配制操作和药检人员还应经相应的专业技术培训。
第十条凡从事制剂配制工作的所有人员均应熟悉本规范,并应通过本规范的培训与考核。
第三章房屋与设施第十一条为保证制剂质量,制剂室要远离各种污染源。
周围的地面、路面、植被等不应对制剂配制过程造成污染。
第十二条制剂室应有防止污染、昆虫和其它动物进入的有效设施。
第十三条制剂室的房屋和面积必须与所配制的制剂剂型和规模相适应。
应设工作人员更衣室。
第十四条各工作间应按制剂工序和空气洁净度级别要求合理布局。
医院制剂的检验

2 医院制剂的质量标准
《药品生 产质量管 理规范》
《医疗机构 制剂配置质 量管理规范》检品登记”
登记
认真填写“检验记录”
记录
填写检验报告书,“检 验报告单”与“制剂操 作单”归档
出报 告
取样
制剂室送样品
鉴别 检验
依法逐项检查
留样
医院制剂要保存3个月
7
Thanks!
负责本院 药品质量 监督检验 工作
临床毒物的分析
负责制订本院制剂质量 标准、检验规程等文件
2
4
5
7
1 3
对本院制剂,留样 定期观察、检验并 做留样观察记录
6
负责各种样品检
验用试液、标准
液、滴定液的配
制、标定
8
对购入的药品实 施质量抽验
有计划开展各项 科研工作
负责检验仪器设备、
衡量器具的使用、维 修、保养工作
检验室要有完整的 检验卡。检验记录 要编号归档,内容 包括质量标准来源、 鉴别试验、测试数 据、数据处理、结 论等原始数据 。 检验报告书要给药 检室负责人审核签 字。
检验室必须建立留 样观察制度,专人 管理,观察制剂在 储存条件下的含量 变化规律。 配备符合规定的足 够面积和空间的样 品柜。
4
1 医院药品检验室 (三)医院药品检验室的主要工作
第五章 医院制剂
第三节 医院制剂的检验
目 录
1 医院药品检验室 2 医院制剂的质量标准 3 医院制剂质量检查程序
(一)医院药品检验室的设置
检验室根据医院药学部的 面积、医院编制床位数及 医院制剂的范围综合考虑 确定,以确保对本院购入 药品及制剂室原料、辅料、 半成品、成品及包装材料 进行检验。
病理室常用试剂配制方法PPT

铝离子与苏木红结合形成蓝紫色的色淀与细胞核 内核酸的磷酸基牢固结合。 无水乙醇较快溶解苏木精,并可抑制霉菌生长。
苏木精染色液的配制
配制苏木精染液所需试剂的作用
甘油作为稳定剂,延缓苏木精染液蒸发,防 止苏木精过度氧化,延长苏木精液的使用 期。
氧化后,产生的碘化钠是无害的,染液的稳定性好。
空气,颜色可慢慢加深,用其染液就不理想;它 同时又可增加胞核的选择性染色,使胞核染色质显示得清晰细致。
A液苏木素5g充分溶于无水乙醇50ml;
醋病酸理(室ac常et用ica试易c剂id)配又溶制名方乙于法酸 乙醇、乙二醇和甘油,微溶于水;它本身
51g溶于95%酒精100ml中,用玻璃棒研碎溶解后,每100ml加冰醋酸一滴。
石蜡切片苏木精伊红(HE)染色技术是病理、 解剖学、组织胚胎学、法医学和生物学等领域最基本的技术操作。 理想的方法还是在实际操作中染一张淋巴结组织切片,在镜下观察其染色效果。
1%盐酸酒精有效期3个月。 伊红染色液有效期3个月。
病理常用试剂及染液的配制 木素染液有效期3个月。 随后苏木精染液每天都会在液面形成一层金属膜,需要把染液过滤后才能用以染色,而汞盐也是一种毒性物质。 木素染液有效期3个月。 苏木精若存放过久或接触空气,颜色可慢慢加深,用其染液就不理想; B液硫酸铝钾50g溶于蒸馏水650ml; 配制苏木精染液所需试剂的作用 醋酸(aceticacid)又名乙酸
苏木精染色液的配制
苏木精氧化剂中首选碘酸钠。其优点是在 室温下易溶于水,不需煮沸就能放氧。氧 化后,产生的碘化钠是无害的,染液的稳 定性好。而氧化汞需要在苏木精染液煮沸 时加入才能放氧,当开始放氧时又要立即 把染液置入冷水中终止放氧。随后苏木精 染液每天都会在液面形成一层金属膜,需 要把染液过滤后才能用以染色,而汞盐也 是一种毒性物质。
医院制剂配制与检验.

我院临床毒物分析10年回顾
刘健, 等(中南大学湘雅二医院临床药学研究室)
摘要: 回顾分析本毒物咨询中心10年来的毒物分析工作。对 98年1月1日~ 07年12月31日体内药(毒)物分析报告及会诊记 录进行分析整理。10年共计进行毒物分析1547例, 其中毒物 分析检测阳性944例, 中毒药物主要为苯二氮类镇静催眠药, 该类药物在法医毒物分析案例中也很常见。中毒者以15~ 39 岁的青年群体居多, 且女性远多于男性。临床毒物分析对于临 床中毒的诊断, 救治, 预防具有重要意义, 近10 年毒物分析提 示我们需进一步加强精神麻醉药品的管理, 防止药物滥用和预 防服毒自杀。 关键词: 毒物分析; 中毒; 苯二氮类; 药物滥用
13
第八章 配制管理
配制规程和标准操作规程不得任意修改。
在同一配制周期中制备出来的一定数量常规配制的 制剂为一批
每批制剂均应按投入和产出的物料平衡进行检查 每批制剂均应有一份能反映配制各个环节的完整记 录。
新制剂的配制工艺及主要设备应按验证方案进行验 证。
14
第九章 质量管理与自检
10
第五章 物 料
物料购入、储存、发放与使用应制定管理 制度 物料应符合药用要求 物料要严格管理。合格、待验及不合格物 料应分别存放,并有易于识别的明显标志
物料应按其性能与用途合理存放
制剂的标签、使用说明书严格管理
11
第六章 卫 生
配制间不得存放与配制无关的物品
清洁规程,包括清洁方法、程序、间隔时间、使用清洁剂或消 毒剂、清洁工具的清洁方法和存放地点等。
药物配制操作规程及评分标准

合无菌技术操作原则。
4.检查无菌物品有效期。
31Βιβλιοθήκη 认真核对医嘱及药物配伍禁忌表,洗手。
5
2.检查药品质量及有效期、批号,药瓶是否破损,药液是否浑浊、沉淀、变质及絮状物 。
8
3.再次核对药物名称,检查一次性注射器有效期,包装是否完好。
8
4.打开注射器,连接针头,排净注射器内空气。
8
操作
质量 5.贴瓶贴,打开瓶盖,消毒瓶塞,待干。
7
70分
6.消毒药瓶开口,抽取溶剂注入药瓶后,适量回抽空气。
10
7.有负压的安瓿,抽药钱注射器注入适量空气后再回抽。
8
8.配制完成后,药瓶上注明配置时间及配药者签名,备用。
8
9.医疗废物分类规范处置,洗手。
8
1.严格执行无菌技术操作原则,操作熟练。
3
终末 2.药物溶解充分,抽吸干净,不浪费药液。
3
质量
15分 3.准备计算药物剂量,配制方法正确。
4
4.药物现配现用,以免长时间放置而降低效价。
5
商城县人民医院药物配制的操作规程及评分标准
项目
操作规程
1.人员要求:衣帽整洁、洗手、戴口罩。
分值 3
2.环境评估:环境整洁、安静、光线充足,符合无菌操作、职业防护要求。
3
准备
质量 3.物品准备:治疗车、无菌盘、注射药物、皮肤消毒剂、速干手消毒剂、无菌注射器
15分 (根据药液量选择)、棉棒、治疗卡、弯盘、砂轮、锐器盒。用物齐全,摆放有序,符 6
常见制剂抽样参考数量表
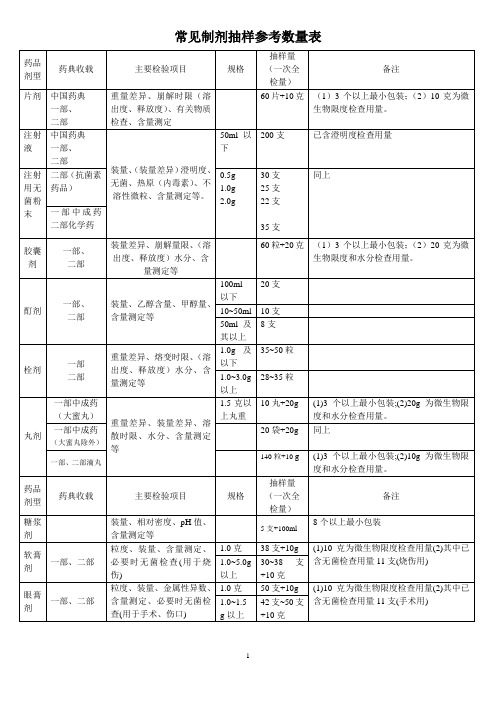
常见制剂抽样参考数量表
备注:
1、不同的药品检验项目,有关取样的规定和方法也不完全统一。
有的按“体积”计,有的按“重量”计,有的按“包装”计,不同的计量方式与各具体品种的含量规格及包装规格有关。
本表为了能较准确地列出抽样量,故没有使用统一计量单位,在现场抽样时,抽样人员可根据品种的含量规格和包装规格进行换算,得出抽样量。
2、表中主要检验项目中,各剂型均未列入“微生物限度”检查,除注射剂、膏药、橡胶膏剂,其余剂型应根据药典规定进行“微生物限度”检查。
“微生物限度”均应至少从二个包装中取样。
药品常规检验数量表
常见制剂抽样参考数量表
备注:
1、不同的药品检验项目,有关取样的规定和方法也不完全统一。
有的按“体积”计,有的按“重量”
计,有的按“包装”计,不同的计量方式与各具体品种的含量规格及包装规格有关。
本表为了能较
准确地列出抽样量,故没有使用统一计量单位。
在现场抽样时,抽样人员可根据品种的含量规格和包装规格进行换算,得出抽样量。
2、表中主要检验项目中,各剂型均未列入“微生物限度”检查,除注射剂、透皮贴剂、巴布膏剂、膏
药、橡胶膏剂,其余剂型应根据药典规定进行“微生物限度”检查。
“微生物限度”均应至少从二个包装中取样。
药物配制操作规程及评分标准

7
70分
6.消毒药瓶开口,抽取溶剂注入药瓶后,适量回抽空气。
10
7.有负压的安瓿,抽药钱注射器注入适量空气后再回抽。
8
8.配制完成后,药瓶上注明配置时间及配药者签名,备用。
8
9.医疗废物分类规范处置,洗手。
8
1.严格执行无菌技术操作原则,操作熟练。
3
终末 2.药物溶解充分,抽吸干净,不浪费药液。
3
质量
合无菌技术操作原则。
4.检查无菌物品有效期。
3
1.认真核对医嘱及药物配伍禁忌表,洗手。
5
2.检查药品质量及有效期、批号,药瓶是否破损,药液是否浑浊、沉淀、变质及絮状物 。
8Hale Waihona Puke 3.再次核对药物名称,检查一次性注射器有效期,包装是否完好。
8
4.打开注射器,连接针头,排净注射器内空气。
8
操作
质量 5.贴瓶贴,打开瓶盖,消毒瓶塞,待干。
15分 3.准备计算药物剂量,配制方法正确。
4
4.药物现配现用,以免长时间放置而降低效价。
5
商城县人民医院药物配制的操作规程及评分标准
项目
操作规程
1.人员要求:衣帽整洁、洗手、戴口罩。
分值 3
2.环境评估:环境整洁、安静、光线充足,符合无菌操作、职业防护要求。
3
准备
质量 3.物品准备:治疗车、无菌盘、注射药物、皮肤消毒剂、速干手消毒剂、无菌注射器
15分 (根据药液量选择)、棉棒、治疗卡、弯盘、砂轮、锐器盒。用物齐全,摆放有序,符 6
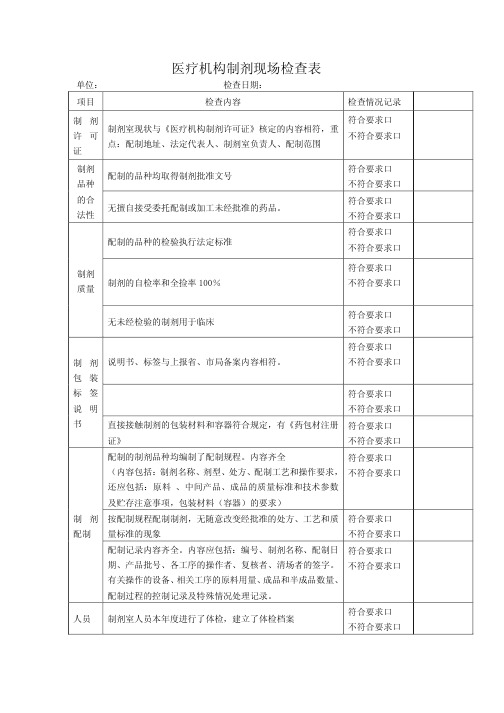
医疗机构制剂现场检查表
自查
定期对实施《医疗机构制剂配制质量管理规范》进行自查 对药监部门的监督检查情况中存提出的问题进行了整改
符合要求口 不符合要求口
符合要求口 不符合要求口
检查 情况 总结
检查人员签名 制剂室陪同人员签名
单位� 项目
医疗机构制剂现场检查表
检查日期� 检查内容
检查情况记录
制剂
符合要求口
制剂室现状与《医疗机构制剂许可证》核定的内容相符�重
许可
不符合要求口
点�配制地址、法定代表人、制剂室负责人、配制范围
证
制剂 品种 ቤተ መጻሕፍቲ ባይዱ合 法性
配制的品种均取得制剂批准文号 无擅自接受委托配制或加工未经批准的药品。
符合要求口 不符合要求口 符合要求口 不符合要求口
不符合要求口
配制记录内容齐全。内容应包括�编号、制剂名称、配制日 符合要求口 期、产品批号、各工序的操作者、复核者、清场者的签字。 不符合要求口 有关操作的设备、相关工序的原料用量、成品和半成品数量、
配制过程的控制记录及特殊情况处理记录。
人员 制剂室人员本年度进行了体检�建立了体检档案
符合要求口 不符合要求口
配制的品种的检验执行法定标准
符合要求口 不符合要求口
制剂 质量 制剂的自检率和全捡率 100�
符合要求口 不符合要求口
无未经检验的制剂用于临床
符合要求口 不符合要求口
符合要求口
制 剂 说明书、标签与上报省、市局备案内容相符。
不符合要求口
包装
标签
符合要求口
说明
不符合要求口
书
直接接触制剂的包装材料和容器符合规定�有《药包材注册 符合要求口
证》
不符合要求口
我院自制制剂检验PPT文档31页

26、机遇对于有准备的头脑有特别的 亲和力 。 27、自信是人格的核心。
28、目标的坚定是性格中最必要的力 量泉源 之一, 也是成 功的利 器之一 。没有 它,天 才也会 在矛盾 无定的 迷径中 ,徒劳 无功。- -查士 德斐尔 爵士。 29、困难就是机遇。--温斯顿.丘吉 尔。 30、我奋斗,所以我快乐。--格林斯 潘。
谢谢
11、越是没有本领的就越加自命不凡。——邓拓 12、越是无能的人,越喜欢挑剔别人的错儿。——爱尔兰 13、知人者智,自知者明。胜人者有力,自胜者强。——老子 14、意志坚强的人能把世界放在手中像泥块一样任意揉捏。——歌德 15、最具挑战性的挑战莫过于提升自我。——迈克尔·F·斯特利
