化学键 知识点总结及练习
高考化学化学键知识点总结

高考化学化学键知识点总结一、化学键的定义和分类在化学世界中,化学键就像是将原子们紧紧“黏合”在一起的神秘力量。
它是相邻原子之间强烈的相互作用。
化学键主要分为离子键、共价键和金属键三大类。
离子键,通常发生在活泼金属与活泼非金属之间。
比如说,氯化钠(NaCl)的形成就是典型的离子键的例子。
钠原子容易失去一个电子,形成带正电的钠离子(Na⁺);氯原子则容易获得一个电子,变成带负电的氯离子(Cl⁻)。
钠离子和氯离子之间由于静电作用相互吸引,就形成了离子键。
共价键则是原子间通过共用电子对形成的化学键。
比如氢气(H₂)分子中,两个氢原子各自提供一个电子,形成共用电子对,从而将两个氢原子紧紧“拉住”。
共价键又分为极性共价键和非极性共价键。
当共用电子对不偏向任何一方原子时,形成的就是非极性共价键,像氧气(O₂)分子中的共价键。
而当共用电子对偏向某一方原子时,就形成了极性共价键,例如氯化氢(HCl)分子中的共价键。
金属键存在于金属单质或合金中。
金属原子失去部分或全部外层电子,形成金属离子和自由电子。
金属离子与自由电子之间存在强烈的相互作用,从而使金属具有良好的导电性、导热性和延展性。
二、离子键的特点离子键具有以下几个显著特点:1、没有方向性离子键的形成与离子的电荷分布有关,而离子的电荷分布通常是球形对称的,所以离子键在空间的各个方向上的作用强度是相同的,没有特定的方向限制。
2、没有饱和性只要离子周围空间允许,它可以尽可能多地吸引带相反电荷的离子,并不存在饱和的问题。
离子键的强度通常用晶格能来衡量。
晶格能越大,离子键越强,离子化合物的熔点和沸点也就越高。
三、共价键的特点与离子键不同,共价键具有方向性和饱和性。
1、方向性这是因为形成共价键的原子轨道在空间具有一定的方向性,只有沿着特定的方向进行重叠,才能最大程度地形成稳定的共价键。
2、饱和性每个原子所能形成的共价键数目是有限的,取决于该原子所能提供的未成对电子数目。
共价键的键参数也是我们需要重点关注的内容,包括键长、键能和键角。
化学键知识点总结

化学键知识点总结
化学键知识点总结
一、化学键的分类
化学键是分子中原子之间相互作用的结果,它可以把两个或多个原子联结在一起形成分子或晶体结构。
化学键可以根据原子之间的相互作用方式分为五类:原子键、共价键、离子键、分子间键及非共价键。
1. 原子键:原子之间由共用电子而形成的键,也称单原子键,只存在于少量元素的某些化合物中,如H2、Cl2等;
2. 共价键:是指电子对在原子之间共享,由共享电子对形成的键,是最常见的化学键,如HCl、H2O、CH4等;
3. 离子键:是指离子之间由相互作用形成的键,一般是金属离子与非金属离子结合而形成的,如NaCl、CaCl2等;
4. 分子间键:是指分子之间相互作用形成的键,是化学键中最特殊的一种,如氢键、氯键等;
5. 非共价键:是指原子之间由于氢原子存在而形成的键,是一种较弱的化学键,如氨基酸分子之间的氢键等。
二、共价键的类型
共价键是指原子之间共享电子而形成的键,是最常见的化学键。
它可以根据电子对的数量进行分类:
1. 单键:是指原子之间的电子对数为1的共价键,如H-Cl、H-Br 等;
2. 双键:是指原子之间的电子对数为2的共价键,如Cl-Cl、O=O等;
3. 三键:是指原子之间的电子对数为3的共价键,如N#N、C#N 等;
4. 多键:是指原子之间的电子对数超过3的共价键,如C≡N、C≡C等。
化学键复习知识总结

化学键知识总结一.离子键1.离子键:阴阳离子之间强烈的相互作用叫做离子键。
注:(1)成键微粒:阴阳离子间(2)成键本质:阴、阳离子间的静电作用(3)成键原因:电子得失(4)形成规律:活泼金属与活泼非金属化合时形成离子键离子化合物:像NaCl这种由离子构成的化合物叫做离子化合物。
(1)活泼金属与活泼非金属形成的化合物。
如NaCl、Na2O、K2S等(2)强碱:如NaOH、KOH、Ba(OH)2、Ca(OH)2等(3)大多数盐:如Na2CO3、BaSO4(4)铵盐:如NH4Cl判断方法:一般含金属元素的物质(化合物)+铵盐。
(一般规律)注意:(1)酸不是离子化合物。
(2)离子键只存在离子化合物中,离子化合物中一定含有离子键。
(3)离子化合物不是分子,其化学式不能称为分子式二.共价键1.共价键:原子间通过共用电子对所形成的相互作用叫做共价键。
用电子式表示HCl的形成过程:注:(1)成键微粒:原子(2)成键实质:静电作用(3)成键原因:共用电子对(4)形成规律:非金属元素形成的单质或化合物形成共价键2.共价化合物:以共用电子对形成分子的化合物叫做共价化合物。
化合物离子化合物共价化合物化合物中不是离子化合物就是共价化合物3.共价键的存在: 非金属单质:H 2、X 2 、N2等(稀有气体除外)共价化合物:H 2O 、 CO 2 、SiO 2、 H 2S 等复杂离子化合物:强碱、铵盐、含氧酸盐4.共价键的分类:非极性键:在同种元素..的原子间形成的共价键为非极性键。
共用电子对不发生偏移。
极性键:在不同种元素..的原子间形成的共价键为极性键。
共用电子对偏向吸引能力强的一方。
三.电子式:定义:在元素符号周围用小黑点(或×)来表示原子的最外层电子(价电子)的式子叫电子式。
原子的电子式:2.阴阳离子的电子式:(1)阳离子 简单阳离子:离子符号即为电子式,如Na +、、Mg 2+等复杂阳离子:如NH 4+ 电子式: 、(2)阴离子 简单阴离子:复杂阴离子:3.物质的电子式:离子的电子式:阳离子的电子式一般用它的离子符号表示;在阴离子或原子团外加方括弧,并在方括弧的右上角标出离子所带电荷的电性与电量。
化学键知识点归纳总结(范文)

化学键知识点归纳总结(范文)一、化学键的基本概念1.1 化学键的定义化学键是原子或离子之间通过电子的相互作用形成的强烈吸引力,它是维持分子或晶体结构稳定的基本力量。
化学键的形成使得原子或离子能够结合成稳定的分子或晶体。
1.2 化学键的类型根据形成方式和性质的不同,化学键主要分为以下几种类型:离子键:由正负离子之间的静电吸引力形成。
共价键:由原子间共享电子对形成。
金属键:金属原子间通过自由电子形成的键。
分子间作用力:包括范德华力和氢键,虽然不属于传统意义上的化学键,但对分子间相互作用有重要影响。
二、离子键2.1 离子键的形成离子键通常发生在金属和非金属元素之间。
金属原子失去电子形成阳离子,非金属原子获得电子形成阴离子,阳离子和阴离子之间通过静电吸引力结合形成离子化合物。
2.2 离子键的特点高熔点和沸点:由于离子间的静电吸引力较强,离子化合物通常具有高熔点和沸点。
导电性:在熔融状态或水溶液中,离子化合物能够导电,因为此时离子可以自由移动。
硬度大、脆性大:离子化合物通常硬度较大,但脆性也大,容易在受到外力时断裂。
2.3 典型离子化合物NaCl(氯化钠):由Na+和Cl离子组成,是最常见的离子化合物之一。
CaCO3(碳酸钙):由Ca2+和CO3^2离子组成,广泛存在于自然界中。
三、共价键3.1 共价键的形成共价键通常发生在非金属元素之间。
两个原子通过共享一对或多对电子形成共价键,使得每个原子都达到稳定的电子配置。
3.2 共价键的类型单键:由一对共享电子形成,如H2分子中的HH键。
双键:由两对共享电子形成,如O2分子中的O=O键。
三键:由三对共享电子形成,如N2分子中的N≡N键。
3.3 共价键的特点方向性:共价键具有明确的方向性,原子间的电子云重叠决定了键的方向。
饱和性:每个原子能够形成的共价键数量有限,取决于其未成对电子的数量。
极性:根据形成共价键的原子电负性差异,共价键可以分为极性共价键和非极性共价键。
(完整版)化学键知识点

离子键一 离子键与离子化合物 1.氯化钠的形成过程: 2.离子键(1)概念:带相反电荷离子之间的相互作用称为离子键。
(2)实质:(3)成键微粒:阴、阳离子。
(4)离子键的形成条件:离子键是阴、阳离子间的相互作用,如果是原子成离子键时,一方要容易失去电子,另一方要容易得到电子。
①活泼金属与活泼的非金属化合时,一般都能形成离子键。
如第IA 、ⅡA 族的金属元素(如Li 、Na 、K 、Mg 、Ca 等)与第ⅥA 、ⅦA 族的非金属元素(如O 、S 、F 、Cl 、Br 、I 等)化合时,一般都能形成离子键。
②金属阳离子与某些带负电荷的原子团之间(如Na +与OH -、SO 4-2等)形成离子键。
③铵根离子与酸根离子(或酸式根离子)之间形成离子键,如NH 4NO 3、NH 4HSO 4。
【注意】①形成离子键的主要原因是原子间发生了电子的得失。
②离子键是阴、阳离子间吸引力和排斥力达到平衡的结果,所以阴、阳离子不会无限的靠近,也不会间距很远。
3.离子化合物(1)概念:由离子键 构成的化合物叫做离子化合物。
(2)离子化合物主要包括强碱[NaOH 、KOH 、B a (O H )2等]、金属氧化物(K 2O 、Na 2O 、 MgO 等)和绝大数盐。
【注意】离子化合物中一定含有离子键,含有离子键的化合物一定是离子化合物。
二 电子式1.电子式的概念在元素符号周围,用“·”或“×”来表示原子的最外层电子的式子叫电子式。
(1)原子的电子式:元素周围标明元素原子的最外层电子,每个方向不能超过2个电子。
当最外层电子数小于或等于4时以单电子分步,多于4时多出部分以电子对分布。
例如:(2)简单阳离子的电子式:简单阳离子是由金属原子失电子形成的,原子的最外层已无电子,故用阳离子的符号表示,如: Na+、Li+、Mg+2、Al+3等。
(3)简单阴离子的电子式:不但要画出最外层电子数,而且还应用括号“[ ]”括起来,F并在右上角标出“-n”电荷字样。
化学键知识点与练习题(含答案)

第三节化学键一、化学键:使离子相结合或使原子相结合的作用力叫做化学键。
相邻的(两个或多个)离子或原子间的强烈的相互作用。
二、形成原因:原子有达到稳定结构的趋势,是原子体系能量降低。
三、类型:化学键离子键共价键极性键非极性键一、离子键和共价键比较二、非极性键和极性键通常以晶体形态存在和共价键时,以离子键为主,该化合物也称为离子化合物(3)只有..当化合物中只存在共价键时,该化合物才称为共价化合物。
(4)在离子化合物中一般既含有金属元素又含有非金属元素;共价化合物一般只含有非金属元素(NH4+例外)注意:(1)离子化合物中不一定含金属元素,如NH4NO3,是离子化合物,但全部由非金属元素组成。
(2)含金属元素的化合物不一定是离子化合物,如A1C13、BeCl2等是共价化合物。
二、、一、电子式:1.各种粒子的电子式的书写:(1)原子的电子式:常把其最外层电子数用小黑点“·”或小叉“×”来表示。
例如:(2)简单离子的电子式:①简单阳离子:简单阳离子是由金属原子失电子形成的,原子的最外层已无电子,故用阳离子符号表示,如Na +、Li +、Ca 2+、Al 3+等。
②简单阴离子:书写简单阴离子的电子式时不但要画出最外层电子数,而且还应用括号“[]”括起来,并在右上角标出“n —”电荷字样。
例如:氧离子、氟离子。
③ 原子团的电子式:书写原子团的电子式时,不仅要画出各原子最外层电子数,而且还应用括号“[]”括起来,并在右上角标出“n —”或“n+”电荷字样。
例如:铵根离子 、氢氧根离子。
(3)部分化合物的电子式:① 离子化合物的电子式表示方法:在离子化合物的形成过程中,活泼的金属离子失去电子变成金属阳离子,活泼的非金属离子得到电子变成非金属阴离子,然后阴阳离子通过静电作用结合成离子键,形成离子化合物。
所以,离子化合物的电子式是由阳离子和带中括号的阴离子组成,且简单的阳离子不带最外层电子,而阴离子要标明最外层电子多少。
化学键知识详解
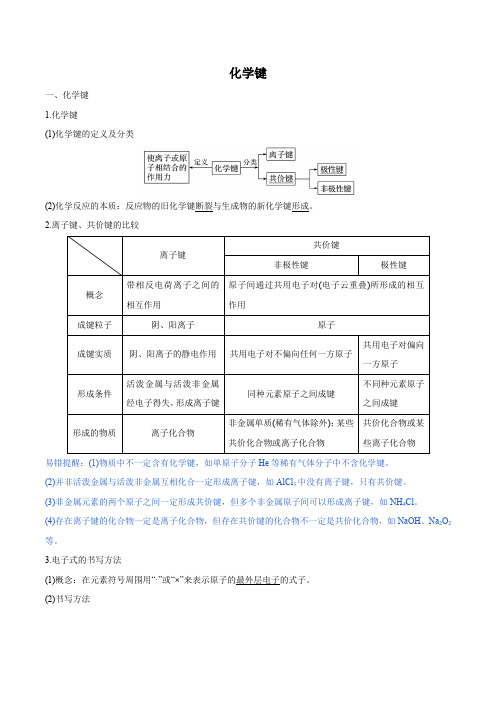
化学键一、化学键1.化学键(1)化学键的定义及分类(2)化学反应的本质:反应物的旧化学键断裂与生成物的新化学键形成。
2.离子键、共价键的比较易错提醒:(1)物质中不一定含有化学键,如单原子分子He等稀有气体分子中不含化学键。
(2)并非活泼金属与活泼非金属互相化合一定形成离子键,如AlCl3中没有离子键,只有共价键。
(3)非金属元素的两个原子之间一定形成共价键,但多个非金属原子间可以形成离子键,如NH4Cl。
(4)存在离子键的化合物一定是离子化合物,但存在共价键的化合物不一定是共价化合物,如NaOH、Na2O2等。
3.电子式的书写方法(1)概念:在元素符号周围用“·”或“×”来表示原子的最外层电子的式子。
(2)书写方法(3)用电子式表示化合物的形成过程①离子化合物如NaCl:。
②共价化合物如HCl:+―→4.化学键与化合物的关系易错提醒:(1)有化学键变化的不一定是化学变化。
如NaCl晶体从溶液中析出只有化学键的形成,没有化学键的断裂,HCl溶于水电离成H+和Cl-等,只有旧化学键的断裂没有新化学键的形成,二者都没有发生化学变化。
(2)存在离子键的化合物一定是离子化合物。
(3)离子化合物中一定存在离子键,可能存在共价键,如NaOH、Na2O2、(NH4)2SO4等。
(4)共价化合物中只有共价键,一定没有离子键。
(5)熔化时导电的化合物一定是离子化合物;溶解时导电,不能判别。
(6)全部由非金属元素组成的化合物也可能是离子化合物,如NH4Cl、NH4NO3等铵盐,铵根离子和酸根离子之间以离子键结合。
由金属元素和非金属元素形成的化合物也可能是共价化合物,如AlCl3。
(7)非金属单质只有共价键(稀有气体除外)。
5.化学键对物质性质的影响(1)对物理性质的影响:金刚石、晶体硅、石英、金刚砂等物质硬度大、熔点高,就是因为其中的共价键,破坏时需消耗很多的能量。
NaCl等部分离子化合物中也有很强的离子键,故其熔点也较高。
化学:化学键知识点总结及练习(2篇)

化学:化学键知识点总结及练习(2篇)化学键知识点总结及练习(第一篇)一、化学键的基本概念1. 定义:化学键是原子之间通过共用或转移电子形成的强烈相互作用,它是维持分子或晶体结构稳定的基本力量。
2. 类型:离子键:通过阴阳离子之间的静电吸引力形成的化学键。
例如,NaCl中的Na⁺和Cl⁻。
共价键:通过原子间共用电子对形成的化学键。
例如,H₂中的HH键。
金属键:金属原子通过自由电子海模型形成的化学键。
例如,Fe中的金属键。
范德华力:分子间较弱的相互作用,包括色散力、取向力和诱导力。
二、离子键1. 形成条件:通常发生在金属和非金属之间。
金属原子失去电子形成阳离子,非金属原子获得电子形成阴离子。
2. 特点:高熔点和沸点。
在水溶液中或熔融状态下导电。
硬而脆。
3. 实例:NaCl(氯化钠):Na失去一个电子形成Na⁺,Cl获得一个电子形成Cl⁻。
MgO(氧化镁):Mg失去两个电子形成Mg²⁺,O 获得两个电子形成O²⁻。
三、共价键1. 形成条件:通常发生在非金属原子之间。
原子通过共用电子对达到稳定的电子配置。
单键:一对共用电子对。
例如,H₂中的HH键。
双键:两对共用电子对。
例如,O₂中的O=O键。
三键:三对共用电子对。
例如,N₂中的N≡N键。
3. 极性共价键:当两个不同非金属原子形成共价键时,电子对偏向电负性较大的原子,形成极性共价键。
例如,HCl中的HCl键。
4. 特点:熔点和沸点较低。
不导电。
分子间作用力较弱。
四、金属键1. 形成条件:发生在金属原子之间。
金属原子失去外层电子形成阳离子,自由电子在金属阳离子间流动。
高导电性和导热性。
延展性和可塑性。
熔点较高。
3. 实例:Cu(铜):Cu原子失去一个电子形成Cu⁺,自由电子在Cu⁺间流动。
五、范德华力1. 类型:色散力:瞬时偶极矩之间的相互作用。
例如,稀有气体分子间的相互作用。
取向力:永久偶极矩之间的相互作用。
例如,HCl分子间的相互作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学键一、化学键1、概念:化学键是指使离子或原子之间结合的作用。
或者说,相邻的原子或原子团强烈的相互作用叫化学键。
注意:不是所有的物质都是通过化学键结合而成。
惰性气体就不存在化学键。
2、分类:金属键、离子键、共价键。
3、意义:①解释绝大部分单质和化合物的形成:绝大部分单质和化合物都是离子或者原子通过化学键的作用形成的。
②解释化学变化的本质:化学变化的本质就是反应物化学键的断裂和生成物化学键的形成过程。
原子重新组合就是通过反应物原子间化学键的断裂,然后又重新形成新的化学键的过程。
二、离子键:带相反电荷离子间的相互作用称为离子键。
1、概念:使阴阳离子结合成化合物的静电作用,叫做离子键。
2、成键微粒:阴阳离子3、本质:静电作用4、成键过程:阴阳离子接近到某一定距离时,吸引和排斥达到平衡,就形成了离子键。
5、成键条件:活泼金属(IA IIA)与活泼非金属(VIA VIIA)之间的化合物。
6、结果:形成离子化合物。
离子化合物就是阴阳离子通过离子键而形成的化合物。
离子晶体就是阴阳离子通过离子键而形成的晶体。
7、范围:典型的金属与典型的非金属之间容易形成离子键。
特别是位于元素周期表中左下方的金属与右上方的非金属元素之间。
例如:氧化钾、氟化钙、氢氧化钠、硝酸钾、氯化钾三、共价键:1、概念:原子通过共用电子对形成的相互作用。
2、本质:静电作用3、方式:原子间通过共用电子对形成静电作用。
4、条件:非金属元素的原子之间容易形成共价键。
5、结果:形成共价单质或共价化合物。
共价单质是指同种元素的原子通过共价键所形成的单质。
共价化合物是由不同种元素的原子通过共价键所形成的化合物。
6、范围:共价单质有H2、B、C、N2、O2、O3、F2、Si、P、S、Cl2、Br2、I2.共价化合物主要有非金属氢化物、非金属的氧化物、酸、非金属的氯化物。
7、类型:极性键:共用电子对发生偏移的共价键。
主要存在于不同元素的原子之间所形成的共价键。
如:H-O、C=O、H-C、非极性键:共用电子对不发生偏移的共价键。
主要存在于同种元素的原子之间所形成的共价键。
如:H-H、C-C、C= C、 C C、N N四、化学键的表示方法——电子式:在元素符号周围用小黑点· (或×)来表示原子的最外层电子的式子。
1、原子的电子式:2、离子的电子式:(1)阳离子(直接用离子符号表示)(2)阴离子练习:写出:溴原子、硅原子;硫离子、鋁离子、钾离子的电子式3、离子化合物的电子式:把化合物的阴阳离子对称分布即可,但对相同离子不能合并,如NaCl、MgCl2的电子式说明:1)金属离子的电子式就是其离子符号,因最外层为02)阴离子和复杂离子的电子式要标[ ]及“电荷数”3)化合物的电子式,数目多的离子均匀分布在数目少的周围,画出每一个化学键,不得合并。
4、共价化合物的电子式Cl 2 CCl 4 H 2O HF5、用电子式表示离子化合物的形成过程:氯化钠的形成过程可如下表示 Na ×+⋅⋅⋅⋅⋅⋅Cl ⋅⋅⨯⋅⋅⋅]-6、用电子式表示共价化合物的形成过程:书写原则:1)原子、离子都要标出最外层电子,离子须标明电荷;2)阴离子要用方括号括起来;3粒不可以合并。
4)不能把“→”写成“=”;5)用箭头标明电子转移方向。
注意:含有共价键的化合物不一定是共价化合物。
共价化合物中一定含有共价键。
共价化合物中一定不含离子键。
含有离子键的化合物一定是离子化合物。
离子化合物中一定含有离子键离子化合物中可能是含有共价键。
分子中只含有共价键的化合物叫做共价化合物対点练习1.写出下列物质的电子式H 2: N 2: H 2O : HCl : N 2H 4: CO: NH 3: H 2O 2: CCl 4: CO 2: CaC 2: NaBr : Na 2O 2: NaOH : NH 4Cl: C 2H 2: C 2H 4: O 2-: OH -: 镁离子: 氯离子:対点练习2.写出下列化合物的形成过程CaO : MgCl 2:CH 4: H 2O :五.范德华力和氢键1.分子间作用力(1)概念:分子之间普遍存在的一种把分子聚集在一起的相互作用力。
范德华力的作用能通常比化学键的键能小得多,一般只有2~20kJ /mol ,主要影响物质的物理性质(熔、沸点和溶解度等)。
(2)规律:组成和结构相似的由分子构成的物质,相对分子质量越大,范德华力越大,物质的熔、沸点越高。
2.氢键(1)概念:氢原子与 电负性大的原子X 以 共价键结合,若与电负性大、半径小的原子Y (O F N 等)接近,在X 与Y 之间以氢为媒介,生成X-H …Y 形式的一种特殊的分子间或分子内相互作用,称为氢键(2)存在条件:①原子半径小 ②电负性大(符合条件的元素为N 、O 、F)(3)存在形式:通式,可用X -H …Y 表示。
式中X 和Y 代表F ,O ,N 等电负性大而原子半径较小的非金属原子。
X 和Y 可以是两种相同的元素,也可以是两种不同的元素。
如F —H … F O —H … N O —H … O N —H … N N —H … O 等(4)对物质的影响作用:①影响物质的熔沸点反常 ②易液化 ③相似相溶六.化学键与分子间作用力和氢键的关系当堂演练1.下列说法正确的是 ( )A.含有金属元素的化合物一定是离子化合物B.第ⅠA 族和第ⅦA 族原子化合时,一定生成离子键C.由非金属元素形成的化合物一定不是离子化合物D.活泼金属与非金属化合时,能形成离子键2.下列叙述不正确的是 ( )A .O 2分子间存在着非极性共价键B .CO 2分子内存在着极性共价键C .SO 2与H 2O 反应的产物是共价化合物D 盐酸中含有H +和Cl -,故HCl 为离子化合物3.下列含有共价键的化合物是( )A 、HIB 、NaOHC 、Br 2 D.NaCl4.下列叙述正确的是( )A 、O 2分子间存在着非极性共价键B .CO 2分子内存在着极性共价键C .SO 2与H 2O 反应的产物是离子化合物D .盐酸中含有H +和Cl -,故HCl 为离子化合物5.含有下列键型的物质,可能为单质的是( )A .只有离子键的物质 B.既有离子键,又有非极性键的物质C .既有极性键,又有离子键的物质 D.只有非极性键的物质6.下列物质中两原子是通过共价键结合的是 ( )A.KFB.NaCl C 、H 2O 2 D.MgO7.下列各组原子序数表示的是两种元素,它们能够形成共价化合物的是 ( )A.11与17B.13与10C.12与8D.8与168.下列化合物中既存在离子键又存在共价键的是 ( ) A.KBr B.NaOH C.HBr D. CO 29.下列微粒中,同时具有离子键和共价键的是( )A .3NHB .Cl NH 4C .S H 2D .K 2O10.下列每组中各物质内既有离子键又有共价键的一组是A.NaOH 、H 2SO 4、(NH 4)2SO 4B.MgO 、Na 2SO 4、NH 4HCO 3C.Na 2O 2、KOH 、Na 2SO 4D.HCl 、Al 2O 3、MgCl 2 课后能力提升1. ( )A.离子化合物中可能含共价键B.共价化合物中可能含离子键C.离子化合物中只含离子键D.共价化合物中不含离子键2.下列电子式正确的是 ( )A .氯原子: Cl B.硫离子∶ S ∶ C .溴离子 [∶Br ∶] D 钙离子Ca 2+3. 下列电子式中不正确的是( )4.下列电子式书写正确的是( )A .∙∙∙∙∙∙∙⨯Cl HB .∙∙∙∙∙∙∙⨯∙⨯∙∙∙∙∙∙OC O C .-∙∙∙∙∙∙∙⨯]H O [D .∙∙∙∙∙∙∙⨯∙∙∙∙∙∙∙⨯O Cl H 5.下列物质中含有共价键的离子化合物是A.Ba(OH)2B.CaCl 2C.H 2OD.H 26.下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的( )A.10与12B.8与17C.11与17D.6与147.下列说法中正确的是( )A.含有离子键的化合物必是离子化合物B.具有共价键的化合物就是共价化合物C.共价化合物可能含离子键D.离子化合物中可能含有共价键8.下列关于离子化合物的叙述正确的是( )A.离子化合物中都含有离子键B.离子化合物中的阳离子只能是金属离子C.离子化合物如能溶于水,其水溶液一定可以导电D.溶于水可以导电的化合物一定是离子化合物9、下列关于电子式的说法不正确的是( )A.每种元素的原子都可以写出电子式B.简单阳离子的电子式与它的离子符号相同C.阴离子的电子式要加方括号表示D.电子式就是核外电子排布的式子10.下列物质中,属于共价化合物的是.A.NH 4ClB.H 2SO 4C.NaClD.I 211.写出下列物质的电子式NH 3 Na 2O 2 NH 4F N 2H 212.写出下列物质的形成过程CaCl 2 Na 2S I 2 H 2S。
