第十八章 其它含氮化合物
氢和稀有气体

这一发觉惊动了科学界,因为当初普遍以为空气已研究得够 清楚了,所以 Ramsay 旳工作具有划时代旳历史意义。
2 氙旳氟化合物旳生成 氙旳氟化物能够由两种单质直接化合生成,反应在一定旳温 度和压强下,在镍制旳容器中进行。为何在镍制容器中进行?
Xe ( g ) + F2 ( g ) ——— XeF2 ( g ) Xe 大过量,防止 XeF4 旳生成 ;
Xe ( g ) + 2 F2 ( g ) ——— XeF4 ( g ) F2 过量,但反应时间应短些,防止 XeF6 旳生成; Xe ( g ) + 3 F2 ( g ) ——— XeF6 ( g ) F2 大过量,反应时间长。 F2 和 Xe 旳混合气体在光照下,也能够直接化合成 XeF2 晶体 。
认识到 “ 惰气 ” 也不是绝对惰性旳。他旳工作为开拓 “ 惰气 ” 元 素化学Ba打rt下let了t 基曾础使。O2 同六氟化铂反应,而生成一种新旳化合物 O2+ [ PtF6 ]- 。他联想到 “惰气” 氙 Xe 旳第一电离能 ( 1171.5 kJ·mol-1 ) 同 O2 分子旳第一电离能 ( 1175.7 kJ·mol-1 ) 相近旳 事实,由此推测到 PtF6 氧化 Xe 旳可能性 。
杂化方式 sp3 不等性
杂化方式 sp3 等性
分子构型 三角锥
分子构型 正四面体
XeOF4 价层电子总数
对数 电子对构型
药剂学第十八章经皮吸收制剂介绍

影响超声波促进药物的经皮吸收的主要 因素:
1、超声波的波长;
一般用于促进药物经皮吸收的超声波
波长选择在90kHz~250kHz范围。
2、超声波的输出功率;
3、药物的理化性质。
(三)无针头注射系统
无针头注射系统分为无针头溶液注射系
统和无针粉末注射系统两种。
1、无针头溶液注射器
2、无针粉末注射器(PowderJact)
第十八章
经皮吸收制剂
第一节 概述
经皮传递系统(transdermal drug delivery systems, TDDS)又称经皮治疗系统 (Transdermel therapeatic systems, TTS)系指 经皮给药的新制剂。该制剂经皮肤敷贴方式给药, 药物透过皮肤由毛细血管吸收进入全身血液循环 达到有效血药浓度,并在各组织或病变部位起治 疗或预防疾病的作用。 经皮吸收制剂既可以起局部治疗作用也可以起全 身治疗作用,为一些慢性疾病和局部镇痛的治疗 及预防提供一种简单、方便和有效的给药方式。 常用的剂型为贴剂(patch),还有软膏剂、硬膏剂、 涂剂和气雾剂等。
第二节 经皮制剂的研究
一、影响经皮制剂吸收的因素 (一)生理因素 1、皮肤的水合作用; 2、角质层的厚度;
3、皮肤的条件;
4、皮肤的结合作用与代谢作用。
(二)剂型因素与药物性质
1、药物剂量和药物浓度
TDDS首选药物:
频繁给予的药物;③常规口服或注射给药的药效 不可靠或具严重福副作用的药物。
①一般是剂量小、作用强的药物;②半衰期短需要
1、表面活性剂
表面活性剂自身可以渗入皮肤并可能与皮
肤成分相互作用,改变皮肤透过性质。 非离子型主要增加角质层类脂流动性,刺 激性小,透过促进效果也最差,可能是由 于临界胶团浓度(CMC)较低,药物容易被 增溶在胶束中而较少释放有关。 离子型与皮肤的相互作用较强,但连续应 用后会引起红肿、干燥或粗糙化。
硝基化合物

成环和重排
O R C CH2 R' 成环 O R + C CH2 R' 重排 R R' O R C CH2R' + N N O
+ + H2C N N C R
醛和环酮以重排产物为主,普通的酮主要生成环氧化物。酮分子中 与羰基相连的两个烃基不相同时,得到两种重排产物的混合物。
O R O R C CH2 H + + H2C N N C H + N N O R C CH3
H 重排
O + CH2N2
O CH2 + N N
O + N2
O C CH2 CH2N2 CH2
O C CH2 + N N
O C
环丙酮
3. 与酰氯反应
O R
脱去氯化氢
O R O H C CH2 Cl + -H+ N N O R C CH + N N + N N
+ + H2C N N C Cl
-Cl
R
第一节 硝基化合物
硝基化合物可分为脂肪族硝基化合物和芳香族硝基化合物。 硝基化合物的结构
CH3 + N O
Sp2杂化
O
O O
C-N 147pm , <ONO = 127
N-O
+ N
122pm
+ N O O
+ N
O O
P, π 共轭
CH3
NO2
μ= 3.5 D
硝基为强的吸电子基
厚 第十八章 止 其它含氮化合物
H2 O R'OH NH3 O O RCH2COR'
含氮化合物-4

CH2=N
+
N
-
+
CH2-N N
偶极矩不大
H H
C
N
N
3原子 电子的大π键 原子4电子的大 原子 电子的大π
sp2
sp
sp
电负性: ( ) ( ) 电负性: C(2.6) N(3.0)
重氮甲烷的制备
1. N-甲基 亚硝基酰胺的碱性分解 甲基-N-亚硝基酰胺的碱性分解 甲基
O R-C-Cl + CH3NH2 O CH2-H R-C-N N=O O RCNHCH3 HNO2
O R C Cl O R O R C OH HN3 H2SO4 C N N N H2O R NH2 + N2 + CO2 NaN3
O H2O RCH2C-OH O ROH RCH2C-OR'
NH3
O RCH2C-NH2
4. 制备卡宾(光照分解) 制备卡宾(光照分解)
CH2N2 hν
CH2 + N2
R2CN2
hν
CR2 + N2
反应机理: 反应机理:
CH2N2
CH2=N+=N -
CH2 + N2
其它重氮化合物也可以制成相应的卡宾。 其它重氮化合物也可以制成相应的卡宾。
OCH3 + N2
eg 3
O R-C-CH=CH-OH + CH2N2
O R-C-CH=CH-OCH3 + N2
eg 4
R-OH + CH2N2 R-OH + CH2N2
HBF4
R-OCH3
2. 与醛、酮的反应 与醛、
eg 1 eg 2 反应机理: 反应机理:
含氮化合物练习题

第十八章含氮化合物 (客观题 22 道,主观题 37 道) 一.客观题1. 命名下列化合物并指明分别属于伯胺、仲胺、叔胺、季铵或酰胺哪一类(1)CH 3CH 2CH 2NH 2 丙胺,伯胺 (2)CH 3CH 2CON(CH 3)2 N ,N -二甲基丙酰胺,酰胺 (3N ,N -二甲基苯胺、叔胺(4 α-呋喃甲醛 (5) 氯化三甲基乙基胺,季铵盐(6)2-丙胺,伯胺(7)(CH 3)4N +OH - 氢氧化四甲胺,季铵碱 (8)C 2H 5NHCH 3 甲乙胺,仲胺2. 写出下列化合物的构造式(9)甲基异丙基胺 (10)二苯胺(11) N-甲基丙酰胺 CH 3CH 2CONHCH 3(12)叔丁胺(CH 3)3CNH 2 (13)氯化三甲基苯基胺(14)3-溴吡啶(15)α-氨基丁酸(16)对羟基偶氮苯(17)四氢呋喃(18)甲基磺酰氯 CH 3-SO 2Cl(19)乙基亚磺酸 CH 3CH 2SO 2H(20)氯胺(21)写出分子式为C 8H 11N 的芳胺的所有同分异构体并命名H 3)2H OC H 3C H 2-N +-C H 3C l-C H 3C H 3CH 3C HCH 3NH 2C H 3N H C H C H 3C H 3CH 3CH 3N +CH 3Cl -NB rC H 3C H 2C H C O O HN H 2=H O2-al H C H 2C H 3N C H 3C H33H C H 3C H H C H 3N-乙基苯胺 N,N-二甲基苯胺 N-甲基邻甲苯胺 N-甲基间甲苯胺N-甲基对甲苯胺 邻乙苯胺 间乙苯胺 对乙苯胺2,6-二甲基苯胺 2,5-二甲基苯胺 2,4-二甲基苯胺 2,3-二甲基苯胺3,5-二甲基苯胺 3,4-二甲基苯胺(22)4.将下列化合物按碱性递增次序排列,并说明理由NH 3CH 3CH 2NH 2 CH 3CH 2CONH 2 CH 3NHCH 3解:CH 3CH 2CONH 2<C 6H 5NH 2< NH3<CH 3CH 2NH 2<CH 3NHCH 3用化学方法区别下列各组化合物 (23)二乙胺、苯胺和苄胺C 2H 5NHC 2H 5 × N 2↑C 6H 5NH 2 白色沉淀 C 6H 5CH 2NH 2 × 黄色油状液体(24)对甲基苯胺、N -甲基苯胺和N ,N -二甲基苯胺 N 2↑黄色油状液体绿色H 22C H 3H 2C H 2C H 2C H 3C H H C H 3H 3H 3H 3H 3H 3H 33H 3H 3H 3H 3H 33−−→−溴水−−−→−亚硝酸H 3H 2H -C H 3H 3H 32试以苯及其他试剂为原料,合成下列化合物 (25)对溴苯胺(26)对氨基苯甲酸(27)4-羟基-4’-硝基偶氮苯(28)间硝基乙酰苯胺混酸55~60℃2ΔN O 2N H 23N H C O C H3H O A cO C H 32H+混酸55~60℃Fe, H C l, H 2OΔ3O C H 3AlC l 3O C H 33HO C H 3H2H混酸55~60℃2Δ3O C H 3混酸55~60℃O C H 322H220~5℃l-2+弱酸, 0℃, H 2OH =O 2+H N O 32455℃95℃O 2ΔO 23O A lC l 3O 2H 3O写出对甲基盐酸重氮苯与下列试剂作用后生成的产物 (29)H 3PO 2(30)KI(31)HBr/Cu 2Br 2 (32)HBF 4,然后加热 (33)HCl/Cu 2Cl 2(34)C 6H 5OH (弱碱性溶液)(35)对甲基苯酚(36)N ,N -二甲基苯胺写出乙酐与下列胺反应生成的产物 解:(37)CH 3CH 2CH 2CH 2NH 2 (38)C 6H 5N(CH 3)2 (39)二,主观题(1) 某化合物A 分子式为C 6H 15N ,能溶于稀盐酸,在室温下与亚硝酸作用放出氮气并得到化合物B 。
10.第十八章 血液的生物化学
❖水
全血含水81%--86% 血浆含水93%--95%
❖气体: O2、CO2、N2 ❖可溶性固体
无机物:以电解质为主
尿素、尿酸、 肌酸、肌酐、 胆红素、氨等
有机物:蛋白质、非蛋白质类含氮化合物
(NPN)、糖类和脂类等。
目录
血液的生理功能
❖ 沟通内外环境及机体各部分 ❖ 维持机体内环境的恒定 ❖ 物质运输 ❖ 免疫 ❖ 凝血、抗凝血 ❖ 血液中某些代谢浓度的变化,反映体内代谢
目录
第三节 血细胞物质 代谢
2,3-BPG的功能 2,3-BPG是调节Hb运氧的重要因素
2,3-BPG的负电荷基团与血红蛋白的2个β亚基的
带正电荷基团形成盐键,从而使Hb分子的T构象更
趋稳定,降低血红蛋白与O2的亲和力。
目录
2,3-BPG旁路的主要生理功能是调节血红蛋白 (Hb)运氧
❖ 当血液通过氧分压较高的肺部时,2,3-BPG的影响 不大;而当血液流过氧分压较低的组织时,2,3BPG则显著增加O2释放,以供组织需要。
红细胞和网织红细胞中合成。
2. 亚细胞定位: 起始和终末阶段:线粒体 中间阶段:胞浆
二、合成原料
甘氨酸、琥珀酰CoA、Fe2+
目录
三、血红素合成过程
1. -氨基--酮戊酸(-aminolevulinic acid, ALA)的合成:
COOH
H2C CH2
+ CH2NH2
C~ SCoA COOH
O
琥珀酰CoA 甘氨酸
目录
(二)红细胞的糖酵解存在2,3-二磷酸甘油酸旁路
葡萄糖
1, 3-BPG
二磷酸甘油酸变位酶
3-磷酸甘油酸激酶
2, 3-BPG
第18章 硝基化合物及其它含氮有机物

-
L
Nu
-
L
Nu
Nu + L-
1902年Meisenheimei即已分离出这种中间产物:
OEt O2N NO2 NO2 MeOK EtO O2N OMe NO2 N+ -O O-K+ EtOK O2N NO2 OMe NO2
脂肪族硝基化合物为无色有香气的液体,在水中的溶解度很小。能溶 于多数有机溶剂中,硝基甲烷(沸点102℃)的介电常数(37)较大, 是一种有用的溶剂。 芳香族硝基化合物为无色或淡黄色高沸点液体或低熔点固体,不溶于 水,常常可以随水蒸气蒸馏出来。芳香族硝基化合物常有剧毒。多硝基 化合物为固体,有爆炸性,三硝基甲苯(TNT)是著名的炸药,在实验 室应在水中保存。 芳香族硝基化合物的紫外光谱中,在250~300nm处有一强(ε~6000) 而宽的吸收峰,其位置取决于溶剂和苯环上的取代基的性质。在2-硝基1,3,5-三甲苯的紫外光谱图中硝基的吸收强度明显降低(ε~800)。结构 研究证明:硝基苯分子中所有原子在同一平面内,而在2-硝基-1,3,5-三 甲苯分子中,硝基所在的平面与苯环平面之间的角度为60°左右。由于 硝基偏离苯环平面,不能与苯环有效共轭,紫外吸收强度也相应降低。
§18.1 硝基化合物
硝基化合物一般可分为脂肪族硝基化合物和芳香族硝基化合物,写为R- NO2,Ar-NO2,不能写成R-ONO(R-ONO表示硝酸酯)。硝基化合物 尚未见天然存在,它们均是人工合成的。
18.1.1 硝基化合物的命名和结构
硝基化合物的命名与卤代烃相似。有机化合物命名中,硝基从来都不能作 为母体,只能作为取代基命名,即便硝基与烷基或芳基相连接。
18其他脂肪族含氮化合物

H 2C CH2
第三节 脂肪族偶氮化合物
C H 3 C H 3
C H 3CNNCC H 3
C N C N
C H 3
2 C H 3C +N 2
C N
自由基引发剂
E t O 2 C N N C O 2 E t
偶氮二甲酸二乙酯
Mitsunobu Reaction
DEAD
其中:HY中的Y基团可以各种各样,如HY为羧酸则 发生酯化反应。
H
C l C H 2 C H 3 C
C l
Simmons-Simith 反应
CH2I2+Zn(Cu) 与烯烃加成,生成环丙烷类似物的反应。
C H 3 C H H 3 C 2CC H 2C H 2 I2 E ,t Z 2 n O ( C u )
C H 2 C H 3 C H 3
CH2I2+Zn(Cu) 称为Simmons-Simith试剂,类碳烯。
R O C H 3 + A l ( O R 1 ) 3
CH2N2 是一种良好的甲基化试剂
2). 与醛、酮的反应
O
eg 1
RC - H - +CH 2N2
O
eg 2
RC - R - '+CH 2N2
O RC - C - H3 + N2
O
O
R'
+ RC - C - H 2R' +N2
R
反应机理:
O RC - R - '+ -CH2N+ N
O-
+
R-C-CH2-N N
R'
O-
+
R- C- CH 2
第十二章含氮化合物ppt课件
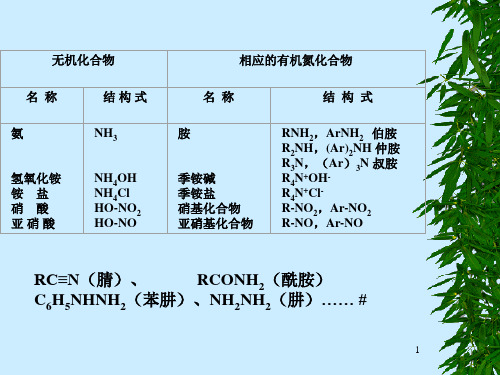
N H
CH 3
+
HNO2
CH 3
叔胺
N CH 3
+
HNO2
NO
N
CH
3
N-亚硝基甲苯胺 (棕色油状)
NMe 2
对亚硝基-N,N-二甲基苯胺 (绿色叶片状)
NO
小结: ① ② ③ ④ ⑤
0℃时,有N2↑为脂肪伯胺。 有黄色油状物或固体,则为脂肪和芳香仲胺。 无可见的反应现象为脂肪叔胺。 0℃时无N2↑,而室温有N2↑,则为芳香伯胺。 有绿色叶片状固体为芳香叔胺。 #
NH 2
Br2 Br Br + HBr
Br 白色↓
Br
Br
HNO3 Fe+HCl
H2SO4△
Br2 NaNO2H2SO4
0~5℃
H3PO2+H2O
TM
17
偶氮化合物中都含有—N=N—官能团。 偶氮化合物通式:R—N=N—R 、
Ar—N=N—R 或 Ar—N=N—
一A、r 芳香族重N盐的制备
NH2 + NaNO2+ 2HCl 0~5℃
NO 2
2-硝基丙烷
NO 2
NO 2
间二硝基苯
H3C
NO 2
对硝基甲苯
2
二、 性质
⒈ 物性
⑴ 硝基是一个强极性基,硝基化合物的偶极矩较大。 ⑵ 沸点比相应的卤代烃高。 ⑶ 多硝基化合物具有爆炸性。 ⑷ 液体硝基化合物是良好的有机溶剂。 ⑸ 有毒。 ⑹ 比重大于1。
⒉化性
⑴ 脂肪族硝基化合物
a. 互变异构和酸性
RC≡N(腈)、
RCONH2(酰胺)
C6H5NHNH2(苯肼)、NH2NH2(肼)…… #
第十八章有机化合物的制备

第十八章
有机化合物的制备
有机化合物的制备又称有机化合物的合成, 简称有机合成。 有机合成是有机化学的重要研究内容之一, 也是研究有机化学的主要目的之一。在前面各 章中,已经讨论了各类常见单官能团化合物的 理化性质以及一些重要相关反应的机理。本章 将要讨论的是各类单官能团化合物的常用制备 方法,以及构建一些常见分子骨架的合成方法 。前者的重点是各类官能团的形成、消除和转 换,后者的重点是多官能团反应在有机合成中 的应用。
格氏试剂与环氧乙烷反应可以得到比原来格氏试剂增加 两个碳原子的伯醇。
若格氏试剂与取代的环氧乙烷反应,则烃基首先进攻 位阻小的碳原子,主要生成二级或者三级醇
(6)羟醛缩合法
含有Hα 的醛或酮在碱或酸的作用下生成β−羟基 醛或酮的反应称作羟醛缩合反应。
二、酚的制备 1. 芳香族磺酸钠碱熔融法
2. 异丙苯法 由苯和丙烯为原料,在三氯化铝催化下生成 异丙苯,然后进行氧化、水解生成苯酚及丙 酮的方法,称为异丙苯合成苯酚法。这是工 业上制备苯酚的主要方法。
醇在硫酸、磷酸以及五氧化二磷等酸性介质加热, 可脱水而生成烯烃。
羧酸酯热解制备烯烃可看作是由醇合成烯烃的另一条途径。 该法属于分子内的顺式消除反应,中间通过一个六元环过渡态 。因此,该法没有异构、重排等副反应。
季铵碱热分解反应,即霍夫曼消除反应也可制备烯烃。
2. 炔烃部分还原法
炔烃在特殊催化剂如(Lindlar)催化剂(Pd / PbO-CaCO3)或罗森孟催化剂(Pd / BaSO4−喹 啉或吡啶)的作用下催化氢化可得到顺式烯烃
武兹(Wurtz)法
格式试剂法和武兹法一般主要用于合成对称的烷烃。
Corey−House 反应
卤代烷的反应活性次序为:碘代烷 > 溴代烷 > 氯代烷; 伯卤代烷 > 仲卤代烷 >叔卤代烷。
第九版病理生理学第十八章肾功能不全考点剖析

、、 、
。
2、慢性肾功能衰竭临床上可分为四个阶段 、 、
、
、
。
3、肾功能不全的基本发病环节是 、 、 。
填空题答案:
1、答:(1)尿的变化,即出现显著少尿或无尿 (2)高 钾血症 (3)水中毒 (4)氮质血症 (5)代谢性酸中毒。 2、答:(1)肾储备功能降低期(代偿期) (2)肾功能 不全期 (3)肾功能衰竭期(4)尿毒症期。 3、答:(1)肾小球滤过功能障碍(2)肾小管功能障碍( 3)肾脏内分泌功能障碍。
二、简述题(6)
5、简述对慢性肾衰竭和尿毒症患者进行饮食控制的目的。 答:饮食控制与营养疗法是非透析治疗最基本、有效的措
施。其关键是蛋白质摄入量及成分的控制,要求采取优质低 蛋白高热量饮食,保证足够的能量供给,减少蛋白质分解。 其他方面还包括磷、嘌呤及脂质摄入的控制。
二、简述题(6)
6、简述尿毒症的临床表现。 答:(1)神经系统:中枢神经系统功能障碍:表现为
7、急性肾功能衰竭最危险的是 A.水中毒 B.血尿 C.高血压 D.高钾血症 E.代谢性酸中毒 本题正确答案:C
四、单项选择题(16)
8、急性肾功能衰竭进入多尿期的标志是每天尿量多于 A.100ml B.400ml C.1000ml D.1500ml E.2000ml 本题正确答案:B
四、单项选择题(16)
差
二、简述题(6)
3、简述肾小管损伤在ATN所致少尿型ARF少尿发生机制中 的作用。 答:(1)肾小管阻塞:肾缺血、肾毒物引起肾小管坏死时 的细胞脱落碎片,异形输血时的血红蛋白、挤压综合征时的 肌红蛋白,均可在肾小管内形成各种管型,阻塞肾小管管腔 ,使原尿不易通过,引起少尿。
二、简述题(6)
3、简述肾小管损伤在ATN所致少尿型ARF少尿发生机制中 的作用。 (2)原尿返漏:在持续肾缺血和肾毒物作用下,肾小管上 皮细胞变性,坏死、脱落,原尿通过受损肾小管壁处返漏入 周围肾间质,除直接造成尿量减少外,还引起肾间质水肿, 压迫肾小管,造成囊内压升高,使GFR减少,出现少尿。
第十八章芳香族含氮化合物
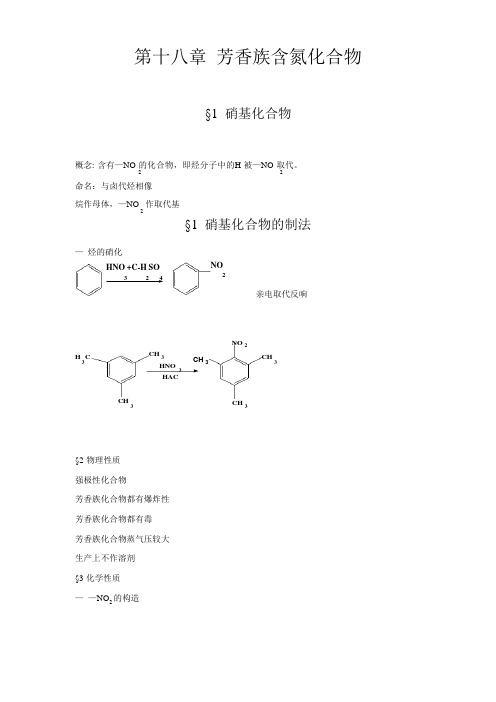
第十八章芳香族含氮化合物§1 硝基化合物概念: 含有—NO 的化合物,即烃分子中的H 被—NO 取代。
2 2命名:与卤代烃相像烷作母体,—NO 作取代基2§1 硝基化合物的制法—烃的硝化HNO +C-H SO NO3 24 2亲电取代反响H C CH 33HNO3HACCH3CH3NO2CH3CH3§2 物理性质强极性化合物芳香族化合物都有爆炸性芳香族化合物都有毒芳香族化合物蒸气压较大生产上不作溶剂§3 化学性质——NO2的构造ON4 3 ONO 2HN:1S 22S 22P 3NO 2: Rp 4OOO -N:SP 2ÓÔ ¯¸ RNRN +OO –R+NON=O, N-O 等长:1.21A 高度离域二 复原反响:最终产物为×î ÖÕ²úÎ ïÎ ªNH 2 ·¼°·NH 2选用不同的复原剂,掌握不同的条件,可得不同氧化态的不同产物。
Fe+HCLNH 2Fe+NaOHN=NNO2Zn+NaOH-NH-NH-Zn+NH Cl NHOHZn+H 2ONO制芳胺:复原剂 Sn(Fe)+HCl H 2/cat. 及多硫化物2NH 2NO 22 Fe,140°¢² ÌÑHNO 3 C-H 2SO 4¢²ÑÌ H 2SO 43NO 2 NO2(NH ) S 4 2NO 2NH 2Fe+HClNO 2NOSnCl 2C-HCLCHONO 2OHNO 2OHNa 2S NH½ú ±Ì £·NO 2C 2H 5OH, DNO 2NO 2 2NHOH三 苯环上取代反响:—NO 强拉电子基所以不能进展F-K 反响2BrBrNO 2NO 2110°SO H§2 芳胺芳胺:NH 分子中的H 被芳基取代成为芳胺3命名:和脂肪胺相像。
还原反应亚硝基苯

2芳胺的制备
(1)硝基化合物的还原
Fe + HCl (产率 100%)
NO2
or H2/Cu 加压 (产率 95%)
NH2
(2)芳环的亲核取代
NH3
OH
加压
O2N
RNH2 Br
NO2
(3)用霍夫曼重排制备
O NH
O
NaOH + X2
NH2 O2N
NH-R NO2
COONa NH2
3芳胺的化学性质
TsNHCH3 HNO2 H3C
CH2 H SO2 N
NO
KOH C2H5OH
H3C
SO2OC2H5 + CH2N2 + H2O 70 %
如将氮上的甲基换成其它烃基,可得其它重氮化合物。
3 重氮甲烷的反应
(1)与酸性物质的反应
eg 1
O R-C-O-H + -CH2-N+ N
O
R-C-O-
+
+ CH3-N N
定义:芳环上的一个基团被一个亲核试剂取代,称为 芳环上的亲核取代反应。
L + Nu:-
Nu + L-
硝基对亲核取代反应的影响: 在芳香亲核取代反应中,硝基是一个活化的邻对位定位基。
SN2Ar反应机理
L
+ Nu:- 慢
NO2
应用实例
Nu L
N OO
O2N
OC2H5 + H2N
NO2 -X
180oC
O2N
NH-OH
苯基羟胺 (中间还原产物)
Fe + HCl
NH2
苯胺
b 双分子还原反应
第十八章 杂环化合物

··
N
· ·
·
·
sp2杂化轨道
··
N—H
·
·
··
N
P 轨道
·
吡咯
五 中
吡咯的分子结构
N原子杂化轨道 体系中π 电子数:
O··
心 六 电 子
··
·
·· O ··
·
呋喃 (
· ·· ·O
··
4+2=6 符合休克
6×10 11
5×10 9
1
亲电试剂进攻发生在α- 位和β- 位,而α- 位更容易些。
① 卤代反应
像苯酚和苯胺一样,吡咯、呋喃、噻吩很容易发生卤代 反应。
氯代、溴代不但不需催化剂,而且为避免多取代物,往 往采用温和条件,如用溶剂稀释和采用低温。
吡咯反应活性最大,在低温下进行,一般得多卤产物。
+ Br2
70%
-NO2 S
5%
③ 磺化反应 吡咯、呋喃不能直接用硫酸磺化,因为它们在浓硫酸中
不稳定,会发生聚合,通常用一种温和的磺化剂—— 吡啶 三氧化硫进行磺化。
N
吡啶
+ N H
HCl
+ SO3
+
NSO3
-SO3H N H 90%
吡咯-2-磺酸
+
NSO3
吡啶三氧化硫
100 ℃
-
-SO3
·
N
N+
H 90%
从煤焦油中提取的苯(b.p.80℃)含有少量(0.5%)噻
吩( b.p.84℃ )很难用分馏的方法将它们分开,由于噻吩
第16章 其他含氮化合物

CH2N2 CH2 R2C=CR2 R2 C CR2
N2=CHCO2Et + C6H5CH=CH2
C6H5HC
CHCO2Et
(二)类碳烯及其反应—— Simmons-Smith反应 反应
Chap.16 其他含氮化合物
16.1 硝基化合物
硝基化合物: 硝基化合物: R—NO2 ArNO2 烃分子中氢原子为硝基取代的衍生物为硝基化合物
脂肪族硝基化合物,如: CH3NO2 按 烃 基 不同 芳 香族 硝 基 化合 物 , 如: NO2
一硝基化合物 按硝基数 目 多硝基 化合物,如: O2N
1. 与酸性物质反应 与酸性物质反应——甲基化 甲基化
RCOOH + CH2N2 RCOOCH3+ N2
O
过程
O RC O H
+ :CH2 N
-
N:
+ RC O + CH3 N N:
RCOOCH3+ N2
其它酸性物质也可与CH2N2反应,引进甲基 反应, 其它酸性物质也可与
CH2N2 +
H-X 氢卤酸 H-O3SR 磺酸 H-OAr 酚 H-OC=C- 烯醇
说明
a. b. c. 卤代烷常用溴代烷或碘代烷 亚硝酸盐用Li、Na、K盐均可 亚硝酸盐用 、 、 盐均可 防止亚硝基化,可用非质子极性溶剂, 防止亚硝基化,可用非质子极性溶剂, 并加尿素来消除它
16.2 重氮化合物 重氮化合物(Diazo compounds)
一、通式:R2C=N2 通式: 二、重氮甲烷的结构
《营养学》第十八章 营养与抗氧化[Nutrition and Free Radicals]
![《营养学》第十八章 营养与抗氧化[Nutrition and Free Radicals]](https://img.taocdn.com/s3/m/21185738af1ffc4ffe47ac71.png)
3.脂质过氧化损伤
不饱和脂肪酸对于氧化特别敏感,脂质过氧化是由脂链上除去 一个氢而启动的,去氢的C原子形成中心自由基(L·),L·有多种去路, 在有氧环境中的细胞内,很快出现分子重排,随之与氧反应生成过氧 基(peroxy radical),可相互结合而中止自由基反应,或攻击膜结构 中膜蛋白,过氧基亦可对邻近部位产生除氢反应,于是出现链反应, 即除氢反应的连续。
二、活性氧自由基的生理功能和毒性作用 在生理状态下,可显示其独特的生理作用,如吞噬细胞产生活性
氧自由基以杀灭外来微生物;前列腺素、凝血酶原和胶原蛋白的合成 也需要活性氧自由的参与。 1.核酸的氧化损伤
DNA成分都可与·OH反应,而单线态氧(1O2)则主要作用于碱基鸟 嘌呤。DNA损伤的类型主要有:⑴碱基损伤,氧自由基可直接作用于 双键部位而改变其结构,·OH可以自动从胸腺嘧啶的甲基中除去H原子,
一、人体内重要的氧自由基
1.超氧阴离子自由基(superoxide anion radical,O2·-): 基态氧接受一个电子形成的第一个氧自由基,其在水溶性介质中
的存活时间约为1秒,在脂溶性介质中存活时间约为1小时,和其它活 性氧相比,超氧阴离子自由基不很活泼,由于它的寿命长,可以从其 生成部位扩散到较远的距离,达到靶组织。此外,它是所有氧自由基 的前身,可以转化为其他自由基,它的危害性相当大。
·OH等均可促进脂质过氧化物生成,脂质过氧化的后果是:破坏 膜的功能,降低其流动性,使膜上的受体和酶灭活,使离子的通透性 增高,细胞内外的离子稳态破坏。脂质过氧化物的分解产物具有细胞 毒性,其中特别有害的是一些不饱和醛类。
二、氧自由基与人类疾病 1.癌症
癌的发生发展分为启动(initiation)、促进(promotion)和发展 (development)三个阶段。每一阶段都有氧自由基的参与。许多化学 致癌剂,不管是天然的,还是人工合成的,在发生致癌作用前必须经 过一个活化阶段,从分子状态变成自由基状态。活化后的致癌物一般 都是极活泼的亲电子化合物或自由基。只有这些活化后的物质才能与 细胞中的靶分子相互作用。
无机化学第四版(下册)第十八章习题答案

第18章非金属元素小结18-1 略18-2为什么氟和其他卤素不同,没有多种可变的正氧化态?解:因为F是电负性最大的元素,在形成化合物时,电子云总是偏向F,而且F处于第二周期,没有空d轨道参与成键,所以,和其他卤素不同,没有多种可变的正氧化态。
18-3 小结p区元素的原子半径、电离能、电子亲和能和电负性,在按周期性递变规律的同时,还有哪些反常之处?说明其原因。
解:p区元素的原子半径、电离能、电子亲和能和电负性,对同一周期,一般是自左向右原子半径依次减小,电离能依次增大,电子亲和能依次增大,电负性依次增大。
对于同一族,一般是从上到下原子半径依次增大,电离能依次减小,电子亲和能依次减小,电负性依次减小。
但第V A族的N、P、As等的第一电离能和电子亲和能出现反常,第一电离能比同周期VIA族的O、S、Se大,电子亲和能比同周期IV A族的C、Si、Ge小,这是由于V A族元素的外层p轨道处于半充满,结构稳定,不易失去电子,也不易接受电子。
另外,F的电子亲和能要小于Cl,O的电子亲和能小于S,N的电子亲和能小于P等,这是由于第二周期p区元素的原子半径太小,电子云密度大,电子之间排斥力很强,以致当加合一个外来电子形成负离子时,因排斥力大使放出的能量减小,导致上述反常结果。
18-4 概括非金属元素的氢化物有哪些共性?解:非金属元素的氢化物都是以共价键结合的分子型氢化物,在通常状况下为气体或挥发性液体,都能与氧、卤素、氧化态高的金属离子以及一些含氧酸盐等氧化剂作用。
18-5 已知下列数据(298K):△f G mӨ[H2S(aq)]= -27.9 kJ·mol-1;△f G mӨ[S2-(aq)]= 85.8 kJ·mol-1;△f G mӨ[H2Se(aq)] = 22.2 kJ·mol-1;△f G mӨ[Se2-(aq)] = 129.3 kJ·mol-1试计算下列反应在298K时的△r G mӨ和平衡常数K,并比较两者中哪一个酸性较强?(1) H2S(aq) -→ 2H+(aq) + S2-(aq)(2) H2Se(aq) -→2H+(aq) + Se2-(aq)解:(1) H2S(aq) -→ 2H+(aq) + S2-(aq)298K △r G1Ө= △f G mӨ[S2-(aq)]-△f G mӨ[H2S(aq)]= 85.8-(-27.9) = 113.7kJ·mol-1由△r G1Ө = - RTlnK1Ө求得:K1Ө = 1.17×10-20(2) H2Se(aq) -→2H+(aq) + Se2-(aq)298K △r G2Ө= △f G mӨ[Se2-(aq)]-△f G mӨ[H2Se(aq)]= 129.3-22.2) = 107.1kJ·mol-1由△r G2Ө = - RTlnK2Ө求得:K2Ө = 1.68×10-19通过(1)、(2)的计算结果可知:H2Se的酸性比H2S的酸性强。
中药炮制学课件 第十八章 其他制法

麦麸40kg/100kg。 2.滑石粉煨 滑石粉炒至灵活状态,投入肉豆蔻,
翻埋至肉豆蔻呈深棕色并有香气飘逸
用滑石粉50kg/100kg 3.面裹煨 面做成团块,包裹肉豆蔻 3~4层,晒
至半干,投入已炒热的滑石粉锅内,适当翻动, 至面皮呈焦黄色时取出 面粉50kg/100kg
第一节 烘焙法
定义:将净选或切制的药物用文火直接或间接加 热,使之充分干燥的方法 烘焙法与炒法不同,一定要用文火,并要勤加翻 动,以免药物焦化。 烘法多用来代替清炒法、炙法、煅法中一部分药 物的炮制。
虻虫
[处方用名] 虻虫、焙虻虫。 [炮制作用] 虻虫有小毒。焙后可降低毒性和腥臭
气味,便于粉碎
蜈蚣 [处方用名] 蜈蚣、焙蜈蚣 [炮制作用] 生蜈蚣有毒,多外用
炒诃子:缓和酸涩之性,消食化积 煨诃子:涩敛之性增强,涩肠止泻 [炮制研究] 含鞣质23.60~37.36%,主要为诃子酸、诃黎勒酸、
1,3,6-三没食子酰葡萄糖、原诃子酸等 麸炒法鞣质含量高,药理作用强
木香 [处方用名] 木香、广木香
云木香、煨木香 [炮制方法] 1.木香 2.煨木香 一层木香片一层纸,放烘干室或温度 较高处,煨至木香所含挥发油渗透到纸上 [炮制作用] 生木香行气作用强 煨后实肠止泻作用增 [炮制研究] 木香煨后挥发油损失约20%,而且挥发油的折光 率、旋光度、比重等理化性质均有改变。 煨木香水煎剂抑制肠管蠕动的作用显著
出油快 3.盛装蛋黄油的容器应洁净干燥 4.注意劳动保扩,防止高温烫伤
黑豆馏油
[处方用名] 黑豆馏油 [炮制方法] 大豆,轧碎置沙质壶中,密封干馏即
得。 [炮制作用] 清热、利湿、收敛
第六节 特殊制法
