主要原材料的研究资料
主要原材料的研究资料全

HCV试剂盒
主要原材料的研究资料1、制膜工序所需要使用的主要原材料清单
2、制金工序所需要使用的主要原材料清单
HEV试剂盒(胶体金法)
主要原材料的研究资料1、制膜工序所需要使用的主要原材料清单
2、制金工序所需要使用的主要原材料清单
TB试剂盒
主要原材料的研究资料1、制膜工序所需要使用的主要原材料清单
2、制金工序所需要使用的主要原材料清单
EB试剂盒
主要原材料的研究资料1、制膜工序所需要使用的主要原材料清单
2、制金工序所需要使用的主要原材料清单
TP试剂盒
主要原材料的研究资料1、制膜工序所需要使用的主要原材料清单
2、制金工序所需要使用的主要原材料清单
CMV试剂盒
主要原材料的研究资料1、制膜工序所需要使用的主要原材料清单
2、制金工序所需要使用的主要原材料清单
HP试剂盒
主要原材料的研究资料1、制膜工序所需要使用的主要原材料清单
2、制金工序所需要使用的主要原材料清单
HEV试剂盒(酶联免疫法)
主要原材料的研究资料1、制膜工序所需要使用的主要原材料清单
2、制金工序所需要使用的主要原材料清单。
体外诊断试剂注册申报资料要求

体外诊断试剂注册申报资料要求依据2022年1月I日起施行的《体外诊断试剂注册申报资料要求(2021年第122号)》,注册申报资料包含如下:一.监管信息1.关联文件境内产品企业营业执照副本或事业单位法人证书复印件按照《创新医疗器械特别审查程序》审批的境内体外诊断试剂产品申请注册时,应当提交通过创新医疗器械审查的相关说明。
按照《医疗器械应急审批程序》审批的体外诊断试剂产品申请注册时,应当提交通过医疗器械应急审批的相关说明。
委托其他企业生产的,应当提供受托企业资格文件(营业执照副本复印件)、委托合同和质量协议。
进口产品境外申请人注册地或生产地所在国家(地区)医疗器械主管部门出具的准许该产品上市销售的证明文件,未在境外申请人注册地或生产地所在国家(地区)上市的创新医疗器械可以不提交。
境外申请人注册地或者生产地所在国家(地区)未将该产品作为医疗器械管理的,申请人需要提供相关文件,包括注册地或者生产地所在国家(地区)准许该产品上市销售的证明文件,未在境外申请人注册地或生产地所在国家(地区)上市的创新医疗器械可以不提交。
2.申报前与监管机构的联系情况和沟通记录在产品申报前,如果申请人与监管机构针对申报产品以会议形式进行了沟通,或者申报产品与既往注册申报相关。
应当提供下列内容:(1)列出监管机构回复的申报前沟通。
(2)既往注册申报产品的受理号。
(3)既往申报前沟通的相关资料,如既往申报会议前提交的信息、会议议程、演示幻灯片、最终的会议纪要、会议中待办事项的回复,以及所有与申请相关的电子邮件。
(4)既往申报(如自行撤销/不予注册上市申请等)中监管机构已明确的相关问题。
(5)在申报前沟通中,申请人明确提出的问题,以及监管机构提供的建议。
(6)说明在本次申报中如何解决上述问题。
二.综述资料1.产品描述1)描述产品所采用的技术原理,产品组成,原材料的来源及制备方法,主要生产工艺,检验方法,质控品的制备方法及赋值情况,如产品检测需要进行校准,应描述校准品的制备方法及溯源情况。
药监局2020年第43号通告附件-生物制品注册分类及注册资料要求

生物制品注册分类及申报资料要求生物制品是指以微生物、细胞、动物或人源组织和体液等为起始原材料,用生物学技术制成,用于预防、治疗和诊断人类疾病的制剂。
为规范生物制品注册申报和管理,将生物制品分为预防用生物制品、治疗用生物制品和按生物制品管理的体外诊断试剂。
预防用生物制品是指为预防、控制疾病的发生、流行,用于人体免疫接种的疫苗类生物制品,包括免疫规划疫苗和非免疫规划疫苗。
治疗用生物制品是指用于人类疾病治疗的生物制品,如采用不同表达系统的工程细胞(如细菌、酵母、昆虫、植物和哺乳动物细胞)所制备的蛋白质、多肽及其衍生物;细胞治疗和基因治疗产品;变态反应原制品;微生态制品;人或者动物组织或者体液提取或者通过发酵制备的具有生物活性的制品等。
生物制品类体内诊断试剂按照治疗用生物制品管理。
按照生物制品管理的体外诊断试剂包括用于血源筛查的体外诊断试剂、采用放射性核素标记的体外诊断试剂等。
药品注册分类在提出上市申请时确定,审评过程中不因其他药品在境内外上市而变更。
第一部分预防用生物制品一、注册分类1类:创新型疫苗:境内外均未上市的疫苗:1.1无有效预防手段疾病的疫苗。
1.2在已上市疫苗基础上开发的新抗原形式,如新基因重组疫苗、新核酸疫苗、已上市多糖疫苗基础上制备的新的结合疫苗等。
1.3含新佐剂或新佐剂系统的疫苗。
1.4含新抗原或新抗原形式的多联/多价疫苗。
2类:改良型疫苗:对境内或境外已上市疫苗产品进行改良,使新产品的安全性、有效性、质量可控性有改进,且具有明显优势的疫苗,包括:2.1在境内或境外已上市产品基础上改变抗原谱或型别,且具有明显临床优势的疫苗。
2.2 具有重大技术改进的疫苗,包括对疫苗菌毒种/细胞基质/生产工艺/剂型等的改进。
(如更换为其他表达体系或细胞基质的疫苗;更换菌毒株或对已上市菌毒株进行改造;对已上市细胞基质或目的基因进行改造;非纯化疫苗改进为纯化疫苗;全细胞疫苗改进为组分疫苗等)2.3 已有同类产品上市的疫苗组成的新的多联/多价疫苗。
免疫主要原材料研究资料

免疫主要原材料研究资料(一)基本原则1.研制、生产用的各种原料、辅料应当制定相应的质量标准,并符合有关法规的要求。
2.诊断试剂的生产企业应具备相应的专业技术人员、仪器设备以及适宜的生产环境,获得《医疗器械生产许可证》;同时,生产企业应按照《体外诊断试剂生产实施细则(试行)》的要求建立相应的质量管理体系,形成文件和记录,加以实施并保持有效运行;生产企业还应该通过《体外诊断试剂生产企业质量管理体系考核评定标准(试行)》的考核。
企业应对试剂的使用范围做出明确规定,并经国家药品监督管理部门批准。
3.诊断试剂的研制应当按照科学、规范的原则组织研发,各反应条件的选择和确定应符合基本的科学原理。
4.研制生产过程中所用的材料及工艺,应充分考虑可能涉及的安全性方面的事宜。
5.试剂生产和质量控制的总体目标:保证产品使用安全,质量稳定,工艺可控,使用有效。
(二)原材料质量控制1.主要生物原料与产品质量最密切相关的生物原料主要包括各种天然抗原、重组抗原、单克隆抗体、多克隆抗体以及多肽类、激素类等生物原科。
这类原料可用于包被酶标反应板、标记相关酶(辣根过氧化物酶、碱性磷酸酶等)、中和反应用抗原或抗体、制备校准品(标准品)等。
一般按工艺要求对这类生物原料进行质量检验,以保证其达到规定的质量标准。
主要生物原料若为企业自己生产,其工艺必须相对稳定;若购买,其供应商要求相对固定,不能随意变更供应商,如果主要原料(包括工艺)或其供应商有变更,应依据国家相关法规的要求进行变更申请。
主要生物原料的常规检验项目一般包括:(1)外观肉眼观察,大部分生物原料为澄清均一的液体,不含异物、浑浊或摇不散的沉淀或颗粒;或者为白色粉末,不含其他颜色杂质;特殊生物原料应具备相应外观标准。
(2)纯度和分子量主要经SDS-PAGE 电泳后,利用电泳扫描仪进行分析,也可用其他适宜的方法,如高效液相法等。
根据所检测生物原料的分子量选择适宜聚丙烯酰胺凝胶浓度进行电泳。
体外诊断试剂注册申报资料模板-主要原材料的研究资料

体外诊断试剂注册申报资料XXXXX检测试剂盒(XXX法)主要原材料的研究资料XXXXX有限公司目录一、主要原材料的选择 (2)(一)、连接酶的选择 (2)(二)、XXX酶的选择 (4)(三)、引物a(如标签引物)的选择 (5)(四)、XXXX的选择 (7)二、主要原材料的检定 (7)(一)、连接酶 (7)(二)、XXX酶 (7)(三)、标签引物 (8)(四)、XXXX (8)三、试剂盒质控品的建立 (9)四、企业参考品的建立 (10)一、主要原材料的选择根据试剂盒组分,对市面常见竞争品牌进行比较测试,参考试剂性能,并比较相关试剂应用于反应体系中的表现以及采购难易、成本、口碑等多方面因素,择优选择适用于本试剂盒的主要原材料。
(一)、连接酶的选择1.检测对象A公司生产的XX酶和B公司生产的XX酶。
2.主要仪器PCR仪、荧光PCR仪、Qubit DNA荧光定量仪、漩涡混合器、迷你离心机、磁力架等。
3.研究方法和考核指标3.1建库测试使用待选择的两种XX酶分别对4例临床真实样本按照附件建库方法进行建库。
取1μL建库产物进行文库定量,并进行电泳检测。
要求:建库产物文库浓度应≥PM和文库片段电泳条带分布应在- bp范围内。
3.2酶活测试(定性检测酶活性)使用待选择的两种连接酶及非连接酶配制反应体系以??为模板进行连接反应,并设置了空白对照,连接产物进行电泳检测。
表1 连接酶酶活实验反应体系要求:2个供应商的连接产物电泳条带分布应单一,无连接酶和空白对照组的反应体系产物应无连接产物产生,呈现多条条带。
4.实验结果4.1建库测试结果:文库产量如表1,两个供应商文库产量浓度结果对比图见图1。
B公司的连接酶建库产量虽整体较高,但不稳定,样本(填入样本编号)的文库产量低于pM(3.1规定的指标)。
电泳结果如图2,两个供应商的连接酶产生的文库片段电泳条带分布应在- bp范围内。
(3.1规定的指标)表1:连接酶的选择:文库产量及电泳结果(单位:pM)*(如有不符合要求的请用高亮标出)图1 连接酶的选择:文库产量对比图图2:连接酶的选择:文库片段电泳条带分布4.2酶活测试结果:酶活测试结果见表2。
生物制品注册分类及申报资料要求(征求意见稿)

附件1生物制品注册分类及申报资料要求(征求意见稿)生物制品是指以微生物、细胞、动物或人源组织和体液等为起始原材料,用生物学技术制成,用于预防、治疗和诊断人类疾病的制剂。
为便于生物制品注册申报和管理,将生物制品分为预防用生物制品、治疗用生物制品和按生物制品管理的体外诊断试剂三类。
预防用生物制品是指用于预防人类传染病或其他疾病的生物制品,如细菌性疫苗、病毒性疫苗等。
治疗用生物制品是指用于人类疾病治疗的生物制品,如采用不同表达系统的工程细胞(如细菌、酵母、昆虫、植物和哺乳动物细胞)所制备的蛋白质、多肽及其衍生物;从人或者动物组织提取的单组分的内源性蛋白;细胞治疗和基因治疗产品、变态反应原制品、微生态制品、由人或动物的组织或者体液提取或者通过发酵制备的具有生物活性的血液制品和多组份制品等。
生物制品类体内诊断试剂参照治疗用生物制品管理。
按照生物制品管理的体外诊断试剂是包括用于血源筛查的体外诊断试剂、采用放射性核素标记的体外诊断试剂。
生物制品按新药程序申报注册;体外诊断试剂以及肌肉注射的普通或者特异性人免疫球蛋白、人血白蛋白等按规定免做临床试验的,可以直接提出上市申请。
注册分类应根据申报注册时制品所处的成熟程度进行界定,审评过程中不再更改。
第一部分预防用生物制品一、注册分类按照产品成熟度的不同,将预防用生物制品(以下简称:疫苗)分为以下三类:1类:创新型疫苗:境内外均未上市的疫苗:1.1新抗原制备的疫苗。
1.2在已上市疫苗基础上开发的新抗原形式,如新基因重组疫苗、新核酸疫苗、已上市多糖疫苗基础上制备的新的结合疫苗等。
1.3含新佐剂或新佐剂系统的疫苗。
1.4含新抗原或新抗原形式的多联/多价疫苗。
2类:改良型疫苗:对境内或境外已上市疫苗产品进行改良,使新产品在安全性、有效性、质量可控性方面有所改进,且具有明显优势的疫苗,包括:2.1在境内或境外已上市产品基础上改变抗原谱或型别,且具有明显临床优势的疫苗。
2.2 具有重大技术改进的疫苗,包括对疫苗菌毒种/细胞基质/生产工艺/剂型等的改进。
呼吸道病毒多重核酸检测试剂注册技术审查指导原则

呼吸道病毒多重核酸检测试剂注册技术审查指导原则本指导原则旨在指导注册申请人对呼吸道病毒多重核酸检测试剂注册申报资料的准备及撰写,同时也为技术审评部门审评注册申报资料提供参考。
本指导原则是对呼吸道病毒多重核酸测定试剂的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
如申请人认为有必要增加本指导原则未包含的研究内容,可自行补充。
如果申报产品检测项目包括的病毒有相应的指导原则,应首先满足指导原则要求的内容。
本指导原则是供申请人和审查人员使用的指导文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围呼吸道感染(Respiratory tract infection , RTI )是人类最常见的一类疾病,可以在任何性别、年龄和地域中发生,是全球范围内引起人群发病和死亡的最主要原因之一。
呼吸道感染引起的临床症状和体征都较为相似,其临床表现主要为鼻炎、咽炎、喉炎、扁桃体炎等症状,严重的可引起气管炎、支气管炎及肺炎等,但不同病原体引起的感染,其治疗方法、疗效和病程也不尽相同。
目前已证明,大部分呼吸道疾病是由细菌外的病原体引起,其中以呼吸道病毒最常见。
本指导原则适用于呼吸道病毒多重核酸检测试剂,适用样本类型为鼻咽拭子、鼻拭子、咽拭子、肺泡灌洗液、痰液或其他呼吸道分泌物样本等,可包括但不限于:甲型流感病毒(Influenza A , IFV A卜乙型流感病毒 (Influenza B,IFV B 入呼吸道合胞病毒(Respiratory Syncytial Virus , RSV 入副流感病毒(Parainfluenza Virus , PIV)、人偏肺病毒(Human Metapneumovirus , hMPV )、腺病毒 (Adenovirus,Adv)、呼吸道感染肠道病毒(肠道病毒/鼻病毒)(Enterovirus , EV/ Rhinovirus , RhV )、冠状病毒 (Coronavirus , CoV )等。
(完整word版)主要原材料的研究资料

HCV试剂盒
主要原材料的研究资料1、制膜工序所需要使用的主要原材料清单
2、制金工序所需要使用的主要原材料清单
HEV试剂盒(胶体金法)
主要原材料的研究资料1、制膜工序所需要使用的主要原材料清单
2、制金工序所需要使用的主要原材料清单
TB试剂盒
主要原材料的研究资料1、制膜工序所需要使用的主要原材料清单
2、制金工序所需要使用的主要原材料清单
EB试剂盒
主要原材料的研究资料1、制膜工序所需要使用的主要原材料清单
2、制金工序所需要使用的主要原材料清单
TP试剂盒
主要原材料的研究资料1、制膜工序所需要使用的主要原材料清单
2、制金工序所需要使用的主要原材料清单
CMV试剂盒
主要原材料的研究资料1、制膜工序所需要使用的主要原材料清单
2、制金工序所需要使用的主要原材料清单
HP试剂盒
主要原材料的研究资料1、制膜工序所需要使用的主要原材料清单
2、制金工序所需要使用的主要原材料清单
HEV试剂盒(酶联免疫法)
主要原材料的研究资料1、制膜工序所需要使用的主要原材料清单
2、制金工序所需要使用的主要原材料清单。
生物制品、化学药品注册分类及申报资料要求2020

附件生物制品注册分类及申报资料要求生物制品是指以微生物、细胞、动物或人源组织和体液等为起始原材料,用生物学技术制成,用于预防、治疗和诊断人类疾病的制剂。
为规范生物制品注册申报和管理,将生物制品分为预防用生物制品、治疗用生物制品和按生物制品管理的体外诊断试剂。
预防用生物制品是指为预防、控制疾病的发生、流行,用于人体免疫接种的疫苗类生物制品,包括免疫规划疫苗和非免疫规划疫苗。
治疗用生物制品是指用于人类疾病治疗的生物制品,如采用不同表达系统的工程细胞(如细菌、酵母、昆虫、植物和哺乳动物细胞)所制备的蛋白质、多肽及其衍生物;细胞治疗和基因治疗产品;变态反应原制品;微生态制品;人或者动物组织或者体液提取或者通过发酵制备的具有生物活性的制品等。
生物制品类体内诊断试剂按照治疗用生物制品管理。
按照生物制品管理的体外诊断试剂包括用于血源筛查的体外诊断试剂、采用放射性核素标记的体外诊断试剂等。
药品注册分类在提出上市申请时确定,审评过程中不因其他药品在境内外上市而变更。
—1 —第一部分预防用生物制品一、注册分类1类:创新型疫苗:境内外均未上市的疫苗:1.1无有效预防手段疾病的疫苗。
1.2在已上市疫苗基础上开发的新抗原形式,如新基因重组疫苗、新核酸疫苗、已上市多糖疫苗基础上制备的新的结合疫苗等。
1.3含新佐剂或新佐剂系统的疫苗。
1.4含新抗原或新抗原形式的多联/多价疫苗。
2类:改良型疫苗:对境内或境外已上市疫苗产品进行改良,使新产品的安全性、有效性、质量可控性有改进,且具有明显优势的疫苗,包括:2.1在境内或境外已上市产品基础上改变抗原谱或型别,且具有明显临床优势的疫苗。
2.2具有重大技术改进的疫苗,包括对疫苗菌毒种/细胞基质/生产工艺/剂型等的改进。
(如更换为其他表达体系或细胞基质的疫苗;更换菌毒株或对已上市菌毒株进行改造;对已上市细胞基质或目的基因进行改造;非纯化疫苗改进为纯化疫苗;全细胞疫苗改进为组分疫苗等)2.3已有同类产品上市的疫苗组成的新的多联/多价疫苗。
生物制品(含体外诊断试剂)注册分类及申报资料要求

生物制品(含体外诊断试剂)注册分类及申报资料要求生物制品是指以微生物、细胞、动物或人源组织和体液等为起始原材料,用生物学技术制成,用于预防、治疗和诊断人类疾病的制剂。
为规范生物制品注册申报和管理,将生物制品分为预防用生物制品、治疗用生物制品和按生物制品管理的体外诊断试剂。
预防用生物制品是指为预防、控制疾病的发生、流行,用于人体免疫接种的疫苗类生物制品,包括免疫规划疫苗和非免疫规划疫苗。
治疗用生物制品是指用于人类疾病治疗的生物制品,如采用不同表达系统的工程细胞(如细菌、酵母、昆虫、植物和哺乳动物细胞)所制备的蛋白质、多肽及其衍生物;细胞治疗和基因治疗产品;变态反应原制品;微生态制品;人或者动物组织或者体液提取或者通过发酵制备的具有生物活性的制品等。
生物制品类体内诊断试剂按照治疗用生物制品管理。
按照生物制品管理的体外诊断试剂包括用于血源筛查的体外诊断试剂、采用放射性核素标记的体外诊断试剂等。
药品注册分类在提出上市申请时确定,审评过程中不因其他药品在境内外上市而变更。
第一部分预防用生物制品一、注册分类1类:创新型疫苗:境内外均未上市的疫苗:1.1无有效预防手段疾病的疫苗。
1.2在已上市疫苗基础上开发的新抗原形式,如新基因重组疫苗、新核酸疫苗、已上市多糖疫苗基础上制备的新的结合疫苗等。
1.3含新佐剂或新佐剂系统的疫苗。
1.4含新抗原或新抗原形式的多联/多价疫苗。
2类:改良型疫苗:对境内或境外已上市疫苗产品进行改良,使新产品的安全性、有效性、质量可控性有改进,且具有明显优势的疫苗,包括:2.1在境内或境外已上市产品基础上改变抗原谱或型别,且具有明显临床优势的疫苗。
2.2具有重大技术改进的疫苗,包括对疫苗菌毒种/细胞基质/生产工艺/剂型等的改进。
(如更换为其他表达体系或细胞基质的疫苗;更换菌毒株或对已上市菌毒株进行改造;对已上市细胞基质或目的基因进行改造;非纯化疫苗改进为纯化疫苗;全细胞疫苗改进为组分疫苗等)2.3已有同类产品上市的疫苗组成的新的多联/多价疫苗。
(完整版)体外诊断试剂注册申报资料要求及说明

附件3体外诊断试剂注册申报资料要求及说明注:申请人应当根据产品类别按照上表要求提交申报资料。
∨:必须提供的资料。
△:注册申请时不需要提供,由申报单位保存,如技术审评需要时提供。
一、申请表二、证明性文件(一)境内申请人应当提交:企业营业执照副本复印件和组织机构代码证复印件。
(二)境外申请人应提交:1.申请人注册地或者生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件和可以合法生产申报产品的资格证明文件,如该证明文件中有产品类别描述,其类别应当覆盖申报产品。
2.申请人注册地或者生产地址所在国家(地区)未将该产品作为医疗器械管理的,申请人需要提供相关证明文件,包括注册地或者生产地址所在国家(地区)准许该产品上市销售的证明文件。
3.申请人符合注册地或者生产地址所在国家(地区)医疗器械质量管理体系要求或者通过其他质量管理体系认证的证明文件。
4.申请人在中国境内指定代理人的委托书、代理人承诺书及营业执照副本复印件或者机构登记证明副本复印件。
三、综述资料(一)产品预期用途。
描述产品的预期用途,与预期用途相关的临床适应症背景情况,如临床适应症的发生率、易感人群等,相关的临床或实验室诊断方法等。
(二)产品描述。
描述产品所采用的技术原理,主要原材料的来源及制备方法,主要生产工艺过程,质控品、校准品的制备方法及溯源(定值)情况。
(三)有关生物安全性方面说明。
由于体外诊断试剂中的主要原材料可能是由各种动物、病原体、人源的组织和体液等生物材料经处理或者添加某些物质制备而成,人源性材料须对有关传染病(HIV、HBV、HCV等)病原体检测予以说明,并提供相关的证明文件。
其他动物源及微生物来源的材料,应当提供相应的说明文件,证明其在产品运输、使用过程中对使用者和环境是安全的,并对上述原材料所采用的灭活等试验方法予以说明。
(四)有关产品主要研究结果的总结和评价。
(五)其他。
包括同类产品在国内外批准上市的情况。
过敏原IgE检测试剂技术审查指导原则

过敏原IgE检测试剂技术审查指导原则(征求意见稿)一、前言本指导原则旨在指导注册申请人对过敏原特异性抗体IgE和总IgE(Allergen-specific IgE and total IgE)检测试剂注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本指导原则是对过敏原特异性抗体IgE和总IgE (Allergen-specific IgE and total IgE)检测试剂的一般要求,申请人应依据产品的具体特性确定其中容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的容进行充实和细化。
如申请人认为有必要增加本指导原则不包含的研究容,可自行补充。
本指导原则是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其它方法,也可以采用,但需要提供详细的研究资料和验证资料,相关人员应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关容也将适时进行调整。
二、适用围IgE抗体介导的I型过敏反应性疾病相当普遍,世界各国变态反应疾病的总发病率约为15%-30%,我国大约有5-10%的人受过敏原的袭扰,是当前世界性的重大卫生学问题,被世界卫生组织(WHO)列为二十一世纪重点防治的三大疾病之一。
过敏性疾病是患者吸入、摄食入或者注入含有致敏成分的物质(称为过敏原或变应原,Allergen)后触发机体的B 细胞产生特异性免疫球蛋白E(Immunoglobulin E, IgE),IgE 以其Fc 段与肥大细胞或嗜碱性粒细胞的表面相应的FcεRI 结合,使机体处于对该过敏原的致敏状态。
当相同过敏原再次或多次进入致敏机体时,可与肥大细胞或嗜碱性粒细胞表面的IgE发生特异性结合,当过敏原与致敏细胞表面的两个或两个以上相邻的IgE结合时,发生FcεRI 交联,使肥大细胞和嗜碱性粒细胞活化,导致细胞脱颗粒并释放储存在细胞浆颗粒里的炎性介质——组胺,并通过花生四烯酸途径合成新介质——白三烯、免疫反应性前列腺素和IL4、IL5等细胞因子及趋化因子,从而引发过敏反应(或称变态反应,Allergy )的疾病及相关症状,如过敏性哮喘、枯草热、荨麻疹、过敏性鼻炎、湿疹、结膜炎及胃肠道I型过敏性疾病及严重过敏反应等。
B群链球菌核酸检测试剂注册技术审查指导原则

B群链球菌核酸检测试剂注册技术审查指导原则本指导原则旨在指导注册申请人对B群链球菌核酸检测试剂注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本指导原则是针对B群链球菌核酸检测试剂的一般要求,申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要详细阐明理由,并对其科学合理性进行验证,提供详细的研究资料和验证资料,相关人员应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围无乳链球菌(Streptococcus agalactiae)在兰氏抗原分类中属于B群,B群目前只发现这一种细菌,所以一般也称为B群链球菌(Group B Streptococcus,GBS)。
GBS为一种β溶血的革兰阳性球菌,成对或呈短链状排列,根据细菌的荚膜多糖不同,GBS可分为Ia、Ib、Ic、II、III、IV、V、VI、VII、VIII和IX等。
GBS是围产期和新生儿感染疾病的致病菌,引起孕产妇的绒毛膜羊膜炎,导致流产、胎膜早破及宫内感染,也可导致新生儿发生肺炎、脑膜炎、败血症等。
2018年孕前和孕期保健指南中提到对高危因素的孕妇妊娠35~37周进行GBS筛查。
本指导原则所述GBS核酸检测试剂指基于分子生物学相关方法的核酸检测技术,以GBS核酸序列为检测靶标,对来自人体样本(如孕妇阴道拭子、直肠拭子、阴道和直肠联合拭子)或经增菌培养后人体样本中的GBS进行体外定性检测的试剂。
结合临床表现和其他实验室指标,用于GBS感染实验室诊断及临床应用。
体外诊断试剂注册申报资料要求及说明

附件3∨:必须提供的资料。
△:注册申请时不需要提供,由申报单位保存,如技术审评需要时提供。
一、申请表二、证明性文件(一)境内申请人应当提交:企业营业执照副本复印件和组织机构代码证复印件。
(二)境外申请人应提交:1.申请人注册地或者生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件和可以合法生产申报产品的资格证明文件,如该证明文件中有产品类别描述,其类别应当覆盖申报产品。
2.申请人注册地或者生产地址所在国家(地区)未将该产品作为医疗器械管理的,申请人需要提供相关证明文件,包括注册地或者生产地址所在国家(地区)准许该产品上市销售的证明文件。
3.申请人符合注册地或者生产地址所在国家(地区)医疗器械质量管理体系要求或者通过其他质量管理体系认证的证明文件。
4.申请人在中国境内指定代理人的委托书、代理人承诺书及营业执照副本复印件或者机构登记证明副本复印件。
三、综述资料(一)产品预期用途。
描述产品的预期用途,与预期用途相关的临床适应症背景情况,如临床适应症的发生率、易感人群等,相关的临床或实验室诊断方法等。
(二)产品描述。
描述产品所采用的技术原理,主要原材料的来源及制备方法,主要生产工艺过程,质控品、校准品的制备方法及溯源(定值)情况。
(三)有关生物安全性方面说明。
由于体外诊断试剂中的主要原材料可能是由各种动物、病原体、人源的组织和体液等生物材料经处理或者添加某些物质制备而成,人源性材料须对有关传染病(HIV、HBV、HCV等)病原体检测予以说明,并提供相关的证明文件。
其他动物源及微生物来源的材料,应当提供相应的说明文件,证明其在产品运输、使用过程中对使用者和环境是安全的,并对上述原材料所采用的灭活等试验方法予以说明。
(四)有关产品主要研究结果的总结和评价。
(五)其他。
包括同类产品在国内外批准上市的情况。
相关产品所采用的技术方法及临床应用情况,申请注册产品与国内外同类产品的异同等。
对于新研制的体外诊断试剂产品,需要提供被测物与预期适用的临床适应症之间关系的文献资料。
2、体外诊断试剂申报资料要求

11.产品风险分析资料
12.产品技术要求
1
1.证明性该文件 境内:企业营业执照副本复印件、组织机构代码证复印件 2.综述资料 产品预期用途:用途、临床背景、相关方法。 产品描述:技术原理、原材料、生产工艺、质控校准溯源 生物安全性方面的说明:人源材料、牛羊源性、其他动物源 及微
生物来源、病毒灭活措施及证明文件。 产品主要研究结果的总结和评价:主要研究结果总结、产品评价。 其他:同类产品上市情况、技术方法及临床应用、与同类产品异
(注册人提供产品没有变化的声明) 四、原医疗器械注册证及其附件的复印件、历次医疗器械注册变
更文件复印件 五、注册证有效期内产品分析报告 六、产品检验报告 七、符合性声明 八、其他
8
延续注册——注册证有效期内产品分析报告 (一)产品临床应用情况,用户投诉情况及采取的措施。 (二)医疗器械不良事件汇总分析评价报告(不良事件列表、
同、新产品预期用途文献。 3.主要原材料 主要原材料的选择、制备及质量标准 质控品、校准品的原料选择、制备、定值过程 校准品的溯源性文件(具体的溯源过程)
2
5.主要生产工艺及反应体系研究资料 主要生产工艺包括: 工作液的配制、分装和冻干;固相载体的包被和组装; 显色/发光系统等的描述及确定依据等。 反应体系包括: 样本采集及处理;样本要求;样本用量;试剂用量;反应条
差异,如存在产品性能差异,需要提交采用变更的包装规 格产品进行分析性能评估的试验资料;如产品性能无差异, 需要提交变更的包装规格与已上市包装规格之间不存在性 能差异的详细说明,具体说明不同包装规格之间的差别及 可能产生的影响。
17
(八)变更适用机型 1.采用新的适用机型进行分析性能评估的试验资料。 2.提供变更前、后的产品技术要求、产品说明书和标签样 稿(如涉及)。
体外诊断试剂注册申报资料要求及说明书
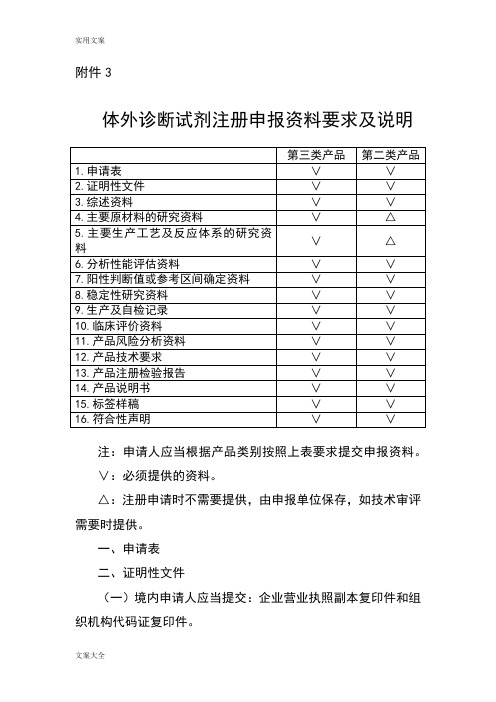
附件3体外诊断试剂注册申报资料要求及说明注:申请人应当根据产品类别按照上表要求提交申报资料。
∨:必须提供的资料。
△:注册申请时不需要提供,由申报单位保存,如技术审评需要时提供。
一、申请表二、证明性文件(一)境内申请人应当提交:企业营业执照副本复印件和组织机构代码证复印件。
(二)境外申请人应提交:1.申请人注册地或者生产地址所在国家(地区)医疗器械主管部门出具的允许产品上市销售的证明文件和可以合法生产申报产品的资格证明文件,如该证明文件中有产品类别描述,其类别应当覆盖申报产品。
2.申请人注册地或者生产地址所在国家(地区)未将该产品作为医疗器械管理的,申请人需要提供相关证明文件,包括注册地或者生产地址所在国家(地区)准许该产品上市销售的证明文件。
3.申请人符合注册地或者生产地址所在国家(地区)医疗器械质量管理体系要求或者通过其他质量管理体系认证的证明文件。
4.申请人在中国境内指定代理人的委托书、代理人承诺书及营业执照副本复印件或者机构登记证明副本复印件。
三、综述资料(一)产品预期用途。
描述产品的预期用途,与预期用途相关的临床适应症背景情况,如临床适应症的发生率、易感人群等,相关的临床或实验室诊断方法等。
(二)产品描述。
描述产品所采用的技术原理,主要原材料的来源及制备方法,主要生产工艺过程,质控品、校准品的制备方法及溯源(定值)情况。
(三)有关生物安全性方面说明。
由于体外诊断试剂中的主要原材料可能是由各种动物、病原体、人源的组织和体液等生物材料经处理或者添加某些物质制备而成,人源性材料须对有关传染病(HIV、HBV、HCV等)病原体检测予以说明,并提供相关的证明文件。
其他动物源及微生物来源的材料,应当提供相应的说明文件,证明其在产品运输、使用过程中对使用者和环境是安全的,并对上述原材料所采用的灭活等试验方法予以说明。
(四)有关产品主要研究结果的总结和评价。
(五)其他。
包括同类产品在国内外批准上市的情况。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
HCV试剂盒
主要原材料的研究资料1、制膜工序所需要使用的主要原材料清单
2、制金工序所需要使用的主要原材料清单
HEV试剂盒(胶体金法)
主要原材料的研究资料1、制膜工序所需要使用的主要原材料清单
2、制金工序所需要使用的主要原材料清单
主要原材料的研究资料1、制膜工序所需要使用的主要原材料清单
2、制金工序所需要使用的主要原材料清单
主要原材料的研究资料1、制膜工序所需要使用的主要原材料清单
2、制金工序所需要使用的主要原材料清单
主要原材料的研究资料1、制膜工序所需要使用的主要原材料清单
2、制金工序所需要使用的主要原材料清单
CMV试剂盒
主要原材料的研究资料1、制膜工序所需要使用的主要原材料清单
2、制金工序所需要使用的主要原材料清单
HP试剂盒
主要原材料的研究资料1、制膜工序所需要使用的主要原材料清单
2、制金工序所需要使用的主要原材料清单
HEV试剂盒(酶联免疫法)
主要原材料的研究资料1、制膜工序所需要使用的主要原材料清单
2、制金工序所需要使用的主要原材料清单。
