蛋白纯化液相层析
血清白球蛋白的分离、纯化及鉴定-10-10

(三)分离纯化的一般程序
选择材料 生物大分子的分离纯化一般 可分为以下几个阶段: 可分为以下几个阶段: ①材料的选择和预处理 破碎细胞及提取( ②破碎细胞及提取(有时还 需要进行细胞器的分离) 需要进行细胞器的分离) 分离纯化: ③分离纯化:包括粗分级分 离和细分级分离 其中前两个阶段为生物大分 子分离纯化的前处理。 子分离纯化的前处理。 破碎细胞 提取 分离纯化 分析及鉴定
脱水 阳离子
带负电荷蛋白质 (疏水胶体)
蛋白质聚集沉淀 蛋白质聚集沉淀
中性盐的选择
常用的中性盐: 常用的中性盐:(NH4)2SO4 1) 溶解度大: 溶解度大: 0℃ 70.6 70. 4.9 1.6 20℃ 20℃ 75.4 75. 18.9 18. 7.8 80℃ 80℃ 95.3 95.01
Salting-out
溶 解 度
盐浓度
水化膜
带正电荷蛋白质 亲水胶体) (亲水胶体)
+ + + + + + ++ +
碱 酸
等点电时的蛋白质 亲水胶体) (亲水胶体)
碱 酸
带负电荷蛋白质 亲水胶体) (亲水胶体)
脱水 + + + + + + ++ +
带正电荷蛋白质 (疏水胶体)
脱水 阴离子
不稳定蛋白颗粒
二.特点
1、高效能 、 2、高度选择性 、 3、高灵敏度 、 4、操作简单 、 不足之处:定量精确, 不足之处:定量精确,但定性较差
三、色谱的种类
气-液色谱 气相色谱 气-固色谱 色谱 液-液色谱 液相色谱 液-固色谱
按原理分类
1、吸附色谱法 、 2、分配色谱法 、 3、离子交换色谱法 、 4、凝胶色谱法 、 5、亲和色谱法 、
分离纯化蛋白质的方法及原理

5、盐析与盐溶 :原理:低浓度时,中性盐可以增加蛋白质溶解度这种现象称为盐溶.盐溶作用主要是由于蛋白质分子吸附某种盐类离子后,带电层使蛋白质分子彼此排斥,而蛋白质与水分子之间的相互作用却加强,因而溶解度增高。球蛋白溶液在透析过程中往往沉淀析出,这就是因为透析除去了盐类离子,使蛋白质分子之间的相互吸引增加,引起蛋白质分子的凝集并沉淀。当溶液的离子强度增加到一定程度时,蛋白质溶解程度开始下降。当离子强度增加到足够高时,例如饱和或半饱和程度,很多蛋白质可以从水中沉淀出来,这种现象称为盐析。盐析作用主要是由于大量中性盐的加入使水的活度降低,原来溶液中的大部分甚至全部的自由水转变为盐离子的水化水。此时那些被迫与蛋白质表面的疏水集团接触并掩盖他们的水分子成为下一步最自由的可利用的水分子,因此被移去以溶剂化盐离子,留下暴露出来的疏水基团。蛋白质疏水表面进一步暴露,由于疏水作用蛋白质聚集而沉淀。
当蛋白质混合物加入填有亲和介质的层析柱时,待纯化的某一蛋白质则被吸附在含配体的琼脂糖颗粒表面上而其他的蛋白质因对该配体无特异的结合部位而不被吸附,他们通过洗涤即可除去,被特异结合的蛋白质可用含游离的相应配体溶液把它从柱上洗脱下来。
凝集素亲和层析、免疫亲和层析、金属螯合层析、染料配体层析和共价层析等属于亲和层析。
有机溶剂引起蛋白质沉淀的主要原因之一是改变了介质的介电常数。有机溶剂的加入使水溶液的介电常数降低。介电常数的降低将增加两个相反电荷之间的吸引力。蛋白质分子表面可解离基团的离子化程度减弱,水化程度降低,因此促进了蛋白质分子的聚集和沉淀。
蛋白质纯化方法总结

分离纯化某一特定蛋白质的一般程序可以分为前处理、粗分级、细分级三步。
1.前处理:分离纯化某种蛋白质,首先要把蛋白质从原来的组织或细胞中以溶解的状态释放出来并保持原来的天然状态(如果做不到呢?比如蛋白以包涵体形式存在),不丢失生物活性。
为此,动物材料应先提出结缔组织和脂肪组织,种子材料应先去壳甚至去种皮以免手单宁等物质的污染,油料种子最好先用低沸点(为什么呢)的有机溶剂如乙醚等脱脂。
然后根据不同的情况,选择适当的方法,将组织和细胞破碎。
动物组织和细胞可用电动捣碎机或匀浆机破碎或用超声波处理破碎。
植物组织和细胞由于具有纤维素、半纤维素和果胶等物质组成的细胞壁,一般需要用石英砂或玻璃粉和适当的提取液一起研磨的方法或用纤维素酶处理也能达到目的。
细菌细胞的破碎比较麻烦,因为整个细菌细胞壁的骨架实际上是一个借共价键连接而成的肽聚糖囊状大分子,非常坚韧。
破碎细菌细胞壁的常用方法有超声波破碎,与砂研磨、高压挤压或溶菌酶处理等。
组织和细胞破碎后,选择适当的缓冲液把所要的蛋白提取出来。
细胞碎片等不溶物用离心或过滤的方法除去。
如果所要的蛋白主要集中在某一细胞组分,如细胞核、染色体、核糖体或可溶性细胞质等,则可利用差速离心的方法将它们分开,收集该细胞组分作为下步纯化的材料。
如果碰上所要蛋白是与细胞膜或膜质细胞器结合的,则必须利用超声波或去污剂使膜结构解聚,然后用适当介质提取。
2. 粗分级分离:当蛋白质提取液(有时还杂有核酸、多糖之类)获得后,选用一套适当的方法,将所要的蛋白与其他杂蛋白分离开来。
一般这一步的分离用盐析、等电点沉淀和有机溶剂分级分离等方法。
这些方法的特点是简便、处理量大,既能除去大量杂质,又能浓缩蛋白溶液。
有些蛋白提取液体积较大,又不适于用沉淀或盐析法浓缩,则可采用超过滤、凝胶过滤、冷冻真空干燥或其他方法进行浓缩。
3.细分级分离:样品经粗分级分离以后,一般体积较小,杂蛋白大部分已被除去。
进一步纯化,一般使用层析法包括凝胶过滤、离子交换层析、吸附层析以及亲和层析等。
关于胶原蛋白纯化几种方法的论述

关于胶原蛋白纯化几种方法的论述胶原蛋白是一种在组织修复和再生中起关键作用的蛋白质。
纯化胶原蛋白对于研究其结构、生物学功能以及制备相关生物材料是必不可少的。
在胶原蛋白的纯化过程中,可以采用多种方法,包括离心、电泳、柱层析和亲和纯化等。
首先,离心是最常用的初步分离方法之一、胶原蛋白的提取通常从组织样品中开始,通过机械方法破碎组织,然后对混合物进行高速离心,以分离胶原蛋白。
这种方法可以消除非溶解的细胞碎片和其他杂质,但无法将胶原蛋白与其他蛋白质分离。
其次,电泳是一种常用的纯化方法。
传统电泳分离方法依靠蛋白质分子在电场中的电荷和尺寸差异来进行分离。
胶原蛋白的特定pH值和分子量使得其迁移速度与其他蛋白质不同,因此可以通过电泳方法进行纯化。
然而,由于胶原蛋白的水溶性较低,它常常以多聚体形式存在,因此电泳分离时容易形成聚集体,导致分离效果不佳。
柱层析是一种常见的高效液相层析技术,也是胶原蛋白纯化中常用的方法之一、通过将样品在柱层析填料中与填料上的固定相相互作用,将胶原蛋白与其他蛋白质分离。
柱层析可以根据分子大小、电荷、亲和力等选择不同的层析填料,以实现目标蛋白质的有效分离。
对于胶原蛋白的纯化,常用的柱层析方式包括凝胶过滤层析、离子交换层析和亲和层析等。
其中凝胶过滤层析常用于分离胶原蛋白与其他蛋白质之间的大小差异,离子交换层析则利用胶原蛋白的电荷差异进行分离,而亲和层析则通过特定配体与胶原蛋白结合来实现分离。
综上所述,胶原蛋白的纯化方法包括离心、电泳、柱层析和亲和纯化等多种方法。
通过选择合适的纯化方法,可以有效地分离纯化目标胶原蛋白,并为后续的研究和应用提供高质量的样品。
然而,每种方法都有其优缺点,因此在选择纯化方法时需要综合考虑实验目的和样品特性。
在未来的研究中,还有待进一步发展更高效、更精确的胶原蛋白纯化方法。
蛋白纯化技术简介

在固定相和流动相之间经过多次分配以不同的速率移
动,从而达到分离的目的。
蛋白质层析技术
Company Logo
蛋白质层析技术
Company Logo
❖ 层析技术基本原理
1. 吸附层析
混合物随流动相通过固定相(吸附剂)时,由于固定相 对不同物质的吸附力不同而使混合物得到分离。
增大配基与载体之间的距离,使其与生物大分子有效的亲 和结合。
Company Logo
Company Logo
2. 凝胶介质的种类
小结
Company Logo
(*数字越小,表示介质交
(1)葡聚糖凝胶(Sephadex ) G-数字 联度越大,分级范围越小。)
凝
胶 过
(2)琼脂糖凝胶
①Sepharose(2B,4B,6B) ②Sepharose CL(2B,4B,6B) ③Superose (6,12)
蛋白质纯化技术
Company Logo
蛋白质纯化技术
Company Logo
蛋白质纯化技术
Company Logo
❖ 切向流过滤
切向流过滤(Tangential Flow Filtration ,简称TFF)
其概念是相对于常规过滤(Normal Flow Filtration , 简称NFF )而言的。
Sepharose 6 Fast Flow
分离颗粒 范围大小
特性/应用
Company Logo
pH 稳定性
耐压 最高流速
(Mpa) (cm/h)
Sepharose 4 Fast Flow
蛋白质层析技术
Company Logo
❖Sepharose CL
四种蛋白纯化方式的原理及优缺点的简述

一.分子筛(凝胶层析)原理:用一般的柱层析方法使相对分子质量不同的溶质通过具有分子筛性质的固定相(凝胶),从而使蛋白质分离。
优点:1.洗脱条件简单,往往只需要一种缓冲溶液,可以使用任何缓冲液。
2.实验操作相对简单3.条件温和,对蛋白活性保持率高4.既可以对标签蛋白纯化也可以对非标签蛋白纯化。
缺点:1. 工艺放大困难:分子筛层析无法遵循线性放大原则,即使遵循柱床高度不变的原则,工艺流速如何进行调整,也是需要面临的问题。
2. 层析柱装填困难3.对上样量有要求4.测定柱效困难5.反复使用层析柱困难二.亲和层析原理:亲和层析是一种吸附层析,亲和层析利用固相介质中的配基与混合生物分子之间亲和能力不同而进行分离,当蛋白混合液通过层析柱时,与配基能够特异性结合的蛋白质就会被吸附固定在层析柱中,其他的蛋白质对配体不具有特异性的结合能力,将通过柱子洗脱下来,这种结合在一定条件下是可逆的,选用适当的洗脱液,改变缓冲液的离子强度和pH 值或者选择更强的配体结合溶液将结合的蛋白质洗脱下来,而无亲和力的蛋白质最先流出层析柱。
优点:1. 亲和层析法是分离蛋白质的一种极为有效的方法,它经常只需经过一步处理即可使某种待提纯的蛋白质从很复杂的蛋白质混合物中分离出来,而且纯度很高。
2. 是最有效的生物活性物质纯化方法,它对生物分子选择性的吸附和分离,可以取得很高的纯化倍数。
此外蛋白在纯化过程中得到浓缩,结合到亲和配基后,性质更加稳定,其结果提高了活性回收率。
此外它可以减少纯化步骤,缩短纯化时间,对不稳定蛋白的纯化十分有利。
缺点:1.除特异性的吸附外,仍然会因分子的错误认别和分子间非选择性的作用力而吸附一些杂蛋白质,另洗脱过程中的配体不可避免的脱落进入分离体系。
2. 载体较昂贵,机械强度低,配基制备困难,有的配基本身要经过分离纯化,配基与载体耦联条件激烈等。
三.离子交换层析原理:离子交换层析根据样品表面电荷不同进行分离纯化的技术,根据不同蛋白样品在同一Ph条件下所带电荷正负以及带电荷量不同而将不同蛋白样品分离。
蛋白质层析原理

蛋白质层析原理
蛋白质层析是一种常用的分离和纯化蛋白质的技术。
其原理基于蛋白质在不同条件下与固定相之间的相互作用差异。
层析柱内填充有具有特定性质的固定相,通常为聚合物凝胶或亲和性树脂。
当样品溶液通过层析柱时,蛋白质会根据其相互作用类型和特性与固定相发生不同程度的相互作用,从而实现分离和纯化。
根据蛋白质与固定相的相互作用类型不同,蛋白质层析可分为几种常见的类型,包括离子交换层析、凝胶过滤层析、亲和性层析和逆向相层析。
离子交换层析利用蛋白质对固定相上带电离子交换作用的差异进行分离。
凝胶过滤层析则是根据蛋白质的大小选择性通过凝胶网孔的大小进行分离。
亲和性层析则利用蛋白质与特定配体之间的特异性结合作用进行分离。
逆向相层析则是根据蛋白质与固定相之间的亲水或疏水性质差异进行分离。
层析过程中,样品溶液先经过等离子体预处理以去除杂质物质,然后通过进样器加入层析柱。
通过改变流动相(即溶剂体系)、温度和pH等条件,可以调节蛋白质与固定相之间的相互作用,从而实现目标蛋白质的分离和纯化。
蛋白质可以通过梯度洗脱或者洗涤缓慢地从固定相中洗脱出来,不同分子量或特性的蛋白质被分离开来。
蛋白质层析是一种灵活、高效的蛋白质纯化技术,可以根据蛋白质的特性和需求选择不同的层析类型和条件,获得高纯度的蛋白质样品。
同时,与其他蛋白质纯化方法相比,层析技术对
蛋白质产量和质量的影响相对较小,因此广泛应用于生物医学、生物工程和生物化学等领域中的蛋白质研究和工业生产中。
蛋白质分离和纯化技术的研究和应用

蛋白质分离和纯化技术的研究和应用蛋白质是生物体内最基本的分子,其担负着细胞结构与功能、物质转运、信号传递等重要生理功能。
由于生物样品中蛋白质种类众多、含量差异较大,为了深入揭示蛋白质的生物学功能和结构特性,必须对蛋白质进行精确分离和纯化。
本文将介绍蛋白质分离和纯化技术的研究和应用。
一、蛋白质分离技术蛋白质分离是指将复杂的蛋白质混合物进行分离,得到不同种类的纯化蛋白质的过程。
在蛋白质分离的基础上,再进行进一步纯化,能够更好地揭示蛋白质的生物学特性。
(一)凝胶电泳凝胶电泳是当前最常用的蛋白质分离技术之一。
它基于蛋白质的电荷、大小、形状和亲疏水性等性质,利用电场将蛋白质分子沿着凝胶移动,实现分子大小的分离。
凝胶电泳具有分离效果好、操作简单易行、样品消耗量小以及可视化等优点。
(二)液相色谱液相色谱(Liquid chromatography)是一种通过化学亲和性、分子大小、极性与非极性等属性分离物质的分离技术。
常用的液相色谱有透析液相色谱、醚基、硅烷基、反相、离子交换、凝胶过滤等类型。
其中反相色谱在蛋白质分离中尤为重要,它基于不同蛋白质在疏水性基质表面的分配系数不同,以蛋白质的亲水性为基础进行分离。
二、蛋白质纯化技术蛋白质纯化是指在获得蛋白质的基础上,通过不同的纯化技术去除其中的杂质,得到纯度高的蛋白质分子。
蛋白质的纯化技术主要分为两类:非特异性纯化和特异性纯化。
(一)非特异性纯化非特异性纯化是指利用物理化学性质对样品进行分步纯化,将目标分子与混杂物质逐步分离开来的方法。
常用的非特异性纯化技术有盐析、凝胶过滤和透析等。
其中,盐析技术是常用的一种非特异性纯化技术,它利用富集目标蛋白质对盐的结合能力高于混杂蛋白质的特性,将混杂蛋白质和目标蛋白质分离。
(二)特异性纯化特异性纯化是指通过蛋白质与配体、抗体等生物学活性团之间的特异作用进行分离纯化的方法。
常用的特异性纯化技术包括亲和层析、免疫亲和层析等。
其中,亲和层析是一种重要的特异性纯化技术,它通过识别目标蛋白质与固定于固相材料上的亲和基团之间的特异性互作来分离纯化蛋白质。
蛋白质的纯化的方法及原理

蛋白质的纯化的方法及原理蛋白质的纯化是从其来源中去除其他有机物和无机物,使其成为纯净的蛋白质样品的过程。
蛋白质纯化的方法可以根据需要选择,其中常用的方法包括盐析、凝胶过滤、电泳、金属柱层析、亲和层析、离子交换层析、逆相高效液相色谱等。
下面将详细介绍这些方法及其原理。
一、盐析盐析是利用不同浓度的盐溶液对蛋白质溶液进行逐渐稀释,从而使蛋白质发生沉淀的过程。
纯化蛋白质的关键是利用蛋白质与溶剂中离子之间的相互作用来控制蛋白质的溶解和沉淀过程。
在盐析中,通过选择离子强度和种类可以调整蛋白质溶液中所需溶剂化离子的浓度,达到沉淀和纯化蛋白质的目的。
二、凝胶过滤凝胶过滤是一种分子筛分离方法,利用不同孔径的凝胶进行分离。
凝胶的孔径能够排除较大分子,如核酸和细胞碎片,而较小分子,如蛋白质则能通过孔隙,实现纯化。
该方法简单易行,不需要任何特殊设备,适用于中小分子量的蛋白质纯化。
三、电泳电泳是利用蛋白质在电场中的移动性差异进行分离和纯化的方法。
常用的电泳方法有平板电泳、SDS-PAGE(聚丙烯酰胺凝胶电泳)和Western blotting (免疫印迹法)等。
电泳能够根据蛋白质的电荷、分子大小和不同的电场力,在凝胶中分离蛋白质,使其形成带状。
通过切割所需蛋白质的带状区域,可以实现对目标蛋白质的纯化。
四、金属柱层析金属柱层析是利用金属离子与蛋白质之间的亲和性进行分离的方法。
金属柱通常被配制成金属离子亲和基质,并固定在柱子上。
目标蛋白质通过与金属离子发生亲和作用而被保留在柱中,其他杂质则从柱中流出。
通过调节洗脱缓冲液的离子浓度和pH值,可实现对目标蛋白质的纯化。
五、亲和层析亲和层析是利用配体与其特异性结合的蛋白质进行分离和纯化的方法。
通常将配体固定在柱子上,待蛋白质样品通过柱子时,目标蛋白质与配体结合,其他杂质则流失。
通过改变洗脱缓冲液的条件,如离子浓度、pH值和络合剂的添加,可以实现目标蛋白质的纯化。
六、离子交换层析离子交换层析是一种利用蛋白质与离子交换基质之间的相互作用进行分离和纯化的方法。
蛋白质分离纯化的方式

蛋白质分离纯化的方式分离纯化某一特定蛋白质的一般程序可以分为前处理、粗分级、细分级三步。
1.前处理:分离纯化某种蛋白质,首先要把蛋白质从原来的组织或细胞中以溶解的状态释放出来并保持原来的天然状态(如果做不到呢?比如蛋白以包涵体形式存在),不丢失生物活性。
为此,动物材料应先提出结缔组织和脂肪组织,种子材料应先去壳甚至去种皮以免手单宁等物质的污染,油料种子最好先用低沸点(为什么呢)的有机溶剂如乙醚等脱脂。
然后根据不同的情况,选择适当的方法,将组织和细胞破碎。
动物组织和细胞可用电动捣碎机或匀浆机破碎或用超声波处理破碎。
植物组织和细胞由于具有纤维素、半纤维素和果胶等物质组成的细胞壁,一般需要用石英砂或玻璃粉和适当的提取液一起研磨的方法或用纤维素酶处理也能达到目的。
细菌细胞的破碎比较麻烦,因为整个细菌细胞壁的骨架实际上是一个借共价键连接而成的肽聚糖囊状大分子,非常坚韧。
破碎细菌细胞壁的常用方法有超声波破碎,与砂研磨、高压挤压或溶菌酶处理等。
组织和细胞破碎后,选择适当的缓冲液把所要的蛋白提取出来。
细胞碎片等不溶物用离心或过滤的方法除去。
如果所要的蛋白主要集中在某一细胞组分,如细胞核、染色体、核糖体或可溶性细胞质等,则可利用差速离心的方法将它们分开,收集该细胞组分作为下步纯化的材料。
如果碰上所要蛋白是与细胞膜或膜质细胞器结合的,则必须利用超声波或去污剂使膜结构解聚,然后用适当介质提取。
2.粗分级分离:当蛋白质提取液(有时还杂有核酸、多糖之类)获得后,选用一套适当的方法,将所要的蛋白与其他杂蛋白分离开来。
一般这一步的分离用盐析、等电点沉淀和有机溶剂分级分离等方法。
这些方法的特点是简便、处理量大,既能除去大量杂质,又能浓缩蛋白溶液。
有些蛋白提取液体积较大,又不适于用沉淀或盐析法浓缩,则可采用超过滤、凝胶过滤、冷冻真空干燥或其他方法进行浓缩。
3.细分级分离:样品经粗分级分离以后,一般体积较小,杂蛋白大部分已被除去。
(仅供参考)层析工艺在血浆蛋白纯化中的应用

组分Ⅲ上清液
PH:7.0。乙醇加至25%(﹤-15℃,50%乙醇) 温度:-6.5℃~-7.5℃。
组分Ⅱ沉淀
溶解。PH:6.5。深层过滤。 离子交换层析纯化
纯化液
超滤浓缩
中间品
调pH,IgG含量。麦芽糖,23~25℃。 恒温低pH孵放21天。除病毒膜。
半成品
除菌分装。一次灯检。 全检。二次灯检。
静丙成品
凝血因子Ⅷ的纯化
血友病甲或所谓“经典”血友病是一种X染色体连锁的出血性疾病,其特点是凝 血因子Ⅷ(FⅧ)的缺乏。其分子病理是由于因子Ⅷ基因的缺陷。由于传统的FⅧ制剂纯度 不够高,且含有大量杂蛋白及存在病毒污染的可能,使许多病人产生病毒感染及引起发热、 溶血与免疫异常等副反应。因此,自上世纪80年代开始研究重点是如何提高FⅧ的纯度及 开发各种灭活病毒的方法。层析法的使用使FⅧ的质量得到大大提高。
含白蛋白 和免疫球 蛋白组分
DEAE Bio-Sep FF柱Ⅱ 去杂蛋白及白蛋白
DEAE Bio-ቤተ መጻሕፍቲ ባይዱep FF柱Ⅲ
含免疫球蛋白组分
滤过液
去杂蛋白组分
CM Bio-Sep FF柱 微量杂质
免疫球蛋白
分离图谱及结果
凝血因子的纯化
正常血液凝固是一系列血浆凝血因子相继激活,最后形成纤维蛋白凝 块的过程。(以瀑布学说为基础的内、外源及共同途径凝血机理)
注:优球蛋白是含有纤维蛋白原、纤溶酶原及其激活因子的复合物,它在低盐条件或酸性环境中可 沉淀。
白蛋白纯化工艺(澳大利亚CSL)
澳大利亚国民血清实验室CSL从1995年六月开始建成投产了世界上最大的层析法白蛋白 生产线,该生产线的年处理量为500吨血浆。
他们采用Cohn 法与层析法结合的工艺将FII+III上清脱盐沉淀优球蛋白后通过DEAE Sepharose FF、CM Sepharose FF 两步离子交换凝胶,一步Sephacryl S-200 High Resolution 凝胶过滤层析得到白蛋白制品。
HPLC检测蛋白纯度

百泰派克生物科技
HPLC检测蛋白纯度
HPLC(high performance liquid chromatography)即高效液相色谱,又称高效液相层析法、高压液相色谱,是近20年在液相色谱技术基础上发展起来的新型分析技术,用于不易挥发的有机化合物中各种成分的分离、鉴定和量化。
HPLC与液相色谱法的原理基本相同,不同点在于HPLC通过高压泵对混合物施加压力,使其快速通过装有固体吸附剂的色谱柱,分离速度得到提升;此外,高灵敏度的检测器和高效微粒固定相的使用也大大提高了HPLC的分离效能和灵敏度。
HPLC检测蛋白纯度
蛋白质纯度是蛋白分析中非常重要的一项指标,一般实验分离的蛋白质常常会含有一些杂质蛋白或提取步骤中使用的试剂等,影响后续实验的顺利进行,因此有必要对其进行纯化,并对纯化结果进行检测。
蛋白质纯度测定可以评价蛋白质是否含有杂质以及杂质的含量,是进行后续蛋白质研究至关重要的环节。
HPLC检测蛋白纯度的原理是将蛋白样品加入装有固体吸附剂的色谱柱,不同的蛋白样品与吸附材料的相互作用不同导致其流出速度不同,蛋白样品得以分离,分离得到的蛋白质再经过检测系统进行分析,最后将色谱数据结合相应数据库进行分析对蛋白质的种类和含量进行鉴定。
百泰派克生物科技提供基于HPLC和质谱的蛋白质定性、定量和纯度检测服务,可用于多种蛋白质/多肽样品分离测定,满足多种蛋白质/多肽样品纯度分析需求。
欢迎免费咨询152-****7680。
蛋白质纯度分析方法

蛋白质纯度分析方法
蛋白质纯度分析方法有多种,常用的包括:
1. SDS-PAGE(聚丙烯酰胺凝胶电泳): 这是一种常用的蛋白质纯度分析方法。
在这种方法中,蛋白质样品被加入到聚丙烯酰胺凝胶中,经过电泳分离,根据分子量的大小在凝胶上形成多个蛋白带,通过染色或蛋白质标记物与凝胶上的蛋白质结合后观察,可以确定蛋白质的纯度和相对分子量。
2. 高效液相色谱(HPLC): 这是一种利用溶液相流动将混合物中的成分进行分离和纯化的方法。
蛋白质在HPLC柱中按照其理化性质如大小、极性和亲水性等进行分离,可以通过检测紫外光吸收、荧光或质谱等来确定蛋白质的纯度。
3. 硫酸铵沉淀: 这是一种通过加入一定浓度的硫酸铵使蛋白质发生沉淀而进行
纯化的方法。
纯化后的蛋白质样品可以通过比色法或质谱分析等方法来确定纯度。
4. 分子筛层析: 这是一种通过蛋白质分子大小的差异来进行分离和纯化的方法。
蛋白质混合物经过分子筛层析柱时,分子较小的蛋白质能够进入分子筛的孔隙中,而分子较大的蛋白质则被排除在外,从而实现对蛋白质纯化的目的。
5. 亲和层析: 这是一种利用蛋白质与某种亲和固定相之间的特定相互作用进行
分离和纯化的方法。
亲和相可以是具有特定配体的固定相,如金属离子、抗体、
亲和标签等,蛋白质与亲和相结合后,其他非特异性结合的蛋白质被洗去,再用特定条件将目标蛋白质洗脱,从而实现对蛋白质的纯化。
快速蛋白液相色谱

快速蛋白液相色谱
快速蛋白液相色谱(Fast Protein Liquid Chromatography, FPLC)是
一种常用的蛋白质纯化技术,可用于从复杂的混合物中分离和纯化蛋
白质。
以下是关于FPLC的介绍:
1. 原理
FPLC基于液相色谱技术,通过分离蛋白质混合物中的成分。
常用的分
离介质有离子交换层析、凝胶过滤、亲和层析、逆向相色谱等。
2. 优势
与传统的手动蛋白质纯化方法相比,FPLC具有以下优势:
- 分离速度更快,能在较短时间内得到高纯度的蛋白质;
- 处理量大,在单次操作中可分离数百毫克到数克的蛋白质;
- 能够控制操作条件,提高样品的分离效果和纯化度。
3. 操作步骤
FPLC的操作步骤一般包括以下几个步骤:
- 样品准备与加载:将蛋白质混合物加入到柱子中,用缓冲液进行洗涤;- 层析分离:根据分离介质不同,进行不同的分离操作;
- 洗脱:用缓冲液进行洗脱,并收集目标蛋白质;
- 分析:对纯化后的蛋白质进行分析和鉴定。
4. 应用范围
FPLC广泛应用于生物制药、分子生物学等领域。
常用于纯化单克隆抗体、重组蛋白、酶类等生物大分子。
5. 常见问题
在 FPLC 操作中,常见问题包括:
- 柱床不均匀:可以更换柱子或者修复柱子;
- 样品质量不好:可以尝试改变样品的处理方法,选择优质的样品;- 分离效果不佳:可以尝试增加样品负载量、改变分离介质的种类、改变操作条件等。
总之,FPLC是一种高效、快速的蛋白质纯化技术,具有广泛的应用前景。
蛋白层析系统

蛋白层析系统
蛋白层析系统是一种常用的蛋白质分离和纯化技术。
它基于蛋白质在化学或物理条件下的差异而实现分离纯化的目的。
蛋白质层析系统通常包含以下几个主要组成部分:
1. 高效层析柱:蛋白质样品通过柱状填料进行分离。
填料通常是多孔性固体材料,如海洛因、DEAE、Octyl-Sepharose等。
填料的选择和操作条件是根据目标蛋白质的性质和纯化要求来确定的。
2. 缓冲液系统:用于保持适宜的pH值和离子强度,以确保蛋白质在层析柱中具有最佳的亲和性和分离度。
缓冲液系统通常包括运行缓冲液、平衡缓冲液和洗脱缓冲液,其配方也需要根据具体需要进行调整。
3. 层析设备:用于控制流速、压力和温度等操作参数。
常见的层析设备包括高压液相层析仪(HPLC)、低压液相层析系统(FPLC)和手动操作的层析设备。
4. 蛋白检测系统:用于检测和监测层析柱流出液中的蛋白质含量。
常见的检测方法包括紫外光谱、荧光标记和蛋白质浓度测定等。
蛋白层析系统的操作步骤通常包括样品预处理、层析柱平衡、样品加载、洗脱和回收等。
不同的层析技术还可以结合其他分离方法,如亲和层析、离子交换层析、尺寸排除层析等,来实现更精确的纯化目标。
蛋白层析系统广泛应用于生物医药研究和生产中,可以从复杂的混合物中高效地纯化目标蛋白质,满足药物研发、蛋白质结构分析和生物学功能研究等领域的需求。
蛋白质和多肽反相hplc分析和纯化指南

蛋白质和多肽反相hplc分析和纯化指南蛋白质和多肽反相HPLC分析和纯化指南1. 简介反相高效液相色谱(RP-HPLC)是一种常用的分析和纯化蛋白质和多肽的方法。
它利用疏水性相互作用将样品分离,可以有效地分离和纯化各种大小的蛋白质和多肽。
本指南旨在为您提供使用RP-HPLC分析和纯化蛋白质和多肽的基本原理和实践技巧。
2. 样品制备适当的样品制备对于成功的RP-HPLC分离至关重要。
样品应该溶解在与HPLC流动相相容的溶剂中,通常是水/醇混合物。
如果样品不溶于此类溶剂,可以考虑使用其他助溶剂,如尿素或盐酸胍。
样品浓度应适中,以避免过载和峰展宽。
3. 色谱条件- 色谱柱: C18反相柱是最常用的,但也可以尝试其他疏水性基团。
柱长和粒径的选择取决于分离需求。
- 流动相: 通常由水和有机溶剂(如乙腈或甲醇)组成的梯度洗脱。
添加小量三氟乙酸(TFA)或其他离子对调节pH和离子强度可能有助于改善分离。
- 检测器: 紫外/可见光检测器是最常用的,检测波长取决于蛋白质/多肽的吸收特性。
4. 方法开发开发RP-HPLC方法需要优化多个参数,包括梯度斜率、流速、温度和pH等。
可以尝试不同的梯度程序和流动相组成,以获得最佳分离。
5. 纯化利用RP-HPLC可以有效地纯化蛋白质和多肽。
根据初步分析结果,选择合适的梯度条件,收集目标峰。
必要时可进行多次重复注射和分馏,以提高纯度。
6. 样品回收纯化后的样品需要除去有机溶剂和其他添加剂。
常用的方法包括液体-液体萃取、离子交换、超滤和凝胶层析等。
回收的样品应进行浓缩和缓冲液交换,以适应后续用途。
7. 结语RP-HPLC是一种强大的分析和纯化蛋白质和多肽的工具。
掌握正确的技术和方法开发策略对于获得满意结果至关重要。
本指南概述了基本原理和关键步骤,为您成功应用RP-HPLC分析和纯化蛋白质和多肽提供参考。
AKTA(FPLC) 纯化系统

AKTApurifierTM 系统可以确保每一根柱子都运行在最佳条件下,并且可以保护它们不受 某些破坏性事件 (比如超压) 的损害。只要从庞大的层析柱数据库中选择一根预装柱, AKTApurifierTM 就会自动地为它设定各种最佳的运行参数。新的层析柱可以不断地被加 入到这个数据库中去,而且可以在同样的安全模式下运行。
AKTApurifierTM UPC 10 和 100 核心系统都用 UPC-900 监控器方便地同时进行紫外波长, pH 以及电导的监控。相对于 UV-900,这种监控器具有更大的灵活性,是一种更为经 济的选择。
AKTApurifier 10 and 100 core system 4
AKTApurifier UPC 10 and 100 core system
GE Healthcare
A˙˙KTATM
设计自己的快速蛋白质 液相层析 (FPLC) 纯化系统
AKTApurifier 和自动 控制配套组件
多功能性和自动化
自动化的FPLCTM蛋白质纯化系统采用的层析系统能够确保获得更可靠的结果和更强大 的多功能性。自动化控制可以减少诸如样品溢出或是放错管子所导致的样品损失,从 而确保您能够获得更多的目的蛋白质。此外,自动化控制使得纯化条件的优化变得更 为便利。您可以在纯化蛋白质上节约大量的时间,从而可以集中精力去完成一些其它 重要的工作。
筛选层析柱配套组件配备了可以自动进行方法优化,多步骤纯化以及更为轻松地进行 层析柱筛选所需的一些电动阀 (motor valves)。一次可将多达八根层析柱接入系统。这 样,在一次运行中,不同层析柱的性能可以在运行时随着条件的改变易于进行比较。 而预设好的方案还可以在使用中防止系统超压以及层析柱损坏。
蛋白质多肽液相色谱纯化方法简介
10-40
Sephadex G-100
4000-150000 40-120 较大蛋白的分离
Sephadex G100 superfine 4000-100000 10-40
Sephadex G-150
5000-300000 40-120 大蛋白的分离
Sephadex G150 superfine 5000-150000 10-40
表 2 样品中有害杂质及去除办法
杂质
害处
预防措施
颗粒物 堵塞柱子/增大反压力
0.45-0.22 微 米 膜 过 滤 ; 10000 g 离 心 10-15 分 钟 ; 细胞匀浆,4000-5000 g 离心 30 分钟。
脂类
封 闭 介 质 配 基 / 导 致 沉 淀 10000 g 离心 10-15 分钟;若目标分子稳定,用有机溶剂
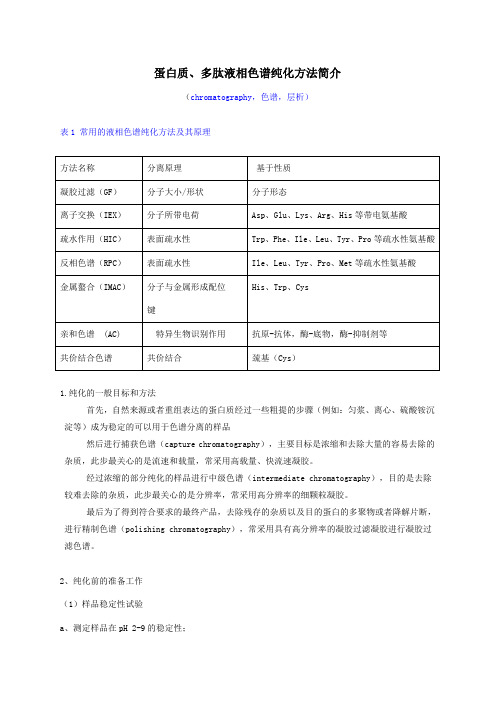
1.纯化的一般目标和方法 首先,自然来源或者重组表达的蛋白质经过一些粗提的步骤(例如:匀浆、离心、硫酸铵沉
淀等)成为稳定的可以用于色谱分离的样品 然后进行捕获色谱(capture chromatography),主要目标是浓缩和去除大量的容易去除的
杂质,此步最关心的是流速和载量,常采用高载量、快流速凝胶。 经过浓缩的部分纯化的样品进行中级色谱(intermediate chromatography),目的是去除
对于等电点小于 5.0 的酸性蛋白质,推荐使用阴离子交换,对于等电点大于 7.0 的碱性蛋白 质,推荐使用阳离子交换。
两种模式:一种使目的蛋白结合凝胶,通过梯度洗脱;一种使目的蛋白不结合凝胶,而大部 分杂质结合凝胶,则穿过液中含有目的蛋白。
column chromatography(柱色谱) batch chromatography(批色谱) 3、疏水作用色谱 利用蛋白质、多肽在高盐存在下,可以结合疏水凝胶,而在盐浓度降低时又可以解脱的原理实 现分离。 4、亲和色谱 利用蛋白质、多肽与某些配基的特异性相互作用而进行分离。例如:酶-底物,酶-抑制剂,糖 蛋白-凝集素,抗原-抗体等。近来发展了金属螯合亲和色谱,用于纯化表面含色氨酸、酪氨酸、组 氨酸等的蛋白质以及(His)6-tagged 重组蛋白。 亲和色谱分为特异性亲和色谱和组别亲和色谱两类。肝素、凝集素、染料、金属螯合亲和色 谱均为组别亲和色谱(同一配基可以结合许多种蛋白质)。 5、反相色谱 常用于蛋白质、多肽的 HPLC 分析,以及多肽的精细制备分离,分辨率极高,可以分离两种仅 相差一个氨基酸的多肽。如血管紧张素(angiotensin)的几个亚型通过反相色谱可以很好地分离 。同一个样品在同一 Source 30 RPC 柱上进行分离,由于色谱条件进行了改变,色谱图截然不同, 说明反相色谱具有高度的选择性。
蛋白液相纯化系统技术参数

蛋白液相纯化系统技术参数.精确的全自动微量
柱塞泵,双泵四泵头,每个泵头都有独立除气
阀。
2,流速:0. 001-25 ml/min (单泵)。
装柱模式可以双泵模式运行,最高达到50 nil/min:从低流速到50 ml/min的流速的变化只需要通过软件简单设置,不需要泵头的更换。
#3.流速准确度:±1.2%,流速精度:RSD<0. 5%,(条件:0. 25 - 25 ml/min, < 3 MPa, 0.8-2 cP)
*4.使用LED单一紫外冷光源(280nm)检测,无需预热。
*5 ,紫外检测范围:-6至I」+6 AU,线性:±5%,(条件:0-2 AU之间)6.光源和流动池分开设计,避免光源过热对样品的影响。
7.检测范围:0. 01 mS/cm—999. 9 mS/cm,宽广的电导范围,易于做疏水和反相层析。
8.缓冲液选择阀:4个缓冲液入口,内置气泡传感器保护层析柱。
9.圆形组分收集器具有滴感应器,防滴漏功能,可根据固定体积或峰收集进行自动收集。
10.圆形组分收集器可根据体积或峰自动收集,兼容3, 8, 15和50nli的收集管,最多可以同时放置175个3ml收集管,收集范围0. TSOniLo。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
俄国植物学家米哈伊尔·茨维特-色谱学之父 茨维特奖-色谱界大奖
1906年茨维特用碳酸钙填充竖 立的玻璃管,以石油醚洗脱植 物色素的提取液,植物色素在 碳酸钙柱中实现分离。由于这 一实验将混合的植物色素分离 为不同的色带,因此他将这种 方法命名色谱法。
层析法的分类
1、根据固定相基质的形式分类,层析可以分为纸层析、薄层层析、毛 细管层析和柱层析。
预期使用有什么联系?
• 什么东西必须去除? • 什么东西必须完全去除? • 最终纯化的规模是什么? • 如果需要扩大规模,用已选择的纯化技术将会产生什
么样的后果?
• 在经济方面的限制是什么? • 什么样的资源和设备是可以利用的?
三步纯化策略CIPP
Capture Intermediate Purification Polishing
Chromatography,HIC ) • 反相层析(Reversed Phase Chromatography,RPC) • 亲和层析(Affinity Chromatography,AC ) • 总结
• 蛋白纯化一般需要考虑回答的问题: • 制备产品的目的是什么? • 什么样的原材料是可以使用的和如何处理它? • 纯度问题与材料的来源有什么样的关系,和终产品的
• 正相层析,属于分配层析,固定相极性大于流动相。 • 正相键合相层析,固定相共价键合在固定基质上的正相层析。 • 反相层析,属于分配层析,固定相极性小于流动相。 • 反相键合相层析,固定相共价键合在固定基质上的反相层析。 • 凝胶过滤层析,属于分子筛层析,流动相主要为水溶液。 • 凝胶渗透层析,属于分子筛层析,流动相主要为有机溶液。
• 每一个纯化参数的重要性是变化的,这主要取决于一个纯化步骤是否 用于捕获、中度纯化或者精细纯化阶段。
比如回收率
样品前处理
1、超声破碎 • 防止能量太大,产热过盛,蛋白发生炭化,但变黑的原因还有含杂质化学
试剂作用等等。 • 起泡使蛋白溶液易溅出而且位于泡沫表面的蛋白易变性,影响最终得率。
防止方法:一定要将末端插入液面下较深部位,防止与空气物质接触,产 生气泡;每次超声的菌液量要适中。 • 离心后沉淀再重复超声破碎一次,合并两次上清液。 • 超声破碎有一个最适合的菌液浓度(例如100mg/mL)。 • 占空比:超声为恒定周期的方波,设开关管的导通时间为Ton,开关管的 关闭时间为Toff,脉冲周期为T,则占空比为Ton:T。
• 分配层析是以载带在固相本体的固定液为固定相,不同物质在固定相 和流动相的分配性能不同而达到分离目的的一种层析技术。
• 分子筛层析是以化学惰性的多空凝胶颗粒作为固定相,根据物质的分 子大小进行分离的一种层析技术。
• 离子交换层析是以离子交换剂为固定相,根据物质的带电性质不同而 进行分离的一种层析技术。
·层析也叫色谱,英文都是Chromatography,是一种分离和分 析方法,在分析化学、生物化学等领域有着非常广泛的应用。
·利用不同物质在不同相态(一相是固定相,另一相是流动相) 的选择性分配,以流动相进行洗脱,不同的物质会以不同的速度 沿固定相移动,最终达到分离的效果。
·起源于20世纪初,1950年代后飞速发展,出现色谱学。有两位 化学家因为在色谱领域的贡献而获得诺贝尔化学奖(瑞典科学家 Tiselius1948年,英国科学家Martin和Synge1952年 ),色谱分 析方法还在12项获得诺贝尔化学奖的研究工作中起到关键作用。
Polishing ,CIPP) • 凝胶过滤层析(Gel Filtration Chromatography,GFC ) • 离子交换层析(Ion Exchange Chromatography,IEC ) • 疏水相互作用层析(Hydrophobic Interaction
Chromatography,HIC ) • 反相层析(Reversed Phase Chromatography,RPC) • 亲和层析(Affinity Chromatography,AC ) • 总结
• 分辨率,高分辨率的获得是通过对色谱技术的选择和色谱介质的效率来形成 一个很窄的色谱峰。一般情况下,在样品纯化的最后阶段获得好的分辨率是 非常困难的,因为这时样品中的杂质和靶蛋白质的特性非常相似。
每一种技术都在分辨率、 容量、速度和回收率之 间达到一种平衡
• 一般来说,如果使上述4个参数中的一个参数最优化,那么将会以损 失其它3个纯化参数为代价并且纯化步骤也会受到影响。
• 疏水相互作用层析是以疏水基团为固定相,根据物质的疏水能力不同 进行分离的一种层析技术。
• 亲和层析是根据生物大分子和配体之间的特异性亲和力(如酶和抑制 剂、抗体和抗原、激素和受体等),将某种配体连接在载体上作为固 定相,而对能与配体特异性结合的生物大分子进行分离的一种层析技 术。亲和层析是分离生物大分子最为有效的层析技术。
谱等都通常采用柱层析形式。层析用的柱子大小、材质多种多样。
2、根据流动相的形式分类,层析可以分为液相层析和气相层析。 · 气相层析是指流动相为气体的层析,测定样品时需要气化,大大限制
了其在生化领域的应用,主要用于氨基酸、等小分子的分析鉴定。 · 液相层析指流动相为液体的层析,是生物领域最常用的层析形式,适
• 容量,纯化过程中加载靶蛋白的总量。在一些情况下,加载样品的总量或许 会受到上样体积的限制(如在凝胶过滤色谱中)或者受到大量存在于样品中 的污染物的限制,而不是靶蛋白的总量的限制。
• 速度,在开始纯化阶段速度是一个最重要的环节,需要尽可能快的将样品中 的污染物如蛋白酶等必须去除的物质除去。
• 回收率,在整个纯化的进程中,回收率的重要性会逐渐增加,因为被纯化产 品的价值在逐渐增加。回收率受到对样品破坏过程的影响和不适宜色谱柱条 件的影响。
凝胶渗透层析(Gel Permeation Chromatography,GPC) 流动相为主要为非水有机溶剂
基质以聚苯乙烯二乙烯苯为代表
有机高分子分离分子量测定(高压)
组群分离,脱盐换液 分级分离,精纯
名称混乱 原理相同
凝胶过滤填料结构
琼脂糖凝胶颗粒
化学惰性 孔径控制 孔内充满流动相 柱内非流动相体积约5%
Polishing ,CIPP) • 凝胶过滤层析(Gel Filtration Chromatography,GFC ) • 离子交换层析(Ion Exchange Chromatography,IEC ) • 疏水相互作用层析(Hydrophobic Interaction
Chromatography,HIC ) • 反相层析(Reversed Phase Chromatography,RPC) • 亲和层析(Affinity Chromatography,AC ) • 总结
• 不要拘泥于各种分类方法。 • 液固液液层析等叫法在中低压层析不常用。 • 蛋白纯化层析都属于液相柱层析,分子筛层析、离子交换
层析、疏水相互作用层析、亲和层析、反相层析是最常用 叫法。
层析过程
• 装柱:重力装柱、正压装柱,软胶、半硬胶装柱压力不同。 柱效测定。
• 加样:注意允许的体积、浓度、总量。 • 洗脱:等度洗脱、梯度洗脱 • 流动相动力:重力,泵。 • 检测:紫外检测器(VWD、DAD)、荧光检测器 • 数据记录:记录仪(有纸、无纸)、电脑 • 馏分收集:馏分收集器
·在捕获阶段,目标是分离、浓缩和稳定目标产物。产品应当被 浓缩,并且转移到保持其能力和活性的环境中。 ·在中度纯化阶段,目标是去除大部分不纯物,如其它蛋白和核 酸、内毒素和病毒。 ·在精制阶段,除了微量或极其相关的物质,绝大多数不纯物已 经被去除。目标是去除任何残留的微量不纯物或极其相关的物质, 获得最终的纯化物。 ·依据每种纯化技术的主要优势和样品在开始纯化或者每一步骤 结束时的条件来合理的组合纯化技术。 ·通过对纯化技术的合理组合使在两个纯化步骤间的样品处理量 最小化,避免对样品使用条件的限制。
于生物样品的分析、分离。
作为固定相支持物的毛细 管,很细很长。 液体固定相涂布在毛细管 内壁,气体流动相流过管 内。 样品也需要气化。
3、根据分离的原理不同分类,层析主要可以分为吸附层析、分配层析、 分子筛层析、离子交换层析、疏水相互作用层析、亲和层析等。
• 吸附层析是以固体吸附剂为固定相,根据待分离物与吸附剂之间吸附 力不同而达到分离目的的一种层析技术。
蛋白纯化-液相柱层析简介
生药所姜松
内容
• 层析概述 • 三步层析策略( Capture、Intermediate Purification、
Polishing ,CIPP) • 凝胶过滤层析(Gel Filtration Chromatography,GFC ) • 离子交换层析(Ion Exchange Chromatography,IEC ) • 疏水相互作用层析(Hydrophobic Interaction
重力液相柱层析
★ 不需特殊设备 ★ 易操作 ★ 可以高通量 ★ 流速不够快也不准 ★ 不易在线监测
简单液相柱层析装置
ÄKTA系列
内容
• 层析概述 • 三步层析策略( Capture、Intermediate Purification、
Polishing ,CIPP) • 凝胶过滤层析(Gel Filtration Chromatography,GFC ) • 离子交换层析(Ion Exchange Chromatography,IEC ) • 疏水相互作用层析(Hydrophobic Interaction
凝胶过滤原理:体积排阻
动画:凝胶过滤
体积大小、分子形状决定洗脱位置
检 测 值
不同分子按照大小顺序洗出 大分子先洗出,小分子后洗 出
体积
分离体积
Vo = void volume 外水体积
Vr or Ve= retention volume or elution volume 保留体积/洗脱体积
