超氧化物歧化酶(SOD)的生产
酵母发酵法制备超氧化物歧化酶(SOD)

离心取上清液
SOD纯化
SOD成品
1、酵母菌发酵
• 将斜面菌种接入试管发酵培养基中,静 置培养14h后,以4%的接种量接入装有 60ml发酵培养基的三角瓶中,30℃摇床 (转速140r/min)培养15h或培养至对 数生长期,于4℃、12000r/min下离心 20min,收集菌体(酵母细胞)。
2、酵母SOD的提取方法
酵母发酵法制备超氧 化物歧化酶(SOD)
• 超氧化物歧化酶Orgotein (Superoxide Dismutase, SOD),别名肝蛋白、奥谷蛋 白,简称:SOD。SOD是一种源于生命体 的活性物质,能专一地清除超氧阴离子自 由基的金属酶,为酸性蛋白,对热、pH和 蛋白酶的水解叫一般酶稳定。其主要功能 是防御细胞因新陈代谢而产生的活性氧及 其他氧化物对细胞膜系统的伤害,保证细 胞正常的生命活动。
一、SOD简介
二、制备所需材料
• 1、菌种:高产SOD酵母菌株。 • 2、斜面保存培养基:8°Be麦芽汁琼脂 固体培养基。 • 3、发酵培养基:蛋白胨2%,酵母膏1%, 葡萄糖1%, 8°Be麦芽汁5%(自然pH 值)。
三、酵母发酵法制备SOD的工艺流程
斜面保藏菌种 种子培养 发酵
离心收集细胞
破壁提取
四、SOD的临床应用
临床试用 SOD 治疗和预防下列疾病: 1 )可抑制心脑血管疾病 2 )抗衰老作用 3 )自身免疫性疾病 4 )肺气肿 5 )辐射病及辐射防护 6 )老年性白内障
五、SOD的发展前景
• SOD不仅仅在临床上得到应用,其在化 妆品、农业上、食品工业等也得到广泛 应用,还有很多未知领域等待未来接班 人去发掘。由此可知其具有非常高的市 场价值,是广大开发商所青睐的。
2.1 甲苯法 2.2 乙醇-氯仿法 2.3 异丙醇法
超氧化物歧化酶的制备

超氧化物歧化酶(SOD)的制备超氧化物歧化酶,简称SOD(Super Oxide Dismutase),是一种广泛存在于动、植物及微生物中的金属酶,至少可分为三种类型:第一种类型-Cu·Zn-SOD,呈蓝绿色,主要存在于真核细胞的细胞浆内,分子量在32000左右,由两个亚基组成,每个亚基含一个铜和一个锌。
第二种类型-Mn-SOD,呈粉红色,其分子量随来源不同而异。
来自原核细胞的分子量约为4000,由两个亚基组成,每个亚基各含一个锰;来自真核细胞线粒体的-Mn-SOD,由4个亚基组成,分子量约为80000。
第三种类型-Fe-SOD,呈黄色,只存在于真核细胞中,分子量在38000左右,由两个亚基组成,每个亚基各含一个铁。
此外,在牛肝中还存在一种-Co·Zn-SOD。
自从1973年Weisiger等在鸡肝中发现二种SOD以来,至今已采用了各种分离及分析方法,成功地从各种动物肝脏及血液中,分离纯化了SOD。
同时发现SOD的存在可能与机体衰老、肿瘤发生、自身免疫性疾病和辐射防护有关。
目前临床上主要用于延缓人体衰老,防止色素沉着,消除局部炎症,特别是治疗风湿性关节炎、慢性多发性关节炎及放射治疗后的炎症,无抗原性,毒副作用较小,是很有临床价值的治疗酶。
SOD不仅在临床上大显身手,而且近年来又被广泛的应用于日用化工行业。
含有SOD的化妆护肤品,对抗衰老及去除脸面雀斑等有显著作用。
添加SOD的化妆护肤品倍受女士的青睐,其产品具有很强的竞争力。
如市场上销售的奥琪、大宝、紫罗兰、永芳等高级护肤化妆品,都因添加了SOD而成为抢手货。
随着SOD被广泛应用于护肤霜、洗面奶、香皂等领域及活性氧、疾病诊断和抗辐射等方面的研究,SOD将成为广大药厂和日用化工厂的重要原料。
目前我国大规模生产SOD 厂家屈指可数,市场需求量大,在今后一段时间内供应将趋紧,因此充分利用动物废弃物,生产SOD是大有发展前途的。
(一)原料及试剂:1、牛血或猪血:动物血液一定要保证新鲜,无污染。
sod_百度百科

接受化疗的癌症病患体内的抗氧化能力会大大地降低,万一低到某个程度,自由基就会损害细胞、黏膜、五脏六腑、脑、中枢神经等.所以癌症患者应及时补充抗氧化剂来维持好体力。日本厚生省与美国癌症中心(NCI)亦建议使用抗氧化剂来预防癌症或治疗因[氧自由基]破坏细胞所引起的病变。降低抗癌药物所引起的如呕吐,食欲不振、掉发等副作用。
术语:超氧化物歧化酶
别名:肝蛋白、奥谷蛋白
SOD(超氧化物歧化酶)是一种源于生命体的活性物质,能消除生物体在新陈代谢过程中产生的有害物质。对人体不断地补充 SOD具有抗衰老的特殊效果。超氧化物歧化酶(Superoxide Dismutase, EC1.15.1.1, SOD)是1938年Marn等人首次从牛红血球中分离得到超氧化物歧化酶开始算起,人们对SOD的研究己有七十多年的历史。1969年McCord等重新发现这种蛋白,并且发现了它们的生物活性,弄清了它催化过氧阴离子发生歧化反应的性质,所以正式将其命名为超氧化物歧化酶。
1、抗氧化
医学报告指出, 抗氧化能力的衰退期已提前至35岁左右,光靠蔬果已经不足以消除人体内外共同形成的氧化压力
②.预防慢性病及其并发症
[自由基]是科学家最近才发现导致各种慢性病与老化的罪魁祸首故说它是[万病之源],是人体健康的大敌,自由基对身体的伤害是日积月累的,尤其是糖尿病与心血管方面的疾病,林天送博士说:[照顾好您的心血管,就可以活到九十岁]。养成多多摄取抗氧化物的好习惯,保证可以让您远离慢性疾病的威胁。
(一) SOD
超氧化物岐化酶(SuperoxideDismutase),简称SOD,ECl.15.1.1,是1969年美国Dude大学I.Fridovich教授和他的研究生McCoard发现的。
超氧化物歧化酶生产工艺

超氧化物歧化酶生产工艺超氧化物歧化酶(Superoxide dismutase,SOD)是一种重要的抗氧化酶。
其主要作用是将细胞内产生的有毒超氧阴离子(O2.-)转化为较为稳定的过氧化氢(H2O2),以减少自由基的产生和细胞损伤。
因此,超氧化物歧化酶的生产工艺对于其应用和研究具有重要意义。
超氧化物歧化酶的生产可以通过微生物发酵方法获得,常用的菌株包括大肠杆菌、酵母菌等。
以下是一种常见的超氧化物歧化酶生产工艺:1. 菌种的培养:选择适宜的菌种,通常是能够高效产生超氧化物歧化酶的菌株。
将菌株接种到适合的培养基中,并进行预培养,以促进细菌生长和繁殖。
2. 发酵过程的优化:控制培养基的温度、pH值、培养基成分等条件,以提高菌株的生长速度和超氧化物歧化酶的产量。
3. 细胞收获和细胞破碎:菌液经过适当的培养时间后,进行细胞的收获和细胞破碎。
通常使用离心等方法分离出菌体,并通过超声波、高压打破等方法破碎菌体,释放出细胞内的超氧化物歧化酶。
4. 超滤和纯化:将破碎的细胞液通过超滤膜进行过滤,去除杂质和废物,保留超氧化物歧化酶。
然后通过适当的纯化工艺,如离子交换层析、凝胶过滤层析等方法,获得高纯度的超氧化物歧化酶。
5. 活性测定和质量控制:通过合适的检测方法,如方法用途和比色法等,对超氧化物歧化酶的活性进行测定。
同时进行一系列的质量控制,确保生产的超氧化物歧化酶符合规定的标准。
总结起来,超氧化物歧化酶的生产工艺主要包括菌种培养、发酵过程优化、细胞收获和破碎、超滤和纯化、活性测定和质量控制等步骤。
通过优化各个环节,可以提高超氧化物歧化酶的产量和纯度,从而满足其在抗氧化研究和应用中的需求。
不同的工艺参数和条件可以根据具体的研究目标和生产要求进行调整和优化。
植物中SOD的分离提取及性质

详细描述
首先,将植物中的SOD进行分离和纯化,然 后使用凝胶色谱法进行分子量测定。这种方 法利用分子大小不同的蛋白质在凝胶色谱柱 中的扩散速度不同,从而分离出不同大小的 蛋白质分子。最后,通过与标准分子量的比
较,可以测定出植物中SOD的分子量。
植物中SOD的等电点测定
要中SOD的等电点 。
在环保领域的应用
空气净化
SOD具有清除活性氧和自由基的功能,可以用于空气净化。将SOD添加到空气净化器或空调系统中,可以有效地 去除空气中的有害物质,保护人体健康。
水质净化
SOD同样可以用于水质净化。将SOD添加到水处理系统中,可以有效地去除水中的有害物质,提高水质。同时, SOD的抗氧化作用还能够抑制水体中有机物和重金属的氧化反应,减少水体污染。
在农业领域的应用
植物育种
SOD在植物育种中具有重要的作用。它能够提高植物 的抗逆性,使植物在不良环境下仍能正常生长。通过 转基因技术将SOD基因导入植物中,可以培育出具有 更强抗逆性的新品种。
农药与肥料
SOD在农药和肥料中也有重要的应用价值。将SOD与 其他物质结合制成的新型农药和肥料,能够更有效地 提高植物的抗逆性和产量,同时减少对环境的污染。
植物中sod的分离提取及性质
汇报人:文小库
2023-11-13
CONTENTS
• 引言 • SOD概述 • 植物中SOD的分离提取方法 • 植物中SOD的性质研究 • 植物中SOD的应用研究 • 研究展望与挑战 • 参考文献
01
引言
研究背景和意义
植物中SOD(超氧化物歧化酶)的分离提取及性质研究具有重要的理论和实践意义。
要点二
详细描述
等电聚焦电泳法是一种根据蛋白质等电点进行分离的 方法。在电场的作用下,不同等电点的蛋白质会聚焦 在不同的pH值区域,从而可以根据聚焦位置确定蛋白 质的等电点。通过这种方法,可以测定出植物中SOD 的等电点。
超氧化物歧化酶SOD的生产

②0.1mol/L盐酸: 取8.6(9)ml浓盐酸,稀释至 1000ml
③5 0毫升0.1mol/L三羟甲基氨基甲烷(Tris)溶 液 19.9_毫升0.1mol/L盐酸混匀并稀释至100 毫升。
• (保存温度: 常温密封避光保存)
• 测定步骤
1、 称取6g样品,加于现在冰箱中放置的缓冲液 60ml(样品的10倍,视情况定),在冰浴中研磨成 匀浆,四层纱布过滤,滤液经4000r/min 离心 20min,取上清液用于酶活测定。
• 2.SOD的分类 • 按其结合的金属离子可分为Fe-SOD、Mn-SOD、
CuZn-SOD三种
3.SOD的理化性质 3.1 SOD对氰化物和H2O2的敏感性 3.2 SOD的吸收光谱特性 3.3 SOD稳定性及影响因素
4.SOD的作用
1、抗氧化 2、预防慢性病及其并发症 3、抗衰老 4、抗疲劳 5、化疗副作用的消除剂 6、避免手术的二次伤害 7、化解妇女的氧化压力危机
抗氧化抗腐蚀的优良性能。以 SOD为主要成份的
产品风靡世界,引发了化妆品历史上的一场革命,
使人类永葆青春美丽梦想成真;
•
4. 用作保健食品、饮料、如SOD糖、SOD
口服液、SOD干啤等都非常畅销! 在饮料、糖果、
糕点等食品中加入SOD既可利用其抗腐蚀性延长
保质期,又可调节人体内分泌系统。
• SOD被视为生命科技中最具神奇魔力的 酶人体内的垃圾清道夫。 SOD是氧自由基
二.SOD的运用
• 1.药物类,主要集中在炎症病患者,尤其治疗类 风湿关节炎、慢性多发性关节炎、心肌梗塞、心 血管病、肿瘤患者以及放射性治疗炎症病患者;
•
2.用于生化制药,作为一种生化酶制剂,广
泛应用于临床和科研上,具有极强的抗衰老,抗
实验提取SOD

超氧化物歧化酶SOD的分离纯化技术摘要通过对绿豆种子的研磨破碎获得SOD粗酶,经过硫酸铵分级分离、透析除盐和浓缩等过程,除去粗酶液中的杂质及干扰蛋白,采用葡聚糖(Sephadex G-100)凝胶层析得到纯化的SOD酶。
跟踪提纯过程活性的分布,并评价提取过程各步骤的效率。
实验结果证实随着不断的分离提纯,总活力不断减小,比活力不断上升,总纯化倍数为1.87,活性得率为0.3768%。
一、前言超氧化物歧化酶(superoxide dsdismutase,SOD)是需氧化物中以超氧阴离子为底物的一种酶,广泛存在于各种生物中。
SOD不仅在生物体内对抗氧化、解毒起重要作用,也有延缓机体衰老、抗肿瘤及抗免疫性疾病等功能,因而受到极大关注。
SOD属于金属酶,其理化性质不仅取决于蛋白质部分,而且还取决于结合到活性部位的金属离子。
按照结合的不同金属离子,生物体中SOD有Cu、Zn-SOD、Mn-SOD和Fe—sOD三种,但近几年发现低等生物中尚存在含Ni的SOD。
在已发现的酶中,超氧化物歧化酶(SOD)是需氧生物和耐氧生物的体内清除超氧化物自由基的酶超氧自由基在体内的过多积累将可能引发脂质过氧化损伤DNA,使脱水酶失活,使线粒体中的NADH脱氢酶NADH氧化酶磷酸腺苻酶(ATPase)失活,从而易引起生物体发疾病或衰老。
自从1968年McCord与Fridovich发现SOD及其催化超氧化物自由基歧化为O2与H2O以来,SOD一直以來被认为是生物体内最重要的抗氧化酶。
根据近10年的研究报告表明,SOD具有清除超氧化物自由基,防止其对机体直接或间接的损伤;使O2成为细胞内自由基的排污漕;调节机体内O 的水平;调节机体内NO水和催化反应产物H2O2等作用。
现在在日常生产应用中,多以动物血液中提取SOD。
但是动物血液中的疾病很多,价格也比较昂贵。
从植物中提取SOD就可以相应的解决上述问题,类似绿豆芽这种植物,其成本低廉,且SOD 的含量丰富,又无污染,将其大量应用于生产有着很好的发展前景。
超氧化物歧化酶(SOD)

工艺流程
酵母泥
洗涤 灭菌 酵母菌复壮 SOD提取
•
酵母培养基 •
SOD纯化
实验过程
• 啤酒酵母的预处理 • 酵母的复壮培养 • 酵母SOD的提取
• SOD纯化
酵母培养基配方
葡萄糖8% 蛋白胨1% 酵母膏1% 蒸馏水 1000ml
121℃灭菌20min
按30%ห้องสมุดไป่ตู้种量接入 经过洗涤后的酵母
恒温摇床培养 28℃140r/min 2h
妆品等方面的应用将更加广泛。
从众多研究者的研究中我们可以得出,微生 物类群SOD含量的基本规律是:革兰氏阳性菌和革 兰氏阴性菌的SOD含量没有明显差异,放线菌和细 菌的SOD 含量没有明显的差异,真核微生物的SOD 含量一般高于原核微生物,好氧微生物的SOD 含 量显著高于厌氧微生物。
鉴于SOD在微生物中的含量的分布,
常用以下七种SOD高产菌株进行研究。
超氧化物歧化酶(Superoxide dismutase, SOD)是一种生物体防御氧化损伤的、对机体具有
显著保护作用的生物酶,它广泛分布于动物、植 物与微生物体内。由于SOD具有清除体内O2-的能 力,且能较好地抵御氧自由基和基他氧化物自由 基对细胞质膜的毒性,维持细胞正常的生理代谢, 所以其在机体保护方面起着重要作用,也因此SOD 被广泛应用于医药、食品和化妆品工业,作为抗 衰老、抗炎症、治疗自身免疫疾病的药品以及食 品、化妆品的添加剂等,被专家称为21世纪最有 前途的药用酶。
扩大培养, 得到含SOD的湿菌体
返回
每1 g酵母湿细胞 中加入9 mL异丙醇
浸泡120 min 抽滤除去溶剂
SOD粗提液
搅拌120min 离心除去菌体
加入三倍体积的50mmol/L 磷酸钾缓冲液(pH7.0)
SOD酶提取
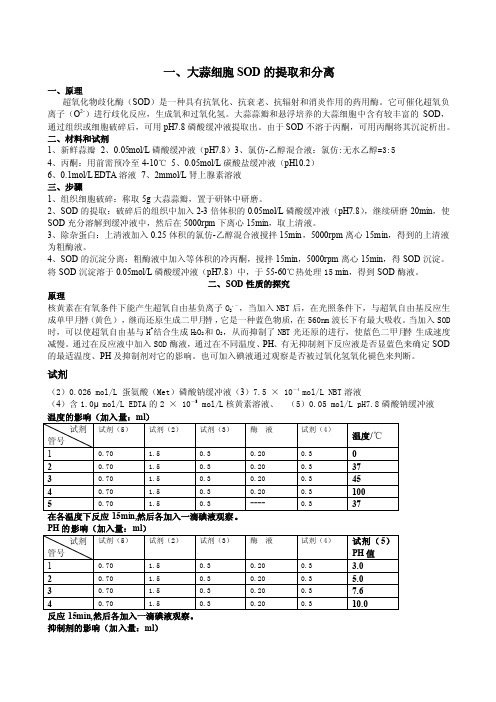
一、大蒜细胞SOD的提取和分离一、原理超氧化物歧化酶(SOD)是一种具有抗氧化、抗衰老、抗辐射和消炎作用的药用酶。
它可催化超氧负离子(O2-)进行歧化反应,生成氧和过氧化氢。
大蒜蒜瓣和悬浮培养的大蒜细胞中含有较丰富的SOD,通过组织或细胞破碎后,可用pH7.8磷酸缓冲液提取出。
由于SOD不溶于丙酮,可用丙酮将其沉淀析出。
二、材料和试剂1、新鲜蒜瓣2、0.05mol/L磷酸缓冲液(pH7.8)3、氯仿-乙醇混合液:氯仿:无水乙醇=3:54、丙酮:用前需预冷至4-10℃5、0.05mol/L碳酸盐缓冲液(pH10.2)6、0.1mol/L EDTA溶液7、2mmol/L肾上腺素溶液三、步骤1、组织细胞破碎:称取5g大蒜蒜瓣,置于研钵中研磨。
2、SOD的提取:破碎后的组织中加入2-3倍体积的0.05mol/L磷酸缓冲液(pH7.8),继续研磨20min,使SOD充分溶解到缓冲液中,然后在5000rpm下离心15min,取上清液。
3、除杂蛋白:上清液加入0.25体积的氯仿-乙醇混合液搅拌15min,5000rpm离心15min,得到的上清液为粗酶液。
4、SOD的沉淀分离:粗酶液中加入等体积的冷丙酮,搅拌15min,5000rpm离心15min,得SOD沉淀。
将SOD沉淀溶于0.05mol/L磷酸缓冲液(pH7.8)中,于55-60℃热处理15 min,得到SOD酶液。
二、SOD性质的探究原理核黄素在有氧条件下能产生超氧自由基负离子O2.-,当加入NBT后,在光照条件下,与超氧自由基反应生成单甲月替(黄色),继而还原生成二甲月替,它是一种蓝色物质,在560nm波长下有最大吸收。
当加入SOD时,可以使超氧自由基与H+结合生成H2O2和O2,从而抑制了NBT光还原的进行,使蓝色二甲月替生成速度减慢。
通过在反应液中加入SOD酶液,通过在不同温度、PH、有无抑制剂下反应液是否显蓝色来确定SOD 的最适温度、PH及抑制剂对它的影响。
超氧化物歧化酶的生产技术

超氧化物歧化酶的生产技术概述超氧化物歧化酶(superoxide dismutase,缩写为SOD)是一种广泛存在于生物体中的酶,具有重要的生理功能。
它通过将超氧阴离子(O2-)转化为氧分子(O2)和氢氧离子(H2O2),起到抗氧化和抗炎作用。
在工业应用和科学研究中,人们对SOD的生产技术进行了深入研究和开发。
本文将介绍超氧化物歧化酶的生产技术,主要包括酶源的选择、发酵条件的优化以及酶的提取和纯化过程。
酶源的选择超氧化物歧化酶广泛存在于动、植物以及微生物等生物体中。
不同生物体中的SOD具有不同的特点和催化活性,因此在生产过程中需要根据需求选择合适的酶源。
常用的酶源包括黄豆、大豆、绿豆等植物,以及人体组织中的淋巴细胞、红细胞和肝细胞等。
此外,一些微生物如大肠杆菌、酵母等也可以作为SOD的酶源。
在选择酶源时,需要考虑生产成本、酶的活性以及生物安全性等因素,综合评估选择合适的酶源。
发酵条件的优化超氧化物歧化酶的生产通常借助于发酵技术,通过培养和扩增酶源生物体,使其表达和产生更多的SOD。
为了提高酶的产量和活性,需要对发酵条件进行优化。
1.培养基选择:根据酶源的不同,选择适宜的培养基组分和配方。
常用的培养基包含碳源、氮源、矿质盐和缓冲剂等。
其中,添加适量的辅助因子如镁离子、重金属离子等可提高发酵效果。
2.发酵温度和pH值:适宜的发酵温度和pH值能够促进酶的生长和表达。
常见的发酵温度为25°C-37°C,pH值为6.0-8.0。
需要根据酶源的特性进行调节。
3.氧气供应:超氧化物歧化酶是一种依赖氧气的酶,因此需要提供足够的氧气供应。
常用的发酵方式包括摇瓶培养和槽式发酵,通过控制搅拌速率和通气速率等参数来满足氧气需求。
4.发酵时间:合理控制发酵时间有助于提高SOD的产量和活性。
通常情况下,发酵时间在24-72小时之间。
酶的提取和纯化在获得发酵液后,需要对中含有SOD的细胞或液体进行酶的提取和纯化,以提高酶的纯度和活性。
超氧化物歧化酶(SOD)的生产技术

超氧化物歧化酶(SOD)的生产技术引言超氧化物歧化酶(Superoxide Dismutase, SOD)是一种重要的酶类物质,可以将细胞内的超氧自由基转化为氢过氧化物和氧气,起到保护细胞免受氧化损伤的作用。
SOD的生产技术对于维护细胞的正常功能具有重要意义。
本文将介绍SOD的生产技术,以及常用的生产方法和工艺。
SOD的生产方法SOD的生产方法可以分为化学合成和生物合成两大类。
化学合成是通过化学反应合成SOD,这种方法简单但成本较高,并且产物纯度较低。
生物合成是利用生物体内的细胞合成SOD,这种方法具有高效、环保、产物纯度高等优点。
常用的SOD生产工艺1.发酵法:发酵法是生产SOD的常用工艺之一。
通过选用高效的SOD产生菌株,如大肠杆菌、曲霉等,将其加入到适宜的培养基中进行培养和发酵。
在培养过程中,要控制适宜的温度、pH值和培养时间等因素,以促进菌体的生长和SOD的合成。
2.超声波法:超声波法是一种物理方法,通过超声波的作用将SOD从生物源中提取出来。
这种方法操作简便,提取效率高,但需要使用专门的超声波提取设备。
3.冷冻法:冷冻法是利用冷冻技术将SOD从细胞中释放出来。
将含有SOD的细胞悬浮液经过低温冷冻处理,然后迅速解冻,细胞被破坏后,SOD从细胞中释放出来。
这种方法可用于大规模的SOD生产。
SOD生产技术的优化与创新为了提高SOD的产量和纯度,越来越多的研究人员致力于优化和创新SOD的生产技术。
以下是一些值得关注的技术和方法:1.基因工程技术:通过基因工程技术,可以将SOD的基因导入到高效表达的宿主中,从而实现大规模的SOD产生。
这种方法可以大大提高SOD的产量和纯度,并且可以对SOD进行结构与功能的改良。
2.提高发酵条件:通过调整发酵条件,如温度、pH值、培养基成分等,可以促进SOD的产生和合成。
同时,研究人员还可以通过优化发酵过程中的氧气供应、搅拌速度等参数,提高SOD的产量。
3.组合生产技术:将不同的SOD产生菌株或基因组合在一起,可以实现多种SOD的同时产生。
动物血中超氧化物歧化酶的提炼

注意: 注意:
收集完新鲜血液后, 收集完新鲜血液后,应尽快加抗凝剂 去除血红蛋白过程中, 去除血红蛋白过程中,搅拌要均匀
去血红蛋白
向溶血液中分别缓慢加入0.25倍体积 倍体积 向溶血液中分别缓慢加入 的预冷95%乙醇和 乙醇和0.15倍体积的预冷 的预冷 乙醇和 倍体积的预冷 氯仿,剧烈搅拌15min左右,静置 左右, 氯仿,剧烈搅拌 左右 静置1h, 然后4000r/min离心 离心20min,除去变性 然后 离心 , 血红蛋白沉淀,取清夜,过滤, 血红蛋白沉淀,取清夜,过滤,收集 滤液。 滤液
3、平衡 、 当全部交换剂装入柱中后, 当全部交换剂装入柱中后,用上柱起 冲液进行平衡。 始缓 冲液进行平衡。流速可维持在 4mL/15min,直至流出液的pH pH与上柱缓冲液 4mL/15min,直至流出液的pH与上柱缓冲液 完全相同。(一般要平衡8h以上或过夜。) 。(一般要平衡8h以上或过夜 完全相同。(一般要平衡8h以上或过夜。)
牛血中超氧化物歧化酶的提炼
超氧化物歧化酶
超氧化物歧化酶 (superoxide dismutase,简称
SOD )是广泛存在于生物体内的含Cu、Zn、Mn、 Fe的金属类酶。它作为生物体内重要的自由基清除 剂,可以清除体内多余的超氧阴离子,在防御生物 体氧化损伤方面起着重要作用。由于SOD作为一种 药物酶能专一消除超氧阴离子而起到保护细胞的作 用。迄今为止人们已从细菌,真菌、原生动物、藻 类、昆虫、鱼类、植物和动物等各种生物体内分离 得到SOD。目前,研究开发最多的资源还是从动物 血液、动物组织中制备提纯SOD。
• • •
• •
1.热变性 1.热变性 原材料的预处理中获得的上清液加 热到65℃ 保温10min 65℃, 10min, 热到65℃,保温10min,然后迅速冷却到室 3000r/min离心20min,弃去沉淀物, 离心20min 温,3000r/min离心20min,弃去沉淀物,收 集上清液。 集上清液。 沉淀过程保持 低温哦 2.沉淀 2.沉淀 清夜在冰浴中冷却,然后在-5℃一 清夜在冰浴中冷却,然后在-5℃一 下的操作温度下,加入1.5倍量预冷丙酮, 1.5倍量预冷丙酮 下的操作温度下,加入1.5倍量预冷丙酮, 边加边搅拌均匀,即有白色沉淀产生, 边加边搅拌均匀,即有白色沉淀产生,静置 2~3min,迅速抽滤,弃去滤液得肉色沉淀。 2~3min,迅速抽滤,弃去滤液得肉色沉淀。 沉淀物用少量蒸馏水溶解,4000r/min离心 沉淀物用少量蒸馏水溶解,4000r/min离心 20min,除去不溶物, pH7.6的 20min,除去不溶物,用pH7.6的 2.5mmol/LK2HPO4-KH2PO4缓冲液透析 缓冲液透析, 2.5mmol/LK2HPO4-KH2PO4缓冲液透析,即 得粗SOD SOD溶液 得粗SOD溶液
SOD酶生产

3.3SOD稳定性及影响因素
PH、热、蛋白酶的影响:SOD在pH5.3~ 9.6间催化性能良好,在pH4.5~pH11间能 稳定存在。pH3.6时, CuZn-SOD中95%的Zn 要脱落,在pH12.2时,SOD的构象会发生不 可逆的转变而使酶失活。 SOD对热的稳定性与溶液中离子强度有关。 当离子强度很低时,即使加热到95℃, 其活 性损失也很少其他因素:SOD活性受饮料的 色泽、成分、酸碱度、乙醇含量等多种因 素的影响,只有在无色、近中性、无乙醇 饮料中SOD活性较稳定。另外还发现有机溶 剂和Cl对SOD的活性具抑制作用
◆谢谢观看
试剂
空白管/mL
自氧化管/mL
50mmol/L的Tris-HCL
2.98
2.98
10mmol/L的HCL
0.02
0.01
50mol/L的邻苯三酚
_
0.01
SOD活性的测定
SOD的安全性
◆大量试验和临床应用表明, 无论何种给药 方式,除罕见的超敏反应外,SOD对人体无 毒性。虽然SOD是Mr在30 000以上的蛋白质, 但却未发现具有抗原性, 其原因也正在进 一步研究中。
另外还发现有机溶剂和cl对sod的活性具抑制作用它催化超氧阴离子转化为h2o2和o2的反应即催化超氧阴离子自由基o2发生歧化反从而清除o22o22hh2o2o2在生命体的自我保护系统中起着极为重要的作用在免疫系统中也有重要的功因而它能防御氧毒性增强机体抗辐射损伤能力防衰老
超氧化物歧化酶(SOD)的生产
破碎 组织 细胞
去除 杂蛋 白
SOD 的沉 淀分 离
测定 邻苯 三酚 自氧 化速 率
测定并 计算 SOD样 酶活性
实验原理
邻苯三酚在碱性条件下,能迅速自氧化, 释放出 O2-,生成带色的中间产物,中间 物的积累在滞留30~45s后,与时间成线性 关系,一般线性时间维持在4min的范围内, 中间物在420nm波长处有强烈光吸收。当有 SOD存在时,由于它能催化O2-与H+结合生 成O2和H2O2,从而阻止了中间产物的积累, 因此,通过测定光吸收即可求出SOD的酶活 性。
sod的产生

在生物学中,SOD(超氧化物歧化酶)是一种非常重要的抗氧化酶。
它的产生过程涉及到多个步骤。
首先,SOD的基因在细胞核中被转录成mRNA,这个过程需要RNA聚合酶的参与。
然后,mRNA通过核孔运输到细胞质中。
在细胞质中,mRNA需要经过一系列的修饰和剪接,才能形成成熟的mRNA。
这个过程需要多种蛋白质的参与,包括剪接体、剪接因子等。
接下来,成熟的mRNA需要被翻译成蛋白质。
这个过程需要核糖体、tRNA、氨酰-tRNA合成酶等多种蛋白质的参与。
在这个过程中,mRNA上的密码子会被翻译成对应的氨基酸序列,这些氨基酸会按照特定的顺序排列,形成SOD的蛋白质结构。
最后,SOD的蛋白质结构需要经过折叠和修饰,才能形成具有活性的SOD。
这个过程需要多种蛋白质的参与,包括分子伴侣、蛋白酶等。
总的来说,SOD的产生是一个复杂的过程,涉及到基因的转录、mRNA的修饰和剪接、蛋白质的翻译和折叠等多个步骤。
这些步骤都需要多种蛋白质的参与,任何一个步骤出现问题,都可能导致SOD的产生受到影响。
此外,SOD的产生还受到许多因素的影响,包括环境因素、遗传因素等。
例如,一些环境污染物可以导致SOD的活性降低,从而增加细胞的氧化压力;一些遗传突变可以导致SOD的基因发生改变,从而影响SOD的产生。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
超氧化物酶(SOD)的生产
SOD(超氧化物歧化酶)是一种源于生命体的活性物质,能消除生物体在新陈代谢过程中产生的有害物质。
对人体不断地补充SOD具有抗衰老的特殊效果。
超氧化物歧化酶(Superoxide Dismutase, EC1.15.1.1, SOD)是1938
年Marn等人首次从牛红血球中分离得到超氧化物歧化酶开始算起,人们对SOD 的研究己有七十多年的历史。
1969年McCord等重新发现这种蛋白,并且发现了它们的生物活性,弄清了它催化过氧阴离子发生歧化反应的性质,所以正式将其命名为超氧化物歧化酶。
它催化如下的反应:202+2H+→H2O2+O2
O2-称为超氧阴离子自由基,是生物体多种生理反应中自然生成的中间产物。
它是活性氧的一种,具有极强的氧化能力,是生物氧毒害的重要因素之一。
SOD是机体内天然存在的超氧自由基清除因子,它通过上述反应可以把有害的超氧自由基转化为过氧化氢。
尽管过氧化氢仍是对机体有害的活性氧,但体内6性极强的过氧化氢酶(CAT)和过氧化物酶(POD)会立即将其分解为完全无害
的水。
这样,三种酶便组成了一个完整的防氧链条。
一、实验目的
a.掌握有机溶剂沉淀法的原理和基本操作。
b.掌握SOD酶提取分离的一般步骤。
二、实验原理
超氧化物歧化酶(superoxide dismutase,SOD)是一种具有抗氧化、抗衰老、抗辐射和消炎作用的药用酶。
它可催化超氧负离子(O2-)进行歧化反应,生成氧和过氧化氢。
大蒜蒜瓣和悬浮培养的大蒜细胞中含有较丰富的SOD,通过组织或细胞破碎后,可用pH7.8的磷酸缓冲溶液提取出来。
由于SOD不溶于丙酮,可用丙酮将其沉淀析出。
有机溶剂沉淀的原理是有机溶剂能降低水溶液的介电常数,使蛋白质分子之间的静电引力增大。
同时,有机溶剂的亲水性比溶质分子的亲水性强,它会抢夺本来与亲水溶质结合的自由水,破坏其表面的水化膜,导致溶质分子之间的相互作用增大而发生聚集,从而沉淀析出。
三、实验器材
研钵,石英纱,烧杯(50ml),玻璃棒,pH计,冷冻离心机,离心管。
四、试剂和材料
新鲜蒜瓣,0.05mol/L磷酸缓冲溶液(pH7.8),氯仿-乙醇混合液(氯仿:无水乙醇=3:5),丙酮(用前预冷至-10℃)。
五、操作步骤 (整个操作过程在0~5℃条件下进行)
a.SOD酶的提取
称取5g大蒜蒜瓣,加入石英砂研磨破碎细胞后,加入pH7.8、0.05mol/L 的磷酸缓冲液(pH7.8)15ml,继续研磨20min,使SOD酶充分溶解到缓冲溶液中,然后6000r/min冷冻离心15min,弃沉淀,取上清液。
b.去除杂蛋白上清液中加入0.25倍体积的氯仿-乙醇混合液搅拌15分钟,6000r/min离心15min,弃去沉淀,得到的上清液即为粗酶液。
c.SOD酶的沉淀分离粗酶液中加入等体积的冷丙酮,搅拌15min,6000rpm离心15min,得到SOD酶沉淀。
冷冻干燥后即得成品。
对成品进行称量并测定酶活力。
六、提取、提纯方法:
本实验涉及一种从生物体内提取超氧化物歧化酶的工艺制备方法。
该方法的制备步骤为:将活蚯蚓洗净,湿磨,得到的蚓汁经过冷冻、在缓冲液中匀浆、搅拌,离心,弃沉淀物得清液;上述清液进行加热,冷却,过滤后滤液中加入丙酮,沉淀物用缓冲液溶解,弃沉淀物得上清液;上清液在搅拌下加入mg、Cu、Zn,然后离心,弃去沉淀,向上清液中加入硫酸铵溶液,离心收集沉淀;将上述沉淀溶解在缓冲液中,接着透析至无SO2-4,透析液最后上层析柱收集洗脱液,浓缩、冷却、干燥,即得蓝绿色的Cu、ZnSOD。
七、检验与纯度分析:
在一般情况下,SOD酶活性测定只能应用间接活性测定法。
本实验采用邻苯三酚自氧化方法。
邻苯三酚在碱性条件下,能迅速自氧化,释放出O2 -,生成带色的中间产物,反应开始后反应液先变成黄棕色,几分钟后转绿,几小时后又转变成黄色,这是因为生成的中间物不断氧化的结果。
这里测定的是邻苯三酚自氧化过程中的初始阶段,中间物的积累在滞留30~45s后,与时间成线性关系,一般线性时间维持在4min的范围内,中间物在420nm波长出有强烈光吸收。
当有SOD存在时,由于它能催化O2 -与H+结合生成O2和H2O2,从而阻止了中间产物的积累,因此,通过计算即可求出SOD的酶活性。
酶活力单位定义:在25℃恒温条件下,每毫升反应液中,每分钟抑制邻苯酚自氧化率达50%的酶量定义为1个酶活力单位。
1、试剂
(1)pH8.2、50mmol/L Tris-HCl
称取Tris 0.61g,EDTA-2Na 0.037g,用双蒸水溶解至80mL左右,用HCl调节pH =8.20(用pH计校正),最后定容至100mL。
(2)10mmol/L HCl
(3)50 mmol/L邻苯三酚
称取邻苯三酚0.063g,用10mmol/L HCl溶液溶解,定容至10mL,避光保存。
(4)SOD样液
2、器材
(1)恒温水浴槽
(2)紫外分光光度计
(3)试管、刻度吸管、微量注射器
[方法和步骤]
1、邻苯三酚自氧化速率的测定
取两支试管按下表加入25℃预热过的缓冲液,然后加入预热过的邻苯三酚(空白管用10mmol/L HCl代替邻苯三酚),迅速摇匀,立即倾入1cm比色杯中,在325nm波长处测定光吸收值,每隔30s读数一次,测定4min内每分钟光吸收值的变化。
要求自氧化速率控制在每分钟的光吸收值为0.07(可增减邻苯三酚的加入量,以控制光吸收值)。
2、SOD样液的活性测定
样品管取代自氧化管。
样品管测定时先加入预热的待测酶液,再加邻苯三酚。
其余步骤同邻苯三酚自氧化速率的测定。
