思考题胶体与溶液和浊液比25页PPT
专题二:分散系 胶体 教学PPT课件

Ⅱ.不能用玻璃搅拌,防止生成Fe(OH)3沉淀。
几种分散系的比较
分散系 溶液
分散质
离子或 小分子
微粒 直径
<1nm
主要特征
均一 稳定 透明
静置
分散质能 否透过
无明显 滤纸 半透膜 变化 能 能
分离
蒸发 结晶 蒸馏 萃取
悬浊液
不均一
固体小颗粒
>100nm 不稳定
乳浊液 液体小液滴
不透明
沉淀 不能 不能 过滤
胶体微粒
半透膜
阴阳离子
5、胶体的制备
如:Fe(OH)3胶体的制备
向沸水中逐滴加入 FeCl3饱和溶液 ,继续煮沸
Hale Waihona Puke 至液体呈 红褐色 ,停止加热,即制得Fe(OH)3
胶体,化学方程式为
。
FeCl3 + 3H2O 煮沸
应注意的问题:
Fe(OH)3(胶体) + 3HCl 红褐色
Ⅰ.不能过度加热,以免出现Fe(OH)3胶体凝聚。
分散系 胶体
1.几个概念
分 一、分散系 2.分散系的分类
散
3.溶液、胶体、浊液的比较
系
及
1.胶体的定义
胶
2.胶体的分类
体 二、胶体 3.胶体的重要性质
4.胶体的制备
5.胶体的应用
一、分散系
1.几个概念: 分散系:
——把一种(或几种)物质的微粒分散 于另一种物质里形成的混合物。 分散质:
——分散系中分散成微粒的物质。
牛
汤
奶
碘
酒
有
泡
色
沫
玻
塑
璃
珍珠 料
2.分散系的分类:
大学化学1溶液和胶体

14
溶液的通性 — 溶液的沸点上升的原因
3.溶液的沸点上升(boiling point)
液体的沸点 ( boiling point ) 当P 液 = P 外,液体沸腾时的温度。
正常沸点:当P外=P标时的液体的沸点。
溶液的沸点升高
是溶液蒸气压下降的直接结果
2024/9/30
15
溶液的通性 — 溶液的沸点上升的数值
p溶液= p*-⊿p = 2.338kPa - 0.021kPa = 2.317kPa
溶液的通性 — 凝固点下降
2.液体的凝固点降低(freezing point)
凝固点:某物质的液相蒸汽压与固相蒸汽压相等时 的温度。用Tf表示 或在一定外压下,物质固、液两相平衡共存时的温 度。
如 :H2O(l) 273K,101.3kPa H2O(s)
该温度下的饱和蒸汽压,简称蒸汽压。
加入一种难挥发的非电解质
束缚一部分高能水分子
P↓
占据了一部分水的表面
2024/9/30
8
溶液的通性 — Raoult定律
在一定温度下,难挥发性非电解质稀溶液的蒸气压
(P)等于纯溶剂的蒸气压(PA*)乘以溶液中溶剂的 摩尔分数(xA )。
p
p* A
xA
xA
nA nA nB
1.蒸气压下降 2.凝固点降低 3.沸点升高 4.渗透压力
p
p* A
xB
ΔTf=kf • bB
ΔTb =kb• bB
= CBRT
的数值与溶液中质点 的个数成正比
2024/9/30
23
第 4 章 酸碱解离平衡和沉淀溶解平衡
4.1 电解质溶液 4.2 酸碱理论 4.3 弱电解质的解离平衡 4.4 缓冲溶液 4.5 沉淀溶解平衡
胶体、浊液、溶液的组成、性质的比较

2.溶液、胶体和 浊液这三种 分散系的根本区别是 ( B )
A.是否为大量分子或离子的集合体 B.分散质微粒直径的大小 C.能否透过滤纸 D.是否均一、稳定、透明
能力拓展:
1、(2006全国)下列叙述正确的是( C )
A 直径介于1~100nm之间的微粒称为胶体 B 电泳现象可证明胶体属于电解质溶液 C 利用丁达尔效应可以区分溶液与胶体 D 胶体粒子很小,可以透过半透膜
10化本2 陈林 2010364249
胶体、浊液、溶液的组成、性质的比较
1、按分散质粒子大小
溶液
胶体
浊液
1nm
2、微粒组成
分散系 溶液
微粒 小分子或离
组成
子
100nm
胶体
大分子或分子 集合体
浊液许多分子的集 合体实验示意图3、能否透过滤纸、透过半透膜
浊液 胶体 溶液
滤纸
半透膜
分散系
能否透过滤 纸(100nm)
少量分子的集合体 大量分子的 或大分子化合物 集合体
氯化钠溶液
氢氧化铁胶体
泥水
能
能
不能
能
不能
不能
胶体、浊液、溶液的组成、性质的比较练习
1.根据中央电视台报道,近年来,我国的一些沿江或 沿海城市多次出现大雾天气,致使高速公路关闭,航
班停飞,雾属于下列分散系中的( D )
A.溶液
B.悬浊液
C.乳浊液
能否透过半 透膜(1nm)
溶液
能 能
胶体
能 不能
浊液
不能 不能
观察以下三种液体有何区别?
分散系
外观 稳定性
溶液
均匀、透明 最稳定
胶体
均匀、透明 介稳体系
胶体的性质PPT课件

分散剂 气 气 气 液 液 液 固 固 固
实例 空气
云、雾 烟、灰尘
泡沫 牛奶、酒精的水溶液
糖水、油漆 泡沫塑料 珍珠(包藏着水的碳酸钙)
有色玻璃、合金
第4页/共28页
(分散剂是液态的分散系) 分散系
依据分散质粒子的大小
溶液(<1nm) 分散 单个小分子 质粒 或离子 子
溶液
分散质 粒子直径
胶体(1~100nm)
① 丁达尔现象;②布朗运动; ③电泳; ④加入电解质发生凝聚;⑤ 渗析;⑥水溶胶是稳定的分散系.
A.①③④
B.②③④
C.③④⑤
D.③④⑥
8、下列有关胶体的说法正确的是( A ) A.有丁达尔现象的透明液体一定是胶体 B.胶体分散系在电场中一定有电泳现象 C.因为Fe(OH)3胶体带正电,所以在电场作用下有电泳现象 D.不能穿过半透膜的微粒一定是胶体微粒
(
A.溶液 B.悬浊液 ACC.胶体
2.下列分散系属于胶体的是(
)
D. 乳浊液
A.豆浆 B.食盐水 C.牛奶 D.碘酒
3.根据中央电视台报道,近年来,我国的一些沿江或沿海 城市多次出现大D雾天气,致使高速公路关闭,航班停飞,雾
属于下列分散系中的(
)
A.溶液 B. 悬浊液 C.乳浊B 液 D. 胶体
4.区别溶液和胶体的最简单的方法是(
第20页/共28页
第21页/共28页
胶体具有介稳性的主要原因:
布朗运动、同种胶粒带同种电荷而互相排斥。
(4)胶体的聚沉
a.胶体的聚沉:其原理是中和胶粒的电荷或
增加胶粒的结合机会以使胶粒结合在一起形成 大颗粒而沉淀。
思考与交流
使胶体聚沉的方法有哪些?并与周围的同学交流。
高中化学 第二章 物质变化及其分类 重难点2 溶液、胶体和浊液三种分散系的比较(含解析)新人教版必修1
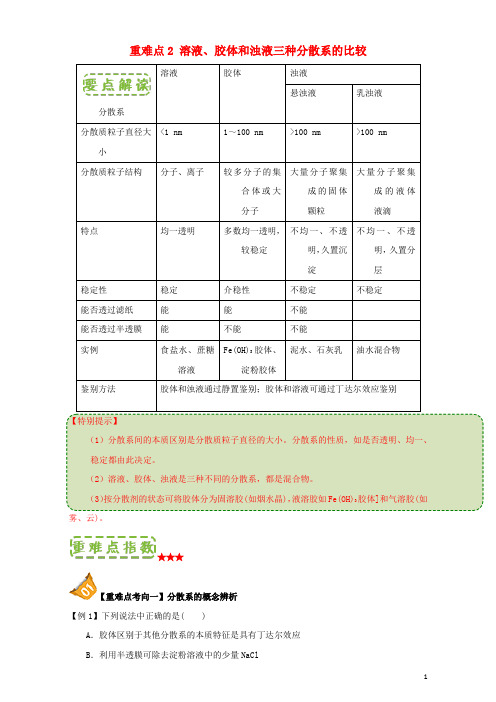
重难点2 溶液、胶体和浊液三种分散系的比较分散系溶液胶体浊液悬浊液乳浊液分散质粒子直径大小<1 nm 1~100 nm >100 nm >100 nm分散质粒子结构分子、离子较多分子的集合体或大分子大量分子聚集成的固体颗粒大量分子聚集成的液体液滴特点均一透明多数均一透明,较稳定不均一、不透明,久置沉淀不均一、不透明,久置分层稳定性稳定介稳性不稳定不稳定能否透过滤纸能能不能能否透过半透膜能不能不能实例食盐水、蔗糖溶液Fe(OH)3胶体、淀粉胶体泥水、石灰乳油水混合物鉴别方法胶体和浊液通过静置鉴别;胶体和溶液可通过丁达尔效应鉴别【特别提示】(1)分散系间的本质区别是分散质粒子直径的大小。
分散系的性质,如是否透明、均一、稳定都由此决定。
(2)溶液、胶体、浊液是三种不同的分散系,都是混合物。
(3)按分散剂的状态可将胶体分为固溶胶(如烟水晶),液溶胶如Fe(OH)3胶体]和气溶胶(如雾、云)。
★★★【重难点考向一】分散系的概念辨析【例1】下列说法中正确的是( )A.胶体区别于其他分散系的本质特征是具有丁达尔效应B.利用半透膜可除去淀粉溶液中的少量NaClC.溶液是电中性的,胶体是带电的D.纳米材料粒子直径一般在10-9~10-7 m之间,因此纳米材料属于胶体【答案】B【解析】胶体与其他分散系的本质区别是分散质粒子的直径大小,丁达尔效应是胶体的一种性质,A项错误;半透膜能允许直径在1 nm以下的小分子或离子透过,1 nm以上的胶体粒子不透过,因此可以用半透膜除去淀粉溶液中的NaCl,B项正确;胶体中的胶粒带正电荷,但整个胶体不带电,呈电中性,C项错误;胶体是分散系,属于混合物,直径在1~100 nm 之间的纳米材料不一定是分散系,若是纯净物,则不属于胶体,D项错误。
【重难点点睛】(1)胶体是分散系,由分散质和分散剂组成,属混合物。
(2)胶体呈电中性,胶体微粒一般带同种电荷,有的胶体微粒如淀粉胶体微粒不带电荷。
分散系及胶体PPT

实例 空气 云、雾 烟灰尘 泡沫 牛奶、酒精的水溶液 糖水、油漆 泡沫塑料 珍珠(包藏着水的碳酸钙) 有色玻璃、合金
(2)按照分散质粒子的大小来分
• 分散系 •溶液 •胶体 •浊液
• 二、胶体
• (1)本质特征:分散质粒子的直径在
1~100nm之间.
• (2)丁达尔效应:区分胶体与溶液的一种物
理方法.
能
不能
是否有丁达尔
否
效应
实例
饱和NaCl溶 液
是
豆浆
否
泥浆水
Q:如果空气中没有气溶胶,我们的 环境将会是什么样?
• 光照下无
丁达尔效应
空间变得一团 漆黑
人类难以生存
随堂检测
• 1.用特殊方法把固体物质加工到纳米级
(1nm~100nm)的超细粉末粒子,然后制得纳米材 料.下列分散系中的分散质粒子的大小和这种纳 米粒子大小具有相同的数量级的是( )
• A. 溶液 B.悬浊液 C.胶体 D. 乳浊液 • 2.下列分散系属于胶体的是( ) • A.淀粉溶液 B.食盐水 C.牛奶 D.碘酒
• 3.根据中央电视台报道,近年来,我国的一些
沿江或沿海城市多次出现大雾天气,致使高速公 路关闭,航班停飞,雾属于下列分散系中的( )
• A. 溶液 B. 悬浊液 C.乳浊液 D. 胶体 • 4.区别溶液和胶体的最简单的方法是( ) • A. 观察外观 B. 丁达尔效应 C. 加热 • 5.胶体的最本质的特征是( ) • A. 丁达尔效应 B. 可以通过滤纸 • C. 分散质粒子的直径在1nm~100nm之间
一、分散系及其分类
• 1 、分散系:把一种(或多种)物质分散在另
一种(或多种)物质中所得到的体系.
胶体和溶液的区别!

胶体和溶液的区别!分散系一种或几种物质分散在另一种(或多种)物质中所形成的体系称为分散系,比如我说氯化钠溶液,就是氯化钠分散在水里,我们称氯化钠为分散质【被分散的物质】称水为分散剂【分散氯化钠的物质】整个分散系的性质会随着分散质粒子大小的改变而改变,我们现阶段了解的分散系有三种:浊液,胶体,溶液。
我们称体系内分散质粒子直径<>分散质粒子>100nm 的分散系我们则称之为浊液我们区分胶体和溶液的最简易的办法就是利用丁达尔效应。
用一束光透过胶体,我们可以从入射光的垂直方向看到一条光亮的“通路”,这种现象就是丁达尔现象,我们也称之为丁达尔效应。
胶体可以是气体也可以是固体也可以是液体,只要分散质粒子直径达到1nm~100nm我们都可以称它是胶体。
根据状态的不同,有气溶胶,固溶胶,液溶胶。
下图则是利用丁达尔效应区别溶液和胶体。
【蓝色为硫酸铜溶液,红褐色为氢氧化铁胶体】科学家通过超显微镜观察到,胶体粒子在不停的做无规则运动。
我们将它称之为布朗运动,这也是胶体的性质之一。
胶体的两种性质电泳现象:对于不同的胶粒,它表面的组成情况不一样,有的胶粒带正电荷,有的胶粒带负电荷。
如果在胶体中通入直流电,他们会向阳极\阴极移动。
但是胶体是呈电中性的。
氢氧化铁胶体本身不带电,但是由于它要吸附溶液中的H+,所以带正电。
向负极移动。
如下图。
聚沉作用:带电荷的胶体粒子可以通过加入电解质溶液,加入带相反电荷的胶体而发生聚沉。
如果是不带电荷的胶体粒子则是通过加热而发生聚沉。
发生聚沉作用也就是胶体会从均一的状态变成类似于沉淀的凝胶。
这也是制备氢氧化铁胶体不可以长时间加热的缘故。
喜欢本篇文章,请随手点赞,欢迎分享到朋友圈文章转自网络,因无法查询出处无法标注来源,如有侵权,请联系管理员删除。
胶体ppt课件

选择题
3. 关于胶体和溶液的区别,下列叙述正确
的是( D )
A. 溶液呈电中性,胶体带电荷 B. 溶液中溶质粒子一定不带电,胶体中分
散质粒子带有电荷 C. 通电后,溶液中溶质粒子分别向两极移
动,胶体中分散质粒子不移动 D. 溶液中通入一束光线没有特殊现象,胶
体中通入一束光线出现明显的“光路”
选择题
丁达尔效应是区别溶液和胶体的 一种常见的物理方法
分别过滤氢氧化铁胶体和泥水
Fe(OH)3胶体
泥水
现象 结论
滤纸上没有不溶物 滤纸有不溶物,
滤液为红褐色
滤液澄清
胶体的分散质能通过滤纸孔隙,而浊 液则不能,说明浊液的分散质的粒子 比胶体的大
胶体的提纯:渗析
应用:血液透析
胶体的性质
分散系 溶液 > 胶体 > 浊液
中有着广泛的用途,下列现象要破坏介稳性
的是( D )
A.生产涂料
B. 配置墨水
C. 明矾净水
D. 用卤水点豆腐
此课件下载可自行编辑修改,供参考! 感谢您的支持,我们努力做得更好!
外观
溶液
<1nm 均一透明
胶体
浊液
1~100nm >100nm 均一 不均一不透明
稳定性
稳定
介稳性
不稳定
能否透过滤纸
能
能
不能
能否透过半透膜
能
不能
不能
鉴别 实例
无丁达尔效应 丁达尔效应 静置分层
氯化钠溶液
氢氧化铁胶体 淀粉胶体
石灰乳 油水
小结
❖分散质的概念、分类 ❖溶液、胶体、浊液 ❖胶体的性质
丁达尔效应 电泳 聚沉 ❖胶体的应用
外观
