卤素复习公开课共17页文档
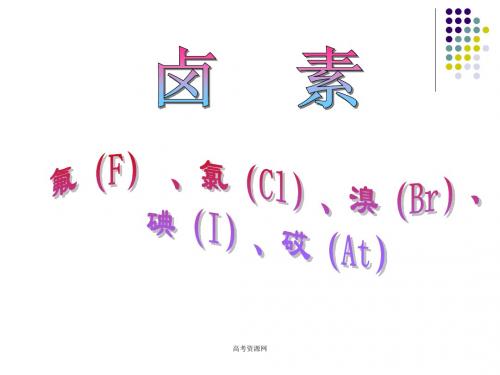
高三化学第二轮专题复习:《卤素》课件
1、检验氯化氢气体中是否有氯气的
方法是( D )
A. 用干燥的蓝色石蕊试纸 B. 用干燥的有色布条 C. 将气体通过硝酸银溶液 D. 用湿润的淀粉碘化钾试纸
高考资源网
2、 盛放溴的试剂瓶中要加入一定量
高考资源网
化学式 色、态
F2 Cl2 Br2 I2
淡黄绿 黄绿色 深红棕 紫黑色
密度熔沸点 随着分子量增大,熔沸点升高,密度增大
与H2 反应
阴暗处化 合爆炸
光照或 点燃爆炸
高温缓 慢化合
持续加热 缓慢化合 HI不稳定
与水 反应
迅速反应 放出O2
与水反应 生成HCl 和HClO
与水反应 与水只起 较氯弱 微弱反应
装置
选气 择体 吸的 收毒 剂性
高考资源网
问题5、请体选:择O2合、适Cl的2、气C体O2发、生H装2、置N制H3备、C下2H列4气。
A
B
C
高考资源网
MnO2
要制得干燥无氯化氢气体的氯气,有同学用了
上图的装置,你认为该装置有什么错误?还需
要哪些改动?写出各仪器中发生的化学反应
方程式.
高考资源网
浓盐酸 MnO2
高考资源网
置换 反应
排在前面的卤素能把排在后面的 卤素从它们的卤化物中置换出来
高考资源网
知识网络系统
H2SO4SO2+H2O CuCl2
CH4 CH3Cl
S H2S
Br2 KBr
PCl3,PCl5
电 Cu 解点
C2H4 ClCH2-CH2Cl
燃
Cl2
C6H6
化学课件《卤素复习》优秀ppt 人教课标版

《卤素》复习教案(三)_模板

《卤素》复习教案(三)_模板一、卤族元素(一)卤素的原子结构和单质的物理性质随卤素核电荷数增加,电子层数依次递增,原子半径渐增大,其原子结构的递变而使卤素单质的物理性质呈规律性变化.从F2 I21、颜色渐加深,状态从气液固,密度从小大,熔沸点由低高(分子晶体)2、单质的溶解性——除氟外(与水剧烈反应)在水中溶解度都较小,且由大小,都易溶于有机溶剂,下表列出Cl2、Br2、I2在不同溶剂中的颜色.水CCl4汽油(苯)Cl2黄绿色黄绿色黄绿色Br2橙色橙红色橙红色I2棕黄色紫色紫红色(二)化学性质由于最外层均为7个电子,极易得一个电子,因此卤素都是强氧化剂,在自然界均只以化合态存在.但随着电子层数递增,原子半径渐增大,核对外层电子的引力渐减弱,得电子能力渐减弱,其氧化性逐渐减弱,主要表现:1、都能与金属反应①F2和所有金属都能反应.②Cl2和绝大多数金属反应.③Br2和较活泼金属反应.④I2只和活泼金属反应.2、都能与H2、P等非金属反应.①F2和H2在暗处即爆炸(F2是非金属性最强的元素)②Cl2和H2需光照爆炸③Br2和H2需加热且缓慢化合(不爆炸)[1] [2] [3] [4] 下一页针对性测试题(三)1.下列燃料中,不属于化石燃料的是( )。
A.煤B.石油C.天然气D.水煤气2.1克氢气燃烧生成液态水放出142.9 kJ热,表示该反应的热化学方程式正确的是( )。
A.2H2(g) + O2(g) = 2H2O(l);△H =-142.9 kJB.H2(g) + 1/2O2(g) = H2O(l);△H =-285.8 kJC.2H2 + O2 = 2H2O;△H =-571.6 kJD.H2(g) + 1/2O2(g) = H2O(g);△H = -285.8kJ3.已知下列两个热化学方程式2H2(g) + O2(g) = 2H2O(l);△H =-571.6kJC3H8(g) +5O2(g) = 3CO2(g) + 4H2O(l);△H =-2220.0kJ实验测得氢气和丙烷的混和气体共5mol完全燃烧时放热3847kJ,则混和气体中氢气与丙烷的体积比是( )。
卤素ppt优秀课件(2024)

了解卤素在周期表中的位置及其性质变化规律。
2024/1/26
27
实验目的和原理
实验原理
卤素单质具有相似的化学性质,如与金属反应生成卤化 物、与非金属反应生成卤化氢等。
卤素位于元素周期表的第ⅦA族,包括氟(F)、氯(Cl )、溴(Br)、碘(I)等元素。
随着原子序数的增加,卤素单质的颜色、密度、熔沸点 等物理性质呈现规律性的变化。
2024/1/26
8
氯气
物理性质
氯气是一种黄绿色、有刺激性气 味的气体,密度比空气大,可溶
于水。
2024/1/26
化学性质
氯气化学性质活泼,可以与多种元 素和化合物发生反应。
用途
氯气是一种重要的化工原料,用于 制造氯化物、漂白剂、消毒剂、农 药等。此外,氯气还用于自来水的 消毒和游泳池水的处理。
9
2024/1/26
34
THANKS
感谢您的观看
2024/1/26
35
对人体健康的影响:长期摄入过量溴和碘可能导致甲状 腺疾病等健康问题。
2024/1/26
工业排放:如石油化工、制药等工业生产过程中产生的 含溴和碘的废气、废水。
溴和碘污染危害
对生态环境的影响:溴和碘对植物的生长具有抑制作用 ,对水生生物也有毒性作用。
22
治理措施和政策建议
2024/1/26
工业污染治理
生活垃圾焚烧:垃圾焚烧过程中产生 的氟化物。
2024/1/26
氟污染危害
对人体健康的影响:长期摄入过量氟 化物可能导致氟斑牙、氟骨症等疾病 。
对生态环境的影响:氟化物对植物的 生长具有抑制作用,对水生生物也有 毒性作用。
20
氯污染来源及危害
高三一轮复习卤素PPT课件

2NaCl(熔化 )==== 2Na+Cl2↑
△
2NaCl+3H2SO4+MnO2=2NaHSO4+MnSO4+Cl2 ↑ +H2O 第16页/共59页
2、实验室制备氯气、净化、收集、尾气处理装置
思考1:制备氯气的装置还可以制备什么气体? HCl
思考2:还可以采取什么方法收集氯气? 排饱和食盐水 思考3:如何验满?湿润淀粉碘化钾试纸或蓝色石蕊试纸
NaCl
第27页/共59页
第28页/共59页
两大关注内容
卤素性质似、变、特 卤离子的检验
第29页/共59页
一.卤素单质
色味态 F2
Cl2
Br2
I2
密度
熔沸点 物 溶解性 性 (1)在水中
颜色
(2)有机溶剂中
颜色
第30页/共59页
下表列出Br2、I2在不同溶剂中的颜色
水
CCl4
苯
Br2 黄 橙 橙 橙红 橙
第26页/共59页
七、知识体系
H2SO4SO2+H2O CuCl2 S H2S 电 Cu
CH4光 CHCl3 C2H4 ClCH2-CH2Cl
Br2 KBr
PCl3,PCl5
解点
燃
Cl2
C6H6
H2点燃或光照
MnO2△
Fe
HCl
Cl Cl2+Ag
光
Ca(ClO)2
H2O
照
AgCl
O2 光照 HClO
练习七:在含有FeBr2 和FeI2的混合 溶液中通入过量氯气,然后把这些溶
液蒸干,并将残渣灼烧,最后留下来
的固体是( D )
卤素复习公开课

PCl3+Cl2 == PCl5
点燃
(3)与水的反应 方程式为:
Cl2+H2O=HCl+HClO
新制氯水成分 分子: Cl2、H2O、HClO(为什么没有HCl分子?) 离子: H+、Cl-、ClO性质: 强氧化性、酸性(多种漂白剂原理比较)
久置氯水成分 分子: H2O 离子: H+、 Cl 性质: 酸性
课堂反馈:
1 .下列关于氯气的描述中,正确的是 ( D ) A.Cl2以液态形式存在时可称作氯水或液氯 B.红热的铁丝在氯气中燃烧,生成FeCl2 C.有氯气参加的化学反应必须在溶液中进行 D.钠在氯气中燃烧生成白色固体NaCl
2 .下列物质中,属于纯净物的是( BC ) A.氯水 B.氯化氢 C.液氯 D.漂粉精 3 .将某元素的单质0.1mol与Cl2充分反应后,生成物 的质量比原单质的质量增加了7.1g,这种元素可能是 ( AB ) A.Cu B.Zn C.Na D.Al
三、氯气的化学性质
2Na+Cl2 == 2NaCl 2Fe+3Cl2 == 2FeCl3 Cu+Cl2 == CuCl2 (2)与非金属反应,写出与H2、P反应的化学方程式 H2+Cl2 == 2HCl 2P+3Cl2 == 2PCl3
点燃 点燃 点燃 点燃 点燃
(1)与金属反应,写出与Na、Fe、Cu反应的化学方程式。
2.下列关于卤族元素的说法中,不正确的是(
D
)
A.单质的熔点和沸点随核电荷数的增加逐渐升高
B.单质的颜色随核电荷数的增加逐渐加深 C.单质的氧化性随核电荷数的增加逐渐减弱 D.氢化物的稳定性随核电荷数的增加逐渐增强
3.下列氯化物中,不能直接利用金属与单质的反应得 到的是( D ) A.FeCl3 B.CuCl2 C.NaCl D.FeCl2 4 .下列关于卤族元素(从Cl→I)性质递变的叙述, 正确的是( C ) (1)单质的氧化性增强; (2)单质的颜色加深; (3)气态氢化物稳定性增强; (4)单质的沸点升高 ; (5)离子的半径增大。 A. (1)(2)(3) B.(2)(3)(4) C.(2)(4)(5) D.(1)(3)(5) F ,原子半径 5.在卤族元素中,氧化性最强的是______ F 。在卤化氢中,最稳定的是______ 最小的是______ HF 。
卤素(复习)正式版

第三节 氧化还原反应(一)
一.知识要点: 1.氧化还原反应的实质是_电__子__转__移___.表观现象是_化__合_价__升__降_____.
通常用_化__合_价__的变化 来作为判断氧化还原反应的依据.
2.以化合价升降与电子得失的关系来理解有关概念:
+2e Zn+2HCl=ZnCl2+H2
a.尾气(Cl2)处理 NaOH + Cl2==NaCl+H2O b.制取漂白粉 Ca(OH)2 + 2Cl2==CaCl2+Ca(ClO)2+H2O
版权所有:深圳华人教育有限公司
3、氯气的实验室制法
(1)原浓理盐酸HC的l 代+ 氧替化品剂为-:-_-浓_C_lH_2(_2氧_S_O化_4_.剂N__a:_MC_ln_O_ 2
5.有关物质的量的计算
版权所有:深圳华人教育有限公司
第三节 氧化还原反应(二)
一.知识要点
1.氧化还原方程式的配平
(1)方法: (2)原则: (3)遵循:
化合价升降法 化合价升高和降低总数相等 质量守恒定律,电荷守恒
2.氧化还原反应的应用
(1)定性判断: a.概念的理解,b.排列顺序(氧化性,还原性),
Cl2<--------HCl---------->H2 (3)Cl-的检验:(AgNO3+HNO3)
(三) HCl 的实验室制法. 可溶性氯化物+浓H2SO4(或H3PO4)---------->HCl
(1)此原理利用了浓H2SO4及H3PO4的__________性.据此原理, 能否制取 HBr.HI?为什么?
(1)与氢气反应渐难 表现为 (2)与变价金属 (金属的化合价) 版权所有:深圳华人教育有限公司
化学:《卤素》复习课件

5
6.下图中的每一方格表示有关的一种反应物或生成物, 其中粗框表示初始反应物(反应时加入或生成的水,以 及生成沉淀J时的其它产物均已略去)。
A
反应
①D
E
B
饱和
食盐 水
F
加入D
BI
加入B
沉
淀 H CJ
G
2024/12/3
C
6
填写下列空白: ①物质B是_____,F是______,J是_______; ②反应①的离子方程式是 ____________________________。
工业:
2
NaCl
+2
电解
H2O ==2
NaOH
+
Cl2↑+H2 ↑
2Cl
--+
+2
H2O
电解
==2
OH
--
+
Cl2↑+H2
↑
2.Cl2与碱: Cl2+2OH-=ClO-+ Cl- +H2O
2Cl2+2Ca(OH)2==Ca(ClO)2+CaCl2+2H2O
漂白粉失效原理:
Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO
卤素复习
寻甸民族中学 高存定
2024/12/3
1Leabharlann 知 识 网 络 系 统 CH4光 CHCl3
H2SO4SO2+H2O CuCl2
I2 NaI
KBr
Br2
电 Cu 解点
燃
C2H4
Fe C6H6
FeCl3
ClCH2-CH2Cl
Cl
FeCl2
Cl P
PCl3,PCl5
HCl H2点燃或光照
