生物化学实验-SDS—聚丙烯酰胺凝胶电泳测定蛋白质的分子量
SDS-聚丙烯酰胺凝胶电泳(PAGE)测定蛋白质分子量

(4)聚丙烯胺凝胶的生成:
四、实验步骤:
1、贮液的配制:
2、凝胶的制备: 2.1 胶板的制备: 2.2 分离胶的制备: 2.3 浓缩胶的制备:
3、蛋白样品的制备:
4、装槽、点样: 5、电泳: 6、剥胶、染色、脱色:
2.1 胶板的制备:
3、植物组织蛋白质提取:
称取大豆叶片1g放在研钵中用液氮研磨,加
第二、不连续系统中的三种物理效应:
①电荷效应:
②分子筛效应: ③浓缩效应:
三、实验材料、仪器和试剂:
1、实验材料:黄瓜叶片(芽黄叶和正常叶)
2、仪器、器皿:
(1)垂直板电泳装置
(电泳槽,玻璃板,胶条,电泳梳子,制胶架等); (2)稳流稳压电泳仪; (4)电子天平; (6)瓷盘、微量进样器; (3)高速冷冻离心机; (5)电冰箱;
②光聚合:
催化剂是核黄素(VB2 ),在痕量氧存在下,核黄素光
解形成无色基,无色基再被氧氧化成自由基,激活单体发 生聚合。光聚合形成的凝胶孔径较大,且不稳定,适于制 备大孔径的浓缩胶。
5)聚丙烯酰胺凝胶结构上的特点:
① 聚丙烯酰胺的基本结构为丙烯酰胺单体构成的长 链,链与链之间通过甲叉桥联结在一起;
⑧支持物筛孔大小:
孔径小,电泳速度慢,反之则快。
2、SDS-聚丙烯酰胺凝胶电泳(SDSPAGE)
SDS-聚丙烯酰胺凝胶电泳测定蛋白质分子量

精选2021版课件
31
5.“SDS — 聚丙稀酰胺凝胶电 泳法测定蛋白质分子量”一实验的开 设达到了与国内同类院校相当的较高 水平。
对本科生的实验教学、本科生的 论文设计、研究生的高级生化实验等 方面都充实了内容。
精选2021版课件
32
精选2021版课件
8
(二)特点:
SDS-聚丙烯酰胺凝胶电泳,是在 聚丙烯酰胺凝胶系统中引进SDS(十二 烷基磺酸钠)。
精选2021版课件
9
蛋白质在一定浓度的含有强还原剂 的SDS溶液中,与SDS分子按比例结合, 形成带负电荷的SDS-蛋白质复合物。
蛋白质丧失了原有的电荷状态形成 仅保持原有分子大小为特征的负离子团 块,降低或消除了各种蛋白质分子之间 天然的电荷差异,因此在进行电泳时,
电泳分类:移动界面电泳、区带电泳等。
区带电泳 是在半固相或胶状介质上加一个点或一薄 层样品溶液,然后加电场,分子在支持介质上或支 持介质中迁移。
精选2021版课件
5
区带电泳使用不同的支持介质,有
滤纸、纤维素粉、聚氯乙烯树脂、淀 粉凝胶、琼脂凝胶、醋酸纤维素膜, 现在则多用聚丙烯酰胺(PAGE)和 琼脂糖凝胶。
球蛋白(去年完成的基金项目)
(三)纯化免疫球蛋白G DEAE-离子交换纤维素法纯化免疫球蛋白G子量( 连续四个单项实验)。
精选2021版课件
18
(1)制胶(简单叙述)(双层胶,摸索胶浓度)
A.将玻璃板用蒸馏水洗净晾干, 准备2个干 净的锥形瓶。把玻璃板在灌胶支架上固定好。
开封后溶于200µl蒸馏水,置-20℃保存,使用前室温融化,沸水浴中加热3-5分钟后上样。
。 样品1:称3mg样品1,加2 ml蒸馏水溶解
SDS-聚丙烯酰胺凝胶电泳PAGE测定蛋白质分子量

02 实验材料
所需的试剂和溶液
丙烯酰胺(AA):用于制备凝胶,是聚合反应 的单体。
甲叉双丙烯酰胺(MBA):交联剂,增加凝胶 的交联度。
N,N,N',N'-四甲基乙二胺(TEMED):催化剂, 加速交联聚合反应。
所需的试剂和溶液
过硫酸铵(APS)
引发剂,产生自由基,引发聚合反应。
SDS
十二烷基硫酸钠,用于变性蛋白质并促使其 带负电荷。
发展新型分离技术
随着生物技术的不断发展,可以发展新型的蛋白质分离技术, 如二维电泳、毛细管电泳等,以提高蛋白质分离的分辨率和准
确性。
应用多维度分析
在后续实验中,可以将SDS-PAGE与其他蛋白质分析技术相结 合,如质谱技术、免疫学检测等,进行多维度分析,更全面地
了解蛋白质的性质和功能。
THANKS FOR WATCHING
白质带负电荷,从而在电场中向正极移动。
聚丙烯酰胺凝胶作为支持介质,能够根据蛋白质分子量的不同
03
对其进行分离。
蛋白质的分子量测定
通过比较标准蛋白的迁移率和已知分 子量的标准蛋白,可以大致测定出待 测蛋白质的分子量。
蛋白质的迁移率与其分子量的对数成 反比,因此可以通过计算待测蛋白与 标准蛋白的相对迁移率来推算其分子 量。
甘氨酸
作为分子量标准品。
Tris-HCl缓冲液
维持电泳过程中的pH值稳定。
所需的仪器和设备
电源
为电泳提供电力。
凝胶板
放置凝胶的框架。
垂直电泳槽
提供电泳所需的基 本结构。
移液器
精确添加试剂和溶 液。
紫外透射仪
检测蛋白质条带。
实验前的准备事项
清洗电泳槽和相关器具,确保无残留物。 准备好所需的试剂和溶液,并确保其在有效期内。
SDS-聚丙烯酰胺凝胶电泳法测定蛋白质分子量

SDS的性质与作用
十二烷基磺酸钠(SDS) Sodium dodecyl sulphate CH3-(CH2)10-CH2OSO3--Na+
SDS的性质与作用
Protein Strand
Denature
-
SDS Molecules
-
SDS的性质与作用
蛋白质变性
0.1-1% SDS 0.1 M 2-巯基乙醇 蛋白质变与SDS分子按比例结合 1 :1.4
插入样品梳加入电极缓冲加入电极缓冲液液ph83ph83浓缩胶浓缩胶ph86ph86通电通电分离胶分离胶ph88ph88加入样品加入样品上样及电泳开始电流恒定在开始电流恒定在10ma10ma当进入分离胶后改为当进入分离胶后改为20ma20ma溴酚蓝距凝胶边缘约溴酚蓝距凝胶边缘约5mm5mm时停止电泳
SDS-聚丙烯酰胺
制备浓缩胶
加入浓缩胶溶 液 pH 8.6
分离胶 pH 8.8
通电
加入电极缓冲 液pH 8.3
上样及电泳
加入样品
浓缩胶 pH 8.6
开始电流恒定在10mA,当进入分离胶后改为20mA, 溴酚蓝距凝胶边缘约5mm时,停止电泳。
分离胶
pH 8.8
凝胶板剥离与染色
电泳结束后,撬开玻璃板,将凝胶板
凝胶电泳
生化社团 吕炎
SDS-聚丙烯酰胺凝胶电泳
测定蛋白质分子量
一、实验目的 二、实验原理 三、实验步骤 四、结果分析 五、注意事项
一、实验目的
学习SDS-聚丙烯酰胺凝胶电泳测 定蛋白质分子量的原理。 掌握SDS-聚丙烯酰胺凝胶电泳的 操作技术。
二、实验原理
SDS的性质与作用 聚丙烯酰胺凝胶的性质
sds聚丙烯酰胺凝胶电泳法测定蛋白质的相对分子量

sds聚丙烯酰胺凝胶电泳法测定蛋白质的相对分子量下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by the editor. I hope that after you download them, they can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, our shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!蛋白质是生物体内功能最为重要的大分子化合物之一,其相对分子量是衡量蛋白质性质及功能的重要指标。
(完整版)实验四SDS聚丙烯酰胺凝胶电泳测蛋白质分子量

实验四 SDS 聚丙烯酰胺凝胶电泳测蛋白质分子量姓名:mangogolaSDS 聚丙烯酰胺凝胶电泳测定蛋白质分子量的原理是:蛋白质在电泳中的迁移速率取决于其所带电荷、分子大小以及形状等因素,而大多数蛋白质与SDS 按一定比例结合(1:1.4/g:g ),这样使各种蛋白质的SDS-复合物都带上相同密度的负电荷,而且形状为短轴相同的雪茄烟形。
由此蛋白质分子的电泳迁移率仅取决于其分子量,在特定凝胶浓度下,一定范围内的蛋白质分子量对数与迁移率呈直线关系,选择分子量范围和性质与待测样品相近的蛋白质作标准蛋白,与样品同时电泳计算得到标准曲线,并根据待测样品的相对迁移率在标准曲线上查出其分子量。
一.实验过程1.凝胶工作液的配制2.灌制分离胶将制胶玻璃板清洗安装紧密后,插入制孔器,在距制孔器下端1cm 处做一标记,取下制孔器将分离胶溶液加入两块玻璃板之间至标记处。
然后立即用注射器向凝胶液面轻轻铺上一层厚约0.5cm 的dd 水,目的是使凝胶面平整,放置待其聚合凝固。
3.灌制浓缩胶将分离胶上的双蒸水用注射器取出并用滤纸吸干,放入制孔器,用滴管灌入浓缩胶至玻璃板顶端待其聚合凝固。
4.待测样品的制备取0.1ml 透析除盐后的样品稀释液(浓度在0.2mg/ml 左右),加入0.1ml 样品溶解液,混匀后沸水浴5min ,冷却。
(沸水浴的目的是使蛋白质变性成肽链,便于与SDS 结合,甘油可以增加蛋白质的比重,便于沉降到加样孔底部,不易飘散) 5.加样和电泳将电极缓冲液注入缓冲液槽,然后轻轻拔出制孔器,加样后连接电泳仪,记录每个加样孔的样品类型及上样量。
浓缩胶使用50V 恒压,分离胶使用100V 恒压。
浓缩胶浓度4%,交联度2.7%[Acr (30%):Bis (0.8%)]溶液0.67ml dd 水3.05ml0.5M pH6.8 Tris-Hcl (0.4%SDS )溶液 1.25mlTEMED (原液)6ul将以上成分加入小烧杯中轻轻摇匀,加入10%的硫代硫酸铵0.026ml ,摇匀后灌胶。
聚丙烯酰胺凝胶电泳法

SDS聚丙烯酰胺凝胶电泳法—蛋白质的分子量测定【实验目的】1.掌握SDS—聚丙烯酰胺电泳法的原理。
2.学会用此种方法测定蛋白质的分子量。
【实验原理】SDS—聚丙烯酰胺凝胶电泳(SDS-PAGE)是对蛋白质进行量化,比较及特性鉴定的一种经济、快速、而且可重复的方法。
该法主要依据蛋白质的分子量对其进行分离。
SDS与蛋白质的疏水部分相结合,破坏其折叠结构,并使其稳定地存在于一个广泛均一的溶液中。
SDS—蛋白质复合物的长度与其分子量成正比。
由于在样品介质和聚丙烯酰胺凝胶中加入离子去污剂和强还原剂后,蛋白质亚基的电泳迁移率主要取决于亚基分子量的大小,而电荷因素可以被忽略。
SDS—PAGE因易于操作和广泛的用途,使它成为许多研究领域中一种重要的分析技术。
SDS是十二烷基硫酸钠(sodium dodecyl sulfate)的简称,它是一种阴离子表面活性剂,加入到电泳系统中能使蛋白质的氢键和疏水键打开,并结合到蛋白质分子上(在一定条件下,大多数蛋白质与SDS的结合比为1.4gSDS/1g蛋白质),使各种蛋白质—SDS复合物都带上相同密度的负电荷,其数量远远超过了蛋白质分子原有的电荷量,从而掩盖了不同种类蛋白质间原有的电荷差别。
这样就使电泳迁移率只取决于分子大小这一因素,于是根据标准蛋白质分子量的对数和迁移率所作的标准曲线,可求得未知物的分子量。
【实验材料】1.实验器材微型凝胶电泳装置;电源(电压200V,电流500mA);100℃沸水浴;Eppendorf管;微量注射器(50μl或100μl);干胶器、真空泵或水泵;带盖的玻璃或塑料小容器;摇床。
2.实验试剂⑴ 2mol/L Tris-HCl (pH8.8):取24.2g Tris, 加50ml蒸馏水,缓慢的加浓盐酸至pH8.8(约加4ml);让溶液冷却至室温,pH将会升高,加蒸馏水至100ml。
⑵ 1mol/L Tris-HCl (pH8.8):取12.1g Tris, 加50ml蒸馏水,缓慢的加浓盐酸至pH6.8(约加8ml);让溶液冷却至室温,pH将会升高,加蒸馏水至100ml。
SDS-聚丙烯酰胺凝胶电泳(PAGE)测定蛋白质分子量

实验七SDS-聚丙烯酰胺凝胶电泳(PAGE)测定蛋白质分子量实验数据:标准蛋白质条带第一条第二条第三条第四条第五条溴酚蓝前沿距离/cm 4.70距离/cm 0.50 0.95 1.60 2.10 3.95 相对迁移率mr 0.11 0.20 0.34 0.45 0.84 分子量Mr 97400 66200 43000 31000 14400LgMr 4.99 4.82 4.63 4.49 4.16样品 1 2 3溴酚蓝前沿/cm 4.90 4.80 4.60样品迁移距离/cm 4.20 1.20 1.70相对迁移率mr 0.86 0.25 0.37标准曲线:y=5.05-1.10x结果:样品 1 2 3Mr 12706 59566 43954mr 4.104 4.775 4.643一. 实验目的和要求1 学习SDS-PAGE测定蛋白质分子量的原理。
2 掌握垂直板电泳的操作方法。
3 运用SDS-PAGE测定蛋白质分子量及染色鉴定。
二 .实验原理带电质点在电场中向带有异相电荷的电极移动,这种现象称为电泳。
区带电泳是在半固相或胶状介质上加一个点或一薄层样品溶液,然后加电场,分子在支持介质上或支持介质中迁移。
支持介质的作用主要是为了防止机械干扰和由于温度变化以及大分子溶液的高密度而产生的对流。
区带电泳使用不同的支持介质,早期有滤纸、玻璃珠、淀粉粒、纤维素粉、海砂、海绵、聚氯乙烯树脂;以后有淀粉凝胶、琼脂凝胶、醋酸纤维素膜,现在则多用聚丙烯酰胺(PAGE)和琼脂糖凝胶。
PAGE根据其有无浓缩效应,分为连续系统和不连续系统两大类,连续系统电泳体系中缓冲液pH值及凝胶浓度相同,带电颗粒在电场作用下,主要靠电荷和分子筛效应。
不连续系统中由于缓冲液离子成分,pH,凝胶浓度及电位梯度的不连续性,带电颗粒在电场中泳动不仅有电荷效应,分子筛效应,还具有浓缩效应,因而其分离条带清晰度及分辨率均较前者佳。
SDS-聚丙烯酰胺凝胶电泳,是在聚丙烯酰胺凝胶系统中引进SDS(十二烷基磺酸钠), SDS能断裂分子内和分子间氢键,破坏蛋白质的二级和三级结构,强还原剂能使半胱氨酸之间的二硫键断裂,蛋白质在一定浓度的含有强还原剂的SDS溶液中,与SDS分子按比例结合,形成带负电荷的SDS-蛋白质复合物,这种复合物由于结合大量的SDS,使蛋白质丧失了原有的电荷状态形成仅保持原有分子大小为特征的负离子团块,从而降低或消除了各种蛋白质分子之间天然的电荷差异,由于SDS与蛋白质的结合是按重量成比例的,因此在进行电泳时,蛋白质分子的迁移速度取决于分子大小。
实验8 SDS-聚丙烯酰胺凝胶电泳法测定蛋白质的分子量

实验8 SDS-聚丙烯酰胺凝胶电泳法测定蛋白质的相对分子量Mr原理蛋白质在聚丙烯酰胺凝胶电泳中, 蛋白质的迁移率取决于它所带净电荷及分子的大小和形状。
在聚丙烯酰胺凝胶系统中加入阴离子去污剂十二烷基磺酸钠(sodium dodecyl sulfate,简称SDS)和还原剂(如巯基乙醇)处理蛋白质样品, 则蛋白质分子中的二硫键被还原, 1g蛋白质可定量结合1.4g SDS。
由于SDS呈解离状态, 使蛋白质亚基带上大量的负电荷, 其数值大大超过蛋白质分子原有的电荷量, 因而掩盖了不同种类蛋白质间原有的电荷差别。
各种蛋白质-SDS复合物表现出相等的电荷密度, 在聚丙烯酰胺凝胶上电泳时, 它们纯粹按照分子的大小由凝胶的分子筛效应来进行分离, 有效迁移率与相对分子量的对数成很好的线性关系。
用这种方法测定蛋白质的Mr, 简便、快速, 只需要廉价的设备和μg量的蛋白质样品。
所得的结果, 在Mr为15000~200000的范围内, 与用其他方法测得的Mr相比, 误差一般在±10%以内。
因此SDS测定Mr的方法, 已得到非常广泛的应用和迅速的发展。
现在经SDS-聚丙烯酰胺凝胶研究过的蛋白质已经有很多种了。
实验证明, 在蛋白质溶液中加入SDS和巯基乙醇后, 巯基乙醇可使蛋白质分子中的二硫键;SDS能使蛋白质的氢键、疏水键打开, 并结合到蛋白质分子上形成蛋白质-SDS复合物。
在一定的条件下, SDS与大多数蛋白质的结合比为1.4gSDS/1g蛋白质。
由于十二烷基硫酸根带负电, 使各种蛋白质的SDS复合物都带上相同密度的负电荷, 它的量大大超过了蛋白质分子原有的电荷量, 因而掩盖了不同种类的蛋白质间原有的电荷差别。
1.在用SDS-凝胶电泳法测定蛋白质的Mr时, 应注意以下几个问题:如果蛋白质-SDS复合物不能达到1.4gSDS/1g蛋白质的比率并具有相同的构象, 就不能得到准确的结果。
影响蛋白质和SDS结合的因素主要有以下3个: ⑴二硫键是否完全被还原: 只有在蛋白质分子内的二硫键被彻底还原的情况下, SDS才能定量地结合到蛋白质分子上去, 并使之具有相同的构象。
(生物化学)SDS-聚丙烯酰胺凝胶电泳法测定蛋白质分子量

ml
4.0 2.5 0.1 0.1 3.3 0.006
灌注分离胶(水封,室温30分钟左右凝固) *丙烯酰胺和亚甲双丙烯酰胺具有神经毒性神经毒性 ——手套
3. 浓缩胶的制备和灌注
5%浓缩胶(10ml)-3ml/组
试剂
ml
Acr/Bis 30%
1.7
0.5mol/L Tris-HCl Ph 6.8
2.5
在平整的桌面上放下玻璃与夹子,使玻璃和 夹子的底面完全对齐,向外扳动塑料卡口,关紧
夹子。
玻璃夹放在制胶架上,薄玻璃朝向自己。按弹 簧夹,将玻璃夹卡入制胶架。在玻璃的间隙内分别
灌制分离胶和浓缩胶,放上梳子,待胶凝固。2. 分离胶的制备和灌注
12%分离胶的制备(10ml)-5ml/组
试剂
Acr/Bis 30% 1.5mol/L Tris-HCl pH 8.8 10% SDS 10% AP H2O TEMED
• 电泳:80V,15-20min(浓缩胶);100V(分 离胶)至指示剂距凝胶底边1cm。
6. 染色、脱色
染色:凝胶于0.25% 考马斯亮蓝染 色20min。
脱色:于脱色液 (7.5%冰乙酸, 5%甲醇)中脱 色至蛋白带清 晰。
蒸馏水煮沸5-10’
7. 照相、分析结果
➢凝胶成像系统照相 ➢绘制标准曲线 ➢计算样品蛋白的分子量
兔磷酸化酶B(97400) 牛血清白蛋白(66200)
兔肌动蛋白(43000) 牛碳酸酐酶(31000)
胰蛋白酶抑制剂(20100) 鸡蛋清溶菌酶(14400)
8. 思考题
➢ 浓缩胶与分离胶的作用机制各是什么? ➢ 分离胶灌注完毕,以蒸馏水封闭的作用是
什么? ➢ 根据实验结果,分析实验误差的可能原因。 ➢ 如何配置1L 0.5mol/L Tris-HCl pH 6.8 缓
生化实验七 SDS一聚丙烯酰胺凝胶电泳法测定蛋白质的分子量

实验七 SDS —聚丙烯酰胺凝胶电泳法测定蛋白质的分子量一、 实验原理了解SDS-聚丙烯酰胺凝胶电泳的原理,学会用这种方法测定蛋白质的相对分子量 二、实验原理带电的颗粒(蛋白质)在电场的作用下,移动的速度是根据此公式,在同一电场强度(v /d)和电极缓冲液(η)条件下,带电的各种蛋白质成分,移动的速度决定于各蛋白质的带电量(q)和自身分子的大小(6πr)。
若使各蛋白质成分的带电量(q)相近似时,则各蛋白质成分移动的速度就只决定于各蛋白质成分自身分子的大小(6πr)。
1967年Shapiro 等人发现,在聚丙烯酰胺凝胶中加入阴离子去污剂十二烷基硫酸钠(sodium dodecylsulfate ,SDS),不影响凝胶的形成,而蛋白质的电泳迁移率则主要取决于它的自身分子量的大小。
加入SDS 之所以能获得如此的效应,是因为SDS 能打开蛋白质分子间的氢键和疏水键,使蛋白质变性成为松散的线状。
同时大多数蛋白质的每个氨基酸都能与固定量的SDS 相结合[溶液中的SDS 总量,至少要比蛋白质的量高3倍以上,大多数蛋白质与SDS 按1:1.4(W /W)的比例结合],形成SDS 一蛋白质复合物。
其结果: (1)由于SDS 解离后带有很强的负电荷,致使SDS 一蛋白质复合物都带上了相同密度的负电荷,其电量大大超过了蛋白质分子原有的电荷量,基本掩盖了不同种类蛋白质间原有的电荷差异。
(2)SDS 与蛋白质结合后,改变了蛋白质原有构象,使所有蛋白质水溶液中的形状都近似椭圆柱形。
不同SDS 一蛋白质复合物的短轴直径都一样,约为18nm ,而长轴则与蛋白质分子的大小成正比。
这样SDS 一蛋白质复合物在凝胶电泳中的迁移率,就不再受蛋白质原有电荷及其形状的影响了,而只取决于椭圆柱长度,即蛋白质分子的大小。
需要注意的是:为使SDS 与蛋白质能充分的按比例结合,必须将蛋白质间的二硫键完全打开。
因此,在用SDS 处理蛋白质样品时,必须同时用巯基乙醇处理。
06 生物化学实验--SDS-聚丙烯酰胺凝胶电泳法测定蛋白质分子量

SDS- 聚丙烯酰胺凝胶电泳法测定蛋白质分子量【目的】1 . 掌握 SDS-PAGE 测定蛋白质分子量的操作方法。
2 . 熟悉 SDS-PAGE 测定蛋白质分子量的原理。
【原理】带电粒子在电场中向着与其自身电荷方向相反的电极移动, 称为电泳。
不同蛋白质分子具有不同的大小、形状, 在一定的 pH 环境中带有不同的电荷量, 因而在一定的电场中所受的电场引力及介质对其的阻力不同, 二者的作用结果使不同蛋白质分子在介质中以不同的速率移动, 经过一定的时间后得以分离, 这就是电泳分离蛋白质及核酸生物大分子的基本原理。
聚丙烯酰胺凝胶电泳就是以聚丙烯酰胺凝胶作为电泳介质的电泳。
在电泳时, 蛋白质在介质中的移动速率与其分子的大小, 形状和所带的电荷量有关, 为了使其只与蛋白质分子的大小有关, 从而利用蛋白质在介质中的迁移率来测定蛋白质的分子量, 就需要消除蛋白质分子的形状和所带电荷量的不同对迁移率的影响或减小到可忽略不计的程度。
SDS 是十二烷基硫酸钠( sAium dAecyl sulfate )的简称, 它是一种阴离子表面活性剂, 加入到电泳系统中能使蛋白质的氢键和疏水键打开, 并结合到蛋白质分子上(在一定条件下, 大多数蛋白质与 SDS 的结合比为 1.4 g SDS/ 1 g 蛋白质), 使各种蛋白质 -SDS 复合物都带上相同密度的负电荷, 其数量远远超过了蛋白质分子原有的电荷量, 从而掩盖了不同种类蛋白质间原有的电荷差别, 使电泳迁移率只取决于分子大小这一因素, 于是根据标准蛋白质分子量的对数和迁移率所作的标准曲线, 可求得未知物的分子量。
SDS 与蛋白质结合后引起蛋白质构象的改变。
SDS- 蛋白质复合物的流体力学和光学性质表明, 它们在水溶液中的形状, 近似于雪茄烟形状的长椭园棒, 不同蛋白质的 SDS 复合物的短轴长度都一样(约为 18? , 即 1.8 nm ), 而长轴则随蛋白质分子量成正比的变化。
SDS-聚丙烯酰胺凝胶电泳法测定蛋白质分子量

实验六报告:SDS-聚丙烯酰胺凝胶电泳法测定蛋白质分子量1.研究背景及目的根据自然界中普遍存在的电泳现象,以及实践应用的需求,科学家不断完善了电泳技术,从移界电泳法、垂直管型盘状电泳、垂直板型电泳、垂直柱型盘状电泳到水平板型电泳。
电泳技术广泛地应用于样品的分析鉴定。
蛋白质分子量的测定在理论和实践中具有很重要的意义,比如临床中对于尿液中蛋白质分子量的测定可以监测人体内的某些疾病(肾小管损坏、多发性骨髓瘤等)。
这种需要促进了相关技术的发明。
具体过程见原理。
蛋白质在聚丙烯酰胺凝胶中电泳时,它的迁移率取决于它所带净电荷以及分子的大小和形状等因素。
从活性电泳到变性电泳经过了很多思考。
从活性如果加入一种试剂使电荷因素及分子的形状消除,那电泳迁移率就取决于分子的大小,就可以用电泳技术测定蛋白质的分子量。
1967年,Shapiro等发现阴离子去污剂十二烷基硫酸钠(SDS)具有这种作用[1]。
通过向样品中添加入巯基乙醇和过量SDS,使蛋白质变性解聚,并让SDS与蛋白质结合成带强负电荷的复合物,掩盖了蛋白质之间原有电荷的差异。
SDS与蛋白质分子结合,不仅使蛋白质分子带上大量的负电荷,而且使蛋白质分子的形状都变成短棒状,从而消除了蛋白质分子之间原有的电荷差异和分子形状的差异。
因此蛋白质在SDS-PAGE中的时迁移率主要取决于其分子大小。
由于SDS与蛋白质的结合,电泳迁移率在外界条件固定的情况下,只取决于蛋白质分子量大小这一因素,使得SDS-聚丙烯酰胺凝胶电泳具有分辨率高、重复性好等特性,因此广泛应用于未知蛋白质分子量测定。
通过本次实验,学习和掌握垂直板型聚丙烯酰胺凝胶电泳的原理和方法,进一步学习和应用SDS-聚丙烯酰胺凝胶电泳法测定蛋白质分子量。
2.原理由于技术的发展,理论上可以通过测序测出蛋白质分子量的真值,但是实际操作过于繁琐,且生物大分子的数量级是KDa,实际中往往不需要特别精确。
所以转向寻求其它方法,如果两种性质具有相关性,就会有相关理论基础和技术,发现分子量与迁移速率有关,于是寻找相关方面的技术。
SDS聚丙烯酰胺凝胶电泳测定蛋白质分子量

03 结果分析
CHAPTER
蛋白质分子量的计算
蛋白质分子量计算
根据已知标准蛋白的迁移率和分子量 ,通过线性回归分析,计算未知蛋白 的分子量。
校准曲线的建立
使用已知分子量的标准蛋白,在相同 条件下进行电泳,绘制迁移率与分是指凝胶能够区分相邻蛋白条带的能力,高分辨率的凝胶能够清晰区分 相近分子量的蛋白质。
电泳的原理
电场作用
01
在电场的作用下,带负电荷的SDS-蛋白质复合物向正极移动。
分离效果
02
不同分子量的蛋白质在电场中移动速度不同,从而实现分离。
检测方法
03
电泳结束后,可以通过染色、银染或荧光染色等方法检测分离
的蛋白质条带,并可根据染色深浅判断蛋白质含量。
02
SDS聚丙烯酰胺凝胶电泳测定蛋白质分子量 的实验步骤
电泳
01
02
03
安装电极
将凝胶放置在电泳槽中, 确保电极与凝胶接触良好。
加样
将准备好的样品加入到凝 胶的样品孔中。
开始电泳
接通电源,开始电泳。确 保电流稳定,避免电流过 大或过小对实验结果的影 响。
染色和脱色
染色
在电泳结束后,将凝胶取出,放 入染色液中染色,使蛋白质条带 呈现可见的着色。
脱色
将染色后的凝胶放入脱色液中脱 色,去除背景颜色,使蛋白质条 带更加清晰可见。
分离度
分离度是指凝胶中各蛋白条带之间的分离程度,好的分离度能够使各蛋白条带 完全分开,便于准确分析。
实验误差和注意事项
实验误差来源
实验误差可能来源于电泳过程中电压、电流的波动、染色过程中染料的浓度和染 色时间等因素。
注意事项
为确保实验结果的准确性,应使用高质量的电泳试剂和设备,严格控制实验条件 ,并遵循标准化操作程序。同时,应定期对标准蛋白进行检测,以确保标准曲线 的准确性。
SDS-聚丙烯酰胺凝胶电泳测定蛋白质分子量
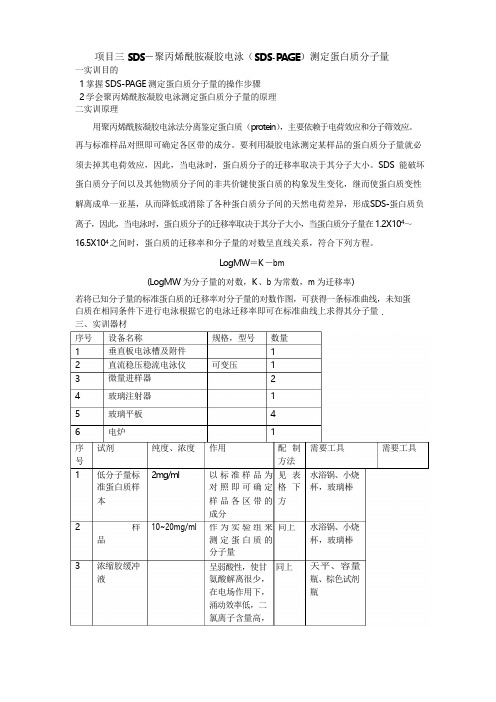
. 样作为实验组来 同上项目三 SDS -聚丙烯酰胺凝胶电泳(SDS-PAGE )测定蛋白质分子量一实训目的1 掌握 SDS-PAGE 测定蛋白质分子量的操作步骤2 学会聚丙烯酰胺凝胶电泳测定蛋白质分子量的原理 二实训原理用聚丙烯酰胺凝胶电泳法分离鉴定蛋白质(protein ),主要依赖于电荷效应和分子筛效应。
再与标准样品对照即可确定各区带的成分。
要利用凝胶电泳测定某样品的蛋白质分子量就必须去掉其电荷效应,因此,当电泳时,蛋白质分子的迁移率取决于其分子大小。
SDS 能破坏蛋白质分子间以及其他物质分子间的非共价键使蛋白质的构象发生变化,继而使蛋白质变性解离成单一亚基,从而降低或消除了各种蛋白质分子间的天然电荷差异,形成 S DS-蛋白质负离子,因此,当电泳时,蛋白质分子的迁移率取决于其分子大小,当蛋白质分子量在 1.2X104~16.5X104 之间时,蛋白质的迁移率和分子量的对数呈直线关系,符合下列方程。
LogMW =K -bm(LogMW 为分子量的对数,K 、b 为常数,m 为迁移率)若将已知分子量的标准蛋白质的迁移率对分子量的对数作图,可获得一条标准曲线,未知蛋 白质在相同条件下进行电泳根据它的电泳迁移率即可在标准曲线上求得其分子量 三、实训器材序号 1 2 3 4 56 设备名称垂直板电泳槽及附件 直流稳压稳流电泳仪 微量进样器玻璃注射器玻璃平板电炉 规格,型号可变压数量1 12 1 41序 试剂纯度、浓度 作用配 制 需要工具 需要工具号 方法1低分子量标 准蛋白质样 2mg /ml以标准样品为 对照即可确定 见 表 格 下 水浴锅、小烧 杯,玻璃棒 本样品各区带的 方成分210~20mg/ml水浴锅、小烧品3浓缩胶缓冲 液测定蛋白质的 分子量呈弱酸性,使甘 同上 氨酸解离很少, 在电场作用下, 涌动效率低,二 氯离子含量高,杯,玻璃棒天平、容量 瓶、棕色试剂 瓶保 证 电 泳 的 作为催化剂,产去掉其电荷效SDS加速剂,可催化4分离胶缓冲 液形成较高的电 位梯度压着蛋 白质聚集在一 起,凝缩为一狭 小区带。
SDS - 聚丙烯酰胺凝胶电泳测蛋白质分子量

实验二十三SDS - 聚丙烯酰胺凝胶电泳测蛋白质分子量一、目的学习和掌握垂直板聚丙烯酰胺凝胶电泳的原理、方法, 并应用该方法测定蛋白质分子量。
二、原理蛋白质在聚丙烯酰胺凝胶中电泳时, 其迁移率取决于它所带净电荷、分子大小、形状等因素。
1967 年Shapiro 等人发现, 如果在聚丙烯酰胺凝胶系统中加入阴离子去污剂十二烷基硫酸钠(SDS) , 则蛋白质分子的电泳迁移率主要取决于它的分子量, 而与其所带电荷多少和形状无关。
SDS 是一种很强的阴离子表面活性剂。
SDS 以其疏水基和蛋白质分子的疏水区相结合,形成蛋白质- SDS 复合物。
SDS 与大多数蛋白质的结合是高密度的, 其重量比为l .4∶1 , 由于十二烷基硫酸根带负电, 使各种蛋白质的SDS 复合物都带上相同密度的负电荷, 而且带电量远远超过了蛋白质分子原有的电荷量, 从而消除或降低了不同蛋白质分子之间所带净电荷对电泳迁移率的影响。
SDS 与蛋白质结合后, 还引起了蛋白质构象的改变。
根据流体力学的研究, SDS - 蛋白质复合物具有扁平而紧密的椭圆形棒状结构, 不同蛋白质的SDS 复合物的短轴长度都一样, 约为1 . 8 nm, 而长轴则随蛋白质的分子量成正比地变化。
这说明, SDS - 蛋白质复合物的形成也消除了天然蛋白质构象不同对迁移率的影响。
影响带电化合物电泳迁移率的内在因素有三: 即带净电荷的多少、分子量的大小和分子的形状。
从以上的分析不难看出, 由于SDS 和蛋白质的结合, 消除了净电荷和分子形状二因素对电泳迁移率的影响。
那么在外界条件固定的情况下, 凝胶电泳的迁移率只取决于蛋白质分子量大小。
因此, 我们只要测出4~6 个已知分子量的标准蛋白质的迁移率, 作出标准曲线, 即可得到待测蛋白质分子的分子量。
只是每次测定样品必须同时做标准曲线, 而不得利用另一次电泳的标准曲线。
SDS - 凝胶电泳具有分辨率高、重复性好、设备简单、操作容易等优点。
实验四 SDS聚丙烯酰胺凝胶电泳测蛋白质分子量

实验四 SDS 聚丙烯酰胺凝胶电泳测蛋白质分子量姓名:mangogolaSDS 聚丙烯酰胺凝胶电泳测定蛋白质分子量的原理是:蛋白质在电泳中的迁移速率取决于其所带电荷、分子大小以及形状等因素,而大多数蛋白质与SDS 按一定比例结合(1:1.4/g:g ),这样使各种蛋白质的SDS-复合物都带上相同密度的负电荷,而且形状为短轴相同的雪茄烟形。
由此蛋白质分子的电泳迁移率仅取决于其分子量,在特定凝胶浓度下,一定范围内的蛋白质分子量对数与迁移率呈直线关系,选择分子量范围和性质与待测样品相近的蛋白质作标准蛋白,与样品同时电泳计算得到标准曲线,并根据待测样品的相对迁移率在标准曲线上查出其分子量。
一.实验过程1.凝胶工作液的配制2.灌制分离胶将制胶玻璃板清洗安装紧密后,插入制孔器,在距制孔器下端1cm 处做一标记,取下制孔器将分离胶溶液加入两块玻璃板之间至标记处。
然后立即用注射器向凝胶液面轻轻铺上一层厚约0.5cm 的dd 水,目的是使凝胶面平整,放置待其聚合凝固。
3.灌制浓缩胶将分离胶上的双蒸水用注射器取出并用滤纸吸干,放入制孔器,用滴管灌入浓缩胶至玻璃板顶端待其聚合凝固。
4.待测样品的制备取0.1ml 透析除盐后的样品稀释液(浓度在0.2mg/ml 左右),加入0.1ml 样品溶解液,混匀后沸水浴5min ,冷却。
(沸水浴的目的是使蛋白质变性成肽链,便于与SDS 结合,甘油可以增加蛋白质的比重,便于沉降到加样孔底部,不易飘散) 5.加样和电泳将电极缓冲液注入缓冲液槽,然后轻轻拔出制孔器,加样后连接电泳仪,记录每个加样孔的样品类型及上样量。
浓缩胶使用50V 恒压,分离胶使用100V 恒压。
浓缩胶浓度4%,交联度2.7%[Acr (30%):Bis (0.8%)]溶液0.67ml dd 水3.05ml0.5M pH6.8 Tris-Hcl (0.4%SDS )溶液 1.25mlTEMED (原液)6ul将以上成分加入小烧杯中轻轻摇匀,加入10%的硫代硫酸铵0.026ml ,摇匀后灌胶。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验原理
电泳:是带电颗粒在电场作用下,作定向运动即 向着与其电荷相反的电极移动的现象。 电泳法分离、检测蛋白质混合样品,主要是根据 各蛋白质组分的分子大小和形状以及所带净电荷 多少等因素所造成的电泳迁移率的差别。 区带电泳是样品物质在一惰性支持物上上进行电 泳的过程。因电泳后,样品不同组分形成带状区 间,故称区带电泳。
在聚丙烯酰胺凝胶系统中,加入一定量的SDS时,蛋白质分子 的电泳迁移率主要取决于它的分子量大小,而其他因素对电泳 迁移率的影响几乎可以忽略不计。当蛋白质的分子量在 15,000~200,000之间时,电泳迁移率与分子量的对数呈直线关 系,符合下列方程式:
lg MW=-b·mR+K MW为蛋白质分子量,mR为相对迁移率,b为斜率,k为截 距。在条件一定时,b和K均为常数。 若将已知分子量的标准蛋白质的迁移率对分子量的对数作图, 可获得一条标准曲线。未知蛋白质的相同条件下进行电泳,根 据它的电泳迁移率即可在标准曲线上求得分子量。
实验步骤
凝胶的制备 蛋白质样品的处理 加样:用微量注射器依次在各个样品槽内加样,各加
10~15μl(含蛋白质10~15μg),稀溶液可加20~30μl
电泳凝胶配方:
30.8%Acr-Bis
1.5mol/l Tris(pH8.9)
0.5mol/l Tris(pH6.7) ddH2O水
10%SDS
10%过硫酸铵AP
3、样品处理与加样 ⑴样品制备
取蔗糖酶样品(样品Ⅰ、Ⅱ、Ⅲ、Ⅳ)各50μl,分别放入1.5ml离心管中, 12000r/min离心10分钟,上清即为电泳样品。 ⑵样品处理
将离心后的上清各取20ul,加入等体积“2×蛋白质样品溶解液”,100℃保温 3分钟,取出冷却后,12000r/min离心2min,取上清直接加样。 ⑶加样
丙烯酰胺
N,N’-甲叉双丙烯酰胺
聚丙烯酰胺凝胶的交联结构
不连续聚丙烯酰胺凝胶电泳是指使用不同孔径和不同缓冲 系统的电泳,它由浓缩胶和分离胶两部分所组成。由于浓 缩胶的堆积(浓缩)作用,可使样品(即使是稀释样品) 在浓缩胶和分离胶的界面上先浓缩成一窄带,然后在一定 浓度(或一定浓度梯度)的凝胶上进行分离。 不连续聚丙烯酰胺凝胶电泳的分离原理: 浓缩效应 电荷效应 分子筛效应
向样品槽内样品Ⅰ、Ⅱ、Ⅲ,各5μl,样品Ⅳ 15μl。如样品浓度较低,可适 当增加上样量。
蛋白质分子量标准溶液加8μl/孔。
实验步骤
电泳:上槽接负极,下槽接正极,打开直流电源。对于垂
直板型电泳,一般样品进胶前电流控制在15~20mA,大 约15~20分钟;样品进胶后,将电流调到25-30mA,保持电 流强度不变。待指示染料迁移至下沿约1~1.5cm处停止电 泳。 剥胶和染色:电泳结束后,取下凝胶膜,将短板玻璃撬开 后取出凝胶板。用水慢慢冲洗一下胶面。将胶置于培养皿 内,加入染色液。染色4小时以上或过夜
蛋白质-SDS复合物在水溶液中的形状,近似于雪茄烟形的长 椭圆棒。不同蛋白质的SDS复合物的短轴长度都一样,约为 1.8nm,而长轴则随蛋白质的分子量成正比变化。这样的蛋白 质-SDS复合物在凝胶中的迁移率,不再受蛋白质原有电荷和 形状的影响,而只是椭圆棒的长度,也就是蛋白质分子量的 函数。
带负电荷的蛋白质-SDS复合物由于结合了大量的SDS,使蛋白 质丧失了原有的电荷状态,形成了仅保持原有分子大小为特 征的负离子团块,从而降低或消除了各种蛋白质分子之间天 然的电荷差异。
按上表配制5ml浓缩胶,混匀后沿玻璃板将浓缩液加到已聚合的分离胶上方, 直至离短玻璃板上得约0.5cm处,轻轻将样品槽模板(梳子)插入浓缩胶内, 约30min后凝胶聚合,再放置20~30min,使凝胶“老化”。小心拔去样品槽的 槽板(梳子),用滤纸吸去样品凹槽中多余的水分,将电泳缓冲液倒入上、 下贮槽中,电泳缓冲液应没过短板约0.5cm以上,即可准备加样。
十二烷基硫酸钠(sodium dodecyl sulfate,简称SDS)是一种阴 离子去污剂,它能破坏蛋白质分子之间以及与其他物质分子 之间的非共价键,使蛋白质变性而改变原有的空间构象。特 别是在强还原剂,如巯基乙醇存在下,由于蛋白质分子内的 二硫键被还原剂打开,不易再氧,这就保证了蛋白质分子 与SDS充分结合.
脱色:染色完毕,倾出染色液,加入脱色液。一天换2~3 次脱色液,直至凝胶的蓝色背景褪清、蛋白质色带清晰为 止。脱色时间一般约需一昼夜(注意:与上述两种染色液 相对应,也有两种脱色液)。 蛋白质分子量的求算:以样品蛋白质迁移率比照标准蛋白 质的迁移率计算样品的分子量。
六、实验结果
1、计算蛋白质样品相对分子质量
将¢15cm培养皿放在一张坐标纸上,量出加样端距溴酚蓝区带中心间的距
离(cm)以及各蛋白质样品区带中心与加样端(凝胶顶端)的距离(cm),按
下式计算相对迁移率Rf
蛋白样品距加样端距离(cm)
相对迁移率Rf=
溴酚蓝区带中心距加样端距离(cm)
列出电泳后各种蛋白质的迁移率和分子量。 以标准蛋白质的相对迁移率为横坐标,标准蛋白质分子质量lgM为纵坐标
TEMED
10%分离胶 2.4ml 1.9ml
3.07ml 75 l 50l 6l
5%浓缩胶 0.85ml
0.63ml 3.45ml
50l 25 l 4 l
⑵、凝胶板的制备 ① 分离胶的制备:
按上表配制7.5ml分离胶,混合均匀后沿玻璃板将凝胶液加至长、短玻璃板 间的缝隙内,再加1ml蒸馏水(或水饱和的异丙醇或正丁醇)沿长玻璃板板壁 缓慢注入,约5mm高,以封住胶面,以促使聚合并使胶面平直,约30min后, 凝胶与水封层间出现折射率不同的界线,则表示凝胶完全聚合,倾去水封层 的蒸馏水,再用滤纸条吸去多余的水分。 ② 浓缩胶的制备:
聚丙烯酰胺凝胶是由丙烯酰胺和交联试剂N,N’-甲叉双丙烯酰 胺在有引发剂(如过硫酸铵)和增速剂(如N,N,N’,N’-四甲
基乙二胺,TEMED)的情况下聚合而成的。丙烯酰胺的聚合 通常是由化学催化或光化学过程完成的,常用过硫酸铵、过硫 酸钾或核黄素来引发这个过程,用TEMED、3-二甲胺丙腈等作 为聚合过程中的增速剂。
