酵母菌基因组DNA的提取实验方法
酵母菌中多倍体基因组的基因分析.doc

酵母菌中多倍体基因组的基因分析多倍体,即染色体成套的增加,在发育,细胞应激,疾病和进化中出现。
尽管多倍体现象很普遍,但很少有人了解伴随着多倍体的生理变化。
我们之前描述过“多倍体特异性致死”,在单倍体或二倍体出芽酵母不具有致死性的基因缺失对于三倍体或者四倍体酵母来说却具有致死性。
这里我们研究基因组是为了明确多倍性特异性致死的作用。
在被检测的3740个突变中只筛选出39个表现出多倍体特异性致死现象,几乎所有的突变都是通过损害同源重组、姐妹染色单体的结合或者有丝分裂纺锤体的功能来影响基因组的稳定性的。
我们发现被检测的野生型四倍体的缺陷,并且明确了四倍体影响基因组稳定性的机制。
我们发现四倍体有较高的发生率去附着纺锤体的单极,我们认为这个缺陷可以用错配来解释以扩大纺锤丝极体、纺锤体和着丝粒的限度,因此,几何约束可能对基因组的稳定产生深远的影响,在这里描述的现象可能与多种多样的生物演化关系相关,包括像癌症这样的疾病。
多倍体在自然界中很常见,所有生物体的多倍体现象发生在植物,真菌,无脊椎动物以及像鱼和两栖动物这样的低等脊椎动物中。
原因尚不清楚,但多倍体在高等脊椎动物中是不能存活的,我们认为多倍体现象在进化中也经常发生。
基因组序列表明,很多同时代的基因组,包括高等脊椎动物的基因组,是由原始的基因副本进化而来,保存了基因顺序和方向的复制的基因组片段在很多酵母菌和人类的基因组都是很明显存在的,这些发现与Ohno的假设是一致的,这个假设是:基因复制产生了进化多样性的基础。
多倍体也会在另外一些整倍体有机体的一小部分细胞中发生。
在绝大多数环境下,细胞在特定的机制——核内周期——的作用下会变成多倍体,它截断了细胞周期并且阻止了细胞分裂。
然而,一些细胞类型,像肝细胞,能够像多倍体细胞一样分裂,并且很多细胞类型在病态的情况下变成多倍体,以便在病毒感染之后或者处于像癌症这样的病态时对细胞应激做出反应。
因此,多倍体只出现在特定的细胞类群以及生理环境下,至少在发育过程中,存在一些机制来限制多倍体细胞的分裂。
实验讲义

酵母菌的分离鉴定、固定化及酒精发酵酵母菌(yeast)是一类单细胞真菌。
一般呈圆形、卵圆形、圆柱形,其菌落呈乳白色或红色,表面湿润、粘稠,易被挑起。
酵母菌多数为腐生,专性或兼性好氧,广泛生长在偏酸性的潮湿的含糖环境中,例如水果、蔬菜、蜜饯的内部和表面以及在果园土壤中最为常见。
酵母菌在有氧环境下将葡萄糖转化为水和二氧化碳,主要用于馒头、面包等食品发酵;在工业上,酿酒酵母(Saccharomyces cerevisiae)将葡萄糖、果糖、甘露糖等单糖吸入细胞内,在无氧的条件下,经过体内酶的作用,把单糖分解为二氧化碳和酒精。
此作用即酒精发酵。
C6H i2O6(葡萄糖)T 2 C2H5OH(酒精)+2 CO2 f 在酿酒酵母酒精发酵的生产和应用中,由于细胞破碎和酶纯化等操作往往导致酶活性和稳定性都受影响,从而降低产酒精效率。
而利用细胞固定化可以很好的解决这一问题。
微生物细胞固定化方法主要有三种:载体结合法,交联法和包埋法,其中固定包埋法是目前比较理想的方法。
包埋法就是将微生物细胞均匀地包埋在多孔的水不溶性的紧密结构中,细胞中的酶处于活化状态,因而活性高,活力耐久。
目前,利用聚乙烯醇(PVA)—海藻酸盐是包埋法中比较高效的一种,这种方法以PVA-海藻酸钠作为混合溶胶,将酵母细胞固定起来进行酒精发酵,不仅可以使细胞浓度增加,而且可以多次使用,减少了酵母培养增殖所消耗的糖分;操作简单、过程迅速、颗粒不粘连、颗粒强度大大提高,且增加了颗粒的生物活性和稳定性,因此可实现连续化生产,提高酒精生产效率。
【实验一】一、酵母菌的分离与培养一、【实验目的】学习用选择性培养基分离酵母菌。
二、【实验原理】大多数酵母菌为腐生,其生活最适pH值为4.5〜6,常见于含糖分较高的环境中,例如果园土、菜地土及果皮等植物表面。
酵母菌生长迅速,在液体培养基中比霉菌生长得快。
利用酵母菌喜欢酸性环境的特点,用酸性液体培养基获得酵母菌的培养液(这样做的好处是酸性培养条件则可抑制细菌的生长),然后在固体培养基上用划线法分离纯化出酵母菌。
酵母的dna提取实验报告

酵母的dna提取实验报告
(最新版)
目录
一、实验目的
二、实验材料
三、实验步骤
四、实验结果
五、实验讨论
六、实验结论
正文
一、实验目的
本实验旨在通过提取酵母的 DNA,研究酵母的基因组成,并为后续的基因工程实验提供 DNA 样本。
二、实验材料
1.酵母菌种
2.蒸馏水
3.乙醇
4.氯化钠
5.滤纸
6.蒸馏器
7.离心机
三、实验步骤
1.酵母菌种的准备:选用新鲜的酵母菌种,将其放入蒸馏水中,保持适当的浓度。
2.提取 DNA:将酵母菌种放入离心机中,离心一定时间后,取出上清液。
向上清液中加入适量的氯化钠,使 DNA 逐渐析出。
3.滤过:将析出的 DNA 溶液倒入装有滤纸的漏斗中,通过滤纸将杂质滤除。
4.洗涤:将滤纸放入蒸馏水中,反复洗涤,直至滤纸上的 DNA 纯净。
5.乙醇沉淀:将洗涤后的滤纸放入乙醇中,静置一段时间,DNA 会逐渐沉淀。
6.收集 DNA:将沉淀后的 DNA 收集起来,即为提取的酵母 DNA。
四、实验结果
通过实验,成功提取到了酵母的 DNA,实验结果符合预期。
五、实验讨论
在实验过程中,我们发现在加入氯化钠后,DNA 的析出速度较快,说明氯化钠对 DNA 的析出有一定的促进作用。
此外,通过多次洗涤和乙醇沉淀,我们成功地提取到了纯净的酵母 DNA。
六、实验结论
通过本实验,我们成功地提取了酵母的 DNA,为后续的基因工程实验提供了必要的材料。
酵母基因提取实验报告

一、实验目的1. 学习酵母基因提取的基本原理和操作步骤。
2. 掌握利用CTAB法提取酵母基因组DNA的方法。
3. 熟悉DNA纯化、定量和鉴定等实验技术。
二、实验原理酵母基因提取是通过物理或化学方法将酵母细胞中的DNA与蛋白质、RNA等杂质分离的过程。
CTAB法是一种常用的DNA提取方法,其原理是利用CTAB(十六烷基三甲基溴化铵)与DNA的结合能力,以及酚/氯仿等有机溶剂的界面作用,将DNA从细胞中提取出来。
三、实验材料与仪器1. 材料:酵母菌(如酿酒酵母)、Tris-HCl缓冲液、NaCl、CTAB、酚/氯仿、无水乙醇、RNase A、DNA标准品、琼脂糖凝胶电泳系统等。
2. 仪器:高速离心机、恒温培养箱、紫外分光光度计、凝胶成像系统、电泳仪、微波炉等。
四、实验步骤1. 酵母菌培养:将酵母菌接种于YEP培养基中,于28℃恒温培养箱中培养至对数生长期。
2. 酵母菌收集:用无菌吸管吸取适量酵母菌培养液,转移到无菌离心管中,以8000 r/min离心5分钟,弃上清液。
3. 细胞裂解:向离心管中加入适量Tris-HCl缓冲液、NaCl、CTAB、酚/氯仿,混匀后室温放置10分钟。
4. 分相:将上述混合液转移至新的离心管中,以12,000 r/min离心5分钟,弃上清液。
5. DNA纯化:向沉淀中加入适量Tris-HCl缓冲液、酚/氯仿,混匀后室温放置10分钟。
6. 分相:将上述混合液转移至新的离心管中,以12,000 r/min离心5分钟,取上清液。
7. 洗涤:向上清液加入等体积的无水乙醇,混匀后室温放置10分钟。
8. 离心:以12,000 r/min离心5分钟,弃上清液。
9. 洗涤:向沉淀中加入适量70%乙醇,混匀后室温放置5分钟。
10. 离心:以12,000 r/min离心5分钟,弃上清液。
11. DNA溶解:向沉淀中加入适量TE缓冲液,室温放置5分钟,使DNA溶解。
12. 定量:利用紫外分光光度计测定DNA的浓度和纯度。
酵母菌DNA的提取

酵母DNA提取方法方法一:石英砂法1、5000rpm×5min 收集过夜培养的菌体(5ml左右),于200μL 裂解液(50 mmol/ L Tris-HCl pH 8.0 , 180 mmol/ LEDTA pH 8.0 , 1 % SDS , 现配)中,加入3/10 总体积石英砂在涡流混合器上振荡13min,每隔4min 将离心管取出用力甩几下,然后65℃水浴10min。
2、加入200μL 5mol/L KAc,冰浴8min;3、12000rpm×5min 转移上清至新的离心管中;4、加入 3 mol/L NaAc 35μl,加入异丙醇200μL混匀后冰浴8min,12000rpm×5min收集沉淀;5、200μL TE 溶解,加入RNase10μL,65℃水浴10min;6、加入200μL 氯仿-异戊醇(24:1),抽提;7、温柔地取上清150μL ,加入20μL 3 mol/L NaAc及375μL 无水乙醇,混匀后12000rpm×8min 收集DNA;8、70% 乙醇洗涤沉淀,吹干后TE 溶解,-20℃保藏。
方法二:蜗牛酶法1. 接种于5 ml的YEPD培养基中在25℃-28℃振荡培养12-16 h。
2. 3500 rpm离心5min沉淀细胞,用1ml 的无菌水洗涤一次,再加0.5ml solution Ⅰ(1M 山梨醇,0.1M EDTA, pH=7.5)重悬。
3. 转移细胞至1.5 ml 的离心管中,加入0.1蜗牛酶(30mg/ml)溶液,37℃保温30-60min, 以获得原生质体。
4. 最大转速离心1min以沉淀细胞,用500ulsolutionⅡ(50mMTris-HCl, 20mM EDTA,pH=7.4)溶液悬浮,然后加入50μl 10% SDS, 混合65℃保温30min。
5. 加入200μl 5M 醋酸钾,放于冰上30 min。
酵母菌表面展示载体构建及转化

酵母菌表面展示载体构建及转化酵母菌表面展示系统是一种重要的生物学工具,可用于表面展示重要的蛋白质、肽段等分子,以扩大其在不同研究领域的应用。
酵母菌表面展示系统具有许多优势,如易于操作、高效表达、易于纯化等。
因此,构建和转化酵母菌表面展示载体是实施这种系统的关键步骤。
1. 酵母菌表面展示载体构建酵母菌表面展示载体通常由两个核心组成部分构成:酵母表面蛋白的扩大子和目标蛋白的插入序列。
以下是构建酵母菌表面展示载体的一般步骤:1.1 提取酵母菌基因组DNA:使用适当的方法从酵母菌中提取基因组DNA。
可以选择一种高质量的DNA提取试剂盒来确保DNA的纯度和完整性。
1.2 扩增酵母菌表面蛋白的扩大子:根据需要选择具体的表面蛋白扩大子,并使用聚合酶链式反应(PCR)扩增其序列。
需要使用具有相应限制性内切酶切位点的引物。
1.3 准备载体:选择合适的酵母菌表面展示载体,并使用同样的限制性内切酶切位点将其线性化。
线性化的载体将提供插入序列的位点。
1.4 进行反应与连接:将扩增的酵母菌表面蛋白扩大子与线性化的载体进行连接。
这一步可以在体外进行,使用DNA连接酶(例如T4 DNA连接酶)。
1.5 转化大肠杆菌:将连接好的载体导入大肠杆菌,并培养在含有适当抗生素的培养基上,以筛选带有目标载体的菌落。
1.6 纯化载体:从培养的重组大肠杆菌中提取目标载体,并使用DNA纯化试剂盒纯化。
2. 酵母菌表面展示载体转化转化是将目标载体导入酵母菌的过程。
以下是酵母菌表面展示载体转化的常见方法:2.1 胞壁酶处理酵母菌细胞:使用蛋白酶K等酶处理酵母菌细胞,使细胞壁变薄,提高载体的导入效率。
2.2 制备酵母菌细胞的质粒DNA:通过将酵母菌细胞进一步培养扩增,提取质粒DNA,并确保其质量和纯度。
2.3 酵母菌细胞的化学转化:通过将质粒DNA与聚乙二醇(PEG)或锌盐等化学物质一起处理酵母菌细胞,使质粒DNA进入细胞内。
2.4 酵母菌细胞的电转化:使用高压电脉冲将质粒DNA导入酵母菌细胞,通过瞬时破坏细胞壁和细胞膜,使DNA进入细胞。
重组法酵母转基因的操作流程

重组法酵母转基因的操作流程1.酵母基因组DNA的提取酵母基因组DNA提取的目的是获取酵母菌体内的DNA用于后续的操作。
一般采用裂解酵母菌体的方法提取DNA,具体步骤如下:-通过酵母预培养,得到酵母菌悬浮液。
-沉淀酵母菌悬浮液,去除培养基。
-使用细胞裂解缓冲液裂解酵母细胞,释放DNA。
-使用丙酮沉淀DNA,去除其他杂质。
-通过洗涤、溶解等步骤得到纯化的酵母基因组DNA。
2.外源DNA的构建外源DNA的构建是将目标基因或其他DNA片段经过特定的操作,构建成可用于转基因的载体DNA。
-针对目标基因,进行PCR扩增或使用其他适当的方法获得目标DNA片段。
-将目标DNA片段与载体DNA进行连接,一般采用限制酶切和DNA连接酶的方法。
-外源DNA还可以构建其他特殊序列,如启动子、标记基因等,以实现特定的目标。
3.酵母菌体的转化转化是将外源DNA导入酵母中,使酵母细胞能够表达外源基因。
酵母菌体转化一般有两种方法:化学法和电转化法。
-化学法转化:-制备酵母靶菌株,包括选择合适的酵母菌株及对应培养基成分的调整。
-制备产生低盐胆固醇溶液和转化缓冲盐溶液。
-稀释酵母导入质粉末,并加入充足的低盐胆固醇溶液。
-在冰上孵育一段时间,将混合液通过热激冷冻的方法转移到电泳气泡中。
-通过勺子串入导入液,冻结导入液后,电泳电环泵注入电泳。
-电泳过程中伴有导入液的减量。
结束电泳时,针尾切割成小片。
-电转化法转化:-将酵母细胞培养至对应的生长期。
-调整酵母细胞浓度。
-准备转化缓冲盐溶液和性相为空凝气泡的溶液。
-将酵母细胞和目标DNA溶液混合。
-通过不同电压的电击法将酵母细胞进行电转化。
-回收转化后的酵母菌体并进行培养。
4.筛选转基因酵母为了筛选出成功转基因的酵母细胞,一般采用标记基因的方法。
-构建一个可表达特定筛选标记基因的转基因酵母菌株。
-将转化后的酵母菌种悬浮液培养在含有选择性的培养基中,使只有转基因酵母能够存活下来。
-通过对菌落进行PCR扩增或其他方法,确认是否成功获得目标基因的酵母菌株。
基因组dna提取流程

基因组DNA提取的流程
1. 样本选择:选择适合提取基因组DNA的样本类型,如细胞、组织或血液。
确保样本保存在合适的条件下,以保持DNA的完整性。
2. 细胞破碎:对于细胞样本,首先需要将细胞破碎以释放DNA。
可以使用物理方法,如机械剪切或超声波处理,或者使用化学方法,如洗涤溶解和细胞裂解酶处理。
3. DNA溶解:将细胞裂解提取物加入DNA溶解缓冲液中,以彻底溶解DNA。
4. 去除杂质:通过离心、过滤或沉淀等方法去除蛋白质、RNA 等杂质。
5. 纯化DNA:使用吸附剂、洗涤剂或沉淀剂等方法去除剩余的杂质,得到纯化的基因组DNA。
6. 检测与定量:通过电泳、荧光光谱等技术检测提取的DNA质量和浓度,确保提取的DNA满足后续实验的要求。
以上是基因组DNA提取的一般流程,具体操作可能会因实验条件、样本类型和目标DNA的不同而有所差异。
酵母实验-学生版

酵母实验-学⽣版酵母系列⼤实验设计PCR介导的酿酒酵母基因敲除1、实验⽬的学习理解酿酒酵母中PCR介导的基因⼀步敲除法的原理,掌握酵母的转化⽅法,了解酵母⽣长及遗传学特性。
2、实验原理酵母菌作为最简单的真核⽣物,能以单倍体和⼆倍体两种形式稳定存在,其中单倍体含有两种交配型,可以⾃由的在单倍体和⼆倍体之间进⾏转换,在⽣物学研究中有着得天独厚的优势。
⾸先酵母菌⽣长速度很快。
对数期⽣长的单倍体菌株在YPD(富营养天然培养基)90分钟分裂⼀代,在合成培养基中140分钟分裂⼀代。
其次,酵母的基因组很⼩,遗传背景相对简单,是⼀种很容易进⾏遗传操作的模式⽣物。
酿酒酵母的基因组只有12052 Kb,其基因组序列早在1996年测序完成,已有约6000个超过100个氨基酸的ORF被报道,只有不到5%的ORF含有内含⼦,其中有约5700个蛋⽩编码基因,分散在16条染⾊体上。
上世纪90年代末,由数个实验室联合进⾏的酿酒酵母基因组敲除项⽬的完成是酵母遗传学研究的⾥程碑事件。
在这个项⽬中,四个基因敲除菌株库被成功构建:两种交配型的单倍体菌株库、杂合⼦⼆倍体菌株库以及⾮必需基因的纯合⼦⼆倍体菌株库。
这个项⽬⼏乎完成了全部ORF的敲除,为⽣物学研究,特别是组学研究,提供了⼗分强⼤的系统性研究⼯具,为后续基因功能的研究奠定了坚实的基础。
此外,酵母作为真核⽣物,与⾼等⽣物在很多代谢通路和蛋⽩表达调节等⽅⾯是⾼度保守的,为⾼等⽣物相关基因,例如疾病基因,功能研究具有提供了简单、易于操作的系统。
⽬前,酿酒酵母已经具有⼀套⼗分灵活快速的遗传操作体系。
酵母允许外源质粒以独⽴复制⼦游离于基因组之外存在,也允许其整合到基因组中。
但跟其他⽣物相⽐,酵母⽐较独特且强⼤的特点是外源序列的整合依赖于同源重组机制。
之前提到的基因组敲除项⽬的完成就是依赖于⾼效率的同源重组,如图-1所⽰。
⼈们利⽤PCR的⽅法,在筛选标记基因两侧引⼊待敲除基因(YFG,your favorite gene)特异性序列;随后将PCR产物通过转化传递到酵母细胞内部;在同源重组的作⽤下,⼀些细胞的对应基因位点的内源性序列被含有同源臂的外源序列直接取代,并通过选择培养基筛选出来。
酵母菌的基因组学研究

酵母菌的基因组学研究酵母菌是单细胞真核生物中最重要的一种,是各种淀粉类、水果类和酿造酒类的发酵剂。
酵母菌在生命科学研究中有着举足轻重的地位,已经成为基础研究的重要模型生物之一。
随着技术的发展,酵母菌基因组学研究取得了长足的进展,对于生命科学和医学的发展都起到了积极的作用。
一、酵母菌基因组的测序酵母菌的基因组是指该生物所有基因序列的总和,是构成其遗传信息基础的全部内容。
酵母菌的基因组在20世纪中期被人们确定,当时采用的是细胞学方法和遗传学方法。
随着分子生物学和基因工程技术的快速发展,酵母菌基因组测序也迎来了飞跃性发展。
目前,已经完成了酿酒酵母、伯克霍尔德菌等多种酵母菌的全基因组测序,为深入研究酵母菌的生命活动和对人类健康的影响提供了重要的基础数据。
通过对基因组数据的分析,科学家们不断深入酵母菌基因的结构和功能,为了进一步研究酵母菌的生命行为提供了有力的保障。
二、基于酵母菌的基因功能研究酵母菌的单细胞结构使得其基因表达和调控相对简单,基因功能的研究更为直接和有效。
科学家们通过对酵母菌基因的分析和研究,发现了许多重要的基因和基因功能。
比如,通过研究酵母菌基因可知其对营养物的吸收和代谢,证实了这种生物可以发酵多种糖类,对人们的生活和工程化生产具有重要的意义。
还有,人类的许多基因在酵母菌中也存在表达。
对基因的功能研究可以在小鼠或其他模式生物上进行,这些研究可以为人类疾病的治疗和预防提供新的途径。
因此,酵母菌基因活动的详细研究对于深入理解人类遗传疾病的发生和治疗具有重要的启示作用。
三、酵母菌中的基因编辑技术基因编辑技术是研究人员操纵基因组的一种有效方法。
随着科学技术的不断发展,人类对于基因编辑技术应用范围和效应的研究也越来越深入。
这种技术以机器制造DNA的特定序列为基础,通过人工手段进行基因的修改和创新,从而实现人类对基因的控制和调控。
基因编辑技术在复杂生物体中仍然十分复杂,但是酵母菌的单细胞特性使得基因编辑技术在酵母菌中有着更广泛的应用。
(整理)酵母菌落PCR

酵母菌落PCR方法酵母菌落PCR方法,酵母菌落PCR方法,涉及提取DNA方法、PCR方法问:很郁闷,最近在做电转毕赤酵母,但是转化完了没有合适的筛选方法,如果提基组的话费时费钱,而且由我这个电转的几率十分低,也就有1%-10%,所以想用菌落PCR 方法筛选,但酵母菌破壁很困难,如果处理不好的话基组释放不出来,就没有阳性结果了。
查了一些资料说用反复冻融法,是不是直接挑单菌落就行了呢?还有说用蜗牛酶帮助消化的,这个我倒不是很清楚,所以请各位大虾们帮帮忙,在实在是被这个伤透脑筋了!求助十万火急!!!!!!!答:蜗牛酶提取DNA以后作PCR效果很稳定酵母DNA的提取1、x新鲜的菌中加入150ul(200ul)bufferiI25(30)ul蜗牛酶(30mg/ml),37度,10Min(可以30min水浴,中间隔5分钟,振荡一次,避免细胞沉到管底。
2、离心10000rmp,10min,去上清,沉淀中加入bufferII250ul3、加入25ul,10%SDS。
65度,30min水浴。
4、加入25ul 5mol/lKAC,冰浴60分钟(4度冰箱放置就可以)5、12000rmp,15min,取上清,在上清中加入2-3倍积的无水乙醇,混匀放置-20度一小时(可过夜,取出后不振荡,直接离心)6、12000rmp,15min,弃上清。
7、150ul,bufferIII溶液沉淀,12000rmp,15min8、将上清溶液转到干净的离心管中,加入6ul(10ug/ul),ran酶,37度,30min9、加入等积异丙醇,4度静止10min,10000rmp,5min,溶50ulbufferIII中10、如果有蛋白质可以使用酚氯仿抽提11、bufferI:0.9mol/l 山梨醇,0.1mol/l EDTA12、bufferII:50mmol/l Tris,20mmol/l EDTA13、bufferIII:10mmol/l tris,1mol/l EDTA14、筛选AD/BD可以直接使用抗生素筛选的方法酵母菌落PCR1、酵母质粒和基组DNAPCR模版的备取对数生长期酵母菌株 1.5ml,13000r/min,离心15s,去上清,双蒸水洗涤一次,13000r/min 离心15s,沉淀悬浮200ulTE缓冲液中,在沸水上煮1-10min,冰浴10min,13000r/min,离心5min,将上清液储存-20度取1ul用PCR2、从板上调取长势良好的菌落少许,悬浮含20ul无菌水的0.5ml eppendofff离心管中(离心管中央预先用注射器针头扎一个小孔,放置盖子受热膨胀)水浴煮沸0.2.5.10min3、利用微波炉快速备酵母治理以及菌落取直大3mm的酵母干菌落,至EP管中盖上盖子,在微波炉中加热,加入30ulTE振荡,13000r/min,离心2-5min,上清储存浴-20度,取1ul来作PCR真菌DNA的提取方法改良1、酵母活化后加入YEPD培养基,25-28度培养16-24小时,收集菌2、取少许新鲜的菌,加入0.6ml缓冲液I(0.9mol/l 山梨醇,0.1mol/l EDTA)1ml。
酵母单杂交实验dna载体构建流程

酵母单杂交实验DNA载体构建流程1.引言酵母单杂交实验是一种常用的研究基因互作或蛋白相互作用的方法。
在酵母单杂交实验中,需要构建适合该实验的DN A载体。
本文将详细介绍酵母单杂交实验DN A载体的构建流程。
2.实验原理在酵母单杂交实验中,需要构建包含目标基因的D NA载体。
DN A载体的构建通常由以下几个步骤组成:2.1D N A提取首先,从参与实验的酵母菌株中提取D NA。
可以使用商业D NA提取试剂盒或自制D NA提取方法。
确保提取的D NA质量和纯度满足实验要求。
2.2扩增目标基因利用聚合酶链反应(P C R)方法,从酵母菌株的基因组DN A中扩增目标基因。
设计合适的引物,使扩增出的目标基因片段与DN A载体连接所需的限制性内切酶切位点相匹配。
2.3D N A片段连接将扩增出的目标基因片段与适当的DN A载体进行连接。
使用限制性内切酶切割目标基因片段和DN A载体,使它们产生互补的粘性末端,在适当的缓冲液中对其进行连接。
使用DN A连接酶催化连接反应,形成目标基因片段与D NA载体的连接产物。
2.4转化酵母菌将连接产物转化到酵母菌中。
通过电击法或化学法将连接产物导入酵母菌细胞中。
待酵母菌细胞经过恢复和选择后,转化出的菌落中将含有目标基因的DN A载体。
2.5验证构建成功进行酵母单杂交实验前,需要对构建的DN A载体进行验证。
可以通过限制性内切酶切、PC R扩增、测序等方法验证目标基因的正确连接和插入。
3.实验步骤根据上述原理,下面给出酵母单杂交实验D NA载体构建的详细步骤:3.1D N A提取-从酵母菌培养物中收集菌落。
-使用D NA提取试剂盒或自制方法提取DN A。
-检测D NA的质量和纯度,确保满足实验要求。
3.2目标基因扩增-根据目标基因序列设计引物。
-进行P CR反应,扩增目标基因片段。
3.3D N A片段连接-利用限制性内切酶切割扩增出的目标基因片段和DN A载体。
-在相关缓冲液中进行D NA片段连接反应。
酵母菌表面展示操作步骤之目标基因构建与载体构建

酵母菌表面展示操作步骤之目标基因构建与载体构建目标基因构建与载体构建是酵母菌表面展示操作的重要步骤。
在进行酵母菌表面展示实验之前,需要对目标基因进行构建,同时选择合适的载体进行基因的插入和转化。
本文将详细介绍目标基因构建与载体构建的操作步骤。
一、目标基因构建1.基因获取:首先需要从合适的来源中获得目标基因的DNA序列,可以通过基因合成、PCR扩增或从其他细菌或真菌中提取得到。
2.引物设计:根据目标基因的DNA序列设计引物。
引物需包含适当长度的序列和兼容于载体的限制性内切酶切位点。
3.PCR扩增:将目标基因的DNA序列用引物进行PCR扩增,得到PCR产物。
PCR反应体系的设计需依据PCR试剂盒的要求进行。
4.酶切与连接:根据PCR产物的长度和限制性内切酶切位点的位置,选择合适的限制性内切酶对PCR产物进行酶切。
然后使用DNA连接酶将酶切产物连接到合适的载体上。
5.转化:将连接好的目标基因载体构建物转化到合适的宿主酵母菌中。
转化方法可以是化学法,也可以是电转法。
6.鉴定:将转化后的酵母菌进行筛选和鉴定,通过PCR、酶切鉴定或测序确认目标基因是否成功构建到酵母菌中。
二、载体构建1.载体选择:根据实验需要和目标基因的特性选择合适的载体。
常见的载体有质粒、表达载体和融合载体等。
根据酵母菌表面展示的要求,选择带有适当信号肽序列的表达载体。
2.载体线性化:将选择好的载体进行限制性内切酶切,得到线性化的载体。
酶切位点需确保不影响目标基因的插入。
3.目标基因插入:将目标基因与线性化的载体进行连接。
连接方法可以是连接酶,也可以是依靠重叠延伸原理进行连接。
连接反应需进行相关的酶切鉴定和测序验证。
4.转化:将连接好的载体构建物转化到合适的宿主酵母菌中,转化方法可选择化学法或电转法。
5.鉴定:转化后的酵母菌进行筛选和鉴定,通过PCR、酶切鉴定或测序确认目标基因是否成功插入到载体中。
总结:目标基因构建与载体构建是酵母菌表面展示操作的重要步骤。
八年级生物教案:酵母菌和霉菌的实验研究方法和技巧

前言生物学是一门非常重要的学科,它不仅有助于我们了解自己的身体结构和内在机制,还能让我们更好地理解动植物的生命活动。
其中,酵母菌和霉菌是我们日常生活中比较常见的微生物。
本篇文章将介绍八年级生物教案中酵母菌和霉菌的实验研究方法和技巧。
一、酵母菌实验研究方法和技巧1.酵母菌的制备和培养酵母菌属于单细胞真菌,可以利用其进行实验研究。
在进行酵母菌实验前需要先进行制备和培养。
酵母菌培养需要一个培养基,通常使用的培养基是含葡萄糖、酵母提取物、海藻酸钠等成分YPAD培养基。
利用无菌技术,将培养基倒入无菌平板中,等待其凝固后,将酵母菌接种于其上,然后放置在恒温培养箱内进行培养,此时需要保持培养箱的温度在30℃左右,以此来促进酵母菌的生长繁殖。
2.酵母菌的观察酵母菌的观察需要使用光学显微镜,通常可以选择在100倍或400倍的倍数下观察。
用显微镜观察酵母菌时需要特别注意一些问题。
首先需要调整好显微镜的对焦,以确保观察的清晰度。
其次需要保持显微镜与酵母菌之间的距离适当,避免太近或太远导致观察失真。
需要注意培养盘之间的区分,避免混淆记录和数据。
3.酵母菌的实验操作利用酵母菌进行实验操作时,需要相应的仪器和工具。
比如酵母菌的DNA提取需要离心机、酶切酶、热循环仪等器材和试剂;酵母菌营养需求的实验需要精密的量取和加热等操作,这时需要使用到酵母菌营养需求实验装置等工具。
二、霉菌实验研究方法和技巧1.霉菌制备和培养霉菌是一种真菌,与酵母菌一样也可用于实验研究中。
进行实验前需要制备和培养霉菌。
霉菌培养使用的是静置法或霉菌谷法。
静置法是将霉菌接种在培养基上后静置,保持适当的温度和湿度,以便霉菌生长。
霉菌谷法是将霉菌在固体培养基上生长,将将其切成一定大小的块,然后将其放置在毛细管中,使其逐渐长成一根细长的霉丝。
2.霉菌的观察霉菌的观察同样需要利用显微镜,通常使用20倍和40倍的倍数进行观察。
霉菌观察需要注意样本的取样和准备,避免采样不当或准备不充分导致观察结果不准确。
酵母菌DNA的提取

酵母菌DNA的提取酵母dna提取方法方法一:石英砂法1、5000rpm×5min收集过夜培养的菌体(5ml左右),于200μl裂解液(50mmol/ltris-hclph8.0,180mmol/ledtaph8.0,1%sds,现配)中,加入3/10总体积石英砂在涡流混合器上振荡13min,每隔4min将离心管取出用力甩几下,然后65℃水浴10min。
2、加入200μl5mol/lkac,冰浴8min;3、12000rpm×5min转移上清至新的离心管中;4、重新加入3mol/lnaac35μl,重新加入异丙醇200μl搅匀后冰浴8min,12000rpm×5min搜集结晶;5、200μlte溶解,加入rnase10μl,65℃水浴10min;6、加入200μl氯仿-异戊醇(24:1),抽提;7、柔情地拉苏特兰明150μl,重新加入20μl3mol/lnaac及375μl无水乙醇,搅匀后12000rpm×8min搜集dna;8、70%乙醇洗涤沉淀,吹干后te溶解,-20℃保藏。
方法二:蜗牛酶法1.注射于5ml的yepd培养基中在25℃-28℃震荡培育12-16h。
2.3500rpm离心5min沉淀细胞,用1ml的无菌水洗涤一次,再加0.5mlsolutionⅰ(1m山梨醇,0.1medta,ph=7.5)重悬。
3.迁移细胞至1.5ml的离心管中,重新加入0.1蜗牛酶(30mg/ml)溶液,37℃保温30-60min,以赢得原生质体。
4.最大转速离心1min以沉淀细胞,用500ulsolutionⅱ(50mmtris-hcl,20mmedta,ph=7.4)溶液悬浮,然后加入50μl10%sds,混合65℃保温30min。
5.加入200μl5m醋酸钾,放于冰上30min。
6.最小输出功率Vergt15min,迁移上清液至代莱离心管中,用等体积的异丙醇结晶dna。
酵母菌DNA提取方法

1.将种子液接入100mL液体YPD培养基中培养48h。
2.离心获取湿菌体,用蒸馏水多次洗涤,放在60℃烘箱中烘干备用。
3.选用Eeup柱式真菌基因组DNA抽提试剂盒对DNA进行提取。
(1)取50-100mg新鲜大型真菌(如蘑菇)或20mg干燥的子实体或菌丝用液氮研磨成粉末,加入1.5mL离心管中。
加入200µL Buffer Digestion 和2µLβ-巯基乙醇,再加入20µL Proteinase K液体,震荡混匀。
56℃水浴1h至细胞完全裂解。
(2)加入100µL Buffer PF,充分颠倒混匀,-20℃冰箱放置5min。
(3)室温10000rpm离心5min,将上清转移到新的1.5mL离心管中。
(4)加入200µL Buffer BD,充分颠倒混匀。
(5)加入200µL的无水乙醇,充分颠倒混匀。
(6)将吸附柱放入收集管中,用移液器将溶液和半透明纤维状悬浮物全部加入吸附柱中,静置2min,再10000rpm温室离心1min,倒掉收集管中的废液。
(7)将吸附柱放回收集管,加入500µL PW Solution,10000rpm离心30s倒掉收集管中的废液。
(8)将吸附柱放回收集管,加入500µL Wash Solution,10000rpm离心30s倒掉收集管中的废液。
(9)将吸附柱重新放回收集管中,于12000rpm室温离心2min,离去残留的Wash Solution。
(10)取出吸附柱,放入一个新的1.5mL离心管中,加入50µL TE Buffer静置3min,12000rpm室温离心2min,收集DNA溶液。
提取的DNA可立即进行下一步实验或-20℃保存。
4.对提取的DNA进行PCR扩增。
5.对提取到的DNA进行琼脂糖凝胶电泳实验,检测DNA的提取情况。
酵母双杂实验原理及技术

蛋白的酵母双杂交实验——以钓饵蛋白筛选cDNA 文库研究蛋白相互作用第一部分 系统简介1. 实验原理蛋白的酵母双杂交实验是以酵母的遗传分析为基础,研究反式作用因子之间的相互作用 对真核基因转录调控影响的实验。
很早就已知道,转录活化蛋白可以和DNA 上特异的序列结合而启动相应基因的转录反应。
这种DNA 结合与转录激活的功能是由转录活化蛋白上两个相互独立的结构域即DNA 结合结构域(Binding Domain, BD)和转录活化结构域(Activation Domain, AD)分别来完成的,并且这两个结构域对于基因的转录活化都是必须的。
目前酵母双杂交实验采用的系统有LexA 系统和Gal4系统两种。
在LexA 系统中,DNA 结合结构域由一个完整的原核蛋白LexA 构成,转录活化结构域则由一个88个氨基酸的酸性的大肠杆菌多肽B42构成,它在酵母中可以活化基因的转录; 在Gal4系统中,BD 和AD 分别由Gal4蛋白上不同的两个结构域(1-147aa 与768-881aa)构成。
在利用GAL4系统筛选cDNA 文库或研究蛋白间的相互作用时,DNA 结合结构域与靶蛋白即“诱饵”相结合,转录活化结构域与文库蛋白或要验证的蛋白相结合。
一般情况下,单独的BD 可以与GAL4上游活化序列(GAL UAS )结合但不能引起转录,单独的AD 则不能与GAL UAS 结合,只有当BD 与AD 分别表达的融合蛋白由于相互作用而导致两者在空间上相互靠近时,BD 与AD 才能与GAL UAS 结合并且引起报道基因的转录。
在BD 与AD 要导入的酵母菌AH109中,通过基因工程的方法在GAL4 UASs 和启动子的下游构建了3个报道基因——ADE2,HIS3,MEL1(或LacZ ),因此可以通过营养缺陷筛选和酵母菌表型的改变来筛选或验证两个蛋白之间是否存在相互作用。
GAL4系统的原理如图所示:图一:酵母双杂交系统工作原理Kan r Amp r pGBKT7-bait pACT2-cDNA2.系统特点同以往研究蛋白质—蛋白质之间相互作用的实验手段相比,双杂交系统具有其独特优势。
酵母基因组DNA大量提取试剂盒使用说明
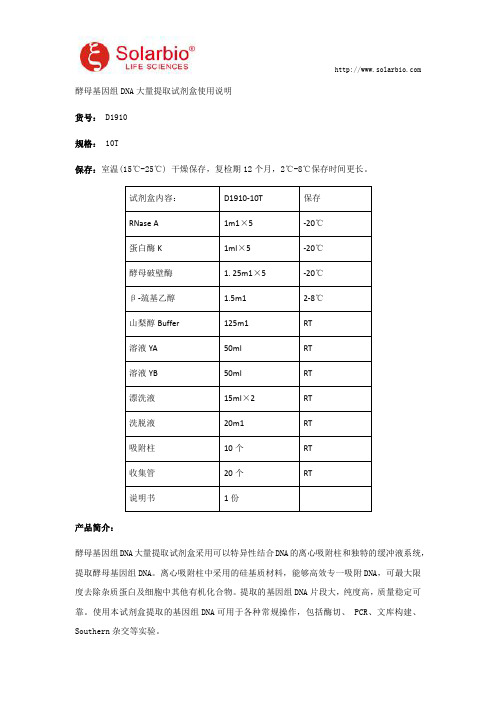
酵母基因组DNA大量提取试剂盒使用说明货号:D1910规格:10T保存:室温(15℃-25℃)干燥保存,复检期12个月,2℃-8℃保存时间更长。
试剂盒内容:D1910-10T保存RNase A1m1×5-20℃蛋白酶K1ml×5-20℃酵母破壁酶 1.25m1×5-20℃β-巯基乙醇 1.5m12-8℃山梨醇Buffer125m1RT溶液YA50ml RT溶液YB50ml RT漂洗液15ml×2RT洗脱液20m1RT吸附柱10个RT收集管20个RT说明书1份产品简介:酵母基因组DNA大量提取试剂盒采用可以特异性结合DNA的离心吸附柱和独特的缓冲液系统,提取酵母基因组DNA。
离心吸附柱中采用的硅基质材料,能够高效专一吸附DNA,可最大限度去除杂质蛋白及细胞中其他有机化合物。
提取的基因组DNA片段大,纯度高,质量稳定可靠。
使用本试剂盒提取的基因组DNA可用于各种常规操作,包括酶切、PCR、文库构建、Southern杂交等实验。
操作步骤:使用前请先在漂洗液中加入无水乙醇,加入体积请参照瓶体上的标签。
所有离心步骤均为使用台式离心机在室温下离心。
1、在离心管中收集酵母细胞20-40ml(不超过109ce l1s),10000rpm离心1min,尽量吸除上清。
2、酵母细胞壁的破除:向酵母菌体中加入9ml山梨醇Buffer。
充分悬浮菌体,加入600ul 酵母破壁酶和100ulβ-巯基乙醇,充分混匀。
30℃处理1-2h,期间可颠倒离心管混匀数次。
3、10000rpm离心lmin,弃上清,收集沉淀。
4、向沉淀中加入5ml溶液YA,充分悬浮沉淀,向悬浮液中加入500ul的RNase A(10mg/ml),充分颠倒混匀,室温放置10min。
5、加入500ul的蛋白酶K(10mg/ml),充分颠倒混匀。
65℃水浴消化30-60min,消化期间可颠倒离心管混匀数次,直至样品消化完全为止。
基因组DNA抽提操作流程

基因组DNA抽提操作流程
1.收集样本:首先需要从待测样本中收集细胞。
这可以是任何包含细胞核的生物组织,如血液、组织样本或细菌培养物。
选择合适的样本类型根据具体的研究目的和实验要求。
2.细胞裂解:将收集到的样本进行细胞裂解,使细胞内部的DNA释放出来。
这可以通过一系列方法实现,如物理破碎、化学裂解或酶的作用。
具体使用哪种方法取决于待测细胞的特点和实验室的设备条件。
3.蛋白质去除:在细胞裂解的过程中,细胞核中的DNA会与蛋白质连接在一起形成复合物,需要进一步去除蛋白质。
可以使用蛋白酶对DNA溶液进行处理,将蛋白质降解分解,并使用盐溶液或酒精进行去除。
4.DNA沉淀:将去除蛋白质的DNA溶液中加入盐溶液或酒精,使DNA 沉淀下来。
这可以通过离心的方法加快DNA的沉淀速度。
离心操作常常需要根据DNA溶液的体积和设备的转速进行优化。
5. 溶解DNA:将沉淀下来的DNA溶于适当的缓冲液中,使其稳定并易于后续的分析和实验。
常用的溶解液包括TE缓冲液(含有Tris-HCl和EDTA)或纯化水。
6.检测DNA浓度和纯度:使用光谱分析仪或比色法等方法检测DNA的浓度和纯度。
这可以帮助确定DNA样本的适用性和是否需要进一步纯化。
需要注意的是,基因组DNA抽提的操作步骤可能会因实验目的和样本类型的不同而有所差异。
在具体操作过程中,应该根据实验室的设备和实验条件进行优化和调整。
同时,实施基因组DNA抽提操作的人员还需要注意安全规范,避免对人体和环境造成潜在的危害。
酵母单杂交实验流程和原理

酵母单杂交实验流程和原理嘿,咱们今天得聊聊这酵母单杂交实验。
说起来,这可是个高大上的实验,但听我给你一讲,保管你也能明白个大概。
首先,咱得知道酵母单杂交实验是干啥的。
这实验主要是用来研究基因和蛋白质之间的关系。
简单说,就是想知道一个基因编码的蛋白质具体是啥样,是啥功能。
这就像你去查一个人的身份,得先找到身份证,然后才能知道他的详细信息。
好,说回实验。
这酵母单杂交实验啊,关键得有几个东西:酵母菌、待测基因的DNA、已知基因的DNA和报告基因。
别看这东西多,操作起来还挺简单。
首先,咱得准备好酵母菌。
这酵母菌啊,就像个小工厂,能按照咱的要求合成蛋白质。
然后,把待测基因的DNA和已知基因的DNA分别切成一小段,就像裁缝裁剪布料一样。
接下来,把这俩小段DNA接在一起,就像两个零件组装在一起。
这俩零件啊,就是待测基因和已知基因的DNA。
然后,把这组装好的DNA送到酵母菌工厂里去,让酵母菌来加工。
这时,如果待测基因和已知基因是同源基因,那么酵母菌就能合成出报告基因编码的蛋白质。
这报告基因啊,就像个小灯泡,能发出光来。
如果合成了蛋白质,小灯泡就亮了,这就是我们想要的。
可要是待测基因和已知基因不是同源基因,那酵母菌就加工不出来报告基因编码的蛋白质,小灯泡就不会亮。
这样一来,我们就能通过观察小灯泡的亮与不亮,来判断待测基因和已知基因是否同源。
好啦,这酵母单杂交实验的流程和原理就介绍到这里。
其实,这个实验说复杂也复杂,说简单也简单。
关键是要掌握好操作步骤,还有耐心。
就像咱们做菜一样,得一步一步来,才能做出美味的佳肴。
嘿,说起来,这实验还真是挺有趣的,不妨自己也试试看吧!。
