酶学-蛋白酶
食品酶学-蛋白酶

7.1 溶菌酶的种类(zhǒnglèi)
• 溶菌酶的研究最早是从1907年发表(fābiǎo)枯草杆菌溶解因
子的报告开始的。1922年英国细菌学家弗莱明(Fleming)
发现人的唾液、眼泪中存在这种能溶解细菌细胞壁 的酶,因其具有溶菌作用,故命名为溶菌酶。
共六十五页
• 1937年由Abraham与Robinson从卵蛋白中最先分离(fēnlí) 出晶体溶菌酶,此后人们在人和动物的多种组织、分泌
液化产品:皮革脱毛(tuō máo)、丝绸脱胶、加酶洗涤剂等 颗粒状产品:稳定性好、无粉尘、颗粒均匀、强度 高、不破碎,是加酶洗衣粉最理想的添加剂。
共六十五页
3、使用(shǐyòng)条件
有效温度范围:20~65 ℃ 最适作用温度:40~50℃ 有效pH范围:8~12 最适作用pH:10~11 金属离子(lízǐ):可被Ca 2+激活,Hg 2+、 Ag 2+ 、Cu 2+ 、Zn
共六十五页
– 鸡蛋清溶菌酶在碱性环境条件下稳定性较差,其它 鸟类蛋清溶菌酶也是由129个氨基酸残基组成,但 其排列(páiliè)顺序和鸡蛋清溶菌酶不同,并且活性 部位也不相同。
共六十五页
– 人溶菌酶分子量为14600单位,对人的溶菌酶 研究发现(fāxiàn)它是由130个氨基酸残基组成,也有4 个S-S键,其一级结构氨基酸顺序及组成与鸡蛋清溶
共六十五页
• 凝乳酶催化酪蛋白沉淀是干酪(gānlào)制造中非常重
要的一步。
• 原料乳杀菌——添加发酵剂、凝乳酶、色素— —凝块形成——排除乳清——切块、搅拌、加 热——成型压榨——腌渍——发酵成熟——上 色挂蜡——成品
共六十五页
二、中性(zhōngxìng)蛋白酶
酶学实验四 碱性蛋白酶活力的测定

实验四碱性蛋白酶活力的测定(赖凌峰李佳佳邓仕彬)一、原理以酪蛋白为底物测定碱性蛋白酶的活力。
酪蛋白经蛋白酶作用后,会降解成相对分子质量较小的肽和氨基酸,在反应混合物中加入三氯醋酸溶液,相对分子质量较大的蛋白质和肽就沉淀下来,相对分子质量较小的肽和氨基酸仍留在溶液中。
溶解于三氯醋酸溶液中的肽的数量正比于酶的数量和反应时间。
因而采用Folin 法测定上清液中肽的含量就可以计算酶的活力。
二、试剂1、0.1mol/L 碳酸钠-碳酸氢钠缓冲液(pH10)2、5%三氯醋酸3、1%酪蛋白溶液:称取5g 酪蛋白置于500mL 0.1mol/L 碳酸钠-碳酸氢钠缓冲液(pH10)中,加热使其溶解。
4、0.4mol/L 碳酸钠溶液5、100μg/mL 酪氨酸溶液6、Folin 试剂,稀释3 倍使用如果自己配制,可按下法:于2000mL 磨口回流装置内加入钨酸钠(Na2WO4.2H2O)100g,钼酸钠(Na2MO2.2H2O)25g,加水700mL,85%磷酸50mL,浓盐酸100mL,文火回流10 小时。
取下回流冷凝器,加入硫酸锂50g,水50mL 和浓溴水(99%)数滴,再煮沸15min,以除去多余的溴(冷后仍有绿色需再加溴水),冷却,加水定容至1000mL,混匀,过滤,制得的试剂应显金黄色,贮于棕色瓶内。
三、步骤1、酶液的萃取称取1g 粗酶制剂置于研钵中,加少量缓冲液一起研磨,然后定容至100mL,从容量瓶中取出5mL 酶液(视酶活而定)再定容至100mL,稀释后的酶液经滤纸过滤后得到澄清的酶液。
2、酶活力的测定样品管:取不同量的酶液(0.2,0.4,0.6mL),用0.1mol/L 碳酸钠-碳酸氢钠缓冲液(pH10)补足体积到1.0mL,然后在每个样品管中再加入1mL 预先在40℃保温的1%酪蛋白溶液,混匀并开始计时,在40℃准确保温10min,加入2mL 5%三氯醋酸溶液,迅速摇匀,于室温静置半小时。
空白管:先在每支试管中各加入1.0mL 1%酪蛋白溶液和2.0mL 5%三氯醋酸溶液,摇匀后,再加入1.0mL的酶液,酶液浓度分别与对应的样品管相同,在40℃下准确保温10min,以下操作同样品管。
蛋白酶产生菌的筛选及酶学性质研究

Ke o d : p o e lt n y ; b cl s c u e e z me p o e t s yw rs r to yi e z me c a i u ; r d n y r p ri l e
3 0 mL f s 0 a k, 6 l 0 mL; i o u u sz , 2 ; r s e t ey An o c u e h r e e t o p a s t a rd c d p o en e n c l m ie % e p c i l. d we c n ld d t e e w r w e k t o u e r t ia v h p s
No 1 .O 0c . t
文章 编号 : 17 - 6 6( 0 6 1— 0 7 0 6 94 2 0 ) 0 0 6 — 4 1
蛋 白酶产 生菌 的筛选及 酶学性质研 究
于宏伟 ,栗志丹 ,郝珊珊 , 贾英 民
( 河北农业大学 食 品科技学院 ,河北 保定 0 10 ) 70 1 摘要 :从养牛 厂附近的土壤 中分 离得 到一 株产 蛋白酶性 质优 良的菌株 ,初步鉴定为芽孢杆 菌 ,对其最适产酶条件进 行了研究 。试 验表 明 ,最 适碳源 为玉米粉 ,最适 氮源为 玉米 浆 ,30 m 0 L摇 瓶最适装 液量 为 6 L,最 适接种 量为 0m 2 %,起始 p H值 为 45和 65时有 2个产酶高峰 ,并对其进行酶学性质的研究。该 酶最适温度为6 . . 5℃ ,最适 p H值为 75 .,该 酶在 5 0℃以下保温 3 n酶活仍 较高 ,在 7 0mi 0℃以上酶活全部丧失 。在 p H值 70 90时 比较稳定 ,而在 p . . ~ H
维普资讯
蛋白酶a的作用位点-概述说明以及解释

蛋白酶a的作用位点-概述说明以及解释1.引言1.1 概述蛋白酶A是一种重要的酶类蛋白,参与了细胞的许多重要生物学过程。
它是一种水解酶,能够催化蛋白质分子的水解反应。
蛋白酶A广泛存在于细胞内各个亚细胞结构中,如细胞质、内质网、线粒体等,具有重要的调控功能。
蛋白酶A的特点主要表现在其选择性催化特性上。
它能够选择性地识别和切割特定的肽键,将目标蛋白质分子切割成特定的片段。
这种选择性作用使蛋白酶A成为细胞内重要的调控因子,能够参与信号转导、蛋白质降解、细胞周期调控等关键生物学过程。
蛋白酶A的作用位点是促进催化反应的关键区域。
在蛋白酶A分子中,作用位点通常是由特定的氨基酸残基组成,形成一个特定的结构。
这个结构使得蛋白酶A能够与待水解的蛋白质分子产生特异性的相互作用,从而催化蛋白质的水解反应。
了解蛋白酶A的作用位点对于理解其催化机制和生物学功能具有重要意义。
通过研究蛋白酶A的作用位点,科学家可以揭示酶与底物之间的相互作用方式,揭示催化反应的催化机理。
同时,深入理解蛋白酶A的作用位点还可以为药物设计和生物工程领域提供重要的参考和依据。
本文将重点探讨蛋白酶A的作用位点以及其在细胞调控和生物工程方面的研究意义。
通过对蛋白酶A作用位点的深入研究,我们有望进一步拓展对蛋白酶A功能的认识,并为相关领域的应用和研究提供新的思路和方法。
文章结构部分的内容可以根据实际内容进行编写,以下是一种可能的编写方式:1.2 文章结构本文主要围绕蛋白酶A的作用位点展开,通过引言、正文和结论三个部分来详细介绍蛋白酶A的作用位点。
引言部分包括对蛋白酶A的概述,介绍蛋白酶A的定义、特点以及其在生物体内的重要作用,引发读者对蛋白酶A作用位点的兴趣。
正文部分分为两个部分,其中2.1节将详细介绍蛋白酶A的定义和特点,包括蛋白酶A的结构、功能以及其在不同生物体中的表达情况。
2.2节将重点阐述蛋白酶A的作用位点,包括其在蛋白质分解中的作用机制、作用位点的结构特点以及与底物的特异性相互作用等内容。
酶学课件之蛋白酶

高岭土吸附
洗脱、压滤
汁液
吸附物
洗脱液
盐析
盐析物
离心 湿粗酶饼 溶解、过滤 澄清液
沉淀 湿酶
干燥
精品
学习文档
菠萝蛋白酶
(2)单宁沉淀法工艺流程
压榨
菠萝下脚料
汁液
去杂质
澄清液 加稳定剂
稳稳定定液液
加单宁 单宁沉淀物 洗脱
滤液
干燥
酶制品
学习文档
菠萝蛋白酶
(3)超滤浓缩法工艺流程
菠萝下脚料 压榨
汁液 去杂质
学习文档
金属蛋白酶的特性
❖ 从鲤鱼肌肉中纯化得到的金属蛋白酶活性温 度范围为30~50℃;
❖ 来源于草鱼肌肉的金属蛋白酶最适温度为 40℃;
❖ 来源于微生物的金属蛋白酶其对温度的耐受 性更强。
❖ 最适pH值在7.5~8.0之间。
学习文档
学习文档
学习文档
1)广泛存在于动物胰脏、细菌、霉菌中,活性中心含 丝氨酸残基,酶活性可受到二异丙基磷酰氟(DFP),苯 甲基磺酰氟(PMSF)和马铃薯抑制剂(PI)等的专一 性抑制。
2)酶学性质 ➢ 酶的最适pH在9.5~10.5,个别为中性 ➢ 分子量在15~30kDa ➢ 等电点PI约9,在低温下于pH9~10稳定,但在65℃时
3、4、2、3 天门冬氨酸蛋白酶类
[carboxyl(asid) pritelnase]
活性中心含 Asp,最适pH 在5以下
胃蛋白酶 凝乳酶
3、4、2、4 金属蛋白酶类
活性中心含有
(metallopritelnase)学习文档Z等n金2+属、 Mg2+
枯草杆菌蛋白酶 嗜热菌蛋白酶
2.1 丝氨酸蛋白酶
食品酶学-蛋白酶

蛋白酶的催化机制
H O C N H C COO+ 3HN
H
+ 3HN
C
COO+
+ 3HN
C
+
H2O
R1
H
C R2 COO-
R1
H
R2
DGo for the rxn is -2kcal/mol
Uncatalyzed rxn at neutral pH, 37°C: 1 X 10-10 /sec Catalyzed rxn (chymotrypsin) at neutral pH, 37°C: 100/sec
食品酶学第六章
——蛋白酶
2012-04-12
1
食
品
酶
学
第六章:蛋白酶
目录CONTENTS
参考书目: 1.刘欣 主编 食品酶学——中国轻工出版社 2.何国庆、丁立孝 主编 食品酶学——化学工业出版社 3.于国萍 主编 食品酶工程——中国农业大学出版社
第一节:蛋白酶概述 第二节:酶白酶反应机制与酶活测定 第三节:蛋白酶在食品生产中的应用
选择性
芳香族羧基/氨基, Leu/Asp/Glu的羧基 Lys/Arg的羧基 Phe/Tyr/Trp的羧基 专一性强 Lys/Arg/Phe的羧基 Phe/Tyr的羧基 Lys/Arg/Phe/Tyr的羧基 主要为疏水性氨基酸的羧基 主要为疏水性氨基酸的羧基 主要为疏水性氨基酸的羧基 Ile/Leu/Val/Phe的氨基 专一性差 专一性强
备注
丝氨酸蛋白酶类 (Serine protease)
3.4.2.2
硫醇(巯基)蛋白酶类 (Thiol protease)
羧基(酸性)蛋白酶 类 (Acid protease) 金属蛋白酶类 (Metalloprotease)
蛋白酶及其在食品工业中应用(论文)

蛋白酶及其在食品工业中应用09化本3班2009364308 梁容摘要:随着科学技术的发展,食品加工的精度越来越高,食品加工的方法越来愈多,人们对食品的要求也越来越高。
蛋白酶作为具有高效性、转移性而且有非常安全的生物催化剂,在食品加工和生产中备受关注。
本文介绍了蛋白酶的种类及其在食品工业中的应用,以其在制糖工业、蛋白制品加工、果蔬加工、焙烤食品、酿酒工业中以及生产油脂中的应用为代表。
关键词:蛋白酶、制糖、鱼、啤酒一、蛋白酶1.蛋白酶是一类由活细胞产生的具有生物催化功能的分子量适中的蛋白质,具有极高的催化效率、高度的特异性及控制的灵敏性。
大多数酶是水溶性的。
由于酶催化反应具有底物专一性、催化高效性、反应条件温和等优点,符合绿色化学的要求,从而被大家高度重视,已在许多领域得到广泛的应用[1]。
蛋白酶广泛的存在于动物、植物以及微生物体内。
蛋白酶主要来源于高等植物的种子和果实, 动物的内脏和腺体, 以及某些微生物如酵母、霉菌和杆菌等。
目前已商品化的酶制剂中, 植物来源的蛋白酶有木瓜蛋白酶、菠萝蛋白酶和生姜蛋白酶等。
动物来源的蛋白酶有从家畜胰脏和胃中提取的胰蛋白酶和胃蛋白酶等。
微生物来源的蛋白酶是商品化酶的主体。
2.种类木瓜蛋白酶,是一种蛋白水解酶,可将抗体分子水解为3个片段。
是番木瓜中含有的一种低特异性蛋白水解酶,活性中心含半胱氨酸,属巯基蛋白酶,是一种在酸性、中性、碱性环境下均能分解蛋白质的蛋白酶。
它的外观为白色至浅黄色的粉末,微有吸湿性。
胃蛋白酶(英文名称:Pepsin),是一种消化性蛋白酶,由胃部中的胃粘膜主细胞所分泌,功能是将食物中的蛋白质分解为小的肽片段。
胃蛋白酶原由胃底主细胞分泌,在pH1.5~5.0条件下,被活化成胃蛋白酶,将蛋白质分解为胨,而且一部分被分解为酪氨酸、苯丙氨酸等氨基酸。
可分解蛋白质中苯丙氨酸或酪氨酸与其他氨基酸形成的肽键,产物为蛋白胨及少量的多肽和氨基酸,该酶的最适pH为2左右。
蛋白酶高产菌株的筛选鉴定与酶学特性研究

蛋白酶高产菌株的筛选鉴定与酶学特性研究赵晓艳;曾志驰;穆丽丽;邓悦;王飞【摘要】以酪蛋白水解圈为筛选标记,在以酪蛋白为唯一氮源的平板上,从土壤中分离筛选到3株高产蛋白酶的菌株,经形态学鉴定和16S rRNA分析,将其分别鉴定为Bacillus sp.G1、Bacillus sp.G2、Stenotrophomonas sp.V1。
将这3株菌株的发酵液通过硫酸铵分级沉淀初步纯化后,其比酶活分别为22.21、19.10和16.03 U/mg。
菌株Bacillus sp.G1和Ba-cillus sp.G2所产蛋白酶的最适反应温度和最适反应pH值均为40℃和7.0;菌株Stenotrophomonas sp.V1所产蛋白酶的最适反应温度为70℃,最适酶反应pH值为7.5。
%Three bacteria strains producing protease were screened and isolated from soil by observation of clearing zones on casein agar plates, based on phenotypic and 16S rRNA gene phylogenetic analysis, G1, G2 and V1 were preliminary classed and named as Bacillus sp.G1, Bacillus sp.G2 and Stenotrophomonas sp.V1.Bacill us sp.G1, Bacillus sp.G2 and Stenotrophomonas sp.V1 were all aerobic strains.The proteases from Bacillus sp.G1, Bacillus sp.G2 and Stenotrophomonas sp.V1 were purified by the methods of ammonium sulfate precipitation, the specific activities of three proteases were up to 22.21 U/mg, 19.10 U/mg and 16.03 U/mg, respectively.The enzymes from Bacillus sp.G1 and G2 were optimally active at 40℃and in 20 mmol/L phosphate buffered saline buffer( PBS, pH 7.0) , and the alkaline protease from Stenotrophomonas sp.V1 was optimally active at 70℃and in 20 mmol/L PBS buffer ( pH 7.5) .【期刊名称】《江西农业学报》【年(卷),期】2016(028)004【总页数】7页(P32-38)【关键词】蛋白酶;筛选;鉴定;酶学特性;Bacillus sp.G1;Bacillussp.G2;Stenotrophomonas sp.V1【作者】赵晓艳;曾志驰;穆丽丽;邓悦;王飞【作者单位】江西农业大学生物科学与工程学院,江西南昌 330045;江西农业大学生物科学与工程学院,江西南昌 330045;江西农业大学生物科学与工程学院,江西南昌 330045;江西农业大学生物科学与工程学院,江西南昌 330045;江西农业大学生物科学与工程学院,江西南昌 330045【正文语种】中文【中图分类】TQ925.2蛋白酶(Protease, EC 3.4)属于水解酶类,是最重要的三大工业用酶之一,销售额约占全球酶制剂市场的60%[1],被广泛应用于食品、酿造、医药、纺织、皮革、日用化学、洗涤剂、饲料以及水产加工等多个行业,在我国国民经济的发展中起着重要的作用[2]。
蛋白酶、溶菌酶PPT课件

蛋白酶与溶菌酶的应用领域
食品工业
蛋白酶和溶菌酶在食品工 业中广泛应用,如制作豆 腐、奶酪、面包等食品, 以及肉类和鱼类的嫩化。
医药领域
蛋白酶和溶菌酶在医药领 域也有应用,如用于制备 药物、诊断试剂和治疗手 段等。
环保领域
蛋白酶和溶菌酶还可应用 于环保领域,如废水处理、 污染物降解等。
04 蛋白酶与溶菌酶的实验研究
蛋白酶、溶菌酶PPT课 件
目录
Contents
• 蛋白酶简介 • 溶菌酶简介 • 蛋白酶与溶菌酶的比较 • 蛋白酶与溶菌酶的实验研究 • 结论与展望
01 蛋白酶简介
蛋白酶的定义
01
蛋白酶是一种能够水解蛋白质的 酶,它能够将蛋白质分解成较小 的肽段和氨基酸。
02
蛋白酶广泛存在于生物体内,参 与多种生理过程,如消化、细胞 凋亡、免疫反应等。
溶菌酶研究展望
针对溶菌酶的抗菌机理和应用效果,未来研究应进一步深入。同时,寻求溶菌酶与其他抗菌物质的协同作用,以 提高抗菌效果也是研究的重要方向。此外,开发新型溶菌酶或改进现有溶菌酶的生产工艺也是未来的研究重点。
THANKS
蛋白酶的分类
根据作用方式的不同,蛋白酶可分为 丝氨酸蛋白酶、半胱氨酸蛋白酶、天 冬氨酸蛋白酶等。
根据来源的不同,蛋白酶可分为动物 蛋白酶、植物蛋白酶和微生物蛋白酶 等。
蛋白酶的生物学功能
消化作用
在消化道中,蛋白酶能够将食 物中的蛋白质分解成可被吸收 的小分子肽和氨基酸,为机体
提供营养。
细胞凋亡
在细胞凋亡过程中,蛋白酶能 够水解特定的蛋白质,参与细 胞结构的破坏和降解。
溶菌酶的分类
根据来源不同,溶菌酶可分为动物溶 菌酶和植物溶菌酶。
蛋白酶的生产和应用
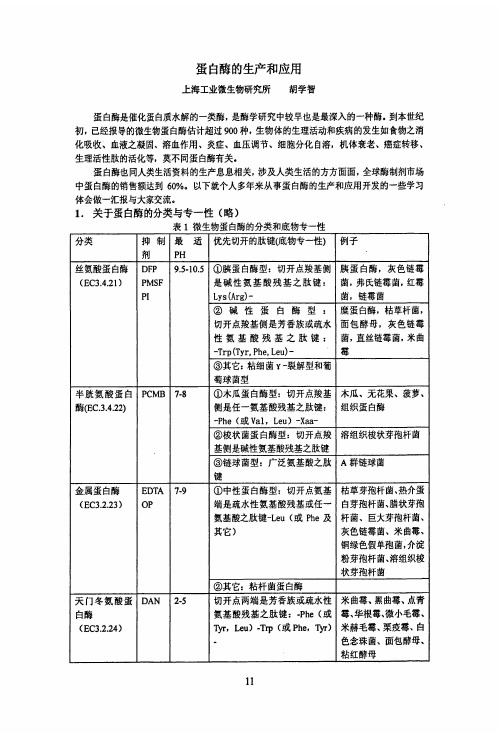
注:PFP.二异丙基磷酰氟 甲基磺酰氟 Ph 马铃薯蛋白酶抑制剂 EDTA:乙二胺四乙酸
PCMB:对氯汞苯甲酸 PMSF."苯 DAN:重氮乙酰正.DL.亮氨酸甲酯 OP:郯二氮杂菲)(菲绕啉)
2.关于微生物蛋白酶的生产
蛋白酶是用途最广泛的酶制剂之一,主要用于洗涤剂,制革、毛皮、蛋白水解物、酿酒、 酱油,以及纺织、医药品、化妆品等的生产上。全球蛋白酶的销售额占酶制剂市场的60%, 我国2005 年全国(外资合资企业不计)微生物酶制剂产量约48 万吨,总销售额约20 亿 人 民币,其中蛋白酶约10 万吨,销售额近9 亿人民币。
食品、饲料加工
蛋白质水解、脱苦、调味液
食品饲料加工
动植物蛋白水解、面包、发酵食品
面包制造
。·
动植物蛋白水解、调味液
弱碱性蛋白酶、调味液
水解蛋白质
Actinase(科研医药)
灰色链霉菌
试剂、食品加工、医药
13
Pantiase NP-2(Yokult)
酸性蛋白酶: SumizymeAP(新日本) Sumizyme RP(新日本) Molsin(Seishin 制药) Neulase F(天野)
奶酪制造
3.蛋白酶的利用 蛋白酶的用途非常广泛(表3),最大的用户是洗涤剂,其次用于饲料、食品工业、酿
酒酿造,以及制革工业和医药。
用途
说明
表3 蛋白酶的用途
干酪制造
凝固酪蛋白,缩短成熟时间 酱油酿造
预处理大豆,提高蛋白质利用率 天然调
味液制造
水解蛋白质,增强风昧,制HVP、HAP
酒精,酿酒
水解蛋白质,促进酵母发酵
啤酒澄清 酿醋
分解啤酒单宁蛋白沉淀,延长保质期 缩短酿醋周期,增加食醋得率
酶工程终结版名词解释

酶:有催化功能的生物大分子分为:蛋白酶(P酶)和核酸类酶(R酶)(主要由RNA组成)酶的特点:催化效率高、专一性强、作用条件温和酶工程主要内容:微生物细胞发酵产酶、动植物细胞培养产酶、酶的提取与分离纯化,酶分子的修饰,酶,细胞和原生质体固定化、酶的非水相催化、酶反应器和酶的应用酶的催化效率比非酶催化反应高107~1013倍酶催化作用的影响因素:底物浓度、酶浓度、温度、Ph 值、激活剂浓度、抑制剂浓度酶在60度以上易失活常见激活剂:ca、mg 、co、zn 、mn 、cl(α——淀粉酶),钴离子和镁离子是葡萄糖异构酶的激活剂酶的命名:国际酶学委员会ICE :推荐名和系统名推荐名:底物名+催化反应类型+酶(水解酶类可省略反应类型名,只在底物后加酶字即可)系统名:作用底物+酶的作用基团+催化反应类型按酶的催化作用类型将蛋白酶分为6大类:氧化还原酶,转移酶,水解酶,裂解酶,异构酶,合成酶将R酶分为:剪切酶、剪接酶、多功能酶还可以由酶的底物是RNA分子还是其他分子,可将R酶分为分子内催化和分子间催化酶活力:是指在一定条件下,酶所催化的反应初速度。
酶催化反应速度,通常用单位时间t内底物S的减少量或产物P的增加量来表示1961年国际生物化学与分子生物学联合会规定:在特定的条件下(温度可采用25摄氏度,pH值等条件均采用最适条件),酶1min催化1umol的底物转化为产物的酶量定义为1个酶活力单位,这个单位称为国际单位(IU)。
国际上另一个常用的酶活力单位是卡特(kat),在特定条件下酶1s催化1mol底物转化为产物的酶量定义为1kat 酶的比活力,是指在特定的条件下,单位重量(mg)蛋白质或RNA所具有的酶活力单位数。
固定化酶:与水不溶性载体结合,在一定的空间范围内起催化作用的酶酶的提取:在一定条件下,用适当的溶剂处理含酶原料,使酶充分溶解到溶剂中的过程。
酶提取注意事项:1、目标酶分子的特性及其物理、化学特性,2、酶分子和杂质的主要性质差异,3、酶的使用目的和要求,4技术实施的的难易程度,5、分离成本的高低,6、是否会造成环境污染。
蛋白分子酶学 重要考点及答案

1理解酶的酸碱催化,以碳酸苷酶的催化反应中,酸和碱分别是什么?酸碱催化是通过瞬时的向反应物提供质子或从反应物接收质子以稳定过渡态,加速反应的一类催化机制,狭义的酸碱催化指在水溶液中通过高反应性的质子和氢氧离子进行的催化,其催化的表观速率常数仅依赖溶液的pH而不受缓冲液浓度的影响。
广义的酸碱催化是指通过H+1和OH-1以及能够提供H+1和OH-1的供体进行的催化,其催化的表观速率常数不仅依赖溶液的pH而不受缓冲液浓度的影响。
在生理条件下,因H+1和OH-1的浓度甚低,故体内的酶反应以广义的酸碱催化作用较为重要。
如氨基、羧基、巯基、酚羟基及咪唑基等能栽在近中性的pH的范围内,作为催化性的质子供体或受体,可提高反应速率102和105倍。
影响酸碱催化反应速率的因素:酸或碱的强度及质子传递的速率。
咪唑基解离常数常数约为6.0,中性条件下,即可做质子供体,又可做质子受体,且速率迅速。
所以组氨酸含量虽少,却占很重要的地位。
以碳酸苷酶为例,碳酸酐酶(CA)家族,α-CA(与人酶同源的CA);β-CA ( 植物,细菌)Zn2+ His,Cys,Cys ;r-CA(古菌)Zn2+ His,His,His在三聚体之间的界面上。
如下图:碳酸苷酶催化CO2 和H2O反应生成碳酸苷。
由图中可知,实际是由H2O提供质子H+,而由CO2接收质子,故广义的碱基团为-COO-和广义的酸为H2O。
酸碱催化生成碳酸苷。
碳酸酐酶是一种活性中心含有Zn2+、能催化CO2 + H2O HCO3- + H+反应的金属酶。
其催化作用主要是通过酶活性区域内的一系列重要氨基酸残基及与这些残基配位连接的Zn2+ 来实现的。
Zn2+位于酶的活性区域底部,催化所必需的该并与β-链上的氨基酸残基His94 , His96 , His119 的季铵氮原子配位结合, 另外再与第四配基H2O 或OH-(取决于溶液pH: pH < 7 时与H2O; 生理条件下pH > 7 , 与OH- ) 相连而形成四面体结构。
食品酶学实验-菠萝蛋白酶

食品酶学综合性实验实验1 菠萝蛋白酶的提取、初步分离纯化及活性测定【目的和要求】1. 了解酶分离纯化的一般程序;2. 掌握硫酸铵沉淀法、透析法分离提取菠萝蛋白酶的基本原理和方法;3. 熟悉蛋白质含量测定、菠萝蛋白酶活力测定等实验原理和方法。
【实验原理】1.建立有效的酶纯化程序应考虑的原则(1)利用酶在分离纯化上最有利的特性;(2)尽早使用一种选择性好的方法;(3)选择交换能力高的层析技术作为第一步层析;(4)不要连续使用相同的纯化方法;(5)将各层析步骤连接起来,使前一步得到的样品适用于下一步层析;(6)在造成酶被稀释的步骤后来要用浓缩酶的方法;(7)要使每步过程的分辨能力呈递增趋势;(8)每步纯化过程后,通过量体积,酶活力和蛋白质浓度测定,监测纯化的进程。
2.菠萝蛋白酶简介菠萝蛋白酶(Bromelain,EC 3.4.22.3)简称菠萝酶,是从凤梨属植物菠萝中提取的一组复合的半胱氨酸巯基蛋白水解酶。
在食品工业中菠萝蛋白酶作为一种食品添加剂,能分解蛋白质、肽、酯和酰胺等,可用于肉质嫩化、水解蛋白、啤酒澄清、干酪生产等。
在医药上它可以治疗水肿及多种炎症。
1891年Mercaro于菠萝的汁中首先发现。
菠萝蛋白酶属于糖蛋白,是由巯基蛋白酶和非蛋白酶组分构成的复杂复合物,因含有一个不稳定的游离巯基,所以菠萝蛋白酶极易被氧化而使其酶活下降。
菠萝蛋白酶的相对分子质量大约为33 000DW,等电点9.55,最适pH在7.1左右,在偏酸环境下酶活下降较快,碱性环境能延缓失活。
菠萝蛋白酶的温度的最稳定范围是55℃~65℃。
金属盐离子中NaCl、KCl对酶活的影响不是很大,维生素C、半胱氨酸、硫代硫酸钠、2-巯基乙醇是菠萝蛋白酶的稳定剂,,EDTA能通过螯合对酶活有影响的金属离子而保护菠萝蛋白酶,有机溶剂中甲醇、乙醇、乙二醇对酶活损失较大。
3.菠萝蛋白酶的粗分离(1)盐析分离盐析法是粗分离蛋白质的重要方法之一。
在稀盐溶液中,蛋白质的溶解度随盐浓度的增加而升高,这种现象称为盐溶。
蛋白酶的发现

蛋白酶的发现
蛋白酶的发现可以追溯到19世纪末和20世纪初,当时科学家们开始对酶的本质和作用进行研究。
以下是蛋白酶发现的一些关键时刻:1.1878年,生理学家Wilhelm Friedrich Conn首先提出了酶的概念,
他认为酶是一种可以催化化学反应的物质。
2.1897年,德国科学家Eduard Buchner开始对不含细胞的酵母提取
液进行发酵研究,最终证明发酵过程并不需要完整的活细胞存在。
这一发现打开了通向现代酶学与现代生物化学的大门。
3.1926年,美国生物化学家James Batcheller Sumner分离获得了尿
素酶的晶体,首次提出酶是蛋白质。
这一发现对后来的酶学研究产生了深远影响,并最终导致了蛋白酶的发现。
4.1930年,John Howard Northrop和Wendell Meredith Stanley通过
对胃蛋白酶、胰蛋白酶和胰凝乳蛋白酶等消化性蛋白酶的研究,最终确认酶是蛋白质。
他们因此获得1946年度诺贝尔化学奖。
5.自20世纪70年代以来,随着X射线晶体学和冷冻电镜等技术的
不断发展,科学家们开始能够对酶进行更深入的结构生物学研究。
这些技术的发展使我们能够更深入地了解酶的三维结构,以及酶在催化过程中的作用机制。
总的来说,蛋白酶的发现是一个长期而不断发展的过程,涉及到多个学科领域的合作和技术的不断进步。
这一发现不仅对酶学和生物化学领域产生了深远影响,也对其他学科领域产生了重要影响。
酶学-3-胰凝乳蛋白酶的催化机制

基础生物化学Basic Biochemistry
胰凝乳蛋白酶的催化机制
酶促反应的机制:中间产物学说
酶促反应的专一性:诱导契合学说
影响酶催化的机制:(临近和定向效应,张力作用,酸碱催化,共价催化,微环境效应)
蛋白质的结构
食物中蛋白质的消化
卵清蛋白(PDB ID: 1UHG
)氨基酸
胰凝乳蛋白酶
胰凝乳蛋白酶催化具有疏水基团的羧基肽键水解。
(切断多肽链中的芳香族氨基酸残基的羧基一侧)。
参与食物中蛋白质的消化过程。
His57
Asp102
Ser195
催化的活性部位
胰凝乳蛋白酶的活性中心由Ser195、His57和Asp102组成,它们构成一个电荷转接系统。
Ser195由于His57和Asp102的影响而成为很强的亲核基团。
催化的四
面体中间物的形成
催化形成的
四面体中间物的稳定
四面体过渡态的形成
底物的敏感键断裂,其中胺成分通过氢键与酶的His57咪唑基连接,底物的羧基部分酯化到Ser195的羟基上。
电荷转接系统从水中吸收一个质子,结果OH-立即攻击连在Ser195上的底物的羧基碳原子,释放产物。
胰凝乳蛋白酶催化机制总结
酶的活性部位Asp102 His57
Ser195
电荷转接系统
对肽键的亲核进攻
产物
氧阴离子洞
四面体过渡态
复合物的形成
肽键断裂
水解。
蛋白酶简介

水解蛋白质肽键的一类酶的总称。
按其水解多肽的方式,可以将其分为内肽酶和外肽酶两类。
内肽酶将蛋白质分子内部切断,形成分子量较小的月示和胨。
外肽酶从蛋白质分子的游离氨基或羧基的末端逐个将肽键水解,而游离出氨基酸,前者为氨基肽酶后者为羧基肽酶。
按其活性中心和最适pH值,又可将蛋白酶分为丝氨酸蛋白酶、巯基蛋白酶、金属蛋白酶和酸性蛋白酶。
按其反应的最适pH值,分为酸性蛋白酶、中性蛋白酶和碱性蛋白酶。
工业生产上应用的蛋白酶,主要是内肽酶。
蛋白酶广泛存在于动物内脏、植物茎叶、果实和微生物中。
微生物蛋白酶,主要由霉菌、细菌,其次由酵母、放线菌生产。
催化蛋白质水解的酶类。
种类很多,重要的有胃蛋白酶、胰蛋白酶、组织蛋白酶、木瓜蛋白酶和枯草杆菌蛋白酶等。
蛋白酶对所作用的反应底物有严格的选择性,一种蛋白酶仅能作用于蛋白质分子中一定的肽键,如胰蛋白酶催化水解碱性氨基酸所形成的肽键。
蛋白酶分布广,主要存在于人和动物消化道中,在植物和微生物中含量丰富。
由于动植物资源有限,工业上生产蛋白酶制剂主要利用枯草杆菌、栖土曲霉等微生物发酵制备。
蛋白酶已广泛应用在皮革、毛皮、丝绸、医药、食品、酿造等方面。
皮革工业的脱毛和软化已大量利用蛋白酶,既节省时间,又改善劳动卫生条件。
蛋白酶还可用于蚕丝脱胶、肉类嫩化、酒类澄清。
临床上可作药用,如用胃蛋白酶治疗消化不良,用酸性蛋白酶治疗支气管炎,用惮性蛋白酶治疗脉管炎以及用胰蛋白酶、胰凝乳蛋白酶对外科化脓性创口的净化及胸腔间浆膜粘连的治疗。
加酶洗衣粉是洗涤剂中的新产品,含碱性蛋白酶,能去除衣物上的血渍和蛋白污物,但使用时注意不要接触皮肤,以免损伤皮肤表面的蛋白质,引起皮疹、湿疹等过敏现象。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蛋白酶
成员:杨超越 李星宇 舒皓钰 王睿飞 徐也甜 李锐涛
蛋白酶
蛋白酶是水解蛋白质肽链的一类酶的总称。到本
世纪初,已经报导的微生物蛋白酶估计超过900
种,生物体的生理活动和疾病的发生,如食物之
消化吸收、血液之凝固、溶血作用、炎症、血压
调节、细胞分化自溶、机体衰老、癌症转移、生
蛋白酶的应用
蛋白酶在烘焙中的应用
蛋白酶的作用机理
蛋白酶能作用于蛋白质和多肽形成多肽 和氨基酸。完好的面粉中蛋白酶活力很 低,制作面包时添加蛋白酶会使面团中 多肽和氨基酸含量增加,氨基酸是形成 香味物质的中间产物,多肽则是潜在的 滋味增强剂、氧化剂、甜味剂或苦味剂。 蛋白酶种类不同,产生的羰基化合物也 不同,若蛋白酶中不含产生异味的脂酶, 适量添加有利于改替面包的香气。
2009年 以色列 用了4500磅的原料 在特拉维夫做了世界最大的鹰嘴豆泥 昭示自己正宗
黎巴嫩人表示不服, 2010年300大厨做了两倍的量 许多人围着大盘载歌载舞
2015年以色列本来打算做一个15吨的 后来因为安全问题而作罢。。。。。。。。
赋予我们食物想象的豆类 粉身碎骨后带来了更多的惊喜
老祖先赠予人类的实惠食物 滋养了中东地区来来去去的民族 文明的兴盛和交流让其传遍地中海各个领域 融入了中东各国人民的血液 在交错分裂的历史和政治图景中 又成为了各自民族想象和身份认同的一部分
内源蛋白酶对肉类食品滋味的影响
滋味是肉制品的重要感官特性之一,公认的基本味 觉有酸、甜、苦、咸和鲜。肉类食品的滋味物质主要有 游离氨基酸、肽、核苷酸和无机盐。 蛋白质的降解是氨基酸和肽形成的重要途径之一, 不同的肽与氨基酸具有不同的呈味特性,从而使肉呈现 不同的滋味。
蛋白酶在茶饮料中的应用
茶 叶 干 物 质 的 20% ~ 30% 是蛋白质,其中一部分 可溶于水,茶叶的冷混浊是 由于蛋白质同酚类化合物构 成的,茶饮料制造时若用蛋 白酶处理,可望消除混浊, 改善过滤速度,延长产品保 质期,并可增强茶饮料的香 味。
理活性肽的活化等,莫不与蛋白酶有关。蛋白酶
与人类密切相关,涉及到生活的各个方面。
蛋白酶
蛋白酶对所作用的反应底物有严格的选择性,一种 蛋白酶仅能作用于蛋白质分子中一定的肽键。 蛋白酶主要存在于人和动物消化道中,在植物和微 生物中含量丰富。
微生物蛋白酶,主要由霉菌、细菌,其次由酵母、 放线菌生产。
蛋白酶
鹰嘴豆蛋白在碱性蛋白酶Alcalase的作用下,其水 解速度相对较快,超氧阴离子捕获率较高。
鹰嘴豆蛋白酶解物在美拉德制备肽工艺中的应用 鹰嘴豆蛋白作为优质的植物蛋白资源,含量约为 25%,若以其蛋白为原料,采用酶法水解可制备具 有呈味特性的游离氨基酸和短肤类物质,再经 Maillard反应形成的产物,即美拉德风味肽产品, 无论从原料还是反应过程中均可被视为天然产品, 且不会与食品中其他配料产生不良反应,近年来 己经成为天然风味基料或调味品的一大发展趋势。
我们的讲述到此完毕,谢谢各位的耐心聆听~
钙·350mg/100g 磷320mg/100g 铁47mg/100g
维生素C、B1、B2 12mg/100g
蛋白酶解的产物是有活性的肽段 肽的抗氧化性至少能部分影响其他的生物活性, 表明多肽的抗氧化性与其它生理功能: 免疫调节、降血压、降胆固醇、类阿片拮抗活性、抗肿瘤等 也可能是其它生理功能的基础
蛋白酶的 分类
蛋白酶的 应用
酶法水解 与鹰嘴豆
蛋白酶的分类
按水解多肽的方式
1. 内肽酶:将蛋白质分子内部切断。 2. 外肽酶:从蛋白质分子的游离氨基或 羧基的末端逐个将肽键水解。
按反应的最适pH值分类
1. 酸性蛋白酶 2. 中性蛋白酶 3. 碱性蛋白酶
按活性中心分类
1. 丝氨酸蛋白酶 2. 巯基蛋白酶 3. 金属蛋白酶 4. 天冬氨酸蛋白酶
蛋白酶在酿造中的应用
蛋白酶用于谷物原料的酒精发酵,可分解谷 物蛋白质,增加酵母营养而促进酵母生长和发酵, 从而有助于缩短发酵时间,提高原料出酒率,向 玉米原料酒精发酵醪添加酸性蛋白酶,发酵周期 可缩短1/3,原料出酒率提高10%~ 20%。酸性蛋 白酶用于白酒生产,除出酒率得以提高,发酵时 间缩短外,还有助于白酒香味物质的形成,并降 低白酒中杂醇油含量。 木瓜蛋白酶、酸性蛋白酶还用于啤酒澄清,防 止啤酒中单宁与蛋白质复合物形成的沉淀浑浊。 酸性蛋白酶用于酿造醋生产可缩短酿醋周期, 提高原料出醋率
番外篇——一场餐桌上的战争
鹰嘴豆碾压成泥后,会变成一种无比美味的食物~
中东地区不可或缺的配菜 下饼界的老干妈
在鹰嘴豆的归属权问题上,
以色列 和黎巴嫩 犹太人和阿拉伯人 相当较真
战争的开始始于2008年 黎巴嫩工业协会向政府情愿 将其注册为黎巴嫩特产 向欧 盟委员会申请原产地保护 这样黎巴嫩的鹰嘴豆泥都会被打上正宗的标签
酶法水解与鹰嘴豆
呐~这是一粒古老又神奇的豆子
豆中之王——鹰嘴豆
鹰嘴豆(学名:Cicer arietinum),为蝶形花科草本植物,别名桃尔豆、鸡豆、
鸡心豆等,是印度和巴基斯坦的重要的五谷之一,在欧洲食用鹰嘴豆也十分普
遍,也是维吾尔医常用药材。因其面形奇特,尖如鹰嘴,故称此名。鹰嘴豆为 豆科草本植物,起源于亚洲西部和近东地区。
气味
( 嗅觉器官的感觉) 、
滋味(
味觉器官的感觉)。
内源蛋白酶对肉类食品气味的影响
肉类食品的气味由各类挥发性成分提供,主要有烃类、醛类、醇类、 酮类、酯类和杂环类等。 不同类挥发性成分具有不同的特征味,如 p-二甲苯呈现水果香味、 辛醛和壬醛呈现鲜草的青香气味。气味化合物大多来源于脂肪的氧化分 解,部分来源于氨基酸的降解,大量研究已表明氨基酸和多肽是肉香的 重要前体物质。
丝氨酸蛋白酶
活性中心:含丝氨酸残基。
分布:广泛存在于动物胰脏、细菌、霉菌中。 最适pH:酶的最适pH在9.5~10.5是碱性蛋白酶,但个别 丝氨酸蛋白酶是中性蛋白酶。
巯基蛋白酶(半胱氨酸蛋白酶)
活性中心:活性中心含一双氨基酸Cys-His,不同族的酶中Cys(半胱氨 酸)与His(组氨酸)前后顺序不同。 分布:广泛存在于原核生物和真核生物中。 最适pH:这类酶最适pH除个别酶为酸性外,其他都为中性。
不同种族、不论宗教的人对鹰嘴豆泥同样的爱和坚持 为它争执不休 为它大快朵颐
MAKE HUMMUS NOT WAR
不同的人能抛开成见 坐下来吃上美食 再大的矛盾也就不是矛 盾了
好吃的灵魂终会相遇 好吃的灵魂终会和解
食物丰富生活
Make you happier
食物治愈生活
Make you healthier
鹰嘴豆蛋白酶解物 (CPH)
酶法水解的优点
水解度(DH)容易控制 组成蛋白质的氨基酸不容易被破坏;
鹰嘴豆蛋白酶解工艺
鹰嘴豆蛋白蕴含着许多具有生物活性的氨基酸序列,具有
较强的体外抗氧化性,因此用特异的蛋白酶水解就有可能
释放出具有该活性的肽段。
蛋白酶具有底物特异性,采用不同蛋白酶水解
蛋白质能释放不同活性的酶解物。
蛋白酶在烘焙中的 作用
改善面团物理性质和面 包质量性质和面包质圣
具有良好乳化性和持泡 性
软化面筋提高面粉可塑 性
改善面团物理性 质和面包质量
黑麦粉 小麦粉
普通面粉
具有良好乳化性和持泡性
在生产蛋糕过程中,鸡蛋液是主要的关键原料,要 求具有良好的乳化性和持泡性。通过添加蛋白酶制 剂可经酶有效地改善鸡蛋液乳化性和持泡性。
软化面筋提高面粉可塑性
生产饼干大都采用可塑性良好的软 质面粉,与生产面包时的要求完全 不同。生产饼干需要蛋白质含量较 低的面粉,使用蛋白酶能软化面筋 而不影响面粉中其它成份。
常用的蛋白酶制剂
木瓜蛋白酶
菠萝蛋白酶
中性蛋白酶
碱性蛋白酶
酶制剂在实际应用注意事项
(1)由于各种酶制剂在高温潮湿条件下,易吸湿潮解 使其活性下降,因而应密封贮存于低温阴凉处。 (2)不同品牌、不同品种酶的活性相差很大,在应用 程中,一般根据所购产品的推荐用量,结合本企业面粉 的特性进行试验,确定最佳添加范围。 (3)酶制剂在面粉中添加过量虽对人体健康不构成危害, 但会影响面粉品质,使面团发粘或变硬,甚至使面团崩 溃,严重影响食品质量。
金属蛋白酶
活性中心:大多数含Zn2+等二价金属。
分布:中性蛋白酶广泛存在于曲霉、芽孢杆菌、链霉菌等中,许多 曲霉生产中性蛋白酶外还产生碱性和酸性蛋白酶及外肽酶。 最适pH:最适pH7~8。
天冬氨酸蛋白酶
最适pH:这类酶的最适pH2.0~5.0,在酸性稳定, 在pH高于6迅速失活。
胃蛋白酶、真菌酸性蛋白酶都是活性中心含天门冬氨酸的 酸性蛋白酶。
蛋白酶在肉类食品中的 应用
内源蛋白酶是引起蛋白质水解的重要因素。
肉类食品氨基酸和小肽,使其具有自身独特的风味,同时这些降 解产物也可以参与香味形成反应如美拉德反应贡献于肉品香味。
内源蛋白酶对肉类食品风味的影响
风味是肉类食品的最重要食用品质之一,在肉类食品的贮存和加工过程中,内 源蛋白酶对风味的形成发挥了重要作用。 风味是通过对摄入口腔的食物的化学感觉而获得的印象,其中包括
