第四章碳氧双键的加成反应1
加成反应

File:Qindian Jiacheng 0541.png
第二步,由于氢已经占据了一侧的位置,溴只能从另外一边进攻。根据马氏规则,溴与2-碳成键,然后氢打向1-碳的一边,反应完成。
马氏规则的原因是,取代基越多的碳正离子越稳定也越容易形成。这样占主导的取代基多的碳就优先被负离子进攻。
在烯烃的亲电加成反应过程中,氢正离子首先进攻双键(这一步是定速步骤),生成一个碳正离子,然后卤素负离子再进攻碳负离子生成产物。立体化学研究发现,后续的卤素负离子的进攻是从与氢离子相反的方向发生的,也就是反式加成。
如丙烯与HBr的加成:
CH3-CH=CH2 + HBr → CH3-CHBr-CH3
此外,端炔的碳碳叁键也可以与HCN等亲核试剂发生亲核加成,如乙炔和氢氰酸反应生成丙烯腈(CH2=CH-CN)。
其他重要的亲核加成反应有:
麦克尔加成
醇醛加成/缩合
Mukaiyama反应
[编辑]亲电加成反应亲电加成反应是烯烃的加成反应,又叫马氏加成,由马可尼科夫规则而得名:烯烃与氢卤酸的加成,氢加在氢多的碳上。广义的亲电加成反应是由任何亲电试剂与底物发生的加成反应。
此外,端炔的碳碳叁键也可以与HCN等亲核试剂发生亲核加成,如乙炔和氢氰酸反应生成丙烯腈(CH2=CH-CN)。
其他重要的亲核加成反应有:
麦克尔加成
醇醛加成/缩合
Mukaiyama反应
[编辑] 亲电加成反应亲电加成反应是烯烃的加成反应,又叫马氏加成,由马可尼科夫规则而得名:烯烃与氢卤酸的加成,氢加在氢多的碳上。广义的亲电加成反应是由任何亲电试剂与底物发生的加成反应。
碳氧双键的加成反应

主讲人 : 杨雪
1
反应机理 羰基的反应活性 醛酮类羰基化合物的加成反应 其它羰基化合物的相关反应
2
一、反应机理
1、可以在酸性条件下进行反应,机理如下:
3
2、也可以在碱性条件下进行反应,机理如下:
二、羰基的反应活性
1、底物的影响 a、电子效应
当羰基上连有吸电子基团时更容易进行亲核加成反应 ClCHO>HCHO>RCHO>CH3COR>RCOOR`>RCONR2`>RCOOb、空间效应 反应中,羰基碳原子由SP2杂化转化为SP3杂化,
为Perkin(浦尔金)反应
反应一般式如下:
OO
ArCHO + RCH2COCCH2R RCH2COO
H COOH C C + RCH2COOH
Ar R
反应机理:
-B RCH2COCCH2R
OO
ArCHO
OO
RCH2COCCHR
RCH2COCCHCHAr
OR
13
Ar
H2CR O CH
C
CHR
O OC
O
CH2CH2COOC2H5 (1) NaOC2H5, C6H6, 80℃
H
CH2CH2COOC2H5 (2) H+, 80%
COOC2H5
2、 α, β-不饱和羰基化合物的加成反应
亲电加成 以丙烯醛与氯化氢的反应为例机理如下:
OH H2C C CH
H
OH
H2C C CH H
OH
H2C C CH H
反应机理如下:
8
半缩醛或半缩酮继续与一分子醇反应形成缩醛或缩酮
9
3、羟醛缩合反应 含有α氢的羰基化合物在酸或碱的催化作用下,
碳碳双键的加成反应

碳碳双键的加成反应加成反应包括,催化氢化、亲电加成、亲核加成和自由基加成。
4.1催化氢化催化氢化分为非均相催化(多相催化)和均相催化。
非均相催化的催化剂为固体,均相催化的催化剂溶于介质成液相,整个反应体系为一相。
4.1.1多相催化氢化氢分子和烯烃吸附在催化剂表面,使n 键和H-H 键断裂,形成金属氢化物和配合物,然后氢原子再分别转移溶剂双键碳原子,故其立体化学为顺式加成,该反应收率高,速度快。
C —C H HI'有时为了提高催化剂的催化性能,常加入惰性载体的活性炭、碳酸钙等。
4.1.2影响催化氢化反应的因素1.温度 (1)升高温度有利于氢化反应,但氢化反应的选择降低。
(2)氢化反应为放热反应,升高温度有利于逆反应,降低转化率。
(3 )升温加速催化剂的失活,增加副反应。
因此,若催化剂有足够的活性时,氢化反应尽可能在低温下进行。
2. 压力增加氢气压力相当于提高氢气浓度,从而有利于氢化的进行,但选择性降低,如 Lindlar 催化剂,常压生成烯,加压为烷烃。
3. 催化剂不同催化剂对同一反应的催化活性不同,同一反应用不同的催化剂,其产物可能不一样。
催化剂的活性与比表面、载体、助催化剂和抑制剂有关,催化剂的比表面越大,活性越高,载 体的作用是提高催化剂的分散度,增加催化剂的稳定性和比表面。
助催化剂能提高催化剂活性,而 抑制剂可部分降低催化剂活性。
_GC — + H 2 PdEaSQ”de 喹啉 / \-H j 吸附H H X C C解吸” C-CsOH 2 Ph —CH=CH CH=CHCCH 2CH 3 —*25 r Ph(CH 2)4COCH2CH 3120C Ph(CH 2)4CHCH2CH 3260 r? OH(CH 2)4CHCH 2CH 3OHI■B AAIUWWVVXJWWWWVW物结构空阻大的底物催化氢化比较困难。
活性(含有电子效应作用的结果)(RCHOH ) >RCH=CHR '(RCH 2CH 2R '>RCOR ' ( RC(OH)HR 'ArCH 2OR (ArCH 3) (RCH 2NH 2)> RCONHR'(RCH 2NHR') > PhH (溶剂的种类和极性,反应体系的酸碱性均能影响催化氢化的反应速度的选择性。
第四章_有机合成

影响烯醇负离子形成的区域选择性的因素包括: (1)α-H的酸性
(2) Bronsted 碱的碱性
(3)非质子性溶剂可以减少烯醇负离子的逆反应,有 利于动力学控制产物的形成。
O S CH3 CH3 DM SO
O HCCH3
CH3 DM F
N(CH3)2
CH2OCH3
O P N(CH3)2
O N
2 与亲电烯的反应 带有酯基、氰基、硝基等吸电子基团的烯烃称为亲电烯,
其能与硫叶立德发生环丙烯化反应
硫叶立德在低温下与α,β-不饱和酮反应生成环氧化 合物,而亚砜型硫叶立德则在较高的温度下与α,β-不饱 和酮反应生成三员碳环化合物。
热力学控制
动力学控制
2 二甲亚砜负离子作为中间体的化学反应
二甲亚砜是非常弱的酸,必须用强碱如NaH除去质子形 成负离子。
a. Wittig 反应可以用于制备合成能量上不利的环外双键化合物 的合成。
b. 当与α,β-不饱和羰基化合物作用时,不会发生1,4-加成。 十分适合于合成萜类、多烯类化合物
c. 反应具有立体选择性。在非极性溶剂中,稳定的磷叶立德
与醛反应优先生成反式烯烃;而活泼的磷叶立德则优先生成 顺式烯烃。
动力学控制 热力学控制
4 与卤代烃的偶合反应
C 2 H 5 M g B rC H 2 C H C H 2 B r C 2 H 5 C H 2 C H C H 2 9 4 %
三 有机铜化合物在合成中的应用
有机铜锂试剂较相应的烷基锂碱性、亲核性弱,与孤立的羰基 酯基、羧基等不反应,但其可以与卤代烃或磺酸酯发生亲核取代 反应,并使环氧乙烷开环,而且还可以与α,β-不饱和羰基化合 物发生共轭加成。
在惰性溶剂(如氯仿、二氯甲烷、乙醚、苯)中,烯烃与 过氧酸(如过氧苯甲酸、间氯过氧苯甲酸、过氧三氯乙酸、过 氧乙酸)反应生成环氧化合物,反应具有立体选择性。过酸通 常优先作用于空间障碍小的一边,并得到顺式加成物。
烃的衍生物

三、乙醛的化学性质
NaOH必须过量
演示实验: 在试管中加入10%的NaOH溶液2ml,滴入2%的 CuSO4溶液4-6滴,振荡后加入乙醛溶液0.5ml, 加热至沸腾,观察现象 现象:产生砖红色沉淀
注意:反应须 在碱性条件下 进行,且加热 温度不宜过高
(4) 被弱氧化剂氧化
②与新制氢氧化铜的反应
现象: 试管内有砖红色沉淀产生
乙醛在氧化反应中有关计量关系
CH3CHO
[O]
CH3COOH
-CHO—2 Cu(OH)2 2 1
-CHO、Ag(NH3)2OH、Cu(OH)2的物质的量关系
-CHO— 2 Ag(NH3)2OH 2 1
-CHO、Ag、Cu2O的物质的量的关系
-CHO— 2 Ag
-CHO—Cu2O
1
2
1
1
分别写出以下转化反应的方程式。 ?考考你:
CH3
O C H + H2
催化剂
CH3CH2OH
注意:和C=C双键不同的是,通常情况 下,乙醛不能和X2、H2O发生加成反应
有机反应
氧化反应:加O或失H 还原反应:加H或失O
氧化反应与还原反应的比较
CH4
+ 2 O2
点燃
CO2
催化剂
+
加O失H 2 H2O 氧化反应 失H
2CH3CH2OH + O2
• 命名同卤代烃的相似,醛基不存在 位置异构,故要从醛基碳开始编号。 书写时先写烃基部分后写醛。 • 异构分为烃基异构和异类异构。 醛的异构可以是同碳原子数酮或烯 某醇(碳原子数n>2)。 注:甲醛和乙醛没有同分异构体。
4.醛类的化学通性
醛类具有和乙醛类似的化学性质:
人教版初中高中化学选修三第四章《生物大分子》知识点复习(含答案解析)(1)

一、选择题1.下列方程式不正确的是A.工业制取漂白粉:2Cl2 +2Ca(OH)2 =CaCl2 + Ca(ClO)2 +2H2OB.蔗糖水解:C12H22O11(蔗糖)+H2O催化剂−−−−−→2C6H12O6(葡萄糖)C.Mg(OH)2沉淀中滴加盐酸的离子方程式:Mg(OH)2+2H+=Mg2++2H2O+H2O⇌NH3·H2O+H+D.氯化铵水解的离子方程式:NH+4答案:B解析:A.工业上用氯气与石灰乳反应制取漂白粉:2Cl2 +2Ca(OH)2 =CaCl2 + Ca(ClO)2+2H2O,A正确;B.蔗糖水解生成葡萄糖和果糖:C12H22O11(蔗糖)+H2O催化剂−−−−−→C6H12O6(葡萄糖)+ C6H12O6(果糖),B错误;C.Mg(OH)2沉淀中滴加盐酸,只有可溶性强电解质写成离子的形式,所以离子方程式为:Mg(OH)2+2H+=Mg2++2H2O,C正确;D.氯化铵水解生成一水合氨和氢离子,盐类水解是微弱的,存在平衡,离子方程式为:+H2O⇌NH3·H2O+H+,D正确。
NH+4答案选B。
2.古诗词丰富多彩,化学也色彩斑斓。
下列实验能观察到诗句“知否,知否?应是绿肥红.瘦。
”中加点字所指颜色的是A.将浓硝酸滴入含苯环的蛋白质中B.向盛有苯酚稀溶液的烧杯中滴入饱和溴水C.将新制备的Cu(OH)2加入乙醛溶液中并加热D.向盛有苯酚稀溶液的烧杯中滴入FeCl3溶液答案:C解析:是绿肥红.瘦中加点字所指颜色为红色,A.蛋白质的显色反应,遇到浓硝酸变黄色,故A错误;B.苯酚和浓溴水发生取代反应生成三溴苯酚白色沉淀,故B错误;C.乙醛和新制氢氧化铜加热反应生成红色氧化亚铜,故C正确;D.苯酚和氯化铁溶液反应生成络合物为紫色溶液,是苯酚的特征性质,故D错误。
答案选C。
3.科学技术的发展不仅改善了人们的生活,也帮助人类实现“上九天揽月、下五洋采‘冰’”。
下列没有涉及化学反应的是油烯烃A.A B.B C.C D.D答案:C解析:A.厨余污油裂化为航空燃油,则有机物发生了裂化反应,A不符合题意;B.粮食酿醋,是将淀粉水解为葡萄糖,葡萄糖分解为乙醇,乙醇催化氧化为乙酸,B不符合题意;C.开采得到可燃冰,是利用物理方法,将可燃冰从海底开采出来,C符合题意;D.以“煤”代“油”生产低碳烯烃,是先与水蒸气反应制得水煤气,然后合成烯烃,或将煤干馏制得的焦炉煤气分离,以获得烯烃,D不符合题意;故选C。
高中化学(新人教版)选择性必修三课后习题:第四章测评(课后习题)【含答案及解析】

第四章测评(时间:75分钟分值:100分)一、选择题(本题包括10小题,每小题2分,共20分。
每小题只有1个选项符合题意)1.(2019全国卷Ⅱ)“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句,下列关于该诗句中所涉及物质的说法错误的是()A.蚕丝的主要成分是蛋白质B.蚕丝属于天然高分子材料C.“蜡炬成灰”过程中发生了氧化反应D.古代的蜡是高级脂肪酸酯,属于高分子聚合物项,蚕丝的主要成分是蛋白质,蛋白质属于天然高分子,蚕丝属于天然高分子材料,A、B两项正确;“蜡炬成灰”过程中发生了燃烧反应,燃烧反应属于氧化反应,C项正确;古代的蜡烛多是由动物油脂制造,动物油脂属于高级脂肪酸酯,但高级脂肪酸酯不属于高分子聚合物,D项错误。
2.有关天然产物水解的叙述不正确的是()A.纤维素水解与淀粉水解得到的最终产物不同B.可用碘检验淀粉水解是否完全C.蛋白质水解的最终产物均为氨基酸D.油脂水解可得到丙三醇,水解均最终生成葡萄糖,A错误;淀粉遇碘变蓝,可用碘检验淀粉水解是否完全,B正确;蛋白质分子中含—CONH—,水解的最终产物均为氨基酸,C正确;油脂为高级脂肪酸甘油酯,则水解可得到丙三醇,D正确。
3.将淀粉浆和淀粉酶的混合物放入玻璃纸袋中,扎好,浸入流动的温水中,相当长一段时间后,取袋中液体分别与碘水、新制Cu(OH)2(加热)和浓硝酸(微热)作用,其现象为()A.显蓝色、无现象、显黄色B.显蓝色、砖红色沉淀、无现象C.无现象、无现象、显黄色D.无现象、砖红色沉淀、无现象淀粉在淀粉酶作用下经足够长的时间后,完全水解为葡萄糖,故碘水不显蓝色;②葡萄糖是小分子,渗透到袋外水中,袋内无葡萄糖,故与新制Cu(OH)2加热无砖红色沉淀;③淀粉酶属于蛋白质,蛋白质是高分子,留在袋内,遇浓硝酸显黄色。
4.核酸检测是诊断新冠肺炎的重要依据,因为核酸是生命的基础物质,是病毒的“身份证”,所以患者的确诊需要病毒的核酸检验。
高考化学复习教学案:醛、酯的重要性质与拓展

第五课时醛、酯的重要性质与拓展【考纲要求】1.掌握酯的化学性质和同分异构体。
2.掌握银镜反应的原理和醛的其它化学性质及应用。
教与学方案【自学反馈1.乙醛的结构结构式:官能团:2.乙醛的物理性质3.乙醛的化学性质(1)加成反应(碳氧双键上的加成)(2)氧化反应(a) 催化氧化(b)银镜反应【规律】(C)与新制的氢氧化铜反应【规律】【拓展】(d)乙醛被溴水、酸性KMnO4溶液氧化,故使它们褪色。
4.酯的化学性质——水解反应酸性条件:碱性条件:5.同分异构现象一元饱和羧酸与一元饱和醇形成的酯与同碳原子数的羧酸互为同分异构体。
【拓展】写出分子式为C4H8O2的属于酸和酯的同分异构体的结构简式,并分别命名。
6.甲酸酯甲酸酯的通式为:HCOOR,其分子中既有基又有基,所以既表现酯的通性——水解,又能发生醛基的氧化反应(银镜反应、与新制的Cu(OH)2 悬浊液反应)。
【规律】甲酸、甲酸酯、甲酸盐中均含—CHO ,所以都具有醛的通性(加 氢、氧化)。
7.合成酯的方法和途径 (1)链状小分子酯CH 3COOH + HO —CH 2CH3COOCH 2CH 3 + H 2O(2)环酯(3)聚酯(通过羧酸和醇通过缩掉小分子(例如水)二形成的高分子化合物)HOOC —COOH + n HO —CH 2CH 2—n + nH 2O—C —C —OCH2CH 2—O ——O O[]nHO —CH 2—CH 2—n n +HOOC —COOH —C —C —O —CH 2—CH 2—O —OO []n+ 2nH 2O(4)内酯(同一分子中的—COOH 和—OH 脱水而形成的)—CH OHCH —CH 2C=OO+ H 2O(5)无机酸酯(例如硝酸和甘油反应形成的三硝酸甘油酯又叫硝化甘油)CH 2—ONO2CH —ONO 2CH 2—ONO 2CH 2—OHCH —OH CH 2—OH+ 3HO —NO 2+ 3H 2O【注意】无机酸与醇的酯化(酸去氢,醇去羟基)和有机酸与醇的酯化(醇去氢,酸去羟基)反应方式的不同;硝酸酯(硝基连在氧原子上)和硝基化合物(硝基连在碳原子上)的区别。
高中化学 第四章第二节 糖类作业(含解析)新人教版选修5

第二节糖类1.糖是人们日常生活中不可缺少的一类重要物质,下列有关糖类物质的叙述中,正确的是( )A.糖类是有甜味的物质,其中最甜的糖是果糖B.糖类物质由碳、氢、氧三种元素组成,又叫碳水化合物,其分子式都可用C n(H2O)m的通式表示C.淀粉、纤维素都是天然有机高分子化合物,分子式都可以写作(C6H10O5)n,二者互为同分异构体D.糖类一般是多羟基醛或多羟基酮以及能水解产生它们的物质答案 D解析果糖是最甜的糖,但糖类物质并不一定都有甜味,如淀粉、纤维素等不具有甜味,有甜味的也不一定是糖,如糖精等,故A错误;糖类物质又称碳水化合物,但是其分子组成并不一定都是C n(H2O)m,如鼠李糖化学式为C6H12O5,B错误;淀粉、纤维素都是天然有机高分子化合物,分子式都可以写作(C6H10O5)n,但是由于n值不同,所以二者不是同分异构体,C错误。
糖类概述定义:从分子结构上看,糖类是指分子中有两个或两个以上羟基的醛或酮以及水解后可以生成多羟基醛或多羟基酮的有机化合物。
①糖类是由碳、氢、氧三种元素组成的一类有机化合物,大多数糖类的分子组成可用通式C m(H2O)n来表示(m、n可以相同,也可以不同)。
②少数糖类物质如鼠李糖(C6H12O5)不符合上述通式;而少数符合上述通式的有机物不是糖类,如甲醛(CH2O)、乙酸(C2H4O2)等。
③糖类物质不一定有甜味,如纤维素就没有甜味;有甜味的不一定是糖类。
2.下列物质中,属于糖类的是( )答案 C解析糖类的定义为多羟基醛或多羟基酮以及水解能生成它们的物质。
依据定义可以判断C正确。
3.下列关于葡萄糖和果糖的说法错误的是( )A.葡萄糖中含有醛基是还原性糖,而果糖中没有醛基是非还原性糖B.葡萄糖和果糖都能与H2在一定条件下作用生成己六醇C.葡萄糖与乙酸作用生成葡萄糖五乙酸酯D.葡萄糖和果糖都是单糖,互为同分异构体答案 A解析虽然果糖中不含有醛基,但果糖与葡萄糖一样也是还原性糖,A错误;葡萄糖分子中含有5个—OH和1个—CHO,果糖分子中含有5个—OH和1个—CO—,醛基和羰基都能与H2加成,最终均生成己六醇,B正确;葡萄糖分子中含有5个—OH,能与乙酸作用生成葡萄糖五乙酸酯,C正确。
第四章 加成反应

②
4.2.3. 亲核加成反应的实例 1. Wittig 反应
Wittig 试剂与羰基发生亲核加成反应,生成烯烃:
C O
Ph3P C
R R'
R C C R'
2. 羟醛缩合
CH3CHO + CH3CHO
OH
O CH3CHCH2C H OH
3. Claisen 酯缩合反应及相关反应
两个酯分子至少有一个酯分子是含有α-氢,在 强碱的作用下,相互缩合成β-羰基酯。
例如溴与烯烃的加成反应。烯烃与溴首先生成π络合物, 然后Br+对π键进行亲电加成生成三元环状正离子中间体-溴 鎓离子,最后Br-从体积较大的溴鎓离子反面进攻原双键碳 原子之一,生成1,2-二溴化物。
H CH3 Br2 H CH3 Br Br- H CH3 H Br CH3 Br Br H CH3 H CH3 H CH3 H CH3 H Br H Br CH3 -Br- Br CH3
典型代表:Cl2、Br2、I2、HOCl、HOBr等与烯烃的亲 电加成反应。
2、三分子亲电加成
Y
2E
E
Y
C C
+ Y
Y+ C C Y
C C E
E
E
一般来说,烯烃与卤化氢的加成,若生成比较不稳定的 正碳离子时,则倾向于按AdE3历程进行,加成的立体化学 特征是反式加成。
4.1.2 亲电加成反应立体化学
Nu E 顺和反异构体
(1)正碳离子历程
a、若生成的正碳离子中间体的正电荷能够在碳骨架中发生 离域,则有利于按正碳离子历程进行; 典型代表:卤化氢、溴和氯与双键碳原子上连有苯基的烯烃 所进行的加成反应。
解释3,3-二甲基-1-丁烯与卤化氢的加成得到2,3-二甲基2-卤丁烷的历程。
4第四章 碳-碳双键的加成反应

CH3
CH3
亲电加成在有机合成中的应用
形成C-X,C-O,C-C及C-N键
形成C-X键:烯烃与X2、HX、HO-X、I-Cl加成 形成C-O键:烯烃加水(酸性条件)(直接、间
接)主要生成仲、叔醇
烯烃的硼氢化-氧化反应(1/2B2H6/H2O2,OH-)反马氏 加成生成伯醇
炔烃加水/Hg++ ,H+经烯醇式重排为醛或酮 炔烃与醇或羧酸的亲核加成
形成C-C键:(催化剂Lewis酸碱)
简单烯:
SnCl 4
Me3CCl CH 2 CH 2 Me3CCH 2CH 2Cl
AlCl3
C2H5COCl CH 2 CH 2 C2H5COCH 2CH 2Cl
形成C-N键:
R CH CH2 N O2 Cl RCHClCH 2 NO2
Cl C+ CH3 H
Cl CH2 +CH2
(Ⅰ)
(Ⅱ)
稳定性(Ⅰ)>(Ⅱ),p-p共轭
马氏加成:
OR,NH2,NHR,NR2连在双键碳上 电子效应为-I,+C,都是+C>-I,反应活性
增加
马氏加成:
马氏加成规则不适合烯烃的亲核及自由基加 成(如过氧化物存在时,HBr与烯烃加成)
其他氢卤酸(HCl,HI)与烯烃加成,碘自由 基活性太弱,HCl,HF不易生成自由基仍为马 氏加成
硼氢化-氧化反应:
H.C.Brown美国Purdue Uni.(1959) 1979年Nobel price
历程:
不对称烯烃的反马氏加成(加水),制备伯 醇
烯烃与卡宾(碳烯)的加成
+R2C=N=N
药物化学第四章--药物代谢反应-2

含芳环药物的氧化代谢是
以生成酚的代谢产物为主
一般遵照芳环亲电取代反
应的原理,供电子取代基
能使反应容易进行,生成
酚羟基的位置在取代基的
对位或邻位;吸电子取代
基则削弱反应的进行程度,
生成酚羟基的位置在取代
基的间位。
保泰松
8
含强吸电子取代基的芳环药物,如可乐定和丙磺
舒则不发生芳环的氧化代谢。
另一是发生N-氧化反应。
N-脱烷基和氧化脱氨是胺类化合物氧化代谢过程的两个不同
方面,本质上都是碳-氮键的断裂。
在CYP-450酶的作用下,氮原子和碳原子上发生电子转移。
碳-氮键的断裂的条件是与氮原子相连的烷基碳原子上应有氢
原子(即-氢原子),该-氢原子被氧化成羟基,生成的羟基胺是不稳定的中间体,会发生自动裂解。
去甲肾上腺素支气管扩张药特布他林非邻二酚羟基结构当对乙酰氨基酚服用剂量过大时超过了机体中这些小分子的供给能力就会产生药物中毒导致肝中毒结合反应小结药物代谢的影响因素药物在体内的代谢与药物本身的化学结构有密切的关系用动物进行药物代谢的研究的资料不能直接应用到人体身上抗凝血药双香豆乙酯同一人群接受相同剂量的抗抑郁药去甲丙咪嗪后不同个体间血药浓度可相差30倍以上使用相同剂量异烟肼的人群的代谢差异的不同必要时需调节用药量对于新生儿幼儿由于酶系统发育不全氧化代谢结合代谢能力均低于成年人幼儿的葡萄糖醛酸转移酶活性低服用氯霉素后难以与葡萄糖醛酸发生结合代谢有时发中毒反应对乙酰氨基酚在幼儿体内通过硫酸酯结合代谢而对成人则主要进行酚羟基的葡萄糖醛酸苷化结合代谢
美索哒嗪
33
6.醇和醛的氧化
含醇羟基的药物在体内醇脱氢酶的催化下,脱氢氧化得到相
高中化学《醛》教案1 新人教版选修5

醛·教案教学目标知识技能:掌握乙醛的结构式、主要性质及用途。
能力培养:通过物质的结构、性质、用途三者之间的关系,提高形成规律性认识的能力。
科学思想:培养学生严肃认真的实验习惯和科学态度,增强学生对化学知识在实际生产中的重要作用的认识,并增强学生对化学现象与化学本质的辩证认识。
科学品质:通过乙醛银镜反应实验现象,点燃学生对化学的好奇心的火焰,活跃学生思维,产生对化学现象本质的探索欲望。
科学方法:训练学生重视善于运用化学实验手段解决问题,培养学生对具体化学事物从感性知觉到理性思维的科学学习方法。
重点、难点乙醛的分子结构、化学性质及有关化学方程式的正确表示。
你听说过哈哈镜吗?住哈哈镜前一站,镜子里的像变成了很滑稽的模样。
真的,在不同的镜子里,有各式各样的怪相:胖身子、小脑袋、大头娃娃、长脸蛋、瘦高条……其实,在家里就有哈哈镜。
如果你对着暖水瓶瓶胆的脖颈部分照,也会看到哈哈镜里那种引人发笑的相貌。
那是因为镜面凹凸不平,不能平行地反射光线。
由于反射的光线有了偏差,反映到我们的眼睛里就不是原来的模样了。
我们到百货商店买镜子,首先挑玻璃厚薄均匀,镜面平整的。
象哈哈镜那样的镜子,怎么能用呢?说起镜子,也有它的历史。
在三千多年前,我们的祖先就开始使用青铜镜了。
那是将青铜铸成圆盘,打磨得又平整又光洁做成的。
这种青铜镜照出来的人影,并不明亮。
它还会生锈,必须经常磨光。
不过,在没有玻璃镜子的时代,还只能使用它哩。
在三百多年前,玻璃镜子出世了。
将亮闪闪的锡箔贴在玻璃面上,然后倒上水银。
水银是液态金属,它能够溶解锡,变成粘稠的银白色液体,紧紧地贴在玻璃板上。
玻璃镜比青铜镜前进了一大步,很受欢迎,一时竟成了王公贵族竞相购买的宝物。
当时只有威尼斯的工场会制作这种新式的玻璃镜,欧洲各国都去购买,财富象海潮一般涌向威尼斯。
镜子工场被集中到穆拉诺岛上,四周设岗加哨,严密地封锁起来。
后来法国政府用重金收买了四名威尼斯镜子工匠,将他们秘密偷渡出国境。
羰基的加成反应在有机合成中的应用

一、概述羰基的加成反应是有机化学中一种重要的反应类型,具有广泛的应用价值。
本文将探讨羰基的加成反应在有机合成中的应用。
二、羰基的加成反应基本原理1. 羰基的结构特点羰基是含有碳氧双键的有机化合物官能团,一般表示为“C=O”。
羰基通常分为醛、酮和羧酸三种类型,它们具有较强的电性,是有机合成中常见的反应物和产物。
2. 羰基的加成反应羰基的加成反应是指具有亲核试剂(如胺、醇等)与羰基发生亲核加成反应,形成加成产物的过程。
这种反应通常在碱性或酸性条件下进行,产物可以是醇、醛、酮、羧酸等化合物。
三、羰基的加成反应在有机合成中的应用1. 羰基的还原羰基的加成反应可用于醛酮的还原反应,常见的还原试剂有金属氢化物(如氢化钠、氢化铝锂等)和还原醇(如醇、胺等)等。
借助该反应,可以将醛酮还原为相应的醇,扩大有机合成的应用范围。
2. 羰基的羟化反应在羰基的加成反应中,羟胺(氨和水的混合物)可以与醛酮发生羟化反应,形成羟醇。
这种反应被广泛应用于药物合成和其他有机合成领域,具有重要的化学和生物活性。
3. 羰基的羟胺加成在温和的酸性条件下,羟胺可以与羰基形成加成产物。
该反应常用于合成β-羟基酮或β-羟基醛的过程中,产物可以进一步转化为药物分子或生物活性分子。
4. 羰基的羟胺甲酰化在适当的反应条件下,羰基与羟胺发生甲酰化反应,生成羰基甲酰胺。
这种反应在药物合成和有机合成中具有重要的应用价值,可以构建含氨基酰胺结构的化合物。
5. 羰基的醇加成在碱性条件下,醇可以与羰基形成加成产物。
这种反应常用于合成醛醇或酮醇的过程中,产物在有机合成中具有重要的应用价值。
6. 羰基的氧化反应在适当的氧化条件下,羰基可以与氧化剂发生氧化反应,形成羧酸。
这种反应在生物活性分子或有机合成中具有重要的应用价值。
7. 羰基的胺加成在适当的酸性条件下,胺可以与羰基形成加成产物。
这种反应在合成酰胺类化合物中具有重要的应用价值,是有机合成中一种有效的方法。
四、结论羰基的加成反应在有机合成中具有广泛的应用价值,可以用于合成各种类型的有机化合物,包括醇、醛、酮、羧酸等。
2012高考一轮复习 醛、羧酸、脂

D.CH3–CH–CH2–CHO
OH
某有机物的结构简式为
CH2CHO CH2COOH CH2OH
C 它在一定条件下可能发生的反应有 ①加成 ②水解 ③酯化 ④氧化 ⑤中和 ⑥消去 A.②③④ B.①③⑤⑥ C.①③④⑤ D.②③④⑤⑥
◆概念: 酸跟醇起反应,生成的一类化合物。
强调:(1)酸,可以是有机羧酸,也可以 是无机含氧酸,不能是无氧酸。 (2)醇,可以是一元醇,也可以 是多元醇。
1. 乙酸的电离方程式
呈弱酸性
-+ COO
+ H
2. 乙酸与Na2CO3溶液反应 (中和反应) 2CH3COOH + Na2CO3 = 2CH3COONa + CO2↑+ H2O 3. 乙酸 → 乙酸乙酯
CH3COOH
CH3
4、乙酸与乙醇的反应
乙酸乙酯的制取装置
浓H2SO4 CH3COOH + HOC2H5 △ CH3COOC2H5+H2O
a、吸收酯层中混有的乙醇和乙酸 b、降低酯在水中的溶解度, 容易分层。
酸和醇的酯化反应
C2H5OH + HO—NO2
浓H2SO4
C2H5O—NO2 + H2O
硝酸乙酯 CH3COOH + HOCH3
浓H2SO4
CH3COOCH3 + H2O
乙酸甲酯
下列化合物中,既显酸性又能发生酯化反 应和消去反应的是( B) A.HO— —COOH B. CH3CH2–CH– COOH C.CH3C=C–COOH OH
CH3COOC2H5+H2O
H+
CH3COOH+C2H5OH
说明:
1.酯的酸性水解是可逆反应,不完全水解
醛酮的化学性质——羰基上的加成
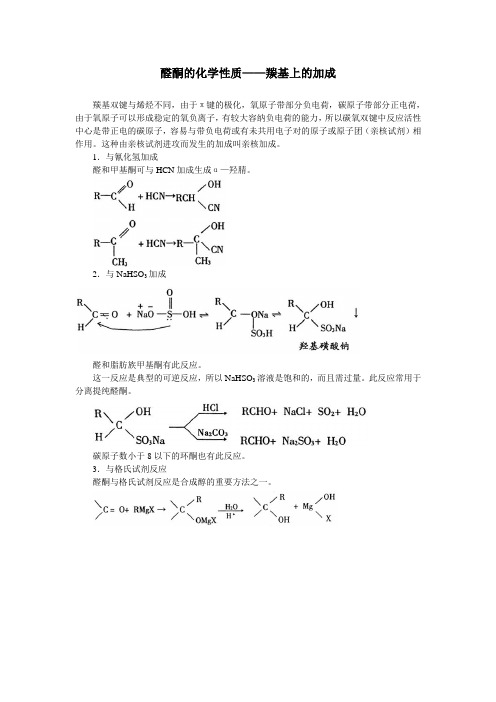
醛酮的化学性质——羰基上的加成
羰基双键与烯烃不同,由于π键的极化,氧原子带部分负电荷,碳原子带部分正电荷,由于氧原子可以形成稳定的氧负离子,有较大容纳负电荷的能力,所以碳氧双键中反应活性中心是带正电的碳原子,容易与带负电荷或有未共用电子对的原子或原子团(亲核试剂)相作用。
这种由亲核试剂进攻而发生的加成叫亲核加成。
1.与氰化氢加成
醛和甲基酮可与HCN加成生成α—羟腈。
2.与NaHSO3加成
醛和脂肪族甲基酮有此反应。
这一反应是典型的可逆反应,所以NaHSO3溶液是饱和的,而且需过量。
此反应常用于分离提纯醛酮。
碳原子数小于8以下的环酮也有此反应。
3.与格氏试剂反应
醛酮与格氏试剂反应是合成醇的重要方法之一。
2021年高中化学选修三第四章《生物大分子》知识点复习(答案解析)(1)

一、选择题1.下列说法正确的是A.植物油和裂化汽油都不能使溴水褪色B.可利用银镜反应证明纤维素在人体内水解的最终产物为葡萄糖C.米酒变酸的过程涉及氧化反应D.变质的油脂有难闻的哈喇味是因为油脂发生了加成反应答案:C解析:A.植物油和裂化汽油均含不饱和键,则均能与溴水发生加成反应使其褪色,A错误;B.人体内没有可以水解纤维素的酶,纤维素在人体内不能水解,B错误;C.米酒变酸的过程中涉及了醇羟基被氧化,最终生成羧基的过程,C正确;D.变质的油脂有难闻的哈喇味是因为油脂被氧化,不是发生加成,D错误;综上所述答案为C。
2.下列说法不正确的是A.用新制的Cu(OH)2悬浊液可以鉴别乙酸,乙醇,葡萄糖B.氨基酸种类较多,分子中均含有-COOH和-NH2,甘氨酸为最简单的氨基酸C.淀粉溶液中加入稀硫酸水解,取样后可以直接加碘水检检淀粉是否水解完全D.油脂在碱性条件下水解的产物中加入热的饱和食盐水,因盐析而在下层析出固体答案:D解析:A.乙酸和新制的氢氧化铜悬浊液可以发生中和反应得到蓝色溶液,乙醇与新制氢氧化铜悬浊液不反应,葡萄糖与新制氢氧化铜悬浊液共热会产生砖红色沉淀,三者现象不同,可以鉴别,A正确;B.氨基酸结构中都含有-COOH 和-NH2两种官能团,甘氨酸为最简单的氨基酸,B正确;C.检验淀粉是否完全水解则需检验是否有淀粉剩余,加入碘水若变蓝则有淀粉剩余,说明没有水解完全,若不变蓝说明水解完全,C正确;D.油脂在碱性条件下水解生成甘油和高级脂肪酸盐,充分反应后加入热的饱和食盐水,甘油易溶于水,高级脂肪酸盐的密度较小,应该在上层析出,D错误;综上所述答案为D。
3.遇到下列情况,采用的措施有误的是()A.将煤气中毒者转移到通风处抢救B.被玻璃割伤手后,先取出伤口里的碎玻璃片,再用稀双氧水擦洗,然后敷药包扎C.炒菜时油锅着火,立即盖上锅盖D.发现家中天然气泄漏,立即打开抽油烟机答案:D解析:A.将煤气中毒者因缺氧窒息,应转移到通风处抢救,以提供充足的氧气,故A措施正确;B.被玻璃割伤手后,先取出伤口里的碎玻璃片,双氧水具有氧化性,能使蛋白质变性,杀死细菌,用稀双氧水擦洗杀菌消毒,然后敷药包扎,故B措施正确;C.炒菜时油锅着火,立即盖上锅盖,隔绝空气,使可燃物不能继续燃烧,故C措施正确;D.可燃性的气体与空气或氧气的混合气体遇明火、静电、电火花或加热可能发生爆炸,打开排气扇会产生电火花,故D措施有误;答案选D。
02加成、消去反应-【化学方程式】高考重要化学方程式汇总

高考重要的有机化学方程式汇总02 加成、消去反应一、典型的加成反应1.碳碳双键的加成反应(1)反应原理:双键变单键,连碳上各加一个原子或原子团(2)反应举例①丙烯与Br2反应:CH3CH=CH2+Br2CH3--CH2Br②丙烯与H2反应:CH3CH=CH2+H2CH3CH2CH3③丙烯与HCl反应:CH3CH=CH2+HCl CH3--CH3或CH3CH2CHCl④丙烯与H2O反应:CH3CH=CH2+H2O CH3--CH3或CH3CH2CHOH 2.二烯烃的加成反应3.碳碳叁键的加成反应(1)普通加成:同碳碳双键①乙炔与Br2反应:CH≡CH+Br2BrCH=CHBr,CH≡CH+2Br2CHBr2-CHBr2②乙炔与H2反应:CH≡CH+H2CH2=CH2,CH≡CH+2H2CH3CH3③乙炔与HCl反应:CH≡CH+HCl CH2=CHCl④乙炔与HCN反应:CH≡CH+HCN CH2=CHCN(2)炔烃与水加成:先加成生成烯醇,再发生自身加成生成醛或酮①CH≡CH+H2O CH3CHO(工业上制取乙炔)②CH3-C≡C-CH3+H2O CH3--CH2-CH3③C≡CH+H2O CH2CHO或-CH3 3.苯环的加成反应(1)加成物质:在催化剂作用下和H2加成(2)加成原理:苯环完全加成变成环己环(3)反应举例①苯的加成:+3H2②甲苯加成:CH3+3H2-CH3③苯酚加成:OH+3H2-OH4.碳氧双键的加成反应(1)醛酮的加成反应:碳氧双键断裂,氧上加氢,碳上加其他部分①乙醛的加成反应②丙酮的加成反应(2)酸羰基、酯羰基、肽羰基:一般不能发生加成反应二、典型的消去反应1.卤代烃的消去反应(1)消去条件:碱的醇溶液,加热(2)消去原理:消卤素原子和β-H形成不饱和键(3)反应举例①溴乙烷的消去:CH3CH2Br+NaOH CH2=CH2↑+NaBr+H2O②1-溴丙烷的消去:CH3CH2CH2Br+NaOH CH2=CHCH3↑+NaBr+H2O (4)特别提醒①卤代烃消去反应产物种类的判断:有几种β-H就有几种消去产物②邻二卤代烃发生消去反应后可能在有机物中引入碳碳三键或两个碳碳双键。
亲核加成反应PPT课件

CH2 COOEt 2 CH3COCH2COOEt NCCH2COOEt RCH2NO2
催化剂:醇钠(钾)、氨基钠、吡啶、三乙胺、季铵碱
第7页/共147页
OO CH3-C-CH2-C-OC2H5 NaOC2H5
OO CH3-C-CH-C-OC2H5
- Na+
O ddC+ C C
1,4-加成
OC2H5 O C=O CH3C-CH C
d+
d-
C
d+
N
d-
(C22H55)。3CN,,7叔1%丁醇
CH3COCHCOCH3 CH2CH2CN
HC
C
d+
C
OC2H5 + CH3COCH2COOC2H5 C2H5ONa
H-C=CH-COOC2H5
d+ d- O
CH3COCHCOOC2H5
d-
第11页/共147页
Micheal反应的应用
OO + O2N
12.1 碳碳双键的亲核加成反应
反应机理:
CC
E Nu
CC
E
引入吸电子基团,降低电子云密度
Nu E
CC
E
CC
Nu
Nu
Y:
CHO COR COOR CONH2
CN NO2
第1页/共147页
SO2R
H C
Ph C
CN
Ph
CN
H
HH
Ph Ph C C
HCN
Ph C C Ph
CN CN
CN
CN CN
苯环分散了负电荷,而且CN的吸电子诱导 效应和共轭效应稳定了碳负离子
C H
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
反应(克拿维纳盖尔反应) 二、Knoevenagel 反应(克拿维纳盖尔反应)
O O
CHO
+
COOEt
哌哌 (81%) COOEt
O CH3NO2
+
C H
N(CH3)2
C5H11NH2
O2NCH2
C H
N(CH3)2 (83%)
CN O COOEt
CN
+
RNH2,HAc
CN COOEt (100%)
22%
由苯甲醛合成萘满酮
CHO O HOOC HOOC 强强 COOEt COOEt
+
CHO
+
H2C COOEt EtONa C COOEt H2 H2 C PPA CH2 CH2
COOEt C C H CH2COOH
H3O+ HOOC
H2/Pt
(75-80%) O
HOOC
四、Darzens 反应
R2C=O + H2O*
R2C-OH O*H
R2C=O*+ H2O
Carbonyl compounds
CH2O CH3CHO CH3CH2CHO (CH3)2CHCHO (CH3)3CCHO CF3CHO C6H5CHO CH3COCH3 FCH2COCH3 CF3COCH3 CF3COCF3 C6H5COCH3
O
R1 强 R2
COOR C COOH H2
COOR R' C CH B O CH 2 C O R''
历历: H2C COOR C COOR H2 R'' R' C C O CH 2 C O B HC COOR C COOR H2 R'
R'' R'
C R''
COOR C CH O CH2 O C OR - OR
K(in water 25C)
2.28x103 1.06 0.85 0.61 0.23 2.9*104 8*10-3 1.4*10-3 0.11 35 1.2*106 9.3*10-6
(3) )
(3) 羰基化合物加成的立体化学 羰基化合物加成的立体化学(Cram规律) 规律) 规律
R R CMe2 H H CMe2 NuO CMe2 NuO CMe2 H H R R OH Nu
O S 主主主 L M 负主主
O H C2H5
CH3
CH3
C6H5
(4)亲核试剂 ) 历程为
H2C X Y O R' C R''
+
B HC X Y
H2C X Y
+
O
BH OH R' C R' CH X Y
+
R'
C R'' CH X Y
+
B
OH R'R'' C CH XY
-H2O R'R''C CXY
Darzens 缩缩: H R C COOR' X B R C COOR' X R' O C R'' R' R C C COOR O X R'' R' R C C COOR' R'' O
O R2C C R' COOR''
1) OH- , H2 O 2) H2 O ,H+ R2C
O
R C OH O
-CO2
第六章碳氧双键的加成反应 第六章碳氧双键的加成反应
前言 (1)加成反应的一般历程 )
O
+ H+
慢
+
OH
Nu快 Nu H 快
+
OH
O
+ Nu慢 Nu
O
OH Nu
大量事实证明了历程(2),因为 能量RO- < R+ 大量事实证明了历程( ),因为 能量 ), 即: 稳定性 RO- > R+
(2) 羰基化合物结构与反应活性 (i) C=O上的取代基的 和+C效应均使羰基活性降低 上的取代基的+I和 效应均使羰基活性降低 上的取代基的
O NuO [ Nu C-C=CO Nu C-C-CO Nu C-C-C]
+
C=C-COH
[H+] Nu C-C=C-
不饱和羰基化合物能够发生亲核加成, α,β-不饱和羰基化合物能够发生亲核加成,也由于中间 不饱和羰基化合物能够发生亲核加成 体因共振而稳定。 体因共振而稳定。
O C6H5-CH=Ch-C-C6H5 + RMgX OMgX C6H5-CH-CH=C-C6H5 R 结结 O
.
R C CH2CH2NR2' KCN-H2O
+
HNR2'
.
H Cl
所以, 反应可以生成比原来酮多一个碳的α 所以,Mannich反应可以生成比原来酮多一个碳的α,β- 不 反应可以生成比原来酮多一个碳的 饱和酮,生成氨基醇,生成酮酸。 饱和酮,生成氨基醇,生成酮酸。
六、Micheal 缩合 羰基部分: 羰基部分:α,β-不饱和醛酮 不饱和醛酮 活泼氢组分:活泼亚甲基化合物, 活泼氢组分:活泼亚甲基化合物,其他亲核试剂 催化剂:有机碱,无机碱,乙醇钠,哌啶, 催化剂:有机碱,无机碱,乙醇钠,哌啶,KOH等。 等 1。反应机理: α,β-不饱和羰基化合物是一个π-π共轭体系,降低了C=C -不饱和羰基化合物是一个 π共轭体系,降低了C=C 不饱和羰基化合物是一个π 双键的亲电加成活性,却增强了亲核加成的可能性。 双键的亲电加成活性,却增强了亲核加成的可能性。
O
乙醛酸代替甲醛的Mannich反应:
O O CHO COOH HOAl O H N C C C H2 COO
+
O
C CH3
+ 2N
O
H N O
-
H C C C COOH H2 N O
Manich 盐的反应:
O R C CH2CH2 N R2' H Cl O R C C CH2 H O OHH Pt O R C C C CN H2 H2 O 脱水 R C C C CH2COOH H2 H2 OH R C C C NR2 H H2 H2
O O O O
R-CH=O > R-CR'=O >R-C-OR' > R-C-OH > R-C-NH2 > R-C-O-
(ii) 同一羰基中,R为-I,使羰基电子云密度降低,活性增强: 同一羰基中, 为 ,使羰基电子云密度降低,活性增强:
Cl3CCHO > Cl2CHCHO > ClCH2CHO > CH3CHO
Nu OH
Cram 规律:羰基与手性羰原子直接相连,手性碳另外三个原 规律:羰基与手性羰原子直接相连, 子分别为L, 反应物起反应时,羰基在M 之间, 子分别为 M, S, 反应物起反应时,羰基在 和S之间,这时 之间 官能团周围位阻最小,试剂从S边进攻羰基 边进攻羰基。 官能团周围位阻最小,试剂从 边进攻羰基。
缩合) 一、羟醛缩合(Aldol 缩合) 羟醛缩合( (1)碱催化
kOH 2 CH3CH2CH2CHO H CH3CH2CH2 C C CH3 CHO OH
(75%)
O CH3C C C CH3 H CH3
CH3C C C CH3 HAc H2 CH3
+
(CH2O)3
+
(CH3)2NH . H Cl
H2 O
+
Me2NCH2
CH3 (33%)
O H3C C CH(CH3)2
+
(CH2O)3
+
HN(CH3)2 H Cl
.
O H3C C
CH3 CH3 CH2NMe2 O
+
Me2NCH2CH2C CH Me Me
以伯胺发生的反应—托品酮(Tropinone)的合成
- H Cl
C C C N H2 H2
O N H
H
+
OH N CH2 N CH2
+
+
H C H
+ N CH2
N CH2
+
: OH
+
C CH2
+ OH
N C C C H2 H2
-H
+
O N C C C H2 H2
OH
亲亲亲亲
N CH2+
+OH N C C C H2 H2
+
C CH2
-H
+
仲胺可为其盐酸盐,加热放出HCl,做催化剂,甲醛可用 其水溶液,在酸性条件下,释放甲醛,活泼H化合物如: 酮、醛、酸、酯、腈、硝基烷、炔、酚类化合物等
小结: 小结: 四种反应均属于活泼氢组分对羰基组分的缩合,也是由负 碳离子对羰基的加成反应,所不同的是活泼氢组分不同。 •羟醛缩合是醛酮自身作为活泼氢组分。 羟醛缩合是醛酮自身作为活泼氢组分。 羟醛缩合是醛酮自身作为活泼氢组分 •Knoevenagel反应是以活泼亚甲基化合物为活泼氢组分 反应是以活泼亚甲基化合物为活泼氢组分 •Stobbe 反应以丁二酸酯为活泼氢组分 •Darzens缩合以α-卤代酸酯为活泼氢组分 缩合以α 缩合以 卤代酸酯为活泼氢组分
OH R2C C R'
O R2CH C R'
O
+
ClCH2COOEt
t-BuOK O
COOEt
1)OH / H2 O 2)H2 O/H+
