高中化学知识点总结之常见离子检验
高中化学常考离子的检验方法

1O .Fe 。 。 ‘
性 高 锰 酸钾 溶 液 , 震荡 , 若 溶 液紫红 色褪 去 , 则 待 测 溶 液 中 含
②用 氧 化 性 试 剂 : 取少 量 待 测 液 于 试 管 中 , 滴 加 少 量 的 酸
注 意 问题 : 除上述方法外 , 还 可利用 F e 的还原性 , 如 用
变色氧化剂高锰酸钾溶液. 但要具体情况具 体分析 , 因 能 使 高
锰 酸 钾 溶 液 褪 色 只能 证 明 有 还 原 性 物 质 存 在 , 不 能 证 明 溶 液
有 C 0; 一 .
理
T 匕
试剂 : Na 0H 溶 液 、 新制氯水或双氧水 、 K S C N溶液.
检验 方 法 : 方 法 ① 直 接 观察 外 观 , 含 F e 的 溶 液 为 浅
绿色.
注意问题 : 针对未 知溶液 , 稀盐 酸和 B a C 1 溶 液 的滴 加 顺 序不 能调 转 , 因先 要 排 除 HC O  ̄ -的可 能性 , 再排除 s 0 i 一的 干 扰, 若 题 目 中有 条 件 限 制 , 则c ( ) ; 的 检 验 可 适 当简 化 .
4 . S 0; 一
方法②取少 量待 测液 于试 管 中, 滴 加少 量 N a OH 溶 液 , 若 有 白 色沉 淀 生 成 , 且 沉淀 迅速 变 成灰 绿 色 , 最 后 变 成 红 褐
色, 则 证 明 溶 液 中有 F e .
学 研
版
干扰 离 子 : C 0 ;、 HS O . 试剂 : 稀盐酸 、 B a C 1 或 C a C 1 z 溶液、 品红 溶 液、 或 者 氧 化
② 利 用 其 漂 白性 : 取 少量待测溶液于试管 中 , 滴 人 几 滴 品 红溶液 , 充分震荡后溶液 红色褪去 , 则 待 测 溶 液 中有 C 1 0 一.
高中化学常见离子检验大全
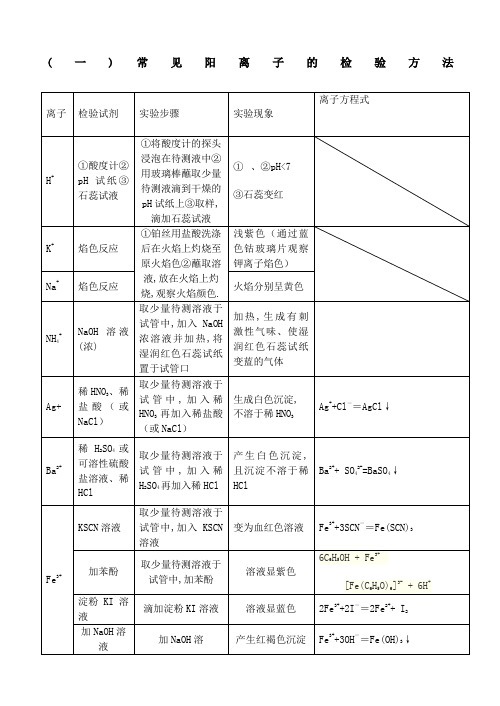
(一)常见阳离子的检验方法离子检验试剂实验步骤实验现象离子方程式Fe2+①KSCN溶液,新制的氯水取少量待测溶液于试管中,加入KSCN溶液,新制的氯水加入KSCN溶液不显红色,加入少量新制的氯水后,立即显红色.2Fe2+ + Cl22Fe3+ + 2Cl-Fe3++3SCN-=Fe(SCN)3②NaOH溶液取少量待测溶液于试管中,加入NaOH溶液并露置在空气中开始时生成白色沉淀,迅速变成灰绿色,最后变成红褐色沉淀.Fe2++2OH - =Fe(OH)2↓4Fe(OH)2十O2+2H2O=4Fe(OH)3③酸性高锰酸钾(无其它还原性物质)取少量待测溶液于试管中,加入酸性高锰酸钾溶液加入酸性高锰酸钾溶液紫色褪去5Fe2+ + MnO4-+8H+5Fe3+ +Mn2++4 H2O④铁氰化钾K3[Fe(CN)6]取少量待测溶液于试管中,加入铁氰化钾溶液产生蓝色沉淀3 Fe2++2[Fe(CN)6] 3- ═Fe2 [Fe(CN)6] 3↓Al3+NaOH溶液取少量待测溶液于试管中,逐滴加入NaOH溶液至过量加入适量NaOH溶液后生成白色沉淀,该沉淀溶于过量NaOH溶液中Al3++3OH-=Al(OH)3↓Al(OH)3+OH-=AlO2-+ 2H2OCu2+NaOH溶液取少量待测溶液于试管中,加入NaOH溶液加入适量NaOH溶液后生成蓝色沉淀Cu2++2OH-=Cu(OH)2↓Mg2+NaOH溶液取少量待测溶液于试管中,加入NaOH溶液加入适量NaOH溶液后生成白色沉淀,该沉淀不溶于过量NaOH溶液中Mg2++2OH-=Mg(OH)2↓(仅用于鉴别Mg2+和Al3+)(二)常见阴离子的检验方法离子检验试剂实验步骤实验现象离子方程式注意:1.若SO42-与Cl-同时检验,需注意检验顺序.应先用Ba(NO3)2溶液将SO42-检出,并滤去BaSO4,然后再用AgNO3检验Cl-.2.检验SO32-的试剂中,只能用盐酸,不能用稀硝酸.因为稀硝酸能把SO32-氧化成SO42-.3.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出并滤去沉淀,然后再用稀硫酸检验Ba2+.4.若Ag+和Ba2+同时检验,也需注意检验顺序,应先用盐酸将Ag+检验出5.若CO32-和HCO3-同时检验,应先用足量的BaCl2溶液将CO32-检出,静置,取上层清夜用Ba(OH)2或Ca(OH)2检出HCO3-。
高中化学常见离子检验大全

②滴入新制CI2,振荡后再滴入淀粉溶液,变蓝
Ag++I=AgIJ
2I-+CI2=I2+2CI-
I2遇淀粉变蓝
CIO-
HCI、淀粉
-KI
取少量待测溶液于试管中,加入HCI溶液,然后加入淀粉-KI溶液
淀粉-KI溶液变蓝
HCI、石蕊
取少量待测溶液于试管中,加入HCI溶液,然后加入石蕊试液
加入稀盐酸后放出的气体使品红溶液褪色
SO32-+2H+=H2O+SO2f
②BaCl2溶液、稀盐酸
取少量待测溶液于试管中,加入
BaCl2溶液再向
沉淀中加入稀盐酸。
加入BaCl2溶
液后生成白色沉淀,沉淀溶于稀盐酸,并放出刺激性气味的气体
SO32-+2H+=H2O+SO2?
离子
检验试剂
实验步骤
实验现象
离子方程式?
加入话量稀盐酸(或稀硫酸)溶液后生成白色沉淀,该沉淀溶于过量酸溶液中
AIO2-+H++H2O—AI(OH)3J
AI(OH)3+3H+—AI3++H2O
Al(OH)3+OH=AlO2-+ 2H2O
Cu2+
NaOH溶液
取少量待测溶液于试管中,加入NaOH溶液
加入话量NaOH
溶液后生成蓝色沉淀
Cu2++2OH=Cu(OH)2J
Mg2+
NaOH溶液
取少量待测溶液于试管中,加入NaOH溶液
加入话量NaOH
溶液后生成白色沉淀,该沉淀不
高中化学中常见离子检验方法总结

高中化学中常见离子检验方法总结高中化学中常见离子检验方法总结一、常见阴离子的检验1.阴离子的初步检验①与稀H2SO4作用,试液中加入稀H2SO4并加热,有气泡产生,可能有CO32-、SO32-、S2-、NO2-或CN-存在,再根据气体的特性不同,再进行判断。
②与BaCl2的作用。
试液中加入BaCl2溶液,生成白色沉淀,可能有SO42-、SO32-、PO43-、S2O32-根据沉淀性质不同进行检验。
③与AgNO3HNO3作用。
试液中加入AgNO3再加入稀HNO3若为白色沉淀为Cl-黄色沉淀可能有I-、Br-和CN-存在,若有黄色沉淀很快变橙、褐色,最后变为黑色,表示有S2O32-存在,Ag2S 为黑色沉淀。
④氧化性阴离子的检验试液用H2SO4酸化后,加入KI溶液和淀粉指示剂,若溶液变蓝,说明有NO2-存在。
⑤还原性阴离子检验a、强还原性阴离子与I2的试验,试液用H2SO4酸化后,加含0.1%KI的I2-淀粉溶液,若其蓝色褪去,可能有SO32-、C2O42-、S2O32-、S2-和CN-等离子存在。
b、还原性阴离子与KMnO4的试验,试液用H2SO4酸化后,加入0.03%KMnO4溶液,若能褪色,可能有SO32-、S2O32-、S2-、C2O42-、Br-、I-、NO2-等离子。
2.个别鉴定反应⑴SO42-加入BaCl2溶液生成BaSO4白色沉淀,该沉淀不溶于稀HCl或稀HNO3Ba2SO42-===BaSO4↓⑵SO32-a、加入BaCl2溶液生成BaSO3白色沉淀,加入稀HCl,沉淀溶解并放出有刺激性气味的气体SO2Ba2SO32-===BaSO3↓BaSO32H===Ba2H2O SO2↑b、加入少量I2-淀粉溶液,蓝色褪去SO32-I2H2O===SO42-2I-2H⑶Cl-加入AgNO3生成AgCl白色沉淀,该沉淀不溶于稀HNO3或稀HCl,但溶于浓NH3·H2OAgCl2NH3·H2O===[Ag(NH3)2]Cl-2H2O⑷Br-a、加入AgNO3生成淡黄色AgBr沉淀,该沉淀不溶于HCl或HNO3中,微溶于浓NH3·H2O。
高中化学之常见离子的检验知识点

高中化学之常见离子的检验知识点Ⅰ常见阳离子的检验:(l)H+能使紫色石蕊试液或橙色的甲基橙试液变为红色。
(2)Na+、K+用焰色反应来检验时,它们的火焰分别呈黄色、浅紫色(通过钴玻片)。
(3)Ba2+能使稀硫酸或可溶性硫酸盐溶液产生白色BaSO4沉淀,且沉淀不溶于稀硝酸。
(4)Mg2+能与NaOH溶液反应生成白色Mg(OH)2沉淀,该沉淀能溶于NH4Cl溶液。
(5)Al3+能与适量的NaOH溶液反应生成白色Al(OH)3絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液。
(6)Ag+能与稀盐酸或可溶性盐酸盐反应,生成白色AgCl沉淀,不溶于稀HNO3,但溶于氨水,生成[Ag(NH3)2]+。
(7)NH4+铵盐(或浓溶液)与NaOH浓溶液反应,并加热,放出使湿润的红色石蓝试纸变蓝的有刺激性气味NH3气体。
(8)Fe2+能与少量NaOH溶液反应,先生成白色Fe(OH)2沉淀,迅速变成灰绿色,最后变成红褐色Fe(OH)3沉淀。
或向亚铁盐的溶液里加入KSCN溶液,不显红色,加入少量新制的氯水后,立即显红色。
2Fe2++Cl2=2Fe3++2Cl-(9)Fe3+能与KSCN溶液反应,变成血红色Fe(SCN)3溶液,能与NaOH溶液反应,生成红褐色Fe(OH)3沉淀。
(10)Cu2+蓝色水溶液(浓的CuCl2溶液显绿色),能与NaOH 溶液反应,生成蓝色的Cu(OH)2沉淀,加热后可转变为黑色的CuO沉淀。
含Cu2+溶液能与Fe、Zn片等反应,在金属片上有红色的铜生成。
Ⅱ常见阴离子的检验:(1)OH-能使无色酚酞、紫色石蕊、橙色的甲基橙等指示剂分别变为红色、蓝色、黄色。
(2)Cl-能与硝酸银反应,生成白色的AgCl沉淀,沉淀不溶于稀硝酸,能溶于氨水,生成[Ag(NH3)2]+。
(3)Br-能与硝酸银反应,生成淡黄色AgBr沉淀,不溶于稀硝酸。
(4)I-能与硝酸银反应,生成黄色AgI沉淀,不溶于稀硝酸;也能与氯水反应,生成I2,使淀粉溶液变蓝。
高中化学常见离子检验汇总大全

⾼中化学常见离⼦检验汇总⼤全⿊龙江省林⼝林业局助考辅导中⼼⾼中化学离⼦检验汇总(⼀)常见阳离⼦的检验⽅法离⼦检验试剂实验步骤实验现象离⼦⽅程式?H+①pH试纸②⽯蕊试液①⽤玻璃棒蘸取少量待测液滴到⼲燥的pH试纸上②取样滴加⽯蕊试液①pH<7②⽯蕊变红K+焰⾊反应①铂丝⽤盐酸洗涤后在⽕焰上灼烧⾄原⽕焰⾊②蘸取溶液,放在⽕焰上灼烧,观察⽕焰颜⾊。
浅紫⾊(通过蓝⾊钴玻璃⽚观察钾离⼦焰⾊)Na+焰⾊反应⽕焰分别呈黄⾊NH4+NaOH溶液(浓) 取少量待测溶液于试管中,加⼊NaOH浓溶液并加热,将湿润红⾊⽯蕊试纸置于试管⼝加热,⽣成有刺激性⽓味、使湿润红⾊⽯蕊试纸变蓝的⽓体Ag+ 稀HNO3、稀盐酸(或NaCl)取少量待测溶液于试管中,加⼊稀HNO3再加⼊稀盐酸(或NaCl)⽣成不溶于稀硝酸的⽩⾊沉淀Ag++Cl-=AgCl↓Ba2+①稀H2SO4或可溶性硫酸盐溶液②稀HNO3取少量待测溶液于试管中,加⼊稀H2SO4再加⼊稀HNO3产⽣不溶于稀硝酸的⽩⾊沉淀Ba2++ SO42-=BaSO4↓Fe3+KSCN溶液加⼊KSCN溶液变为⾎红⾊溶液Fe3++3SCN-=Fe(SCN)3(络合物)加苯酚取少量待测溶液于试管中,加苯酚溶液显紫⾊淀粉KI溶液滴加淀粉KI溶液溶液显蓝⾊2Fe3++2I-=2Fe2++ I2NaOH溶液加NaOH溶液产⽣红褐⾊沉淀Fe3++3OH-=Fe(OH)3↓Fe2+ ①KSCN溶液,新制的氯⽔①取少量待测溶液于试管中,加⼊KSCN溶液,新制的氯⽔①加⼊KSCN溶液不显红⾊,加⼊少量新制的氯⽔后,⽴即显红⾊。
2Fe2+ + Cl22Fe3+ + 2Cl-Fe3++3SCN-=Fe(SCN)3(⼆)常见阴离⼦的检验⽅法注意:1.若SO42-与Cl-同时检验,需注意检验顺序。
应先⽤Ba(NO3)2溶液将SO42-检出,并滤去BaSO4,然后再⽤AgNO3检验Cl-。
2.检验SO32-的试剂中,只能⽤盐酸,不能⽤稀硝酸。
高中化学 离子检验

离子的检验
1.某无色溶液中加入氯化钡溶液后有白色沉淀,该沉淀不溶 于稀硝酸,该溶液中( ) A.一定含有 SO24- B.一定含有 Ag+ C.可能含有 SO24-或 Ag+ D.一定含有 Ag+、SO24- 解析:选 C。加入 BaCl2 后生成的白色沉淀可能是 AgCl,也 可能是 BaSO4,二者均难溶于稀硝酸。
在滤液中滴加 AgNO3 溶液,如果出现白色沉淀,证明有 Cl-。 [答案] B
例题中: (1)写出检测 Cl-、CO23-、OH-的离子方程式。 (2)若先向溶液中加入足量 Mg(NO3)2 时,反应的离子方程式 是什么? 答案:(1)Ag++Cl-===AgCl↓,Ba2++CO23-===BaCO3↓, Mg2++2OH-===Mg(OH)2↓。 (2)Mg2++CO23-===MgCO3↓、2OH-+Mg2+===Mg(OH)2↓。
1.氯离子(Cl-)的检验 (1)反应原理:Cl-+Ag+===AgCl↓(白色)。 (2)可能存在的干扰离子:CO23-。 因为 CO23-+2Ag+===Ag2CO3↓(白色),但 Ag2CO3 能跟硝酸 反应而溶解:Ag2CO3+2HNO3===2AgNO3+CO2↑+H2O。 (3)试剂:AgNO3 溶液、稀硝酸。
(3)取剩余的一份溶液,加适量的硝酸银,观察到有沉淀产生, 该学生由此证明溶液中一定含 Cl-。你认为所得的结论是否 严密?________。理由是_____________________________。 解析:(1)CO23-+2H+===CO2↑+H2O,故产生气泡。 (2)先加入盐酸排除 CO23-的干扰。 (3)有 CO23-、SO24-的干扰,故所得结论不严密。 答案:(1)有气泡产生 (2)盐酸 (3)否 CO23-、SO24-也会和 Ag+生成白色沉淀
高中化学检验各种离子的方法

高中化学检验各种离子的方法1、H+的检验采用试剂:石蕊试液,Na2CO3溶液或pH试纸操作步骤和反应现象: 取含有H+溶液于试管中,滴加Na2CO3溶液有气泡;取溶液用玻璃棒蘸取溶液少量滴到蓝色石蕊试纸或pH试纸上呈红色。
有关离子方程式; 2H++CO32- CO2↑+H2O2、Na+、K+的检验采用试剂:铂丝、HCl操作步骤和反应现象: 取含钠离子的溶液,用烧过的铂丝蘸溶液或固体少许在酒精灯焰上灼烧,观察有黄色火焰;用蘸HCl溶液烧铂丝进行清洗,直到看不出黄色为止,再取K+盐或其溶液在酒精灯焰上灼烧,透过钴玻璃片观察有紫色火焰。
3、NH4+的检验采用试剂:浓HCl、NaOH溶液、红色石蕊试纸操作步骤和反应现象: 取含NH4+的盐或溶液加入浓NaOH溶液后加热,使产生气体接触湿润红色石蕊试纸变蓝或用玻璃棒蘸上浓HCl挨近上述气体时冒大量白烟有关离子方程式或化学方程式:NH4++OH- NH3↑+H2ONH3+H2O NH3•H2ONH3+HCl NH4Cl4、Mg2+检验采用试剂:NaOH溶液操作步骤和反应现象: 含Mg2+的溶液中加入NaOH溶液时生成白色不溶于过量NaOH的沉淀有关离子方程式 Mg2++2OH- Mg(OH)2↓5、Al3+的检验采用试剂:NaOH溶液,HCl溶液操作步聚和反应现象: 在含有Al3+的溶液中滴加少量NaOH溶液产生白色絮状沉淀,过量NaOH溶液沉淀溶解;白色状沉淀也溶于盐酸有关离子方程式:Al3++3OH- Al(OH)3↓Al(OH)3+OH- AlO2-+2H2OAl(OH)3+3H+ Al3++3H2O6、Cu2+的检验采用试剂:NaOH溶液NH3•H2O操作步骤和反应现象: 取含Cu2+的蓝色溶液加入NaOH溶液生成蓝色的沉淀,再加NH3•H2O振荡呈深蓝色溶液有关离子方程式:Cu2++2OH- Cu(OH)2↓Cu(OH)2+4NH3 Cu(NH3)4(OH)27、Fe2+的检验采用试剂:NaOH溶液操作步骤和反应现象: 在含Fe2+溶液中加入NaOH溶液生成白色沉淀,在空气中逐渐变成红褐色沉淀. 有关反应的离子方程式及化学方程式Fe2++2OH-=Fe(OH)2↓(白色)4Fe(OH)2+2H2O+O2=4Fe(OH)3↓(红褐色)8、Fe3+的检采用试剂:NaOH溶液,KSCN溶液操作步骤和反应现象 (1)在含Fe3+溶液中加入NaOH溶液生成褐红色的沉淀,(2)在含Fe3+溶液中滴加KSCN溶液生成血红色溶液。
高中化学离子检验总结

高中化学离子检验总结化学是我们生活中不可或缺的一部分,离子检验是化学实验中的一项重要内容。
离子检验主要通过一系列的化学反应来识别不同的离子,它的结果可以帮助我们确定未知物质的成分。
在高中化学学习中,离子检验是一个重要的实验项目。
本文将对高中化学离子检验进行总结和讨论。
1. 离子检验的基本原理离子检验的基本原理是利用离子之间的化学反应,通过观察反应过程中产生的颜色、沉淀、气体等特征来判断离子的存在与否。
离子检验需要我们准确的实验操作和观察力,同时也需要对化学反应的了解和实验技巧的掌握。
2. 常见的离子检验2.1. 阴离子检验在离子检验中,常见的阴离子包括氯离子、溴离子、碘离子、硫酸根离子、硝酸根离子等。
阴离子检验通常通过化学反应产生特定的沉淀或气体来进行判断。
例如,溴离子可以通过加入溴水或氯水来检验。
溴水与溴离子反应会生成红棕色溴酸根沉淀,而氯水与溴离子反应则会生成淡黄色氯溴离子。
2.2. 阳离子检验常见的阳离子包括铁离子、钠离子、铜离子、银离子、铝离子等。
阳离子检验也需要通过特定的化学反应来进行。
例如,铁离子可以通过添加硫氰化钠溶液来检验。
当硫氰化钠溶液与铁离子反应时,会产生红色的三硫氰合铁离子沉淀。
3. 离子检验的实验操作和注意事项离子检验需要准确的实验操作和观察力,以下是一些实验操作和注意事项:3.1. 实验前的准备在进行离子检验之前,我们需要准备好所需的试剂和设备,同时也需要对实验操作流程进行合理的计划。
3.2. 试剂的准确配制离子检验中使用的试剂需要准确配制,并且要在实验过程中遵循安全操作规范。
不同的试剂可能对人体造成伤害,所以需要戴上实验手套和安全眼镜进行操作。
3.3. 实验条件的控制离子检验的实验条件(例如温度、pH值等)对于实验结果的准确性也非常重要,我们需要控制好温度和酸碱度等因素,以确保实验得出的结论是准确的。
3.4. 结果的观察和记录在离子检验中,我们需要仔细观察反应过程中的变化,例如颜色、气体的产生、沉淀的形成等。
高中化学离子的检验!史上最全!

⾼中化学离⼦的检验!史上最全!本⽂总结了⾼中常见的阴离⼦、阳离⼦的检验⽅法,⽅便学⽣进⾏系统复习。
希望对你有所帮助~阳离⼦1. H+①取样,加⼊锌,产⽣⽆⾊⽓体。
Zn + 2H+=Zn2++ H2↑②取样,加⼊Na2CO3溶液,产⽣⽆⾊⽓体。
③取样,滴加紫⾊⽯蕊试液,变红。
④⽤玻璃棒蘸取少量待测液滴到⼲燥的pH试纸上,pH<>⑤取样,滴加橙⾊的甲基橙试液,变红。
2. Na+、K+、Ca2+⽤焰⾊反应来检验,它们的⽕焰分别呈黄⾊、浅紫⾊(通过钴玻璃⽚)、砖红⾊。
3. Mg2+加⼊NaOH溶液,⽣成⽩⾊絮状沉淀Mg(OH)2,该沉淀不溶于NaOH溶液。
Mg2++ 2OH- = Mg(OH)2↓4. Al3+①加⼊NaOH溶液,⽣成⽩⾊絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液,但不能溶于氨⽔。
Al3++ 3OH- = Al(OH)3↓Al(OH)3 + OH- = AlO2-+2H2O②加⼊氨⽔,产⽣⽩⾊絮状沉淀。
A13++3NH3·H2O= Al(OH)3↓+3NH4+5. Ba2+加⼊稀硫酸或可溶性硫酸盐溶液,⽣成⽩⾊沉淀BaSO4,该沉淀不溶于稀硝酸。
Ba2+ + SO42- = BaSO4↓6. Ag+①加⼊稀盐酸或可溶性盐酸盐,⽣成⽩⾊沉淀AgCl,该沉淀不溶于稀硝酸。
Ag+ + Cl- =AgCl↓②加⼊氨⽔,⽣成⽩⾊沉淀,继续滴加氨⽔,沉淀溶解。
Ag++NH3·H2O=AgOH↓+NH4+AgOH+2NH3·H2O=[Ag(NH3)2]++OH-+2H2O③加⼊NaOH溶液,⽣成⽩⾊沉淀,并迅速变为棕⿊⾊。
Ag++OH-=AgOH↓2AgOH=Ag2O+H2O7. NH4+加⼊浓NaOH溶液,加热,产⽣刺激性⽓味⽓体NH3,该⽓体能使湿润的红⾊⽯蕊试纸变蓝。
8. Cu2+(蓝⾊(浓的CuCl2溶液显绿⾊))①加⼊NaOH溶液,⽣成蓝⾊沉淀Cu(OH)2,加热后可转变为⿊⾊的CuO沉淀。
高中化学检验各种离子的方法

高中化学检验各种离子的方法高中化学是一门重要的自然科学学科,其中离子的检验是非常重要的内容之一。
离子是指具有电荷的化学物质,它们可以通过一些特定的化学反应进行检验。
一、硫酸根离子的检验硫酸根离子是一种常见的阴离子,它可以通过加入钡离子进行检验。
当硫酸根离子和钡离子反应时,会产生一种白色沉淀,这就是硫酸钡。
这个反应可以用来检测硫酸根离子的存在。
二、氯离子的检验氯离子是一种常见的阴离子,它可以通过加入银离子进行检验。
当氯离子和银离子反应时,会产生一种白色沉淀,这就是氯化银。
这个反应可以用来检测氯离子的存在。
三、碳酸根离子的检验碳酸根离子是一种常见的阴离子,它可以通过加入盐酸或硫酸进行检验。
当碳酸根离子和盐酸或硫酸反应时,会产生一种气体,这就是二氧化碳。
这个反应可以用来检测碳酸根离子的存在。
四、铁离子的检验铁离子是一种常见的阳离子,它可以通过加入硫氰化钾进行检验。
当铁离子和硫氰化钾反应时,会产生一种深红色溶液,这就是氰合铁离子。
这个反应可以用来检测铁离子的存在。
五、铜离子的检验铜离子是一种常见的阳离子,它可以通过加入氢氧化钠进行检验。
当铜离子和氢氧化钠反应时,会产生一种蓝色沉淀,这就是氢氧化铜。
这个反应可以用来检测铜离子的存在。
六、铝离子的检验铝离子是一种常见的阳离子,它可以通过加入氢氧化钠进行检验。
当铝离子和氢氧化钠反应时,会产生一种白色沉淀,这就是氢氧化铝。
这个反应可以用来检测铝离子的存在。
以上是高中化学检验各种离子的方法,这些方法在实际化学实验中非常有用,可以帮助我们快速准确地检测各种离子的存在。
在实验中,我们需要注意实验条件,严格按照实验步骤进行操作,以保证实验结果的准确性和可靠性。
离子的检验

一、常见阳离子的检验1、Mg2+:加入NaOH溶液,生成白色沉淀[Mg(OH)2],该沉淀不溶于过量的NaOH溶液.2、Al3+:加入NaOH溶液,生成白色絮状沉淀,该沉淀能溶于盐酸或过量的NaOH溶液,但不能溶于氨水.3、Ba2+:加入稀硫酸或可溶性硫酸盐溶液,生成白色沉淀(BaSO4),该沉淀不溶于稀硝酸.4、Ag+:①加入稀盐酸或可溶性盐酸盐,生成白色沉淀(AgCl),该沉淀不溶于稀硝酸.②加入氨水,生成白色沉淀,继续滴加氨水,沉淀溶解.5、 Fe2+:①加入少量NaOH溶液,生成白色沉淀[Fe(OH)2],迅速变成灰绿色,最终变成红褐色[Fe(OH)3].②加入KSCN溶液,无现象,然后加入适量新制的氯水,溶液变红.6、Fe3+:①加入KSCN溶液,溶液变为血红色.②加入NaOH溶液,生成红褐色沉淀.7、Cu2+:①加入NaOH溶液,生成蓝色沉淀[Cu(OH)2].②插入铁片或锌片,有红色的铜析出.8、NH4+:加入浓NaOH溶液,加热,产生刺激性气味气体(NH3),该气体能使湿润的红色石蕊试纸变蓝.9、H+:①加入锌或Na2CO3溶液,产生无色气体;②能使紫色石蕊试液、pH试纸变红.二、常见阴离子的检验1、OH-:能使无色酚酞、紫色石蕊等指示剂分别变为红色、蓝色;能使红色石蕊试纸、pH试纸变蓝.2、Cl-:加入AgNO3溶液,生成白色沉淀(AgCl).该沉淀不溶于稀硝酸,能溶于氨水.3、Br-:①加入AgNO3溶液,生成淡黄色沉淀(AgBr),该沉淀不溶于稀硝酸.②加入氯水后振荡,滴入少许四氯化碳,四氯化碳层呈橙红色.4、I-:①加入AgNO3溶液,生成黄色沉淀(AgI),该沉淀不溶于稀硝酸.②加入氯水和淀粉试液,溶液变蓝.5、 SO42-:加入BaCl2溶液,生成白色沉淀(BaSO4),该沉淀不溶于稀硝酸.6、SO32-:①加入盐酸或硫酸,产生无色、有刺激性气味的气体(SO2),该气体可使品红溶液褪色.②加入BaCl2溶液,生成白色沉淀(BaSO3),该沉淀可溶于盐酸,产生无色、有刺激性气味的气体(SO2).7、S2-:①加入盐酸,产生臭鸡蛋气味的气体,且该气体可以使湿润的Pb(NO3)2试纸变黑.②能与Pb(NO3)2溶液或CuSO4溶液生成黑色的沉淀(PbS或CuS).8、CO32-:①加入CaCl2或BaCl2溶液,生成白色沉淀(CaCO3或BaCO3),将沉淀溶于强酸,产生无色、无味的气体(CO2),该气体能使澄清的石灰水变混浊.②加入盐酸,产生无色、无味的气体,该气体能使澄清的石灰水变浑浊;向原溶液中加入CaCl2溶液,产生白色沉淀.9、HCO3-:加入盐酸,产生无色、无味的气体,该气体能使澄清的石灰水变浑浊;向原溶液中加入CaCl2溶液,无明显现象.10、NO3-:向浓溶液中加入铜片、浓硫酸加热,放出红棕色、有刺激性气味的气体(NO2).碘钟反应碘钟反应是一种化学振荡反应,其体现了化学动力学的原理。
【高中化学】物质的检验、鉴别知识点总结
【高中化学】物质的检验、鉴别知识点总结!
3、常见有机物的检验:
(1)碳碳双键或三键:加少量溴水或酸性KMnO4溶液,褪色.
(2)甲苯:取两份甲苯,一份滴入溴水,振荡后上层
呈橙色;另一份滴入酸性KMnO4溶液,振荡,紫色褪去.
(3)卤代烷:与NaOH溶液(或NaOH的醇溶液)
共热后,先用硝酸酸化,再滴加AgNO3溶液,产生白色沉淀的为氯代烷,淡黄色沉淀的为溴代烷,黄色沉淀的为碘代烷.
(4)乙醇:将螺旋状铜丝加热至表面有黑色CuO生成,迅速插入待测溶液,反复多次,可见铜丝被还原成光亮的红色,并由刺激性气味产生..
(5)苯酚:滴加过量的浓溴水,有白色沉淀;或滴加少量FeCl3溶液,溶液呈紫色.
(6)乙醛或葡萄糖:加入银氨溶液,水浴加热,产生
银镜;或加入新制Cu(OH)2悬浊液加热至沸腾,有红色沉淀生成.
(7)乙酸:使石蕊试液变红;或加入Na2CO3或
NaHCO3溶液有气泡;或加入新制Cu(OH)2悬浊液溶解得蓝色溶液.
(8)乙酸乙酯:加入滴加酚酞的NaOH溶液加热,红色变浅或消失.
(9)淀粉:滴加碘水,呈蓝色.
(10)蛋白质:灼烧,有烧焦羽毛气味;或加入浓硝酸微热,出现黄色.。
高中化学离子检验总结

高中化学离子检验总结前言离子检验是高中化学实验中非常重要的内容之一。
通过离子检验,我们可以准确地鉴定不同离子的存在与否,从而帮助我们确定未知物质的组成。
在进行离子检验实验时,我们需要熟悉不同离子的特性和检验方法,以及实验中常用的反应方程式。
本文将对常见的离子检验方法进行总结,帮助同学们更好地进行离子检验实验。
阳离子的检验铵离子铵离子是一类氨基阳离子,常见的有NH4+。
我们可以通过加入碱溶液,例如NaOH溶液,在产生氨气的同时,将溶液浓度较小的酸酸化,出现白烟的特性来判断铵离子的存在。
反应方程式:NH4+ + NaOH → NH3↑ + H2O钠离子钠离子是一种常见的单价阳离子,其存在可以通过以下几种方法来检验。
火焰试验将待检物质放在铂丝上,然后将铂丝放入火焰中加热,观察火焰颜色的变化。
钠离子存在时,会发出明亮的黄色光。
沉淀法将待测溶液加入氯化银溶液(AgNO3),如果出现白色沉淀,则表明溶液中含有钠离子。
反应方程式:Na+ + AgNO3 → AgCl↓ + NaNO3钾离子钾离子是一种常见的单价阳离子,其存在可以通过以下几种方法来检验。
火焰试验将待检物质放在铂丝上,然后将铂丝放入火焰中加热,观察火焰颜色的变化。
钾离子存在时,会发出紫色光。
钡氯化物法将待测溶液加入氯化钡溶液(BaCl2),如果出现白色沉淀,则表明溶液中含有钾离子。
反应方程式:2 K+ + BaCl2 → 2 KCl + Ba↓阴离子的检验硝酸根离子硝酸根离子是一种常见的阴离子,其存在可以通过以下几种方法来检验。
铁氰化钾法将待测溶液加入铁氰化钾溶液(K4[Fe(CN)6]),如果出现深蓝色溶液或沉淀,则表明溶液中含有硝酸根离子。
反应方程式:NO3- + 3 K4[Fe(CN)6] → KNO3 + K[Fe(CN)6]↓氯离子氯离子是一种常见的阴离子,其存在可以通过以下几种方法来检验。
银镜反应法将待测溶液加入硝酸银溶液(AgNO3),如果溶液变黑或出现黑色沉淀,则表明溶液中含有氯离子。
高中常见离子检验方法

高中常见离子检验方法
1. 火焰试验:将待检离子溶液挂在锥形玻璃棒上,送入酒精灯火焰中,观察火焰的颜色和特点变化。
2. 沉淀法:将待检离子溶液与特定试剂混合,观察是否生成沉淀或颜色变化。
3. 电化学法:利用电化学方法,如电解或电沉积法来检验离子。
4. 复分析法:通过多种化学反应组合,将待检离子与已知离子进行比较,以确定待检离子的种类和含量。
5. 分光光度法:利用光谱仪测量溶液对特定波长的光的吸收或发射特性,来分析离子的含量和浓度。
6. 离子交换法:利用离子交换树脂对离子交换特性进行分析。
高中化学离子检验知识点总结

高中化学离子检验知识点总结
哎哟喂,说起这高中化学里头头一遭难啃的硬骨头——离子检验,咱得用咱那地道的方言,掺和上点儿英文味儿,给您捋捋清楚。
首先啊,得明白啥是离子检验,不就是瞅瞅溶液里头藏着哪些个“小间谍”嘛!比如说,钠离子Na⁺,检验它简单,整个焰色反应,火烧云一出,那就是它了!氯离子Cl⁻呢,得用银离子Ag⁺来试,生成那白花花的氯化银AgCl沉淀,准没错儿。
再聊聊硫酸根离子SO₄²⁻,这家伙得小心伺候,先用盐酸HCl 赶走碳酸根CO₃²⁻这些个“冒牌货”,再用钡离子Ba²⁺一探,嘿,白色沉淀硫酸钡BaSO₄,稳当当的。
还有啊,铵根离子NH₄⁺,得用碱液NaOH伺候,加热一熏,红石蕊试纸变蓝了,那就是氨气NH₃溜出来打招呼了。
至于那些个铁离子Fe³⁺、亚铁离子Fe²⁺,一个黄一个浅绿,颜色辨认是基础,加深点儿还得用硫氰化钾KSCN或者高锰酸钾KMnO₄来验明正身。
总而言之,离子检验就是场“侦探游戏”,得眼观六路,耳听八方,还得手里有招儿,心里不慌。
掌握了这些个门道,化学海洋里的离子小秘密,还不是手到擒来?。
高中化学常见离子检验大全

Cu2+
NaOH溶液
取少量待测溶液于 试管中,加入
NaOH溶液
加入话量NaOH
溶液后生成蓝色 沉淀
Cu2++2OH J Cu(OH)2J
2+
NaOH溶液
取少量待测溶液于 试管中,加入
NaOH溶液
加入话量NaOH
溶液后生成白色 沉淀,该沉淀不
溶于过量NaOH
生成不溶于稀 盐酸的白色沉 淀
Ba2++ SO42-=BaSO4J
SO32-
①稀盐酸、 品红溶液
取少量待测溶液 于试管中,加入 稀盐酸后放出的 气体通入品红溶 液
加入稀盐酸后 放出的气体使 品红溶液褪色
SO32-+2H+=H2O+SO2?
②BaCl2溶
液、稀盐酸
取少量待测溶液 于试管中,加入BaCl2溶液再向沉 淀中加入稀盐 酸。
浅紫色(通过蓝 色钴玻璃片观察 钾离子焰色)
Na+
焰色反应
火焰分别呈黄色
NH4+
NaOH溶液
(浓)
取少量待测溶液于 试管中,加入NaOH浓溶液并加 热,将湿润红色石 蕊试纸置于试管口
加热,生成有刺 激性气味、使湿 润红色石蕊试纸 变蓝的气体
WH;+0H-十也0
Ag+
稀HNO3、
稀盐酸(或
NaCl)
取少量待测溶液于 试管中,加入稀HNO3再加入稀盐
溶液中
Mg2++2OH—=Mg(OH)2J
(仅用于鉴别Mg2+和Al3+)
(二)常见阴离子的检验方法
必修一化学方程式总结及常见离子检验

必修一化学方程式总结及常见离子检验Company number:【WTUT-WT88Y-W8BBGB-BWYTT-19998】高中化学必修1 化学方程式总结一、教材中涉及的离子检验物质检验的一般步骤:取试样———加试剂———观现象———定结论1、SO42-的检验:取待测液先用稀盐酸酸化,再加BaCl2溶液,若出现白色沉淀,则证明有SO42-2、CO32-的检验:取待测液加稀盐酸,产生无色无味气体,通入澄清石灰水变浑浊;另取待测液加CaCl2溶液有白色沉淀产生。
综合上述两种现象说明有CO32-3、Cl-的检验:待测液先用稀硝酸酸化,再加入AgNO3溶液,若出现白色沉淀,则证明有Cl-4、Na+、K+的检验:用铂丝蘸取待测液,在酒精灯上灼烧,产生黄色火焰,证明有钠元素若产生的火焰透过蓝色钴玻璃观察呈淡紫色,证明有钾元素5、Al3+的检验:在待测液中加NaOH溶液,有白色沉淀产生,继续加过量NaOH沉淀溶解,说明有Al3+6、Fe3+的检验:待测液中滴KSCN溶液,呈红色,说明有Fe3+或者取待测液加NaOH溶液,有红褐色沉淀生成,说明有Fe3+7、NH4+的检验:在待测液中加强碱加热,产生能使湿润的红色石蕊试纸变蓝的气体,说明有NH4+4Na + O2 = 2Na2O(白色) 2Na + O2 Na2O2(淡黄色)2Na + S = Na2S(研磨即爆炸) 2Na + Cl2 2NaCl 2Na + 2H2O = 2NaOH + H2↑ 2Na + 2H2O = 2Na+ + 2OH- + H2↑2Na + 2HCl = 2NaCl + H2↑ 2Na + 2H+ = 2Na+ + H2↑2Na + 2H2O + CuSO4 = Na2SO4+ Cu(OH)2↓ + H2↑6Na + 6H2O + 2FeCl3 = 6NaCl + 2Fe(OH)3↓ + 3H2↑Na2O + H2O = 2NaOH Na2O + CO2= Na2CO32Na2O2 + 2H2O = 4NaOH + O2↑ 2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑2Na2O2 + 2CO2 = 2Na2CO3 + O2(供氧)Na2CO3 +2HCl = 2NaCl + H2O + CO2↑(互滴鉴别) CO32- + 2H+ = H2O + CO2↑NaHCO3 + HCl = NaCl + H2O + CO2↑ HCO3- + H+ = H2O + CO2↑NaHCO3 + NaOH = Na2CO3 + H2O HCO3- + OH- = CO32- + H2ONa2CO3 + H2O + CO2 = 2NaHCO3(鉴别、除杂) CO32- + H2O + CO2 = 2HCO3-2NaHCO3 Na2CO3+H2O+ CO2↑2NaOH + CO2 (少量) = Na2CO3 + H2O 2OH-+ CO2 (少量) = CO32- + H2O NaOH + CO2(过量)= NaHCO3 OH -+ CO2(过量)= HCO3-2Al+6HCl=2AlCl3+3H2↑(同H2SO4) 2Al+6H+ =2Al3+ + 3H2↑2Al + 2NaOH + 2H2O = 2 NaAlO2 + 3H2↑ 2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑Al2O3 + 6HCl = 2AlCl3 + 3H2O Al2O3 + 6H+ =2Al3+ + 3H2OAl2O3+2NaOH=2NaAlO2+H2O Al2O3 + 2OH- = 2AlO2- + H2OAl(OH)3 + 3HCl = AlCl3 + 3H2O Al(OH)3 + 3H+ = Al3+ + 3H2OAl(OH)3 +NaOH=NaAlO2+2H2O Al(OH)3 + OH- = AlO2- + 2H2O2Al(OH)3Al2O3 + 3H2OAlCl3 + 3NH3·H2O = Al(OH)3↓ + 3NH4Cl Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+ NaAlO2+HCl+H2O=NaCl+Al(OH)3↓ AlO2- + H+ + H2O = Al(OH)3↓2NaAlO2 + CO2(少量)+3H2O=2Al(OH)3↓+Na2CO32AlO2- + CO2(少量)+ 3H2O = 2Al(OH)3↓ + CO32-NaAlO2+ CO2(过量)+2H2O=Al(OH)3↓+Na HCO3AlO2- + CO2(过量) + 2H2O = Al(OH)3↓ + HCO3-Al3+ + 3OH- = Al(OH)3↓ Al 3+ + 4OH- = AlO2-+2H2OAlO2- + H+ + H2O = Al(OH)3↓ AlO2- + 4H+ = Al3+ + 2H2O 4Al + 3O2 = 2Al2O33Fe+2O2Fe3O4 2Al2O34Al+3O2↑ 3Fe+4H2O(g)Fe3O4+4H22FeCl3 + Fe = 3FeCl2 2Fe3+ + Fe = 3Fe2+2FeCl2+Cl2=2FeCl3 2Fe2+ + Cl2 = 2Fe3+ +2Cl-2FeCl3 + Cu = 2FeCl2 + CuCl2(用于雕刻铜线路板) 2Fe3+ + Cu = 2Fe2++ Cu2+KAl(SO4)2 = K+ + Al3+ + 2SO42-FeO+ 2HCl = FeCl2 + H2O(同H2SO4) FeO+2H+= Fe2+ +H2OFe2O3 + 6HCl = 2FeCl3 + 3H2O(同H2SO4) Fe2O3 + 6H+=2Fe3+ + 3H2OFe3O4 + 8HCl = 2FeCl3 + FeCl2 +4H2O(同H2SO4) Fe3O4 + 8H+= Fe2+ +2Fe3+ +4H2O FeSO4 + 2NaOH=Fe(OH)2↓ + Na2SO4 Fe2+ + 2OH-=Fe(OH)2↓FeCl 3 + 3NaOH=Fe(OH)3 ↓+ 3NaCl Fe3+ + 3OH-=Fe(OH)3 ↓4Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3 (白色沉淀→灰绿色沉淀→红褐色沉淀)Fe(OH)2 + 2H+=Fe2+ + 2H2O Fe(OH)3 + 3H+ = Fe3+ + 3H 2O2Fe(OH)3Fe2O3 + 3H2O (加热) Fe3++ 3SCN- = Fe(SCN)3 (红色溶液,用于鉴别Fe3+) 2FeCl3 + H2S(少量) = 2FeCl2+ 2HCl + S↓ 2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2↓FeCl3+3H2O Fe(OH)3(胶体)+3HCl C+H2O CO+H2 (生成水煤气)Si + 2NaOH + H2O = Na2SiO3 + 2H2↑ Si+2OH-+H2O= SiO32- + 2H2↑Si+ 4HF = SiF4 + 2H2↑ Si+ 2F2 = SiF4Si+O 2SiO2 (研细的硅与纯氧) Si + C SiC2C+ SiO22CO↑+Si (工业制粗硅)2Cl2+Si= SiCl4 SiCl4 +2H2=Si+4HCl(粗硅提纯)SiO2 + 2NaOH = Na2SiO3 + H2O SiO2 + 2OH- = SiO32-+ H2OCaO+SiO2CaSiO3 SiO2 + 4HF = SiF4 + 2H2ONa2SiO3 +2HCl=2NaCl+H2SiO3↓ Na2SiO3 + H2O+CO 2 = Na2CO3 + H2SiO3↓(强酸制弱酸)Na2SiO3 + H2O+ 2CO2 (过量) = 2NaHCO3+H2SiO3↓SiO2 + Na2CO3Na 2SiO3+ CO2↑ SiO2 + CaCO 3CaSiO3+ CO2↑(工业制玻璃)H2SiO3 + 2NaOH == Na 2SiO3 + 2H2O H2SiO 3 SiO2 + H2OCu+Cl2CuCl2 (棕黄色烟) 3Cl2+2Fe2FeCl3(棕黄色烟) (高价产物)2Na + Cl2 2NaCl (白烟) Cl2 +H22HCl (燃烧苍白色火焰,光照会爆炸)3Cl2 + 2P 2PCl3 (液体) 5Cl2 + 2P 2PCl5(固体) (白色烟雾)Cl2+H2O HCl+HClO (新制氯水成分三分子H2O,Cl2,HClO四离子H+,Cl-,ClO-,OH-) Cl2 + 2NaOH = NaCl + NaClO + H2O2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(工业制漂白粉)漂白粉的漂白原理 Ca(ClO)2+H2O+ CO2(少量) = CaCO3↓+2HClO (强酸制弱酸)漂白粉的失效原理Ca(ClO)2+H2O+CO2(少量) = CaCO3↓+ 2HClO 2HClO2HCl+O2↑2FeCl2 + Cl2 = 2FeCl3 2NaBr + Cl2 == 2NaCl + Br2 2Br - + Cl2 == 2Cl- + Br22KI + Cl2 == 2KCl + I2 2I- + Cl2 == 2Cl- + I2实验室制备氯气 MnO2 + 4HCl(浓) MnCl2+Cl2↑+2H2OMnO2+ 4H + + 2Cl- Mn 2+ + Cl2↑ + 2H2ONaX+AgNO 3=AgX↓+NaNO3(X=Cl,Br,I)(沉淀不溶于HNO3,根据沉淀颜色鉴别卤离子) NaCl + AgNO3 = AgCl↓ + NaNO3 (白色沉淀)NaBr + AgNO3 = AgBr↓ + NaNO3 (浅黄色沉淀) KI +AgNO3 = AgI↓ + KNO3 (黄色沉淀)2Na + S Na2S Fe+S FeS 2Cu+S Cu2S (低价产物)H2 + S H2S S + O2 SO23S + 6NaOH 2Na2S + Na2SO3 + 3H2O 3S + 6OH- 2S2- + SO32- + 3H2OSO2+H2O H2SO3(注意“可逆反应”的定义)2NaOH+ SO2 (少量) = Na2SO3 + H2O NaOH+ SO2(过量)= NaHSO3Ca(OH)2 + SO2 (少量) = CaSO 3↓+ H2O Ca(OH)2 + SO2(过量) = Ca(HSO3)2CaO+ SO2 = CaSO3 2SO2+O2 2 SO3Cl2+SO2 +2H2O=H2SO4+2HCl (同Br2、I2) Cl2+SO2 +2H2O= 4H+ + SO42- + 2Cl-2H2S + SO2= 2H2O + 3S↓SO3+H2O=H2SO 4 CaO+ SO3 = CaSO42H2S + O2(少量) 2H2O+2S 2H2S + 3O2(足量) 2H2O + 2SO2FeS + 2HCl = H2S↑ + FeCl2 (同H2SO4,实验室制备H2S)4FeS2+11O22Fe2O 3 + 8SO2 SO2+O2 2SO3 SO3+H2O=H2SO4(工业制硫酸)N2+3H22NH3(工业合成氨)N 2+O22NO N2 + 3Mg Mg3N22NO + O2 = 2NO2 2NO2 N2O4 3NO2+H2O = 2HNO 3+NO4NO+3O2+2H2O=4HNO3 4NO2+O2+2H2O=4HNO3Na2SO3+H2SO4=Na2SO4+SO2+H2O(实验室制备SO2)2Na2SO3 + O 2 = 2Na2SO4 SO2(少量) + 2NH3 + H2O = (NH4)2SO3NH3+H2O NH3·H2O NH4++OH-NH3 + HCl = NH4Cl(白烟) NH3 + HNO3 = NH4NO3(白烟) 2NH3 + H2SO4 = (NH4)2SO44NH3+5O2 4NO+6H2O 2NO + O2 = 2NO2 3NO2+H2O=2HNO3+NO(工业制硝酸)NH4Cl NH3↑+HCl↑ NH4HCO3NH3↑+ H2O +CO2↑(NH4)2SO 4 + 2NaOH Na2SO4 + 2NH3↑+ 2H2O (用于检验NH4+)2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑+2H2O(实验室制氨气)2H2SO4(浓) + Cu CuSO4 + 2H2O + SO2↑ 2H2SO4(浓) +Zn = ZnSO4 + 2H2O + SO2↑6H2SO4(浓) + 2Fe Fe2(SO4)3 + 6H2O + 3SO2↑ (Fe少量)2H2SO4(浓) + C CO2↑ + 2H2O + 2SO2↑ 2H2SO4(浓) + S 2H2O + 3SO2↑H2S + H2SO4(浓)= S↓+ SO2↑+ 2H2O 2HBr + H2SO4(浓)= Br2 + SO2↑+ 2H2O 4HNO3 4NO2↑ + O2↑ + 2H2O(硝酸显黄色的原因)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O Cu + 4H+ + 2NO3- = Cu2+ + 2NO2↑ + 2H2O3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O 3Cu + 8H+ + 2NO3- = 3Cu2+ + 2NO↑ + 4H2O 6HNO3(浓) + Fe Fe(NO3 )3+ 3H2O + 3NO2↑8HNO3(稀) + 3Fe(足量)= 3Fe(NO3)2+2NO↑+4H2O4HNO3(稀) + Fe(少量)= Fe(NO3)3 + NO↑ + 2H2OC + 4HNO3(浓) CO2↑ + 4NO2↑ + 2H2O。
高中化学常见离子检验篇

常见物质性质小结之离子检验篇下面这些,完全可以在化学推断题、实验设计题中直接使用;像亚铁离子这种有多种检验方法的,一般情况下选用第一种,有时候可用第二种,第三种等如实验条件限制,原溶液中所含离子颜色干扰等一、阳离子1.氢离子H+:取少量溶液,滴加紫色石蕊试液或甲基橙试液,溶液显红色,则可证明溶液中含有氢离子;2.钠离子Na+:焰色反应,火焰呈黄色;3.钾离子K+:焰色反应,透过蓝色钴玻璃观察,火焰呈蓝色;4.钡离子Ba2+:取少量溶液,加稀盐酸酸化,无明显现象排除Ag+,再滴加稀硫酸,析出不溶于稀硝酸的白色沉淀,则可证明溶液中含有钡离子;5.镁离子Mg2+:取少量溶液,滴加NaOH溶液,析出白色沉淀且沉淀溶于NH4Cl溶液,则可证明溶液中含有镁离子;6.铝离子Al3+:取少量溶液,逐滴滴加NaOH溶液,先析出白色絮状沉淀,然后沉淀消失,则可证明溶液中含有铝离子;7.银离子Ag+:取少量溶液,滴加稀盐酸,析出不溶于稀硝酸的白色沉淀,则可证明溶液中含有银离子;8.铵离子NH4+:取适量溶液,加入浓的NaOH溶液并加热,放出能使湿润的红色石蕊试纸变蓝的刺激性气味气体,则可证明溶液中含有铵离子;9.亚铁离子Fe2+:①取少量浅绿色溶液,滴加NaOH溶液,先生成白色沉淀,迅速变为灰绿色,最后沉淀变为红褐色,则可证明溶液中含有亚铁离子;请注意“先”“迅速”“最后”,不要更改②取少量浅绿色溶液,加入KSCN溶液,不显红色,滴加少量新制氯水,溶液立即显红色或血红色,则可证明溶液中含有亚铁离子;10.三价铁离子Fe3+:①取少量黄色溶液,滴加KSCN溶液,溶液变为血红色,则可证明溶液中含有三价铁离子;②取少量黄色溶液,滴加NaOH溶液,生成红褐色沉淀,则可证明溶液中含有三价铁离子;11.铜离子Cu2+:取少量蓝色溶液,加入NaOH溶液,生成蓝色沉淀,沉淀加热后变为黑色,则可证明溶液中含有铜离子;二、阴离子1.氢氧根OH-:①取少量溶液,滴加无色酚酞试液,溶液显红色,则可证明溶液中含有氢氧根;②取少量溶液,滴加紫色石蕊试液,溶液显蓝色,则可证明溶液中含有氢氧根;③取少量溶液,滴加橙色甲基橙试液,溶液显黄色,则可证明溶液中含有氢氧根;2.氯离子Cl-:取少量溶液,滴加AgNO3溶液,生成不溶于稀硝酸的白色沉淀,则可证明溶液中含有氯离子;3.溴离子Br-:取少量溶液,滴加AgNO3溶液,生成不溶于稀硝酸的淡黄色沉淀,则可证明溶液中含有溴离子;4.碘离子I-:①取少量溶液,通入氯气,再滴加淀粉溶液,溶液显蓝色,则可证明溶液中含有碘离子;②取少量溶液,滴加AgNO3溶液,生成不溶于稀硝酸的黄色沉淀,则可证明溶液中含有碘离子;5.硫酸根SO42-:取少量溶液,先加入稀盐酸,无明显现象排除Ag+,再加入氯化钡溶液,生成不溶于稀硝酸的白色沉淀,则可证明溶液中含有硫酸根;6.亚硫酸根SO32-:①取少量溶液,滴加氯化钡溶液,有白色沉淀生成,加入稀盐酸后会有可使品红溶液褪色的刺激性气味气体,则可证明溶液中含有亚硫酸根;②取少量溶液,加入浓硫酸不可用浓盐酸或浓硝酸,有刺激性气味气体逸出,且该气体能使品红溶液褪色,则可证明溶液中含有亚硫酸根;7.碳酸根CO32-:取少量溶液,加入稀盐酸有无色无味的气体生成,且该气体能使澄清石灰水变浑浊,则可证明溶液中含有碳酸根;。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
①Ag++ I-=AgI↓
②2I-+ Cl2=I2+ 2C1-
③2I-+ Cl2=I2+ 2C1-
NO3-
被检物的浓溶液(或晶体) + H2SO4(浓) +Cu并共热
有红棕色气体产生
Cu + 4H++ 2NO3-=Cu2+
+ 2NO2↑+ 2H2O
SO32-
稀盐酸或稀硫酸
放出无色有刺激性气味、能使品红试液褪色的气体
SO42-
BaCl2[或Ba(NO3)2溶液]、稀HNO3
生成白色沉淀,该沉淀不溶于稀HNO3
Ba2++ SO42-=BaSO4↓
Cl-
AgNO3溶液、
稀HNO3
生成白色沉淀,此沉淀不溶于稀HNO3
Ag++ Cl-=AgCl↓
Br-
①AgNO3溶液、
稀HNO3
②新制的氯水、四氯化碳
①生成浅黄色沉淀,此沉淀不溶于稀HNO3
Ag+
①盐酸或氯化物+稀HNO3
②NaOH溶液
③氨水
①生成白色沉淀,白色沉淀不溶于稀HNO3
②生成白色沉淀,并迅速变为棕黑色
③生成白色沉淀,过量的氨水使沉淀溶解
①Ag++ C1-=AgCl↓
②Ag++ OH-=AgOH↓
2AgOH=Ag2O + H2O
③Ag++2NH3·H2O=
AgOH↓+ 2NH4+
高中化学知识点总结之常见离子检验
(1)常见阳离子的特征反应和检验方法.
阳离子
检验试剂
实验现象
离子方程式
H+
①紫色石蕊试液
②橙色甲基橙试液
③锌片(或铁片)
①石蕊试液变红色
②甲基橙试液变红色
③有能燃烧的气体产生
Zn + 2H+=Zn2++ H2↑
K+
焰色反应
紫色(透过蓝色钴玻璃)
Na+
焰色反应
黄色
NH4+
实验现象
离子方程式
OH-
①无色酚酞试液
②紫色石蕊试液
③甲基橙试液
①酚酞试液变红色
②紫色石蕊试液变蓝色
③橙色甲基橙试液变黄色
CO32-
稀盐酸(或硫酸、硝酸)、澄清石灰水
加入酸后,有无色、无味的气体产生,该气体能使澄清石灰水变浑浊
CO32-+ 2H+=CO2↑+ H2O
CO2+ Ca(OH)2=CaCO3↓+ H2O
4Fe(OH)2+ O2+ 2H2O=4Fe(OH)3
②2Fe2++ C12=2Fe3++ 2Cl-
Fe3++ 3SCN-=Fe(SCN)3
Fe3+
①NaOH溶液
②KSCN溶液
①生成红褐色沉淀
②生成红色溶液
①Fc3++ 3OH-=Fe(OH)3↓
②Fe3++ 3SCN-=Fe(SCN)3
Cu2+
①NaOH溶液
SO32-+ 2H+=SO2↑+ H2O
Mg2+
NaOH溶液
产生白色絮状沉淀,过量的NaOH溶液不能使沉淀溶解
Mg2++2OH-=Mg(OH)2↓
Ca2+
Na2CO3溶液+稀盐酸
产生白色沉淀,沉淀溶于稀盐酸中
Ca2++ CO32-=CaCO3↓
CaCO3+2H+=Ca2++ CO2↑+ H2O
(2)常见阴离子的特征反应和检验方法.
阴离子
检验试剂
NaOH溶液(浓)
加热,产生有刺激性气味、使湿润红色石蕊试纸变蓝色的气体
NH4++ OH-=NH3↑+ H2O
Fe2+
①NaOH溶液
②新制的氯水+KSCN溶液
①生成白色沉淀,迅速变为灰绿色,最后变成红褐色
②滴加新制的氯水,溶液由浅绿色变为黄色,再滴加KSCN溶液,溶液呈红色
①Fc2++ 2OH-=Fe(OH)2↓
②浓氨水
①生成蓝色絮状沉淀,加热后变成黑色
②生成的蓝色沉淀,溶于过量浓氨水中,呈深蓝色溶液
①Cu2++2OH-=Cu(OH)2↓
Cu(OH)2CuO + H2O
②Cu2++ 2NH3·H2O=
Cu(OH)2↓+ 2NH4+
Cu(OH)2+ 4NH3·H2O=
[Cu(NH3)4]2++2OH-
+4H2O
②溶液由无色变为橙色,加CCl4振荡后,CCl4层变为橙红色
①Ag++ Br-=AgBr↓
②2Br-+ Cl2=Br2+ 2C1-
I-
①AgNO3溶液、
稀HNO3
②新制的氯水、四氯化碳
③新制的氯水、淀粉溶液
①生成黄色沉淀,此沉淀不溶于稀HNO3
②溶液由无色变为黄色,加CCl4振荡后,CCl4层显紫红色
AgOH + 2NH3·H2O=
[Ag(NH3)2]++ 2H2O
Al3+
①氨水
②NaOH溶液
①产生白色沉淀
②产生白色胶状沉淀,过量的NaOH溶液使沉淀溶解
①A13++3NH3·H2O=
Al(OH)3↓+3NH4+
②A13++ 3OH-=Al(OH)3↓
A1(OH)3+ OHቤተ መጻሕፍቲ ባይዱ=A1O2-+ 2H2O
