高中化学 第三讲 配合物竞赛
高中化学 第三讲 配合物竞赛

第三讲配合物赛点回顾与展望配合物化学一般是指金属原子或金属离子同其他分子或离子发生配位反应的化学,现代配位化学研究领域远远突破了无机化学范围,它涉及金属有机化学、催化机理、物质结构、生命科学和材料科学等,正在成为一门充满活力的边缘学科,应用极为广泛,如核原料和核反应堆材料的生产,超导材料,纳米材料,表面加工工艺,稀土金属的提取与分离,半导体,激光材料的分离与提纯,新药制备与提纯,海水淡化,稀土农业,沙尘暴的防治,沙漠的开发利用等等,国内、国际化学竞赛题涉及的内容也较广泛,但都立足于基础概念与基本原理,如组成、结构、稳定性、综合平衡、反应规律、异构现象、运用原理解释日常生活、社会热点问题,今后测试走向既有连续性,又有新意,新意不外乎原理的重组,综合性、智能性要求更高而已,万变不离其宗,扎实基础,灵活运用,就能永立潮头。
一、配合物(一)基本概念1、配合物2、配合物组成(1)中心体,是配合物的核心成分,该核心叫中心体或形成体。
(2)配合体,向中心体提供电子对的原子、分子或离子的微粒。
常见的配位体分类(3)配位数:向中心体提供电子形成配位键的数目。
3、配合物的分类4、配合物的命名:含阴离子的配合物,先内界后外界;含阳离子的配合物,先外界后内界。
内蜀命名:配体数目(汉字表达)→配体名称→合→中心体名称(用罗马字母标出化合价),如:Na3AlF6:六氟合铝酸钠(中心体无变价可不标),俗名冰晶石。
K4[Fe(CN)6]:六氰合铁(Ⅱ)酸钾,俗名亚铁氰化钾,又名黄血盐K3[Fe(CN)6]:六氯合铁(Ⅲ)酸钾,俗名铁氰化钾,又名赤血盐H2SiF6:六氟合硅酸,俗名氟硅酸(二)配合物结构3、几何异构几何异构是指化学组成相同,仅仅由于配体围绕中心离子的位置不同而产生的结构、性质不同的几何体。
最常见的有顺式、反应式两种异构体。
如:PtCl2(NH3)2有两种几何异构体:另外,八面体构型有其他多种类型的几何异构体,如[PtBr3(NH3)3]+有下图:两种几何异构体。
化学竞赛 配合物课件

(二)几何异构
几何异构:化学组成相同的形成体与配体在空 间的位臵不同而产生的异构现象。 二氯二氨合铂
顺式(cis)
反式(trans)
顺反异构
顺式(cis) 橙黄色,溶解度较大 反式(trans) 亮黄色,溶解度较小
O H2N N OH N N NH2 O O N N O
9、乙二胺 10、草酸根 11、西佛碱 水杨醛与邻苯二胺或乙二胺(三亚乙 基四胺)
2
2
N N
N N
N N
N N
卟吩基
酞箐基
NH N
N HN
HOOCH2C NCH2CH2N HOOCH2C
CH2COOH CH2COOH
过氧根ቤተ መጻሕፍቲ ባይዱ子
配位数 配位数的影响因素 配位数的影响因素 形成体的电荷:Pt(II)、Pt(IV) 形成体半径:AlF63–、BF4– 配体电荷:Zn(NH3)62+、Zn(CN)42– 配体半径:AlCl4– 浓度、温度 螯合物 螯合剂 配合物的分类:按核多少、配体类型等
3、同类按英文字顺[Co(NH3)5(H2O)]Cl3、[Pt(NH2)(NO2)(NH3)2] NCS–、NH2–、NO2– (三)配合物——无机盐H2[SiF6]、K4[Fe(CN)6]、[Pt(NH3)6]Cl4
[Ag(NH3)2]Cl
[Cu(NH3)4]SO4
氯化二氨合银(I)
硫酸四氨合铜(II) 相当于金属离子
CH3 C O Be
O
Be O
O C O O CH3 CBe
CH3
O O O C O C CH3 Be O CH O C O 3 CH3
高中化学竞赛辅导讲座配位化合物

配离子的稳定常数
生成反应: Ag (aq) 2 NH3 (aq)
[Ag(NH3 ) 2 ] (aq)
稳定常数: K稳=c[Ag(NH3)2]+/{c(Ag+)C2(NH3)}
K 稳越大,配离子越稳定。
配离子稳定常数的应用 1.计算配合物溶液中有关离子的浓度
2. 判断配离子与沉淀之间转化的可能性 ——沉淀的配位溶解
(3) 水合异构
[Cr(H2O)6]Cl3 紫色 [CrCl(H2O)5]Cl2 · 2O H 亮绿色 [CrCl2(H2O)4]Cl · 2O 2H 暗绿色 (4) 配位异构 [Co(en)3][Cr(ox)3] [Cr(en)3][Co(ox)3]
2. 立体异构 (1)空间几何异构 (2)旋光异构
Cu (aq) 2e E (Cu / Cu)
2 2
2
Cu(s)
0.0592V 2 E (Cu / Cu) lg{c(Cu )} 2 0.0592V 1 2 E (Cu / Cu) lg 2 2 K 稳 (Cu(NH 3) 4 ) 0.0592V 1 0.3394V lg 12 2 2.30× 10 0.0265V
1s 2s 2p
[Fe(H2O)6]2+ sp3d2杂化, 八面体构型,外轨型配合物 [Fe(CN)6]4- d2sp3杂化, 八面体构型,内轨型配合物
内、外轨型配合物: 中心原子d1 ~ d3型, 有空(n-1)d轨道,d2 s p3杂化 形成内轨型 中心原子d4 ~ d7型,视配体的强弱:强场配体, 如CN – , CO, NO2 –等,易形成内轨型;弱场配体, 如 X – 、H2O易形成外轨型 中心原子d8~ d10型, 无空(n-1)d轨道, sp3 d2杂化 形成外轨型
高中化学竞赛《配合物》课件

例2、Ni(CO)4 的成键情况
在配体 CO 的作用下,Ni 的价层电子重排成 3d104s0
等;
形成 sp3 杂化轨道,正四面体分布,4 个CO 配体与sp3 杂化轨道成配键,形成的 Ni(CO)4 构型为正四面体。
例1和例2 的相同点是,配体的孤对电子配入中心的外 层空轨道, 即 ns np nd 杂化轨道,形成的配合物称外轨型配合物, 所成的键称为电价配键,电价配键不是很强。
内轨型配合物:中心原子用部分内层轨道接纳配体电子。 例如:[Cr(H2O)6]3+ d2sp3杂化, 八面体构型,3d3
内外轨型取决于:配位体场(主要因素)和中心原子(次要因素) ① 强场配体,如CN-、CO、NO2- 等,易形成内轨型;
弱场配体,如 X-、H2O易形成外轨型。
② 中心原子d3型,如Cr3+,有空(n-1)d轨道,(n-1)d 2 ns np3 易形成内轨型;中心原子d 8~ d10型,如Fe2+、Ni2+、Zn2+、Cd2+、 Cu+ 无空(n-1)d轨道,(ns) (np)3 (nd)2易形成外轨型。
(2)金属离子在周围电场作用下,原来相同的五个简并d轨道发 生了分裂,分裂成能级不同的几组轨道;
3)由于d轨道的分裂,d轨道上的电子将重新排布,依旧满足能量 低原理,优先占据能量较低的轨道,往往使体系的总能量有所降低。
、
高能量的 d x2 y2 d z统2 称d轨道 ;能量低的 d xz d xy d yz
内轨配合物稳定,说明其键能 E内 大于外轨的 E外,那么怎样解释 有时要形成外轨配合物呢?其能量因素如何?从上面的例题中可以 看到,形成内轨配合物时发生电子重排,使原来平行自旋的 d电子 进入成对状态,违反洪特规则,能量升高。 成一个对,能量升高一 个P(成对能)。如 Fe(CN)63-中的d 电子,由 变成
全国高中生化学竞赛试题3 配位化合物(答案)
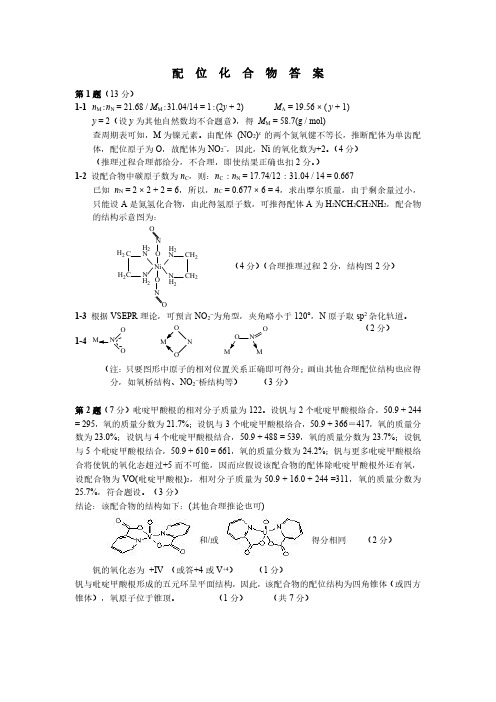
配位化合物答案第1题(13分)1-1n M :n N =21.68/M M :31.04/14=1:(2y +2)M A =19.56×(y +1)y =2(设y 为其他自然数均不合题意),得M M =58.7(g /mol)查周期表可知,M 为镍元素。
由配体(NO 2)x 的两个氮氧键不等长,推断配体为单齿配体,配位原子为O ,故配体为NO 2-,因此,Ni 的氧化数为+2。
(4分)(推理过程合理都给分,不合理,即使结果正确也扣2分。
)1-2设配合物中碳原子数为n C ,则:n C :n N =17.74/12:31.04/14=0.667已知n N =2×2+2=6,所以,n C =0.677×6=4,求出摩尔质量,由于剩余量过小,只能设A 是氮氢化合物,由此得氢原子数,可推得配体A 为H 2NCH 2CH 2NH 2,配合物的结构示意图为:N C CN NC C N H 2H 2H 2H 2H 2H 2H 2H 2Ni NNOO OO(4分)(合理推理过程2分,结构图2分)1-3根据VSEPR 理论,可预言NO 2-为角型,夹角略小于120°,N 原子取sp 2杂化轨道。
1-4O NONOOON O (2分)(注:只要图形中原子的相对位置关系正确即可得分;画出其他合理配位结构也应得分,如氧桥结构、NO 2-桥结构等)(3分)第2题(7分)吡啶甲酸根的相对分子质量为122。
设钒与2个吡啶甲酸根络合,50.9+244=295,氧的质量分数为21.7%;设钒与3个吡啶甲酸根络合,50.9+366=417,氧的质量分数为23.0%;设钒与4个吡啶甲酸根结合,50.9+488=539,氧的质量分数为23.7%;设钒与5个吡啶甲酸根结合,50.9+610=661,氧的质量分数为24.2%;钒与更多吡啶甲酸根络合将使钒的氧化态超过+5而不可能,因而应假设该配合物的配体除吡啶甲酸根外还有氧,设配合物为VO(吡啶甲酸根)2,相对分子质量为50.9+16.0+244=311,氧的质量分数为25.7%,符合题设。
全国高中生化学竞赛试题3 配位化合物

配位化合物(全国初赛)第1题(13分)六配位(八面体)单核配合物MA 2(NO 2)2呈电中性;组成分析显示:M 21.68%,N 31.04%,C 17.74%;配体A 含氮不含氧;配体(NO 2)x 的两个氮氧键不等长。
1-1该配合物中心原子M 是什么元素?氧化态多大?给出推论过程。
(2002年第5题)1-2画出该配合物的结构示意图,给出推理过程。
13指出配体(NO 2)x 在“自由”状态下的几何构型和氮原子的杂化轨道类型。
1-4除本例外,上述无机配体还可能以什么方式和中心原子配位?画出三种。
第2题(7分)研究发现,钒与吡啶-2-甲酸根形成的单核配合物可增强胰岛素降糖作用,它是电中性分子,实验测得其氧的质量分数为25.7%,画出它的立体结构,指出中心原子的氧化态。
要给出推理过程。
(2004年第5题)第3题(8分)今有化学式为Co(NH 3)4BrCO 3的配合物。
(2004年第8题)3-1画出全部异构体的立体结构。
3-2指出区分它们的实验方法。
第4题(6分)本题涉及3种组成不同的铂配合物,它们都是八面体的单核配合物,配体为OH -和/或Cl -。
(2005年第4题)4-1PtCl 4·5H 2O 的水溶液与等摩尔NH 3反应,生成两种铂配合物,反应式为:。
4-2BaCl 2·PtCl 4和Ba(OH)2反应(摩尔比2:5),生成两种产物,其中一种为配合物,该反应的化学方程式为:。
第5题(11分)化合物A 是近十年开始采用的锅炉水添加剂。
A 的相对分子质量90.10,可形成无色晶体,能除去锅炉水中溶解氧,并可使锅炉壁钝化。
(2006年第7题)5-1A 是用碳酸二甲酯和一水合肼在70℃下合成,收率80%。
画出A 的结构式。
5-2写出合成A 的反应方程式。
5-3低于135℃时,A 直接与溶解氧反应,生成三种产物。
写出化学方程式。
5-4高于135℃时,A 先发生水解,水解产物再与氧反应。
化学选修三配合物省名师优质课赛课获奖课件市赛课一等奖课件

4、下列分子或离子中都存在着配
位键旳是
( )B
A.NH3、H2O B.NH4 + 、H3O+
C.N2、HClO D. [Cu(NH3) 4]2+ 、PCI3
小结
1、配位键
定义 “电子对予以—接受键”
3d
4s
4p
[Ar] 3d104s1
sp3杂化轨道
dsp2杂化轨道
平面正方形
NH3
2+
[ ] H3N Cu NH3
NH3
[Cu(NH3)4]2+离子
向试验[2—2]深蓝色溶液中滴加硫酸,观察 试验现象,由此现象变化阐明了什么
天蓝色 溶液
深蓝色 溶液
天蓝色 溶液
H2O
2+
H2O Cu OH2
H3N
配位键旳形成条件
一方提供孤电子对 一方提供空轨道
2、配合物
定义
配合物旳构成 配合物旳性质 配合物旳应用
四、配合物理论简介 [Cu(NH3)4]2+
思索与 交流1
为何CuSO4 •5H2O晶体是蓝色 而无水CuSO4 是白色?
试验探究[2—1]
向盛有固体样品旳试管中,分别加1/3试管
水溶解固体,观察试验现象并填写下表
固体
C白uS色O4
Cu绿Cl色2•2H2O
深Cu褐Br色2
NaCl
白色
K白2S色O4
天蓝色 氨水 蓝色 氨水 深蓝色 +乙醇
溶液
沉淀
溶液 静置
深蓝色 晶体
H2O
高中化学竞赛之结构化学——配合物

配合物200961全国高中学生化学竞赛基本要求8. 配合物。
路易斯酸碱的概念。
配位键。
重要而常见的配合物的中心离子(原子)和重要 而常见的配体(水、羟离子、卤离子、拟卤离子 、氨分子、酸根离子、不饱和烃等)。
螯合物及 螯合效应。
重要而常见的络合剂及其重要而常见 的配合反应。
配合反应与酸碱反应、沉淀反应、 氧化还原反应的联系(定性说明)。
配合物几何 构型和异构现象基本概念。
配合物的杂化轨道理 论。
八面体配合物的晶体场理论。
Ti(H2O)63+ 的颜色。
2组成 (composition)配位单元:由一个简单阳离子或原子和一定数目的中性分子或阴 离子以配位键结合,按一定的组成和空间构型形成一 个复杂的离子或分子. 形成的离子称为配离子,形成的 分子称为配分子. 配合物的简单定义:由配离子与带有相反电荷的离子组成的电中性 化合物以及不带电荷的配分子本身.配分子:Ni(CO) 4 ,− 配离子:BF4 ,[CoCl 3 ( NH 3 ) 3 ] [Fe(CN) 6 ]4- , [Co(NH 3 ) 5 (H 2 O)]3+ , [Cu(NH 3 ) 4 ]2+ [Co(NH 3 ) 5 (H 2 O)]Cl 3配合物:配酸 配盐 配碱HBF4[Cu(NH 3 ) 4 ](OH) 2K 4 [Fe(CN ) 6 ] ,3配位体●每个配位体至少有一个原子具有一对(或多对)孤对电子,或分子中有π 电子。
如,N、O、C、P、S、Cl、F等。
●根据配位体所提供的络合点数目和结构特征,可将配体分成以下几类: 1.单啮配位体:只有一个配位点的配体。
如:NH3 ,形成的单核配位离子比单个金属离子大(半径增大),使正、负 离子间静电引力下降,溶解度增大,不易沉淀,AgCl能溶于氨水,生成银氨 络离子。
2. 非螯合多啮配位体:配体有多个配位点,但受几何形状限制不能与同一金 属离子配位。
如:PO43-、CO32- 等,一个配体与多个金属离子配位,每个金属离子与若干 个这样的配位体配位,形成的多核配位化合物,往往是不溶性沉淀,常作沉 淀剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三讲配合物
赛点回顾与展望
配合物化学一般是指金属原子或金属离子同其他分子或离子发生配位反应的化学,现代配位化学研究领域远远突破了无机化学范围,它涉及金属有机化学、催化机理、物质结构、生命科学和材料科学等,正在成为一门充满活力的边缘学科,应用极为广泛,如核原料和核反应堆材料的生产,超导材料,纳米材料,表面加工工艺,稀土金属的提取与分离,半导体,激光材料的分离与提纯,新药制备与提纯,海水淡化,稀土农业,沙尘暴的防治,沙漠的开发利用等等,国内、国际化学竞赛题涉及的内容也较广泛,但都立足于基础概念与基本原理,如组成、结构、稳定性、综合平衡、反应规律、异构现象、运用原理解释日常生活、社会热点问题,今后测试走向既有连续性,又有新意,新意不外乎原理的重组,综合性、智能性要求更高而已,万变不离其宗,扎实基础,灵活运用,就能永立潮头。
一、配合物
(一)基本概念
1、配合物
2、配合物组成
(1)中心体,是配合物的核心成分,该核心叫中心体或形成体。
(2)配合体,向中心体提供电子对的原子、分子或离子的微粒。
常见的配位体分类
(3)配位数:向中心体提供电子形成配位键的数目。
3、配合物的分类
4、配合物的命名:含阴离子的配合物,先内界后外界;含阳离子的配合物,先外界后内界。
内蜀命名:配体数目(汉字表达)→配体名称→合→中心体名称(用罗马字母标出化合价),如:Na3AlF6:六氟合铝酸钠(中心体无变价可不标),俗名冰晶石。
K4[Fe(CN)6]:六氰合铁(Ⅱ)酸钾,俗名亚铁氰化钾,又名黄血盐
K3[Fe(CN)6]:六氯合铁(Ⅲ)酸钾,俗名铁氰化钾,又名赤血盐
H2SiF6:六氟合硅酸,俗名氟硅酸
(二)配合物结构
3、几何异构
几何异构是指化学组成相同,仅仅由于配体围绕中心离子的位置不同而产生的结构、性质不同的几何体。
最常见的有顺式、反应式两种异构体。
如:PtCl2(NH3)2有两种几何异构体:
另外,八面体构型有其他多种类型的几何异构体,如[PtBr3(NH3)3]+有下图:
两种几何异构体。
一般来说异构现象主要发生在配位数为4的平面四方形结构和配位数为6的八面体结构配合物中,对于具体情况要善于具体分析。
4、旋光异构
当一种分子具有与它的镜像不能重叠的结构时就会产生旋光异构现象,形成具有光学活性的两种旋光异构体。
例如:[RhCl2(en)2]+有下图:
判断一个分子是否具有旋光异构体,通常的方法有:根据分子是否具有对称面和对称中心来确定。
如有对称面或对称中心的分子则无旋光异构体,没有对称面又没有对称中心则有旋光异构体。
二、螯合物
螯合物也称内配合物,它是由配合物的中心离子和某些合乎一定条件的同一配位体的两个或两个以上配位原子键合而成的具有环状结构的配合物。
或者说由多齿配体形成的配合物。
凡含有两个或两个以上都提供孤电子对的原子的配位体称为螯合剂,如
(乙酰丙酮基:符号acac-)、EDTA等均可作螯合剂。
螯合物的稳定性和它的环状结构(环的大小和环的多少)有关。
一般来说以五元环、六元环稳定。
一个配体与中心离子形成的五元环数目越多,螯合物越稳定。
如EDTA与很多金属离子有五个五元环的螯合物,很稳定。
在分析上,常用EDTA测定很多金属离子的含量。
三、路易斯酸碱理论
1923年路易斯提出了酸碱电子理论。
该理论认为凡可以接受电子对的物质称为酸(常称为路易斯酸),凡可以给出电子对的物质称为碱(常称为路易斯碱)。
因为酸是电子对的接受体、碱是电子对的给予体。
酸碱反应实质是形成配位键生成酸碱配合物的过程。
这种酸碱的定义涉及物质的微观结构,使酸碱理论与物质结构产生了相关联系。
如下列物质均可能作为电子对接受体,是酸:H+、Na+、Cu2+、BF3、Ag+、Mg2+、Fe2+、Fe3+、Ni2+。
而下列各种物质均可以作为电子的给予体,是碱:OH-、CN-、NH3、X-、H2O,RCOO-、NO2、NO、CO。
路易斯电子理论中反应主要包括酸、碱的直接配合反应、酸取代反应、碱取代反应、双取代反应几种类型。
四、配合反应
配体提供孤电子对,中心离子(原子)有与之相匹配的价层空轨道,它们之间相互作用形成共价键(配位键)的过程称为配合反应。
前面已指出路易斯酸碱反应都可以认为是配合反应;沉淀反应中相当一部分反应也是配位反应的结果,如Cu2+和OH-二配位产生的Cu(OH)2、Cu(OH)2易聚合成{Cu(OH)2}m,常以沉淀形式出现。
但如果沉淀中阴、阳离子的成键离子性较强,则一般不认为是配位反应,如CaF2沉淀的生成。
不论是何种类型的反应,如果是在水溶液中进行,由于水溶液中离子并非单独存在,而是水合离子或其他配离子,都将与配位反应建立联系。
在水溶液中的氧化还原反应,各离子以何种形体存在直接影响其氧化性、还原性的强弱。
如H+不能氧化单质铜,是因为水合铜离子氧化性强于H+,如果将铜置于氢氰酸中,则将有H2产生,因为产物中铜以Cu(CN2)-存在。
例1:F2是非常活泼的非金属单质,人们通常只能用电解法制备,1986年,化学家Karl
Chrite首次用化学方法制得了F2,有关反应为:
4KMnO4+4KF+20HF=4K2MnF+10H2O+3O2↑SbCl5+5HF=SbF5+5HCl
2K2MnF6+4SbF5=4KSbF5+2MnF3+3F2↑(此反应在423K下进行)
(1)写出Sb基态原子的价电子构型。
(2)画出SbF6-的立体结构,并指出中心原子的杂化类型
(3)推测向HF中加入五氟化锑,HF酸性如何变化?
例2:请画出MA2CDEF的九种异构体。
练习:1、下列化合物中,哪些是配合物?哪些是螯合物?哪些是复盐?
(1)CuSO4·5H2O (2)K2PtCl6(3)Co(NH3)6Cl3(4)Ni(en)2Cl2
(5)(NH4)2SO4FeSO4·6H2O (6)Ca(NH2CH2CH2COO)3(7)Cr(H2O)6Cl3
2、根据价健理论指出下列配离子中心体的杂化类型和配离子的空间构型:
(1)[Ag(CN)2]-(2)AlF63-(3)Fe(CO)5(4)[Pt(em)CO3]
3、请解释下列问题:(1)重金属盐中毒,为什么往往可以灌蛋清解毒?(2)为什么Cu2O溶于浓氨水得无色溶液?(3)当白衣服上洒了蓝黑墨水,为什么可以用草酸去洗?
4、CoCl2水溶液呈粉红色,是由[Co(H2O)6]2+所呈现的,直接向该溶液通入热空气是不会被氧化的,如果向该溶液中通入过量的氨气,再通入空气很容易被氧化,为什么?
参考答案:
例1:(1)5s25p3 (2)sp3d (3)酸性增强。
