亲和层析纯化可溶性GST标签重组蛋白的标准操作规程
GST标签的蛋白纯化

GST标签的蛋白纯化1.200mL菌液离心所得的菌体用80mL 1×PBS 重悬,置于冰上超声10min(超声5s,停10s)。
2.超声所得产物留样1mL,剩余样品4℃,12000rpm离心30min。
3.收集上清,用0.45um的过滤器过滤,留样1mL 。
沉淀用20mL 1×PBS 重悬,留样1mL。
沉淀于-30℃保存。
4.准备Binding Buffer 1×PBS,pH=7.3Elution Buffer 50mM Tris-HCl,10mM 还原型谷胱甘肽,pH=8.0分别加入1mM DTT用于洗脱和结合8.使用蠕动泵将Binding Buffer注入柱中,以2mL/min的流速平衡柱。
避免空气进入柱内。
9.使用蠕动泵将样品注入柱中,以1mL/min的流速结合样品,循环上样3次。
10.使用蠕动泵将50mL Binding Buffer注入柱中,以2mL/min的流速清洗柱。
11.使用蠕动泵将20mL Elution Buffer注入柱中,以1mL/min的流速结合蛋白。
从第2mL开始,每1mL 产物收集在1.3mL EP管中。
共收集10柱体积的产物。
剩余Elution Buffer用于去除杂蛋白。
12.使用蠕动泵将50mL 超纯水注入柱中,以2mL/min的流速1清洗柱。
13.使用蠕动泵将20mL 20%酒精注入柱中,以2mL/min的流速,当柱中充满酒精时将柱取下保存在4℃。
14.将沉淀留样使用电磁炉煮沸5min,12000rpm离心10min,吸取上清。
同蛋白产物一同进行SDS-PAGE电泳。
根据电泳结果,推测GST标签蛋白可能以包涵体形式存在于沉淀中接菌pw61,进行小量诱导,并制备蛋白样品根据电泳结果显示,推测GST标签蛋白存在于沉淀中。
Western Blot 未显示有条带,丽春红染色有明显条带,推测使用的GST抗体不能与目的条带特异性结合。
纯化可溶性蛋白3875裂解:将离心好的菌沉淀取出,500 ml菌液用60 ml Buffer A平衡缓冲液将沉淀重悬。
GST融合蛋白表达与纯化
70%(V/V)乙醇
适于水溶液的0.22μm膜
1、在1.5ml的微量离心管中放入1ml表达目的蛋白的大肠杆菌细胞培养物,4℃,最高转速离心2min,收集上清,将其过0.22μm的膜,收入1.5ml的微量离心管中,弃沉淀。
材料(带√的项见附录1)
用含有trp启动子和目的基因的质粒转化的大肠杆菌宿主菌株
√M9最低营养培养基加0.5%(m/V)酪蛋白水解物(Difco公司)
√1000x抗生素贮液
√400x吲哚-3-丙烯酸(IAA)
20ml无菌培养管
150ml摇瓶
37℃定轨摇床
1、从新鲜的琼脂平板上挑取含trp启动子和目的蛋白基因质粒转化的大肠杆菌宿主菌株的单一菌落,接种至含有2ml M9培养基(含0.5%的酪蛋白水解物和适量的抗生素)的20ml培养管,将培养管在定轨摇床上(200rpm)37℃培养过夜。
转化的大肠杆菌宿主菌株
√LB培养基
√1000x抗生素贮液
√20%(V/V)甘油,无菌的
√LB平板
20ml培养管
30℃或37℃定轨摇床
1、从新鲜琼脂平板上挑单菌落,接种2ml LB培养基(补加适当的抗生素;在20ml培养管中),在定轨摇床上培养过夜。对于基于pL的系统,温度为30℃,对于其他系统,温度为37℃。
辅助方案5 细胞外培养基样品的制备
通过分析培养基中的样品能够检查指导目的蛋白细胞外分泌的表达系统。如果培养物中蛋白质浓度很低(如低于100mg/L),可以加入牛血清白蛋白(BSA)作为沉淀的载体和核。
材料
表达目的蛋白的转化大肠杆菌细胞
2g/L BSA(可选;用0.22μm的膜除菌,4℃保存≤1个月)
GST蛋白表达、纯化步骤(word文档良心出品)

Protein Expression Protocol:1.Transform control construct and tag-fusion-constructs into E.coli BL21(DE3) competent cell, growovernight;2.Inoculate single colony to 2~3 ml LB medium, and grow at 37 degree for 7~10 hours or overnight;3.1:100 inoculate to 3 ml LB, bacteria grow for 2-3 hours at 37 degree, then follow 1:2000 add 1 MIPTG to induce protein expression overnight at 22 degree;4.Spin down bacteria at 12000 rpm for 1 min, wash with 1 ml ddH2O, add 100 ul 1x PBS toresuspend the deposition, then sonicate 3~5 min on ice;5. Spin down at 12000 rpm for 10min, separate the supernatants and deposition;6. Boiling with loading buffer at 100 degree for 5min, Spin down at 12000 rpm for 5min, 12%SDS-PAGE;7. After confirmed protein expressed in supernatants, increase the volume of bacteria medium. 1:100inoculate to 100 ml LB, grow bacteria for 2-3 hours at 37 degree;then follow 1:2000 add 1 M IPTG to induce protein expression overnight at 22 degree;8. Spin down bacteria at 8000 rpm 4 degree for 5 min, wash with 10 ml ddH2O, add 5 ml 1x PBS toresuspend the deposition, then sonicate 60 min on ice;9. Spin down at 12000 rpm 4 degree for 10min, separate the supernatants and deposition;10.Prepare the supernatants for purification.蛋白表达注意事项:1. E.coli BL21比DH5α生长要快,固体培养基上10~12小时即可长斑,液体培养基中8小时后即可生长成较大密度;切勿培养时间过长,防止菌体老化;2.为了后续实验的便利,应尽量减少包涵体的形成。
gst蛋白纯化

GST蛋白纯化简介谷胱甘肽S-转移酶(glutathione S-transferase,GST)是一种常用的亲和标签,用于在分子生物学研究中用于蛋白质纯化和蛋白质亲和结合实验。
GST蛋白被广泛应用于蛋白质结构和功能研究、酶学研究、蛋白质互作研究等领域。
本文将介绍一种常见的方法来纯化GST蛋白,该方法主要包括以下步骤:细胞裂解、亲和层析、洗脱和纯化。
方法细胞裂解首先需要将GST蛋白表达在适当的宿主中,例如大肠杆菌。
在细胞达到适当的生长阶段后,使用合适的方法将细胞裂解,使得目标蛋白释放到溶液中。
一种常用的裂解方法是超声波裂解,通过超声波震荡将细胞破碎。
亲和层析经过细胞裂解后,将得到的细胞裂解液通过亲和层析柱。
亲和层析柱通常使用含有还原型谷胱甘肽(glutathione,GSH)结合物质的树脂,例如glutathione agarose beads。
这种树脂与GST标签结合,使得GST标签的融合蛋白能够特异性地结合于柱子上。
通过洗脱液去除非特异结合蛋白,将目标蛋白纯化。
洗脱洗脱过程是将结合于柱子上的目标蛋白从固定相洗净。
一般采用含有高浓度还原型谷胱甘肽的洗脱液,例如50 mM GSH。
洗脱液中的还原型谷胱甘肽与柱子上的结合物质竞争与GST标签结合,以此达到将GST蛋白洗脱下来。
纯化经过洗脱后,蛋白溶液中的GST蛋白含量较高。
为了进一步提高纯度,可以通过对溶液进行浓缩、去除低分子量杂质、调整溶液pH值等方法进行纯化。
常用的纯化方法包括丙酮沉淀法、离子交换柱层析法等。
注意事项•在实验过程中应严格操作,避免任何可能导致目标蛋白污染的情况发生。
•选择合适的表达宿主,不同的宿主可能会对GST蛋白的表达量和可溶性产生影响。
•在细胞裂解过程中,避免样品受到温度、剧烈振荡等因素的影响。
•注意亲和层析柱的操作方法,避免破损或污染。
•洗脱过程中注意还原型谷胱甘肽浓度和洗脱液的pH 值。
结论GST蛋白纯化是一种常见的蛋白质纯化方法,通过亲和层析技术可以实现对GST蛋白的高效纯化。
GST融合蛋白的纯化

GST融合蛋白的纯化诱导和收集菌体在一定的诱导条件下IPTG诱导蛋白的合成。
18~25℃的低温条件下培养可以使大部分蛋白融合蛋白可溶性表达,并保持较高的活性。
IPTG浓度一般为0.1~1.0mM。
5000rpm 5min离心收集菌体。
亲和层析柱的制备取存放谷胱甘肽琼脂糖的瓶子颠倒数次,使其混匀,取1.5ml混合液加入层析柱中,加10ml 20%乙醇,使琼脂糖在柱中自然沉降。
将20%乙醇流尽后,加10ml PBS清洗柱子,待管中PBS液面刚好没过凝胶时,套上滴口的套子,待用。
每100ml菌液的菌体用4ml PBS(加1%Triton-100、蛋白酶抑制剂)悬浮。
在冰水中超声波破碎细胞(1分钟/次×5次,每次间隔1分钟)。
将裂解液分装至小管,4℃10000rpm离心5分钟。
收集上清液,加DTT至终浓度为1mM。
0.45um过滤后加入亲和层析柱。
室温下使混合液自然通过层析柱,保留0.5ml过滤液做PAGE电泳检测用。
用10ml PBS洗柱子3遍,每次临近结束时收集洗涤液0.5ml测OD值。
配制10mM的还原型谷胱甘肽溶液,即洗脱液3ml(0.009g溶于3ml 50mM Tris-Cl溶液中)。
用洗脱液洗脱GST融合蛋白,每管0.5ml接收洗脱液。
测各管洗脱液蛋白浓度。
PAGE电泳检测纯度。
亲和层析柱的再生:用0.04M NaOH洗10ml×3次,用10ml PBS平衡后,加20%乙醇储存于4度。
或者按照beads使用说明书上的方法再生。
如果洗脱液中的还原型谷胱甘肽对实验有影响时,需用分子筛去除。
如果需要不带标签的蛋白,则蛋白被柱子吸附后,用蛋白酶进行切割;或者用分子筛过滤后,在筛子上进行酶切。
gst纯化蛋白步骤

gst纯化蛋白步骤GST纯化蛋白是一种常用的蛋白质纯化方法,它利用谷胱甘肽硫转移酶(Glutathione S-Transferase,GST)的亲和性,将GST标签蛋白与GST结合亲和树脂进行结合,然后通过洗脱,最终得到纯化的目标蛋白。
下面将为大家介绍GST纯化蛋白的详细步骤。
1.构建重组蛋白表达载体:首先需要在目标蛋白编码基因的N端或C端加上GST标签,通常选择GST-N和GST-C两种方式。
将GST标签与目标蛋白基因连接后,将其插入合适的表达载体中。
2.转化宿主细胞:将构建好的重组表达载体转化到适合的宿主细胞中,常用的宿主细胞有大肠杆菌和酿酒酵母等。
3.表达目标蛋白:宿主细胞在适宜的培养条件下进行培养,使其产生大量重组蛋白。
常见的培养条件包括温度、培养基的选择和添加诱导物等。
4.细胞破碎:培养得到丰富的重组蛋白的细胞后,通过机械或化学方法将细胞破碎。
常用的方法有超声波破碎、高压均质破碎、冻融法和溶菌酶法等。
5.蛋白纯化:将细胞破碎液进行离心分离,去除残余细胞碎片。
接下来,将蛋白样品加入含有GST结合亲和树脂的柱子中,通过亲和吸附,在树脂上富集GST标签蛋白。
6.洗脱纯化蛋白:使用合适的洗脱缓冲液,可以脱离与亲和树脂结合的非特异性结合蛋白,并洗脱纯化的目标蛋白。
一般使用还原性缓冲液,可将目标蛋白从GST结合亲和树脂上彻底洗脱。
7.蛋白质浓缩:通过合适的方法,如超滤、溶液浓缩装置等,使纯化的目标蛋白浓缩到较高浓度。
8.纯化蛋白的分析:对纯化的目标蛋白进行SDS-PAGE凝胶电泳分析,检测其纯度和分子量等指标。
通过上述步骤,可以得到较高纯度的GST标签蛋白。
需要注意的是,在步骤的选择和操作过程中,要根据目标蛋白的特性和所需纯度等要求进行调整,以获得更好的纯化效果。
希望本文对您进行GST纯化蛋白的实验有所帮助。
GST融合蛋白的纯化

GST融合蛋白的纯化诱导和收集菌体在一定的诱导条件下IPTG诱导蛋白的合成。
18~25℃的低温条件下培养可以使大部分蛋白融合蛋白可溶性表达,并保持较高的活性。
IPTG浓度一般为0.1~1.0mM。
5000rpm 5min离心收集菌体。
亲和层析柱的制备取存放谷胱甘肽琼脂糖的瓶子颠倒数次,使其混匀,取1.5ml混合液加入层析柱中,加10ml 20%乙醇,使琼脂糖在柱中自然沉降。
将20%乙醇流尽后,加10ml PBS清洗柱子,待管中PBS液面刚好没过凝胶时,套上滴口的套子,待用。
每100ml菌液的菌体用4ml PBS(加1%Triton-100、蛋白酶抑制剂)悬浮。
在冰水中超声波破碎细胞(1分钟/次×5次,每次间隔1分钟)。
将裂解液分装至小管,4℃10000rpm离心5分钟。
收集上清液,加DTT至终浓度为1mM。
0.45um过滤后加入亲和层析柱。
室温下使混合液自然通过层析柱,保留0.5ml过滤液做PAGE电泳检测用。
用10ml PBS洗柱子3遍,每次临近结束时收集洗涤液0.5ml测OD值。
配制10mM的还原型谷胱甘肽溶液,即洗脱液3ml(0.009g溶于3ml 50mM Tris-Cl溶液中)。
用洗脱液洗脱GST融合蛋白,每管0.5ml接收洗脱液。
测各管洗脱液蛋白浓度。
PAGE电泳检测纯度。
亲和层析柱的再生:用0.04M NaOH洗10ml×3次,用10ml PBS平衡后,加20%乙醇储存于4度。
或者按照beads使用说明书上的方法再生。
如果洗脱液中的还原型谷胱甘肽对实验有影响时,需用分子筛去除。
如果需要不带标签的蛋白,则蛋白被柱子吸附后,用蛋白酶进行切割;或者用分子筛过滤后,在筛子上进行酶切。
纯泰GST(GSH)亲和层析介质使用说明书

z 聚苯乙烯层析柱
1) 将层析柱固定在铁架台或层析架上,封闭层析 柱下端出口,向柱内充入纯水,排开层析柱内 空气,先将垫片完全浸没于水面下方,在保持 水平的状态下,小心推向底部,避免垫片下方 滞留气泡。
2) 打开层析柱下端出口,排出柱中纯水;在液面 低至距垫片1~1.5cm高度时封闭下端出口,用移 液枪按需要量吸取介质,或用玻璃棒紧靠柱子 内壁引流,将介质加入到层析柱中;静置30min, 让介质自然沉降。
每次层析前,为达到最佳纯化效果,需对介质 进行再生,步骤如下:
1) 2倍介质体积高pH缓冲液(0.1M Tris-HCl, 0.5M
NaCl, pH8.5)和低pH缓 冲液(0.1M sodium acetate, 0.5M NaCl, pH4.5)交替洗脱三次。 2) 10倍介质体积缓冲液A平衡介质。 7. SDS-PAGE检测:
三、 适用范围
分离谷胱甘肽S-转移酶(GST)融合蛋白、其 它谷胱甘肽转移酶以及与谷胱甘肽有亲和作用的 蛋白。
四、 操作说明
1. 缓冲液配制
z 缓冲液A(平衡缓冲液):10mM Na2HPO4, 1.8mM KH2PO4,140mM NaCl,2.7mM KCl, 调节pH值至 8.0。
z 缓冲液 B(洗脱缓冲液):10mM Glutathione
-1-
1) 用10倍介质体积缓冲液A过柱,平衡介质; 2) 上样; 3) 用5~10倍介质体积缓冲液A过柱,洗去层析柱
中剩余上样液并重新平衡介质; 4) 用5~10倍介质体积缓冲液B洗脱,收集洗脱液; 5) 用5~10倍介质体积缓冲液A重新平衡介质。 注:纯化过程流速不宜过快,对于1ml介质,流速 保持在0.5ml/min为宜。 5. 介质清洗
gst亲和层析步骤

gst亲和层析步骤GST(谷胱甘肽S-转移酶)亲和层析是一种常用的蛋白质纯化技术,它基于谷胱甘肽S-转移酶与谷胱甘肽结合的高亲和力,可用于纯化含有GST标签的蛋白质。
第一部分:材料准备在进行GST亲和层析之前,需要准备一些实验材料。
以下是常见的实验材料列表:1. 细菌表达系统:常用的细菌表达系统包括大肠杆菌(E. coli)和酵母菌等。
选择适当的表达系统,并确保表达系统中含有GST融合蛋白的基因。
2. 培养基和抗生素:根据表达系统的需求,准备适当的培养基,并添加相应的抗生素以选择含有GST融合蛋白的菌落。
3. 细胞破碎缓冲液:根据实验需求选择适当的细胞破碎缓冲液,如PBS(磷酸盐缓冲液)或Tris缓冲液,并添加辅助试剂如EDTA(乙二胺四乙酸)和PMSF (苯甲磺酰氟)等。
4. 融合蛋白纯化缓冲液:准备一系列用于融合蛋白纯化的缓冲液,包括洗脱缓冲液、结合缓冲液、平衡缓冲液等。
常用的缓冲液成分包括PBS、NaCl(氯化钠)、DTT(二硫苏糖醇)和Tween-20等。
5. GST树脂:选择合适的GST亲和树脂,如GST-Sepharose或Glutathione Agarose等。
6. 色谱柱:选择合适的色谱柱,如预装的柱子或自制的柱子,并进行消毒和平衡。
7. 蛋白质测定试剂盒:用于测定蛋白质的浓度,如BCA(双硫苏糖酸)蛋白定量试剂盒。
第二部分:GST融合蛋白的表达和纯化1. 转化细菌:将含有GST融合蛋白基因的质粒DNA转化到表达宿主细胞中,如E. coli。
通过热激冷冻法、电穿孔法或化学法等方法将质粒DNA导入细菌细胞内。
2. 培养细菌:将转化后的细菌菌落接种到含有适当抗生素的培养基中,并在适当的条件下培养细菌,如温度、pH值和搅拌速度等。
3. 蛋白表达诱导:当细菌培养达到适当的生长阶段时,添加适当浓度的诱导剂,如IPTG(异丙基硫代-β-D-半乳糖苷),以诱导GST融合蛋白的表达。
4. 细胞收获:在蛋白表达诱导后一定时间,收集细菌细胞。
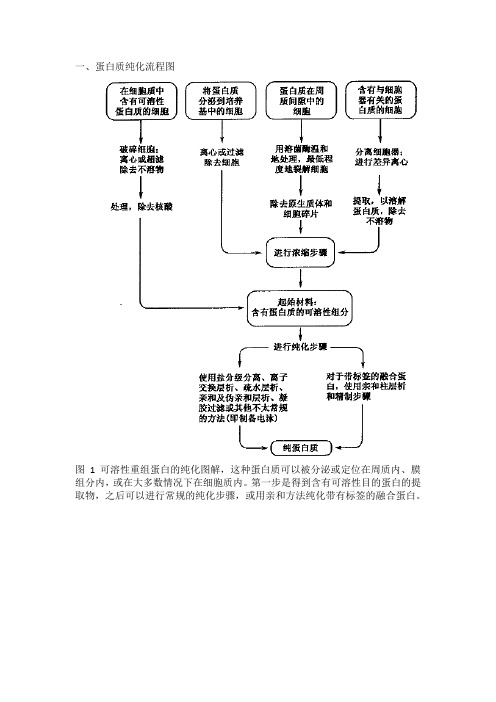
11重组蛋白纯化——可溶性蛋白纯化(GST)

SOP6 谷胱甘肽亲和柱纯化带谷胱甘肽还原酶(GST)标签蛋白1.样品制备与“SOP Ni-NTA层析柱亲和纯化6His标签融合蛋白”中样品制备方法相同,裂解缓冲液(50mM Tris,150mM NaCl,2mM EDTA,0.5% NP-40,0.5% Triton X-100,0.5mM DTT ,1mM PMSF,1mM NaF ,protease inhibitors cocktail,pH7.5) 。
(PMSF,DTT,protease inhibitors cocktail在破菌前加入。
)适合于GST Pull- Down的细菌裂解液配方还有很多。
2.样品纯化Glutathione Beads亲和树脂灌装层析柱或直接使用Glutathione Beads预装柱,层析柱下端接核酸蛋白检测仪。
2.1 平衡层析柱至工作温度,纯化过程可在室温或4℃进行。
2.2 将层析柱固定在支架上,让其流尽树脂保护液,快流干的时候用至少5倍体积的平衡/洗涤缓冲液(50mM Tris,150mM NaCl,pH8.0)冲洗柱子。
2.3 制备的蛋白样品与平衡/洗涤缓冲液1:1混合,加到平衡好的Glutathione Beads中(保证目的蛋白与Glutathione Beads充分接触,提高目的蛋白的回收率),收集流穿液。
2.4 用10~15倍柱床体积的平衡/洗涤缓冲液清洗柱床,去除非特异性吸附的杂蛋白,收集洗涤液。
2.5 使用5~10倍柱床体积的洗脱缓冲液(50mM Tris,150mM NaCl,10mM还原型谷胱甘肽,pH8.0),收集洗脱液,即目的蛋白组分。
还原型Glutathione易氧化,也容易影响pH,需现用现配,同时注意调pH 8.0。
3.SDS-PAGE检测分析纯化过程各组分纯化过程中得到的样品(包括上样前样品液、流穿液、洗杂液和顺次收集的洗脱蛋白)以及原始样品使用SDS-PAGE检测分析纯化效果。
亲和柱层析操作(可溶性蛋白)

亲和柱层析操作规程(可溶性蛋白)1.装柱:1.1 取出层析柱,用去离子水冲洗干净,连接好管子后固定柱子;1.2用水冲洗层析柱3-5次,每次10ml去离子水;1.3取出填料,静止至室温后,根据需要用移液器取出3-5ml的填料进行装柱,1.4用去离子水冲洗填料5个柱体积;2.柱的平衡与上样:2.1用0.02M PB bufferA 缓冲液(PH8.0)平衡Ni柱,直至流出液的pH为8.0;2.2对处理的样品进行过滤后,缓慢上样让蛋白充分结合;3洗杂蛋白:3.1用0.02M PB bufferA 缓冲液(PH8.0)过柱,清洗没有结合到层析柱上的杂蛋白,至流出液与缓冲液的OD值接近为止,流出液取20ul做SDS-PAGE检测;3.2用含5mM咪唑的PB bufferA 缓冲液(pH8.0)过柱,共洗约30ml,至流出液与含5mM咪唑的PB bufferA 缓冲液的OD值接近为止,流出液取20ul做SDS-PAGE检测;3.3用含10mM咪唑的PB bufferA 缓冲液(pH8.0)过柱,共洗约30ml,至流出液与含10mM咪唑的PB bufferA 缓冲液的OD值接近为止,流出液取20ul做SDS-PAGE检测;3.4用含20mM咪唑的PB bufferA 缓冲液(pH8.0)过柱,共洗约30ml,至流出液与含20mM咪唑的PB bufferA 缓冲液的OD值接近为止,流出液取20ul做SDS-PAGE检测;3.5用含40mM咪唑的PB bufferA 缓冲液(pH8.0)过柱,共洗约30ml,至流出液与含40mM咪唑的PB bufferA 缓冲液的OD值接近为止,流出液取20ul做SDS-PAGE检测;3.6用含50mM咪唑的PB bufferA 缓冲液(pH8.0)过柱,共洗约30ml,至流出液与含50mM咪唑的PB bufferA 缓冲液的OD值接近为止,流出液取20ul做SDS-PAGE检测;3.2用含100mM咪唑的PB bufferA 缓冲液(pH8.0)过柱,共洗约30ml,至流出液与含100mM咪唑的PB bufferA 缓冲液的OD值接近为止,流出液取20ul做SDS-PAGE检测;(具体的洗脱梯度需根据实验自行调整)4解离目的蛋白:4.1用含100mM咪唑的PB bufferA 缓冲液(pH8.0)过柱,共洗约30ml,至流出液与含100mM咪唑的PB bufferA 缓冲液的OD值接近为止,流出液取20ul做SDS-PAGE检测;4.2 用含200mM咪唑的PB bufferA 缓冲液(pH8.0)过柱,共洗约30ml,至流出液与含200mM咪唑的PB bufferA 缓冲液的OD值接近为止,流出液取20ul做SDS-PAGE检测;4.3 用含500mM咪唑的PB bufferA 缓冲液(pH8.0)过柱,共洗约30ml,至流出液与含500mM咪唑的PB bufferA 缓冲液的OD值接近为止,流出液取20ul做SDS-PAGE检测;4.4用含1000mM咪唑的PB bufferA 缓冲液(pH8.0)过柱,共洗约30ml,至流出液与含1000mM咪唑的PB bufferA 缓冲液的OD值接近为止,流出液取20ul 做SDS-PAGE检测;(具体的洗脱梯度需根据实验自行调整)5.柱的清洗与保存:5.1用含500mM咪唑的缓冲液A(pH8.0)以冲洗层析柱,共冲洗30ml;5.2用浓度为1.5M的NaCl溶液冲洗层析柱,共冲洗30ml;5.3用过滤去离子水冲洗50ml;5.4用20%乙醇冲洗30ml后于4℃20%乙醇中保存。
GST融合蛋白操作规程

GST融合蛋白操作规程
1、重悬菌:用15倍菌重体积的上样缓冲液重悬菌。
(即1kg大肠杆菌用15L上
样缓冲液)。
2、破碎菌:破碎前需加0.5mMPMSF。
破碎压力为800bar左右。
整个过程需低
温操作。
3、离心:9000rpm离两次,25min一次。
4、装柱及平衡柱子:装柱子时不可产生气泡;用5—10倍体积及的上样缓冲液
平衡柱子。
5、上样:20倍菌重体积上样,(即1kg大肠杆菌用20L上样缓冲液),上样速度
度不可太快。
最大值范围应接近重力流速,不可超过重力流速太多。
(例如我们目前柱子的重力流速为25ml/min左右,我们的最大流速也应该在25ml/min 左右)。
上样完后进行反冲。
6、冲洗柱子:先用冲洗缓冲液1冲洗5—10倍体积。
再用冲洗缓冲液2冲洗至
流出液在Bradford不变色为止。
7、酶切:酶切前先把柱子掏出,用冲洗缓冲液2淘洗至流出液在Bradford不变
色为止。
再把柱子倒回烧杯中,再加入冲洗缓冲液2至快1L左右,再加入3%PEG400,3mM巯基乙醇。
再加入酶终浓度为1:200左右的TEV酶。
酶切4h以上。
(整个过程需低温操作)。
8、收集目的蛋白(整个过程需低温操作)
9、目的蛋白后期处理。
GST纯化步骤(精)

GST融合蛋白纯化方法1目的片段接入pGEX载体;2涂板,挑单克隆,摇菌至OD600≈1.0,加入IPTG(终浓度1 mM)诱导6-8 h;3收菌,每升菌液约以50 mL PBS重悬,加入1%Triton X-100(v/v),1%β-巯基乙醇(v/v),PMSF (终浓度1 mM);以下步骤均在冰上操作:4 超声破碎菌体,15000 g,10min离心取上清,在上清中加入适量GST-beads,轻轻晃动令其吸附蛋白1 h;5 2000 g,3min离心弃上清;6加入至少10倍体积PBS,轻摇至beads悬浮于溶液中,2000 g,3 min离心弃上清;7 重复步骤6 两次;8 加入1 mL GST Elution Buffer,轻摇10 min;9 2000 g,3 min离心,收集上清;10 重复步骤8-9至少两次;11 SDS-PAGE电泳检测蛋白纯度,Bradford法检测蛋白浓度;12将蛋白置于-20℃保存。
P.S. 大量提取前应取少量菌液,改变IPTG浓度,诱导温度,诱导时间等,以确定蛋白表达的最适条件。
制备细胞裂解物:1.每100ml培养物的细胞沉淀悬于4ml PBS;2.加入溶菌酶至终浓度1mg/ml,冰上放置30min;3.用针筒将10ml 0.2%Triton X-100强行注入细胞裂解物中,剧烈震动数次混匀;4.加入DNase和RNase至终浓度5ug/ml,4℃震动温育10min;5. 4℃ 3000g(5000r/min)离心30min;6.上清转移到一只新试管,加入DTT至终浓度为1mmol/L;纯化融合蛋白:7.细胞裂解物与50%谷胱甘肽-琼脂糖树脂匀浆混合,每100ml 细胞培养物加2ml 树脂,于室温下轻摇30min;8混合物于4℃以500g(2100r/min)离心5min,小心去掉上清并留样少许进行SDS-PAGE;9.沉淀中加入10倍标准体积的PBS,颠倒离心管数次混匀,洗去未与树脂结合的蛋白;10. 4℃以500g(2100r/min)离心5min,小心去掉上清并留样少许进行SDS-PAGE;11.重复步骤9和10两次;12.结合的GST融合蛋白可用谷胱甘肽洗脱缓冲液洗脱,也可用凝血酶,肠激酶或Xa因子切割,释放靶蛋白;用谷胱甘肽洗脱洗脱融合蛋白:a.沉淀中加入1倍柱床体积的谷胱甘肽洗脱缓冲液,室温轻轻搅动10min,洗脱树脂上结合的蛋白;b. 4℃以500g(2100r/min)离心5min,上清移至新管中;c.重复步骤a和b两次,合并3次的上清;蛋白酶解从结合的GST融合蛋白上回收靶细胞:a.在结合了融合蛋白的树脂中加入凝血酶,肠激酶或Xa因子。
GST标签的蛋白纯化

GST标签的蛋白纯化GST标签的蛋白纯化1.200mL菌液离心所得的菌体用80mL 1×PBS 重悬,置于冰上超声10min(超声5s,停10s)。
2.超声所得产物留样1mL,剩余样品4℃,12000rpm离心30min。
3.收集上清,用0.45um的过滤器过滤,留样1mL 。
沉淀用20mL 1×PBS 重悬,留样1mL。
沉淀于-30℃保存。
4.准备Binding Buffer 1×PBS,pH=7.3Elution Buffer 50mM Tris-HCl,10mM 还原型谷胱甘肽,pH=8.0分别加入1mM DTT用于洗脱和结合8.使用蠕动泵将Binding Buffer注入柱中,以2mL/min的流速平衡柱。
避免空气进入柱内。
9.使用蠕动泵将样品注入柱中,以1mL/min的流速结合样品,循环上样3次。
10.使用蠕动泵将50mL Binding Buffer注入柱中,以2mL/min 的流速清洗柱。
11.使用蠕动泵将20mL Elution Buffer注入柱中,以1mL/min的流速结合蛋白。
从第2mL开始,每1mL 产物收集在1.3mL EP管中。
共收集10柱体积的产物。
剩余Elution Buffer用于去除杂蛋白。
12.使用蠕动泵将50mL 超纯水注入柱中,以2mL/min的流速1清洗柱。
13.使用蠕动泵将20mL 20%酒精注入柱中,以2mL/min的流速,当柱中充满酒精时将柱取下保存在4℃。
14.将沉淀留样使用电磁炉煮沸5min,12000rpm离心10min,吸取上清。
同蛋白产物一同进行SDS-PAGE电泳。
根据电泳结果,推测GST标签蛋白可能以包涵体形式存在于沉淀中接菌pw61,进行小量诱导,并制备蛋白样品根据电泳结果显示,推测GST标签蛋白存在于沉淀中。
Western Blot 未显示有条带,丽春红染色有明显条带,推测使用的GST抗体不能与目的条带特异性结合。
GST蛋白纯化方法

制备样品:1、12000rpm离心5min手机细胞,倒上清。
尽量控干cell沉淀。
每100ml培养液的细胞用4ml冰冷的1xGST Bind/Wash Buffer 重悬。
2、在冰浴或盐冰浴中超声波处理样品。
如果样品已不再粘稠即可停止超声。
如果DNA没有剪切好会因为样品粘稠而堵住柱子。
纯化:1、将树脂浆灌注(其中树脂为50%)。
小型聚丙烯色谱管可以加载2.5ml树脂(柱床体积),用于纯化12-20mg目的蛋白。
2、当储存缓冲液(20%乙醇)液面降到柱床上沿以下时,用5x体积1xGST Bind/Wash Buffer洗树脂。
3、待GST Bind/Wash Buffer流到柱床上沿以下时,加入制备好的蛋白抽提液。
收集流穿组分并置于冰上。
4、以10x体积1xGST Bind/Wash Buffer洗柱,收集流穿组分并置于冰上。
5、以3x体积1xGST Bind/Wash Buffer洗脱目的蛋白。
收集洗脱组分置于冰上待后续分析。
6、分析洗脱和穿过组分中出现的目的蛋白。
若目的蛋白带的是无功能的GST则无法与树脂结合,纯化。
7、洗脱结束后,用3-5x体积柱床体积的1xGST Bind/Wash Buffer洗涤柱子。
8、再用3-5x柱床体积的ddH2O洗涤柱子。
9、GST凝胶最后保存于2-3x柱床体积的20%乙醇中。
GST纯化所需试剂:1、10xGST Bind/Wash Buffer(pH7.3)用NaOH或HCl调PH配制500ml 10xGST Bind/Wash Buffer试剂配方:43mM 的Na2HPO4.12H2O 需称量7.7g14.7mM的KH2PO4需称量1g1.37M NaCl 需称量40.03g27mM KCl 需称量1g使用时稀释10x变成1xGST Bind/Wash Buffer即可。
2、1xElution Buffer 配制(现配现用,以免被氧化)取1g还原型谷胱甘肽溶于3.25ml 10xGlutathione Reconstitution Buffer中,再加ddH2O稀释到32.5ml。
实验八 亲和纯化GST融合蛋白

实验八单柱亲和纯化GST融合蛋白Single Column Purification of GST Fusion ProteinsN末端或C末端GST融合蛋白纯化方法运用谷胱甘肽琼脂糖凝胶(0.5-2 ml) 谷胱甘肽树脂预装柱(0.5-1 ml) 进行GST融合蛋白纯化的方法,适用于25-100 ml的诱导培养菌(纯化2.5-10 mg GST融合蛋白)1. 细菌培养:直接挑取表达质粒新转化的单菌落, 加入25-100 ml LB+Amp液体培养基中(含氨苄100 μg/ml),37℃振荡培养至OD600nm达0.5。
2. 诱导蛋白表达:加入终浓度为0.3 mM 的IPTG,30-37℃振荡培养3 h,诱导蛋白表达。
设立阴性对照。
取样10-20 μl进行SDS-PAGE电泳, 取样1-2 μl进行Western blot鉴定。
表达的时间和温度根据表达量, 可溶性和稳定性进行调整, 对于37℃不稳定或不溶的蛋白, 0.1 mM 的IPTG 20-25℃诱导培养6-20 h; 10-16℃振荡培养12-24 h.3.细胞收集:5000×g离心10分钟(4℃), 弃上清。
-20/-80℃贮存。
细胞冻融利于破碎。
4.破碎细胞:用5-10 ml的裂解缓冲液(10 mM Tris-HCl, pH8.0, 0.1 NaCl) 将菌体重悬,超声破碎细胞(冰浴),使融合蛋白释放。
15000-19000×g离心30分钟,上清即为可溶性蛋白的细胞粗提物。
上样5 μl进行SDS-PAGE电泳鉴定(Western:: 1∶10稀释, 上样5 μl)。
5.谷胱甘肽树脂预装柱的平衡: 20 ml的缓冲液4℃进行柱平衡。
每毫升谷胱甘肽树脂大约能够结合5-10 mg GST融合蛋白。
6.结合融合蛋白:用柱帽堵上,将澄清的细胞粗提物加入谷胱甘肽树脂预装柱(0.5 ml, # ;1 ml, # ),4℃放置15-30 min。
GST纯化步骤

GST纯化步骤GST(Glutathione S-transferase)是一种广泛存在于生物体内的酶,可参与细胞代谢、解毒等重要生理过程。
GST纯化是一种重要的实验步骤,可以通过这种方法获得高纯度的GST蛋白。
下面将详细介绍GST纯化的步骤。
1.原料制备2.打断细胞将得到的蛋白溶液加入一定比例的裂解缓冲液中,如Tris-HCl缓冲液(pH 7.5),同时可以加入一定比例的蛋白酶抑制剂、凝血酶和DNA酶等物质,以防止蛋白在裂解过程中被降解。
然后,将细胞打破,可选择使用超声波破碎、高压细胞破碎机等方法。
3.澄清制备4.亲和层析将亲和树脂(如:谷胱甘肽琼脂糖)装填到柱中,然后与蛋白溶液进行接触,使GST蛋白与亲和树脂发生特异性结合。
在接触过程中,可以适当调节pH值、离子浓度等条件,以促进GST蛋白与亲和树脂的结合。
接着,通过流动层析的方法,将非特异性结合的蛋白、杂质等洗脱,并收集GST蛋白。
5.洗脱通过改变柱上的洗脱缓冲液的条件,如改变pH值、离子浓度等,使GST与亲和树脂之间的结合断裂,从而将纯化的蛋白洗脱出来。
常用的洗脱缓冲液包括Tris-HCl缓冲液、EDTA缓冲液等。
6.脱盐将洗脱的GST蛋白通过浓缩手段去除缓冲盐、小分子物质等。
目前常用的浓缩方法有离心浓缩、透析浓缩等。
在此步骤中还可以使用一些化合物,如PEG,帮助蛋白更好地进行浓缩。
7.验证纯化效果通过SDS-、Western blot等方法对纯化后的GST蛋白进行鉴定,确定纯化效果。
此外,还可以使用酶活测定、质谱等方法对GST蛋白进行功能验证。
通过以上步骤,可以获得高纯度的GST蛋白。
纯化后的GST蛋白可以用于生物化学、分子生物学等领域的进一步研究,如蛋白结构和功能的研究、酶动力学的研究等。
GST蛋白纯化试剂盒说明书及操作指南

GST蛋白纯化试剂盒说明书及操作指南GST蛋白纯化试剂盒是一种常用的实验工具,用于从细胞裂解液中高效纯化谷胱甘肽S转移酶(GST)标签融合蛋白。
下面将详细介绍试剂盒的组成、使用步骤以及注意事项,以帮助用户顺利进行GST蛋白纯化实验。
一、试剂盒组成蛋白纯化试剂盒由以下几个主要组分组成:1、离心管:提供用于样品处理和离心过程的离心管。
2、细胞裂解缓冲液:含有适量的洗脱缓冲液和辅助物质,在细胞裂解过程中保护目标蛋白的完整性。
3、离心管悬浮粉末:用于牢固固定GST亲和树脂。
4、清洗缓冲液:用于去除非特异性结合物质,保证目标蛋白的纯度。
5、洗脱缓冲液:用于洗脱目标蛋白,使其从GST亲和树脂上解离。
二、操作步骤以下是使用GST蛋白纯化试剂盒进行GST蛋白纯化的基本步骤:1、细胞裂解:将经过表达的GST标签融合蛋白的细胞用细胞裂解缓冲液裂解,并加入适量的离心管悬浮粉末。
轻轻摇晃或旋转离心管,使粉末均匀分布。
2、离心:将裂解液转移至离心管中,并以适当的速度离心使GST亲和树脂沉淀到离心管底部。
3、除去上清:谨慎倒出上清液,避免破坏沉积的GST亲和树脂。
4、清洗:加入适量的清洗缓冲液,轻轻摇晃离心管,使清洗缓冲液与GST 亲和树脂充分接触,去除非特异性结合物质。
重复此步骤两次以确保清洗。
5、洗脱:加入适量的洗脱缓冲液,轻轻摇晃或旋转离心管,使目标蛋白从GST亲和树脂上洗脱。
6、收集洗脱液:将洗脱液收集于新的离心管中,这样就得到了纯化的GST 标签融合蛋白。
三、注意事项在使用蛋白纯化试剂盒过程中,请注意以下几点:1、严格按照说明书中的步骤进行操作,避免操作失误导致结果不准确。
2、所有悬浮粉末和缓冲液应按照说明书中的要求储存,并避免暴露在高温、阳光直射或湿度过高的环境中。
3、使用前请检查试剂盒是否有损坏或过期,如有问题请勿使用。
4、操作过程中请佩戴适当的实验防护设备,避免对自己和他人造成伤害。
准确使用GST蛋白纯化试剂盒可以高效地纯化目标蛋白,为科研工作者提供了一个有效的实验工具。
GST标签纯化
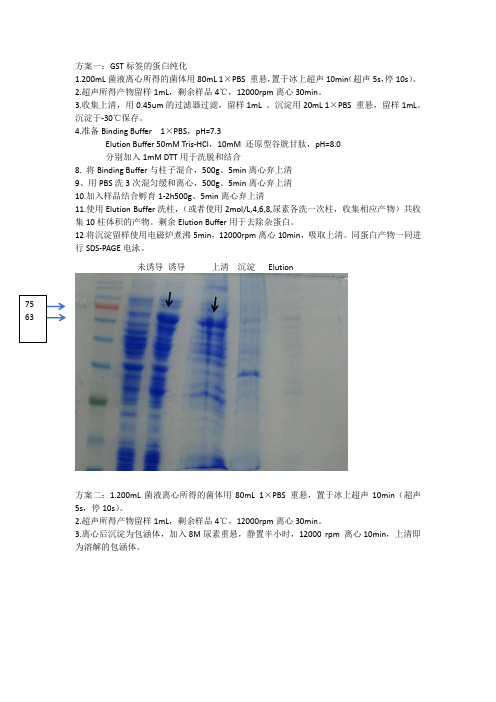
方案一:GST标签的蛋白纯化1.200mL菌液离心所得的菌体用80mL 1×PBS 重悬,置于冰上超声10min(超声5s,停10s)。
2.超声所得产物留样1mL,剩余样品4℃,12000rpm离心30min。
3.收集上清,用0.45um的过滤器过滤,留样1mL 。
沉淀用20mL 1×PBS 重悬,留样1mL。
沉淀于-30℃保存。
4.准备Binding Buffer 1×PBS,pH=7.3Elution Buffer 50mM Tris-HCl,10mM 还原型谷胱甘肽,pH=8.0分别加入1mM DTT用于洗脱和结合8. 将Binding Buffer与柱子混合,500g、5min离心弃上清9、用PBS洗3次混匀缓和离心,500g、5min离心弃上清10.加入样品结合孵育1-2h500g、5min离心弃上清11.使用Elution Buffer洗柱,(或者使用2mol/L,4,6,8,尿素各洗一次柱,收集相应产物)共收集10柱体积的产物。
剩余Elution Buffer用于去除杂蛋白。
12将沉淀留样使用电磁炉煮沸5min,12000rpm离心10min,吸取上清。
同蛋白产物一同进行SDS-PAGE电泳。
未诱导诱导上清沉淀Elution7563方案二:1.200mL菌液离心所得的菌体用80mL 1×PBS 重悬,置于冰上超声10min(超声5s,停10s)。
2.超声所得产物留样1mL,剩余样品4℃,12000rpm离心30min。
3.离心后沉淀为包涵体,加入8M尿素重悬,静置半小时,12000 rpm 离心10min,上清即为溶解的包涵体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
亲和层析纯化可溶性GST标签重组蛋白的标准操作规程(编号:069)1、目的及适用范围
利用GST亲和层析纯化体外表达的带有His标签的可溶性重组蛋白。
2、主要仪器
GST柱、真空抽滤泵、超声破碎仪、冷冻离心机
3、主要试剂
3.1 Binding Buffer:1×PBS
3.2 Elution Buffer:20-50mM还原型谷胱甘肽
3.3 高pH值缓冲溶液:0.1M Tris,0.5M NaCl,pH 8.5
3.4 低pH值缓冲溶液:0.1M 醋酸钠,0.5M NaCl,pH
4.5
4、GST柱的预处理
用5个柱体积的1×PBS缓冲溶液平衡柱子
5、操作步骤
5.1蛋白的纯化
5.1.1大肠杆菌诱导表达目的蛋白;
5.1.2 4500rpm,离心10-15min,弃上清,收集菌体;
5.1.3 将收集的菌体用1×PBS重悬,8000rpm离心10min,弃上清,收集菌体;
5.1.4 将菌体用1×PBS重悬,超声破碎菌体;
5.1.5 4℃,12000rpm,离心15min,收集超声后上清;
6.1.6 将收集的上清加入GST柱子中,4℃结合2h;
5.1.7 流出穿透液;
5.1.8 用20-30个柱体积的1×PBS冲洗柱子,除去非特异性结合的杂蛋白;
5.1.9 用1-3个柱体积的Elution Buffer洗脱目的蛋白;
5.1.10将诱导前全菌,诱导后全菌,穿透,洗脱样品进行SDS-PAGE电泳,检测纯化效果。
5.2 柱子的再生
5.2.1 用3个柱体积的高pH缓冲溶液冲洗柱子;
5.2.2 用3个柱体积的低pH缓冲溶液冲洗柱子;
141。
