阿伏加德罗定律专题
阿伏伽德罗定律及其推论ppt课件.ppt
1.下列说法中正确的是 [
]
A.相同状况下,
气体的摩尔体积约等于22.4L/mol
B.标准状况下,22.4L的任何气体中都
约含有6.02×1023个分子
C.0℃,101kPa条件下,5.6LNH3中约 含有6.02×1023个原子
D.100℃、101kPa条件下,
22.4L水蒸气的质量等于18g
2.同温同压下,物质的量为0.2mol的 N2O(气)和NO2(气),它们的 [ CD ] A.质量相同,体积不同 B.体积相同,分子数不同 C.分子数相同,质量不同 D.体积相同,原子数相同
m
M
n X NA
N
XM
NA
ρ Vm X
ρX
Vm
V
1.利用气体摩尔体积,进行质量与体积 间的相互计算
【例题1】8.5g氨在标准状况时体积是多少升? 解:氨的式量是17,氨的摩尔质量是17g/mol
n(NH3)=
m(NH3) M(NH3) =
8.5g 17g/mol = 0.5mol
V(NH3)=22.4L/mol×0.5mol=11.2L
等于摩尔质量比。
练习:
ρ1∶ρ2=M 1∶M 2
在标准状况下,空气的平均式量为29,
相同条件下的下列气体密度比空气密度大的是(①③④ )
①CO2②H2③Cl2④HCl⑤N2
推论5
恒温恒容下,
气体的压强比等于它们的物质的量之比。
即:p1∶p2=n1∶n2
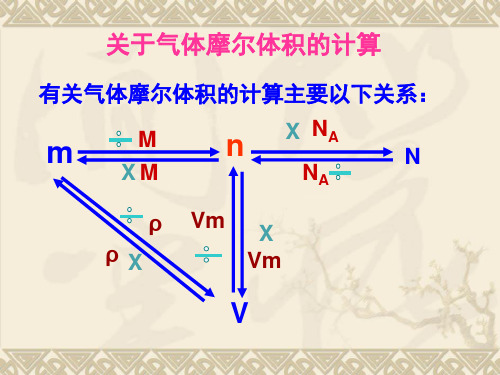
三、关于气体摩尔体积的计算
有关气体摩尔体积的计算主要以下关系:
解得:x=8g m(CO2)=30g-8g=22g
V(CO2)=17.6L-6.4L=11.2L
答:CO的质量为8g,CO2的质量为22g; CO的体积为6.4L,CO2的体积为11.2L。
专题9 阿伏加德罗定律及阿伏加德罗常数

专题9 阿伏加德罗定律及阿伏加德罗常数 自我检测1、设NA 为阿佛加德罗常数,下列叙述中正确的是A .46 g NO 2 和 N 2O 4混合气体中含有原子数为3N AB .标准状况下22.4 L H 2 中含中子数为2N AC .1L 1mol/L 醋酸溶液中离子总数为2N AD .1molMg 与足量O 2或N 2反应生成MgO 或Mg 3N 2均失去2N A 个电子2、设阿伏加德常数为N A 。
则下列说法正确的是A .常温常压下,11.2L 甲烷中含有的氢原子数为2N AB .标准状况下,0.3mol 二氧化硫中含有氧原子数为0.3N AC .常温下,2.7g 铝与足量的盐酸反应,失去的电子数为0.3N AD .常温下,1L 0.1mol/L MgCl 2溶液中含Mg 2+数为0.2N A3、N A 代表阿伏加德罗常数,下列说法正确的是A .9gD 2O 中含有的电子数为5N AB .1molMgCl 2中含有的离子数为2N AC .1molCH 4分子中共价键总数为4N AD .7.1g C12与足量NaOH 溶液反应转移的电子数为0.2N A4、设N A 为阿伏加德罗常数,下列叙述中正确的是A .常温下11.2L 的甲烷气体含有甲烷分子数为0.5N A 个B .14g 乙烯和丙烯的混合物中总原子数为3N A 个C .0.1mol/L 的氢氧化钠溶液中含钠离子数为0.1N A 个D .5.6g 铁与足量的稀硫酸反应失去电子数为0.3N A 个5、设N A 为阿佛加德罗常数,下列说法正确的是A .23g 钠在氧气中完全燃烧失去电子数为0.5N AB .1L2mol·L -1的MgCl 2溶液中含Mg 2+数为2N AC .标准状况下,11.2L 的SO 3所含分子数为0.5N AD .室温下,8g 甲烷含有共价键数为2N A6、N A 代表阿伏加德罗常数。
下列有关叙述正确的是A .标准状况下,2.24LH 2O 含有的分子数等于0.1N AB .常温下,23100m L 1m ol /L N aC O 溶液中阴离子总数大于0.1N AC .分子数为N A 的CO 、C 2H 4混合气体体积约为22.4L ,质量为28gD .3.43gN H 中含N —H 键数目为A 0.2N7、设N A 为阿佛加德罗常数,下列说法不正确的是A .标准状况下的22.4L 辛烷完全燃烧,生成二氧化碳分子数为8N AB .18g 水中含有的电子数为10N AC .46g 二氧化氮和46g 四氧化二氮含有的原子数均为3N AD .在1L2mol/L 的硝酸镁溶液中含有的硝酸根离子数为4N A8、N A 为阿佛加德罗常数,下述正确的是A .80g 硝酸铵含有氮原子数为2N AB .1L 1mol/L 的盐酸溶液中,所含氯化氢分子数为N AC .标准状况下,11.2L 四氯化碳所含分子数为0.5 N AD.在铜与硫的反应中,1mol铜失去的电子数为2 N A9、以N A表示阿佛加德罗常数,下列说法中正确的是A.53g碳酸钠中含N A个CO32-B.0.1molOH-含N A个电子C.1.8g重水(D2O)中含N A个中子D.标准状况下11.2L臭氧中含N A个氧原子10、下列有关物理量相应的单位表达错误的是A.摩尔质量g/mol B.气体摩尔体积L/molC.溶解度g/100g D.密度g/cm311、某非金属单质A和氧气发生化合反应生成B。
阿伏伽德罗定律练习题

阿伏加德罗定律基础知识点一、阿伏加德罗定律1.内容在同温同压下,同体积的气体含有相同的分子数。
即“三同”定“一同”。
2.推论(1)同温同压下,V1/V2=n1/n2(2)同温同体积时,p1/p2=n1/n2=N1/N2(3)同温同压等质量时,V1/V2=M2/M1(4)同温同压同体积时,W1/W2=M1/M2=ρ1/ρ2二、阿伏加德罗常数物质的量是以阿伏加德罗常数来计量的,0.012kg碳-12所含的碳原子数就是阿伏加德罗常数(NA)。
6.02×1023是它的近似值。
1、阿伏加德罗常数的直接应用例1、下列说法正确的是(NA表示阿伏加德罗常数)A.标准状况下,以任意比例混合的甲烷和丙烷混合物22.4L,则所含有的分子数为NAB.标准状况下,1L辛烷完全燃烧后,所生成气态产物的分子数为8/22.4NAC.常温常压下,活泼金属从盐酸中置换出1molH2时发生转移的电子数为2NAD.常温常压下,1mol氦气含有的核外电子数为4NA解析:阿伏加德罗定律所述的气体包括混合气体。
标准状况下,22.4L混合气体所含有的分子数为NA,所以选项A正确。
标准状况下,辛烷是液体,不能使用标准状况下气体的摩尔体积22.4L/mol这一量,所以1L辛烷的物质的量不是1/22.4mol,选项B错误。
每生成1molH2时必有2molH+获得2mol电子,即转移电子数为2NA,选项C正确。
1个氦原子核外有2个电子,氦气是单原子分子,所以1mol氦气含有2mol电子,这与外界温度和压强无关,所以选项D错误。
本题正确答案为AC。
2、阿伏加德罗定律与化学方程式例2、在一定条件下,有aL O2和O3的混合气体,当其中的O3全部转化为O2时,体积变为1.2aL,求原混合气中O2和O3的质量百分含量。
解析:由阿伏加德罗定律,结合化学方程式的意义可知,化学方程式中气体化学式的系数比等于其体积比,所以此题实际上是阿伏加德罗定律的应用题。
专题二--阿伏伽德罗定律

1 依照阿伏加德罗定律,下列叙述正确的是()A. 同温同压下,两种气体的体积之比等于摩尔质量之比B. 同温同压下,两种气体的物质的量之比等于密度之比C. 同温同压下,两种气体的摩尔质量之比等于密度之比D. 同温同压同体积下,两种气体的质量之比等于密度之比2.已知同温同压下,不同气体的体积相同,所含的气体分子数相同。
判断下列说法正确的是A.同温同压下,两种气体的物质的量之比等于它们的密度之比B.同温同压下,两种气体的相对分子质量之比等于它们的密度之比C.同温同压下,两种气体的分子数之比等于它们的相对分子质量之比D.同温同压下,两种气体的体积之比等于它们的摩尔质量之比3.在0℃1.01×105 Pa下,有关H2、O2、CH4三种气体的叙述正确的是A.其密度之比等于物质的量之比B.其密度之比等于摩尔质量之比C.等质量的三种气体,其体积比等于相对分子质量的倒数比D.等体积的三种气体,其物质的量之比等于相对分子质量之比4.A气体的摩尔质量是B气体的n倍,同温同压下,B气体的质量是同体积空气的m倍,则A的相对分子质量为13.在0℃1.01×105 Pa下,有关H2、O2、CH4三种气体的叙述正确的是BCA.其密度之比等于物质的量之比B.其密度之比等于摩尔质量之比C.等质量的三种气体,其体积比等于相对分子质量的倒数比D.等体积的三种气体,其物质的量之比等于相对分子质量之比5.A气体的摩尔质量是B气体的n倍,同温同压下,B气体的质量是同体积空气的m倍,则A的相对分子质量为CA.m/n B.29m/n C.29mn D.29n/m6. 下列两种气体的分子数一定相等的是A.质量相等、密度不等的N2和C2H4B.等体积等密度的CO和C2H4C.等温等体积的O2和N2D.等压等体积的N2和CO27.下列条件下,两瓶气体所含原子数一定相等的是A.同质量、不同密度的N2和CO B.同温度、同体积的H2和N2C.同体积、同密度的C2H4和C3H6D.同压强、同体积的N2O和CO28.下列叙述正确的是A.同温同压下,相同体积的物质,它们的物质的量必相等B.任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等C.1L一氧化碳气体一定比1L氧气的质量小D.等体积、等物质的量浓度的强酸中所含的H+数一定相等9.(2008年海南)在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是:A.甲的分子数比乙的分子数多 B.甲的物质的量比乙的物质的量少C.甲的摩尔体积比乙的摩尔体积小 D.甲的相对分子质量比乙的相对分子质量小10.(2006年江苏)标准状况下两个容积相等的贮气瓶,一个装有02,另一个装有CH4,两瓶气体具有相同的()A.质量B.原子总数C.密度D.分子数11.(2006年四川卷)在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是A.两种气体的压强相等B. O2比03的质量小C.两种气体的分子数目相等D.两种气体的氧原子数目相等12.同温、同压下,下列有关比较等质量的二氧化硫气体和二氧化碳气体的叙述中正确的是()A.密度比为16:11 B.密度比为11:16C.体积比为1:1 D.体积比为11:1613.在标准状况下,m g气体A与ng气体B的分子数相同,下列说法中不正确的是()A.两种气体A与B的相对分子质量比为m:nB.同质量气体A与B的分子个数比为n:mC.同温,同压下,A与B气体的密度比为n:mD.相同状况下,同体积A与B质量比为m:n14、某非金属单质A和氧气发生化合反应生成B。
2023年高考必备阿伏加德罗常数及其定律相关知识点归纳

一、与“阿伏加德罗常数和阿伏加德罗定律”有关知识点归纳(一)阿伏加德罗常数有关知识归纳1. 阿伏加德罗常数旳概念及理解⑴概念:1 mol任何粒子旳粒子数叫阿伏加德罗常数, 一般用“NA”表达, 而6.02×1023是阿伏加德罗常数旳近似值。
⑵概念旳理解: ①阿伏加德罗常数旳实质是1mol任何粒子旳粒子数, 即12g12C所含旳碳原子数。
②不能说“含6. 02×1023个粒子旳物质旳量为1mol”, 只能说“含阿伏加德罗常数个粒子旳物质旳量为1mol”。
③阿伏加德罗常数与6.02×1023不能等同, 阿伏加德罗常数不是一种纯数, 它有单位, 其单位为“mol-1”, 而6.02×1023只是一种近似值, 它无单位。
2. 与阿伏加德罗常数有关旳概念及其关系①物质旳量物质旳量(n)、阿伏加德罗常数(NA)与粒子数(N)之间旳关系: n=N/NA。
②摩尔质量摩尔质量(Mr)、阿伏加德罗常数(NA)与一种分子(或原子)真实质量(mr)之间旳关系: mr=Mr/ NA。
③物质旳质量物质旳质量(m)、阿伏加德罗常数(NA)与粒子数(N)之间旳关系: m/Mr=N/ NA。
④气体体积气体体积(V)、阿伏加德罗常数(NA)与粒子数(N)之间旳关系:V/Vm=N/NA, 当气体在原则状况时, 则有:V/22.4=N/ NA。
⑤物质旳量浓度物质旳量浓度(cB)、溶液旳体积(V)与物质旳量(nB)之间旳关系: cB= nB/V,根据溶液中溶质旳构成及电离程度来判断溶液中旳粒子数。
3. 有关阿伏加德罗常数试题旳设陷方式命题者为了加强对考生旳思维能力旳考察, 往往故意设置某些陷阱, 增大试题旳辨别度。
陷阱旳设置重要有如下几种方面:⑴状态条件考察气体时常常给出非原则状况(如常温常压)下旳气体体积, 这就不能直接用“22.4L/mol”进行计算。
⑵物质旳状态考察气体摩尔体积时, 命题者常用在原则状况下某些易混淆旳液体或固体作“气体”来设问, 困惑学生。
阿伏伽德罗定律习题

1.在常温下20 L 密闭容器中通入a molH 2、b molO 2(a ≤4,b ≤4,a 、b 均为正整数),点燃后充分反应恢复到原温度时,容器中气体(水蒸气忽略不计)密度最大可能是 ( )A 5.6 g/LB 9.6 g/LC 11.2 g/LD 56 g/L2.同温同压下,某容器中充满O 2重116 g ,若充满CO 2重122 g ,现充满某气体重114 g ,则某气体的相对分子质量为 ( )A 28B 60C 32D 443.只要知道下列哪一组物理量,就可以估算出气体分子间的平均距离?(A )阿伏伽德罗常数、气体的摩尔质量和质量;(B )阿伏伽德罗常数,气体的摩尔质量和体积;(C )该气体的密度、体积和摩尔质量;(D )阿伏伽德罗常数、该气体的摩尔质量和密度。
[解析]阿伏伽德罗常数是联系宏观世界和微观世界的桥梁,具有代表性的关系式有:设分子的质量为m ,则M =NA·m ;设物质的摩尔体积为V ,则每个分子占有的体积为Vm =A N V,(此式对固体和液体可以近似理解为每个分子的体积,对气体可以理解为每个分子平均占有的空间体积)。
另外,物质的密度ρ=M/V ,利用这些关系式,再利用体积公式,就可对本题的各选项进行选择。
已知气体的摩尔质量和质量,可以求出物质的量,再知道阿伏伽德罗常数,只能求出分子总数。
已知阿伏伽德罗常数和气体的摩尔质量和体积,无法求得分子总数。
已知气体密度和体积及摩尔质量,只能求出摩尔数,不知阿伏伽德常数,无法求分子总数。
已知阿伏伽德罗常数及该气体的摩尔质量和密度,可以求出该气体的摩尔体积。
[答案]D 。
4. 下列两种气体的分子数一定相等的是A.质量相等、密度不等的N2和C2H4B.等体积等密度的CO 和C2H4C.等温等体积的O2和N2D.等压等体积的N2和CO25. 下列条件下两瓶气体所含原子数一定相等的是A 同质量、不同密度的N2和COB 同体积、同密度的C2H4和C3H6C 同温度、同体积的H2和N2D 同压强、同体积的N2O 和CO26.常温下,在某容积固定的密闭容器里分别充入两种气体各m ol 1.0,在一定条件下充分反应后,恢复至原温度,容器内气体的压强降为开始时的1/4,则原混合气体可能是A. 2H 和2OB. HCl 和3NHC. 2H 和2ClD. CO 和2O 解析:V 、T 相同时,由RT n V p 11=、RT n V p 22=可推出:V RT n p 11=,V RT n p 22=,所以212121n n RT n V V RT n p p =⨯=。
高考选择。阿伏伽德罗专题。(含答案解析)

高考选择。
阿伏伽德罗专题。
(含答案解析)1.阿伏伽德罗常数是指单位物质中含有的粒子数,其值为6.02×10²³/mol。
下列说法正确的是:A。
3.6 g D₂O中含有的中子数为2N_A。
B。
10 g C₂H₄和4 g CO组成的混合气体中含有的分子数为0.5N_A。
C。
标准状况下,2.24 L HF中含有的分子数为0.1N_A。
D。
KIO₃与HI溶液反应,生成0.1 mol I₂转移的电子数为0.2N_A。
2.阿伏伽德罗常数是指单位物质中含有的粒子数,其值为6.02×10²³/mol。
下列说法正确的是:A。
标准状况下,22.4 L盐酸含有N_A个HCl分子。
B。
常温常压下,7.8 g Na₂O₂含离子数为0.4N_A。
C。
室温下向1 L pH=1的醋酸溶液中加水,所得溶液中H 数目大于0.1 N_A。
D。
1 mol 乙酸(忽略挥发损失)与足量的 C₂H₅OH 在浓硫酸作用下加热,充分反应可生成N_A个CH₃COOC₂H₅。
3.阿伏伽德罗常数是指单位物质中含有的粒子数,其值为6.02×10²³/mol。
下列有关叙述正确的是:A。
将 78 g Na₂O₂与过量 CO₂反应转移的电子数为2N_A。
B。
1 mol N₂与4 mol H₂反应生成的 NH₃分子数为2N_A。
C。
标准状况下,2.24 L CCl₄中所含原子数为0.5N_A。
D。
标准状况下,18 g D₂O中所含电子数为9N_A。
4.阿伏伽德罗常数是指单位物质中含有的粒子数,其值为6.02×10²³/mol。
下列说法正确的是:A。
标准状况下,11.2 L的甲醇所含的氢原子数等于2N_A。
B。
常温常压下,Na₂O₂与H₂O反应生成1 mol O₂时,转移电子数是2N_A。
C。
25℃时,Ksp(BaSO₄)=1×10⁻¹³,则 BaSO₄饱和溶液中 Ba 数目为1×10⁻¹³N_A。
阿伏伽德罗定律ppt课件.ppt

(1)“三同”定“一同”。
(2)适用于气态物质。既适用于单一气体, 又适用于混合气体。
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
理想气体的状态方程:PV=nRT P---压强 V---体积 n---物质的量 R---常数 T---热力学温度(T=273+t)
V1 = n1 Vn
(推论一已得) 则:Βιβλιοθήκη m1r1 m2r22
2
所以
r 1
=
M1
r 2
M2
= m1M1
m2M2
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
[练习3]
• 同温同压下,体积相同的下列气体,
密度与其它三者不同的是( ) D
(2)m(A)= m3–m1(g),设气体A的摩尔质量为M, 则:n(A)= (m3–m1)/M mol
(3)因气体A与氧气的体积相等,由推论:V1/V2=n1/n2得: (m2–m1)/32 mol = (m3–m1)/M mol
则:M= 32(m3–m1)/ (m2–m1) (g/mol)
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
篮球比赛是根据运动队在规定的比赛 时间里 得分多 少来决 定胜负 的,因 此,篮 球比赛 的计时 计分系 统是一 种得分 类型的 系统
阿伏加德罗定律的推论三
依据:PV=n RT 或 PV= m RT 以及 ρ=m/V M
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
阿伏加德罗定律推论的应用举例
推论一:同温同压下,气体的密度比等于气体的式量比。
1. 在相同温度压强下,实验室制得的下列体积的气体密度由大到小的顺序正确的是()①10mL O2 ②20mL H2 ③30mL Cl2 ④40mL CO2
A. ③④①②
B. ④③②①
C. ①②③④
D. 无法确定
解析;气体的密度与气体的体积无关。
所以选A。
推论二:同温同压下,气体的体积比等于气体的物质的量比、等于气体的分子数比。
2. 化合物A是一种不稳定的物质,它的分子组成可用OxFy表示,10mLA气体能分解生成15mL O2和10mL F2(同温同压)。
A的化学式是________,推断的依据是_________。
解析:OxFy→O2 +F2
10mL 15mL 10mL
分子数比 2 3 2
再由质量守恒定律得x=3,y=2。
A的化学式为O3F2
推论三:同温同压下,同体积的任何气体的质量比等于其密度比。
3.依照阿伏加德罗定律,下列叙述正确的是()
A. 同温同压下,两种气体的体积之比等于摩尔质量之比
B. 同温同压下,两种气体的物质的量之比等于密度之比
C. 同温同压下,两种气体的摩尔质量之比等于密度之比
D. 同温同压同体积下,两种气体的质量之比等于密度之比
解析:根据阿伏加德罗定律及推论,应选CD。
综合题
4.同温同压下,下列有关比较等质量的二氧化硫和二氧化碳气体的叙述正确的是BC
A.体积比为1∶1
B. 体积比为11∶16
C.密度比为16∶11
D. 密度比为11∶16
5.等物质的量的氢气和氧气在同温同压下具有相等的BC
A.原子数B.体积 C.分子数D.质量
6.相同状况下,下列气体所占体积最大的是D
A.80g SO3 B.16g O2 C.32g H2S D.3g H2
7.在同温同压下,相同质量的下列气体中,体积最大的是A
A.H2
B.NH3
C.O2
D.SO2
8.同温同压下,甲容器中所盛气体为CH4,乙容器中所盛气体为C2H2。
(1)若甲、乙两容器中所含氢原子数相等,则两容器所盛气体的体积之比为。
(2)若甲、乙两容器中所含原子总数相等,则两容器所盛气体的物质的量之比为
1) 1∶2 (2) 4∶5
9.在0℃1.01×105 Pa下,有关H2、O2、CH4三种气体的叙述正确的是BC
A.其密度之比等于物质的量之比
B.其密度之比等于摩尔质量之比
C.等质量的三种气体,其体积比等于相对分子质量的倒数比
D.等体积的三种气体,其物质的量之比等于相对分子质量之比
10.同温同压下,某瓶充满O2时为116g,充满CO2时为122g,充满气体A时为114g,则A 的式量为D
A.60 B.32 C.44 D.28
令气体的物质的量为n,容器质量为m,则:
m+n×32g/mol=116g,
m+n×44g/mol=122g.解得,n=0.5mol,m=100g.充满气体X后的质量为114g,所以气体X 的质量为114g-100g=14g,物质的量为0.5mol.气体X的摩尔质量为28
11.混合气体由N2和CH4组成,测得混合气体在标准状况下的密度为0.821g/L,则混合气体中N2和CH4的体积比为B
A.1:1 B.1:4 C.4:1 D.1:2
12.在一定条件下,1体积气体A2和3体积气体B2完全反应生成了2体积气体X(体积在相同条件下测定),则X的化学式是D
A、AB
B、A2B3
C、AB2
D、AB3。
