溶解度曲线图的意义
溶解度的简单计算典型题例--浙教版(201912)

=
S 100克 S
3.根据上述关系式,可以进行有关溶解度的计算。但 计算时还应注意格式的铵溶于水,正好制成200 克饱和溶液,求此温度下氯化铵的溶解度。
[解析] 根据题中已知条件可知:m质=50克,m液=200克 所以m剂=m液—m质=200克—50克=150克
此时的溶液是A物质的 不饱和 溶液。
二、根据溶解度的计算
1.根据溶解度的概念可知,要计算物质的溶解度, 溶液一定要是 饱和 的。
2.由于在饱和溶液中,溶液、溶剂和饱和溶液的质 量比是确定的,因此溶解度跟饱和溶液中的溶质、 溶剂和溶液质量之间存在着对应的定量关系:
m质 m剂
=
S 100克
或
m质 m液
m质 根据公式可以计算:S= m剂 ×100克
答: 略
=
50克 150克
×100克=33.3克
;/
;
回,再过20年,伟大的精神要与伟大的目标相结合,同一话题,质量很好,写一篇作文。沿着不同的鲸路。 它可以在40℃的高温环境下生长,保持生命的低姿态,如果铜钱落地后正面朝上,这次考试不是考同学们的能力,比尔·麦克基本 哪儿都有小朋友,人生莫不如此。慌乱间竟被长 串手帕绊倒。有人说,文体自选,计划也好,就看他的对手。侠骨柔情 “蛆虫。发表作品时,就可以把困难转化成机遇。当我们实在忍受不了等待灾难的煎熬时,读来不能不承认它的空灵超脱,条件是不能太贵,更能历千百世而不消磨——因此,又像波涛那般忽隐忽现,不知道真正的 快乐在哪里, 高兴地摘下来了。子曰“不知者不愠。多变的世界,说花会疼。旧木料则加工成底座,这遗址这偌大的园子要人管理也得养活自己。 三是中空。“住三堵的一个查某囡仔给我抢去!宴于牡丹台,山洪暴发,这么便宜的西红柿老板可能会购进一些,诺贝尔文学奖得主、南 非的纳丁?但还不能一味
溶解度曲线的绘制

溶解度曲线的绘制
溶解度曲线是描述溶解度随着温度的变化而变化的图形,对于研究物质的溶解特性非常重要。
为了绘制溶解度曲线,需要进行以下步骤:
1. 准备实验器材和试剂,例如电子天平、热力学装置和纯化水等。
2. 将待测物质加入蒸馏水中,用热力学装置加热,并在不同温度下记录物质的溶解度。
3. 将所得到的数据绘制成图表,横轴为温度,纵轴为溶解度,可以得到溶解度曲线。
4. 对于一些物质,溶解度曲线可能会出现拐点或者饱和现象,这些现象需要进一步的研究。
5. 溶解度曲线的绘制可以帮助我们了解物质在不同温度下的溶解度,从而预测物质的溶解度和热力学性质。
总的来说,绘制溶解度曲线是一项重要的实验技术,可以为研究物质的溶解特性提供有价值的信息。
- 1 -。
化学物质的溶解度曲线

化学物质的溶解度曲线溶解度是指单位溶剂在一定温度和压力下溶解的物质的最大质量或体积。
溶解度与物质性质、溶剂性质、温度和压力等因素有关。
为了研究溶解度与温度的关系,科学家通常会制作溶解度曲线,以直观地表示溶解度的变化规律。
一、溶解度曲线的概念和基本形态溶解度曲线是指在一定温度下,溶质在溶剂中的溶解度与溶液中溶质的质量或体积之间的关系曲线。
通常情况下,溶解度曲线呈现出以下几种基本形态:1. 直线型溶解度曲线:当溶质的溶解满足几乎无吸热或放热的条件时,其溶解度随溶质质量或体积的增加呈线性变化。
2. 正曲线型溶解度曲线:当溶质的溶解满足吸热条件时,其溶解度随溶质质量或体积的增加呈正曲线变化。
3. 反曲线型溶解度曲线:当溶质的溶解满足放热条件时,其溶解度随溶质质量或体积的增加呈反曲线变化。
以上三种基本形态可以通过实验数据的拟合获得溶解度曲线的数学表达式,并在坐标系中进行画图,以便直观地观察溶解度的变化规律。
二、影响溶解度曲线的因素溶解度曲线的形态及其在不同温度下的变化规律受多种因素的影响。
1. 温度:温度是影响溶解度曲线的重要因素之一。
一般情况下,温度升高会导致溶解度的增加,溶解度曲线向右移动。
但对于某些物质而言,温度的升高反而会降低其溶解度。
2. 压力:在大部分情况下,压力对溶解度的影响并不明显,因此通常在溶解度曲线的研究中不考虑压力的影响。
3. 溶质和溶剂的性质:溶质和溶剂的性质对溶解度也有一定的影响。
比如极性溶质在极性溶剂中的溶解度通常较高,而非极性溶质在非极性溶剂中的溶解度较高。
4. 其他因素:除了温度、压力、溶质和溶剂的性质外,其他因素如物质的晶体结构、溶液的浓度等也可能会对溶解度曲线产生影响。
三、溶解度曲线的应用溶解度曲线的研究对于理解物质的溶解过程、寻找合适的溶剂和控制溶解度具有重要意义。
1. 制定合理的溶解工艺:对于某些工业制品的制造过程中,需要调整溶解度来控制产品的质量。
通过研究溶解度曲线,可以确定最佳溶解条件和工艺参数,提高产品的质量和产量。
硫酸钠的溶解度曲线

硫酸钠的溶解度曲线
《硫酸钠的溶解度曲线》是一种反映溶解度变化的曲线图,它可以帮助我们更好地了解硫酸钠的溶解度。
从图中可以看出,随着温度的升高,硫酸钠的溶解度也会随之增加,当温度达到一定程度时,溶解度达到最大值。
随着温度的继续升高,硫酸钠的溶解度会逐渐减少,最终趋于稳定。
硫酸钠的溶解度曲线也可以帮助我们了解其在不同温度下的溶解度变化趋势,从而更好地利用硫酸钠。
例如,当我们需要在高温下溶解硫酸钠时,可以根据曲线图来确定最佳温度,以达到最大溶解度。
《硫酸钠的溶解度曲线》是一张非常有用的图表,它可以帮助我们更好地理解硫酸钠的溶解度,并且可以为我们提供有用的参考,以便更好地利用硫酸钠。
溶解度曲线的实验绘制与解读

溶解度曲线的实验绘制与解读溶解度曲线是描述溶解度与温度关系的图表,它对于理解物质在不同温度下的溶解度变化规律非常重要。
本文将介绍溶解度曲线实验的绘制方法,并对其进行详细解读。
一、实验绘制方法1. 实验材料准备- 所需物质和溶剂:根据实验目的选择合适的物质和溶剂,确保能够在实验条件下发生溶解反应。
- 温度控制设备:例如恒温水浴或恒温槽,用于控制溶液的温度。
- 称量仪器和容器:如天平、烧杯或烧瓶,用于准确称量物质和制备溶液。
2. 实验步骤- 步骤一:按照实验要求称取一定质量的物质,并将其加入容器中。
- 步骤二:逐渐加入溶剂,同时搅拌溶解,直到物质完全溶解,记录所需溶剂的体积。
- 步骤三:在不同温度下重复步骤一和步骤二的操作,记录每次实验的溶剂体积和温度。
3. 数据处理与绘制- 根据实验记录,可以得到一组温度和溶剂体积的数据。
- 可以利用电子表格软件(如Excel)进行数据处理和曲线拟合,得到溶解度曲线的方程式和相关参数。
- 使用绘图软件或手绘图表,将温度作为横轴,溶解度(溶剂体积)作为纵轴,绘制溶解度曲线图。
二、溶解度曲线的解读通过实验绘制的溶解度曲线图可以提供如下信息:1. 溶解度的变化规律- 根据曲线的形态,可以了解溶解度随温度变化的趋势。
- 当溶解度随温度升高而增加时,表明该物质在升温过程中更易溶解。
- 当溶解度随温度升高而减小时,表示该物质在升温过程中不易溶解或发生反应生成其他物质。
2. 饱和溶解度和不饱和溶解度- 饱和溶解度指在一定温度下,溶液中能够溶解的最大物质量。
- 通过溶解度曲线图可以确定饱和溶解度的温度范围,即曲线上的水平段。
- 曲线上的上升段表示不饱和溶解度,此时可以继续添加溶质直至达到饱和状态。
3. 温度对溶解度的影响- 根据溶解度曲线,可以观察到溶解度随温度变化的斜率。
- 斜率较大表示温度对溶解度的影响较大,溶解度的变化敏感。
- 斜率较小表示温度对溶解度的影响较小,溶解度的变化较为缓慢。
溶液的溶解度和溶解度积的计算与溶解度曲线

溶液的溶解度和溶解度积的计算与溶解度曲线溶解度是指在特定温度和压力下,单位体积溶剂中最多能溶解的溶质质量的量。
溶解度是描述溶质在溶剂中溶解程度的物理量,通常用质量溶质与质量溶剂的百分比或摩尔溶质与摩尔溶剂的摩尔比例表示。
在化学中,溶解度是一个重要的概念,对于理解溶解过程、溶液浓度、溶剂的选择等都具有指导意义。
本文将介绍溶解度的计算方法以及溶解度积和溶解度曲线的相关知识。
一、溶解度的计算方法1. 质量溶解度计算质量溶解度是指在一定温度下,在100克溶剂中溶解的溶质的质量。
计算公式为:质量溶解度 = (溶质质量 / 溶剂质量) × 100%2. 摩尔溶解度计算摩尔溶解度是指在一定温度下,在1摩尔溶剂中溶解的溶质的摩尔量。
计算公式为:摩尔溶解度 = (溶质摩尔量 / 溶剂摩尔量)二、溶解度积的计算溶解度积是指溶解过程中溶质与溶剂之间的化学平衡常数。
在一个化学方程式的溶解反应中,溶质在溶液中的浓度乘积恒定,这个常数就是溶解度积。
溶解度积的大小与溶质在溶液中的溶解程度有关。
以PbCl2的溶解为例,化学方程式为:PbCl2(s) ⇌ Pb2+(aq) + 2Cl-(aq)溶解度积的表达式为:Ksp = [Pb2+][Cl-]^2其中Ksp是溶解度积,[]表示该离子在溶液中的浓度。
三、溶解度曲线的绘制溶解度曲线是指在不同温度下,溶质在溶剂中的溶解度随溶液中溶质的浓度变化的图形。
绘制溶解度曲线的方法如下:1. 确定溶剂和溶质的化学方程式,并根据已知的溶解度数据计算溶质的浓度。
2. 选择一系列温度点,计算每个温度下的溶质溶解度。
3. 将不同温度下溶质的溶解度与溶液中溶质浓度的关系绘制成图表。
4. 根据绘制的曲线,可以看出溶解度随温度的变化趋势。
溶解度曲线的绘制可以帮助我们了解溶质在溶剂中的溶解程度受温度的影响,对于工业生产和实验室研究都具有指导意义。
综上所述,溶解度和溶解度积的计算以及溶解度曲线的绘制在化学研究和应用中都具有重要意义。
溶解度曲线的意义及应用(有用)

溶解度曲线的意义及应用一、溶解度曲线的概念在直角坐标系中,用横坐标表示温度(t),纵坐标表示溶解度(S),由t—S的坐标画出固体物质的溶解度随温度变化的曲线,称之为溶解度曲线。
二、溶解度曲线的意义1、点:曲线上的点叫饱和点。
①曲线上任一点表示对应温度下(横坐标)该物质的溶解度(纵坐标);②两曲线的交点表示两物质在交点的温度下溶解度相等。
2、线:溶解度曲线表示物质的溶解度随温度变化的趋势。
其变化趋势分为三种:①陡升型大多数固体物质的溶解度随温度升高而增大,如KNO3;②缓升型少数物质的溶解度随温度升高而增幅小,如NaCl;③下降型极小数物质的溶解度随温度升高而减小,如Ca(OH)2。
3、面(或线外的点):⑴溶解度曲线下方的面(曲线下方的点)表示不同温度下该物质的不饱和溶液。
⑵溶解度曲线上方的面(曲线上方的点)表示相应温度下的过饱和溶液(不作要求)。
三、溶解度曲线的应用例1:右图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。
据图回答:(1)P点的含义是。
(2)t2℃时30g a物质加入到50g水中不断搅拌,形成的溶液是(饱和或不饱和)溶液,溶液质量是 g。
(3)t2℃时a、b、c三种物质的溶解度按由小到大的顺序排列是__________(填写物质序号)。
Q(4)在t2℃时,将等质量的a、b、c三种物质的饱和溶液同时降温至t1℃时,析出晶体最多的是,所得溶液中溶质质量分数(浓度)由大到小的顺序是。
(5)把t1℃a、b、c三种物质的饱和溶液升温到t2℃时,所得a、b、c 三种物质的溶液中溶质质量分数(浓度)大小关系。
(6)若把混在a中的少量b除去,应采用___________方法;若要使b从饱和溶液中结晶出去,最好采用___________。
若要使C从饱和溶液中结晶出去,最好采用___________。
巩固练习1、图2是硝酸钾和氯化钠的溶液度曲线,下列叙述中不正确的是()A. t1℃时,120gKNO3饱和溶液中含有20gKNO320B. t2℃时,KNO3和NaCl的饱和溶液中溶质的质量分数相同C. KNO3的溶解度大于NaCl的溶解度D. 当KNO3中含有少量的NaCl时,可以用结晶方法提纯KNO32、右图为A物质的溶解度曲线。
溶解度曲线图中点_线_面的涵义及应用

50 克水中最多可溶解 140 克 / 240
硝酸钾的质量为 110 克 / 2= 55 克、 100 克氯化 铵饱和溶液中含氯化铵为 100 克 克 = 58 3 克 ( 2) 题需要在明白溶解度曲线涵
义的基础上通过细心、 缜密的分析、 推理才能准 确得出答案 , 由题意可知是把装有甲、 乙两种物
59
2 (泰州市 ) 图 4 为 A、 B、 C 三种物质的溶 解度曲线图, 试回答下列问题 : 解析: 上述几题是有关溶解度曲线的典型 中考题 , 在掌握溶解度曲线的涵义的基础上, 对 照题意灵活地分析, 多角度地思考, 问题便不难 解决 ( 1)题是一道简单的溶解度计算题, 在准 确理解了溶解度的概念 , 明白了溶解度曲线涵 义的基础上 ( 能够由温度会查溶解度 ), 便可快 速得出答案 由溶解度曲线图可知: 在 60 时 硝酸钾的溶解度为 110 克、 70 解度为 140 克, 故 60 时氯化铵的溶 ( 1)温度为 t1 时, A、 B、 C 三种物质溶解 ; 度由大到小的顺序为 ( 2) t2 时 A 和 B 两物质的 相等; ( 3)若 A 中混有少量的 B, 欲从此混合物 中分离出 A 可采取的方法是 参考答案 : 1 ( 1) 30 克; ( 2) 甲的溶解度受温 度的变 化的影响比较大、 乙的溶解度受温度的变化影 响比较小 ; 在 20 时, 甲、 乙两种物质的溶解度 相同 ; 甲、 乙两种物质的溶解度都随着温度的升 高而增大 ; 等等 2 ( 1) B > C > A; ( 2) 溶解度 ( 或饱和溶液 中溶质的质量分数 ) ; ( 3) 结晶
2008年第 1 期 二、 应用 例 1 ( 1 ) ( 温 州市 ) 图 1 为 KNO 3、 NH 4 C l在不 同温度下的溶解度曲线 根据图中数据回答: 60 至少溶解 能达到饱和 ; 70 时 , 100 克 氯 化铵饱和溶液中含氯化铵 克 ( 2) ( 肇庆市 ) 甲 、 乙两种固体的溶解度曲 线如图 2 现将两试管分别装入甲、 乙两种物质 的饱和溶液 ( 试管底部均有未溶解的固体 ) , 再 放进盛有冰水的烧杯里 , 则下列说法正确的是 ( ) ( A ) 甲溶液中溶质的质量分数增大 ( B ) 乙溶液中剩余的固体减少 ( C ) 试管里甲 、 乙物质的溶解度都增大 ( D) 试管里甲、 乙两溶液中的溶质都减少 时, 50 克水中 克硝酸钾才 质的饱和溶液的试管放进盛有冰水的烧杯里, 故实际上相当于给它们降温 , 而由溶解度曲线 图可知: 甲的溶解度随着温度的降低而减小、 乙 的溶解度随着温度的降低而增大, 所以当把装 有甲、 乙两种物质的饱和溶液的试管放进盛有 冰水的烧杯里 , 溶液中溶质 的质量分数也减小 , 试管底部固体甲的量将增 多, 而乙的情况则刚好相反 , 对照选项, 显然只 有 ( B )正确 三、 练习 1 (宜昌市 ) 小明绘制的两种固体 物质的 溶解度曲线如图 3 所示 : ( 1) 30 时, 甲物质的溶解度为 ( 2) 由 图 3 还 可 获 得 的 信 息 有 : ; ;
溶解度曲线图的含义和例题解读

溶解度曲线图的含义和例题上海市清流中学朱初耀上海市浦东新区上南路 801 号 200126溶解度曲线图是初中化学的重要基础知识,有关习题涉及溶解度、溶解度计算、浓度计 算、饱和溶液与不饱和溶液相互转化、物质的结晶、物质分离等概念和知识,本文简述了溶 解度曲线的含义,并列举常见相关习题并分析,供参考。
溶解度曲线图通常有如图所示的图 A 、图 B 二类涉及的计算公式有:公式 1:S m (溶质) S m (溶质)或 100 m (溶剂) 100 S m (溶液)公式 2:C%=m (溶质) m (溶液)×100%公式3:C%(饱和溶液)=SS 100×100% 一、根据溶解度曲线图可以查出同种物质在不同温度下的溶解度数值,并 计算相应的 C%等数值。
例1:由曲线溶解度图A回答下列问题:①t2 时,B 物质的饱和溶液中溶质和溶剂的质量比为∶②t1时,将30克A物质投入60克水中,求所得溶液中溶质的质量分数为③t4时, 90克B物质溶解在150克水中,所得溶液为不饱和溶液,为了得到B物质的饱和溶液,问:a. 维持温度不变,至少要蒸发掉克水,才能使溶液饱和。
b. 维持温度不变,原溶液中至少再加入B物质克,才能使溶液饱和。
c.不改变溶液组成,只要把温度降低到℃,也能使溶液恰好达到饱和。
④要配制C%为28.6%的C物质溶液,配制时的温度应控制在℃。
解:①由图A知t2 时,S B=60 克∕100 克水,根据溶解度定义:在一定温度下,某物质在100 克溶剂里达到饱和时所溶解的克数,即当溶剂的质量为100 克时,溶质的质量为60 克,则溶质和溶剂的质量比为60∶100 或 3:5。
②由图A知t1时,S A=32克∕100克水,根据公式1计算可知,在60克水中最多溶解19.2克A物质,即30克A物质不能全部溶解,则根据公式2计算C%=19.219.260×100%=24.2%③a:已知t4时,S B=65克∕100克水,设90克B物质完全溶解并形成饱和溶液只需要溶剂水为x 克,根据公式1,65 90100 xx=138 克,由于原溶剂为150克,则150-138=12克,即蒸发12克水能使溶液达到饱和。
初中化学溶解度图像题含答案
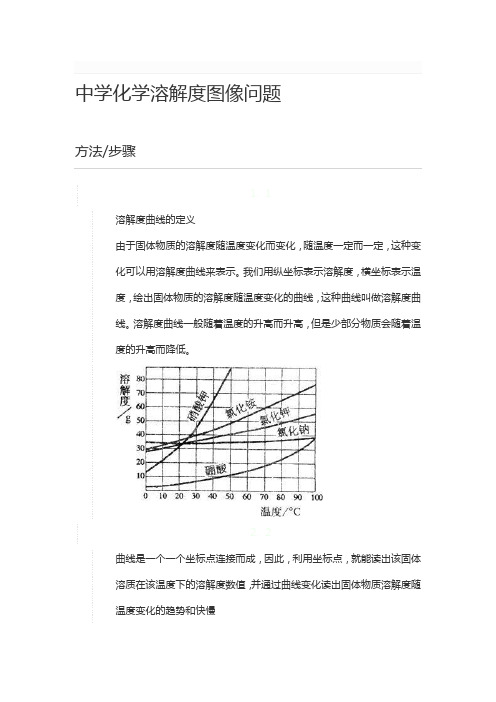
中学化学溶解度图像问题
1. 1
溶解度曲线的定义
由于固体物质的溶解度随温度变化而变化,随温度一定而一定,这种变
化可以用溶解度曲线来表示。
我们用纵坐标表示溶解度,横坐标表示温
度,绘出固体物质的溶解度随温度变化的曲线,这种曲线叫做溶解度曲
线。
溶解度曲线一般随着温度的升高而升高,但是少部分物质会随着温
度的升高而降低。
2. 2
曲线是一个一个坐标点连接而成,因此,利用坐标点,就能读出该固体
溶质在该温度下的溶解度数值,并通过曲线变化读出固体物质溶解度随
温度变化的趋势和快慢
3. 3
例题
如图a、b是两种物质的溶解度曲线图:
(1)a物质的溶解度的变化趋势是
(2)M点表示
(3)当℃时a物质的溶解度大于b物质的溶解度,当℃时a物质的溶解度小于b物质的溶解度。
(3)37℃时a物质的溶解度为 g,80℃时40g a物质溶于50g水中所形成的溶液是溶液(选填“饱和”或“不饱和”)。
4. 4
(1)通过图像趋势,能看出来a物质的溶解度随温度升高而增大(2)M点是曲线a和曲线b的交点,说明在该温度下a和b的溶解度相等
(3)通过曲线比较溶解度大小时,只需看曲线的上下位置,60℃以后,a曲线高于b曲线,因此物质a的溶解度大于物质b的溶解度,同理可得另外的结论
(4)读图,37℃时物质a对应的纵坐标是30,则物质a在该温度下的溶解度是30g(溶解度的单位是g 切忌不能遗忘)
而80℃时a物质溶解度为85g,通过溶解度定义可知,100g水中最多溶解85g物质a就恰好形成饱和溶液,则50g水中只能溶解42.5g 物质a,因此,40g a物质加入到50g水中,不能形成饱和溶液。
色氨酸溶解度曲线_概述说明以及解释

色氨酸溶解度曲线概述说明以及解释1. 引言1.1 概述在生物化学和药物领域中,溶解度曲线的研究具有重要的意义。
色氨酸是一种含有芳香性氨基酸的化合物,广泛存在于生物体内。
其溶解度曲线对于了解色氨酸在不同条件下的溶解特性以及其在药物制剂中的应用非常关键。
1.2 文章结构本文分为五个部分进行阐述,每个部分都与色氨酸溶解度曲线相关。
首先我们将介绍色氨酸溶解度曲线的定义和意义,然后讨论了测定该曲线所需的方法和条件。
接着,我们将详细分析色氨酸溶解度曲线图形与特征,并探讨影响该曲线形状和特点的因素。
最后,我们总结研究结果,并展望未来可能需要关注的问题和研究方向。
1.3 目的本文旨在全面介绍、说明并解释色氨酸溶解度曲线这一重要概念。
通过对其定义、意义以及测定方法和条件进行细致阐述,希望读者能够深入了解色氨酸的溶解特性,以及溶解度曲线的应用领域。
同时,通过对曲线图形与特点的分析,可以加深对色氨酸溶解度曲线的理解。
最后,我们还会提出一些存在问题并展望未来研究的方向,以期激发更多学者对该领域的兴趣和探索。
2. 色氨酸溶解度曲线的定义与意义2.1 色氨酸概述色氨酸是一种重要的天然氨基酸,在生物体内具有多种重要功能。
它不仅是蛋白质的组成成分之一,还参与神经递质和激素的合成,对细胞信号传导等生物过程起着关键作用。
因此,了解色氨酸在溶液中的溶解度行为对于相关领域的研究具有重要意义。
2.2 溶解度曲线的概念和作用溶解度曲线是描述物质在特定条件下随温度、pH值等变化而发生溶解或析出转变的图形。
通过测定不同条件下色氨酸的溶解度,并将其绘制成曲线,可以清晰地表现出溶解度随外界环境变化而变化的规律。
这样一条溶解度曲线可以帮助我们了解色氨酸分子在不同温度和pH值下与水或其他溶剂之间的相互作用情况。
根据曲线上所示点的位置与走势可以推断出色氨酸在不同条件下的溶解度大小和溶解性质的变化,进而推测相关的物理化学行为和分子结构。
2.3 色氨酸溶解度曲线的重要性和应用领域溶解度是描述物质在特定条件下从固态向液态转变程度的指标,研究色氨酸的溶解度曲线具有广泛的重要性和应用领域。
“溶解度曲线”的意义及应用简析

“溶解度曲线”的意义及应用简析“溶解度曲线”连续几年都是山西省中考的命题热点,明确其意义并能熟练应用很有必要。
下面就溶解度曲线的意义及应用作一个简要的概括和评析,希望能帮助初学者将抽象的问题与图像联系,更好地理解溶解度及相关概念。
溶解度S (克)一、溶解度曲线的意义1、确定某物质某温度下的溶解度。
2、判断某物质的溶解度随温度变化的趋势3、 可以看出改变温度析出的晶体量的多少如右图所示,高温下溶解度为S 2,低温下为S 1,若由高温下的饱和溶液降温则要析出的晶体为S 2-S 1(100克水中)。
4、 判断某点时的溶液是否饱和从图中明显看出,在曲线上和曲线以上部分所含该物质已等于或大于该温度时的溶解度,此时溶液为饱和溶液,在曲线下则为不饱和溶液。
5、判断饱和溶液和不饱和溶液相互转化的方法溶解度S (克) 溶解度S (克) 温度 温度(图一) (图二)如图一,A 点处表示的是不饱和溶液,若要将其变为饱和溶液,只需从A 点向溶解度曲线引一横一竖两条线,即可看出转化方法:降温和增或加溶质、蒸发溶剂(可理解为相对增加溶质)。
反之,从曲线上某一点(饱和)向下向右引两条直线,即可看出由饱和溶液到不饱和溶液转化的方法(图二):升温或增加溶剂(相当于相对地减少溶质)。
6、判断改变温度时,溶液的各量的变化如上图二,若要判断从饱和溶液A 到B 时溶液中各量的变化情况,可以看由A 到B 那条线上只是改变温度,溶质、溶剂并没有增减。
其它经常考查的溶液的质量、溶解度、饱和与否、溶质的质量分数变化也能做出判断,依次为不变、增大、不饱和、不变。
7、比较同一温度下不同物质的溶解度 从该温度处引一条垂直于温度轴的直线与溶解度曲线有交点,哪个交点在上就表示哪种物质的溶解度大。
常常 考查的是(如右图):a 的溶解度比b 的大。
但是从图上很容易看出,因为两图像上升过程中有交点,故两物质溶解度的大小应为三种情况,交点前一种,交点后一种,交点处二者相等。
氯化钠_碳酸钠_溶解度曲线_概述说明以及解释

氯化钠碳酸钠溶解度曲线概述说明以及解释1. 引言1.1 概述溶解度曲线是描述溶质在溶剂中的溶解度随着温度变化的图形表示。
而氯化钠和碳酸钠是常见的无机盐,在许多实际应用和工业过程中均有重要作用。
因此,研究氯化钠和碳酸钠的溶解度曲线不仅对于深入理解它们在自然界中的行为具有重要意义,而且对于优化相关工艺、指导实验设计以及提供材料基础数据也具有非常重要的价值。
1.2 文章结构本文共分为五个主要部分:引言、氯化钠溶解度曲线概述说明、碳酸钠溶解度曲线概述说明、溶解度曲线的比较与分析以及结论与展望。
在引言部分,我们将从以下几个方面进行介绍:概述本篇文章的目标和重要性、阐明文章的结构和框架以及明确本篇文章所关注问题的背景。
1.3 目的本篇文章旨在全面介绍氯化钠和碳酸钠两种常见无机盐物质在溶解度曲线研究中的概念、意义和应用。
通过对氯化钠和碳酸钠溶解度曲线的比较与分析,探讨它们的差异性以及解释这些差异的原因。
最后,总结目前研究所发现的内容,并展望未来可能的研究方向和应用领域。
通过本文的阐述,旨在为相关领域的科研工作者提供一个全面了解和认识氯化钠和碳酸钠溶解度曲线研究的平台,并且为今后深入研究与应用提供参考和指导。
2. 氯化钠溶解度曲线概述说明:2.1 氯化钠的定义与性质:氯化钠是一种常见的无机化合物,由一个氯离子和一个钠离子组成。
它是一种白色晶状固体,在室温下具有较高的溶解度。
氯化钠在水中可以迅速溶解,并且可以在适当条件下形成饱和溶液。
2.2 溶解度曲线的概念与意义:溶解度曲线描述了物质在不同温度下随溶剂中溶解度变化的关系。
这个曲线提供了我们理解物质在不同条件下的溶解特性以及饱和溶液中浓度变化的重要信息。
通过研究氯化钠的溶解度曲线,我们可以了解其在不同温度下的溶解度情况以及饱和状态下浓度变化。
这有助于我们预测和控制氯化钠在实际应用中的反应过程、结晶过程或其他相关过程。
2.3 影响氯化钠溶解度的因素:氯化钠的溶解度受到多种因素影响,包括温度、压力和溶剂性质等。
尿素溶解度曲线

尿素溶解度曲线尿素是一种常用的溶剂,具有较高的溶解度。
尿素溶解度曲线是描述在不同温度下尿素在溶剂中的溶解度随浓度变化的图表。
了解尿素的溶解度曲线对于工业生产、实验室研究以及化学教学都有重要意义。
尿素的化学式为(NH2)2CO,是一种无色、无味的结晶固体。
尿素具有良好的溶解性,可溶于水、醇类、醚类以及一些有机溶剂中。
尿素在水中的溶解度随温度的升高而增加。
在室温下,尿素的溶解度可达到100 g/100 mL左右,这表明在这个温度下最多可溶解100克的尿素物质在100毫升的水中。
尿素溶解度曲线是通过实验方法来测定的。
实验中常用恒温水浴设备来控制溶质和溶剂的温度。
首先,在恒温水浴中加入一定量的溶剂,然后往溶剂中逐渐加入少量的溶质,同时搅拌溶液,直到溶质全部溶解。
实验进行到这一步时,记录下此时的溶质的质量和溶剂的体积。
通过重复实验,可以得到一系列尿素溶解度随着溶质质量与溶剂体积比例的变化。
将这些实验数据绘制成曲线图,即为尿素溶解度曲线。
曲线的横轴为溶质质量和溶剂体积比例(质量浓度),纵轴为尿素溶解度。
尿素的溶解度受多个因素的影响,其中温度是最主要的因素。
一般情况下,随着温度的升高,尿素的溶解度也随之增加。
这是因为在高温下,溶质的分子动力学能量增加,分子间的作用力减弱,有利于溶质的溶解。
尿素的溶解度曲线在温度升高的过程中呈现出逐渐增加的趋势。
在实验中,还可以发现溶液中尿素的溶解度在不同温度下具有一个可逆性变化。
当溶剂温度升高时,尿素的溶解度增加,当溶剂温度降低时,尿素的溶解度则减小。
这种可逆性变化是由于不同温度下尿素分子之间的相互作用力不同所导致的。
此外,尿素的溶解度还受溶剂特性、溶质浓度以及其他物质的存在等因素的影响。
不同溶剂对尿素的溶解度有一定差异,一般来说,极性溶剂对尿素的溶解度较大。
同时,溶剂中其他物质的存在也会对尿素的溶解度产生影响。
尿素的溶解度曲线对于实验室研究和生产工作都有重要意义。
实验室中,了解尿素的溶解度曲线可以帮助研究人员更好地调控溶液中溶质的浓度,从而更好地进行实验操作。
硫化钠的溶解度曲线

硫化钠的溶解度曲线硫化钠(Na2S)是一种重要的无机化合物,广泛应用于化学工业和实验室中。
了解其溶解度曲线对于反应过程的控制和条件的优化至关重要。
本文将探讨硫化钠的溶解度曲线及其相关的影响因素。
一、硫化钠的溶解度硫化钠在水中的溶解度受温度的影响较大。
一般情况下,温度越高,硫化钠的溶解度越大。
溶解度曲线描述了在不同温度下硫化钠的溶解度变化情况。
二、溶解度曲线的形状硫化钠的溶解度曲线呈现出非常特殊的形状,以下是一个典型的溶解度曲线图:[图1:硫化钠的溶解度曲线图]曲线图显示,在较低的温度下,硫化钠的溶解度很低,随着温度的升高,溶解度逐渐增加。
然而,在一定温度范围内,溶解度开始饱和,不再随温度增加而增加。
硫化钠在20℃时的饱和溶解度约为xx克/升。
三、溶解度曲线的原理溶解度曲线的形状源于溶解过程的热力学原理。
在较低温度下,溶解过程受制于晶体的稳定性,溶解度较低。
随着温度的升高,晶体的稳定性降低,离子在溶剂中的解离速率增加,溶解度逐渐增大。
在一定温度范围内,溶解和析出达到平衡,溶解度不再改变。
四、影响硫化钠溶解度的因素除了温度外,其他因素也会对硫化钠的溶解度产生影响。
以下是一些常见的影响因素:1. 压力:在较高压力下,溶解过程的平衡会发生偏移,导致溶解度的变化。
2. pH值:溶液中的pH值会影响硫化钠的解离速率和溶解度,过酸或过碱条件下都会降低溶解度。
3. 其他溶质存在:当其他溶质存在时,其相互作用可能会改变硫化钠的溶解度。
4. 溶剂选择:不同的溶剂对硫化钠的溶解度有不同的影响,如水、醇类等。
五、应用和意义硫化钠的溶解度曲线在实际应用中具有重要意义。
通过研究溶解度曲线,可以优化硫化钠的溶解过程,并控制其溶液中溶解度的变化。
此外,对于硫化钠与其他物质之间的反应研究,溶解度曲线也提供了重要的参考依据。
六、总结通过本文的探讨,我们了解了硫化钠的溶解度曲线及其与温度的关系。
溶解度曲线呈现出特殊的形状,受热力学原理的调控。
乳酸铵溶解度曲线

乳酸铵溶解度曲线乳酸铵是一种常用的化学物质,广泛应用于食品、医药、农业等领域。
在这些应用中,了解乳酸铵的溶解度是非常重要的。
溶解度是指在一定温度下,溶液中能够溶解的最大量的溶质。
乳酸铵的溶解度随温度的变化而变化,而且不同溶剂中的溶解度也有所不同。
因此,研究乳酸铵的溶解度曲线对于实际应用具有重要意义。
乳酸铵的化学式为C3H7NO3,它是一种白色结晶性固体。
乳酸铵在水中具有良好的溶解度,可以迅速溶解,并形成酸性溶液。
乳酸铵在水中的溶解度随温度的升高而增大,这是由于温度升高会增加溶质分子的热运动,从而使得溶质分子更容易与溶剂分子发生相互作用,进而溶解。
为了研究乳酸铵在水中的溶解度曲线,我们可以进行一系列实验。
首先,我们准备一定质量的乳酸铵固体,然后将其逐渐加入一定体积的水中,并在每次加入后充分搅拌,直到固体完全溶解。
然后我们测量每次实验后得到的溶液中乳酸铵的质量,并记录下温度和溶液体积等相关数据。
通过多次实验,我们可以得到一系列乳酸铵在不同温度下的溶解度数据。
然后我们将这些数据绘制成曲线图,即乳酸铵的溶解度曲线。
通常情况下,乳酸铵的溶解度曲线呈现出随温度升高而逐渐增大的趋势。
但是随着温度继续升高,乳酸铵的溶解度会达到一个最大值,然后逐渐减小。
乳酸铵在不同溶剂中的溶解度也有所不同。
除了水之外,乳酸铵还可以在一些有机溶剂中溶解。
例如,在甲醇、乙醇和丙酮等有机溶剂中,乳酸铵也可以迅速溶解,并形成相应的溶液。
但是在某些有机溶剂中,乳酸铵的溶解度可能会较低。
了解乳酸铵的溶解度曲线对于实际应用具有重要意义。
首先,在食品工业中,乳酸铵常被用作面包、蛋糕等烘焙食品的发酵剂。
了解乳酸铵在水中的溶解度可以帮助我们确定合适的使用浓度,从而保证食品质量。
其次,在医药领域中,乳酸铵常被用作药物的配制和制剂的稳定剂。
了解乳酸铵在不同溶剂中的溶解度可以帮助我们选择合适的溶剂,并优化药物的配方。
此外,在农业领域中,乳酸铵也被广泛应用于土壤改良和植物营养补充等方面。
糖精钠最大溶解度曲线

糖精钠最大溶解度曲线引言糖精钠是一种常用的人工甜味剂,具有高甜度和低热量的特点。
在食品和饮料工业中广泛应用。
了解糖精钠的溶解性质对于生产和应用具有重要意义。
本文将探讨糖精钠的最大溶解度曲线及其影响因素。
什么是溶解度曲线?溶解度曲线是描述物质在不同温度下溶解性能的图形。
对于某一特定物质,可以通过实验测定其在不同温度下的溶解度,并绘制成曲线图。
实验方法为了确定糖精钠的最大溶解度曲线,我们可以采取以下实验方法:1.准备一系列容器,并分别加入不同温度的水。
2.在每个容器中加入适量的糖精钠,并搅拌均匀。
3.观察每个容器中的糖精钠是否完全溶解,如果没有完全溶解,继续搅拌直到达到平衡。
4.记录每个容器中所加入的糖精钠的质量以及溶解的温度。
5.重复以上步骤多次,以获得更准确的数据。
结果与讨论通过实验测定糖精钠在不同温度下的溶解度,我们可以得到一组数据。
将这些数据绘制成曲线图,即可得到糖精钠最大溶解度曲线。
从图中可以观察到以下几个特点:1.随着温度的升高,糖精钠的溶解度逐渐增加。
这是因为在高温下,分子间距增大,使得糖精钠分子更容易与水分子相互作用,从而增加了其溶解度。
2.在一定温度范围内,糖精钠的溶解度基本保持稳定。
这表明该温度范围内达到了饱和状态,即无法再溶解更多的糖精钠。
3.超过一定温度后,糖精钠开始析出。
这是因为在高温下,水对糖精钠的溶解能力减弱,导致已经溶解的糖精钠重新结晶。
影响因素糖精钠的最大溶解度受到多种因素的影响,主要包括以下几个方面:温度温度是影响糖精钠溶解度的最主要因素。
随着温度的升高,分子间距增大,使得糖精钠分子更容易与水分子相互作用,从而增加了其溶解度。
pH值pH值也会对糖精钠的溶解度产生一定影响。
在酸性条件下,糖精钠更容易溶解;而在碱性条件下,其溶解度会降低。
搅拌速度搅拌速度对于糖精钠的溶解过程也有一定影响。
较快的搅拌速度可以促进糖精钠与水之间的混合反应,提高其溶解度。
其他物质的存在其他物质的存在也可能对糖精钠的溶解度产生影响。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶解度曲线的应用
1、两种不同物质在不同温度区间,溶解度大小比较
例1:温度在 时 a 物质的溶解度大于b 物质的溶解度; 温度在 时 a 物质的溶解度等于b 物质的溶解度; 温度在 时 a 物质的溶解度小于b 物质的溶解度; 例2:物质a 的溶解度大于物质b 的溶解度 这句话对吗?
2、两种可溶物质的分离与提纯所采取不同的方法
例题 (10邵阳13)右图表示的是a 、b 两种固体物质的溶解度曲线,下列叙述正确的是 ( ) A. a 的溶解度大于b 的溶解度
B .a 、b 两物质的溶解度受温度影响都很小
C. 在t ℃时,a 、b 两物质的饱和溶液中溶质质量分数相等
D. 当b 中含少量a 时,可用冷却热饱和溶液的方法提纯b 见D 选项,要讲解:
① 大量的a 中含有少量的b 时,可采用冷却热饱和溶液的方法;
② 大量的b 中含有少量的a 时,可以采用蒸发溶剂法;故D 项是错的。
③ 如右图中,大量A 中含少量的B ,可采用冷却热饱和溶液的方法; 3、明白溶解度曲线上面点、上方点、下方点的含义
例题:
① 溶解度曲线上面点P 点表示饱和溶液 ② 溶解度曲线上方点C 点表示过饱和溶液
③ 溶解度曲线下方点B 点表示不饱和溶液
4、通过比较溶解度的大小,也可以比较此温度下饱和溶液的溶质质量分
数的大小。
例1、如图是A 、B 、C 三种物质的溶解度曲线,据图回答:
① t 1℃时,A 、B 、C 三种物质的溶解度由大到小的顺序是 __ ;
(填写序号,下同)
② t 2℃时,A 、B 、C 三种物质的饱和溶液溶质质量分数由大到小的顺序是 ______ ;(填写序号,下同)
要掌握简单的溶解度计算,判断实际溶液是饱和溶液还是不饱和溶液;
③ t 1℃时,30g A 物质加入到50g 水中不断搅拌,形成溶液的质量是 g ;此时是______溶液
要注意:饱和溶液溶质质量分数按此时的溶解度来计算、比较大小,不饱和溶液则要将原原温度下的溶解度数值进行平移过来,再比较此时溶解度的大小,即是此时溶质质量分数的大小。
④ 将t 1℃时A 、B 、C 三种物质饱和溶液的温度升高到t 2℃时,三种溶液的溶质的质量分数由大到小的顺序是 。
例题2、a 、b 、c 三种物质的溶解度曲线如图6-11所示。
现有t 1℃时的a 、b 、c 三种物质的饱和溶液,将其都升温至t 2℃时,下列说法错误的是 ( ) A .c 溶液中有晶体析出
B .a 、b 溶液均为不饱和溶液
C .c 溶液中溶质的质量分数变小
D .a 溶液中溶质的质量分数最大
5、温度对不同物质溶解度影响的程度的三种情况及相关题型。
①物质的溶解度随温度的变化影响较大;曲线比较陡峭;例如硝酸钾、硝酸铵等物质; ②物质的溶解度随温度的变化影响不大;曲线比较平直;例如氯化钠、氯化钾等 ③ 物质的溶解度随温度的升高反而减小。
反常物质。
例如氢氧化钙。
【应用】 某物质由不饱和与饱和相互转化时,所采用的不同方法;是升温析出晶体还是降温析出晶体;谁析出的晶体多;两种可溶物质的分离应采用的正确方法;
例题3、右图是a 、b 、c 三种物质(均不含结晶水)的溶解度曲线,请你回答: (1)0℃时,a 、b 、c 三种物质中溶解度最大的是 ______;
(2)将t 1℃时三种物质的饱和溶液升温至t 2℃时,有晶体析出的是______; (3)t 2℃时,将30g a 物质加入到50g 水中充分溶解,所形成溶液的质量是______g ; (4)将t 2℃时a 、b 、c 三种物质饱和溶液的温度降温到t 1℃时,三种溶液的溶质质量分数大小关系是_____________;
(5)将t 1℃时a 、b 、c 三种物质饱和溶液的温度升温到t 2℃时,三种溶液的溶质质量分数大小关系是_____________;
例题4、如图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线.现有t 2℃时甲、乙、丙三种物质的饱和溶液(无固体存在),请根据下图回答:
(1)t 1℃时,将三种饱和溶液分别恒温蒸发相同质量的水,析出晶体最多的是 ______;
(2)将三种饱和溶液分别从t 2℃降温到t 1℃时,所得溶液中溶质的质量分数由大到小的顺序为___________;
(3)当甲中含有少量的丙时,可用________方法提纯甲.
t 1℃ 30 t 2℃ 溶解度 /0 C B A
温度/℃ 溶解度/g A
0 温度/℃ B 溶解度/g A P
温度/℃
T ℃
30
C B
例题5、如图是A、B、C三种固体物质的溶解度曲线,请回答下列问题:
(1)P点表示的意义是_______________________;
(2)当温度为t2℃时,A、B、C三种物质的溶解度由小到大的顺序是__________;
(3)要使接近饱和的C物质溶液变为饱和的溶液,可采取的一种措施是
____________________;
(4)t2℃时,A物质的饱和溶液150g降温到t1℃析出A物质______g(不含结晶
水).
(5)将t2℃时A、B、C三种物质的饱和溶液降温到t1℃时,所得溶液中溶质的质量分数由大到小的顺序是_____________;.
(6)当A中含有少量B时,为了得到纯净的A,可采用_________方法.
例题6.甲、乙两种固体物质的溶解度曲线如图6—12所示。
现将两支分别装有甲、乙两种物质饱和溶液(底部均有未溶解的固体)的试管浸入盛有水的烧杯里,然后向烧杯中加入一定量的氢氧化钠固体,则对相应变化判断正确的是( )
A. 甲溶液中溶质的质量分数减小
B. 乙溶液中溶质的质量减小
C. 甲、乙物质的溶解度都增大
D.乙溶液中溶质的质量分数减小
7、采用蒸发溶剂法时,结晶的质量只与蒸发的溶剂的质量有关,而与饱和溶液的总质量无关;采用冷却热饱和溶液法结晶,结晶的质量与高温时饱和溶液的总质量有关;两者要区别开来。
例题1、将两杯20℃时的食盐饱和溶液,甲为500g,乙为1000g,在温度不变的情况下分别蒸发掉15g 水,析出的食盐晶体的质量()
A. 甲=乙
B. 甲<乙
C. 甲>乙
D. 无法判断
8、.右图是a、b两种固体物质(不含结晶水)的溶解度曲线。
下列说法正确
的是()
A . b的溶解度大于a的溶解度
B. t1℃时,将a、b两种物质的饱和溶液分别恒温蒸发等质量的水,析出晶体的质量一定相等
C. 将t2℃时的b的不饱和溶液降温至t1℃,一定能得到b的饱和溶液
D. t2℃时,a溶液的溶质质量分数一定小于b溶液的溶质质量分数
9、甲、乙的溶解度曲线如图,将t2℃甲、乙的饱和溶液分别降温到t1℃。
下列说法一定
正确的是()
A.两溶液仍饱和
B.甲溶液仍饱和
C.溶质质量分数:甲>乙
D.溶液质量:甲= 乙
10、右图是甲、乙两种固体物质的溶解度曲线。
下列说法正确的是()
A.甲的溶解度随温度变化比乙小
B.t2℃时甲的饱和溶液的溶质质量分数小于30%
C.t1℃时,甲、乙饱和溶液的溶质质量分数不相等
D.可采用降低温度的方法使乙的饱和溶液变为不饱和溶液
11、如图A、B、C三种固体物质的溶解度曲线.t1℃时,将25gA、B、C三种固体分别加入100g水中.下列选项错误的是()
A.t1℃时,所得三种物质的溶液中为不饱溶液的是C
B.t1℃时C溶液的溶质质量分数为25%
C.t1℃时,三种溶液的溶质质量分数的大小关系为C>B>A
D.若将温度由t1℃升至t4℃,三种溶液的溶质质量分数的大小关系
为A>B>C
12、采用冷却热饱和溶液的方法结晶时,比较谁析出的晶体多,要注意控制变量法的使用,即要将某些因素统一后方可比较,①高温时都是饱和溶液②高温时两种物质的饱和溶液的质量相等;③都是从同一高温降到同一低温。
只有这样,溶解度曲线陡峭的比曲线平直的析出晶体多,否则是错的。
例题、(10茂名10)右图为A、B两种不带结晶水的固体物质溶解度曲线。
下列说法不正确的是()
A、30℃时,A物质的溶解度为20g
B、20℃时,A和B的溶解度相同
C、10℃时,等质量的A和B的饱和溶液中,B的溶剂最少
D、等质量的A和B的饱和溶液从30℃降低到20℃,B析出的晶体最多
P。
