物质的量的单位ppt课件
合集下载
《物质的量及其单位-摩尔摩尔质量》课件

化学反应过程中物质的量监控
在化学反应过程中,实时监测反应物和生成物的物质的量变化,控制反应进程和产品质量 。
THANKS FOR WATCHING
感谢您的观看
对于某一分子,其摩尔质量在数值上等于该分子的相对分子质量。例如,水分 子的相对分子质量为18,则其摩尔质量也为18g/mol。
摩尔质量在化学方程式计算中应用
计算反应物的质量
计算生成物的质量
在化学反应中,已知反应物的物质的量和 摩尔质量,可以计算反应物的质量。
在化学反应中,已知生成物的物质的量和 摩尔质量,可以计算生成物的质量。
用于计算气体的密度
通过气体摩尔体积和气体的摩尔质量,可以计算出气体的密度。这对于了解气体的物理性质以及进行相关的实验 和计算具有重要意义。
05 溶液浓度表示方法及换算
溶液浓度常见表示方法介绍
质量百分比浓度
表示溶质质量与溶液质量 之比,常用于工业生产中。
体积百分比浓度
表示溶质体积与溶液体积 之比,常用于酒类等液体 溶剂的表示。
摩尔在化学计算中应用
化学反应计量关系
在化学反应中,各反应物和生成 物之间的物质的量之比等于其化 学计量数之比。通过摩尔可以方 便地表示和计算这种计量关系。
溶液浓度计算
溶液的浓度可以用物质的量浓度 来表示,即单位体积溶液中所含 溶质的物质的量。通过摩尔可以 方便地计算溶液的浓度和溶质的
物质的量。
化学方程式计算
不同浓度单位之间的换算
03
在实际应用中,可能需要将不同浓度单位之间进行换算,这时
需要根据具体的换算公式进行计算。
溶液浓度在化学实验和工业生产中应用
化学实验中的应用
在化学实验中,溶液浓度是影响化学反应速率和化学平衡的重要因素之一,因此需要对溶液浓度进行 精确控制。
在化学反应过程中,实时监测反应物和生成物的物质的量变化,控制反应进程和产品质量 。
THANKS FOR WATCHING
感谢您的观看
对于某一分子,其摩尔质量在数值上等于该分子的相对分子质量。例如,水分 子的相对分子质量为18,则其摩尔质量也为18g/mol。
摩尔质量在化学方程式计算中应用
计算反应物的质量
计算生成物的质量
在化学反应中,已知反应物的物质的量和 摩尔质量,可以计算反应物的质量。
在化学反应中,已知生成物的物质的量和 摩尔质量,可以计算生成物的质量。
用于计算气体的密度
通过气体摩尔体积和气体的摩尔质量,可以计算出气体的密度。这对于了解气体的物理性质以及进行相关的实验 和计算具有重要意义。
05 溶液浓度表示方法及换算
溶液浓度常见表示方法介绍
质量百分比浓度
表示溶质质量与溶液质量 之比,常用于工业生产中。
体积百分比浓度
表示溶质体积与溶液体积 之比,常用于酒类等液体 溶剂的表示。
摩尔在化学计算中应用
化学反应计量关系
在化学反应中,各反应物和生成 物之间的物质的量之比等于其化 学计量数之比。通过摩尔可以方 便地表示和计算这种计量关系。
溶液浓度计算
溶液的浓度可以用物质的量浓度 来表示,即单位体积溶液中所含 溶质的物质的量。通过摩尔可以 方便地计算溶液的浓度和溶质的
物质的量。
化学方程式计算
不同浓度单位之间的换算
03
在实际应用中,可能需要将不同浓度单位之间进行换算,这时
需要根据具体的换算公式进行计算。
溶液浓度在化学实验和工业生产中应用
化学实验中的应用
在化学实验中,溶液浓度是影响化学反应速率和化学平衡的重要因素之一,因此需要对溶液浓度进行 精确控制。
【人教版】高中化学必修一:1.2.1《物质的量的单位——摩尔》ppt课件

答案:C
-18-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
知识点1 知识点2 知识点3
Z 知识梳理 HISHI SHULI
象是微观粒子,如原子、分子、离子、中子、质子、电子,也可以 是这些粒子的特定组合,而不能指宏观物体,因此“1 mol鸡蛋”说法 错误。在用“mol”时,要指明粒子的种类,如“1 mol O”表示1 mol氧原 子,“1 mol O2”表示1 mol氧气分子,“1 mol O2-”表示1 mol氧离子,而 不能说“1 mol氧”,因为这里的氧指代不明确。
1
1
联 系
摩尔质量以 g·mol-1 为单位时,在数值上等于其相对分子质量 或相对原子质量;混合物组成一定时,1 mol 混合物的质量在数 值上等于该混合物的平均相对分子质量
-13-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
Z重难聚焦 HONGNAN JVJIAO
-11-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
Z重难聚焦 HONGNAN JVJIAO
D典例透析 IANLI TOUXI
粒特的别质提量醒(m()1:m)已=知������������A阿; 同伏理加,德若罗已常知数m(、NAN)A和,则摩M尔=质m·量NA(。M),则一个微 (2)高中化学计算主要是以物质的量为中心的计算,学习中要养成
-15-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
-18-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
知识点1 知识点2 知识点3
Z 知识梳理 HISHI SHULI
象是微观粒子,如原子、分子、离子、中子、质子、电子,也可以 是这些粒子的特定组合,而不能指宏观物体,因此“1 mol鸡蛋”说法 错误。在用“mol”时,要指明粒子的种类,如“1 mol O”表示1 mol氧原 子,“1 mol O2”表示1 mol氧气分子,“1 mol O2-”表示1 mol氧离子,而 不能说“1 mol氧”,因为这里的氧指代不明确。
1
1
联 系
摩尔质量以 g·mol-1 为单位时,在数值上等于其相对分子质量 或相对原子质量;混合物组成一定时,1 mol 混合物的质量在数 值上等于该混合物的平均相对分子质量
-13-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
Z重难聚焦 HONGNAN JVJIAO
-11-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
Z重难聚焦 HONGNAN JVJIAO
D典例透析 IANLI TOUXI
粒特的别质提量醒(m()1:m)已=知������������A阿; 同伏理加,德若罗已常知数m(、NAN)A和,则摩M尔=质m·量NA(。M),则一个微 (2)高中化学计算主要是以物质的量为中心的计算,学习中要养成
-15-
M 第1课时 物质的量的 单位——摩尔
目标导航
UBIAODAOHANG
Z 知识梳理 HISHI SHULI
物质的量ppt课件

铅笔打数 = 铅笔支数 ÷ (12支/打)
以H2O为例,已知H2O的分子数为1.204×1024个,阿伏加德 罗常数约为6.02×1023/mol,计算H2O的物质的量是多少mol?
= 物质的量(n)
粒子数(N) ÷ 阿伏伽德罗常数(NA)
2mol
= 1.204×1024 ÷ 6.02×1023/mol
探究活动
1 mol H2O 约含有6.02×1023个水分子,
质量是18g
1molAl 约含有6.02×1023 个铝原子,
质量是27g
1mol任何粒子集合体都约含6.02×1023个粒子, 那么1mol粒子的质量是多少呢?
探究活动
1mol任何粒子或物质的质量以克为单位时,能得出其数值与该粒子 的相对原子质量或相对分子质量存在什么样的关系?
瓜子包数 = 瓜子质量 ÷ 每包质量
以H2为例,知道H2的质量为20g,H2的摩尔质量是 2g/mol,计算H2的物质的量是多少mol?
= 物质的量(n)
质量(m)
÷ 摩尔质量(M )
10mol
= 20g
÷ 2 g / mol
物质的量( n )、摩尔质量( M )、质量( m)
的关系式 :
n= m
M
= 物质的量( n )、阿伏伽德罗常数( NA )、粒子 n
N
数( N)的关系式 :
NA
物质的量的“四化”
专有化 微观化 具体化
• 专有名词,表述时不可增减字。如不能说成“物质量”或 “物质的数量”等
• 只适用于微观粒子(原子、分子、离子、原子团、电子、
质子、中子 等) • 必须指明具体粒子的种类。如“1 mol O”、“2.5 mol
以H2O为例,已知H2O的分子数为1.204×1024个,阿伏加德 罗常数约为6.02×1023/mol,计算H2O的物质的量是多少mol?
= 物质的量(n)
粒子数(N) ÷ 阿伏伽德罗常数(NA)
2mol
= 1.204×1024 ÷ 6.02×1023/mol
探究活动
1 mol H2O 约含有6.02×1023个水分子,
质量是18g
1molAl 约含有6.02×1023 个铝原子,
质量是27g
1mol任何粒子集合体都约含6.02×1023个粒子, 那么1mol粒子的质量是多少呢?
探究活动
1mol任何粒子或物质的质量以克为单位时,能得出其数值与该粒子 的相对原子质量或相对分子质量存在什么样的关系?
瓜子包数 = 瓜子质量 ÷ 每包质量
以H2为例,知道H2的质量为20g,H2的摩尔质量是 2g/mol,计算H2的物质的量是多少mol?
= 物质的量(n)
质量(m)
÷ 摩尔质量(M )
10mol
= 20g
÷ 2 g / mol
物质的量( n )、摩尔质量( M )、质量( m)
的关系式 :
n= m
M
= 物质的量( n )、阿伏伽德罗常数( NA )、粒子 n
N
数( N)的关系式 :
NA
物质的量的“四化”
专有化 微观化 具体化
• 专有名词,表述时不可增减字。如不能说成“物质量”或 “物质的数量”等
• 只适用于微观粒子(原子、分子、离子、原子团、电子、
质子、中子 等) • 必须指明具体粒子的种类。如“1 mol O”、“2.5 mol
物质的量PPT

1 摩尔(mol)的标准
1971年,在第十四届国际计量大会上
规定:将0.012kg12C中所含有的碳原
子数定为1摩尔(1mol)。
1 摩尔(mol)粒子的粒子数是多少呢?
≈ 6.02×1023
阿伏加德罗常数
符号:NA
1mol任何粒子的粒子数
单位:mol-1
近似值:NA ≈ 6.02×1023 mol-1
1:在0.5mol O2中含有的氧分子数目是多少?
解:O2的分子数为
N
=
n
×
NA
=0.5 mol× 6.02 ×1023mol-1
=
3.01 × 1023
答:O2的分子数为3.01 × 1023个。
2:在0.5mol O2中含有的氧原子数目是多少?
解:O2的氧原子数为
N
=
n
×2 ×
NA
=0.5 mol×2× 6.02 ×1023mol-1
无意义的表示。
③ 物质的量的数值可以是整数,也可
以是小数。
练习:1、把意义大声说出来:
①1molO2,表示: 1mol氧分子
②1molFe,表示:1mol铁原子
③1molH2O,表示:
1mol水分子
2、批判与反思:以下说法是否正确?
①1mol氧
□
②1mol大米
□
×
×
+
③1mol质子(H )
□ ④1mol细菌
1mol粒子的粒子数
‖
=
阿伏加德罗常数
‖
0.012Kg12C中所含原子数
约为
约为
约为
6.02×1023
不能认为1 mol粒子=6.02×1023个
物质的量ppt课件

1.定义:表示含有一定数目粒子的集合体,是国际单位制七个 基本物理量之一。 2.符号:n
3.单位: 摩尔( mol),简称摩
4.描述对象:微观粒子或结构
01
物质的量
一、物质的量
01
物质的量
一、物质的量
注意:
①物质的量是一个基本物理量,是专有名词,四个字不可拆分、 省略。
②物质的量只能用来描述微观粒子或结构,不能用来描述宏观物 质。
32
2.991×10-23g 18.006g
18
02
摩尔质量
一、摩尔质量
1.定义:单位物质的量的物质所具有的质量叫做摩尔质量。
2.符号:M
3.单位:g/mol(或g·mol-1)
4.数值:数值上等于相应物质的相对化学式量(相对原子质量、 相对分子质量等)
02
摩尔质量
一、摩尔质量
4.换算关系:
例6:36g葡萄糖(C6H12O6)的物质的量为_0_._2_mol,其中含C_1_.2_mol, 含H_2_._4_mol,含O_1_.2_mol。
PART 02
02
摩尔质量
我们已经学习了物质的量和阿伏伽德罗常数,那么1mol粒子所 具有的质量是多少呢?
粒子 Fe原子 O2分子 H2O分子
物质的量 1mol 1mol 1mol
粒子数 NA NA NA
单个粒子质量 物质的质量 相对化学式量
9.288×10-23g 55.91g
56
5.314×10-23g 31.99g
01
物质的量
一、物质的量
生活中:
一双筷子═2根筷子 一打鸡蛋═12个鸡蛋
那么1mol粒子到底是多少个粒子呢?
01
3.单位: 摩尔( mol),简称摩
4.描述对象:微观粒子或结构
01
物质的量
一、物质的量
01
物质的量
一、物质的量
注意:
①物质的量是一个基本物理量,是专有名词,四个字不可拆分、 省略。
②物质的量只能用来描述微观粒子或结构,不能用来描述宏观物 质。
32
2.991×10-23g 18.006g
18
02
摩尔质量
一、摩尔质量
1.定义:单位物质的量的物质所具有的质量叫做摩尔质量。
2.符号:M
3.单位:g/mol(或g·mol-1)
4.数值:数值上等于相应物质的相对化学式量(相对原子质量、 相对分子质量等)
02
摩尔质量
一、摩尔质量
4.换算关系:
例6:36g葡萄糖(C6H12O6)的物质的量为_0_._2_mol,其中含C_1_.2_mol, 含H_2_._4_mol,含O_1_.2_mol。
PART 02
02
摩尔质量
我们已经学习了物质的量和阿伏伽德罗常数,那么1mol粒子所 具有的质量是多少呢?
粒子 Fe原子 O2分子 H2O分子
物质的量 1mol 1mol 1mol
粒子数 NA NA NA
单个粒子质量 物质的质量 相对化学式量
9.288×10-23g 55.91g
56
5.314×10-23g 31.99g
01
物质的量
一、物质的量
生活中:
一双筷子═2根筷子 一打鸡蛋═12个鸡蛋
那么1mol粒子到底是多少个粒子呢?
01
物质的量的单位摩尔-完整版PPT课件
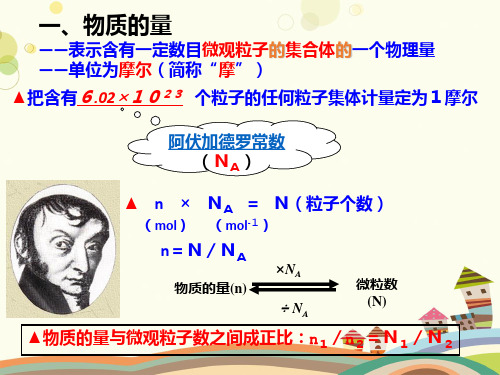
一、物质的量
——表示含有一定数目微观粒子的集合体的一个物理量 ——单位为摩尔(简称“摩”)
▲把含有6.02×1023 个粒子的任何粒子集体计量定为1摩尔
阿伏加德罗常数 (NA)
▲ n × NA = N(粒子个数)
(mol) (mol-1)
n=N/NA
物质的量(n)
×NA
÷ NA
微粒数 (N)
▲物质的量与微观粒子数之间成正比:n1/n2=N1/N2
使用物质的量注意事项:
①物质的量这四个字是一个整体,是一个 专用名词,不得简化或增添任何字。
②物质的量只适用于微观粒子,使用摩作 单位时,所指粒子必须指明粒子的种类, 如原子、分子、离子等。且粒子的种类一 般都要用化学符号表示。
③物质的量计量的是粒子的集合体,不是 单个粒子。
——表示含有一定数目微观粒子的集合体的一个物理量 ——单位为摩尔(简称“摩”)
▲把含有6.02×1023 个粒子的任何粒子集体计量定为1摩尔
阿伏加德罗常数 (NA)
▲ n × NA = N(粒子个数)
(mol) (mol-1)
n=N/NA
物质的量(n)
×NA
÷ NA
微粒数 (N)
▲物质的量与微观粒子数之间成正比:n1/n2=N1/N2
使用物质的量注意事项:
①物质的量这四个字是一个整体,是一个 专用名词,不得简化或增添任何字。
②物质的量只适用于微观粒子,使用摩作 单位时,所指粒子必须指明粒子的种类, 如原子、分子、离子等。且粒子的种类一 般都要用化学符号表示。
③物质的量计量的是粒子的集合体,不是 单个粒子。
2.3物质的量 课件(共28张ppt)高中化学人教版2019高中化学必修一

④集体化 物质的量可以表示多个微粒的特定组合或集合体,如 1 mol NaCl, 0.5 mol H2SO4
判断:
1mol大米 × 1 摩尔氧 × 1 摩尔氧原子 √ 3 摩尔 H2O √ 0.5 摩尔二氧化碳分子 √ 物质的量即是物质的质量,也是物质的数量 × 摩尔是7个基本物理量之一 ×
注意事项:
①专有化 “物质的量”四个字是一个整体,不能拆开,也不能添字。 如不能说成“物质量”或“物质的数量”等
②微观化 只用来描述微观粒子,如原子、分子、离子、中子、质子、 电子等,不能表示宏观的物质,如米
③具体化 必须指明具体粒子的种类,常用化学式表示,如“1 mol O”“2 mol O2”“1.5 mol O3”;不能说“1 mol 氧”
1 mol 粒子 = NA 个粒子 ≈ 6.02×1023个粒子
注意事项:
(1)阿伏加德罗常数是一个物理量,有单位,而不是纯数。 (2)不能认为1 mol粒子等于6.02×1023个,也不能认为 6.02×1023就是阿伏加德罗常数 (3)在计算时采用近似值6.02×1023mol-1
一个惊人的数字
这些物质中粒子数目非常庞大,不可能一个一个去数
生活中的计生量活中物品以什么方式计量?
大件物品以单个方式计量
情境引入 生活中物品以什么方式计量?
小件物品按一定的标准打包为一个集合体
微观粒子
物质的量
是国际单位制七个基本物理 量之一。
X个
物理量 长度 时间
物质的量 热力学温度
电流 发光强度
质量
......
8g
C: 12g/mol
2 molC
24g
H2O: 18g/mol 10 molH2O
180g
判断:
1mol大米 × 1 摩尔氧 × 1 摩尔氧原子 √ 3 摩尔 H2O √ 0.5 摩尔二氧化碳分子 √ 物质的量即是物质的质量,也是物质的数量 × 摩尔是7个基本物理量之一 ×
注意事项:
①专有化 “物质的量”四个字是一个整体,不能拆开,也不能添字。 如不能说成“物质量”或“物质的数量”等
②微观化 只用来描述微观粒子,如原子、分子、离子、中子、质子、 电子等,不能表示宏观的物质,如米
③具体化 必须指明具体粒子的种类,常用化学式表示,如“1 mol O”“2 mol O2”“1.5 mol O3”;不能说“1 mol 氧”
1 mol 粒子 = NA 个粒子 ≈ 6.02×1023个粒子
注意事项:
(1)阿伏加德罗常数是一个物理量,有单位,而不是纯数。 (2)不能认为1 mol粒子等于6.02×1023个,也不能认为 6.02×1023就是阿伏加德罗常数 (3)在计算时采用近似值6.02×1023mol-1
一个惊人的数字
这些物质中粒子数目非常庞大,不可能一个一个去数
生活中的计生量活中物品以什么方式计量?
大件物品以单个方式计量
情境引入 生活中物品以什么方式计量?
小件物品按一定的标准打包为一个集合体
微观粒子
物质的量
是国际单位制七个基本物理 量之一。
X个
物理量 长度 时间
物质的量 热力学温度
电流 发光强度
质量
......
8g
C: 12g/mol
2 molC
24g
H2O: 18g/mol 10 molH2O
180g
物质的量的单位摩尔课件

02
物质的量的基本概念与性质
物质的量的定义与符号
01
物质的量是一种物理量,用于描 述物质的基本单元的数目。
02
物质的量的符号为“n”,单位为 摩尔(mol)。
Байду номын сангаас
物质的量的性质
物质的量是一种国际 单位制中的基本物理 量。
物质的量具有加和性 ,即多个物质可以合 并为一个物质。
物质的量可以用于表 示微粒数目,如分子 、原子、离子等。
计算方法
通过化学式和分子量可以计算出物质 的摩尔质量。例如,对于碳12(C) ,其分子量为12,所以其摩尔质量为 12克/摩尔。
气体摩尔体积的概念与计算方法
气体摩尔体积定义
气体摩尔体积是指单位物质的量的气体所占有的体积,单位 为升/摩尔。
计算方法
通过气体的温度和压力,可以计算出气体的摩尔体积。例如 ,在标准状况下(0摄氏度,101.325kPa),气体的摩尔体 积约为22.4升/摩尔。
物质的量的单位换算
1摩尔(mol)等于6.0223×10^23 个原子或分子等基本单元。
物质的量的单位摩尔与质量、体 积等物理量之间可以进行换算。
换算关系为:1mol = 6.0223×10^23个原子或分子等 基本单元 = 6.0223×10^-31kg/
个原子或分子等基本单元 = 6.0223×10^-3m³/个原子或分
化学反应的媒介
在化学反应中,摩尔是反 应物和生成物之间化学计 量关系的桥梁。
摩尔的应用
化学计量
摩尔是化学计量的基本单 位之一,用于表示化学反 应中各物质之间的计量关 系。
药物计量
在医疗领域,摩尔也用于 药物的计量和配制,以确 保治疗的有效性和安全性 。
物质的量(课堂PPT)

摩尔质量用大写字母M表示,但指的是某种物质的质量除以该物质的物质的量,即 M=m/n,摩尔质量的单位是kg/mol或g/mol。摩尔质量与相对分子质量的关系为, M=Mrg/mol。
摩 尔 体 积 , 用 Vm 表 示 , 指 的 是 某 气 体 物 质 的 体 积 , 除 以 该 气 体 物 质 的 量 。 Vm = V / n 。
谢谢
物质的量(课堂PPT)
演讲人
物质的量是一个物理量,代表实质是含有一定数目物质的集体,用n来指代,单位名 称为摩尔,单位符号为mol。
摩尔是一系统的物质的量,该系统中所包含的基本单元数与0.012kg12C所含有的原 子数目相等,0.012kg12C,所含的碳原子数目被称为阿伏加德罗常数,符号为NA, 数值6.022×10的23次方。
附:
01 基本符号
02
物质的量—— n
03
物质的质量— —m04Βιβλιοθήκη 摩尔质量—— M05
粒子数(微粒 的个数)——
N
06
阿伏伽德罗常 数——NA
07
相对原子质 量——Ar
08
相对分子质 量——Mr
09
质量分数—— w
气体摩尔体积——Vm——L/mol——22.4L/mol(在标准状况下,即在273.15K、 101.325Pa的条件下) 物质的量浓度——cB(B在c的右下角)——mol/L 物质的量(mol)=物质的质量(g)/物质的摩尔质量(g/mol) 以单位体积溶液里所含溶质B(B表示各种溶质)的物质的量来表示溶液组成的物理量, 叫做溶质B的物质的量浓度。 常用单位:mol/L或mol/m3。 气体的体积V=物质的量(mol)x气体摩尔体积(Vm)
摩 尔 体 积 , 用 Vm 表 示 , 指 的 是 某 气 体 物 质 的 体 积 , 除 以 该 气 体 物 质 的 量 。 Vm = V / n 。
谢谢
物质的量(课堂PPT)
演讲人
物质的量是一个物理量,代表实质是含有一定数目物质的集体,用n来指代,单位名 称为摩尔,单位符号为mol。
摩尔是一系统的物质的量,该系统中所包含的基本单元数与0.012kg12C所含有的原 子数目相等,0.012kg12C,所含的碳原子数目被称为阿伏加德罗常数,符号为NA, 数值6.022×10的23次方。
附:
01 基本符号
02
物质的量—— n
03
物质的质量— —m04Βιβλιοθήκη 摩尔质量—— M05
粒子数(微粒 的个数)——
N
06
阿伏伽德罗常 数——NA
07
相对原子质 量——Ar
08
相对分子质 量——Mr
09
质量分数—— w
气体摩尔体积——Vm——L/mol——22.4L/mol(在标准状况下,即在273.15K、 101.325Pa的条件下) 物质的量浓度——cB(B在c的右下角)——mol/L 物质的量(mol)=物质的质量(g)/物质的摩尔质量(g/mol) 以单位体积溶液里所含溶质B(B表示各种溶质)的物质的量来表示溶液组成的物理量, 叫做溶质B的物质的量浓度。 常用单位:mol/L或mol/m3。 气体的体积V=物质的量(mol)x气体摩尔体积(Vm)
高一化学 PPT课件 图文

如果把 6.02×1023 粒米给60亿人吃,每人 每天吃一斤,要吃14万年。所以物质的量只用来 表示原子、分子、离子等微观粒子。
3.物质的量(n)、粒子数(N)与阿伏伽德罗常 数(NA)的关系
n=1mol N≈6.02X1023
NA
n=2mol N≈2X6.02X1023 2NA
n=0.5mol N≈0.5X6.02X1023 0.5NA
(2)9.03×1023个H,其物质的量是多少?
解:
n
(H)
=
N(H) NA
=69.0.023××11002233mol-1=1.5mol
练习:
1. mol C中约含有 6.02 × 1023 个碳原子 2. 0.3 mol H2SO4含有 0.3NA 个硫酸分子
1.806 × 1023
3. 1.204 × 1024个H2O2分子的物质的量 为 2 mol 。
二、配制一定浓度的溶液 主要仪器:容量瓶
标有温度、容积、刻度线
常用规格: 100ml,250ml,500ml,1000ml
注意事项: ①使用前要检漏 ②溶解或稀释不能在容量瓶中进行 ③不能长期存放溶液或进行化学反应 ④不能进行加热 ⑤只能配置容量瓶上规定容积的溶液
【实验1—5】配置100mL 1.00mol/L NaCl溶液
1mol微观粒子的数目是多少?
‖
0.012kg12C中所含有的碳原子数
2.阿伏加德罗常数
(1)标准:1mol任何粒子的粒子数叫做阿伏 加德罗常数
(2)符号:NA (3)单位:mol-1 (4)NA ≈ 6.02 ×1023mol-1
感受阿伏加德罗常数
如果把6.02×1023个直径为2.5cm的硬币排 成一行,可以来回于地球与太阳之间240.8亿次
3.物质的量(n)、粒子数(N)与阿伏伽德罗常 数(NA)的关系
n=1mol N≈6.02X1023
NA
n=2mol N≈2X6.02X1023 2NA
n=0.5mol N≈0.5X6.02X1023 0.5NA
(2)9.03×1023个H,其物质的量是多少?
解:
n
(H)
=
N(H) NA
=69.0.023××11002233mol-1=1.5mol
练习:
1. mol C中约含有 6.02 × 1023 个碳原子 2. 0.3 mol H2SO4含有 0.3NA 个硫酸分子
1.806 × 1023
3. 1.204 × 1024个H2O2分子的物质的量 为 2 mol 。
二、配制一定浓度的溶液 主要仪器:容量瓶
标有温度、容积、刻度线
常用规格: 100ml,250ml,500ml,1000ml
注意事项: ①使用前要检漏 ②溶解或稀释不能在容量瓶中进行 ③不能长期存放溶液或进行化学反应 ④不能进行加热 ⑤只能配置容量瓶上规定容积的溶液
【实验1—5】配置100mL 1.00mol/L NaCl溶液
1mol微观粒子的数目是多少?
‖
0.012kg12C中所含有的碳原子数
2.阿伏加德罗常数
(1)标准:1mol任何粒子的粒子数叫做阿伏 加德罗常数
(2)符号:NA (3)单位:mol-1 (4)NA ≈ 6.02 ×1023mol-1
感受阿伏加德罗常数
如果把6.02×1023个直径为2.5cm的硬币排 成一行,可以来回于地球与太阳之间240.8亿次
高一化学物质的量ppt课件.ppt

例1 判断正误,分析原因。
× 将 58.5 g NaCl 溶于 1 L 水中,所
得溶液的物质的量浓度为 1 mol·L-1,
课堂练习一
❖ 用5molNaOH配成500mL溶液,其浓度
为 10 mol/L,取5mL该溶液,其浓 度为 10 mol/L。
❖ 从1L 1mol/L NaCl溶液中,分别取出 100mL、10mL和1mL溶液,它们的物质 的量浓度是否相等?所含溶质各是多少 克?
课堂练习(1)
下列溶液中,Cl-数目与1L 1mol/L NaCl 溶液所含的Cl-数目相等的是
A、0.5L 2mol/L MgCl2 溶液 B、2L 0.25mol/L CaCl2 溶液 C、3L 0.5mol/L AlCl3溶液 D、0.5L 2mol/L NaCl 溶液
课堂练习(1)
❖已知2L Al2(SO4)3 溶液中含Al3+个数 约为9.03×1023,求溶液中SO42-的 物质的量浓度。
作业:
1.课本p17 习题1-6写在课本上,7-10抄题 写过程写在作业纸上,上交。
2.完成三维设计第二节的第3、4课时
3.在下周上课前自学第一单元第一节,下 周四之前完成三维设计对应部分。
4.复习本节内容,下周三小测试。
❖300mL 某浓度的氢氧化钠溶液中含 有60 g溶质,现欲配制0.1mol/L 的 氢氧化钠溶液500mL,应取原溶液的 体积为
课堂练习(4)
❖ 使用胆矾配制0.1mol/L 的硫酸铜溶液1L,正确的 操作是( )
A. 将胆矾加热除去结晶水后,称取16 g溶解在1 L 水里
B. 称取胆矾25 g,溶解在1 L水里 C. 将25 g胆矾溶于水,然后将此溶液稀释至1 L D. 将16 g胆矾溶于水,然后将此溶液稀释至1 L
物质的量完整课件(共39张PPT)

0.2
0.2
0.1
二、摩尔质量
1. 1mol物质的质量 2. 1mol 任何粒子或物质的质量以克为单位时,其数值都与该粒子的相对原子质 量或相对分
子质量相等。
3. 2. 摩尔质量 4. 〔1〕定义:单位物质的量的物质所具有的质量叫做摩尔质量,符号为M。 5. 〔2〕单位:g/mol 6. 〔3〕数值:数值等于该粒子的相对分子〔原子〕质量。
;分子数是
1.204 ×1024
。
〔6〕SO4- 摩尔质量是
,物质的量是
。
96 g/mol
9.6g
3. 物质的质量〔m),物质的量(n),摩尔质量(M)三者之间的关系
n m M
m n N
M
NA
【例题6】24.5gH2SO4 的物质的量是多少?
n (H 2 S4 O )M m ( (H H 2 2 S S4 4 O ) O ) 92 g 8 ./5 4 m g o 0 .2 lm 5ol
〔2〕标准状况下〔0℃,101kPa), 1mol 任何 气体的体积都约占22.4 L/mol。
25℃,101kPa时,气体摩尔体积约为24.5L/mol。
〔3〕计算公式:
V V 注意:
m
n ①22.4L/mol 使用条件:适用气体,且一般指标准状况,即0℃、101kPa。
②
适用对象:必须是气态物质,单一或混合气体均可用。
溶质的单位 溶液的单位
单位
公式
物质的量浓度
溶质的质量分数
mol
g
L
g
mol·L-1
CB
溶质的物质的(n量B) 溶液的体(积 V)
-
wB溶 溶质 液的 的((m m 质 质 B))量 1量 0% 0
第3节第1课时物质的量的单位摩尔(课件)高一化学

n(Na 2CO3 )
=
m(Na 2CO3 ) M (Na2CO3)
=
5.3g 106g mol-1
=
0.05mol
(3)0.25mol CaCO3的质量是 25 g
m(CaCO3) = n(CaCO3) M (CaCO3) = 0.25mol 100g mol-1 = 25g
(4)0.02mol某物质的质量为0.73g,则该物质的摩尔质量为 36.5 g/mol
NA 1mol
化学方程式中,物质的物质的量之比等于其计量数之比
课堂小结
物质的量总结
微粒个数
物质的量
质量
微观
N NA
n
m M
宏观
阿伏加德罗常数
摩尔质量
随堂演练
1.下列叙述错误的是( A )
A.1 mol任何物质都含有约6.02×1023个原子 B.1 mol C含有约6.02×1023个碳原子 C.在使用摩尔表示物质的量的单位时,应用化学式指明粒子的种类 D.物质的量是国际单位制中七个基本物理量之一
随堂演练
2.偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航
天运载火箭的推动力。下列叙述正确的是( B )
A.偏二甲肼的摩尔质量为60 g B.6.02×1023个偏二甲肼分子的质量约为60 g C.1 mol偏二甲肼的质量为60 g·mol-1 D.6 g偏二甲肼含有NA个偏二甲肼分子
粒子数约为6.02×1023
02
阿伏加德罗常数
课堂探究
二、阿伏加德罗常数
探究学习
重点 理解
1.阿伏加德罗常数:国际上规定,1 mol 任何粒子的粒子数叫阿伏 加德罗常数
2. 符号: NA 单位: mol-1 (每摩尔) 近似值:6.02×1023mol-1 集合体的单位
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.阿伏加德罗常数
⑴定义: 1mol任何粒子的粒子数
⑵单位:mol-1 (每摩尔) ⑶符号:NA 精确值:0.012Kg12C中所含碳原子数 近似值:6.02×1023 mol-1
NA≈6.02× 1023mol-1
.
9
1mol物质含有阿伏加德罗常数个微粒。
阿伏加德罗常数:12ቤተ መጻሕፍቲ ባይዱ12c中含有的碳原子数,符号为NA 。
聘任都灵大学理科教授。自 18年被选为
都灵科学院院士后,还担任过意大利教
育委员和度量衡学.会会长.
10
类似: 圆的周长
圆的直径
无限不循
环小数. 准确数
近似数
=π≈3.14
12克 12C
无限不循环小数. 准确数
一个12C原 子的实际 质量
阿伏加德罗常数NA
≈6.02×1023
近似数
.
11
4、物质的量(n)、粒子数(N)和阿伏加 德罗常数(NA)之间的关系
基准:NA
摩尔质量
1、准确值:12g12C所含原子数
近似值: 6.02 x 1023
2、n= N NA
n1 = N1
n2
N2
单位物质的量的物质所具有的质量。
计算:数值上等于其相对分子质量(式量)
单位:g·mol-1 或 kg·mol-1
.
17
C-12 O-16
检测反馈
1. CO2的式量为_4_4__,摩尔质量为 __4_4__g/mol;
课堂导入
“2H2 + O2点=燃= 2H2O”这一方程式表示的含 (1义)?、2个氢分子和1个氧分子在点燃条件下化 合生成2个水分子。
(2)、4g氢与32g氧气在点燃条件下化合生
成36g水。
宏观
微观
质量
如何计量 物质?
体积
粒子
数
.
1
启示:物科质学的上桥要梁建。立起一个微观粒子和宏观
想办法在水分子数和水的质量之间找 到一个桥梁 ——-- 集体单位。
.
13
5.摩尔质量
⑴定义:单位物质的量的物质所具有的 质量叫做摩尔质量。 ⑵单位: g/mol ⑶符号: M ⑷数值上等于相对原子(分子)质量. 注:摩尔质量(g/mol)与1mol物质的质 量(g)在单位上不同。
.
14
6.摩尔质量与物质的量、质量之间的关系
n=m
M
7.物质的量、质量、微粒数之间的关系
家意
是 准是
大
一一
利
个个
物
数衡
理
值量
学
标
含阿伏加德罗常数
个微粒
任何粒子集体计量
为1mol
阿伏加徳罗生平简介:
意大利物理学家。
1776年8月9日生于都灵市
一个律师家庭,1856年7月9日卒于都灵
市。1792年进都灵大学法律系学习,取
得法学博士学位后,曾开业当律师。
1800年弃法从理,十分勤奋,1820年被
.
7
特别重要! 使用物质的量和摩尔时的 注意事项
⑴适用范围:微观粒子(如分子、原子、 离子等)或它们的特定组合。不能用于 宏观物体。如1mol小米( × )因为 不是微观粒子
⑵使用准则:必须指明微粒的种类(分 子、原子、离子等);并规定用该粒子的 符号(化学式),不使用中文名称。如 1mol氢( × )因为必须指明是那一 种粒子;1molH、1molH2、. 1molH+ 8
2CO + O2 =2CO2 物质的量 2mol 1mol 2mol
分子数 2NA NA 2NA 质量 56 32 88
方程式中系数之比等于它们的物质的量之比
.
16
物质的量 基本物理量 单位:摩尔
课堂小结:
1、衡量物质所含微粒数多少 2、专有名词,不能随意拆开 3、对象为微观粒子及其特定组合
1、是基本物理量的单位 2、量度对象具体微观粒子及其特定组合 3、使用时用化学式指明粒子的种类
1mol二氧化碳的质量为__4_4__g; 4.4g二氧化碳的物质的量为__0_._1_mol;
2mol二氧化碳的质量为__8_8__g.
8.8g二氧化碳相当于__0_.2_mol.
.
18
N-14 H-1 O-16 Mg-24
质量 (克)
9克
36克水
物质的量 (摩尔) 0.5摩尔水分子
2mol
微粒 (个)
物质的量(n)
×NA
÷ NA
微粒数(N)
n= N NA
N= n×NA
n与粒子数(N)成正比。
注意:一定要指明粒子种类
.
12
练一练
1、1molO2约含有__6_._02_×__1_0_23___个O2, __2___mol O,约含有_2×__6_.0_2_×_1_0_23_个O
2、3molH2SO4中约含有_3_×_6_.0_2_×_1_023个H2SO4,可 电离出___6____mol H+ ,约为6×__6_.0_2×__1_02_3 个H+
注意!物质的量是一个专有名词。不可
以分开理解。
.
6
2.物质的量的单位——摩尔 (1)标准:1 mol粒子集体所含的粒子数与
0.012 kg 12C中所含的碳原子数相同,约为 6.02×1023。 (2)符号: mol。 (3)计量对象:原子、分子、 离子、原子团、 电子、质子、中子等所有 微观粒子。
.
2
结论:宏观可称量的物质和微观可 数的粒子之间的确存在某种联系。
[疑问]
微观粒子
这种“联系”是什么呢?
宏观物质
(难见、难称量)
(可见、可称量)
经科学家反复研究,联系“可称量的物质”
和“可数粒子”之间的桥梁是一个物理量,这 个物理量就是“物质的量”。
.
3
1.2.1
物质的量的单位 -摩尔
第一课时
.
3.01X1023 2X6.02X1023
0.2克 ( 0.1 )摩尔氢分子 6.02X1022
24克
1摩尔镁原子
6.02X1023
56克
2摩尔氮气
2X6.02X1023
.
19
下列物质中所含分子的物质的量最多的是 A
A.4 ℃时2.7 mL水
B.2.8 g CO
4
1.理解物质的量的含义。(重点) 2.了解物质的量的单位——摩尔(mol)
(难点) 3. 了解阿伏加德罗常数的含义,并能运用NA进行计
算。 (难点) 4.了解摩尔质量的含义,能进行简单计算。(重点)
.
5
符号
概念:表示含有一定数目粒子的集合体。
微观粒子: 分子、原子、离 子、电子、质子等 单位:摩尔,简称:摩,符号:mol
质 量 ÷ 摩 尔 质 量 物 质 的 量 × 阿 伏 加 德 罗 常 数 微 粒 数
× 摩 尔 质 量
÷ 阿 伏 加 德 罗 常 数
m
N = n=
M
NA
.
15
探究展示
1mol H2O水中有 ( 2 )mol H ,( 1 ) mol O
( 2NA)个H,( NA )个O
微粒数之比等于物质的量之比
