筛选试验规范V2.0
临床试验研究实操问题解答

XXXX医院临床试验研究实操问题解答问:某项目发生了SAE后,受试者的相关治疗费用需由申办方报销支付,CRA表示保险公司需要研究者提供受试者的身份证号码、银行账号等有效信息,受试者的隐私是否可以提供给CRA?答:不允许向申办方泄露受试者的隐私,本案例中涉及保险公司出于核对受试者信息的真实、有效性的理赔流程,申办方可以请保险公司与研究者进行对接,告知涉及到理赔的相关信息。
【法规依据】ICH-GCP E6(R2) 2.11:确保用于鉴别受试者身份的记录的保密性应当得到保护,根据相应的保密规定。
问:PI所负责的科室有1名在读博士研究生,其具有GCP证书,但没有本院的医生执业证书,该博士研究生是否可以被授权为研究者?答:没有本院执业证书不能被授权为研究者。
【法规依据】《药物临床试验质量管理规范》(局令第3号)第五章第十九条规定:负责临床试验的研究者应具备的条件包括:在医疗机构中具有相应专业技术职务任职和行医资格。
2020版《药物临床试验质量管理规范》(2020年7月1日起施行)第四章第十六条:研究者和临床试验机构应当具备的资格和要求包括:经历和能力;能够根据申办者、伦理委员会和药品监督管理部门的要求提供最新的工作履历和相关资格文件。
问:研究中心是否必须保存研究人员授权表原件?答:现行法规中未明确要求研究人员授权表必须作为原件保存在研究中心,具体结合临床试验机构SOP及申办者SOP而定。
问:某高血压项目,多个受试者因不可控因素无法返回研究中心领取血压计,可以由申办者邮寄给受试者吗?答:不可以。
因为受试者的姓名、地址等均属于受试者的隐私,研究者需要保护受试者的隐私。
不可以将受试者的相关信息提供给申办方。
【法规依据】《世界医学大会赫尔辛基宣言》二、医学研究的基本原则:10.在医学研究中,保护受试者的生命和健康,维护他们的隐私和尊严是医生的职责。
21.必须始终尊重受试者保护自身的权利。
尽可能采取措施以尊重受试者的隐私。
环境应力筛选试验
环境应力筛选试验1 环境应力筛选的目的和原理1.1 环境应力筛选的目的环境应力筛选的目的在于发现和排除产品的早期失效,使其在出厂时便进入随机失效阶段,以固有的可靠性水平交付用户使用。
1.2 环境应力筛选的原理环境应力筛选是通过向电子装备施加合理的环境应力和电应力,将其内部的潜在缺陷加速变成故障,以便人们发现并排除。
环境应力筛选是装备研制生产的一种工艺手段,筛选效果取决于施加的环境应力、电应力水平和检测仪表的能力。
施加应力的大小决定了能否将潜在的缺陷在预定时间内加速变为故障;检测能力的大小决定了能否将已被应力加速变成故障的潜在缺陷找出来,以便加以排除。
因此,环境应力筛选又可看作是产品质量控制检查和测试过程的延伸。
2 缺陷分类2.1 通用定义产品丧失规定的功能称失效。
对可修复产品通常也称为故障。
对设备而言,任一质量特征不符合规定的技术标准即构成缺陷。
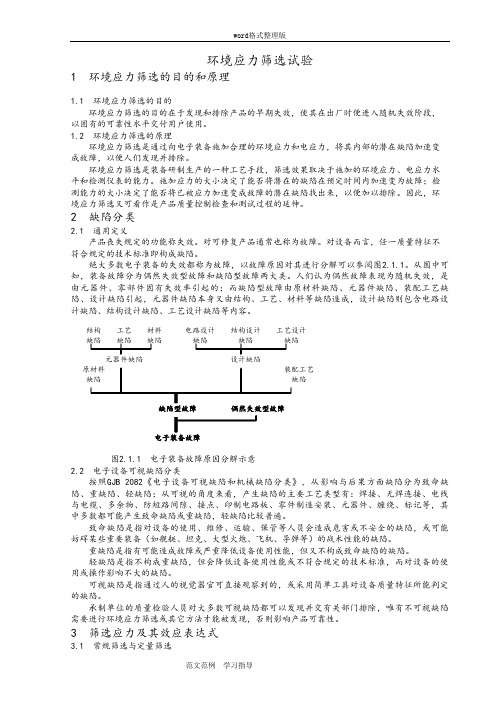
绝大多数电子装备的失效都称为故障,以故障原因对其进行分解可以参阅图2.1.1。
从图中可知,装备故障分为偶然失效型故障和缺陷型故障两大类。
人们认为偶然故障表现为随机失效,是由元器件、零部件固有失效率引起的;而缺陷型故障由原材料缺陷、元器件缺陷、装配工艺缺陷、设计缺陷引起,元器件缺陷本身又由结构、工艺、材料等缺陷造成,设计缺陷则包含电路设计缺陷、结构设计缺陷、工艺设计缺陷等内容。
结构工艺材料电路设计结构设计工艺设计缺陷缺陷缺陷缺陷缺陷缺陷元器件缺陷设计缺陷原材料装配工艺缺陷缺陷缺陷型故障偶然失效型故障电子装备故障图2.1.1 电子装备故障原因分解示意2.2 电子设备可视缺陷分类按照GJB 2082《电子设备可视缺陷和机械缺陷分类》,从影响与后果方面缺陷分为致命缺陷、重缺陷、轻缺陷;从可视的角度来看,产生缺陷的主要工艺类型有:焊接、无焊连接、电线与电缆、多余物、防短路间隙、接点、印制电路板、零件制造安装、元器件、缠绕、标记等,其中多数都可能产生致命缺陷或重缺陷,轻缺陷比较普遍。
抗肿瘤药物体内筛选试验标准操作规程(SOP)

抗肿瘤药物体内筛选标准操作规程概述:抗肿瘤药物是指能够直接杀伤或抑制肿瘤细胞生长或增殖的一类药物,作用机制包括抑制肿瘤细胞核酸或蛋白质的合成、干扰大分子物质代谢、干扰微管系统、抑制拓扑异构酶等。
本操作规程包括与抗肿瘤药物申请临床试验和申请上市有关的非临床有效性和安全性研究的内容,其中着力强调非临床有效性和安全性之间的关联性,以及非临床研究和临床试验之间的关联性。
旨在一方面为抗肿瘤药物的非临床研究提供技术参考;另一方面,通过技术要求引导科学有序的研发过程,使国内此类药物的研发更趋规范和合理。
本操作规程仅代表目前对抗肿瘤药物非临床研究的一般性认识。
具体药物的非临床研究应在本指导原则的基础上,根据药物的自身特点制订研究方案。
研究目的:建立一套包括抗肿瘤药物体内作用的药效学研究和评价体系及相应的标准操作规程以及抗肿瘤药物安全性和作用新机制的研究。
①有效性研究抗肿瘤药物有效性研究的目的主要在于探索受试物的作用机制、作用强度、抗瘤谱等,为之后的安全性评价以及临床试验中适应症、给药方案的选择提参考信息。
②安全性评价安全性评价的目的主要包括:(1)估算 I 期临床试验的起始剂量;(2)预测药物的毒性靶器官或靶组织;(3)预测药物毒性的性质、程度和可逆性;(4)为临床试验方案的制订提供参考。
研究计划:(a)小鼠急性毒性测试按照急性毒性测试的常规方法,选用昆明种小鼠,通过腹腔注射方式给药,测定体外抗肿瘤活性突出的化合物的半数致死量(LD50),参考给药小鼠体重变化情况,评价化合物的急性毒性,并确定小鼠体内抗肿瘤活性测试的给药剂量。
(b)小鼠体内抗肿瘤活性测试根据动物体内抗肿瘤活性测试的标准方法,选用昆明种小鼠,皮下接种肉瘤S180或肺癌H22瘤株,选择体外活性突出且急性毒性较低的化合物,设定合适的剂量通过腹腔注射方式给药,以临床常用抗肿瘤药物环磷酰胺作为阳性对照药物,测定肿瘤生长抑制作为体内活性评价指标。
(c)专利保护范围内的化合物的继续合成申请保护范围较大的专利,合成部分可能具有良好活性的新的化合物,拓展研究范围,发现活性更强的化合物,并申请新的发明专利。
艾滋病抗体筛查操作规范

艾滋病抗体筛查操作规范酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)ELISA的基础是抗原或抗体的固相化及抗原或抗体的酶标记。
结合在固相载体表面的抗原或抗体仍保持其免疫学活性,酶标记的抗原或抗体既保留其免疫学活性,又保留酶的活性。
加入酶反应的底物后,底物被酶催化成为有色产物,产物的量与标本中受检物质的量直接相关,故可根据呈色的深浅进行定性或定量分析。
操作:严格按试剂说明书操作。
报告筛查试验呈阴性反应出具HIV抗体阴性报告。
筛查试验呈阳性反应,可出具“HIV抗体待复查”报告,同时应尽快进行以下处理:(1)填写HIV抗体复查送检单,经一名检测操作人员和一名具有中级以上技术职称的人员审核签字。
(2)尽可能重新采集受检者的血样,将二份血样(或仅原血样)连同HIV抗体复查送检单一并送当地艾滋病筛查中心实验室,再转送艾滋病确认实验室,或直接送确认实验室确认。
筛查中心实验室应尽快用两种试剂进行复测,如结果均阳性或一阴一阳,则应将送检标本和HIV抗体复查送检单一并送艾滋病确认实验室确认。
如复检结果均为阴性,在送检单上盖上“HIV抗体阴不必再送确认实验室。
快速检测试验(rapid testing)是定性检测HIV-1/2 抗体的免疫层析法。
加样品入反应条,当样品迁移通过结合物包被处带时,与标记硒胶体的抗原或标记金胶性(一)”字样图章,并及时将结果反馈送检单位,体的抗原,此复合物继续迁移通过固相包被的合成肽和重组抗原的病人窗口。
如果样品中有HIV-1/2 抗体,抗体将与硒胶体-抗原结合,并在病人窗口处被固相包被的合成肽和重组抗原所捕捉固定,形成一条红线;否则,没有这条红线。
为了确保试验有效,在反应条中含有质控带。
操作:取出试剂条,待平衡至室温时,加样处加待测血清(或血浆)50ul,15-30分钟判定结果。
结果判定:阳性病人条带处(标有“Patient”)和质控条带处(标有“Control”)都呈红色。
药筛标准操作规程

药筛标准操作规程药筛标准操作规程第一章总则第一条为规范药品筛选工作,确保药品质量,提高药品研发效率,特制定本操作规程。
第二条本操作规程适用于药品筛选工作中的各个环节,包括实验室筛选和临床前筛选等。
第三条在进行药品筛选前,必须确保具备相关的设备和试剂,并落实相应的安全措施。
第四条药品筛选应遵循科学、规范、严谨的原则进行,尽可能减少人为干扰。
第五条对于筛选结果要进行详细的记录和分析,并及时进行修正和改进。
第二章实验室筛选第六条实验室筛选应在一定数量药物基础上进行,确保有足够的样品进行筛选和分析。
第七条实验室筛选的各个步骤应进行严格的质控,确保实验结果的准确性和可靠性。
第八条实验室筛选应根据具体药物的性质和筛选目的,选择合适的实验方法和技术。
第九条实验室筛选的结果需要经过复核和统计分析,确保分析结果的可信度。
第十条实验室筛选的结果需要进行专业评估和验证,确保筛选结果的科学性和准确性。
第三章临床前筛选第十一条临床前筛选应根据具体的药物特性,选择合适的评价指标和模型。
第十二条临床前筛选的各个步骤需要进行完整的记录和文档管理,以备审查和验证。
第十三条临床前筛选应在符合法规和伦理要求的前提下进行,确保患者的权益和安全。
第十四条临床前筛选应根据筛选结果及时进行修正和改进,以提高药物研发的效率。
第十五条临床前筛选的结果需要进行专业评估和验证,确保筛选结果的科学性和准确性。
第四章安全措施第十六条进行药品筛选工作时,必须佩戴安全防护用品,并遵守相关的操作规程和安全操作规定。
第十七条药品筛选过程中,必须注意化学品的储存和使用,遵守相关的安全操作规定。
第十八条高毒、易燃或有害物质的使用需进行专门局部通风或在密闭系统内操作。
第十九条发生意外事故时,应立即停止工作,采取紧急措施,并及时上报相关负责人。
第五章质量控制第二十条药品筛选过程中,必须对实验设备、试剂及药品进行合格评价,确保其质量符合要求。
第二十一条药品筛选过程中,需要按照试验操作规程进行、并记录相关的观察和分析结果,确保数据真实可靠。
《婴幼儿疾病筛选技术规范》(2010年版)

《婴幼儿疾病筛选技术规范》(2010年版)婴幼儿疾病筛选技术规范 (2010年版)
本文档旨在制定婴幼儿疾病筛选技术的规范,以确保筛查过程的可靠性和准确性,并提供指导。
以下是本规范的主要内容:
1. 引言
本章节介绍了制定本规范的目的和背景,以及适用范围和术语的定义。
2. 疾病筛选技术要求
本章节规定了婴幼儿疾病筛选技术的基本要求,包括筛查方法选择、样本采集、实验室技术及设备要求等方面。
3. 筛查项目与流程
本章节详细介绍了婴幼儿疾病筛查的项目和流程,包括常见疾病的筛查项目、筛查前准备工作、样本送检和结果评估等。
4. 数据管理与保密
本章节规定了婴幼儿疾病筛查的数据管理和保密要求,包括数据收集、存储、传输和使用方面的规定,以确保个人隐私和数据安全。
5. 质量控制与质量保证
本章节介绍了婴幼儿疾病筛查的质量控制和质量保证措施,包括实验室的质量管理体系、标准品使用和质量评估等方面的要求。
6. 培训与持续改进
本章节提供了婴幼儿疾病筛查工作人员的培训要求和持续改进措施,以确保技术水平和操作能力的提升。
7. 风险评估与应急管理
本章节规定了婴幼儿疾病筛查中可能存在的风险和应急管理的要求,以保障筛查工作的安全和顺利进行。
8. 法律和道德要求
本章节提供了婴幼儿疾病筛查工作的法律和道德要求,包括隐私保护、知情同意和结果告知等方面的规定。
9. 附则
本章节包括了本规范的附录、参考文献和修订记录等内容。
该文档将有助于规范婴幼儿疾病筛选技术的操作流程,促进婴幼儿健康发展和疾病的早期发现。
凝血

凝血因子特性
丝氨酸蛋白酶:II、VII、IX、X、 酶活性 XI、XII、PK 辅因子 :III、V、VIII、HMWK
依赖 VitK
:II、VII、IX、X
在吸附血浆中没有:VitK依赖因子 在血清中没有 : Fg、V、VIII、XIII
储存不稳定 :V、VIII 内源 :VIII、IX、XI、XII、 PK、HMWK 参与凝血途径 外源 :III、VII 共同 :I、II、V、X、XIII
是体内凝血的主要途径,也是发生止血血栓病理改变 的主要原因之一
共同凝血途径(common pathway) 是指从FX的激活到纤维蛋白形成的过程。 它是内、外凝血系统的共同凝血阶段。
两条凝血途径并不是完全独立,而是相互密切联系 在机体的整个凝血过程中可能发挥不同的作用
凝血过程(凝血活酶形成)
(FIIa)
精274-苏275 肽键断裂, 释放出F1+2 精323-异亮324 肽键断裂
凝血酶使纤维蛋白原转变为纤维蛋白 遗传性凝血酶原缺陷症非常罕见, 为常染色体隐性遗传性疾病。
2)因子VII--稳定因子,stable
分子量48000,血浆浓度10nmol/L 组织损伤时,TF释放到血液中, FVII与其结合,分子构型改变,
有酶活性 的β-FXa
FX 缺陷为常染色体隐性遗传性 疾病,两性均可受累。
2.接触凝血因子
指参与内源性凝血途径接触相激活 的凝血因子,包括FXII、XI、PK、 HMWK
共同特点:通过接触反应启动内源 凝血途经,并与激肽、纤溶和补体 等系统相联系 缺乏并不出现出血现象(除FXI缺乏 有轻度出血外),反而表现出不同 程度的血栓形成倾向或纤溶活性下 降
全国艾滋病检测技术规范(2019年修订版)

4
4.5.1样品包裹必须在具有处理感染性材料能力的实验室内、由经过培训的工作人员打开,打开包裹时应穿戴防护衣、戴口罩和防护眼镜,在生物安全柜中打开,用后的包裹应及时进行消毒。
4.2.1.8 样品采集后处理、保存、运输的时限和条件,因不同的检测项目而异,应参见不同检测项目要求。
4.2.1.9 采血完成后的穿刺针头必须丢弃于放置尖锐危险品容器内,妥善处理,防止发生职业暴露。
4.2.2滤纸干血斑
4.2.2.1 根据需要,可将采集的各种血液样品制备成滤纸干血斑,用于检测。最常用的是用抗凝全血、末梢全血和血浆制备滤纸干血斑。
4.2.2.5 血斑充分干燥后,将其放入密封袋中,每张干血斑单独保存,避免血斑之间的相互污染,同时放入干燥剂及湿度指示卡,密封包装,保存备用。
4.2.3尿液和口腔黏膜渗出液
4.2.3.1尿液:推荐使用专用采尿管,保持尿液稳定。尿液样品可采集随机尿,女性经期应取中段尿。
4.2.3.2口腔黏膜渗出液:使用试剂盒提供的容器收集样品。存放时间和是否冻存以试剂盒说明书为准。口腔黏膜渗出液应采集口腔渗出液,不是唾液。
4.4.2.1 第一层容器:直接装样品,应防渗漏。样品应置于带盖的试管内,试管上应有明显的标记,标明样品的唯一性编码或受检者姓名、种类和采集时间。在试管的周围应垫有缓冲吸水材料,以免碰碎。
4.4.2.2 第二层容器:容纳并保护第一层容器,可以装若干个第一层容器。要求不易破碎、带盖、防渗漏、容器的材料要易于消毒处理。
二○ 年 月
前 言
艾滋病在我国流行已数十年,随着感染者和临床病人的不断增加、感染人群变化,艾滋病检测工作量逐渐加大,对监测和检测的需求也不断增加,承担艾滋病检测的实验室已遍及全国各级医疗、疾病预防控制、采供血、妇幼保健机构,出入境检验检疫、军队等各个系统。为了尽早发现HIV感染者和艾滋病病人,及早提供咨询、治疗,同时为适应基层艾滋病检测工作需求,在新的形势下,根据《关于艾滋病抗病毒治疗管理工作的意见》、《中国预防与控制艾滋病中长期规划(1998—2010年)》、《中国遏制与防治艾滋病十二五行动计划的通知(国办发[2012]4号)》、“四免一关怀”等国家艾滋病防治重要方针政策和十三五防治工作重点,在广泛征求各省、市疾病预防控制机构和医疗机构意见的基础上,在中华人民共和国卫生和计划生育委员会艾滋病专家及省级专家的参与下,中国疾病预防控制中心性病艾滋病预防控制中心对《全国艾滋病检测技术规范(2009年版)》进行修改、增补和完善,制定出《全国艾滋病检测技术规范(2015年版)》(以下简称《规范》),使其既能满足目前艾滋病检测工作的实际需求,又能体现检测技术的发展。
筛查试验要求

筛查试验要求筛查试验是一种用于评估某种干预措施的效果的研究方法。
它是通过对被试对象进行分组,对不同组进行不同干预措施的实施,然后观察和测量不同组的效果差异来判断干预措施的有效性。
筛查试验的设计要求严格,需要满足以下几个方面的要求:1. 随机分组:为了避免干预措施选择偏差的产生,筛查试验要求将被试对象随机分配到不同的组别中。
这样可以保证每个组别的特征在统计上是相似的,从而减少干预效果的干扰。
2. 对照组设置:为了评估干预效果,筛查试验通常会设置对照组,即未接受干预措施的组别。
对照组可以作为一个参照,帮助我们判断干预措施是否真正起到了作用。
3. 结局指标选择:筛查试验的目的是评估干预措施对特定结果的影响,因此需要选择合适的结局指标来进行测量和观察。
结局指标应该具有客观性、可重复性和敏感性,以便准确地评估干预效果。
4. 样本大小计算:筛查试验需要计算合适的样本大小,以保证研究结果的统计学意义。
样本大小的计算需要考虑到预期效果大小、样本方差、显著性水平和统计功效等因素。
5. 数据收集和分析:筛查试验需要设计合理的数据收集和分析方案。
数据收集应该严格按照预定的时间点和方法进行,以保证数据的准确性和完整性。
数据分析可以使用合适的统计方法,如t检验、方差分析或回归分析等,来比较不同组别之间的差异。
6. 值得注意的是,筛查试验的结果只能表明干预措施与特定结果之间存在关联性,不能说明因果关系。
为了更准确地评估因果关系,需要进行更严格的随机对照试验或其他研究设计。
总结起来,筛查试验是一种重要的研究方法,可以用于评估干预措施的效果。
它的设计要求严格,需要满足随机分组、对照组设置、结局指标选择、样本大小计算、数据收集和分析等要求。
通过合理的设计和实施,筛查试验可以为干预措施的评估提供有力的科学依据。
不规则抗体筛选试验标准操作规程(sop)

不规则抗体筛选试验标准操作规程一、目的为规范微柱凝胶抗球蛋白检测卡在红细胞不规则抗体筛选试验中的应用,保证实验结果的准确性和有效性。
二、适用范围输血科进行的微柱凝胶卡式不规则抗体试验。
三、原理红细胞血型抗原—抗体反应体系在微柱凝胶卡微孔上端反应室反应后,如红细胞血型抗原与相应特异性抗体发生凝集反应后,离心后被排阻在具有三维空间网状结构的凝胶表层或者颗粒间隙之中,不能通过凝胶筛网,而未发生抗原—特异性抗体凝集的红细胞则可以通过凝胶筛网沉降至微柱凝胶底部。
四、步骤和方法1、取微柱凝胶抗球蛋白检测卡放入专用离心机,3000r/min离心1min后撕开锡纸膜,正立放置待用。
2、在标记为I、II、III的各反应腔中分别加入对应的I、II、III号筛选红细胞稀释液(1滴细胞+3滴lis液)50微升,再在标记为I,II,III的各反应腔中分别加入对应的受检者血清(血浆)20微升,加入后轻轻震荡3次使其充分混合。
3、将检测卡在微柱凝胶专用孵育器中37℃孵育15min后,用专用离心机以1800r/min·2min,2500r/min·1min离心后取出判断结果。
5、结果判读:I、II、III型红细胞任何一种出现阳性反应,表明该血清(血浆)不规则抗体筛选阳性。
五、质量控制微柱凝胶试剂卡,试剂筛选红细胞在有效期内使用。
六、注意事项1、检测卡若在冰箱储存,使用前须放置实验室5—10min平衡至室温。
2、撕开微柱凝胶卡锡纸膜时,注意避免各微柱间特异性抗体试剂的交叉污染。
3、细菌污染,纤维蛋白析出及抗凝不佳的血,可产生假阳性结果,建议使用血清。
4、严格遵循离心力,离心时间要求,离心速度过快,离心时间过长均易产生假阴性结果。
5、由于试剂生产厂家,批号不同等因素,红细胞浓度,吸取样品的量及离心条件等环节要求有所差异,以试剂说明书为准。
二次筛选试验方法和应用

容器中, 搅拌均匀后 , 每次从 中抽取出一个号签 ,
第O 第 期 3 2 卷
篓 溅
瓣萎
3 7
假 如抽 到 3 l 、83 、5 5 、87 、5 9 ; 、2 1 、64 、7 6 、8 8 、8 于是 就 把这 l 0个对 应 的产 品拿 出来 做 为样本 。
所 有试 验项 目完成 后 , 清点好 数量 交 出。
箱、 颗粒碰撞设备、 恒加设备、 检漏设备、 其它相关
试 验的设备 、 用于老炼试验 的老炼板 、 稳压 电源 、 测 试台、 示波器 、 万用表 、 其它有关测量 的仪器 。
2 4 二次筛 选试验 的试验样 品 .
24 1 元 器 件需 要 10 进 行 二 次 筛 选 的 .. 0%
样品, 是一次筛选后的全部合格 品。元器件 的一 次筛选 , 国军标规定 必须 10 0 %进行 筛选试 验。 元器件的二次筛选 , 由使用方根据实际需要 白行 决定 样 品的数量 。 24 2 部分元器件需要进行二次筛选试验 , .. 试验样品是采用随机抽样方式确定。常用的两种 抽样方式为简单随机抽样和系统抽样 。 A 简单随机抽样 : ) 一个总体含 N个个体 , 从 中逐个不放 回地抽取 n 个个体作为样本( ≤N , n ) 如果每次抽取时总体内的各个个体被抽到的机会 相等 , 这种抽样 叫做简单随机抽样 。它适用于总 体中个数不多的样品抽样。例如从 1 0 0个样品里
( )在第一段用简单 随机抽样确定第 1 3 个个 体编号 II ) ( ≤K ;
( )将 I 4 加上 间 隔 K得 到第 2个个 体编 号 ( I +K)再加 上 K得 到 第 3个 个 体 编 号 ( +2 , , I K) 依 次进行 下去 , 直到 获取 整个样 本 。 例如从 10 00个样 品里抽 出 1 个 样本 , 0 操作步 骤 : 1开始对 10 样 品进 行 编 号 , 成 l 从 00个 分 O个 部分 K= / N n=10/0=10 假 设 在第 一 段 用 简 00 1 0 , 单 随机 抽样抽 出第 9个个体 , 在第 二 步 骤 : 1开 始对 10个 样 从 0 品进行 编号 , 号码写 在号签 上 , 号签放 在一个 把 将
筛查试验要求

筛查试验要求筛查试验是一种常用的医学研究方法,用于检测特定疾病或疾病风险因素的存在与否。
在进行筛查试验时,需要满足一定的要求,以确保试验的准确性和可靠性。
本文将介绍筛查试验的要求,以及为什么这些要求是必要的。
筛查试验要求具备代表性的样本。
样本的选择应该具有代表性,能够反映目标人群的特征。
如果样本选择不当,可能导致结果的偏差,无法准确评估疾病的风险。
筛查试验要求有明确的诊断标准。
诊断标准应该明确且一致,以确保试验结果的可比性。
如果诊断标准模糊或不一致,可能导致结果的不准确或不可靠。
第三,筛查试验要求有有效的筛查工具或方法。
筛查工具应该能够准确地检测出目标疾病或风险因素的存在。
如果筛查工具不够敏感或特异,可能会造成漏诊或误诊,导致试验结果的不准确性。
第四,筛查试验要求有一定的随访期。
随访期可以用来确定试验结果的持久性和稳定性。
如果没有足够的随访期,可能无法准确评估疾病的风险。
第五,筛查试验要求有严格的数据收集和分析方法。
数据收集应该准确且完整,以确保结果的可靠性。
数据分析应该科学且合理,避免主观性的干扰。
第六,筛查试验要求有明确的伦理审查和知情同意。
所有参与试验的个体应该经过伦理审查,并在知情同意的基础上参与试验。
这是保护个体权益和确保试验合法性的重要步骤。
第七,筛查试验要求有充分的统计学处理和结果解释。
统计学处理可以对试验结果进行量化和比较,以确定其统计学意义。
结果解释应该准确且清晰,避免歧义和错误信息的传播。
筛查试验要求具备代表性的样本、明确的诊断标准、有效的筛查工具、一定的随访期、严格的数据收集和分析方法、明确的伦理审查和知情同意、充分的统计学处理和结果解释。
这些要求保证了筛查试验的准确性和可靠性,为疾病预防和控制提供了重要的依据。
通过遵守这些要求,我们可以更好地进行筛查试验,为健康管理和疾病预防做出贡献。
元器件二次筛选试验指南

附录D元器件二次筛选试验指南D1 筛选与二次筛选试验的基本概念D1.1 筛选试验的定义与目的筛选试验是指为选择具有一定特性的产品或剔除早期失效的产品而进行的试验。
本《指南》提出的筛选试验主要是指剔除早期失效的产品而进行的试验。
它是一种对产品进行全数检验的非破坏性试验,通过按照一定的程序施加环境应力,激发出产品潜在的设计和制造缺陷,以便剔除早期失效产品,降低失效率。
元器件的筛选一般应由元器件生产方按照军用电子元器件规范或供需双方签定的合同进行。
一般将元器件生产方进行的筛选称为“一次筛选”,如果当“一次筛选”的技术条件不能完全满足使用方对元器件的质量要求时,使用方或其委托单位可以进行再筛选以补充生产方筛选的不足。
一般将使用方或委托单位进行的筛选称为“二次筛选”或称“补充筛选”。
即二次筛选是指已采购的元器件在“一次筛选”试验没有满足使用方规定的项目要求的技术条件时,由使用方进行的筛选。
元器件的“一次筛选”和“二次筛选”的目的与试验方法基本相同,但应强调“二次筛选”应是在“一次筛选”的基础上剪裁而成的。
筛选试验一般是对元器件成品而进行的,但也可以在生产过程中对元器件的半成品进行,例如,质量保证等级较高的半导体器件封帽前的非破坏性键合拉力试验、内部目检等筛选都属于半成品筛选。
在一定条件下,虽然二次筛选是提高元器件批质量的有效措施之一,但它也有其局限性和风险性,并不是所有的元器件都要进行二次筛选,也不能把二次筛选看作是任何情况下都是必须的,根据国外的经验只有少数采购不到高质量等级的元器件才需要进行二次筛选。
因为筛选只能提高批产品的使用可靠性,不能提高产品的固有可靠性。
也就是说,产品的固有可靠性是设计进去的,制造出来的,而不是筛选出来的。
因此,在选择元器件时,应根据整机、设备的质量与可靠性要求,选择相应的高质量等级的元器件。
特别是电子整机、设备的关键件、重要件,一定要选择最高质量等级的元器件。
为有效剔除有缺陷的元器件,减少系统或设备的早期失效,本《指南》主要提出了对军用电子元器件成品进行二次筛选试验的基本原则、要求、项目和方法供参考。
筛选安全操作规程

筛选安全操作规程(最新版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的安全管理制度,如通用安全、交通运输、矿山安全、石油化工、建筑安全、机械安全、电力安全、其他安全等等制度,想了解不同制度格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, this shop provides you with various types of safety management systems, such as general safety, transportation, mine safety, petrochemical, construction safety, machinery safety, electrical safety, other safety, etc. systems, I want to know the format and writing of different systems ,stay tuned!筛选安全操作规程1、筛选有药烟花药物的筛子不能共同使用,如需使用,必须清洗干净,各种筛子必须在筛子上标明用途。
筛分过滤实验报告

筛分实验一、实验目的(1)测定天然河砂的颗粒级配。
(2)绘制筛分级配曲线,求d0、d80、K80。
(3)按设计要求对上述河砂进行再筛选。
二、实验原理滤料级配是指将不同大小粒径的滤料按一定比例加以组合,以取得良好的过滤效果。
滤料是带棱角的颗粒,其粒径是指把滤料颗粒包围在内的球体直径(这是一个假想直径)。
在生产中简单的筛分方法是用一套不同孔径的筛子筛分滤料试样,选取合适的粒径级配。
我国现行规范是以筛孔孔径0.5 mm及1.2mm两种规格的筛子过筛,取其中段。
这虽然简便易行但不能反映滤料孔径的均匀程度,因此还应该考虑级配情况。
能反映级配状况的指标是通过筛分级配曲线求得的有效粒径的d10以及d80和不均匀系数K80。
d10是表示通过滤料质量10%的筛孔孔径,它反映滤料中细颗粒尺寸,即产生水头损失的“有效”部分尺寸;d80系指通过滤料质量80%的筛孔孔径,它反映粗颗粒尺寸;K80为d80与d10之比,即K80=d80/d10。
K80越大表示粗细颗粒尺寸相差越大,滤料粒径越不均匀,这样的滤料对过滤及反冲均不利。
尤其是反冲时,为了满足滤料粗颗粒的膨胀要求就会使细颗粒固过大的反冲强度而被冲走:反之,若为满足细颗粒个被冲走的要求而减小反冲强度,粗颗粒可能因冲不起来而得不到充分清洗。
故滤料需经过筛分级配。
三、实验内容3.1 实验设备与试剂(1)圆孔筛一套,直径0.15-0.9mm,筛孔尺寸如表4-1所示。
(2)托盘天平,称量300g,感量0.1g。
(3)烘箱。
(4)带拍摇筛机,如无,则人工手摇。
(5)浅盘和刷(软、硬)。
(6)1000mL量筒。
3.2 实验步骤(1)取样。
取天然河砂300g,取样时要先将取样部位的表层铲去,然后取样。
将取样器中的砂样洗净后放在栈盘中,将浅盘置于105℃恒温箱中烘干,冷至室温备用。
(2)称取砂样200g,选用一组筛子过筛。
筛子按筛孔大小顺序排列,砂样放在最上面的一只筛(1.68mm 筛)中。
不规则抗体筛选试验标准操作规程(sop)

不规则抗体筛选试验标准操作规程一、目的为规范微柱凝胶抗球蛋白检测卡在红细胞不规则抗体筛选试验中的应用,保证实验结果的准确性和有效性。
二、适用范围输血科进行的微柱凝胶卡式不规则抗体试验。
三、原理红细胞血型抗原—抗体反应体系在微柱凝胶卡微孔上端反应室反应后,如红细胞血型抗原与相应特异性抗体发生凝集反应后,离心后被排阻在具有三维空间网状结构的凝胶表层或者颗粒间隙之中,不能通过凝胶筛网,而未发生抗原—特异性抗体凝集的红细胞则可以通过凝胶筛网沉降至微柱凝胶底部。
四、步骤和方法1、取微柱凝胶抗球蛋白检测卡放入专用离心机,3000r/min离心1min后撕开锡纸膜,正立放置待用。
2、在标记为I、II、III的各反应腔中分别加入对应的I、II、III号筛选红细胞稀释液(1滴细胞+3滴lis液)50微升,再在标记为I,II,III的各反应腔中分别加入对应的受检者血清(血浆)20微升,加入后轻轻震荡3次使其充分混合。
3、将检测卡在微柱凝胶专用孵育器中37℃孵育15min后,用专用离心机以1800r/min·2min,2500r/min·1min离心后取出判断结果。
5、结果判读:I、II、III型红细胞任何一种出现阳性反应,表明该血清(血浆)不规则抗体筛选阳性。
五、质量控制微柱凝胶试剂卡,试剂筛选红细胞在有效期内使用。
六、注意事项1、检测卡若在冰箱储存,使用前须放置实验室5—10min平衡至室温。
2、撕开微柱凝胶卡锡纸膜时,注意避免各微柱间特异性抗体试剂的交叉污染。
3、细菌污染,纤维蛋白析出及抗凝不佳的血,可产生假阳性结果,建议使用血清。
4、严格遵循离心力,离心时间要求,离心速度过快,离心时间过长均易产生假阴性结果。
5、由于试剂生产厂家,批号不同等因素,红细胞浓度,吸取样品的量及离心条件等环节要求有所差异,以试剂说明书为准。
抗体筛检试验操作规程

抗体筛检试验操作规程一、试验目的二、试验前准备1.安全措施:在进行试验前,操作人员应穿戴好实验室所要求的防护服、手套、口罩等个人防护用品,确保实验的安全进行。
2.仪器准备:确保所需要的实验仪器设备状态良好,无损坏或故障。
三、实验步骤1.样品准备:a.样品收集:采集患者的体液样本,按照规范的采样方法进行,避免外界污染。
b.样品处理:将样品离心,去除悬浮物,得到清澈的液体。
c.样品储存:如不能立即使用,应将样品进行适当的储存,避免变质和污染。
2.标本分配:根据试剂说明书的要求,将样品分配到不同的试管或孔板中。
3.添加试剂:根据试剂的使用说明书,按照要求将试剂依次加入样品中。
注意加入试剂的顺序和时间,避免因操作不当引起实验结果的误差。
4.摇动和舍弃:轻轻摇动试管或孔板,使样品和试剂充分混合,以保证试验的均一性。
然后,按照规定的程序舍弃废弃物,避免污染和交叉感染。
5.实验读数:将样品置于分光光度计或其他适当的仪器中,按照试剂说明书要求进行读数。
记录读数结果。
6.结果判定:根据标准曲线或指标值,对读数结果进行判定,确定阳性或阴性结果。
注意结果的解读要准确和可靠。
四、结果评估根据试验结果的阳性或阴性情况,评估样品中是否含有特定抗体。
阳性结果可能表示感染或其中一种疾病的存在,而阴性结果则表示无特异抗体存在。
五、记录和报告试验过程中应详细记录试验操作和结果,包括样品信息、试剂信息、实验步骤、读数结果等。
及时准确地完成实验记录和结果报告,以便后续的数据分析和报告撰写。
六、实验后处理试验结束后,及时清洗和消毒实验用具和工作台面。
将废弃物放入指定的处置容器中,并按照实验室的废物处理规范进行处理和处置。
七、实验验证为了保证试验结果的准确性和可靠性,应定期进行实验验证,对操作流程、试剂、仪器等进行检验和验证。
必要时,可以进行重复实验或对照试验,以确保试验结果的一致性和可靠性。
八、实验质控建立适当的实验质控体系,包括对试剂的质量控制、实验仪器的校准和验证、样品处理和分配的质控和实验数据的监控等方面。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
目录
1 范围 (2)
2 术语和定义 (2)
2.1 筛选 (2)
2.2 批允许不合格率(PDA) (2)
3 一般要求 (2)
3.1 筛选的电子元器件种类 (2)
3.2 筛选要求 (2)
3.3 筛选的大气条件 (2)
3.4 筛选条件允差 (2)
3.5 筛选PDA要求 (3)
3.6 其他 (3)
4 筛选条件 (3)
5 筛选流程 (4)
6 筛选实施要求 (4)
6.1 性能检测 (4)
6.2 故障处置 (4)
6.3 标识 (4)
7 检验方法和步骤 (4)
7.1 半导体分立器件、集成电路的检验方法和步骤 (4)
7.2 晶体谐振器筛的检验方法和步骤 (5)
7.3 HFA3861和HFA3783芯片的检验方法和步骤 (5)
1 范围
本规范适用于本公司生产的产品使用的电子元器件筛选要求。
2 术语和定义
2.1 筛选
一种通过试验剔除不合格或有可能早期失效元器件的方法。
2.2 批允许不合格率(PDA)
当采购的元器件百分之百地经受过规定的试验后,使用方接收该批元器件所能允许的不合格最大百分数。
3 一般要求
3.1 筛选的电子元器件种类
筛选的电子元器件包括装机的集成电路、半导体分立器件和晶体谐振器。
3.2 筛选要求
元器件应经过检验,允许不合格率不大于5%的批(类)进入环境温度循环应力筛选程序。
3.3 筛选的大气条件
标准大气条件:
1)温度:15℃~35℃;
2)相对湿度:不加控制室内环境;
3)大气压力:试验场所的当地气压。
3.4 筛选条件允差
3.4.1 筛选温度允差
除必要的支撑点外,受筛单元部件应完全被温度试验箱内空气包围。
箱内温度梯度(靠近受筛单元部件测得)应小于1℃/m;温度允差范围为±2℃,但总的温度变动最
大值为2.2℃。
3.4.2 筛选时间允差
筛选时间允差为±1%。
3.5 筛选PDA 要求
表 1 筛选PDA 要求
3.6 其他
对于生产厂家已做过筛选,且筛选条件已能满足要求的电子元器件,只选择外观检验。
4 筛选条件
温度
-55℃
室温 +65℃
时间
图 2 温度循环程序
温度循环筛选试验程序见图1,上限温度为65℃,下限温度为-55℃;上限温度保持时间为2h ,下限温度保持时间为2h ;温度变化速率:升温2℃/min ,降温1℃/min ,循环5次;不通电。
5 筛选流程
图 2 筛选流程
6 筛选实施要求
6.1 性能检测
检验员负责对所有受筛元器件实施性能检测并现场记录,检验项目及指标要求见第7条。
6.2 故障处置
元器件筛选后,应剔除检测不合格的元器件。
6.3 标识
对筛选合格的元器件在器件的包装物上标记。
7 检验方法和步骤
7.1 半导体分立器件、集成电路的检验方法和步骤
7.1.1 外观检验
7.1.1.1 方法:用3-10倍放大镜或凭眼力进行外观检验。
7.1.1.2 检验内容:
1)引出端;
2)型号、质量类别或等级;
3)制造单位名称、代码或商标及出厂日期;
4)检验批识别代码;
5)认证合格标志(适用时);
6)器件封装外形;
7)需要时的其他特殊标志。
7.1.1.3 合格判据:
1)器件型号、引出端标识、标志清晰、完整(以器件具体规定为准);
2)外壳无损伤痕迹、腐蚀、污染、密封破裂,电镀层剥落、掉漆和明显的机械缺陷;
3)引出端无折断、弯曲或毛刺。
7.2 晶体谐振器的检验方法和步骤
7.2.1 外观检验
7.2.1.1 方法:用3-10倍放大镜或凭眼力进行外观检验。
7.2.1.2 检验内容:
1)引出端;
2)型号、质量类别或等级;
3)制造单位名称、代码或商标及出厂日期;
4)检验批识别代码;
5)认证合格标志(适用时);
6)器件封装外形;
7)需要时的其他特殊标志。
7.2.1.3 合格判据:
1)器件型号、引出端标识、标志清晰、完整(以器件具体规定为准);
2)外壳无损伤痕迹、腐蚀、污染、密封破裂,电镀层剥落、掉漆和明显的机械缺陷;
3)引出端无折断、弯曲或毛刺。
7.3 HFA3861和HFA3783芯片的检验方法和步骤
7.3.1 检验平台组成
每套检验平台由二块带有测试座的芯片测试电路板组成。
其中一块芯片测试电路板运行基站程序,另一块芯片测试电路板运行外站程序。
7.3.2 检验步骤
1)将HFA3861和HFA3783芯片放置于芯片测试电路板的测试座中,夹好;
2)用中间串接可调衰减器的中频电缆连接两块测试电路板;
3)分别接通电源(运行基站程序的一端先加电)。
7.3.3 检测结果及合格判据
芯片测试电路板有8个LED二极管作为显示。
1)更换芯片、插拔中频电缆时必须将电源断开;
2)每次测试大约需要20秒时间(从LED1亮到LED2亮);
3)每次测试结束后,基站和外站电路板都要重新加电;
4)对于测试不合格的芯片应重新固定芯片再测试两次,其中对于HFA3861无法配置、无tx_rdy或tx_clk的故障3次测试仍不能通过可以判定芯片故障,对于其他现象需要进一步判断。
