酶促反应影响因素讲解
酶促反应速率的影响因素

酶促反应速率的影响因素酶是一种特殊的蛋白质,它们能够催化化学反应并加速反应速率。
酶促反应速率受多种因素的影响,这些因素可以分为物理因素和化学因素两类。
一、物理因素1.温度:酶的反应速率随着温度的升高而增加,直至达到最适温度,此时反应速率最大。
但是,如果温度过高,酶的结构就会发生变化,导致失活。
因此,温度的升高对酶的活性具有双重影响,需要控制在适宜范围内。
2. pH值:不同的酶在不同的pH值下具有最适活性。
例如,胃蛋白酶在酸性环境下具有最高活性,而肠蛋白酶则在碱性环境下具有最高活性。
当环境pH值偏离最适值时,酶的活性会降低。
3.底物浓度:底物浓度对酶反应速率的影响呈现一定的规律。
当底物浓度较低时,酶活性受限于底物浓度;当底物浓度逐渐增加时,酶反应速率也呈现出增加的趋势,但是当底物浓度达到一定程度时,酶的活性已经达到饱和状态,继续增加底物浓度也不会增加酶的反应速率。
二、化学因素1.酶和底物的亲和力:酶和底物的亲和力越大,酶反应速率就越快。
酶和底物的亲和力受到酶的三级结构和底物的形状等因素的影响。
2.离子强度:离子强度对酶的活性也有一定的影响。
当离子强度过高时,离子和酶的结合会阻碍酶和底物之间的结合,导致酶的活性下降。
3.抑制剂:抑制剂是一种能够抑制酶活性的物质。
抑制剂可以分为可逆抑制剂和不可逆抑制剂。
可逆抑制剂可以通过改变酶和底物之间的亲和力来抑制酶活性,而不可逆抑制剂则通过破坏酶的结构来抑制酶活性。
酶促反应速率受到多种因素的影响,需要在实验设计和操作中充分考虑这些因素,以保证实验结果的可靠性和准确性。
同时,对于酶催化反应机理的研究,也需要深入探究这些因素的作用机制,以加深对酶催化反应的认识。
影响酶促反应的因素

影响酶促反应的因素
酶促反应指的是由酶作为催化剂进行催化的化学反应。
影响酶促反应的因素有温度,酸碱度,酶浓度,底物浓度,抑制剂和激活剂等。
1.温度:酶促反应在一定温度范围内反应速度随温度的升高而加快;但当温度升高到一定限度时,酶促反应速度不仅不再加快反而随着温度的升高而下降。
在一定条件下,每一种酶在某一定温度时活力最大,这个温度称为这种酶的最适温度。
2.酸碱度:每一种酶只能在一定限度的pH范围内才表现活性,超过这个范围酶就会失去活性。
3.酶浓度:在底物足够,其它条件固定的条件下,反应系统中不含有抑制酶活性的物质及其它不利于酶发挥作用的因素时,酶促反应的速度与酶浓度成正比。
4.底物浓度:在底物浓度较低时,反应速度随底物浓度增加而加快,反应速度与底物浓度近乎:成正比,在底物浓度较高时,底物浓度增加,反应速度也随之加快,但不显著;当底物浓度很大且达到一定限度时,反应速度就达到一个最大值,此时即使再增加底物浓度,反应也几乎不再改变。
5.抑制剂:能特异性的抑制酶活性,从而抑制酶促反应的物质称为抑制剂。
6.激活剂:能使酶从无活性到有活性或使酶活性提高的物质称为酶的激活剂。
影响酶促反应的因素

§3影响酶促反应的因素一、温度一般而言,温度越高化学反应越快,但酶是蛋白质,若温度过高会发生变性而失去活性,因而酶促反应一般是随着温度升高反应加快,直至某一温度活性达到最大,超过这一最适温度,由于酶的变性,反应速度会迅速降低。
大多数酶,在30-40℃范围内显示最高活性。
贾2-8 pH对病反应速度的影响热对酶活性的影响对食品很重要,如,绿茶是通过把新鲜茶叶热蒸处理而得,经过热处理,使酚酶、脂氧化酶、抗坏血酸氧化酶等失活,以阻止儿茶酚的氧化来保持绿色。
红茶的情况正相反,是利用这些酶进行发酵来制备的。
二、PH值酶是蛋白质,在极端的酸性或碱性条件下会变性而完全失去活性,大多数酶的最适PH值为4.5-8.0范围内。
三、水分活度水能影响食品中酶反应的速度,通常可用降低食品中水分含量的方法来阻滞酶度遣腔泛塞物装度[S】等作用引起的变质。
四、酶浓度对大多数酶促反应来说,在适宜的温度、PH值和底物浓度一定的条件下,反应速度至少在初始阶段与酶的浓度成正比。
如果反应继续进行,则速度将降低,这主要是因为底物浓度下降及终产物对酶的抑制之故。
五、底物浓度酶催化反应可用下式表示:E+ S= ES > ·E +P式中E、S、ES、P分别代表酶、底物、酶—底物络合物和产物,可推出下列公式(米氏方程):V=Vm[S]/ (K+[S])式中:V —测定的反应初速度Vma.—最大反应速度公式用图表示,则如图(1)所示,由公式及图可得出下列结论:1. 当底物浓度增加时,酶反应的速度趋于一个极限值,即Vmz.2. 当V=1/2Vm时,则1/2=[S]/(K- [S]),或K=[S],即米氏常数相当于反应速度为最大速度一半时的底物浓度。
3. K.是酶和底物亲和力的度量,K,值小表示底物对酶的亲和力大,酶催化反应的速度也大。
K.是酶学中的一个重要常数,它的倒数1/K 叫做”亲和力常数”。
六、抑制剂有些物质能使酶活性中心的化学性质发生改变,导致酶活力下降或丧失,这种现象称为酶的抑制,引起酶抑制的物质叫抑制剂。
酶促反应影响因素

酶促反应影响因素酶促反应影响因素1. 温度:温度高于酶的最适活性温度,会加速酶分子的活性,而酶活性过高则可导致酶烧伤或破坏,从而降低反应的速率,所以保持合适的温度是影响酶促反应的重要因素之一。
2. 酶浓度:酶浓度是影响酶促反应速率的主要因素,它直接影响反应中酶与底物之间的接触次数,当酶浓度增加时,酶与底物越多,接触次数越多,反应速率自然越快,反之,当酶浓度过低时,反应速率就变慢。
3. pH值:pH值也会影响酶促反应,每种酶都有自己最适宜的pH值,若pH值过高或过低,酶活性可能会下降,甚至在一定的极端条件下可能造成酶的解离,因此需要控制反应的pH值。
4. 辅助因子:对于一些特定的酶,还需要加入某些激活剂或辅助因子,才能促进反应,引起酶活性。
例如,维生素是不可缺少的辅助因子,它们可能和一些酶结合形成介质型酶,影响酶促反应的反应速率。
5. 抑制剂:在生理反应过程中,也需要抑制酶的活性,而一些有机分子可以抑制酶的活性,从而降低反应的速率。
抑制剂的效果受其类型、浓度和pH值等影响,如果抑制剂的浓度过高,将会完全抑制酶活性,从而降低反应的速率。
6. 氧化剂和还原剂:氧化剂和还原剂都会影响酶促反应,氧化剂可以促进酶的反应速率,而还原剂则可以降低酶的反应速率。
例如,苯酚可以作为氧化剂加速酶促反应,而过氧化氢则可以作为还原剂,降低酶促反应的速率。
7. 金属离子:一些金属离子也可以影响酶的反应速率,其中锰、铜、铁等离子可能介导酶的正向活性,而硫酸钙、硫酸镁、硫酸铝等离子可能起抑制作用,降低酶的反应速率。
因此,温度、酶浓度、pH值、辅助因子、抑制剂、氧化剂和还原剂以及金属离子等都是影响酶促反应速率的重要因素。
基于此,实验室工作者可以在有效控制这些条件条件的基础上,改善反应的质量和效率,从而获得更佳的实验结果。
影响酶催化作用的因素
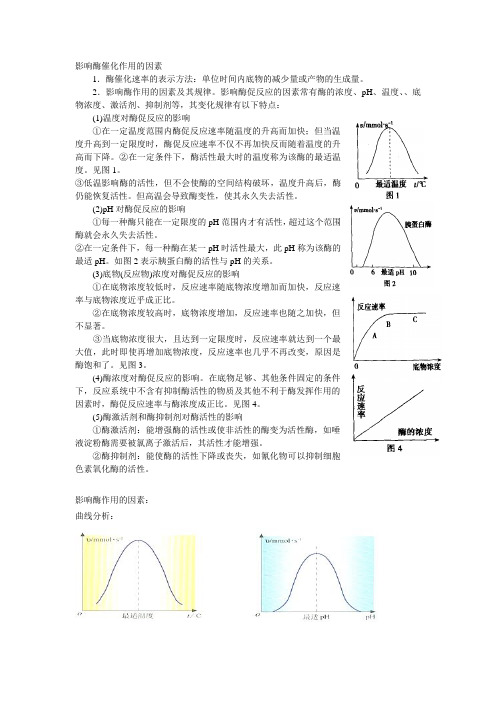
影响酶催化作用的因素1.酶催化速率的表示方法:单位时间内底物的减少量或产物的生成量。
2.影响酶作用的因素及其规律。
影响酶促反应的因素常有酶的浓度、pH、温度、、底物浓度、激活剂、抑制剂等,其变化规律有以下特点:(1)温度对酶促反应的影响①在一定温度范围内酶促反应速率随温度的升高而加快;但当温度升高到一定限度时,酶促反应速率不仅不再加快反而随着温度的升高而下降。
②在一定条件下,酶活性最大时的温度称为该酶的最适温度。
见图1。
③低温影响酶的活性,但不会使酶的空间结构破坏,温度升高后,酶仍能恢复活性。
但高温会导致酶变性,使其永久失去活性。
(2)pH对酶促反应的影响①每一种酶只能在一定限度的pH范围内才有活性,超过这个范围酶就会永久失去活性。
②在一定条件下,每一种酶在某一pH时活性最大,此pH称为该酶的最适pH。
如图2表示胰蛋白酶的活性与pH的关系。
(3)底物(反应物)浓度对酶促反应的影响①在底物浓度较低时,反应速率随底物浓度增加而加快,反应速率与底物浓度近乎成正比。
②在底物浓度较高时,底物浓度增加,反应速率也随之加快,但不显著。
③当底物浓度很大,且达到一定限度时,反应速率就达到一个最大值,此时即使再增加底物浓度,反应速率也几乎不再改变,原因是酶饱和了。
见图3。
(4)酶浓度对酶促反应的影响。
在底物足够、其他条件固定的条件下,反应系统中不含有抑制酶活性的物质及其他不利于酶发挥作用的因素时,酶促反应速率与酶浓度成正比。
见图4。
(5)酶激活剂和酶抑制剂对酶活性的影响①酶激活剂:能增强酶的活性或使非活性的酶变为活性酶,如唾液淀粉酶需要被氯离子激活后,其活性才能增强。
②酶抑制剂:能使酶的活性下降或丧失,如氰化物可以抑制细胞色素氧化酶的活性。
影响酶作用的因素:曲线分析:曲线含义的准确表述:B 点:该酶发挥催化作用的最适温度或最适pH 值AB 段:达到最适温度(pH 值)前,随着温度(pH 值)升高,酶的催化效率提高酶的最适pH 值往往随底物种类、浓度等的变化而不同,因此,并不是一个常数,只是在一定条件下才有意义。
酶促反应影响因素

杨振龙 2014年9月5日
上节课小结
产生部位 化学本质 合成原料 合成场所 功能 作用场所 活细胞(不包括成熟的红细胞) 绝大多数是蛋白质,少数是RNA 氨基酸或核糖核苷酸 核糖体或细胞核 生物催化作用 细胞内外均可
酶的本质
(1)酶具有高效性 酶的特性 (2)酶具有专一性 (3)酶的作用条件较温和
A.随温度升高,酶活性不断上升 B.随pH下降,酶活性不断升高 C.最适温度为T,最适pH为X D.酶活性受温度影响,但不受 pH影响
C
5.下表是某同学为验证酶的专一性而设计的实验方案,a~d表示4 支试管,①~⑦表示实验步骤。对该实验方案的有关评价,错误 的是
a
① 淀粉溶液
b
蔗糖溶液2 mL
c
唾液淀粉酶溶液2 mL
υ/mmol. s-1
最适pH
pH
酶活性受PH影响示意 图
例:如下图表示某反应物剩余量随pH及温度的变化情况,正确 的是
C
A.该酶的最适温度是37℃ B.随着pH的升高,酶的活性先降低后升高 C.随着温度的升高,酶的最适pH不变 D.随着温度的升高,酶的活性逐渐降低
例:(2013•海淀区模拟)如图所示是与酶活性影响因素相关 的曲线,据图能得出的结论是( )
底物足够
酶的浓度
• 在底物充足, 其他条件适宜的 条件下,酶促反 应速率与酶浓度 成正比。
酶浓度影响其活性示意图
五、酶活剂对酶反应速率的影响
• 能使酶活性提高的物质,都称为激活剂(activator),
其中大部分是离子或简单的有机化合物。如Mg++
是多种激酶和合成酶的激活剂,动物唾液中的α淀粉酶则受Cl-的激活。 特点: 1、酶对激活剂有一定的选择性,一种酶的激 活剂对另一种酶来说可能是抑制剂。 2、有一定的浓度要求,当激活剂的浓度超过 一定的范围时,它就成为抑制剂。
酶促反应的动力学及其影响因素

种因素。
在探讨各种因素对酶促反应速度的影响时,通常测定其初始速度来代表酶促反应速度,即底物转化量<5%时的反应速度。
影响酶促反应速度的因素包括:1. 酶浓度:在其他因素不变的情况下,底物浓度的变化对反应速率影响的作图时呈矩形双曲线。
底物足够时,酶浓度对反应速率的影响呈直线关系。
2. 底物浓度:在其他因素不变的情况下,随着底物浓度的增加,反应速率也会相应增加。
3. pH值:pH值通过改变酶和底物分子解离状态影响反应速率。
4. 温度:温度对反应速率的影响具有双重性。
在适宜的温度范围内,随着温度的升高,反应速率加快。
但当温度过高时,酶的活性会受到抑制,反应速率反而下降。
5. 抑制剂和激活剂:抑制剂可逆或不可逆的降低酶促反应速率,而激活剂可加快酶促反应速率。
在实际生产中要充分发挥酶的催化作用,以较低的成本生产出较高质量的产品,就必须准确把握酶促反应的条件。
酶促反应的动力学研究与探讨的是酶促反应的速率及影响酶促反应速率的各种因素。
其中,主要的因素包括酶浓度、底物浓度、pH值、温度、激活剂和抑制剂等。
1. 酶浓度:在其他因素不变的情况下,底物浓度的变化对反应速率的影响呈矩形双曲线。
当底物浓度足够时,酶浓度对反应速率的影响则呈直线关系。
2. 底物浓度:在酶浓度不变的情况下,底物浓度的增加会促进反应速度的增加,但当底物浓度达到一定值后,再增加底物浓度对反应速度的影响不大。
3. pH值:pH值通过改变酶和底物分子解离状态影响反应速率。
4. 温度:温度对酶促反应速率的影响具有双重性。
在低温条件下,由于分子运动速度较慢,反应速度比较慢;随着温度的升高,分子运动速度加快,反应速度也会加快;但当温度升高到一定值后,过高的温度会使酶变性,反应速度反而下降。
5. 激活剂和抑制剂:激活剂可以加快酶促反应速度,而抑制剂可以降低酶促反应速度。
在实际生产中要充分发挥酶的催化作用,以较低的成本生产出较高质量的产品,就必须准确把握酶促反应的条件。
生物化学--酶促反应的速率和影响因素 PPT课件

一个酶的活性中心不是一 个点、一条线或一个面, 而是一个空间部位。 酶活性中心的氨基酸残基 在一级结构上可以相距较 远,但通过肽键的盘绕折 叠,在空间结构中都处于 邻近位置。
酶活性中心的必需基团
酶活性中心含有多种不同的基团,其中 一些基团是酶的催化活性必需的,称为 必需基团。 在酶的催化过程中,这些必需基团与底 物分子通过非共价力等方式,起催化作 用。
按照酶活性部位的功能,分为
1.结合部位:是活性中心,决定酶的专一性 结合部位在空间形状和氨基酸残基组成上有利于与底物形 成复合物使参加化学变化的反应基团相互接近并定向。 2.催化部位:是活性中心,决定酶的催化能力 酶的催化部位与结合部位重叠或者靠近。催化部位含有多 种具有活性侧链的氨基酸残基,如Ser,His,Asp,Cys等,及 辅酶和金属离子。作用是使底物的价键发生形变或极化, 降低过渡态活化能。 3.调控部位:不是酶的活性中心,调控部位的作用是调节 酶促反应的速率或方向。可以与底物以外的分子发生某种 程度的结合,引起酶分子空间构象的变化,对酶起激活或 抑制作用。
米氏常数Km
Km=(k2+k3)/k1
Vmax [S] v K m [S]
当反应速率等于最大速率一半时,即v=1/2vmax 米氏方程可以表示为Km=[S],Km的物理意义 是当酶促反应初速度达到最大反应速率一半时 的底物浓度,单位为浓度单位.
米氏常数Km是酶学研究中的重要数据
1. 不同的酶具有不同的Km值,它是酶的一个重 要的物理常数。只与酶的性质有关,与酶的浓度 无关。 可以用来鉴别酶。
酶活力
即酶活性,指酶催化某一化学反应的能 力
酶活力的大小可以用在一定条件下所催 化的某一化学反应的反应速率来表示.
单位时间内底物的减少量或产物的增加量
影响酶促反应的因素.

制剂的EI复合体,不能再结合S
抑制剂I在化学结构上与底物S个相似,能与底物S竞争 酶E分子活性中心的结合基团,因此,抑制作用大小取决于 抑制剂与底物的浓度比,加大底物浓度,可使抑制作用减 弱。
2.非竞争性抑制(non-competitive inhibition) 抑制剂I和底物S与酶E的结合完全互不相关,既不排斥, 也不促进结合,抑制剂I可以和酶E结合生成EI,也可以和ES 复合物结合生成ESI。底物S和酶E结合成ES后,仍可与I结合
的症状。解磷定等药物可与有机磷杀虫剂结合,使酶和有机磷杀
虫剂分离而复活。
(二)可逆性抑制(reversible inhibition)
抑制剂与酶以非共价键结合,在用透析等物理方法除去
抑制剂后,酶的活性能恢复,即抑制剂与酶的结合是可逆的。
这类抑制剂大致可分为以下二类。
1.竞争性抑制(competitive inhibition)
生化学家将酶活性最高处的pH称为最适pH。一般来说,血 清中大多数酶最适pH接近中性(pH6.5-7.5)。有些酶在最适 pH处活性变化尖锐明显,也有些平坦宽广。测定酶活性浓度时 一定要选择在最适pH处,不仅因为此处酶反应速度最大,测定 灵敏度最高,还因为此处酶活性变化的斜率最小,如反应体系 中出现pH变化时,对测定结果影响最小。
2. 专一性不可逆抑制
此属抑制剂专一地作用于酶的活性中心或其必需基团,进行 共价结合,从而抑制酶的活性。有机磷杀虫剂能专一作用于胆碱
酯酶活性中心的丝氨酸残基,使其磷酰化而不可逆抑制酶的活性。
当胆碱酯酶被有机磷杀虫剂抑制后,胆碱能神经末稍分泌的乙酰 胆碱不能及时分解,过多的乙酰胆碱会导致胆碱能神经过度兴奋
酶促反应动力学(有方程推导过程)ppt课件

当酶反应体系处于恒态时: v1 v2
即: k 1 E t E S S k 1 E k 2 S E S EtSE E SSSk1k 1k2
令: k1 k2 Km k1
则: K m E S E S S E tS
经整理得: ES
Et S Km S
(1)
由于酶促反应速度由[ES]决定,即 vk2ES
2、pH影响酶分子的构象:过高或过低pH都会影响酶分子 活性中心的构象,或引起酶的变性失活。
整理版课件
9
动物体内多数酶的最适pH值接近中性,但也有例外,如胃 蛋白酶的最适pH约1.8,肝精氨酸酶最适pH约为9.8(见下表)。
一些酶的最适pH
整理版课件
10
四、 底物浓度对反应速度的影响
1、酶反应与底物浓度的关系
种酶与不同底物作用时,Km 值也不同。各种酶的 Km 值
范围很广,大致在 10-1~10-6 M 之间。
整理版课件
17
3. Km在实际应用中的重要意义
(1)鉴定酶:通过测定可以鉴别不同来源或相同来源但 在不同发育阶段、不同生理状态下催化相同反应的酶是 否属于同一种酶。
(2)判断酶的最佳底物:如果一种酶可作用于多个底 物,就有几个Km值,其中Km最小对应的底物就是酶的 天然底物。如蔗糖酶既可催化蔗糖水解 (Km=28mmol/L),也可催化棉子糖水解 (Km=350mmol/L),两者相比,蔗糖为该酶的天然底物。
➢ 在一定范围内,反应速度达到最大时对应的温度称为该 酶促反应的最适温度(optimum temperature Tm).一 般动物组织中的酶其最适温度为35~40℃,植物与微生 物中的酶其最适温度为30~60℃,少数酶可达60℃以上, 如细菌淀粉水解酶的最适温度90℃以上。
酶促反应的生化过程和影响因素

酶促反应的生化过程和影响因素酶促反应是生物体内一种常见的生化过程,它能够加速化学反应的速度,从而帮助生物合成必需物质、去除废物和维持生物体内稳态。
酶促反应的速度和效果与许多因素相关,这篇文章将探讨酶促反应的生化过程、影响因素以及酶的应用。
1. 酶促反应的生化过程酶是一种生物催化剂,可以加速化学反应而不影响反应物的化学本质和反应终点的能量状态。
在酶促反应中,酶与底物结合形成酶底物复合物,使得底物分子的能垒降低,从而使得反应发生的能量更低、速率更快。
当反应结束后,酶和产物分离,酶分子经历一个循环过程,使得它可以反复地催化同一反应。
整个过程中,酶的催化作用涉及到包括底物分子中活性部位的基团与酶中的催化中心的相互作用、酶结构改变、产生的中间体转化、产物的释放等多种因素。
2. 酶促反应的影响因素酶促反应的速率不仅取决于催化中心的效率,还与许多物理和化学因素有关。
以下是影响酶促反应的三个关键因素:2.1 温度通常情况下,酶促反应的速率随温度的升高而加快,因为温度升高会使底物分子的平均动能增加,从而使得底物更可能接近酶的催化中心。
但是,过高的温度会破坏酶的结构,导致其失去活性。
2.2 pH不同酶对酸碱度的依赖程度不同,但是大多数酶都只在一个特定的 pH 值下才能发挥最大的催化能力。
这是由于 pH 值的变化会影响酶的结构和电荷分布,从而干扰其与底物的结合或催化转化过程。
2.3 底物浓度底物浓度也是酶促反应速率的重要因素,因为底物分子的浓度越高,酶与底物的碰撞频率就越高,从而加速酶促反应的速率。
但当底物浓度过高时,酶的催化速率会受到限制,因为酶的催化中心数量有限。
3. 酶的应用酶是一种非常有用的生物催化剂,可应用于许多生产和检测领域,包括农业、食品、医学、环保等。
3.1 生产许多工业生产过程都需要使用酶,如生物燃料生产、抗生素生产、高级别医药合成等。
通过选择特定的酶,并进行工艺调整,可以更加高效地生产目标物,并减少废物生成。
酶促反应的速率和影响因素PPT(完整版)

Km——米氏常数
Vmax——最大反应速率
Leonor Michaelis (1875-1949) Maud Menten (1879-1960
3、当反应速率等于最大速率一半时,即V=0.5Vmax时。则
Km=【S】
米氏方程所规定动力学规律,是酶促反应的一项基本熟悉属性
米氏常数的求法,双倒数作图法
可以将米氏方程的形式加以改变,将方程两边同时取倒数,使方 程变成y=ax+b的直线方程
米氏常数K,m的意义
由米氏方程可知,当反应速度等于最大反应速度的一半时,即
适合条件下,酶促反应速率最大,在不同的pH条件下,酶的活性
中心与底物之间形成氢键的能力和方向不同,其结果是影响了 酶——底物过渡态的形成和稳定程度,从而对酶的活性产物影响。
pH对于不同的酶也不一样
E-S复合物的形成的速率和酶与底物的性质有关。 3、当反应速率等于最大速率一半时,即V=0. 酶促反应的速率和影响因素 温度对酶促反应速率的影响有俩个方面 酶促反应的速率和影响因素 反应速率与底物浓度成正比; Leonor Michaelis (1875-1949) Maud Menten (1879-1960 反应速率与底物浓度成正比; 反应速率不再增加,达最大速率; 酶促反应的速率和影响因素 酶促反应的速率和影响因素 动物 最适温度=35度-40度 pH对于不同的酶也不一样 少数酶特殊,如液化淀粉酶 的最适温度为90度 由米氏方程可知,当反应速度等于最大反应速度的一半时,即 适合条件下,酶促反应速率最大,在不同的pH条件下,酶的活性中心与底物之间形成氢键的能力和方向不同,其结果是影响了酶——底物过渡态的形成和稳定程度,从而对酶的活 性产物影响。 医学上,实验室中高温消毒,高温使酶蛋白变性 1931年,德国化学家Michaelist和Menten根据中间产物学说对酶促反应的动力学进行研究,推导出了整个反应中的底物浓度和反应速度关系著名公式,即米氏方程
影响酶促反应的因素——温度,ph,激活剂及抑制剂,生化实验报告(共8篇)

影响酶促反应的因素——温度,ph,激活剂及抑制剂,生化实验报告(共8篇) 影响酶促反应速度的因素生化实验实验二影响酶促反应速度的因素【目的】观察温度、PH、激活剂、抑制剂对酶促反应速度的影响。
【原理】唾液淀粉酶催化淀粉水解,生成一系列水解产物,即糊精、麦芽糖和葡萄糖等。
淀粉及其水解产物遇碘会呈现不同的颜色。
在不同温度,不同PH值下,唾液淀粉酶活性不同,催化淀粉水解程度不一,生成的产物也就不同。
此外,激活剂、抑制剂也能影响淀粉酶活性,影响淀粉的水解。
因此可根据在不同反应条件下,溶液加碘呈现的不同颜色来判断淀粉的水解程度,从而验证了温度、pH、激活剂、抑制剂对酶促反应速度的影响。
淀粉I2 【操作】1. 温度对酶促反应速度的影响取3支试管,编号,按下表操作:2. PH对酶促反应速度的影响取3支试管,编号,按下表操作:3.激活剂与抑制剂对酶促反应速度的影响取4支试管,编号,按下表操作:【结果及分析】观察各管颜色变化,说明温度、pH、激活剂、抑制剂对酶促反应的影响。
【实验注意事项】篇二:生化实验思考题参考答案生化实验讲义思考题参考答案实验一淀粉的提取和水解1、实验材料的选择依据是什么?答:生化实验的材料选择原则是含量高、来源丰富、制备工艺简单、成本低。
从科研工作的角度选材,还应当注意具体的情况,如植物的季节性、地理位置和生长环境等,动物材料要注意其年龄、性别、营养状况、遗传素质和生理状态等,微生物材料要注意菌种的代数和培养基成分的差异等。
2、材料的破碎方法有哪些?答:(1) 机械的方法:包括研磨法、组织捣碎法;(2) 物理法:包括冻融法、超声波处理法、压榨法、冷然交替法等;(3) 化学与生物化学方法:包括溶胀法、酶解法、有机溶剂处理法等。
实验二总糖与还原糖的测定1、碱性铜试剂法测定还原糖是直接滴定还是间接滴定?两种滴定方法各有何优缺点?答: 我们采用的是碱性铜试剂法中的间接法测定还原糖的含量。
间接法的优点是操作简便、反应条件温和,缺点是在生成单质碘和转移反应产物的过程中容易引入误差;直接法的优点是反应原理直观易懂,缺点是操作较复杂,条件剧烈,不易控制。
酶促反应的速率和影响因素

初二生物酶促反应速率影响因素

初二生物酶促反应速率影响因素生物酶是一类特殊的蛋白质分子,在生物体内起着催化生化反应的作用。
酶催化反应的速率受到多种因素的影响,这些因素包括温度、酶浓度、底物浓度、pH值和抑制剂等。
本文将会讨论这些因素对酶促反应速率的影响,帮助我们更好地理解生物酶的特性和应用。
一、温度的影响温度是影响酶催化反应速率最重要的因素之一。
在适宜的温度范围内,酶活性达到最大值。
当温度升高到一定程度时,酶分子与底物之间的相互作用受到破坏,失去了酶活性,反应速率开始下降。
这是因为高温会引起酶分子的变性,使其构象发生改变,无法与底物结合形成酶底物复合物。
另一方面,低温会减缓酶催化反应速率,因为低温下分子活动减弱,酶与底物的碰撞频率降低。
综上所述,酶催化反应速率受到温度的影响,过高或过低的温度都会使反应速率降低。
二、酶浓度的影响酶浓度是影响酶催化反应速率的另一个重要因素。
在底物浓度相对较高的情况下,增加酶的浓度可以提高反应速率。
这是因为酶浓度的增加可以增加酶与底物之间的碰撞频率,增加反应速率。
然而,当酶浓度达到一定值后,继续提高酶浓度对反应速率的影响就不大了,因为底物浓度成为限制酶反应速率的因素。
当底物浓度过低时,增加酶浓度也能提高反应速率。
三、底物浓度的影响底物浓度是影响酶催化反应速率的关键因素之一。
在酶浓度相对较高的情况下,增加底物浓度可以提高反应速率。
这是因为底物浓度的增加可以增加酶与底物之间的碰撞频率,增加反应速率。
然而,当底物浓度达到酶的饱和点后,继续增加底物浓度对反应速率的影响就不大了,因为酶的活性已经达到最大。
在酶饱和的情况下,增加底物浓度不会再提高反应速率。
四、pH值的影响pH值是影响酶催化反应速率的一个重要因素。
酶的活性受到pH值的影响,每种酶都有一个最适pH值,处于最适pH值时,酶催化反应速率最高。
当pH值偏离最适pH值时,酶的活性会下降。
这是因为酶的酸碱性质受到pH值的影响,因而构象发生改变,无法与底物结合形成酶底物复合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 另外,过酸、过碱或者温度过高都会 导致酶变性失活,且失去活性是永久 的、不可逆的。酶的本质就是蛋白质, 就好像煮鸡蛋一样,变质后凝固的蛋 白质再也回不到液态。
• 因低温而导致的酶活性下降在温度上 升以后又会使酶的活性恢复。故酶制 剂可以在低温的环境下保存。
D.该实验的pH应控制在该淀粉酶作用的最适pH条件下
影响酶酶促反应的影响因素
• 温度 • PH • 激活剂 • 抑制剂 • 底物浓度 • 酶浓度
通过影响酶活性而影响反应 直接影响酶促反应
一、温度对酶促反应的影响
每种酶都有自己适合的温度 • 动物:35---40 ℃ • 植物: 40--50 ℃ • 细菌、真菌差别较大,有的酶最适温度可高达70℃
酶促反应的影响因素
杨振龙 2014ห้องสมุดไป่ตู้9月5日
酶的本质
酶的特性
上节课小结
产生部位 活细胞(不包括成熟的红细胞)
化学本质 合成原料 合成场所 功能
绝大多数是蛋白质,少数是RNA 氨基酸或核糖核苷酸 核糖体或细胞核 生物催化作用
作用场所 细胞内外均可
(1)酶具有高效性 (2)酶具有专一性 (3)酶的作用条件较温和
酶是蛋白质,高于最适温度后,蛋 白质结构发生不可逆的改变,活性 下降;当温度再下降到最适温度时, 酶活性受温度影响示意图 活性不能恢复。
0⁰C左右酶活性很低,但结构稳定,因此酶制剂适于在0--4度下保存
应用实例
• 加酶洗衣服等用热水的效果要比用冷水好。 • 人在发烧的时候食欲下降,亦是身体里一些酶的作用。
乙酶被降解的过程中其分子结构会发生 改变,从而使其活性丧失。
2.(2013·临沂一模)下图为酶催化作用的模型。下列叙述正
确的是
( )。
A
A.该模型能很好地解释酶的专一性 B.该模型反映了酶可降低反应的活化能 C.该模型中生理过程表示脱水缩合 D.人成熟的红细胞内不能合成酶,也无上述模型
表示的生理过程
酶的最适温度
在一定条件下,一种酶在某一特定的温度时,其活性最 大,该温度称为该酶的最适温度。酶的最适温度不是一 个固定不变的常数。其数值受酶工作的时间、底物种类、 浓度、缓冲液种类等的影响。
在一定范围内,酶促反应速率随 着温度的升高而加快;
在达到最适温度以前,反应速度 随温度升高而加快
在达到最适温度以后,反应速度 随温度升高而下降
解析 由图可知,酶的竞争性抑制剂结构与 底物相似,与底物“争夺”酶的结合位点, 当底物足够多时,反应速率仍然可以加快; 非竞争性抑制剂改变了酶的结构,使酶的 催化能力降低,即使增加底物,其反应速 率仍然较低。
C
小结
• 酶的浓度和底物浓度对酶的活性的影 响与温度和PH对酶活性的影响不同。 温度和PH对酶的影响主要是改变酶的 内在性质。而改变酶的浓度和底物浓 度只是增加了酶和底物的接触面积, 从而改变了反应的速率,并不影响酶 的活性。
C.最适温度为T,最适pH为X
D.酶活性受温度影响,但不受
pH影响
C
5.下表是某同学为验证酶的专一性而设计的实验方案,a~d表示4
支试管,①~⑦表示实验步骤。对该实验方案的有关评价,错误
的是
a
b
c
d
蔗糖溶液2 ① 淀粉溶液
mL
唾液淀粉酶溶液2 mL
唾液淀粉酶溶液2 mL
②
37 ℃温水中水浴加热10 min
• 特别提醒 酶与无机催化剂的相同之处:
•
(1)化学反应前后数量和性质不变。
•
(2)加快化学反应的速度,缩短达到化学平衡的时间,
但不能改变平衡点。
•
(3)都能降低化学反应的活化能。
思维激活 1;甲、乙两种酶用同一种蛋白酶处理, 酶活性与处理时间的关系如右图所 示,请思考: (1)甲、乙两种酶的化学本质是否相 同?出现此结果表明酶具哪种特性? (2)乙酶活性改变的机制是什么?
底物不同,酶量属于无关变量,A项正确;不能将斐林试 剂改为碘液,因为其一碘液无法检测蔗糖,其二碘液只能 证明淀粉的存在,对淀粉没有被水解和淀粉未完全水解的 检测结果不容易区分,B项错误;⑥处的温度应为50~65 ℃,C项正确;第②步操作省略不影响实验结果,D项正确。 • 答案 B
6.下表是探究温度对淀粉酶活性影响的实验设计及结果。
三、底物浓度对酶活性的影响
• 酶浓度一定时,在底物浓度较低时,酶促反应速率随底物 浓度的增加而急剧加快,这时二者成正相关。但当底物浓 度达到某一定值时后,再增加底物浓度,反应速率 不再
变化。原因是受酶数量的限制。
酶 促
酶的浓度一定
反
应
速
率
底物浓度
四、酶浓度对其活性的影响
酶
底物足够
促
反
应
速
率
酶的浓度
例:酶抑制剂分竞争性抑制剂和非竞争性抑制剂,两者作用特
点如图甲所示,图乙表示相应的反应速率。下列有关叙述不正
确的是
答案 C
A.曲线a表示没有酶抑制剂存在时的作用效果 B.曲线a、b反应速率不再增加是受酶浓度的限制 C.曲线c表示在竞争性抑制剂作用下酶的活性降低
D.非竞争性抑制剂与该酶结合后能改变其空间结构
3.以下各种酶与其作用部位相匹配的是
B
A.淀粉酶——肽键
B.ATP水解酶——高能磷酸键
C.限制酶——氢键
D.解旋酶——磷酸二酯键
关于酶的实验
1.(2013·江苏改编)为了探究温度、pH对酶活性的影响,
下列实验设计合理的是
B
实验编号
探究课题
选用材料与试剂
过氧化氢溶液、新鲜的
①
温度对酶活性的影响
③
将c倒入a,将d倒入b
④
37 ℃温水中水浴加热10 min
⑤
加入现配的斐林试剂溶液2 mL
⑥
37 ℃恒温水浴2 min
⑦
观察并记录颜色变化
A.加入的唾液淀粉酶的量属于无关变量
B.应将斐林试剂改为碘液
C.②④⑥的温度设置有一处错误
D.第②步操作可以省略 • 解析 考查与酶有关的实验设计。此实验的自变量是所加
1、酶对激活剂有一定的选择性,一种酶的激 活剂对另一种酶来说可能是抑制剂。
2、有一定的浓度要求,当激活剂的浓度超过 一定的范围时,它就成为抑制剂。
1、竞争性抑制:底物与抑制剂竞争性的与酶活性中 心的同一部位结合,增加底物浓度可减少抑制剂 的作用。
2、非竞争性抑制剂:此类抑制剂与酶结合与底物不在同一位 点,抑制剂可以和酶和酶与底物的复合物结合。
酶浓度影响其活性示意图
• 在底物充足, 其他条件适宜的 条件下,酶促反 应速率与酶浓度 成正比。
五、酶活剂对酶反应速率的影响
• 能使酶活性提高的物质,都称为激活剂(activator),
其中大部分是离子或简单的有机化合物。如Mg++
是多种激酶和合成酶的激活剂,动物唾液中的α-
淀粉酶则受Cl-的激活。 特点:
试管
①
②
③
淀粉溶液/mL
2
2
2
淀粉酶溶液/mL
1
1
1
反应温度/℃
30
40
50
碘液/mL
2
2
2
蓝色深浅
++
+
+++
注:“+”的多少代表颜色深浅。
根据以上实验设计及结果,以下说法不正确的是
B
A.该实验的自变量是温度
B.根据实验结果可知该淀粉酶的最适温度是40 ℃
C.该实验是通过检测淀粉的剩余量来确定温度对酶活性的影响的
A.本实验的因变量是不同的催化剂 B.本实验的无关变量有温度和酶的用量等
答案 C
C.1号与3号,1号与4号可分别构成对照实验
D.分析1号、2号试管的实验结果可知加热能降低反应的活化
能
3.欲测定某种酶的催化反应速率,人们设计了如下几种方案,
其中最可行的是
答案 B
A.其他条件最适,改变温度,观察反应生成物的量
过酸或过碱酶都会破坏酶分子的 空间结构,使酶永久失去活性, 且不可恢复。
0
最适pH
pH
酶活性受PH影响示意
图
例:如下图表示某反应物剩余量随pH及温度的变化情况,正确 的是
C
A.该酶的最适温度是37℃ B.随着pH的升高,酶的活性先降低后升高 C.随着温度的升高,酶的最适pH不变 D.随着温度的升高,酶的活性逐渐降低
B.其他条件最适,改变反应时间,观察反应生成物的量
C.其他条件最适,改变酶的浓度,观察反应生成物的量
D.其他条件最适,改变反应物的浓度,观察反应生成物的量
重要概念:酶活性 酶活性的表示方法 P83
4.小张进行“酶活性的影响因素”实验,结果如下图,分析 正确的是
A.随温度升高,酶活性不断上升
B.随pH下降,酶活性不断升高
B
二、PH对酶活性的影响
最适PH
• 酶促反应速率最快时的环境pH称为该酶促反应的最适pH。
教材P85;注意几个最适PH
• 每一一般种地酶,只动能物在体一内定的限. 度的PH
范围内才有活性,其中酶活性最 高时的PH,即为该酶的最适PH。 高于或低于最适pH值酶的活性 都会降低。
υ/mmol. s-1
肝脏研磨液
新制的淀粉酶溶液、可溶
②
温度对酶活性的影响
性淀粉溶液、碘液
新制的蔗糖酶溶液、可溶
③
pH对酶活性的影响
性淀粉溶液、碘液
新制的淀粉酶溶液、可溶性淀
④
pH对酶活性的影响
粉溶液、斐林试剂
A.实验① B.实验② C.实验③ D.实验④
2.(2013·广州调研)下图表示“比较过氧化氢在不同条件下的 分解”实验。有关分析合理的是
