大学物理第6张-讲义
大学物理第6章-光的衍射

E
(4)
6.5 夫琅禾费单缝衍射 (Diffraction by single slit ) 6.5.1 夫琅禾费单缝衍射装置 1.衍射光线: 平行光线 P点明暗取决于单缝处波 阵面上所有子波发出的 平行光线到达 P点的振动 的相干叠加。 2.衍射角 : 衍射光线与单 缝平面法线方向的夹角。
d
光栅衍射光强分布 缺 级
-5 -4 -2 -1 0 1
d
sin
sin
2
4
5
(30)
2.明纹条件
缝平面 透镜L
x
P
x
P点的光强分布主要由 相邻二单缝产生的衍射 光的光程差决定。
d
o
f
相邻二单缝衍射光的光程差:
d sin
观察屏
(a b) sin
d si n 2k
光的衍射(绕射) (Diffraction of Light)
光在传播过程中能绕过 障碍物边缘,偏离直线传 播的现象称为衍射。
6.4 光的衍射 ( diffraction of light ) 6.4.1 光的衍射现象
透镜 观察屏 P 透镜
观察屏
P
o
圆孔
f 观察屏
o
单狭缝
f
观察屏
* s
小圆孔
o 小圆板
B
四个半波带
C
AC 4
A
AC 3 2
2
2
2
2.衍射条纹分析
a sin 2k k=1,2,...暗 2 a sin (2k 1) k=1,2,...明 2
大学物理第六章92页PPT

+
+
r
作高斯面: QE0
rr
q
++ +
S+
++
Ñ EdS 0
S
0
q 0
2. 导体表面附近电场强度大小与导
体表面电荷面密度成正比。
+
+
作钱币形
E 高斯面
+ + + +S + +
Ñ SEdSS/0
ESS/0
E
0
+ + +
E0
二、孤立导体的形状对电荷分布的影响 尖端放电现象
导体表面电荷分布与导体形状有关
1. 空腔内表面上处处无电荷,电荷只能分布在外表面。
2. 空腔无电场,腔内是等势区。
A
S++
B--
疑问:内表面上有电荷吗?
rr
Ñ SE d S0, qi0
矛盾
若内表面带电 ABA BE vdlv0导体是等势体
二、导体空腔内部有带电体的情况
1. 空腔内表面上带电,所带感应电荷与空腔内带电体的
电荷等值异号。
§6.1 静电场中的导体
导体和电介质
导体:导电性能良好的物体,如金属、人体、大地
绝缘体:导电性能很差的物体,又称电介质
半导体:介于导体和绝缘体之间
自由电子
超导体:基本无电阻
构成导体框架、形状、大小的是那些基本不动的带正 电荷的原子实,而自由电子充满整个导体属公有化。
当有外电场或给导体充电,在场与导体的相互作用 的过程中,自由电子的重新分布起决定性作用。
带电导体尖端附近的电场特别 大,可使尖端附近的空气发生 电离而成为导体产生放电现象
大一上物理课件 第六章

第六章 磁场通过复习后,应该:1.掌握磁感应强度、毕奥-萨伐尔定律、洛伦兹力、霍尔效应、安培力、磁场对载流线圈的作用、物质的磁性和磁化、电磁感应定律;2.理解几种电流的磁场、安培环路定理、质谱仪、超导体及其抗磁性、感生电动势、自感现象;3.了解磁场中的高斯定理、电磁流量计、超导磁体、人体生物磁场、涡旋电场。
6-1 一个半径为0.2m 、阻值为200Ω的圆形电流回路,接12V 的电压,求回路中心处的磁感应强度。
解: 已知半径r =0.2m ,电源电压U =12V ,圆形回路的电阻R =200Ω,根据欧姆定律,可求得回路的电流为I =U / R =12/200 A=0.06 A由圆形电流磁场公式,可得回路中心处的磁感应强度为T 10881T 2020601042770--⨯=⨯⨯⨯==...r IB πμ6-2 一根长直导线上载有电流100A ,把它放在50G 的均匀外磁场之中,并使导线与外磁场正交,试确定合成磁场为零的点到导线的距离。
解: 长直载流导线产生的磁场,其磁感线是一些围绕导线的同心圆,在导线周围总有一点A ,其磁感强度与外磁场的磁感应强度大小相等、方向相反,该点的合磁场为零。
已知I =100A ,B = 50G = 5.0×10-3 T ,根据长直载流导线磁场公式aI B πμ20=,可得A 点离导线的距离a 为mm 04m 1004m 1005210010423370...B I a =⨯=⨯⨯⨯⨯==---πππμ6-3 0.4m 长的细管上绕有100匝导线,其电阻为3.14Ω,欲在螺线管内获得200G 的磁感应强度,需外加电压多少伏?解: 已知螺线管单位长度上的线圈匝数n =100/0.4=250匝·米-1,B =200G =2×10-2 T ,根据螺线管电流磁场公式B = μ0nI ,可得螺线管通过的电流为A 763A 102A 2501041022720.nB I ≈⨯=⨯⨯⨯==--ππμ 已知线圈电阻R =3.14Ω,根据欧姆定律可计算出需加的外电压为U =IR =2/π×102×3.14V=200V6-4 一平面上有两个同心的圆形回路,用相同电动势的电池(内阻忽略不计),通过相反方向的电流,使在中心处产生的磁感应强度为零,已知外圆用铜线,其电阻率为1.7×10-6Ω·cm ,内圆用铝线,电阻率为2.8×10-6Ω·cm ,这些导线的截面积相同,外圆直径为200cm ,求内圆的直径。
大学物理实验讲义实验液晶电光效应实验

实验14 液晶电光效应实验液晶是介于液体与晶体之间的一种物质状态。
一般的液体内部分子排列是无序的,而液晶既具有液体的流动性,其分子又按一定规律有序排列,使它呈现晶体的特性。
当光通过液晶时,会产生偏振面旋转,双折射等效应。
液晶分子是含有极性基团的极性分子,在电场作用下,偶极子会按电场方向取向,导致分子原有的排列方式发生变化,从而液晶的光学性质也随之发生改变,这种因外电场引起的液晶光学性质的改变称为液晶的电光效应。
1888年,奥地利植物学家Reinitzer在做有机物溶解实验时,在一定的温度范围内观察到液晶。
1961年美国RCA公司的Heimeier发现了液晶的一系列电光效应,并制成了显示器件。
从70年代开始,日本公司将液晶与集成电路技术结合,制成了一系列的液晶显示器件,至今在这一领域保持领先地位。
液晶显示器件由于具有驱动电压低(一般为几伏),功耗极小,体积小,寿命长,无辐射等优点,在当今各种显示器件的竞争中有独领风骚之势。
【实验目的】1.在学习液晶光开关的基本原理,测量液晶光开关的电光特性曲线,并由电光特性曲线得到液晶的阈值电压和关断电压。
2.测量驱动电压周期变化时,液晶光开关的时间响应曲线,并由时间响应曲线得到液晶的上升时间和下降时间。
3.测量液晶光开关的视角特性。
4.了解液晶光开关构成矩阵式图像显示的原理。
【仪器用具】ZKY-LCDEO型液晶光开关电光特性综合实验仪、数字示波器【实验原理】1.液晶光开关的工作原理液晶的种类很多,仅以常用的扭曲向列型液晶为例,说明其工作原理。
光开关的结构如图1所示。
在两块玻璃板之间夹有液晶,液晶分子的形状如同火柴一样,为棍状。
棍的长度在十几埃,直径为4~6埃,液晶层厚度一般为5-8微米。
玻璃板的内表面涂有透明电极,电极的表面预先作了定向处理(可用软绒布朝一个方向摩擦),这样,液晶分子在透明电极表面就会躺倒在摩擦所形成的微沟槽里;电极表面的液晶分子按一定方向排列,且上下电极上的定向方向相互垂直。
大学物理1-6章课后习题答案1

二、课后习题解答1-1、一飞轮直径为0.2m ,质量为5.00kg ,t 边缘饶一轻绳,现用恒力拉绳子的一端,使其有静止均匀地加速,经0.50s 转速达10转/s 。
假定飞轮可看作实心圆柱体。
求; 飞轮的角加速度及在这段时间转过的转数 拉力及拉力所做的功从拉动后t=10s 时飞轮的角速度及边缘上一点的速度和切向加速度及发向速度。
解:,/1058.1,/6.12,/126,/1026.1)3(3.4921212125232202s m r a s m r a s m r v s t J J J J A t n t t z z z ⨯======⨯====-=ωβωβωωωωτ1-2、有一根长为l 、质量为m 的匀质细杆,两端各牢固的连接一个质量为m 的小球,整个系统可绕一过O 点并垂直于杆的水平轴无摩察的转动,如图。
当系统转到水平位置时,求: 系统所受的和力矩 系统的转动惯量 系统的角加速度解: (1)设垂直纸面向里为z 轴的正方向(即力矩的正方向),合力矩为两小球及杆的重力矩之和。
mgl M M M M lmg r g dr rg rgdm M l mlmg M lmg M F r M z z zz l l l l z zzz 4341243,4190,4/34/24/34/0=+'+'=∴======'-='=⨯=--⎰⎰杆右左杆右左杆所受重力矩:其中两小球所受重力矩:ρρρθ224/34/34/34/24/34/222483748731)41(,)43()2(ml J J J J ml r dr r dm r J l m J l m J z z zz l l l l l l z z z=+'+'=∴====='='---⎰⎰杆右左杆右左杆的转动惯量:两小球的转动惯量:转动惯量之和,小球的转动惯量和杆的系统的转动惯量等于两λλ(3)由转动定理lg J M J M z z z z 3736==⇒=ββ1-3、有一质量为m 1、 m 2(m 1>m 2)两物体分别悬挂在两个半径不同的组 合轮上,如图。
大学物理第6章 几何光学

(4) 与副光轴平行的光线,通过透镜后过副光轴与 焦平面的交点。
F
P
P
F P
P
F
F
(a) p 2f 成倒立缩小实像
( b) 0 p f 成正立放大虚像
F
P
P
P
F P
F
F
(c) f p 2 f 成倒立放大实像
(d) 实物经凹透镜成正 立缩小虚像
例[6-3] 一薄凸透镜的焦距为20cm,如果已知物距分别 为(1)40cm;(2)60cm;(3)30cm;(4)10cm。 试分别计算这四种情况下的像距,并确定成像性质。
n1 n2
r
n21称为第二种介质对第一种介质的相对折射率。
一种介质相对于真空的折射率
n c/v
称为绝对折射率,简称折射率。 折射率不仅与介质有关,还与光的频率有关。 两种介质相比,把折射率较大的介质称为光密介质, 折射率较小的介质称为光疏介质。 折射定律又写为
n1 sin i n2 sin r
p p'
p, p ' 分别为物距和像距
i
A
i'
6.2.2 平面折射成像 点光源发出的光经平面折射后,折射光的反向延长线 一般不会相交于同一点,平面折射将破坏光束的同心 性,不能成“完善”的像,这种现象称为像散。 水面上沿着法线方向观看水中物体时,进入眼睛光线 的张角很小,根据折射定律和几何关系,在近似条件 下,可得 n
1 1 1 30 p 20
p' 60 m 2 p 30
(3) 由 由
得
p' 60cm
知:当 2 f p f 时,成放大倒立实像。
(4) 由 由
大学物理化学核心教程课后参考答案第6章

第六章相平衡一.基本要求1.掌握相平衡的一些基本概念,会熟练运用相律来判断系统的组分数、相数和自由度数;2.能看懂单组分系统的相图,理解相图中的点、线和面的含义及自由度,知道相图中两相平衡线的斜率是如何用Clapeyron方程和Clausius-Clapeyron方程确定的,了解三相点与凝固点的区别;3.能看懂二组分液态混合物的相图,会在两相区使用杠杆规则,了解蒸馏与精馏的原理,知道最低和最高恒沸混合物产生的原因;4.了解部分互溶双液系和完全不互溶双液系相图的特点,掌握水蒸汽蒸馏的原理;5.掌握如何用热分析法绘制相图,会分析低共熔相图上的相区、平衡线和特殊点所包含的相数、相的状态和自由度,会从相图上的任意点绘制冷却时的步冷曲线;了解二组分低共熔相图和水盐相图在湿法冶金、分离和提纯等方面的应用;6.了解生成稳定化合物、不稳定化合物和形成固溶体相图的特点,知道如何利用相图来提纯物质;二.把握学习要点的建议相律是本章的重要内容之一,不一定要详细了解相律的推导,而必须理解相律中各个物理量的意义以及如何求算组分数,并能熟练地运用相律;水的相图是最简单也是最基本的相图,要把图中的点、线、面的含义搞清楚,知道确定两相平衡线的斜率,学会进行自由度的分析,了解三相点与凝固点的区别,为以后看懂相图和分析相图打好基础;超临界流体目前是分离和反应领域中的一个研究热点,了解一些二氧化碳超临界流体在萃取方面的应用例子,可以扩展自己的知识面,提高学习兴趣;二组分理想液态混合物的相图是二组分系统中最基本的相图,要根据纵坐标是压力还是温度来确定气相区和液相区的位置,理解气相和液相组成为什么会随着压力或温度的改变而改变,了解各区的条件自由度在二组分相图上都是条件自由度,为以后看懂复杂的二组分相图打下基础;最高或最低恒沸混合物不是化合物,是混合物,这混合物与化合物的最根本的区别在于,恒沸混合物含有两种化合物的分子,恒沸点的温度会随着外压的改变而改变,而且两种分子在气相和液相中的比例也会随之而改变,即恒沸混合物的组成也会随着外压的改变而改变,这与化合物有本质的区别;杠杆规则可以在任何两相区使用,但也只能在两相区使用,在三相区和在三相平衡线上是不能使用杠杆规则的;从具有最高会溶温度的相图,要认清帽形区的特点,是两液相的平衡共存区,这对今后理解两个固溶体也会形成帽形区很有帮助;在学习用热分析法绘制二组分低共熔相图时,首先要理解在步冷曲线上为什么会出现转折点和水平线段,这一方面要从散热与释放出的凝固热进行补偿的角度理解,另一方面要从自由度的变化来理解;理解了步冷曲线上自由度的变化情况,对相图中的自由度就容易理解;要花较多的精力掌握简单的二组分低共熔相图,要进行相区、两相平衡线、三相平衡线和特殊点的自由度分析,这样今后就容易看懂和理解复杂相图,因为复杂相图一般是简单相图的组合;低共熔混合物到底有几个相这个问题初学时容易混淆,答案当然是两相,不过这是两种固体以微小的结晶均匀混合的物系,纵然在金相显微镜中看起来也很均匀,但小晶体都保留着原有固体的物理和化学性质,所以仍是两相;低共熔点的温度和组成都会随着外压的改变而改变,所以低共熔混合物也不是化合物;对于形成稳定化合物和不稳定化合物的相图,要抓住相图的特点,了解稳定化合物的熔点与不稳定化合物的转熔温度之间的差别,比较一般的三相线与不稳定化合物转熔时的三相线有何不同要注意表示液相组成点的位置有什么不同,这样在分析复杂相图时,很容易将稳定化合物和不稳定化合物区别开来;固溶体是固体溶液的简称,固溶体中的“溶”是溶液的“溶”,所以不要把“溶”字误写为“熔”字;既然固溶体是溶液的一种,实际是混合物的一种即固体混合物,所以固溶体是单相,它的组成线与液态溶液的组成线一样,组成会随着温度的改变而改变;在相图上,固溶体总是处在由两根曲线封闭的两相区的下面;在分析复杂相图,首先要能正确认出固溶体或帽形区的位置,则其他相区的分析就变得简单了;三.思考题参考答案1.硫氢化铵NH HS(s)的分解反应:①在真空容器中分解;②在充有一定4NH(g)的容器中分解,两种情况的独立组分数是否一样3答:两种独立组分数不一样;在①中,C =1;因为物种数S 为3,但有一个独立的化学平衡和一个浓度限制条件,所以组分数等于1;在②中,物种数S 仍为3,有一个独立的化学平衡,但是浓度限制条件被破坏了,两个生成物之间没有量的限制条件,所以独立组分数C =2;2.纯的碳酸钙固体在真空容器中分解,这时独立组分数为多少答: 碳酸钙固体的分解反应为 32CaCO (s)CaO(s)CO (g)+物种数为3,有一个平衡限制条件,但没有浓度限制条件;因为氧化钙与二氧化碳不处在同一个相,没有摩尔分数的加和等于1的限制条件,所以独立组分数为2;3.制水煤气时有三个平衡反应,求独立组分数C1 H 2Og+ Cs= H 2g+ COg2 CO 2g+ H 2g= H 2Og+ COg3 CO 2g+ Cs= 2COg答: 三个反应中共有5个物种,5S =;方程1可以用方程3减去2得到,因而只有2个独立的化学平衡,2R =;没有明确的浓度限制条件,所以独立组分数3C =;4.在抽空容器中,氯化铵的分解平衡,43NH Cl(s)NH (g)HCl(g)+;指出该系统的独立组分数、相数和自由度数答:反应中有三个物种,一个平衡限制条件,一个浓度限制条件,所以独立组分数为1,相数为2;根据相律,自由度为1;即分解温度和分解压力两者之中只有一个可以发生变化;5.在含有氨的容器中氯化铵固体分解达平衡,43NH Cl(s)NH (g)HCl(g)+;指出该系统的独立组分数、相数和自由度答: 反应中有三个物种,一个平衡限制条件,没有浓度限制条件;所以独立组分数为2,相数为2,自由度为2;6.碳和氧在一定条件下达成两种平衡,指出该系统的独立组分数、相数和自由度数;答:物种数为4,碳,氧,一氧化碳和二氧化碳,有两个化学平衡,无浓度限制条件,所以独立组分数为2,相数为2,自由度为2;7.水的三相点与冰点是否相同答:不相同;纯水的三相点是气-液-固三相共存,其温度和压力由水本身性质决定,这时的压力为 Pa,温度为 K ;热力学温标1 K就是取水的三相点温度的1/ K ;水的冰点是指在大气压力下,冰与水共存时的温度;由于冰点受外界压力影响,在 kPa压力下,冰点下降 K,由于水中溶解了空气,冰点又下降 K,所以在大气压力为 kPa 时,水的冰点为 K ;虽然两者之间只相差 K,但三相点与冰点的物理意义完全不同;8.沸点和恒沸点有何不同答:沸点是对纯液体而言的;在大气压力下,纯物质的液-气两相达到平衡,当液体的饱和蒸气压等于大气压力时,液体沸腾,这时的温度称为沸点;恒沸点是对二组分液相混合系统而言的,是指两个液相能完全互溶,但对Raoult定律发生偏差,当偏差很大,在p x-图上出现极大值或极小值时,则在T x-图上出现极小值或极大值,这时气相的组成与液相组成相同,这个温度称为最低或最高恒沸点,用简单蒸馏的方法不可能把二组分完全分开;这时,所对应的双液系统称为最低或最高恒沸混合物;在恒沸点时自由度为1,改变外压,恒沸点的数值也改变,恒沸混合物的组成也随之改变;当压力固定时,条件自由度为零,恒沸点的温度有定值;9.恒沸混合物是不是化合物答:不是;它是完全互溶的两个组分的混合物,是由两种不同的分子组成;在外压固定时,它有一定的沸点,这时气相的组成和液相组成完全相同;但是,当外部压力改变时,恒沸混合物的沸点和组成都会随之而改变;化合物的沸点虽然也会随着外压的改变而改变,但它的组成是不会改变的;10.在汞面上加了一层水能减少汞的蒸气压吗答:不能;因为水和汞是完全不互溶的两种液体,两者共存时,各组分的蒸气压与单独存在时的蒸气压一样,液面上的总压力等于纯水和纯汞的饱和蒸气压之和;如果要蒸馏汞的话,加了水可以使混合系统的沸点降低,这就是蒸气蒸馏的原理;所以,仅仅在汞面上加一层水,是不可能减少汞的蒸气压的,但是可以降低汞的蒸发速度;11.单组分系统的三相点与低共熔点有何异同点答:共同点:两者都是气-液-固三相共存;不同点:单组分系统的三相点是该组分纯的气、液、固三种相态平衡共存,这时的自由度等于零,它的压力、温度由系统自身的性质决定,不受外界因素的影响;而二组分系统在低共熔点如T-x图上的E点温度时,是纯的A固体、B固体和组成为E的熔液三相平衡共存,这时的自由度为1,在等压下的条件自由度等于零;E点的组成由A和B的性质决定,但E点的温度受压力影响,当外压改变时,E点的温度和组成也会随之而改变;12.低共熔混合物能不能看作是化合物答:不能;低共熔混合物不是化合物,它没有确定的熔点,当压力改变时,低共熔物的熔化温度和组成都会改变;虽然低共熔混合物在金相显微镜下看起来非常均匀,但它仍是两个固相微晶的混合物,由两个相组成;13.在实验中,常用冰与盐的混合物作为致冷剂;试解释,当把食盐放入0℃的冰-水平衡系统中时,为什么会自动降温降温的程度有否限制,为什么这种致冷系统最多有几相解: 当把食盐放入0℃的冰-水平衡系统中时,由于食盐与冰有一个低共熔点,使水的冰点降低,因此破坏了冰-水平衡,冰就要融化;融化过程中要吸热,系统的温度下降;降温有一定的限度,因为它是属于二组分系统的低共熔混合物,当温度降到低共熔点时,冰、食盐与溶液达到了平衡,系统的温度就不再下降;根据相律:2f C P =+-,组分数为2H O(l)和NaCl(s),2C =;当0f =时,最多相数4P =,即气相,溶液,冰和NaCls 四相共存;如果指定压力,则条件自由度等于零时,最多相数3P =,溶液,冰和NaCls 三相平衡共存;四.概念题参考答案1.4NH HS(s)与任意量的3NH (g)及2H S(g)达平衡时,有A C = 2,P = 2,f = 2BC = 1,P = 2,f = 1C C = 2,P = 3,f = 2D C = 3,P = 2,f = 3答:A;系统中有三个物种,一个平衡条件,由于已存在3NH (g)及2H S(g),就不存在浓度限制条件,所以组分数2C =;平衡共存时有固相和气相两个相,根据相律,自由度2f =;2.在大气压力下,3FeCl (s)与2H O(l)可以生成32FeCl 2H O(s),32FeCl 5H O(s),32FeCl 6H O(s)和32FeCl 7H O(s)四种固体水合物,则该平衡系统的组分数C 和能够平衡共存的最大相数P 为A 3, 3C P ==B 3, 4C P == C 2, 3C P ==D 3, 5C P == 答:C;这是二组分系统生成稳定化合物或稳定水合物的一个例子,3FeCl (s)与2H O(l)可以生成多种水合物,但它还是二组分系统,所以组分数必定等于2;不能把生成的稳定水合物也看作是组分;如果要写出生成水合物的多个平衡方程式,则多一个水合物物种,也多一个化学平衡方程,所以组分数是不会改变的;根据组分数等于2这一点,就可以决定选C;根据相律,当自由度等于零时,能得到平衡共存的最大相数;则20f C P =+-=,理论上最大相数似乎应等于4,但是题目已标明是在大气压力下,用*13f C P P =+-=-,所以能见到的平衡共存的最大相数只有3个;如果题目不标明是在大气压力下,由于凝聚相系统受压力影响极小,也应该看作是在等压条件下进行的,能见到的平衡共存的最大相数只能是3个;3.在 100 kPa 的压力下,2I (s)在2H O(l)和4CCl (l)两个完全不互溶的液相系统中达分配平衡;设平衡时2I (s)已不存在,则该系统的组分数和自由度数分别为A *2, 1C f ==B *2, 2C f == C *3, 2C f ==D *3, 3C f == 答:C;该系统中显然有2I (s),2H O(l)和4CCl (l)三个物种,3S =,但无化学平衡,0R =,也无浓度限制条件,'0R =不要把2I 在两相中的分配平衡看作是浓度关系式,因为在推导分配常数时已用到了2I 在两相中化学势相等的条件,所以组分数3C =;由于是两相平衡,又指定了压力,所以条件自由度*13122f C P =+-=+-=;4.4CuSO 与水可生成42CuSO H O ⋅,42CuSO 3H O ⋅和42CuSO 5H O ⋅三种水合物,则在一定温度下与水蒸气达平衡的含水盐最多为A 3种B 2种C 1种D 不可能有共存的含水盐答:B;系统的组分数为2,已指定温度,根据相律,条件自由度等于零时,可得最多可以共存的相数,*1210f C P P =+-=+-=,最多可以三相共存;现在已指定有水蒸气存在,所以,可以共存的含水盐只可能有2种;5.某一物质X,在三相点时的温度是20℃,压力是200 kPa;下列哪一种说法是不正确的A 在20℃以上,X 能以液体存在B 在20℃以下,X 能以固体存在C 在25℃和100 kPa 下,液体X 是稳定的D 在20℃时,液体X 和固体X 具有相同的蒸气压答:C;可以画一张单组分系统相图的草图,C 所描述的条件只能落在气相区,所以这种说法是不正确的;6.2N 的临界温度是124 K,如果想要液化2N (g),就必须A 在恒温下增加压力B 在恒温下降低压力C 在恒压下升高温度D 在恒压下降低温度答:D;临界温度是指在这个温度之上,不能用加压的方法使气体液化,所以只有在恒压下用降低温度的方法使之液化;7.当Clausius-Clapeyron 方程应用于凝聚相转变为蒸气时,则A p 必随T 之升高而降低B p 必不随T 而变C p必随T之升高而变大D p随T之升高可变大也可减少答:C; 因为凝聚相转变为蒸气时总是吸热的,根据Clausius-Clapeyron方程,等式右方为正值,等式左方也必定为正值,所以p随T之升高而变大;8.对于恒沸混合物的描述,下列各种叙述中不正确的是A 与化合物一样,具有确定的组成B 不具有确定的组成C 平衡时,气相和液相的组成相同D 恒沸点随外压的改变而改变答:A;恒沸混合物不是化合物,不具有确定的组成,其恒沸点和组成都会随着外压的改变而改变;9.对于二组分气—液平衡系统,哪一个可以用蒸馏或精馏的方法将两个组分分离成纯组分A接近于理想的液体混合物B对Raoult定律产生最大正偏差的双液系C对Raoult定律产生最大负偏差的双液系 D部分互溶的双液系答:A;完全互溶的理想双液系,或对Raoult定律发生较小正负偏差的都可以用蒸馏或精馏的方法将其分开,两者的沸点差别越大,分离越容易;而对Raoult定律产生最大正负偏差的双液系,气-液两相区分成两个分支,形成了最低或最高恒沸混合物,用蒸馏方法只能得到一个纯组分和一个恒沸混合物;部分互溶的双液系首先要将两个液层分离,然后视具体情况而决定分离两个互溶部分的液相,或采用萃取的方法,单用蒸馏方法是不行的;10.某一固体,在25℃和大气压力下升华,这意味着A 固体比液体密度大些B 三相点的压力大于大气压力C 固体比液体密度小些D 三相点的压力小于大气压力答:B;画一单组分系统相图的草图,当三相点的压力大于大气压力时,在25℃和大气压力下处于气相区,所以固体会升华;2CO 的相图就属于这一类型;11.在相图上,当系统处于下列哪一点时,只存在一个相A 恒沸点B 熔点C 临界点D 低共熔点答:C;在临界点时,气-液界面消失,只有一个相;其余三个点是两相或三相共存;12.在水的三相点附近,其摩尔气化焓和摩尔熔化焓分别为144.82 kJ mol -⋅和15.99 kJ mol -⋅;则在三相点附近,冰的摩尔升华焓为 A 138.83 kJ mol -⋅ B 150.81 kJ mol -⋅C 138.83 kJ mol --⋅D 150.81 kJ mol --⋅答:B;摩尔升华焓等于摩尔气化焓与摩尔熔化焓之和;13.某反应系统中共有的物种为Ni(s),NiO(s),2H O(l),2H (g),CO(g)和2CO (g),它们之间可以达成如下三个化学平衡1 ,12NiO(s)CO(g)Ni(s)CO (g)p K ++ 2 ,2222H O(l)CO(g)H (g)CO (g)p K ++ 3 ,322NiO(s)H (g)Ni(s)H O(l)p K ++该反应的组分数C 和平衡常数之间的关系为A ,1,2,33, p p p C K K K ==B ,3,1,24, /p p pC K K K == C ,3,1,23, /p p p C K K K ==D ,3,2,14, /p p p C K K K ==答:B;这个系统有6个物种,在三个化学平衡中只有2个是独立的,没有其他限制条件,所以组分数4C =;因为(1)(2)(3)-=,方程式的加减关系,反应的Gibbs 自由能也是加减关系,而平衡常数之间则是乘除关系,所以,3,1,2/p p p K K K =;14.将纯的2H O(l)放入抽空、密闭的石英容器中,不断加热容器,可以观察到哪种现象A 沸腾现象B 三相共存现象C 升华现象D 临界现象 答:D;在单组分系统的相图上,是该系统自身的压力和温度,就象该实验所示;实验不是在外压下进行的,系统中也没有空气,所以不可能有沸腾现象出现;在加热过程中,水的气、液两种相态一直处于平衡状态,即22H O(l)H O(g);随着温度的升高,2H O(l)的密度不断降低,而水的蒸气压不断升高,致使2H O(g)的密度变大,当2H O(l)和2H O(g)的两种相态的密度相等时,气-液界面消失,这就是临界状态;15.Na 2CO 3和水可形成三种水合盐:Na 2CO 3·H 2O 、Na 2CO 3·7H 2O 和NaCO 3·10H 2O;在常压下,将Na 2CO 3投入冰-水混合物中达三相平衡时,若一相是冰,一相是Na 2CO 3水溶液,则另一相是A Na 2CO 3B Na 2CO 3·H 2OC Na 2CO 3·7H 2OD Na 2CO 3·10H 2O答:D;画一张草图,NaCO 3·10H 2O 的含水量最多,一定最靠近表示纯水的坐标一边;五.习题解析1.将2N (g),2H (g)和3NH (g)三种气体,输入773 K,73.210 kPa ⨯的放有催化剂的合成塔中;指出下列三种情况系统的独立组分数设催化剂不属于组分数1 2N (g),2H (g)和3NH (g)三种气体在输入合成塔之前;2 三种气体在塔内反应达平衡时;3 开始只输入3NH (g),合成塔中无其它气体,待其反应达平衡后;解: 1 进入合成塔之前,三种气体没有发生反应,故组分数3C =;2在塔内反应达平衡时,系统的物种数3S =,但有一个化学平衡条件,故2C =; 3开始只输入3NH (g),3NH (g)分解达平衡,系统的物种数3S =,但有一个化学平衡条件和一个浓度限制条件,故1C =;2.指出下列平衡系统中的物种数,组分数,相数和自由度数;1 CaSO 4的饱和水溶液;2 将5g3NH (g)通入1 dm 3水中,在常温下与蒸气平衡共存;解:1物种数2S =,4CaSO (s)和2H O(l);组分数2C =,相数2P =;根据相律,22f C P =+-=;这两个自由度是指温度和压力,即在一定的温度和压力的范围内,能保持固、液两相平衡不发生变化;2 因为3NH (g)与水会发生相互作用,生成32NH H O ⋅,所以物种数3S =,3NH (g),2H O(l)和32NH H O ⋅;有一个形成一水合氨的平衡,故1R =,所以2C =;有气、液两相,2P =;根据相律,22f C P =+-=;这两个自由度是指温度和压力,即在一定的温度和压力的范围内,能维持固、气两相平衡的状态不发生变化;3.3CaCO (s)在高温下分解为CaO(s)和2CO (g),根据相律解释下述实验事实; 1 在一定压力的2CO (g)中,将3CaCO (s)加热,实验证明在加热过程中,在一定的温度范围内3CaCO (s)不会分解;2 在3CaCO (s)的分解过程中,若保持2CO (g)的压力恒定,实验证明达分解平衡时,温度有定值;解:1 该系统中有两个物种,2CO (g)和3CaCO (s),所以物种数2S =;在没有发生反应时,组分数2C =;现在是一个固相和一个气相两相共存,2P =;当2CO (g)的压力有定值时,根据相律,条件自由度*12121f C P =+-=+-=;这个自由度就是温度,即在一定的温度范围内,可维持两相平衡共存不变,所以3CaCO (s)不会分解; 2该系统有三个物种,2CO (g),3CaCO (s)和CaO(s),所以物种数3S =;有一个化学平衡,1R =;没有浓度限制条件,因为产物不在同一个相,故2C =;现在有三相共存两个固相和一个气相,3P =;若保持2CO (g)的压力恒定,条件自由度*12130f C P =+-=+-=;也就是说,在保持2CO (g)的压力恒定时,温度不能发生变化,即3CaCO (s)的分解温度有定值;4.已知固体苯的蒸气压在273 K 时为 k Pa,293 K 时为 k Pa ;液体苯的蒸气压在293 K 时为 k Pa,液体苯的摩尔气化焓为1vap m 34.17 kJ mol H -∆=⋅;试计算1 在303 K 时液体苯的蒸气压,设摩尔气化焓在这个温度区间内是常数;2 苯的摩尔升华焓;3 苯的摩尔熔化焓;解:1 用Clausius-Clapeyron 方程,求出液态苯在303 K 时的蒸气压 解得液体苯在303 K 时的蒸气压2用Clausius-Clapeyron 方程,求出固体苯的摩尔升华焓解得固体苯的摩尔升华焓3苯的摩尔熔化焓等于摩尔升华焓减去摩尔气化焓5.结霜后的早晨冷而干燥,在-5℃,当大气中的水蒸气分压降至 Pa 时,霜会升华变为水蒸气吗 若要使霜不升华,空气中水蒸气的分压要有多大已知水的三相点的温度和压力分别为 K 和611 Pa,水的摩尔气化焓1vap m 45.05 kJ mol H -∆=⋅,冰的摩尔融化焓1fus m 6.01 kJ mol H -∆=⋅;设相变时的摩尔焓变在这个温度区间内是常数;解:冰的摩尔升华焓等于摩尔熔化焓与摩尔气化焓的加和,用Clausius-Clapeyron 方程,计算 K-5℃时冰的饱和蒸气压解得 (268.15K)401.4 Pa p =而 K-5℃时,水蒸气的分压为 Pa,低于霜的水蒸气分压,所以这时霜要升华;当水蒸气分压等于或大于401.4 Pa 时,霜可以存在;6.在平均海拔为4 500 m 的高原上,大气压力只有 kPa;已知压力与温度的关系式为 5 216 K ln(/Pa)25.567p T=-;试计算在这高原上水的沸点; 解:沸点是指水的蒸气压等于外界压力时的温度;现根据压力与温度的关系式,代入压力的数据,计算蒸气压等于 kPa 时的温度,解得: 357 K T =即在海拔为4 500 m 的高原上,水的沸点只有357 K,即84 ℃,这时煮水做饭都要用压力锅才行;7.将3NH (g)加压,然后在冷凝器中用水冷却,即可得液氨,即3NH (l);已知某地区一年中最低水温为2℃,最高水温为37℃,问若要保证该地区的氮肥厂终年都能生产液氨,则所选氨气压缩机的最低压力是多少已知:氨的正常沸点为-33℃,蒸发焓为11 368 J g -⋅,设蒸发焓是与温度无关的常数;解: 氨在正常沸点-33℃240 K 时,它的蒸气压等于大气压力,为 kPa;水温为2℃275 K 时,氨的蒸气压较低,得到液氨没有问题;主要是计算在37℃310K 时氨的蒸气压,这就是压缩机所需的最低压力;已知氨的摩尔蒸发焓为:根据Clausius-Clapeyron 方程,计算310 K 时 氨的蒸气压,;解得: (310K) 1 408.3 kPa p =即在37℃时,压缩机的最低压力必须大于1 408.3 kPa ,才能终年都能生产液氨;8.CO 2的固态和液态的蒸气压与温度的关系式,分别由以下两个方程给出:试计算: 1 二氧化碳三相点的温度和压力;2 二氧化碳在三相点时的熔化焓和熔化熵;解: 1 在三相点时,固态和液态的蒸气压相等,s l p p =,即解得三相点的温度 215.3 K T =代入任意一个蒸气压与温度的方程式,计算三相点时的压力两个结果稍有不同 解得 ()466.7 kPa p =三相点2 根据Clausius-Clapeyron 方程的一般积分式式中'C 是积分常数;对照题中所给的方程,从固体的蒸气压与温度的关系式,可计算得到二氧化碳的摩尔升华焓,从液体的蒸气压与温度的关系式,可计算得到二氧化碳的摩尔蒸发焓,摩尔熔化焓等于摩尔升华焓减去摩尔蒸发焓,9.根据2CO 的相图,回答如下问题;1说出OA ,OB 和OC 三条曲线以及特殊点O 点与A 点的含义;2在常温、常压下,将2CO 高压钢瓶的阀门慢慢打开一点,喷出的2CO 呈什么相态为什么3在常温、常压下,将2CO 高压钢瓶的阀门迅速开大,喷出的2CO 呈什么相态为什么4为什么将2CO (s)称为“干冰”2CO (l)在怎样的温度和压力范围内能存在 解:1OA 线是2CO (l)的饱和蒸气压曲线;OB 线是2CO (s)的饱和蒸气压曲线,也就是升华曲线;OC 线是2CO (s)与2CO (l)的两相平衡曲线;O 点是2CO 的三相平衡共存的点,简称三相点,这时的自由度等于零,温度和压力由系统自定;A 点是2CO 的临界点,这时气-液界面消失,只有一个相;在A 点温度以上,不能用加压的方法将。
天津大学版物理化学课件六章相平衡

又如:任意组成的二组分盐水溶液与水蒸气的两相平衡系统, 又如:任意组成的二组分盐水溶液与水蒸气的两相平衡系统, 可以改变的变量有三个:温度、压力和盐水溶液的组成。 可以改变的变量有三个:温度、压力和盐水溶液的组成。但 因水蒸气压是温度和溶液的组成的函数,或者说沸腾温度是 因水蒸气压是温度和溶液的组成的函数, 压力和溶液的组成的函数。显然,要保持两相平衡, 压力和溶液的组成的函数。显然,要保持两相平衡,这三个 变量之中只有两个可以独立改变,故这个系统的自由度数为2 变量之中只有两个可以独立改变,故这个系统的自由度数为2 F=2)。 (F=2)。
要表示每一相的组成需要(S-1)个浓度变量,系统共有P个 相,共需有P(S-1)浓度变量。根据相平衡条件:所有各相 的温度相等,压力相等,于是确定系统状态的总变量数=[P (S-1)+2]。
• 设一相平衡系统: Ⅰ:1,2,3,…,S Ⅱ:1,2,3,…,S …………… 共有P(S-1)浓度变量 P: 1,2,3,…,S 各相温度压力相等,则有 总变量数=[P(S-1)+2]
3.自由度数 自由度数F 自由度数 • 相平衡系统发生变化时,系统的温度、压力及 每个相的组成均可发生变化。我们把能够维持 把能够维持 原有相数而可独立改变的变量(可以是温度、 原有相数而可独立改变的变量(可以是温度、 压力和某一相组成的某些物质的相对含量) 压力和某一相组成的某些物质的相对含量)叫 做自由度,这种变量的数目叫自由度数, 做自由度,这种变量的数目叫自由度数,用F表 示。 • 例如:纯水的气液两相平衡时,温度、压力可 以改变,但是其中只有一个变量(如T)可以独 立改变,另一个变量(p)是不能独立改变的, 它是前一个变量的函数,这个函数关系就是克 拉佩龙方程。由此可见,要维持纯水的气液两 相平衡,系统只有一个独立可变的变量,我们 说这一系统的自由度数F = 1。
大学物理第六章-PPT课件

P P2 P1 O V II A=0 I V
等体过程的内能: 气体吸热全部用于增加 mi m i 内能。 R ( T T ) Q E RT ( 6 . 1 1 ) 2 1
d E m i R d T M2 内能仅与始末态温度有关,与过程无关。 等体过程的热量: 定义等体摩尔热容量: C V i R 2 m C dT dQ (微小) 则 V V M m (有限) Q C T T ) V V( 2 1 M 系统吸收的热量全部增加气体的内能。
2019/3/15
吉林大学 物理教学中心
6.1.2 内能、热量、功 一、内能 分子热运动的动能(平动、转动、振动)和
分子间相互作用势能的总和。内能是状态
= E E 的单值函数。 E ki pi 内
i i
对于理想气体,忽略分子间的作用 ,则 E E = E ( T ) 理 k
平衡态下理想气体内能:
式中Q , dE , A 单位均用焦耳(J )表示。
2019/3/15 吉林大学 物理教学中心
符号规则
符号
Q
系统吸热 系统放热
A
系统做正功 系统做负功
E
增加
减少
+ -
热力学系统。 (1) 适用范围 初、末态为平衡态的过程。 ( 2 )第一定律包括热现象的能量守恒与转换定 律,指出第一类永动机不可能制造。 ( 3 )功与热的转换不能直接进行,只能通过物 质系统的能量改变来实现。
过程的中间状态都无限接近于平衡态,这样的过 程可以用系统的一组状态参量的变化来描述,这样的 过程称为准静态过程(quasi-static process)。
是一种理想的热力学过程,优点在于对过程变化的 描述和讨论都比较方便和简捷,并可进行数学处理。实 际过程大多可以近似看成是准静态过程,所以该过程有 很强的实际意义。
大学物理教程-波动理论

球面波
4
哈尔滨工业大学(威海)
Harbin Institute of Technology at Weihai
17.1 简谐波
0
● ● ●
4
● ● ●
●
大学物理教程
8
● ●
● ●
12
16
● ● ● ●
● ● ● ● ●
●
● ● ●
20
●
● ● ●
●
●
● ● ●
振
动
方
向
●
●
● ● ●
●
● ●● ●
14
哈尔滨工业大学(威海)
Harbin Institute of Technology at Weihai
17.1 简谐波
大学物理教程
例3. 如图所示,已知振源 x=0 的振动曲线, 沿 x 轴的正方向传播 u=4m/s,
求 t =3s 时波形曲线。
y(cm)
0.5
u
0
-0.5
y(cm)
0.
5
1
0
2
4
3 x
t=3s: y 0.5 cos(
)
2
8
15
哈尔滨工业大学(威海)
Harbin Institute of Technology at Weihai
17.1 简谐波
大学物理教程
例4. 已知正向波在t=0时的波形图,波速u=1200m/s。求 波函数和波长。
y(cm)
u
t=0
0.05
哈尔滨工业大学(威海)
Institute of Technology at Weihai
第17章 Harbin
大学物理-流体力学

为 U 形管中液体密度, 为流体密度。
较适合于测定气体的流速。
h
A B
常用如图示形式的比多管测液体的流速
1 2
v2
PA
PB
gh
v 2gh
3.飞机机翼周围的空气是如何流动的
假设在机翼右方的空气是水平方向以速度v1向左运动的,如图。 由于机翼倾斜,流经机翼的流线向 下偏移,如图中的v2。这两个矢量 之差v2- v1正是指向机翼对空气的 作用力的方向。根据牛顿第三定律, 空气对机翼施加大小相等、方向相 反的反作用,如图中的F。 这个力 的垂直分量正是飞机的升力(lift)。
所以: E
S
表示增大液体单位表面积所增加的表面能
2、表面张力系数的基本性质 (1)不同液体的表面张力系数不同,密度小、容易蒸发的 液体表面张力系数小。 (2)同一种液体的表面张力系数与温度有关,温度越高, 表面张力系数越小。 (3)液体表面张力系数与相邻物质的性质有关。 (4)表面张力系数与液体中的杂质有关。
二、液体的表面张力现象及微观本质
液体表面像张紧的弹性膜一样,具有收缩的趋势。
(1)毛笔尖入水散开,出水毛聚合; (2)水黾能够站在水面上; (3)硬币能够放在水面上; (4)荷花上的水珠呈球形; (5)肥皂膜的收缩;
液体表面具有收缩趋势的力, 这种存在于液体表面上的张力称为 表面张力。
表面张力的微观本质是表面层分子之 间相互作用力的不对称性引起的。
高尔夫球运动起源于15世纪的苏格兰。
起初,人们认为表面光滑的球飞行阻力 小,因此当时用皮革制球。
最早的高尔夫球(皮革已龟裂)
后来发现表面有很多划痕的旧球反而飞得更远。 这个谜直到20世纪建立流体力学边界层理论后才解开。
光滑的球
第6章_X射线物理学基础

1
第六章
X射线物理学基础
第六章 X射线物理学基础
2
第一节 X射线的性质 第二节 X射线的产生与X射线谱 第三节 X射线与物质的相互作用
3. X射线上述特性,成为研究晶体结构、进行元素分析、医 疗透视和工业探伤等方面的有力工具。
第二节 X射线的产生与X射线谱
24
一、X射线产生: 1. X射线:高速运动带电粒子(电子)与某物质相撞击后突 然减速或被阻止,与该物质中内层电子相互作用而产生的。 2. X射线产生条件: 1)产生并发射自由电子(加热W灯丝发射热电子); 2)在真空中迫使电子作定向的高速运动(加速电子); 3)在电子运动路经上设障碍,使其突然减速或停止(靶) 据此,就可理解X射线发生器的构造原理了。
2. 威廉· 康拉德· 伦琴(Wilhelm Konrad RÖntgen )摄于1896年
4
1845年3月27日生于德国莱茵州雷 内普 (Lennep)镇。 1869年获苏黎世大学理学博士学位 1870年回德国维尔茨堡大学工作。 1894年任维尔茨堡大学校长。 1895年11月8日发现了X射线。 1900年任慕尼黑大学物理研究所教 授,主任。 1901年,获首届诺贝尔物理学奖。 1923年2月10日,在慕尼黑去世。
X射线波动性的表现(2)
17
4. 电场矢量E 随传播时间或传播距离变化呈周期性波动, 波振幅为 A(或E0)。 一束沿 y 轴方向传播的波长为λ的X射线波方程为:
大学物理第二章电磁学PPT课件
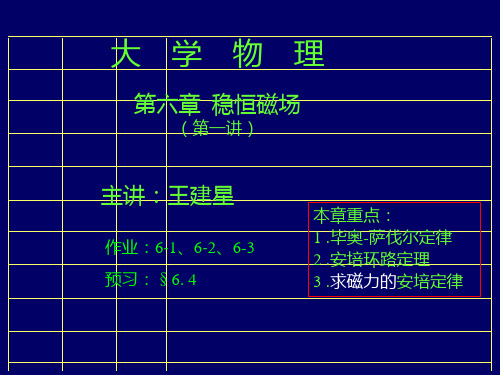
第六章 稳恒磁场
(第一讲)
主讲:王建星
作业:6-1、6-2、6-3 本章重点: 1 .毕奥-萨伐尔定律 2 .安培环路定理 3 .求磁力的安培定律
预习:§6. 4
第六章 稳恒磁场 §6. 1 磁感(应)强度 一.基本磁现象
1.安培假说:(1822年)
1) 一切磁现象都是电流 (或运动电荷)产生的; 2) 组成磁铁的最小单元(“磁分子”)是环形电流。
B= —— 2R
O
(6-J1)
4) 若线圈是由N 匝细导线组成 可看成是N匝圆电流的磁场的迭加
O
x
x
B=N ————— 2(R2+ x2)3/2
0 IR2
(6-J2)
记住以上两类典型载流导线的B公式,解题时可直接引用!
① 任取一 I d l ,写出 d B 的大小、标明方向; ② 建立坐标,将d B 分解 d Bx d B y d Bz
③ 求各分量的积分和,Bx
④ 合成
B Bx i B y j Bz k
2 x 2 y 2 z
dB
L
x
By d By Bz d Bz
磁场
运动电荷②
2. 磁场对外表现 ① 磁场对引入其中的磁铁、运动电荷或载流导体有磁力作用;
② 载流导体在磁场中移动时,磁场力一般要作功。 与电场的规律非常相似 ——可借用电场的描述方法
三. 磁感(应)强度
洛仑兹力 磁场对运动电荷的作用力的规律: 当运动试探电荷以一定速率 v 、 磁 场 沿不同方向通过某点时,电荷所 y 受的磁力不同! 1. 存在一个特定的方向:电荷 沿该向运动不受磁力作用。 此方向与电荷种类无关. x 2.电荷沿不同于特定方向的 磁力 速度通过场中某点时, 的方向总是垂直于速度与该 特定方向组成的平面。
大学物理学(第二版)全套PPT课件

万有引力定律
任意两个质点通过连心线方向上的力相互吸引。 该引力大小与它们质量的乘积成正比与它们距离 的平方成反比。
机械能守恒定律
在只有重力或弹力做功的物体系统内(或者不受 其他外力的作用下),物体系统的动能和势能( 包括重力势能和弹性势能)发生相互转化,但机 械能的总能量保持不变。
04
动量守恒与能量守恒
热力学第二定律
热力学第二定律的表述
不可能从单一热源取热,使之完全转换为有用的功而不产生其他影响。
热力学第二定律的数学表达式
对于可逆过程,有dS=(dQ)/T;对于不可逆过程,有dS>(dQ)/T,其中S表示熵,T表 示热力学温度。
热力学第二定律的应用
热力学第二定律揭示了自然界中宏观过程的方向性,指出了与热现象有关的实际宏观过 程都是不可逆的。同时,它也提供了判断这些过程进行方向的原则。
刚体的定轴转动中的功与能
转动功
力矩在转动过程中所做的功叫做“转动功”,它等于力矩与角位 移的乘积。
转动动能
刚体定轴转动的动能叫做“转动动能”,它等于刚体的转动惯量与 角速度平方的一半的乘积。
机械能守恒
在只有重力或弹力做功的情况下,刚体的机械能守恒,即动能和势 能之和保持不变。
06
热学基础
温度与热量
磁场的基本概念
01
磁场的定义
磁场是一种物理场,由运动电荷或电流产生,对放入其中的磁体或电流
有力的作用。
02
磁感线
用来形象地表示磁场方向和强弱的曲线,磁感线上某点的切线方向表示
该点的磁场方向。
03
磁场的性质
磁场具有方向性、强弱性和空间分布性。
安培环路定理与毕奥-萨伐尔定律
01
