胃肠腔镜手术指引
腹腔镜大肠癌根治手术操作指引

腹腔镜大肠癌根治手术操作指引关键信息项:1、手术目的2、手术适用范围3、手术前准备4、手术操作步骤5、手术中的注意事项6、手术后护理及康复7、并发症及处理方法1、手术目的11 腹腔镜大肠癌根治手术旨在通过微创手术技术,彻底切除大肠癌病灶,清扫可能存在转移的淋巴结,以达到治疗大肠癌、提高患者生存率和生活质量的目的。
2、手术适用范围21 适用于确诊为大肠癌,且经评估肿瘤未广泛转移、患者身体状况能够耐受腹腔镜手术的患者。
22 对于肿瘤局部侵犯严重、存在广泛粘连或其他不适合腹腔镜操作的情况,应谨慎选择或转为开腹手术。
3、手术前准备31 患者评估311 全面的身体检查,包括血常规、生化指标、凝血功能、心电图、心肺功能等,以评估患者对手术的耐受能力。
312 影像学检查,如结肠镜、腹部 CT、磁共振成像(MRI)等,明确肿瘤的位置、大小、侵犯范围及有无远处转移。
32 肠道准备321 术前 1-3 天开始进食流质饮食。
322 口服肠道清洁剂进行肠道清洁,以减少肠道内的粪便和细菌。
323 必要时进行灌肠处理。
33 预防性抗生素应用331 在手术前 30 分钟至 1 小时内给予预防性抗生素,以降低手术感染的风险。
4、手术操作步骤41 患者体位与穿刺孔布局411 患者通常采取头低脚高的改良截石位。
412 穿刺孔的位置根据肿瘤的位置和手术者的习惯进行选择,一般包括脐部观察孔和操作孔。
42 腹腔探查421 进入腹腔后,全面探查腹腔内器官,明确肿瘤的位置、大小、形态,以及有无腹腔转移、腹水等情况。
422 评估肿瘤与周围组织的关系,确定手术切除范围和可行性。
43 游离肠管431 根据肿瘤所在部位,游离相应的结肠或直肠。
432 注意保护肠系膜血管、输尿管等重要结构。
44 淋巴结清扫441 按照肿瘤根治的原则,清扫相应区域的淋巴结。
442 确保淋巴结清扫彻底,同时避免损伤周围神经和血管。
45 肿瘤切除451 离断肠管,切除包含肿瘤在内的足够长度的肠段。
腔镜下全胃切除术手术步骤

腔镜下全胃切除术手术步骤腔镜下全胃切除术是一种现代化的手术方法,该技术不仅具有与传统手术同等的疗效,而且还具有创伤小、恢复快、外观美观等特点,广泛应用于各种胃癌及胃部良性疾病的治疗。
本文将为您介绍腔镜下全胃切除术的手术步骤。
操作步骤第一步:开腹取出胃发现胃癌时,首先要通过腹腔镜进行检查,确定患者的病情后,先用腹腔镜检查一遍,然后再通过一个小的腹部切口将胃取出。
胃取出后,根据癌肿位置确定如何进行手术。
第二步:胃动脉淋巴结的处理在腹腔镜下,首先需要排出肠道内的气体,然后切除胃内附近的胃动脉淋巴结,以帮助判断癌瘤是否转移。
若淋巴结发现癌细胞,则需要根据情况进一步判断是否要进行放疗或化疗。
第三步:切除各个胃区域对胃癌的治疗通常采取的是胃全切除,即将整个胃切除。
这个过程分为三个阶段:首先,通过腔镜下找到黄书结肠部位,并切断,然后沿着胰腺大血管切断小肠,将胃和脾脏一起切断,最后,沿着胆管一侧的胃底切断。
第四步:进行人工肠胃吻合将胃腔切断后,可以通过人工的肠道吻合完成胃部的替代。
此时,需要将胰腺和小肠各自的断面端缝在一起,然后将胃的断面和小肠的断面缝在一起。
吻合完毕后,用一条缝线将保护管固定在吻合部位。
第五步:处理缝合线处理缝合线是腹腔镜下全胃切除术中一个非常重要的步骤。
缝合线是为了固定吻合部位而使用的针线,如果缝合线固定不好的话,极易引起感染、炎症等问题。
因此,在吻合部位缝合线安排完毕后,需要仔细检查是否固定牢固,并采用一系列防治感染的措施,以避免手术后出现感染等问题。
腹腔镜下全胃切除术是一项比较复杂的手术,需要医生掌握一定的技术,但它对于治疗胃癌和其他胃部疾病的效果非常明显。
通过本文所介绍的手术步骤,相信您会对腹腔镜下全胃切除术有更深入的了解。
腹腔镜下全胃切除术手术步骤

腹腔镜下全胃切除术手术步骤
腹腔镜下全胃切除术是一种常见的胃部手术,用于治疗胃癌、
胃溃疡或其他严重胃部疾病。
手术步骤可以分为准备阶段、手术操
作阶段和术后处理阶段。
首先,在准备阶段,医生会对患者进行全面的身体检查,包括
血液检查、心电图、胃镜检查等,以确保患者身体状况适合手术。
患者需要空腹,停止进食和饮水,以准备手术。
接着是手术操作阶段。
在手术中,医生会在患者的腹部做几个
小切口,然后用腹腔镜和其他手术工具进入腹腔。
首先,医生会检
查腹部器官的情况,然后将胃进行切除。
在切除胃的过程中,医生
会小心地处理周围的器官和血管,以确保手术的安全和有效性。
一
旦胃被切除,医生可能会进行淋巴结清扫,以确保没有癌细胞残留。
最后是术后处理阶段。
术后,患者需要在医院接受恢复治疗,
包括输液、止痛和定期检查。
患者需要逐渐恢复饮食,医生会根据
个体情况制定饮食计划。
此外,术后患者需要定期复查,以确保康
复情况良好。
总的来说,腹腔镜下全胃切除术是一项复杂的手术,需要经验丰富的医生和精密的操作。
术后的康复也需要患者和医生的共同努力,以确保手术的成功和患者的健康。
医学课件无痛胃肠镜操作流程

麻醉后恢复
凡麻醉结束后尚未清醒(含嗜睡)、或 虽已清醒但肌张力恢复不满意的患者均 应进入麻醉恢复室/区域苏醒(一般10 ~20min)。达到Aldrete评分苏醒标准 后出室(Aldrete评分大于等于9分)。
恢复过程中需观察患者体温、血压、心 率、呼吸、血氧饱和度及神志状态等。 患者苏醒后需由医务人员或家属扶下床 ,以避免患者出现坠床、摔伤等意外。
常见并发症及处理
心律失常 除室上性心动过速和室性期 前收缩外,心动过速一般无需处理,紧 急情况下应静脉给予患者Ⅰa~Ⅳ型抗 心律失常药物,必要时除颤。如发生心 动过缓,当心率降至 50次/min以下 ,可静推阿托品0.5mg,如有需要可 重复给药至3mg或静脉给予肾上腺素 0.02~0.1mg。如果 5min后无效,可考 虑使用异丙肾上腺素。在威胁生命的情 况下应给予心脏按压等急救措施。
(5)当日实施麻醉的主管医师应当对术 前评估记录进行确认,并且再次核实患 者身份和将要进行的操作。
(6)建立静脉通道,首选右上肢。
麻醉实施
患者采取左侧卧位,嘱患者咬好口垫, 首先由护士开放患者静脉通道,持续吸 氧,连接监护设备,并监测患者生命体 征。根据消化内镜的诊疗目的和镇静深 度的需求,可采用下列不同的麻醉或镇 静方法。
氯胺酮:尤其适用于1~5岁的小儿消 化内镜诊疗,常用剂量为6mg/kg肌注, 建立静脉通道后,持续静脉泵入2~ 3mg/(kg·h)维持。
麻醉实施
芬太尼:芬太尼用于消化内镜镇静时, 初始负荷剂量50~100μg,每2~ 5min追加给药25μg,直至达到镇 静目的。
咪达唑仑:咪达唑仑用于消化内镜镇静 时,初始负荷剂量为 1mg(或小于 0.03mg/kg),1~2min内静脉给药。可 每隔2min重复给药 1mg(或0.02~ 0.03mg/kg)直至达到理想镇静水平。
《腹腔镜胃癌手术操作指南(2016版)。

《腹腔镜胃癌手术操作指南(2016版)。
腹腔镜胃癌手术操作指南(2016版)1. 手术前的准备1.1 患者评估在手术前,应对患者进行全面的身理检查和病史询问,以评估患者的身体状况和手术风险。
重点关注患者的血压、心率、呼吸、体温等生命体征,以及有无其他严重的并发病。
1.2 影像学检查术前应进行腹部CT、MRI等影像学检查,以了解肿瘤的位置、大小、侵犯范围以及邻近器官的情况。
1.3 实验室检查术前应进行血常规、肝功能、肾功能、电解质等实验室检查,以确保患者的生理功能正常。
2. 手术器械和材料的准备2.1 器械需要准备常规的腹腔镜手术器械,包括腹腔镜、镜头、手术钳、分离器、切割器等。
2.2 材料需要准备手术用的缝合线、伤口敷料、引流管等材料。
3. 手术步骤3.1 麻醉和体位患者应进行全身麻醉,并采取头高脚低的仰卧位。
3.2 建立气腹通过脐部切口插入腹腔镜,注入二氧化碳建立气腹。
3.3 探查通过腹腔镜探查腹腔,了解肿瘤的位置和邻近器官的情况。
3.4 分离肿瘤使用手术器械分离肿瘤周围的组织和器官,暴露肿瘤。
3.5 切除肿瘤使用切割器切除肿瘤和周围的淋巴结。
3.6 重建消化道根据肿瘤的位置和大小,决定是否需要切除部分消化道,并进行消化道重建。
3.7 关闭切口使用手术缝合线关闭切口,并放置引流管。
4. 手术后的处理4.1 监护手术后应对患者进行生命体征的监护,包括血压、心率、呼吸、体温等。
4.2 疼痛管理根据患者的疼痛程度,给予适当的止痛药物。
4.3 引流管护理定期观察引流管的引流情况,及时处理引流管的堵塞、脱落等情况。
4.4 饮食管理根据患者的恢复情况,逐步恢复饮食,从流质饮食开始,逐步过渡到固体饮食。
4.5 康复锻炼鼓励患者进行康复锻炼,逐步恢复身体功能。
5. 手术并发症的处理手术并发症可能包括出血、感染、吻合口漏等。
一旦发现并发症,应立即进行处理,包括再次手术、抗生素治疗等。
6. 手术后的随访手术后应对患者进行定期的随访,以了解患者的恢复情况和预后。
胃肠腔镜手术指引

腹腔镜下 胃ca根治 5板1#丝线 1板4#丝线 2板7#丝线
体位:人字位。主刀站病人左侧(屏幕摆右上)一助站右侧屏幕摆左上。 开放后位置互换。 备荷包钳、闭合钳(3钉)、可可钳
• 碘伏消毒,在脐上正中做一5cm的切口,最后吻合好后小针加强一圈, 最里面用长针持,到达外面再换短持。
• 关完前鞘后上腔镜器械,给主刀抓钳、肠钳、一助给以肠钳。这时二 助用吻合器配合主刀从肛门处进行吻合。
腹腔镜下直肠ca根治(挖肛)
体位,一只脚架起。屏幕摆脚上;主刀站病人右侧。 丝线各两包。不需要荷包钳,闭合钳。备可可
• 主刀挖肛,一二助造瘘,给弯盘放好大刀、血管钳、组织钳、组织剪, 持针器大角针一起端下去;4#丝线放于病人架脚上,递光变,长电刀。 • 台上消毒,递尖刀、血管钳做以环形切口,电刀切除脂肪,递甲钩牵 开,到达腹腔后卵圆钳提出直肠近端,递血管钳继续裸化肠系膜,之 后小针4#情况。
开台:
• 碘伏消毒递尖刀打洞,电刀分离,血管钳撑开,手指探查肾区情况, 递准备好的手套注射器打气膨起,尖刀打辅助孔,递小曲卡,尖刀, 大曲卡,主操作孔,最后以曲卡不要针芯,胖针7#丝线缝合皮下两针 ,角针7#缝皮固定,小号引流管剪3—5cm一边剪开7#丝线固定小曲卡 。 • 给腔镜器械钳。
腹腔镜下直肠(乙状结肠)ca根治(保肛)
1、4#丝线各一 7#丝线2板 体位:人字位。主刀屏幕摆脚下。一助屏幕摆病人右上方处。 备荷包钳、可可钳
• 碘伏消毒,在耻骨联合上方做一5cm长的横切口,到达腹腔后上小的 切口保护器,递无齿卵圆钳夹出病变肿瘤,选择合适的切除长度。
• 裸化肠管,血管钳、带线、尖刀离断处理好肠系膜。上荷包钳(针) 给钉座(和枪一起打好石蜡油)做好荷包后递蚊式钳去除吻合端的脂 肪垂。 • 查看有无出血及荷包情况,无误后10*28●7#丝线关腹,此时穿线速 度宜快。
腔镜下全胃切除术手术步骤
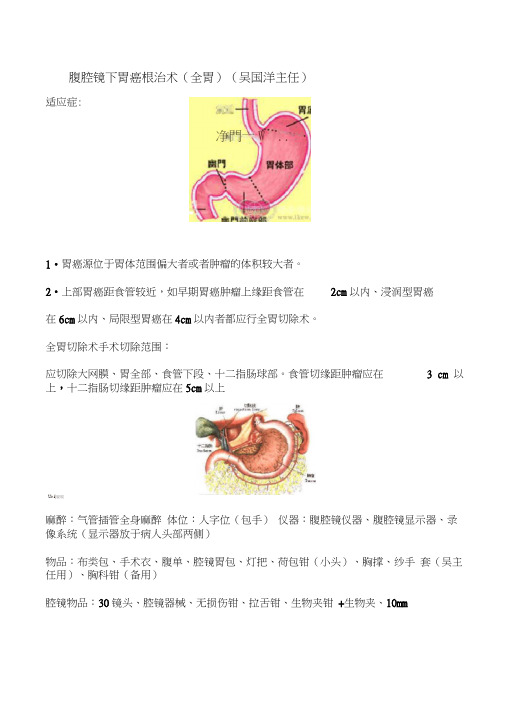
腹腔镜下胃癌根治术(全胃)(吴国洋主任)适应症:净門亠W ..1•胃癌源位于胃体范围偏大者或者肿瘤的体积较大者。
2•上部胃癌距食管较近,如早期胃癌肿瘤上缘距食管在2cm以内、浸润型胃癌在6cm以内、局限型胃癌在4cm以内者都应行全胃切除术。
全胃切除术手术切除范围:应切除大网膜、胃全部、食管下段、十二指肠球部。
食管切缘距肿瘤应在 3 cm 以上,十二指肠切缘距肿瘤应在5cm以上Ur i|雇唳麻醉:气管插管全身麻醉体位:人字位(包手)仪器:腹腔镜仪器、腹腔镜显示器、录像系统(显示器放于病人头部两侧)物品:布类包、手术衣、腹单、腔镜胃包、灯把、荷包钳(小头)、胸撑、纱手套(吴主任用)、胸科钳(备用)腔镜物品:30镜头、腔镜器械、无损伤钳、拉舌钳、生物夹钳+生物夹、10mm钛夹钳+钛夹、5mm钛夹钳+钛夹(备用)、超声刀头(长)+超声刀连接线、一次性腹腔穿刺器12mm (国产)1套、强生或美外12mmTrocar 1个(低温)、强生或美外5mmTrocar 1个(低温)、血管夹钳+血管夹(备用)一次性物品:11#刀片、23号刀片、剖腹针(1包)、荷包线(小号)(1-2包)、3-0(8针)(2包)、O#PDS(1条)、电刀头(中长)、吸引器管(3条)、切口保护器(1包)、电线套(1包)1#4#7#慕丝(若干包)、三角纱(若干包),骨科纱(若干包)、5*12圆针(备用)、导尿包(1包)、油球(1包)、负压球(1个)、22#引流管(1条),切口敷贴7*7(5包)、切口敷贴9*15(1包)高耗:贝诺25吻合器(2把)、贝诺30闭合器1把、贝诺60闭合器1把、美外60-3.5mm腔内切割闭合器1把腹腔镜下全胃切除术(腔内配合)脐孔穿刺并建立气腹,也可采用开放式。
维持腹内压在12〜15 mm Hg。
通常在脐孔处或在耻骨上10 mm处戳孔放置镜头,左侧腋前线肋缘下行12 mm戳孔为主操作孔,脐左5 cm 偏上行5 mm戳孔为辅操作孔右侧腋前线肋缘下5mm戳孔, 右锁骨中线平脐偏上12 mm戳孔。
腹腔镜胃肠手术笔记

腹腔镜胃肠手术笔记患者信息:年龄:60岁性别:男性临床诊断:胃肠道息肉术前准备:1. 患者禁食8小时,禁止饮水4小时。
2. 血液检测:血常规、血型、凝血酶原时间、凝血酶原时间国际标准化比值、血气分析等。
3. 心电图、胸部X线片、胃镜检查。
术前操作:患者于手术准备室完成术前操作,包括麻醉师的评估和插管,抗菌药物预防感染,两个静脉通道置管,留置膀胱尿管。
手术步骤:1. 患者采取隆胸卧位,局麻下行腹腔镜胃肠道手术。
2. 在脐部进行0.5cm小切口,将腹腔镜引入腹腔,注入适量气体扩张腹腔。
3. 在左侧上腹部再次置入5mm工作孔,用作工作口,同时在双侧下腹各置入5mm探针入孔,进行额外操作。
4. 放置腹腔镜之后,对腹腔进行彻底的检查,包括肝、胃和胆囊等脏器。
5. 在胃窦部切除口进行游离,定位导管放入于窦部,通过缝合口将窦部切除并拿出。
6. 检查胃肠道其他部位,发现并切除多个息肉。
7. 在胃小弯上方和左胁下方各作一个口,检查胰腺和肝等腹腔内脏器。
8. 术毕,排出腹腔内气体并关闭切口。
术后处理:将患者转至恢复室,进行密切监测,并留置导尿管。
患者禁食,输液维持,并给予必要的抗生素。
术后护理:1. 定期监测患者血压、心率、呼吸情况及术后切口出血情况。
2. 观察患者排尿情况,维持导尿管通畅。
3. 监测患者术后恢复情况,包括呕吐、腹痛、伤口感染等。
4. 术后第二天给予患者逐渐清淡的流质饮食,观察消化道吸收功能。
术后随访:1. 术后第一周复查伤口愈合情况,拆除导尿管。
2. 术后第三周进行复查,检验并评估术后效果。
3. 术后定期随访,进行术后并发症的预防和处理。
备注:以上为一例腹腔镜胃肠手术的笔记,手术步骤和护理措施仅供参考。
真实病例需要详细评估和医生决策,并严格遵循医院和科室的操作规范。
胃肠外科内镜操作规程

胃肠外科内镜操作规程一、患者准备工作1.患者应按医生要求空腹至少8小时。
2.患者需签署知情同意书,并通过问诊、检查等手段确认术前禁忌症,如出血倾向、心肺功能不全等。
3.患者术前需要完成相应的检查,如血常规、凝血功能、肝功能等。
二、内镜材料准备1.配备适当的内镜和附件:胃镜、结肠镜等。
2.配备内镜相关的必要器械和设备:缩窄带、钳型活组织夹等。
三、操作流程1.引导患者取坐位或左侧卧位,保持舒适。
2.给予途径选择:上消化道内镜检查或结肠镜检查。
3.经典检查顺序:舌咽部、食管、贲门、胃体、胃底、幽门、十二指肠球部、水平部、降部、回肠、盲肠、升结肠等。
4.操作顺序:先观察,后活检。
在观察过程中,要注意黏膜颜色、蠕动活动等情况,及时记录。
若发现异常病变,选择适当的方法进行活组织检查。
5.操作技巧:(1)调节镜体位置:控制旋钮调整镜体的角度和方位,精确观察病变。
(2)吸引黏液和病变:使用吸引器将黏液和病变物质吸入。
(3)注水扩张法:通过向镜体内注入适量水分,使黏膜高度展开,便于观察和活检。
(4)活组织检查:选择适当的试剂、器械进行黏膜的活检,注意活检时的角度和深度。
(5)外科疗法:根据观察结果,可以进行特定的外科治疗,如黏膜病损切除、黏膜病变封闭、黏膜缩窄等。
四、操作后护理1.手术完毕后,将内镜从患者体内取出。
2.停止术中给予的麻醉、镇痛药物,并做好相应的麻醉恢复工作。
3.鉴别观察患者术后有无并发症,如出血、感染等。
根据患者情况,选择适当的处理措施。
4.术后病患需要适当的休息和饮食,术前禁食指导。
5.根据医生的要求,对手术过程中使用的器械进行清洗、消毒和灭菌处理。
五、术中注意事项1.术前、术中应随时监测患者的生命体征,如心率、呼吸、血压等。
2.术中要确保操作的安全性和有效性,根据病患的不同情况选择合适的操作方法。
3.术中要严格执行无菌操作,避免感染的发生。
4.进行活检时要注意适当选择活组织夹的类型和尺寸,避免出血和组织损伤。
腹腔镜袖状胃切除术操作指南(完整版)

腹腔镜袖状胃切除术操作指南(完整版)气腹建立和术前准备在手术室内,将患者置于仰卧位,双手放于体侧,双腿自然弯曲。
在肚脐下方注射局麻药后,进行套管穿刺,建立气腹。
随后进行术前准备,包括消毒、穿刺、固定和准备手术器械等。
第二步:解剖和切除胃大弯侧的附属组织在手术器械的协助下,进行胃大弯侧的解剖和切除。
在此过程中,需要注意保护胃的血管和神经,避免出现出血或损伤的情况。
第三步:制作袖状胃在胃大弯侧切除后,需要将胃小弯侧制作成袖状或管状胃。
在制作过程中,需要遵循一定的原则和技巧,确保袖状胃的大小和形状符合患者的实际情况。
第四步:缝合袖状胃和胃底在制作袖状胃后,需要将袖状胃和胃底进行缝合。
在此过程中,需要注意缝合的技巧和缝合的质量,避免出现漏气或其他并发症的情况。
第五步:术后处理和观察术后需要进行处理和观察,包括止血、排气、拔管等。
在此过程中,需要注意患者的情况和术后并发症的发生情况,及时采取措施进行处理和治疗。
三、结论腹腔镜袖状胃切除术是一种安全、有效的减重手术,可以明显改善肥胖相关代谢综合征。
本操作指南的编写旨在规范和标准化该手术的操作步骤,为临床医生提供标准规范的操作指导,促进该手术的应用和发展。
在手术前,患者需要仰卧,根据医生的惯,可以采用分腿位或并腿仰卧位,术者站在不同的位置。
如果采用分腿“大字位”,术者站在患者两腿之间,扶镜手站在患者右侧,另一助手站在患者左侧,器械护士则位于左下肢外前方。
主监视器应置于患者头侧,另一监视器则置于患者右侧(非必备)。
如果采用并腿仰卧位,则术者站在患者右侧,助手和扶镜手则站在患者左侧。
为符合人体工程学,建议至少使用两台监视器,均置于患者头侧,一台偏左侧供主刀术者使用,另一台偏右侧供助手及扶镜手使用。
摆好体位后,双下肢需要使用间歇加压泵或者弹力袜/弹力绷带加压包扎,以预防双下肢静脉血栓(图1)。
在套管穿刺过程中,需要根据患者实际情况,包括身高、腹壁厚度、术者站位和操作惯等情况、腹腔镜管的长度等,可以在脐部用尖刀切开一1 cm纵切口。
胃肠外科内镜操作规程

电子胃镜、十二指肠镜检查操作规程[目旳] 电子胃十二指肠镜是应用最广、进展最快旳内镜检查,通过检查可以直接观测胃及十二指肠粘膜颜色、溃疡或肿瘤旳大小、部位及范围,并可行组织学或细胞学检查。
[用物] 胃镜主机,胃镜(十二指肠镜),工作站,吸引器,检查床,一次性胃镜活检钳,一次性胃镜毛刷,湿纱布,医疗废物桶。
[操作环节]1、检查前准备(1)仔细问询患者病史及体格检查,查看化验检查及心电图,排除检查禁忌症。
(2)向患者讲解胃镜检查旳目旳,检查时也许出现旳不适症状及应对措施。
(3)向患者讲解服用胃镜胶旳目旳,口服胃镜胶7ml,利多卡因5ml咽部含化5min。
(4)指导患者侧卧,头下铺垫单,含咬口。
(5)录入患者基本信息,,打开视频。
(6)打开胃肠主机电源和冷光源,调整白平衡,检查胃肠镜性能。
(7)打开吸引器,调整吸引压力2、检查中(1)配合检查医生指导患者大口喘气,胃镜抵达会厌部时,指导患者做吞咽动作。
(2)采集胃镜照片,需病理检查及幽门螺杆菌迅速检测旳患者,使用一次性胃镜活检钳取病变胃组织进行检查,准备止血药物。
(3)退出胃镜时,使用湿纱布对胃镜插入部进行初步擦拭,清除粘液,注气注水10秒。
(4)关闭胃镜主机及光源,拔下胃镜,环形放入污镜车中,运送至内镜消毒室清洗消毒。
3、检查后(1)协助患者擦拭面部分泌物。
(2)搀扶患者至恢复室,因患者咽喉部麻醉作用未消退,嘱其不要吞咽唾液,以免呛咳。
麻醉作用消失后,可先饮少许水,如无呛咳可进食。
当日饮食以流质、半流质为宜,行活检旳患者应进温凉旳饮食。
(3)向患者解释出现咽痛、咽喉部异物感,嘱患者不要用力咳嗽,以免损伤咽喉部粘膜。
(4)问询患者与否有其他不适,予以有关处理。
[注意事项]1、严格掌握胃镜检查旳适应症及禁忌症。
2、检查前调整白平衡,测试内镜注气注水与否畅通,确定内镜性能良好后方可使用。
3、活检钳一次性使用,用后毁形,与医疗垃一起处理。
4、检查结束后先对内镜进行预处理,清除表面污物后送清洗消毒室进行清洗消毒。
腹腔镜下全胃切除术手术步骤

腹腔镜下全胃切除术手术步骤全文共四篇示例,供读者参考第一篇示例:腹腔镜下全胃切除术是一种常见的胃癌治疗手术,也被用于治疗其他胃部疾病,如溃疡性胃炎和肠道恶性肿瘤。
腹腔镜手术具有创伤小、恢复快、术后疤痕少等优势,因此越来越受到患者和医生的青睐。
以下是腹腔镜下全胃切除术的手术步骤。
患者需要进行全面的术前准备,包括查看各项生理指标,进行胃镜检查等。
医生会详细了解患者病史,对手术注意事项进行解释,确保患者理解并配合。
手术开始前,患者会被置于全麻下,再由医生在患者腹部做3个至5个小切口,用于插入腹腔镜及其他手术器械。
随后,医生会在腹腔镜的引导下视觉观察腹腔内的情况,并进行进一步的操作。
第一步是处理胃的血管和胃十二指肠等器官的连接。
医生会使用专门的器械进行动态处理,避免误伤其他脏器和血管。
在这一步骤中,医生需要非常小心和精确。
接着,医生需要对胃进行解剖。
在腹腔镜的引导下,医生会进行切割和缝合等操作,以确保胃的完全切除。
在解剖过程中,医生需要注意避开周围重要器官和血管,避免术后并发症。
随后是对淋巴结进行清扫。
医生会逐个清理胃周围的淋巴结,以确保患者的术后康复。
清扫淋巴结需要非常仔细和耐心,确保清除所有潜在的恶性细胞。
最后是对胃切口进行缝合。
医生会使用特殊的缝合技术,对胃切口进行精细的缝合,以促进伤口的愈合。
在缝合过程中,医生需要确保缝合牢固,避免术后感染和其他并发症。
整个手术过程中,医生需要非常小心和谨慎,确保手术操作的顺利进行。
术后,患者需要严格遵循医生的建议,定期复查,以确保术后康复的顺利进行。
腹腔镜下全胃切除术是一种安全有效的治疗方法,但术前术后的准备和护理同样重要。
患者应该积极配合医生的治疗方案,保持良好的心态,以便尽快康复。
第二篇示例:腹腔镜下全胃切除术是一种常见的外科手术,主要用于治疗胃癌和其他严重胃部疾病。
相比传统的开放手术,腹腔镜手术具有创伤小、恢复快、术后疼痛轻等优点。
本文将介绍腹腔镜下全胃切除术的手术步骤。
腔镜下近端胃部分切除术配合及护理

腔镜下近端胃部分切除术是一种常见的胃部手术,用于治疗胃部疾病,特别是胃癌。
在这篇文章中,我们将深入探讨腔镜下近端胃部分切除术的配合及护理,并共享一些个人观点和理解。
一、腔镜下近端胃部分切除术的原理腔镜手术是一种微创手术,通过腹腔镜或胃镜等内窥镜进行操作。
腔镜下近端胃部分切除术是指在胃体与胃窦的交界部位进行胃部切除手术,旨在治疗早期胃癌或其他胃部疾病。
二、术前配合在进行腔镜下近端胃部分切除术之前,患者需要进行术前配合。
这包括全面的术前检查,如血液检查、胃镜检查、CT检查等,以确定手术时的具体情况。
患者还需要进行术前准备,包括心理调适、饮食调理等。
三、手术过程及配合腔镜下近端胃部分切除术的手术过程是非常精细和复杂的,需要经验丰富的医生进行操作。
患者在手术中需要配合医生进行呼吸调整和姿势调整,以确保手术的顺利进行。
四、术后护理术后护理是腔镜下近端胃部分切除术的关键环节。
患者需要在术后密切配合医生进行恢复训练,包括早期康复训练、饮食调理、伤口护理等。
家属的关爱和支持也是非常重要的。
五、个人观点和理解腔镜下近端胃部分切除术配合及护理是一项综合性工作,需要医生、患者和家属共同努力。
在这个过程中,患者的积极配合和家属的关爱是非常重要的。
医生的专业技术和精湛经验也是确保手术成功的关键。
六、总结腔镜下近端胃部分切除术配合及护理是一项复杂而又重要的工作,需要全面的配合和护理措施。
我们希望通过这篇文章的介绍,能让更多的人了解腔镜手术的重要性,并加强对患者的关爱和支持。
在这篇文章中,我们深入探讨了腔镜下近端胃部分切除术的配合和护理,并共享了一些个人观点和理解。
希望这些信息能对大家有所帮助,让更多的人了解腔镜手术的重要性,加强对患者的关爱和支持。
腔镜下近端胃部分切除术是一种微创手术,对患有早期胃癌或其他胃部疾病的患者来说,是一项非常有效的治疗方法。
然而,手术的成功与否不仅取决于医生的专业技术和经验,还取决于患者术前配合和术后护理的全面性。
腔镜下全胃切除术手术步骤word精品

腹腔镜下胃癌根治术(全胃)(吴国洋主任)1•胃癌源位于胃体范围偏大者或者肿瘤的体积较大者。
2•上部胃癌距食管较近,如早期胃癌肿瘤上缘距食管在 2cm 以内、浸润型胃癌 在6cm 以内、局限型胃癌在4cm 以内者都应行全胃切除术。
全胃切除术手术切除范围:应切除大网膜、胃全部、食管下段、十二指肠球部。
食管切缘距肿瘤应在3 cm以上,十二指肠切缘距肿瘤应在5cm 以上 麻醉:气管插管全身麻醉体位:人字位(包手)仪器:腹腔镜仪器、腹腔镜显示器、录像系统(显示器放于病人头部两侧)物品:布类包、手术衣、腹单、腔镜胃包、灯把、荷包钳(小头)、胸撑、纱手 套(吴主任用)、胸科钳(备用)腔镜物品:30镜头、腔镜器械、无损伤钳、拉舌钳、生物夹钳 +生物夹、10mm适应症:+ZIBHIurTFfflEys钛夹钳+钛夹、5mm钛夹钳+钛夹(备用)、超声刀头(长)+超声刀连接线、一次性腹腔穿刺器12mm (国产)1套、强生或美外12mm Trocar 1个(低温)、强生或美外5mm Trocar 1个(低温)、血管夹钳+血管夹(备用)一次性物品:11#刀片、23号刀片、剖腹针(1包)、荷包线(小号)(1-2包)、3-0(8针)(2包)、0#PDS(1条)、电刀头(中长)、吸引器管(3条)、切口保护器(1包)、电线套(1包)1#4#7#慕丝(若干包)、三角纱(若干包),骨科纱(若干包)、5*12圆针(备用)、导尿包(1包)、油球(1包)、负压球(1个)、22#引流管(1条),切口敷贴7*7(5包)、切口敷贴9*15(1包)高耗:贝诺25吻合器(2把)、贝诺30闭合器1把、贝诺60闭合器1把、美外60-3 ・5mm腔内切割闭合器1把腹腔镜下全胃切除术(腔内配合)脐孔穿刺并建立气腹,也可采用开放式。
维持腹内压在12〜15 mm Hg。
通常在脐孔处或在耻骨上10 mm处戳孔放置镜头,左侧腋前线肋缘下行12 mm戳孔为主操作孔,脐左5 cm偏上行5 mm戳孔为辅操作孔,右侧腋前线肋缘下5mm戳孔, 右锁骨中线平脐偏上12mm戳孔。
腹腔镜下胃肠道手术指南说明书

Complications After Esophageal Anastomosis inNewbornsV. A. Savvina1,2,*, Yu. P. Pavlyukova1 and A. Yu. Tarasov21 M.K. Ammosov North-Eastern Federal University, Yakutsk, Russia2 Republican Hospital No. 1 National Center of Medicine, Yakutsk, Russia*ABSTRACTEsophageal atresia is a congenital anomaly in which the oral end of the esophagus ends in a pouch. Its frequency is 1 in 2500–4500 newborns. Esophageal atresia is considered a complex malformation; the results of its treatment are used to judge the level of surgical care provided by the medical institution. With this malformation, the operation of choice is to perform a primary esophageal anastomosis. Primary anastomosis may be accompanied by severe early and late complications, such as anastomotic leakage, recurrent tracheo-esophageal fistula, esophageal stenosis, the development of reflux esophagitis, etc. However, according to many authors, large diastasis between the segments of the esophagus, concomitant anomalies and body weight less than 1,500 g are obstacles for primary anastomosis. In such situations, the implementation of a delayed esophageal anastomosis or replacement of the esophagus with a large intestine or stomach is recommended. Currently, with the introduction of thoracoscopically performed esophageal anastomosis in newborns, there is an improvement in the results of treatment with esophageal atresia. According to the authors, approximately 75 % of operations for esophageal atresia can be performed thoracoscopically with good results. Progress in thoracoscopic treatment of esophageal defect has significantly improved the quality of life of children after surgical correction of the anomaly.Keywords: esophageal atresia, newborns, primary anastomosis, complications1. INTRODUCTIONMaterials and Methods:for 10 years from 2010 to 2019, 43 newborns with esophageal atresia were admitted to the Surgical Department of the Pediatric Center of Republican Hospital No. 1 –National Center of Medicine. The diagnosis of malformation in most cases was established antenatally at the second ultrasound of the fetus at 20–22 weeks of gestation; microgastria and polyhydramnios were detected, other concomitant malformations were excluded for these fetuses [1]. 23 % of patients had concomitant malformations: anus atresia was detected in 6 patients, in 2 a combination of anorectal atresia with malformations of the skeletal system (foot and spine), hydronephrosis, congenital heart diseases (ductus arteriosus, atrial septal defect, ventricular septal defect), that is, VACTERL association was observed. In most cases, 95 % of newborns had a typical form of esophageal atresia with a lower tracheoesophageal fistula. According to the Waterston classification, newborns were distributed as follows: Group A (full-term newborns weighing more than 2,500 g, without pneumonia and concomitant malformations) –11 % (5 patients), Group B (newborns weighing from 1,800 to 2,500 g without concomitant defects or weighing more than 2,500 g, but with pneumonia or concomitant malformations) –50 % (21 patients), Group C (newborns weighing less than 1,800 g or more than 1,800 g, but with pneumonia or with concomitant malformations) – 39 % (17 patients).The diagnosis of esophageal atresia at the stage of the maternity hospital was clarified by conducting a test through a probe installed in the blind-ended pouch of the esophagus, with air supplied with a syringe and coming out of the nose with a noise. At the stage ofsurgical resuscitation, all patients underwent contrasting Proceedings of the Conference on Health and Wellbeing in Modern Society (CHW 2021)of the oral segment of the esophagus with water contrast followed by its evacuation, echocardiography, ultrasound of the abdominal cavity and kidneys, neurosonography, and laboratory tests.Figure 1. Typical atresia of the esophagus with lower tracheo-esophageal fistula2. RESEARCH RESULTSThe mechanisms of pathological disorders in a newborn child during the formation of esophageal atresia are multifaceted. At the early stage of embryogenesis, the trachea and esophagus communicate with each other, as they develop from the cranial section of the primary intestine. Violation of recanalization, lacing of the esophagus from the respiratory tube, and fast growth of the trachea and esophagus can lead to esophageal atresia.The upper segment of the esophagus is stretched by the swallowed amniotic fluid and presses on the developing trachea, resulting in poor development of cartilaginous rings —tracheomalacia. Due to the lack of patency along the esophagus, antenatal coordinated peristaltic movements of the esophagus are not formed, and the cortico-visceral swallowing reflex is impaired. But the most important is the presence of a direct communication between the stomach and the tracheobronchial tree through the distal tracheoesophageal fistula, which causes the overstretching of the stomach with air during the child’s cry. In addition, gastric contents move through the distal tracheoesophageal fistula directly into the tracheobronchial tree, causing chemical pneumonia, which can be complicated by bacterial pneumonia [2,3].The newborns were operated on the 2nd day of life after preoperative preparation, 3 newborns with respiratory failure syndrome were on artificial lung ventilation before the operation. Esophageal anastomosis was performed in 35 (81.4 %) patients, in 8 (18.6 %) newborns with extended diastasis between the segments of the esophagus, the tracheo-esophageal fistula was sutured, a gastrostomy was placed, and a cervical esophagostomy was removed. 2 esophageal anastomosis was applied on a delayed basis due to severe prematurity of the newborn [4].Since 2014, esophageal anastomosis has been performed thoracoscopically; a total of 15 endoscopic anastomoses have been performed.Among the postoperative complications that may accompany the period after introducing esophageal anastomosis, three main ones should be highlighted:●Stenosis of the anastomosis;●Anastomotic leakage;●Recanalization of the tracheo-esophageal fistula.These complications can occur with both open and thoracoscopic interventions.In the studied group of patients, postoperative complications were observed in 17 (48 %) newborns in the forms of: failures of the esophageal anastomosis in 5 cases (14 %), stenosis of the anastomosis zone –12 cases (34 %), esophageal perforation against the background of balloon dilatation of the stenosis zone –1 case, and 1 child had gastroesophageal reflux with severe reflux esophagitis.Figure 2. Stages of thoracoscopic correction of esophageal atresia – isolation of the atresia oral segment of the esophagus, the appearance of a completed esophageal anastomosis with a single-row interruptedsuture with an absorbable suture (5/0)In all cases, the esophageal anastomosis was applied with biodegradable suture material (5/0–6/0) as single-row interrupted suture. Anastomosis was possible with diastasis between the segments of the esophagus at no more than 1.5–2.0 cm. In recent years, there have been attempts to preserve the child’s native esophagus, if possible, since long-term results while preserving their own esophagus are definitely better. For this purpose, modifications are made to lengthen the oral segment of the esophagus when introducing an esophageal anastomosis with large diastasis — the technique of circular myotomy according to Livaditis, and the Foker process – lengthening the atresized ends of the esophagus by introducing traction sutures with a delayed anastomosis [5,6].In the postoperative period, the newborns were on extended ventilation for an average of 7–8 days with myorelaxation. In cases of an uncomplicated course of the early postoperative period, X-ray control of the anastomotic zone using a water-soluble contrast agent was performed on postoperative days 9–10. Enteral tube feeding was started from the 10th postoperative day (after the restoration of the sucking reflex), from about 12–14 days, they were switched to breastfeeding. In premature infants, introducing primary esophageal anastomosis is impossible due to the severity of the condition, while in 2 cases delayed anastomoses were performed 2–3 weeks after applying draining gastrostomy, and relative stabilization of the condition.Table 1. Postoperative complications depending on the type of operationThe complexity of performing surgical operations on the esophagus is mainly due to the fact that esophageal anastomoses are often untenable [7]. There are several reasons that explain this phenomenon. The esophagus does not have a serous membrane, which plays an important role in the healing of digestive anastomoses, due to its high plastic and adhesive properties. All operations on the esophagus are accompanied by violating the integrity of the structures of the mediastinum with risk of developing postoperative mediastinitis. The blood supply to the esophagus is worse than the blood supply to the intestines. The esophagus is constantly contracting. Peristalsis causes its lengthening or contraction with each inhalation, while peristaltic movements pushing food subject the suture line to additional stress.Cases of failed esophageal anastomosis were diagnosed on the 6–8th postoperative day with the release of saliva through the drainage of the posterior mediastinum. Since 2012, inmost cases of esophageal anastomosis failure, conservative tactics have been undertaken [8,9], including the introduction of a gastrostomy tube to decompress the stomach and prevent reflux of the contents into the esophagus, the installation of additional drainage in the posterior mediastinum, the connection of active aspiration through the drains, and the change of antibiotic therapy (Fig. 3). On the 16–20th day of conservativemanagement, secondary healing was achieved in the zone of esophageal anastomosis, which was confirmed by X-ray contrast study. Rough stenoses were not observed in cases of secondary healing in the anastomotic area.Figure 3. Failure of esophageal anastomosisOne of the most common reasons for reoperations after reconstruction of esophageal atresia is narrowing in the anastomotic area. Many factors can contribute to the formation of a stricture: anastomotic leak in theearly postoperative period, gastroesophageal reflux, using non-absorbable sutures instead of absorbable ones. Narrowing usually occurs between 2 weeks and 6 months after surgery and is manifested by impaired food transit time. Dysphagia is accompanied by choking and coughing. The diagnosis is confirmed by contrast X-ray examination or fibroesophagoscopy (Fig. 4).Figure 4. Stenosis of esophageal anastomosisTo restore the patency of the lumen, it is necessary to expand the esophagus in the narrowing zone, which can be performed using bougienage or balloon hydrodilation. These techniques can be performed blindly or under X-ray or endoscopic guidance. Endoscopic methods of bougienage and balloon dilation have certain advantages over similar interventions. The main condition for ensuring the safety of endoscopic bougienage is to conduct dilating bougie only along the guide wires (Fig. 5).Figure 5. Condition after bougienage of esophageal stenosis along the guide wireIn 1/3 of patients after esophageal anastomosis, bougienage of the esophagus was performed due to the onset of symptoms of dysphagia. It should be noted that until 2012, calibration bougienage of the esophageal anastomosis zone was performed for prophylactic purposes before the patients were discharged. But practice has shown that invasive manipulations in the zone of esophageal anastomosis should be carried out only according to absolute indications. In cases with stenoses we performed bougienage along the wire — in most cases briefly, only in 1 child in the postoperative period we observed lasting stenosis of esophageal anastomosis, the child received a second thoracoscopic esophageal anastomosis at 3 months of age. In 3 cases, balloon dilatation of the esophageal stenosis zone was performed, in 1 case, this procedure resulted in a complication in the form of a rupture of the esophageal wall, rethoracotomy and suturing of the esophageal defect with the introduction of a preventive gastrostomy were performed. In this patient, in the delayed period, we observed persistent reflux esophagitis with mucosal ulceration of the lower third of esophagus; at the age of 3 years, the patient underwent a Nissen fundoplication as antireflux surgery.In cases of large defects in the zone of insolvency of the esophageal anastomosis and pronounced phenomena of mediastinitis, a rethoracotomy was performed with the destruction of the esophageal anastomosis, ligation of the distal segment of the esophagus, and the removal of the proximal section to the neck on the left, forming an esophagostomy, while a gastrostomy was applied. Later, these patients underwent colon esophagoplasty at the age of 1 year (Fig. 6).The main advantages of a colonic graft over other segments of the intestinal tube are:●more pronounced magistral blood supply;●insignificant effect on digestion when turning offlarge sections of the colon;●direct form of the graft;●high resistance to aggressive gastric juice andhypoxia;●option to cut out a graft of any required lengthwith a good stable blood supply.Figure 6.Stage of colonic graft formationColon esophagoplasty was performed in 5 (12 %) patients, in all cases a graft of the left half of the colon on the left colon artery was used; operation was carried out in the anterior mediastinum retrosternally, with the introduction of an antireflux modification using Stepanov E.A. method. 1 patient was operated on in Moscow using the method of moving the sternum of the stomach. But in recent years, of all the methods of plastic surgery of the esophagus, with the impossibility of preservin g the patient’s own esophagus, the best delayed clinical results were obtained with the method of colon esophagoplasty (Fig. 7).Figure 7. X-ray with contrast on the 10th postoperative day after colon esophagolplasty.Mortality in esophageal atresia during the study period was 14 % (6 newborns). The main causes of death were severe concomitant malformations and extreme prematurity.3. CONCLUSIONSAfter the introduction of thoracoscopic esophageal anastomosis in newborns with esophageal atresia, the number of postoperative complications, including such acute ones as anastomotic leakage, significantly decreased.Striving to preserve patients’ own esophagus with anastomotic leakage is justified. Conservative tactics without destroying the esophageal anastomosis showed encouraging results.Postoperative stenosis in the area of the esophageal junction in most cases can be eliminated by the safest method of bougienage of the esophagus along the guide wire.In persistent course of reflux disease in patients after esophageal anastomosis, introduced for esophageal atresia, it is advisable to carry out antireflux fundoplication using Nissen fundoplication in a timely manner to prevent the formation of metaplasia of the esophageal mucosa. REFERENCES[1]L. Spitz, J. Rare Dis. 2 (2007) 24.[2] D. Alberti, G. Boroni, L. Corasaniti, F. Torri, J.Matern. Fetal Neonatal Med. 24(1) (2011) 4–6. [3] A. Conforti, F. Morini, P. Bagolan, Semin. inPediatr. Surg. 23(5) (2014) 261–269.[4] F. Friedmacher, P. Puri, Pediatr. Surg. Int. 28(9)(2012) 899–906.[5]J.E. Foker, T.S. Kendall-Krosch, K. Catton et al.,Semin. Pediatr. Surg. 18 (2009) 23–29.[6] A. Nars, J.C. Langer, Eur. J. Pediatr. Surg. 23(3)(2013) 191–197.[7]S.S. Rothenberg, J. Laparoendosc. Adv. Surg.Tech. 22 (2012) 195–199.[8]Yu.A. Kozlov, V.V. Podkamenev, V.A.Novozhilov, Atreziya pishchevoda,GEOTAR-Media, Moscow, 2015.[9] A.Yu. Razumovskiy, O.G. Mokrushina, N.V.Golodenkoet al., Rus. J. of Pediatr. Surg., Anesthesiol. and Resuscitat. 1 (2011) 40–47.。
腹腔镜胃折叠手术的流程

腹腔镜胃折叠手术的流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!腹腔镜胃折叠术流程。
1. 麻醉。
术前进行全身麻醉,使患者处于睡眠状态,无痛感。
腹腔镜胃癌根治术操作流程之欧阳历创编

腹腔镜胃癌根治术操作流程手术方式:腹腔镜辅助胃手术:胃的游离及淋巴结清扫在腹腔镜下完成,胃的切除或吻合是通过腹壁小切口辅助完成,是目前我院采用的手术方式麻醉方式:全麻手术体位:分腿大字位,双腿各外展30°,左脚折刀15°,与会阴形成的三角位置刚好能站1人为宜。
头高脚低倾斜30°。
患者臀下垫一薄软垫,由于受体位的影响,手术床与患者骶尾部的接触面及力度增大,使用软垫可保护患者皮肤,减少摩擦。
手术机位:显示屏两台分别放在病人头端左右两侧约45°,超声刀主机放在病人左侧术中提醒:腔内拭血用若干白纱布对半剪开并缝3针固定,以及水杯内放置一块小号纱垫以保护镜头,巡回护士做好记录用物准备器械包一次性物品仪器设备中型包电刀及清洁片高清腹腔镜摄像系统手术衣包吸引管道及吸头气腹系统欧阳历创编 2021..02.09敷料包1#4#7#缝线冷光源LC器械及各连接线腹腔镜镜套3 显示器超声刀及连接线荷包线负压吸引装置胃补八根针高频电刀主机食道吻合器0#可吸收线超声刀主机腔镜下胃肠钳一套尿管引流管及引流袋强生一次性大穿刺器胃镜胶瑞奇26#吻合器1瑞奇蓝钉(60-3.5)160#闭合钉1可吸收夹若干水杯1(内置灭菌注射用水)手术配合步骤肿瘤时使用的器械要与其他器械分开使用,避免肿瘤细胞产生种植。
取标本时,采用切口保护圈保护腹壁小切口,于圈内牵引出病变胃标本及清扫淋巴结、脂肪组织。
在解除气腹时先排尽气体,再拔除套管避免“烟囱”效应。
腹腔及腹壁切口用43℃蒸馏水冲洗、浸泡,通过这些措施以尽量减少发生切口种植的几率。
欧阳历创编 2021..02.09。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
• 台上消毒,递尖刀、血管钳做以环形切口,电刀切除脂肪,递甲钩牵 开,到达腹腔后卵圆钳提出直肠近端,递血管钳继续裸化肠系膜,之 后小针4#线缝合。
• 从肛门拖出肿瘤后大角针4#丝线缝合。 • 再重新用腹腔镜探查腹腔情况。
腹腔镜下直肠(乙状结肠)ca根治(保肛)
1、4#丝线各一 7#丝线2板 体位:人字位。主刀屏幕摆脚下。一助屏幕摆病人右上方处。 备荷包钳、可可钳
• 碘伏消毒,在耻骨联合上方做一5cm长的横切口,到达腹腔后上小的 切口保护器,递无齿卵圆钳夹出病变肿瘤,选择合适的切除长度。
• 裸化肠管,血管钳、带线、尖刀离断处理好肠系膜。上荷包钳(针) 给钉座(和枪一起打好石蜡油)做好荷包后递蚊式钳去除吻合端的脂 肪垂。
腹腔镜下右半结肠ca根治
体位:平卧位。主刀站病人左侧,镜子放于右上方。
• 脐上正中切口,上小切口保护器,血管钳,剪刀带线,分离好;荷包 钳、闭合钳准备,做完荷包给钉座,上枪。吻合之后上线性切割闭合 器,装标本。
泌外手术 腹腔镜下左肾切除
体位:折刀位;
• 用物准备:腹包等常规包布,14#红尿管、50ml注射器、腔镜保护套3 个、吸引器、长电刀、4#7#丝线、11#23#刀片、导尿的东西;腹腔镜 一套、另加:大直角、哈姆洛克、电凝线、超声刀、
开台:
• 碘伏消毒递尖刀打洞,电刀分离,血管钳撑开,手指探查肾区情况, 递准备好的手套注射器打气膨起,尖刀打辅助孔,递小曲卡,尖刀, 大曲卡,主操作孔,最后以曲卡不要针芯,胖针7#丝线缝合皮下两针 ,角针7#缝皮固定,小号引流管剪3—5cm一边剪开7#丝线固定小曲卡 。
• 给腔镜器械钳。
胃肠腔镜手术指引
腹腔镜下 胃ca根治 5板1#丝线 1板4#丝线 2板7#丝线
体位:人字位。主刀站病人左侧(屏幕摆右上)一助站右侧屏幕摆左上。 开放后位置互换。 备荷包钳、闭合钳(3钉)、可可钳
• 碘伏消毒,在脐上正中做一5cm的切口,最后吻合好后小针加强一圈, 最里面用长针持,到达外面再换短持丝线关腹,此时穿线速 度宜快。
• 关完前鞘后上腔镜器械,给主刀抓钳、肠钳、一助给以肠钳。这时二 助用吻合器配合主刀从肛门处进行吻合。
腹腔镜下直肠ca根治(挖肛)
体位,一只脚架起。屏幕摆脚上;主刀站病人右侧。 丝线各两包。不需要荷包钳,闭合钳。备可可
